Перейти к:
Портрет пациента со стабильной ишемической болезнью сердца и нарушением мышечного статуса
https://doi.org/10.15829/1728-8800-2022-3454
Аннотация
Цель. Определить клинический портрет пациента со стабильной ишемической болезнью сердца (ИБС) и сопутствующим нарушением мышечного статуса.
Материал и методы. В исследование включены 387 пациентов со стабильной ИБС, имеющих показания для открытой реваскуляризации миокарда. Количественная оценка мышечной ткани проводилась с использованием данных компьютерной томографии. Выполнен сравнительный анализ показателей клинико-анамнестической характеристики групп пациентов с саркопенией (n=152) и с нормальным мышечным статусом (n=235).
Результаты. Признаки саркопении выявлены у 39,3% пациентов со стабильной ИБС. В группе саркопении и группе с нормальным мышечным статусом отмечалось преобладание лиц мужского пола — 86,2 и 64,7% (р=0,01), наличие гиперхолестеринемии — 51,3 и 31,1% (р=0,02), сахарного диабета (СД) 2 типа — 21,1 и 28,1% (р=0,06), многососудистого поражения коронарных артерий — 25,6 и 17,8% случаев (р=0,018), соответственно. При саркопении отмечали в 4 раза более длительный анамнез СД (р=0,01) и в 2,3 раза бóльшую длительность ИБС (р=0,03). Частота ожирения при саркопении меньше в 3,4 раза (р=0,003). Корреляционный анализ показал связь мышечного статуса с возрастом (r=-0,674; p=0,002), длительностью анамнеза ИБС (r=-0,582; p=0,001) и СД (r=-0,748; p<0,001).
Заключение. Клинико-анамнестический образ пациента со стабильной ИБС и саркопенией характеризуется ассоциацией пониженной мышечной массы с мужским полом, гиперхолестеринемией, многососудистым поражением коронарного русла, длительным анамнезом СД 2 типа и стенокардии.
Для цитирования:
Коков А.Н., Масенко В.Л., Кареева А.И., Кривошапова К.Е., Барбараш О.Л. Портрет пациента со стабильной ишемической болезнью сердца и нарушением мышечного статуса. Кардиоваскулярная терапия и профилактика. 2022;21(12):3454. https://doi.org/10.15829/1728-8800-2022-3454
For citation:
Kokov A.N., Masenko A.I., Kareeva A.I., Krivoshapova K.E., Barbarash O.L. Profile of a patient with stable coronary artery disease and impaired muscle status. Cardiovascular Therapy and Prevention. 2022;21(12):3454. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3454
Введение
Несмотря на развитие и активное внедрение в практическое здравоохранение медицинских технологий лечения, первичной и вторичной профилактики болезней системы кровообращения, заболеваемость и смертность от данной патологии продолжает сохранять лидирующие позиции. На фоне агрессивной тактики ранней реваскуляризации и активной вторичной профилактики прослеживается тенденция к увеличению среднего возраста пациентов с атеросклеротическим поражением коронарного русла. В сочетании с вектором роста пожилого населения положительный эффект усилий здравоохранения в реализации борьбы с сердечнососудистыми заболеваниями обнажает серьезную проблему сочетанной возраст-ассоциированной патологии, влияющей на продолжительность лечения основного заболевания, а также увеличивающей риск фатальных исходов у лиц пожилого и старческого возраста [1]. Важной особенностью этой категории пациентов является наличие патологии, связанной с прогрессирующим изменением опорно-двигательного аппарата, включающим в себя потерю мышечной ткани и снижение ее функционального резерва — саркопению.
Саркопения характеризуется постепенной потерей массы и силы скелетных мышц и, хотя обычно ассоциируется с ускоренным старением, в настоящее время может начинаться после 40 лет [2]. В 1989г И. Розенберг определил саркопению как потерю мышечной массы (от греч. sarcs — "плоть" и penia — "дефицит") после сравнения мышечной массы бедра пожилой и молодой женщин. Три десятилетия спустя саркопения как потеря мышечной массы и силы была официально признана мышечным заболеванием. Наличие саркопении у пациентов в возрасте до 60 лет и старше не просто снижает качество жизни — саркопения является предиктором прогрессирования хронических заболеваний, развития послеоперационных инфекционных и неинфекционных осложнений, а также достоверно связана с увеличением смертности от всех причин [3].
Полиморбидность пожилого возраста, включая саркопению, является неблагоприятным фоном для основной патологии пациентов с клинически значимым поражением коронарных артерий. Активная позиция современной кардиологии в отношении ранней реваскуляризации коронарного русла требует взвешенного подхода с учетом всех факторов риска, в т.ч. определения выраженности саркопении. Дефицит мышечного статуса пациентов с многососудистым поражением может повлиять на выбор тактики хирургического лечения с учетом возможных осложнений [4]. Таким образом, интерес к проблеме саркопении у пациентов с хроническим коронарным синдромом высокого риска имеет значение как с позиции отбора на реваскуляризацию, так и в отношении прогноза в раннем и отдаленном послеоперационном периоде.
Цель настоящего исследования — определение клинического портрета пациента со стабильной ишемической болезнью сердца (ИБС) и сопутствующим нарушением мышечного статуса.
Материал и методы
В одноцентровое исследование включены 387 пациентов в возрасте 50-82 лет со стабильной ИБС, госпитализированные в клинику Научно-исследовательского института комплексных проблем сердечно-сосудистых заболеваний (НИИ КПССЗ) для выполнения открытой реваскуляризации миокарда. Исключение составили больные с тяжелой сопутствующей патологией, в т.ч. с онкологическими заболеваниями, принимающие длительное время кортикостероидные препараты, цитостатики, барбитураты или миорелаксанты. Исследование выполнено в соответствии с принципами Хельсинкской конвенции и одобрено этическим комитетом ФГБНУ "НИИ КПССЗ" (протокол № 12 от 27.12.2019). У всех участников до включения в исследование получено письменное добровольное информированное согласие (утверждено 27.12.2019).
В ходе первичного осмотра на этапе включения пациента в исследование осуществляли сбор жалоб, анамнеза жизни и заболевания, антропометрию, клинический осмотр. Исходная клинико-анамнестическая характеристика пациентов представлена в таблице 1.
Таблица 1
Клинико-анамнестическая характеристика пациентов с ИБС

Примечание: АГ — артериальная гипертензия, ИБС — ишемическая болезнь сердца, ИМТ — индекс массы тела, ОНМК — острое нарушение мозгового кровообращения, ПИКС — постинфарктный кардиосклероз, СД — сахарный диабет, ФК — функциональный класс.
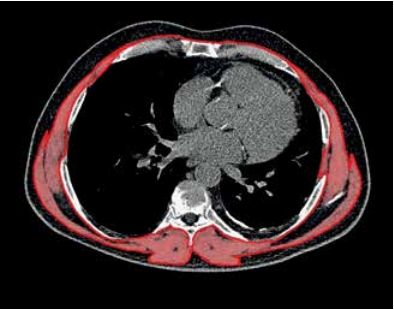
Рис. 1. Количественная оценка площади поперечнополосатой мускулатуры на уровне межпозвонкового диска Th8-9 с использованием компьютерной томографии. Цветом выделены структуры плотностью от -29 до +150 единиц по шкале Хаунсфилда, соответствующие мышечной ткани и подлежащие морфометрии.
Основную часть выборки составили лица мужского пола. Большинство пациентов ранее перенесли инфаркт миокарда (ИМ), характеризовались наличием артериальной гипертензии (АГ), имели признаки стенокардии функционального класса (ФК) II-III. В исследуемой выборке отмечена довольно высокая частота встречаемости модифицируемых факторов кардиоваскулярного риска, таких как табакокурение (36,6%), ожирение (29,1%), сахарный диабет (СД) 2 типа (25,3%) и гиперхолестеринемия (39,0%). Полученные данные клинико-анамнестической характеристики соответствуют результатам крупных российских и международных эпидемиологических исследований [5] и в целом отражают реальную клиническую тяжесть больных ИБС, поступающих в стационары Кемеровской области.
Всем пациентам, включенным в исследование, перед хирургическим вмешательством проведена диагностика саркопении в соответствии с критериями Европейской рабочей группы по саркопении у пожилых людей (EWGSOP2, European Working Group on Sarcopenia in Older People) и выполнена количественная оценка скелетных мышц на компьютерном томографе Somatom Sensation (Siemens, ФРГ) с использованием данных рутинного сканирования органов грудной клетки (пат. РФ № 2754291 от 31.08.2021). С помощью разработанного программного продукта (свидетельство о регистрации программы для ЭВМ № 2021615382 от 07.04.2021) на аксиальных изображениях на уровне позвоночного сегмента Th8-9 выделяли наружный и внутренний контур поперечнополосатых мышц, включая m. latissimus dorsi, m. scalenus anterior dorsi, m. intercostales externi, m. erector spinae, m. trapezius (рисунок 1). Затем определяли суммарную площадь пикселей в выделенной области в пределах от -29 до +150 единиц Хаунсфилда рентгеновской плотности, соответствующей значениям аттенуации мышечной ткани. С использованием полученного значения площади скелетной мускулатуры рассчитывали мышечный индекс тела (МИТ) как отношение площади мышечной ткани к квадрату показателя роста. Пороговыми значениями, ниже которых процент мышечной массы от композиционного состава тела испытуемого лица меньше, чем средние значения представителей взрослой популяции того же пола, на два стандартных отклонения и более и соответствует саркопении, принимали 33,85 см2/м2 для мужчин и 24,85 см2/м2 для женщин.
Оценку тяжести поражения коронарного русла проводили на основании данных селективной коронароангиографии с использованием ангиографической установки INNOVA 3100 (GE, США). Дополнительная оценка коронарных артерий по шкале SYNTAX (Synergy between Percutaneous Coronary Intervention with TAXUS and Cardiac Surgery) проводилась для объективизации тяжести поражения с учетом локализации и морфологических показателей стенозов артерий.
Статистическую обработку результатов осуществляли с помощью программы SPSS Statistics v.22.0 (США). Для количественных признаков данные представлены в виде медианы и интерквартильного размаха — Ме (Q25; Q75). Количественные и порядковые переменные сравнивали с использованием критерия Манна-Уитни с поправкой Бонферрони. Для определения связей количественных показателей использовали коэффициент ранговой корреляции Спирмена (r), выполняли линейный регрессионный анализ. Результаты считали статистически значимыми при р<0,05.
Исследование выполнено в рамках гранта РНФ № 22-15-00305 "Патофизиологические особенности формирования остеосаркопенического ожирения при мультифокальном атеросклерозе как маркера биологического старения".
Результаты
Для определения клинической характеристики пациентов со стабильной ИБС и дефицитом мышечной ткани был выполнен анализ данных количественной оценки компьютерной томографии (КТ) органов грудной клетки. Медиана расчетного показателя МИТ составила 34,1 (28,9; 37,6) для лиц мужского пола и 25,2 (21,6; 28,2) для женщин. Критерии низкой мышечной массы в основной выборке пациентов, со стабильной ИБС, выявлены у 152 (39,3%) обследованных лиц. Группу сравнения (n=235) составили пациенты со значениями МИТ выше пороговых. Сравнительная клинико-анамнестическая характеристика групп в зависимости от наличия саркопении представлена в таблице 2.
Доля лиц мужского пола преобладала в обеих оцениваемых группах, но среди пациентов с саркопенией количество мужчин было статистически значимо больше (86,2%), чем в группе с неизмененным мышечным статусом (64,7%). Независимо от наличия саркопении пациенты не различались по возрасту, приверженности к курению, АГ в анамнезе, перенесенных инсультах и ИМ. Также не было выявлено достоверных различий в группах по частоте встречаемости СД 2 типа и тяжелых проявлений стенокардии и хронической сердечной недостаточности (ХСН). Вместе с тем, анамнестические данные указывали на более продолжительную (в 4 раза) длительность СД 2 типа в группе саркопении по сравнению с группой пациентов без снижения мышечной массы — 8 (3; 10) vs 2 (1; 4) года, соответственно (р=0,01). Продолжительность наблюдения в анамнезе ИБС также преобладала в 2,3 раза у больных с нарушением мышечного статуса (3,5 (1; 10) года) в сравнении с пациентами без саркопении (1,5 (1; 5) года) (р=0,03). Кроме того, среди больных со стабильной ИБС и сопутствующей саркопенией достоверно чаще отмечались нарушения липидного профиля (р=0,02).
Пациенты со стабильной ИБС, включенные в исследование, характеризовались избыточным весом, при этом в группе с нормальным мышечным статусом значения показателя индекса массы тела (ИМТ) были статистически выше, чем в группе саркопении (р=0,02). Соответственно, среди больных с пониженной мышечной массой частота встречаемости ожирения была в 3,4 раза ниже, чем в группе сравнения.
Выраженность поражения коронарного русла у пациентов с нормальным и низким мышечным статусом была подвергнута сравнительному анализу с использованием данных селективной коронарографии (таблица 3). Не было выявлено статистически значимых различий изучаемых групп как по количеству баллов шкалы SYNTAX (р=0,35), так и по распространенности степеней риска, определенного по SYNTAX Score. Вместе с тем, гемодинамически значимое поражение коронарного русла с вовлечением 3-х коронарных артерий верифицировано у 25,6% пациентов с саркопенией, тогда как в группе с нормальной мышечной массой трехсосудистое поражение выявлено у 17,8% больных (р=0,018).
Снижение мышечной массы организма является возраст-ассоциированным состоянием. В связи с этим нами был выполнен сравнительный анализ клинико-анамнестических данных разновозрастных категорий пациентов с саркопенией. Все пациенты, имеющие по данным компьютерной томографии (КТ) значения показателя МИТ ниже порогового уровня, с помощью медианы возраста (65 лет) были разделены на две группы. В первую группу вошли 58 больных, чей возраст не превышал 65 лет, вторую группу составили 94 пациента в возрасте ≥65 лет (таблица 4). В результате было отмечено закономерное статистически значимое преобладание в более старшей группе больных с СД 2 типа, с тяжелыми ФК стенокардии, ХСН и трехсосудистым поражением коронарного русла. Также пациенты ≥65 лет характеризовались длительным анамнезом ИБС. В отношении более молодых пациентов с саркопенией отмечена высокая частота встречаемости гиперхолестеринемии — 84,4 vs 30,9% в группе ≥65 лет (р=0,001).
Кроме того, с увеличением возраста пациентов отмечалось статистически значимое уменьшение частоты распространенности ожирения (17,2% — в первой группе, 8,5% — во второй группе, р=0,04). При проведении корреляционного анализа обнаружена отрицательная связь нормализованного показателя мышечного статуса с возрастом пациентов (r=-0,674; p=0,002) и его положительная связь с ИМТ (r=0,63; р<0,001). Кроме этого, выявлена отрицательная корреляционная связь МИТ с длительностью анамнеза ИБС (r=-0,582; p=0,001) и СД 2 типа (r=-0,748; p<0,001).
Таким образом, результаты проведенного анализа позволяют сформировать портрет пациента со стабильной ИБС на фоне саркопении на основании ассоциаций низкого уровня количественных показателей мышечной массы с полом, возрастом, длительностью основного заболевания, метаболическими нарушениями.
Таблица 2
Сравнительная клинико-анамнестическая характеристика пациентов с ИБС в зависимости от наличия саркопении
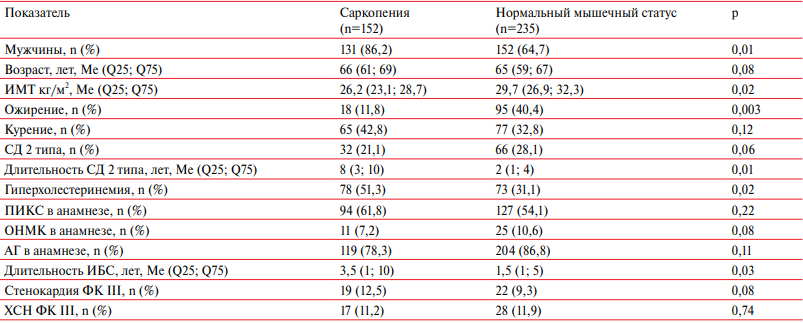
Примечание: АГ — артериальная гипертензия, ИБС — ишемическая болезнь сердца, ИМТ — индекс массы тела, ОНМК — острое нарушение мозгового кровообращения, ПИКС — постинфарктный кардиосклероз, СД — сахарный диабет, ФК — функциональный класс, ХСН — хроническая сердечная недостаточность.
Таблица 3
Поражение коронарных артерий, по данным коронароангиографии, в зависимости от наличия саркопении

Таблица 4
Сравнительная клинико-анамнестическая характеристика пациентов с ИБС и низкой мышечной массой в зависимости от возраста
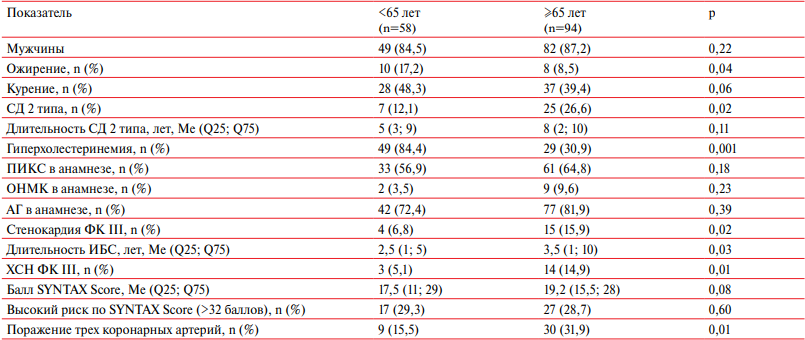
Примечание: АГ — артериальная гипертензия, ИБС — ишемическая болезнь сердца, ОНМК — острое нарушение мозгового кровообращения, ПИКС — постинфарктный кардиосклероз, СД — сахарный диабет, ФК — функциональный класс, ХСН — хроническая сердечная недостаточность.
Обсуждение
Общемировая динамика смещения структуры возраста популяции в сторону более старшего населения обусловливает тенденцию к увеличению возраста и пациентов с заболеваниями системы кровообращения. На фоне вектора старения неуклонно увеличивается распространенность саркопении и синдрома старческой астении. Распространенность саркопении в общей популяции в настоящее время колеблется от 5 до 50% в зависимости от возрастной категории [6]. По данным отечественных исследователей патологическое снижение мышечной массы отмечается у 37% пациентов в возрасте >65 лет [7]. В настоящем исследовании частота саркопении составила 39,3% со значительным преобладанием лиц мужского пола. Вариабельность частоты этой патологии может быть обусловлена целым рядом факторов, в т.ч. за счет различных критериев для определения саркопении.
Для оценки старческой астении и саркопении в настоящее время существуют проверенные шкалы, которые рутинно используются в клинических условиях. Европейская рабочая группа по саркопении у пожилых людей (EWGSOP) уже опубликовала многочисленные клинические тесты, чтобы сделать картину более осязаемой и понятной [2]. Тем не менее существует необходимость в количественной верификации потери мышечной массы. И хотя в настоящее время доступен весьма широкий спектр визуализирующих, функциональных и биологических маркеров саркопении, объективное измерение показателей саркопении затрудняется ограничениями, присущими всем диагностическим инструментам, и отсутствием единых методологических подходов [8]. Наибольшее распространение в количественной оценке мышечной ткани получил подход с определением площади всех поперечнополосатых мышц по данным КТ брюшной полости [9]. Однако данная методика сопровождается избыточной лучевой нагрузкой, в связи с чем требуются серьезные основания ее широкого применения. Ранее мы предложили использовать для количественной оценки мышечной ткани данные рутинной КТ грудной клетки, получившей в период пандемии новой коронавирусной инфекции достаточно активное использование в клинической практике. Морфометрия дыхательной мускулатуры и паравертебральных мышц грудной клетки в настоящее время имеет преимущество перед прицельным сканированием абдоминального уровня в качестве оппортунистического скрининга.
Результат значительной распространенности саркопении в настоящей работе не соответствует результатам зарубежных исследователей. Так, по данным Nielsen BR, et al., саркопения отмечается у 14,3-20,3% лиц в возрасте 60-75 лет [10]. Однако следует отметить, что приведенные результаты указывают на распространенность дефицита мышечной массы в общей популяции, тогда как выборка настоящего исследования представлена пожилыми пациентами высокого и крайне высокого кардиоваскулярного риска. Взаимосвязь сердечно-сосудистых заболеваний и саркопении является предметом изучения с позиции общности факторов риска и перекрестных патофизиологических путей развития атеросклероза и саркопении. При этом в научной литературе нами не было найдено данных об особенностях клинической характеристики сложной категории пациентов, состояние коронарного русла которых требует открытой реваскуляризации, с позиции низких показателей мышечной массы.
По нашим данным, среди пациентов с низкой мышечной массой преобладают лица мужского пола независимо от возраста, причем после 65 лет доля мужчин в этой группе увеличивается с 84,5 до 87,2%. В том же исследовании Nielsen BR [10] отмечена более высокая распространенность саркопении после 65 лет в женской популяции (25,5%), чем в мужской (16,4%). Подобный гендерный диссонанс обусловлен исходным преобладанием мужчин в общей выборке больных, имеющих показания для коронарного шунтирования, что, в целом, характеризует категорию пациентов с тяжелым атеросклерозом. С возрастом мышечная масса снижается как у мужчин, так и у женщин. Но несмотря на то, что у пожилых мужчин абсолютная мышечная сила выше, чем у женщин того же возраста, потеря мышечной массы с возрастом у мужчин происходит быстрее и более выраженно. В исследовании Health ABC пожилые мужчины в течение 3-летнего периода наблюдения потеряли в два раза больше объема мышц бедра, чем женщины [11].
Клиническое значение избыточной массы тела как одного из основных факторов риска развития атеросклеротических заболеваний сосудов обусловлено негативным влиянием жировой ткани на сердечно-сосудистую систему, которое реализуется преимущественно за счет эндо- и паракринных эффектов висцерального жира, определяя более значимым фактором риска именно характер распределения жировой ткани в организме, а не феномен ожирения в целом [12]. В связи с этим статистически значимое преобладание лиц с ожирением, по данным оценки ИМТ, среди пациентов со стабильной ИБС и нормальной мышечной массой не может свидетельствовать о протективных свойствах жировой ткани. Fahimfar N, et al. отмечают, что ИМТ коррелирует с выявлением критериев саркопении только у лиц с высокой жировой массой [13]. Таким образом, защитная роль высокого уровня ИМТ в сочетании с негативным патофизиологическим аспектом висцерального ожирения подчеркивает важность раздельной оценки сухой мышечной массы и висцерального жирового депо объективными методами диагностики. Увеличение эктопических жировых отложений и висцерального жира приводит к изменению экспрессии адипонектина, что сопровождается повышением резистентности к инсулину.
Мышечная ткань является наиболее крупным инсулин-стимулируемым утилизатором глюкозы; следовательно, мышечная масса является важным детерминантом поддержания уровня глюкозы и энергетического гомеостаза. У пациентов с инсулинорезистентностью отмечается повышенный уровень активных форм кислорода в митохондриях мышц, что приводит к развитию регионального окислительного стресса и вызывает посттрансляционные модификации мышечного белка с нарушенной сократительной функцией. Однако в настоящем исследовании ассоциация низкой мышечной массы с наличием СД не была выявлена. В отношении саркопении имело значение не наличие СД, а продолжительность его анамнеза. Это подтверждается данными зарубежных авторов, исследовавших связь между саркопенией и функцией β-клеток у 150 пациентов с СД в возрасте до 50 лет. Авторы пришли к выводу, что протективные свойства нормальной функции β-клеток в отношении мышечной ткани утрачиваются на фоне длительного течения заболевания, связанного с инсулинорезистентностью [14].
В дополнение к портрету пациента со стабильной ИБС и сопутствующей саркопенией следует добавить дислипидемию. Выявленная ассоциация саркопении с повышенным уровнем общего холестерина отражает провоспалительный статус пациентов высокого кардиологического риска. Старение связано с иммунной дисрегуляцией, характеризующейся высокими уровнями циркулирующих провоспалительных маркеров даже при отсутствии факторов риска и клинических проявлений. Согласно теории плейотропного старения, в процессе эволюции воспалительная реакция исходно является защитным механизмом организма в раннем, молодом и зрелом возрасте, но в пожилом возрасте преобладающим становится негативный вектор эффектов воспаления на фоне возрастной мультиморбидности [15]. Однако является ли воспаление непосредственной причиной сопутствующей патологии или же оно представляет собой маркер биологического старения? На наш взгляд, высокий уровень сывороточных и тканевых провоспалительных факторов, выявляемый у пациентов с атеросклерозом и саркопенией, одновременно является триггером развития ассоциированных патологических состояний и реактивным маркером основной патологии.
Прогрессирующая потеря мышечной массы со снижением сократительного резерва миоцитов у больных с саркопенией также напрямую связана с хроническим воспалением. Окислительный стресс в мышцах модулирует экспрессию транскрипционного ядерного фактора κB, который усиливает протеолиз и увеличивает продукцию провоспалительных цитокинов. Фактор некроза опухоли α нарушает синтез белка в скелетной мышце, изменяя инициацию трансляции и способствуя развитию саркопении. Воспаление также связано с уменьшением инсулиноподобного фактора роста, воздействующего на регенерацию мышц и поддержание мышечной массы [16]. Кроме того, воспаление отрицательно влияет на функцию эндотелия, что, с одной стороны, опосредованно нарушает перфузию мышц и в итоге приводит к саркопении, с другой — приводит к нарушению дифференциации эндотелиальных клеток-предшественников, в результате чего повреждается сосудистая стенка и прогрессирует атеросклероз.
Таким образом, парадигма персонифицированного подхода к лечению полиморбидного пожилого пациента с клинически значимым атеросклеротическим поражением коронарного русла должна учитывать возраст-ассоциированное хроническое воспаление в сочетании с фенотипическими особенностями организма, в т.ч. мышечного статуса.
Заключение
Результаты настоящего исследования позволили сформировать клинико-анамнестический образ пациента со стабильной ИБС и сопутствующей саркопенией. Отмечена ассоциация низкого уровня мышечной массы с мужским полом, гиперхолестеринемией, длительным анамнезом СД 2 типа и стенокардии, а также многососудистым поражением коронарного русла. Наличие ожирения с оценкой ИМТ не является типичным для пациентов с саркопенией, однако данный аспект требует дальнейшего изучения с учетом негативного влияния висцерального ожирения на мышечную ткань с потенцированием саркопенического ожирения.
Отношения и деятельность. Исследование выполнено в рамках гранта РНФ № 22-15-00305 "Патофизиологические особенности формирования остеосаркопенического ожирения при мультифокальном атеросклерозе как маркера биологического старения".
Список литературы
1. Вегнер Е. А., Кривошапова К. Е., Барбараш О. Л. Сложности диагностики синдрома старческой астении среди пожилого населения различных стран. Комплексные проблемы сердечно-сосудистых заболеваний. 2020;9(4):95-104. doi:10.17802/2306-1278-2020-9-4-95-104.
2. Cruz-Jentoft AJ, Bahat G, Bauer J, et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 2019;48(1):16-31. doi:10.1093/ageing/afy169.
3. Сумин А.Н., Олейник П.А., Безденежных А. В. Состояние скелетных мышц у больных стабильной ишемической болезнью сердца: клиническое значение, ассоциированные факторы. Кардиоваскулярная терапия и профилактика. 2020;19(1):24-31. doi:10.15829/1728-8800-2019-895.
4. Терентьева Н. А., Галимова Н. А., Баздырев Е. Д. и др. Структура осложнений у пациентов с различными вариантами нарушения костно-мышечного статуса, подвергшихся коронарному шунтированию. Сибирское медицинское обозрение. 2022;4:54-60. doi:10.20333/25000136-2022-4-54-60.
5. Бойцов С. А., Драпкина О. М., Шляхто Е. В. и др. Исследование ЭССЕ-РФ (Эпидемиология сердечно-сосудистых заболеваний и их факторов риска в регионах Российской Федерации). Десять лет спустя. Кардиоваскулярная терапия и профилактика. 2021;20(5):3007. doi:10.15829/1728-88002021-3007.
6. Торопцова Н. В., Феклистов А. Ю. Патология костно-мышечной системы: фокус на саркопению и остеосаркопению. Медицинский совет. 2019;4:78-86. doi:10.21518/2079-701X-2019-4-78-86.
7. Бочарова К.А., Герасименко А. В., Жабоева С.Л. Ассоциация саркопении с ведущей соматической патологией в пожилом возрасте. Современные проблемы науки и образования. 2014;6:1150.
8. Масенко В. Л., Коков А. Н., Григорьева И. И. Лучевые методы диагностики саркопении. Исследования и практика в медицине. 2019;6(4):127-37. doi:10.17709/2409-2231-2019-6-4-13.
9. Prado C, Lieffers J, McCargar L, et al. Prevalence and clinical implications of sarcopenic obesity in patients with solid tumours of the respiratory and gastrointestinal tracts: a population-based study. Lancet Oncol. 2008;9(7):629-35. doi:10.1016/S14702045(08)70153-0.
10. Nielsen BR, Abdulla J, Andersen HE, et al. Sarcopenia and osteoporosis in older people: a systematic review and meta-analysis. Eur Geriatr Med. 2018;9(4):419-34. doi:10.1007/s41999-018-0079-6.
11. Goodpaster B, Park S, Harris T, et al. The loss of skeletal muscle strength, mass, and quality in older adults: the health, aging and body composition study. J Gerontol A Biol Sci Med Sci. 2006;61(10):1059-64. doi:10.1093/gerona/61.10.1059.
12. Масенко В. Л., Коков А. Н., Семенов С. Е. и др. Патофизиологические аспекты коморбидности факторов риска атеросклероза и саркопении. Клиническая физиология кровообращения. 2020;17(4):245-56. doi:10.24022/1814-69102020-17-4-245-256.
13. Fahimfar N, Zahedi F, Gharibzadeh S, et al. Prevalence of Osteosarcopenia and Its Association with Cardiovascular Risk Factors in Iranian Older People: Bushehr Elderly Health (BEH) Program. Calcif Tissue Int. 2020;106(4):364-70. doi:10.1007/s00223-019-00646-6.
14. Liu J, Yu D, Xu M, et al. β-Cell function is associated with osteosarcopenia in middle-aged and older nonobese patients with type 2 diabetes: A cross-sectional study. Open Med (Wars). 2021;16(1):1583-90. doi:10.1515/med-2021-0376.
15. Ferrucci L, Fabbri E. Inflammageing: chronic inflammation in ageing, cardiovascular disease, and frailty. Nat Rev Cardiol. 2018;15(9):505-22. doi:10.1038/s41569-018-0064-2.
16. Narayan V, Thompson E, Demissei B, et al. Mechanistic Biomarkers Informative of Both Cancer and Cardiovascular Disease: JACC State-of-the-Art Review. J Am Coll Cardiol. 2020; 75(21):2726-37. doi:10.1016/j.jacc.2020.03.067.
Об авторах
А. Н. КоковРоссия
Кандидат медицинских наук, зав. лабораторией лучевых методов диагностики.
Кемерово
В. Л. Масенко
Россия
Кандидат медицинских наук, научный сотрудник лаборатории лучевых методов диагностики.
Кемерово
А. И. Кареева
Россия
Младший научный сотрудник лаборатории лучевых методов диагностики.
Кемерово
К. Е. Кривошапова
Россия
Кандидат медицинских наук, научный сотрудник лаборатории коморбидности при сердечно-сосудистых заболеваниях.
Кемерово
О. Л. Барбараш
Россия
Доктор медицинских наук, профессор, академик РАН, директор.
Кемерово
Дополнительные файлы
Рецензия
Для цитирования:
Коков А.Н., Масенко В.Л., Кареева А.И., Кривошапова К.Е., Барбараш О.Л. Портрет пациента со стабильной ишемической болезнью сердца и нарушением мышечного статуса. Кардиоваскулярная терапия и профилактика. 2022;21(12):3454. https://doi.org/10.15829/1728-8800-2022-3454
For citation:
Kokov A.N., Masenko A.I., Kareeva A.I., Krivoshapova K.E., Barbarash O.L. Profile of a patient with stable coronary artery disease and impaired muscle status. Cardiovascular Therapy and Prevention. 2022;21(12):3454. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3454
JATS XML

























































