Перейти к:
Кардиометаболические факторы риска у пациентов с сахарным диабетом 2 типа и саркопенией
https://doi.org/10.15829/1728-8800-2024-3655
EDN: GGXZHV
Аннотация
Цель. Анализ факторов риска саркопении в формировании атеросклеротических поражений органов-мишеней у пациентов с сахарным диабетом (СД) 2 типа.
Материал и методы. В исследование были включены 84 пациента с СД 2 типа, разделенные на группы согласно критериям европейской группы по изучению саркопении EWGSOP2 2019г (European Working Group on Sarcopenia in Older People). Всем пациентам проводили анкетирование с помощью краткой формы оценки здоровья SF-36 (Health Status Survey), качества жизни SarQoL (Sarcopenia and Quality of Life), Strength, SARC-F (Assistance with walking, Rise from a chair, Climb stairs and Falls), динамометрию, тест ходьбы на 4 м, биоимпедансометрию, суточное мониторирование артериального давления и ультразвуковое исследование сердца. Статистически значимыми различия считались при р<0,05.
Результаты. У пациентов с саркопенией наблюдается более низкое содержание жировой, мышечной и клеточной массы, индекса аппендикулярной массы, жидкости, белков и минералов. В группе с саркопенией выявлены более высокие показатели общего холестерина, холестерина липопротеинов низкой плотности, гликированного гемоглобина, а также гипокальциемия. Уровень триглицеридов у лиц с пресаркопенией был высоким. В этой же группе зафиксированы нестабильные показатели артериального давления, повышенная масса миокарда и выраженные признаки атеросклероза нижних конечностей.
Заключение. Саркопения является одной из важных медикосоциальных проблем и сопровождается неблагоприятными исходами. Сочетание саркопении и СД 2 типа может способствовать быстрому развитию макро- и микроангиопатий и повышать риск сердечно-сосудистых осложнений.
Ключевые слова
Для цитирования:
Самойлова Ю.Г., Матвеева М.В., Хорошунова Е.А., Подчиненова Д.В., Максимова Л.Л., Горбач Г.Г., Тривоженко А.Б., Авхименко В.А. Кардиометаболические факторы риска у пациентов с сахарным диабетом 2 типа и саркопенией. Кардиоваскулярная терапия и профилактика. 2024;23(1):3655. https://doi.org/10.15829/1728-8800-2024-3655. EDN: GGXZHV
For citation:
Samoilova Yu.G., Matveeva M.V., Khoroshunova E.A., Podchinenova D.V., Maksimova L.L., Gorbach G.G., Trivozhenko A.B., Avkhimenko V.A. Cardiometabolic risk factors in patients with type 2 diabetes and sarcopenia. Cardiovascular Therapy and Prevention. 2024;23(1):3655. (In Russ.) https://doi.org/10.15829/1728-8800-2024-3655. EDN: GGXZHV
Введение
Сахарный диабет (СД) 2 типа, ожирение, артериальная гипертензия (АГ) ассоциированы с высоким риском развития сердечно-сосудистых катастроф. По данным Федерального регистра сахарного диабета, общая численность пациентов с СД в Российской Федерации (РФ), состоящих на диспансерном учете от 01.01.2021г, составила 4799552 (3,23% населения РФ), из них СД 1 типа — 5,5% (265,4 тыс.), СД 2 типа — 92,5% (4,43 млн), другие типы СД — 2,0% (99,3 тыс.). Средний возраст выявления СД 2 типа 65-69 лет. Смертность по сравнению с прошлыми данными у пациентов с СД 2 типа увеличилась с 87,7 до 93,9 на 100 тыс. населения, основная причина смерти — сердечно-сосудистые заболевания (ССЗ) [1]. СД 2 типа является одним из основных факторов риска (ФР) развития цереброваскулярных заболеваний, ишемической болезни сердца (ИБС). Эти данные подтверждают ряд научных исследований во всем мире [2][3]. Смертность от ССЗ при СД регистрируется в 38,6% у пациентов с СД 1 типа и в 38,6% при СД 2 типа [1][4].
Ежегодно количество пациентов, страдающих ожирением, увеличивается. В 2022г масштабное исследование NATION (Национальное эпидемиологическое кроссекционное исследование), проведенное под руководством Национального медицинского исследовательского центра эндокринологии Минздрава России, показало, что в РФ ожирением страдают ~40 млн (30%) человек. Согласно докладу Всемирной организации здравоохранения (2022г) о проблеме распространения ожирения в Европе 2022г, более половины взрослого населения РФ (55,5%) имеют избыточную массу тела и ожирение [5]. Ожирение и избыточная масса тела являются одними из ведущих ФР развития ССЗ, СД 2 типа, саркопении [6].
Термин саркопеническое ожирение включает в себя снижение мышечной массы и силы и избыточное накопление жира, преимущественно за счет висцерального ожирения [7][8]. У пожилых пациентов к снижению мышечной массы и увеличению жировой массы тела приводят ряд факторов: гиподинамия, несбалансированное питание, наличие сопутствующей коморбидной патологии — ИБС, АГ, хронической болезни почек, заболеваний опорно-двигательного аппарата и т.д. В метаанализе нескольких исследований установлено, что саркопеническое ожирение повышает риск развития СД 2 типа на 38% по сравнению с изолированным ожирением или саркопенией [9].
Миграция лимфоцитов и макрофагов в очаг хронического воспаления, сопровождается повышенной секрецией провоспалительных цитокинов, таких как С-реактивный белок (СРБ), фактор некроза опухолей альфа (ФНО-α), интерлейкин (ИЛ)-1, ИЛ-6. Кроме этого, жировая ткань продуцирует адипокины, которые обладают липотоксичностью в отношении скелетной мускулатуры и способствуют прогрессированию саркопении [10]. Следующие провоспалительные маркеры: СРБ, ФНО-α, эндотелин-1, ИЛ-1β, в группе пациентов с СД 2 типа и ИБС могут свидетельствовать о нарушении функции эндотелия [11]. Например, ФНО-α способствует повышению образования свободных радикалов и может стать причиной интенсификации процессов апоптоза эндотелиоцитов и инактивации оксида азота. Параллельно, с регуляцией хронического воспаления ассоциируются такие маркеры, как ИЛ-1, ИЛ-8 и ФНО-α, которые стимулируют пролиферацию эндотелиоцитов. Кроме этого, в очаг воспаления мигрируют макрофаги, усиливающие синтез коллагена фибробластами, что приводит к изменению структуры сосудистой стенки и может играть патогенетическую роль в развитии атеросклероза [12].
В настоящее время проблема коморбидности саркопенического ожирения и ССЗ является высоко актуальной, т.к. есть ряд вопросов, касающихся общности патогенеза дислипидемии, ожирения и потери мышечной массы [13]. Вопрос о том, являются ли эти процессы независимыми возраст-ассоциированными состояниями или коморбидной патологией, объединяемой общими звеньями патогенеза, до сих пор остается предметом дискуссий. Согласно данным литературного обзора, проведенного Мисниковой И. В. и др. (2017), атеросклеротические изменения и саркопеническое ожирение рассматриваются как единое звено патогенеза в развитии сердечно-сосудистых осложнений. Устранение хронического воспаления у пациента считается ключевым механизмом в лечении атеросклероза и саркопении [11], однако для подтверждения этой гипотезы требуется проведение ряда крупных исследований.
Анализ научных публикаций за последние пять лет выявил отсутствие крупномасштабных международных исследований по влиянию саркопенического ожирения на риск развития ССЗ.
Проблема ожирения и сердечно-сосудистых заболеваний активно изучается в Южной Корее. По итогам одного из исследований выявлено, что саркопеническое ожирение сочетается с кальцинозом коронарных артерий [14]. В другом исследовании пациенты с неалкогольной болезнью печени и саркопенией имели более высокий риск прогрессирования атеросклероза (скорректированное отношение шансов 2,20; р<0,009), чем лица без саркопении [15].
В исследовании, проведенном He J, et al., у пациентов с более высокими показателями — индексом аппендикулярной массы, кистевой динамометрией, скоростью ходьбы, было показано снижение риска развития ИБС. В то же время, генетическая предрасположенность к ИБС не влияла ни на один из признаков, связанных с саркопенией [16].
Вместе с тем, есть исследования, противоречащие этим данным. Например, при анализе распространенности ССЗ среди пожилых пациентов с саркопеническим ожирением в Нью-Мексико разница составила 11,5 vs 13,7% в группе контроля [17]. В другом крупномасштабном региональном британском исследовании при обследовании 4111 мужчин от 60 до 79 лет связи между ССЗ и саркопеническим ожирением выявлено не было [17].
Следует отметить, что крупномасштабных исследований, оценивающих влияние саркопении на течение СД 2 типа и ассоциированных с ним ССЗ (АГ, ИБС, атеросклеротические поражения органов-мишеней), проведено не было. Поэтому настоящее исследование является особенно актуальным.
Цель исследования — анализ ФР саркопении в формировании атеросклеротических поражений органов-мишеней у пациентов с СД 2 типа.
Материал и методы
Исследование проведено в соответствии со стандартами клинической практики и Хельсинкской декларацией на базе эндокринологического отделения ФГБУ Сибирского федерального научно-клинического центра ФМБА России. Протокол исследования был одобрен этическим комитетом ФГБОУ ВО СибГМУ Минздрава России (заключение № 8888 от 29.11.2021), все пациенты подписали информированное согласие. Исследование являлось одномоментным, сплошным. Критерии включения: пациенты, страдающие СД 2, в возрасте 45-85 лет, подписавшие "информированное согласие". Критерии невключения: заболевания сердечно-сосудистой системы, дыхательной системы, опорно-двигательного аппарата, желудочно-кишечного тракта на стадии декомпенсации, тяжелая стадия почечной недостаточности на стадии хронической болезни почек С4-5, ампутация конечности в анамнезе, дефицит витамина В12, злоупотребление алкоголем, имплантация кардиостимулятора, наличие крупных металлических протезов и конструкций, выраженный лимфостаз нижних конечностей.
Участвовали 84 добровольца, подписавшие информированное согласие. На основании алгоритма первичного скрининга на выявление снижения мышечной силы по данным кистевой динамометрии и биоимпедансометрии, EWGSOP2 2019г (European Working Group on Sarcopenia in Older People) пациенты были разделены на 3 группы: 1-я группа — пациенты с СД 2 типа и саркопенией (снижение мышечной массы и силы) (n=13), 2-я группа — пациенты с СД 2 типа и пресаркопенией (снижение мышечной силы) (n=46), 3-я — группа сравнения (без снижения мышечной силы и массы) с СД 2 типа (n=25). Группы были сопоставимы по полу и возрасту.
Протокол исследования включал измерение силы рук с помощью кистевой динамометрии: проводилось 3-кратное снятие максимальных показателей с использованием обеих рук в изометрическом сокращении, за стандарт принято положение сидя с разгибанием локтя на 90º. Диагностические критерии низкой мышечной силы при динамометрии (модель ДК-100, Россия), согласно EWGSOP2 2019г: у женщин <16 кг, а у мужчин <27 кг. Всем участникам проведена биоимпедансометрия с использованием аппарата Inbody 770 (Южная Корея) с оценкой: индекса массы тела (ИМТ), анализа внеклеточной и внутриклеточной жидкости, а также общей жидкости в организме, жировой массы тела, процента жировой массы, площади висцерального жира, мышечной массы, количества минералов и белка, клеточной массы. На основании полученных данных рассчитывали аппендикулярный индекс скелетной массы как отношение сухой мышечной массы конечностей к росту в м². За низкую мышечную массу, согласно критериям EWGSOP2 2019г, принимали значения <7,0 кг/м² для мужчин и <5,5 кг/м² для женщин [18]. Дополнительно оценивали мышечную функцию с помощью теста ходьбы на 4 м. Показателем тяжелой саркопении считалось снижение скорости ≤0,8 м/с [18]. Всем пациентам измеряли антропометрические характеристики — рост, вес и ИМТ, окружность талии (ОТ) и окружность бедер (ОБ). Для анализа качества жизни использовали следующие опросники — SF-36 (Health Status Survey) и SarQoL (Sarcopenia and Quality of Life), а для степени тяжести саркопении применяли SARC-F (Strength, Assistance with walking, Rise from a chair, Climb stairs and Falls) [18]. Уровень физической активности интерпретировали с помощью анкетирования, где учитывалось время физической нагрузки в мин/сут.
Дополнительно проводили забор крови для оценки лабораторных показателей: глюкозы, общего белка, альбумина, липидного спектра, включая холестерин (ХС), триглицериды, ХС липопротеинов высокой плотности (ЛВП), ХС липопротеинов низкой плотности (ЛНП), а также гликированного гемоглобина, натрия, калия, ионизированного кальция).
Суточное мониторирование артериального давления (СМАД) проводили по стандартной методике в течение 24-26 ч с помощью аппарата СМАД "Валента", монитор N: 5728, версия ПО: 1.4.0.69. Аппарат был запрограммирован на измерение уровня артериального давления (АД) в дневное время (7.00-23.00) с интервалом 15 мин, в ночное время (23.00-7.00) — 30 мин. Каждое исследование удовлетворяло следующим критериям качества: продолжительность мониторинга не <23 ч, не <56 успешных измерений АД, отсутствие "пробелов" в записи длительностью >1 ч.
Ультразвуковое исследование (УЗИ) проводили с помощью аппарата VIVID E9. Во время проведения УЗИ сердца оценивали следующие показатели: ударный объем (мл), массу миокарда (г), процентный стеноз коронарных артерий, фракцию выброса (%). При проведении УЗИ артерий нижних конечностей определяли уровень стенозирования в процентном соотношении бедренной артерии, подколенной артерии, тыльной артерии стопы, задней большеберцовой артерии. При проведении УЗИ сонных артерий оценивали проходимость в процентном соотношении общей сонной артерии и внутренней сонной артерии.
Статистическую обработку данных проводили с помощью программного обеспечения Statistica IBM (русская версия 23.0). Критерием проверки на нормальность распределения был выбран W-критерий Шапиро-Уилка. Параметры, распределение которых отличалось от нормального, представлены в виде медианы и интерквартильного размаха Me [Q25; Q75]. Качественные бинарные признаки — в виде относительной частоты (%) и ее 95% доверительного интервала. Непараметрические критерии использовали при проверке гипотез для количественных параметров с распределением, отличным от нормального: для парного сравнения критерии Манна-Уитни (независимые выборки) и Вилкоксона (зависимые), Краскела-Уоллеса. Для проведения корреляционного анализа — непараметрический критерий Спирмена. Для достоверности отличий качественных признаков — таблицы сопряженности с расчетом χ². Статистически значимыми различия считали при р<0,05.
Исследование финансировалось грантом РНФ "Ранняя диагностика саркопении на основе метаболического профиля", 22-25-00632 от 10.01.2022.
Результаты
В ходе исследования у пациентов с СД 2 типа с саркопенией и пресаркопенией выявлен ряд различий по параметрам ИМТ, массы тела, индекса ОТ/ОБ, кистевой динамометрии, гликемии и уровню физической активности (таблица 1). У пациентов с саркопенией ИМТ в пределах нормы, при пресаркопении — избыток массы тела имели 21,7% (n=10), I ст. ожирения выявлена в 65,2% (n=30), II ст. — 13% (n=6), в группе сравнения — ожирение I ст. имело место у 72% (n=18), а ожирение II ст. — у 28% (n=7). Кроме этого, отмечалось более низкое значение индекса ОТ/ОБ в 1-й и 2-й группах по сравнению с группой 3.
Таблица 1
Характеристика групп
|
Показатель |
1. Группа с саркопенией |
2. Группа с пресаркопенией |
3. Группа сравнения |
р |
|
Масса тела, кг |
64 [ 54,6-68,9] |
83,2 [ 75,7-92,7] |
92,3 [ 84,9-106,5] |
0,001 |
|
ИМТ, кг/м² |
22,8 [ 20,4-23,7] |
32,9 [ 29,6-36,1] |
34,2 [ 30,5-37,9] |
0,019 |
|
ОТ/ОБ |
0,95 [ 0,87-0,97] |
1,02 [ 0,96-1,1] |
1,05 [ 1,0-1,1] |
0,001 |
|
Сила правой руки, кг |
23 [ 17-26] |
11 [ 8-16] |
20 [ 19-25] |
0,001 |
|
Сила левой руки, кг |
21 [ 14-23] |
10 [ 8-14] |
20 [ 17-25] |
0,001 |
|
Скорость ходьбы, м/с |
1,3 [ 1,1-2,2] |
1,6 [ 1,2-2,1] |
1,2 [ 1-1,5] |
0,035 |
|
Гликемия, ммоль/л |
6,8 [ 5,7-8,0] |
7,3 [ 6,5-8,6] |
7,1 [ 6,1-7,6] |
0,001 |
|
Физическая активность, мин/сут. |
40 [ 30-60] |
35 [ 25-45] |
45 [ 30-90] |
0,001 |
Примечание: ИТМ — индекс массы тела,
ОБ — окружность бедер, ОТ — окружность талии.
Во 2-й группе показатели кистевой динамометрии и скорости ходьбы были ниже, а гликемии — выше, чем в 1-й и 3-й группах. Вероятно, эти результаты связаны с преобладанием избыточной массы тела и ожирения в группе с пресаркопенией на фоне снижения физической активности. Во 2-й группе уровень физической активности был ниже по сравнению с 1-й и 3-й группами.
У пациентов с саркопенией жалобы встречались чаще, чем среди представителей других групп: частые острые респираторные вирусные инфекции (ОРВИ) в анамнезе, одышка при физической нагрузке, сухость кожных покровов, тяжесть в ногах (таблица 2). Пациентов с пресаркопенией достоверно чаще беспокоили онемение нижних конечностей, головокружение, боль в суставах. Из сопутствующих заболеваний пациенты с саркопенией и пресаркопенией чаще страдали патологией щитовидной железы — 39 и 35%, по сравнению с 3-й группой (16%) (р=0,02). Поражение печени у пациентов 1-й группы встречалось в 39% случаев, во 2-й группе — в 56%, в 3-й — у 60% (р=0,02). АГ выявлена у 92% пациентов с саркопенией, у 96% лиц с пресаркопенией и у 92% в группе без снижения мышечной массы (р=0,02).
Таблица 2
Частота основных жалоб у пациентов обследованных групп
|
Показатель, n (%) |
1. Группа с саркопенией |
2. Группа с пресаркопенией |
3. Группа сравнения |
χ² |
р |
|
Онемение нижних конечностей |
9 (69) |
35 (76) |
13 (52) |
29,1 |
0,001 |
|
Головокружение |
3 (23) |
18 (39) |
6 (24) |
6,9 |
0,07 |
|
Частые ОРВИ |
1 (7,5) |
0 (0,00) |
0 (0,00) |
6,76 |
0,08 |
|
Одышка при физической нагрузке |
5 (38,5) |
11 (24) |
9 (36) |
8,23 |
0,04 |
|
Сухость кожи |
1 (7,7) |
0 (0,00) |
0 (0,00) |
6,76 |
0,08 |
|
Тяжесть в ногах |
8 (62) |
21 (46) |
8 (32) |
14,5 |
0,002 |
|
Боль в суставах |
3 (23%) |
21 (46%) |
7 (28%) |
12,3 |
0,006 |
Примечание: ОРВИ — острая респираторная вирусная инфекция.
Дополнительно в проведенном исследовании проанализирован лекарственный анамнез пациентов с СД 2 типа. Пациенты с саркопенией реже принимали гипотензивную терапию (69%) по сравнению с пациентами 2-й (85%) и 3-й (80%) групп, соответственно (р=0,003). Эти результаты связаны с тем, что АГ в группе с саркопенией встречалась реже. У пациентов 1-й группы отмечался низкий комплаенс в отношении регулярности приема антигипертензивных препаратов (данные получены при первичном анализе). Статины принимали 62% пациентов с саркопенией и СД 2 типа, в группах с пресаркопенией и сравнения статины принимали 72% участников (р=0,02). Дезагрегантную терапию принимали в 1-й группе 69% пациентов, во 2-й и 3-й группах — 85 и 80%, соответственно (р=0,002).
При оценке результатов опросника SARC-F (рисунок 1) признаки вероятной саркопении зарегистрированы в группе с пресаркопенией. В 1-й и 3-й группах, по данным опросника, саркопения отсутствует, однако эти результаты не являются статистически значимыми, т.к. группа пациентов с саркопенией была малочисленной (n=13), что существенно ограничивает результаты работы.
Межгрупповые различия в показателях качества жизни по данным опросника SF-36 отсутствовали, однако следует отметить, что в 1-й и 2-й группах количество баллов при оценке физического компонента тестирования было ниже по сравнению с группой сравнения.
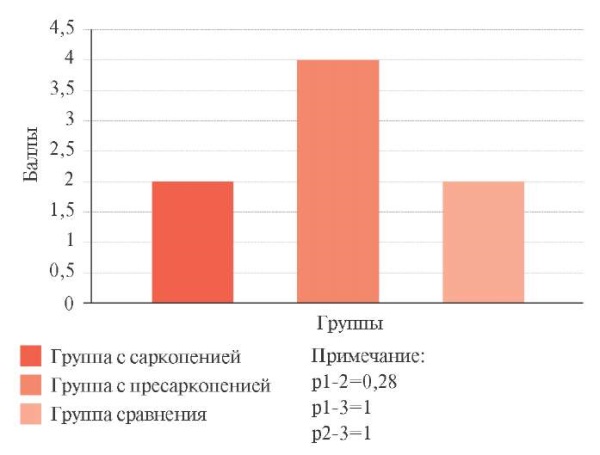
Рис. 1 Оценка результатов опросника SARC-F.
Примечание: SARC-F — Strength, Assistance with walking,
Rise from a chair, Climb stairs and Falls
(сила, помощь при ходьбе, подъем со стула, подъем по лестнице и падения).
Анализ качества жизни по данным опросника SarQol (рисунок 2) показал, что пациенты с саркопенией не отличались от лиц с пресаркопенией и группы сравнения ни по общему количеству баллов оценки качества жизни, ни по другим доменам тестирования.
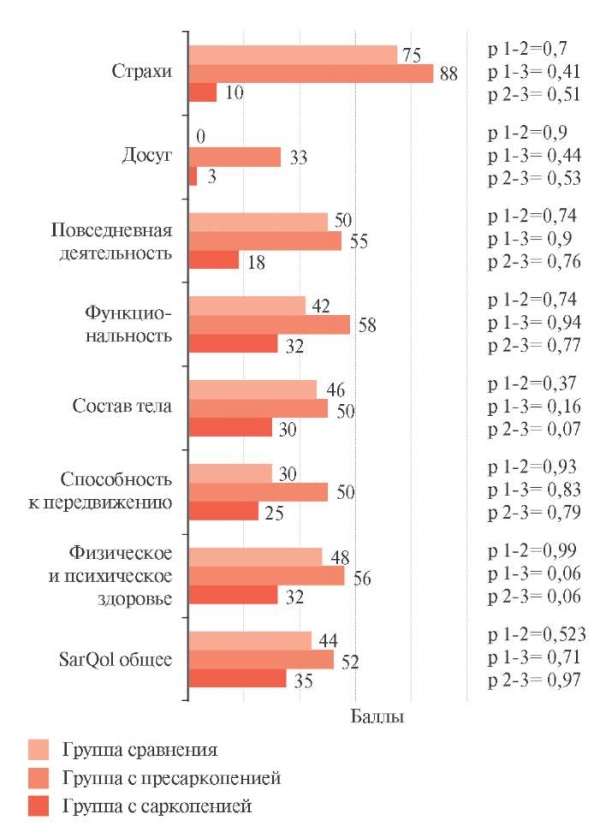
Рис. 2 Оценка результатов опросника SarQol между группами.
Примечание: SarQoL — Sarcopenia and Quality of Life
(оценка саркопении и качества жизни).
После объективного осмотра, сбора жалоб, анамнеза и анкетирования была проведена оценка композиционного состава тела с помощью биоимпедансметрии. При сравнении результатов между группами (таблица 3) отмечено выраженное количественное и процентное более низкое содержание жировой массы у пациентов с саркопенией, а также мышечной массы, индекса аппендикулярной массы, объема внеклеточной и внутриклеточной жидкости, клеточной массы, белка и минералов, по сравнению со 2-й и 3-й группами.
Таблица 3
Оценка композиционного состава тела
|
Показатель |
1. Группа с саркопенией |
2. Группа с пресаркопенией |
3. Группа сравнения |
p |
|
Жировая масса, кг |
17 [ 13-22,2] |
36,1 [ 29,9-43,7] |
40,7 [ 30,1-50,3] |
0,001 |
|
Жировая масса, % |
29,2 [ 24,7-36,5] |
43,6 [ 41,6-47,8] |
43 [ 36,7-49,6] |
0,001 |
|
Площадь висцерального жира, см² |
96,4; 41,0 |
194,4; 54,1 |
204,3; 55,7 |
0,02 |
|
Скелетная мышечная масса, кг |
23,4 [ 20,7-28,1] |
25,1 [ 22,9-29,2] |
28,2 [ 25,1-32,3] |
0,001 |
|
Индекс аппендикулярной скелетной мускулатуры, кг/м² |
5,4 [ 3,8-8,5] |
7,13 [ 5,7-8,8] |
7,5 [ 5,6-9,5] |
0,001 |
|
Белки, кг |
8,4 [ 7-10,0] |
9,0 [ 8,3-10,4] |
10,0 [ 9,0-11,4] |
0,001 |
|
Минералы, кг |
3,0 [ 2,9-3,4] |
3,2 [ 2,9-3,6] |
3,5 [ 3,2-4,0] |
0,001 |
|
Общее количество воды в теле, л |
31,6 [ 28,3-37,8] |
35,1 [ 31,4-39,4] |
38,5 [ 34,1-43,1] |
0,001 |
|
Внутриклеточная жидкость, л |
19,5 [ 17,4-23,1] |
20,8 [ 19,1-23,9] |
23,2 [ 20,8-26,3] |
0,001 |
|
Внеклеточная жидкость, л |
12,5 [ 10,9-14,7] |
13,8 [ 12,4-15,7] |
14,9 [ 13,5-16,8] |
0,001 |
|
Клеточная масса, кг |
27,9 [ 24,9-33] |
29,8 [ 27,4-34,3] |
33,2 [ 29,8-37,7] |
0,373 |
Обращает на себя внимание тот факт, что в группе пациентов с саркопенией выявлены более высокие уровни ХС, ХС ЛНП, гликированного гемоглобина по сравнению с 2-й и 3-й группами (таблица 4). По уровню альбумина значимых различий между группами не обнаружено. При оценке показателей липидного спектра выявлены более низкие значения ХС ЛВП в группе сравнения, при этом уровень ТГ в группе со сниженной мышечной силой был выше по сравнению с пациентами с саркопенией и группой сравнения. По уровню натрия и калия статистических различий между группами не было, уровень кальция был ниже в 1-й группе.
Таблица 4
Оценка лабораторных показателей
|
Показатель |
1. Группа с саркопенией |
2. Группа с пресаркопенией |
3. Группа сравнения |
р |
|
Общий белок, г/л |
69 [ 59-73] |
68,5 [ 65-72] |
69 [ 67-74] |
0,002 |
|
Альбумин, г/л |
41 [ 37-44] |
40 [ 38-43] |
40 [ 36-42] |
0,001 |
|
ХС, ммоль/л |
5,1 [ 3,8-6,7] |
4,7 [ 3,8-5,8] |
4,6 [ 3,8-5,3] |
0,001 |
|
ТГ, ммоль/л |
1,2 [ 0,6-2,0] |
2,1 [ 1,4-3,2] |
1,9 [ 1,4-2,7] |
0,005 |
|
ХС ЛВП, ммоль/л |
1,2 [ 0,9-1,5] |
1,2 [ 1,0-1,4] |
1,1 [ 0,9-1,3] |
0,001 |
|
ХС ЛНП, ммоль/л |
3,1 [ 1,8-4,5] |
2,8 [ 2,0-3,7] |
2,7 [ 2,1-3,0] |
0,001 |
|
Гликированный гемоглобин, % |
8,2 [ 7,3-9,4] |
7,7 [ 7-10,1] |
7,9 [ 6,7-9,9] |
0,006 |
|
Натрий, ммоль/л |
139 [ 138-141] |
141 [ 139-143] |
140 [ 139-142] |
0,007 |
|
Калий, ммоль/л |
3,9 [ 3,4-4,4] |
4,0 [ 3,6-4,3] |
3,9 [ 3,8-4,1] |
0,004 |
|
Кальций, ммоль/л |
1,15 [ 1,12-1,19] |
1,19 [ 1,14-1,23] |
1,20 [ 1,16-1,23] |
0,007 |
Примечание: ЛВП — липопротеины высокой плотности,
ЛНП — липопротеины низкой плотности,
ТГ — триглицериды, ХС — холестерин.
Согласно результатам инструментальных обследований, статистически значимых различий по показателям УЗИ сонных артерий между 1-й и 2-й группами выявлено не было. При этом у пациентов с пресаркопенией зарегистрирована более высокая масса миокарда 203 [ 108-230] г по сравнению с пациентами с саркопенией, у которых она составила 159 [ 159-159,5] г. Суточный индекс диастолического АД (ДАД) во 2-й группе был выше 10,35 [ 1,33-49,24] по сравнению с 1-й 7,9 [ 3,5-12].
По результатам УЗИ и СМАД (таблица 5) у пациентов 1-й и 3-й групп выявлены признаки гемодинамически незначимого атеросклероза нижних конечностей и сонных артерий (сужение артерии менее чем на 70%); при этом у пациентов с саркопенией зафиксирован более высокий уровень среднего ДАД. В то же время у пациентов с пресаркопенией зарегистрированы признаки гемодинамически значимого стеноза артерий нижних конечностей (таблица 6), по сравнению с 3-й группой; в этой же группе выявлены более лабильные показатели АД, чем в 3-й (таблица 6). Среднее суточное ДАД, индекс ночного времени ДАД, суточный индекс систолического АД (САД), вариабельность ДАД и САД были выше во 2-й группе по сравнению с группой сравнения (группа 3).
Таблица 5
Результаты инструментальных исследований
у пациентов с саркопенией и в группе сравнения
|
Показатель |
Группа с саркопенией |
Группа сравнения |
r |
p |
|
УЗИ артерий н/к ЗББА справа, % |
0,0 [ 0,0-100] |
3,75 [ 0,0-0,0] |
1,452 |
0,001 |
|
УЗИ артерий н/к ЗББА слева, % |
0,0 [ 0,0-100] |
5,0 [ 0,0-0,0] |
1,406 |
0,001 |
|
УЗИ устья ВСА справа, % |
10 [ 0,0-35,0] |
20 [ 15-15] |
0,604 |
0,020 |
|
Среднее суточное ДАД, мм рт.ст. |
67,5 [ 60-73,5] |
60,5 [ 60-71] |
-1,217 |
0,036 |
Примечание: ВСА — внутренняя сонная артерия,
ДАД — диастолическое артериальное давление,
ЗББА — задняя большеберцовая артерия,
н/к — нижние конечности, УЗИ — ультразвуковой исследование.
Таблица 6
Результаты инструментальных исследований
у пациентов с пресаркопенией и в группе сравнения
|
Показатель |
Группа с пресаркопенией |
Группа сравнения |
r |
p |
|
УЗИ артерий н/к ЗББА справа, % |
100 [ 0-100] |
3,75 [ 0,0-0,0] |
1,762 |
0,001 |
|
УЗИ артерий н/к ЗББА слева, % |
67,5 [ 15-100] |
5,0 [ 0,0-0,0] |
1,8 |
0,001 |
|
Среднее суточное ДАД, мм рт.ст. |
77 [ 72,5-84,75] |
60,5 [ 60-71] |
-2,815 |
0,001 |
|
Индекс времени ДАД, ночь, % (гипер) |
47,33 [ 10,75-50,42] |
3 [ 1,33-10,33] |
2,474 |
0,001 |
|
Суточный индекс САД, % |
14,58 [ 2,52-22,27] |
7,81 [ 5,42-14,46] |
0,087 |
0,010 |
|
Вариабельность САД 24 ч |
16,97 [ 15,83-26,73] |
12,17 [ 11,8-13,1] |
2,256 |
0,032 |
|
Вариабельность ДАД 24 ч |
14,71 [ 10,39-21,25] |
8,93 [ 8,57-9,38] |
2,354 |
0,026 |
Примечание: ДАД — диастолическое артериальное давление,
ЗББА — задняя большеберцовая артерия, н/к — нижние конечности,
САД — систолическое артериальное давление, УЗИ — ультразвуковое исследование.
Обсуждение
В настоящей работе рассмотрены взаимосвязи между СД 2 типа, саркопенией, АГ и метаболическими нарушениями (дислипидемией, гипергликемией, гипокальциемией) [19]. Полученные результаты свидетельствуют о том, что пациенты с саркопенией и пресаркопенией имеют более низкие значения ИМТ, жировой и мышечной массы, индекса аппендикулярной массы, чем больные СД 2 типа без признаков саркопении.
Для пациентов со сниженной мышечной силой характерны гиподинамия и более низкая скорость ходьбы на 4 м по сравнению с пациентами с саркопенией. Расхождения в результатах можно объяснить низкой распространенностью саркопении в популяции (~13%). При этом, по результатам других исследований, заболеваемость саркопенией у пациентов с СД 2 типа колеблется, в среднем, от 10 до 15% [20][21]. Снижение скорости ходьбы у пациентов с СД 2 типа также часто ассоциируется с симптомами диабетической полинейропатии и суставным синдромом, что может привести в дальнейшем к снижению мышечной массы в нижних конечностях и развитию саркопении [22].
Декомпенсация углеводного обмена приводит к большему риску развития саркопении и сердечно-сосудистых катастроф, кроме этого, атрофия скелетных мышц связана с накоплением конечных продуктов гликирования и развитием инсулинорезистентности [23].
Наличие ожирения в сочетании с гипергликемией усугубляет риск развития хронического воспаления за счет синтеза провоспалительных цитокинов, таких как ИЛ-6, ФНО-α, СРБ, а также активности индуцибельной NO-синтазы (inducible nitric oxide synthase, iNOS), которые способны запускать протеолиз и апоптоз в миоцитах [24].
Результаты анализа данных, полученных с помощью опросников SarQoL и SARC-F подтверждают снижение качества жизни и выявляют первые признаки саркопении у пациентов со сниженной мышечной силой до начала снижения мышечной массы, но при этом количество баллов при саркопении были ниже, чем в группе с пресаркопенией. Учитывая тот факт, что SARC-F обладает умеренной специфичностью, данный тест следует использовать вместе с инструментальными методиками для диагностики снижения мышечной массы и силы (кистевая динамометрия, биоимпедансметрия, измерение окружности голени) [25]. Различия между результатами, полученными с помощью опросников SarQoL и SF-36, отсутствовали.
Оценка композиционного состава тела пациентов с саркопенией и СД 2 типа позволила выявить меньшее содержание общей жидкости и, соответственно, меньшее содержание внеклеточной и внутриклеточной жидкости, что может ассоциироваться с низким количеством скелетной мышечной массы, поскольку скелетная мускулатура является одним из основных водных депо организма [26].
Саркопения часто сочетается с другими нарушениями состава тела: снижением минеральной плотности костной ткани (остеосаркопения), повышенной жировой массой (саркопеническое ожирение) или с тем и другим [27]. При анализе антропометрических данных в настоящем исследовании установлено, что, несмотря на меньшие значения ИМТ и ОТ в группе с пресаркопенией, эти пациенты находились в категории абдоминально-конституционального ожирения I ст. и имели более низкую минеральную плотность по сравнению с группой сравнения.
В группе пациентов с саркопенией ИМТ был в пределах нормы, уровень жировой и костной массы был ниже, чем у пациентов с пресаркопенией и в группе сравнения, возможно, такая клиническая картина связана с наличием сопутствующей старческой астении на фоне саркопении [28].
Выявленное у пациентов с саркопенией меньшее содержание тощей массы и активной клеточной массы характеризует худшее состояние белкового компонента питания по сравнению с группами без саркопении и пресаркопении; при этом, оценивая лабораторные показатели (общий белок, альбумин), достоверной разницы между группами не наблюдали.
Обследованные с саркопенией имели более высокий уровень ХС ЛНП, однако эти пациенты в меньшей степени принимали статины в сравнении с лицами без саркопении или с пресаркопенией. В проведенном южнокорейском исследовании выявлено, что люди с более низким индексом массы скелетных мышц имели значительный риск развития дислипидемии за счет высокого уровня ХС ЛНП [29]. Результаты настоящего исследования согласуются с вышеупомянутыми: действительно, в группе с саркопенией было зарегистрировано повышение уровней общего ХС и ХС ЛНП. Инсулинорезистентность усиливает гликогенолиз, увеличивает экспрессию белка SREBP-1c (sterol regulatory-element-binding protein 1c), что способствует снижению β-окисления жирных кислот, вследствие чего уровень ТГ в скелетных мышцах и печени становится выше [30]. В настоящем исследовании уровень ТГ в группе с пресаркопенией был выше, чем у пациентов с саркопенией и группой сравнения. Возможно, это связано с тем, что пациенты с пресаркопенией имели избыточную массу тела или ожирение. Полученные данные согласуются с результатами проведенного Habib SS, et al. (2020) анализа когорты из 288 взрослых мужчин, где было показано, что уровни общего ХС и ТГ у пациентов с саркопеническим ожирением значительно выше, а уровень ХС ЛВП ниже по сравнению с лицами, не страдающими саркопеническим ожирением. Данные результаты показывают, что саркопения усугубляет течение дислипидемии [31]. В группе с пресаркопенией выявлены значимые атеросклеротические поражения артерий нижних конечностей.
АГ и дислипидемия вызывают эндотелиальную дисфункцию сосудов и могут запускать образование атеросклеротических бляшек [32]. При оценке СМАД в работе была зарегистрирована значимая разница по всем стандартным показателям, при этом пациенты с пресаркопенией и СД 2 типа относились к "non-dipper", при наличии пресаркопении отмечали достоверно более высокие значения индекса в состоянии надпорогового АД и вариабельности САД и ДАД за 24 ч. В этой группе при проведении эхокардиографии обнаружены высокие значения массы миокарда по сравнению с пациентами, страдающими саркопенией. Эти данные указывают на необходимость более тщательного контроля АД у пациентов с СД 2 типа, имеющих признаки саркопенического ожирения.
Несомненно, ограничением данного исследования является количество пациентов, отсутствие контрольной группы.
Заключение
Саркопения в настоящее время является одной из важных медико-социальных проблем и сопровождается неблагоприятными исходами. Среди клинической презентации у пациентов с группой сравнения и пресаркопении чаще отмечаются неспецифические жалобы, тогда как в группе с саркопенией симптомы обусловлены течением СД 2 типа и наличием микро- и макрососудистых осложнений. Лекарственный анамнез указывает на то, что пациенты с саркопенией реже использовали антигипертензивную и дезагрегантную терапию, а также статины, по сравнению с пациентами с пресаркопенией и группой сравнения. Поэтому требуется своевременная диагностика и назначение лекарственных препаратов у пациентов с саркопенией, а также для повышения комплаентности лечения следует проводить профилактическую работу с пациентами (беседы, буклеты, стенды, видеоролики), которые будут отражать значение и эффективность назначаемой терапии. Ассоциация саркопении и СД 2 типа ухудшает прогноз у пациентов, способствуя развитию сердечно-сосудистых осложнений. Коррекция гипергликемии, дислипидемии, профилактика гиподинамии, восполнение белкового дефицита могут предотвратить развитие саркопении и улучшить качество жизни пожилых пациентов с нарушением углеводного обмена.
Отношения и деятельность. Исследование финансировалось грантом РНФ "Ранняя диагностика саркопении на основе метаболического профиля", 22-25-00632 от 10.01.2022.
Список литературы
1. Дедов И. И., Шестакова М. В., Викулова О. К. и др. Сахарный диабет в Российской Федерации: динамика эпидемиологических показателей по данным Федерального регистра сахарного диабета за период 2010-2022 гг. Сахарный диабет. 2023;26(2):104-23. doi:10.14341/DM13035.
2. Sattar N, Rawshani A, Franzen S, et al. Age at Diagnosis of Type 2 Diabetes Mellitus and Associations with Cardiovascular and Mortality Risks. Circulation. 2019;139(19):2228-37. doi:10.1161/CIRCULATIONAHA.118.037885.
3. Kaze AD, Santhanam P, Musani SK, et al. Metabolic Dyslipidemia and Cardiovascular Outcomes in Type 2 Diabetes Mellitus: Findings From the Look AHEAD Study. J Am Heart Assoc. 2021;10(7):e016947. doi:10.1161/JAHA.120.016947.
4. Козиолова Н.А., Полянская Е. А., Миронова С. В. Сахарный диабет 2 типа и микрососудистые осложнения у больных стабильной ишемической болезнью сердца: распространенность, прогноз и выбор антитромботической терапии. Южно-Российский журнал терапевтической практики. 2022;3(4):7-24. doi:10.21886/2712-8156-2022-3-4-7-24.
5. Алферова В. И., Мустафина С. В. Распространенность ожирения во взрослой популяции Российской Федерации (обзор литературы). Ожирение и метаболизм. 2022;(1):96-105. doi:10.14341/omet12809.
6. Драпкина О. М., Будневский А. В., Овсянников Е.С. и др. Саркопеническое ожирение: закономерности и парадоксы. Профилактическая медицина. 2021;24(1):73-8. doi:10.17116/profmed20212401173.
7. Donini LM, Busetto L, Bischoff SC, et al. Definition and Diagnostic Criteria for Sarcopenic Obesity: ESPEN and EASO Consensus Statement. Obes Facts. 2022;15(3):321-35. doi:10.1159/000521241.
8. Бернс С.А., Шептулина А.Ф., Мамутова Э.М. и др. Саркопеническое ожирение: эпидемиология, патогенез и особенности диагностики. Кардиоваскулярная терапия и профилактика. 2023;22(6):3576. doi:10.15829/1728-8800-2024-3576.
9. Курмаев Д.П., Булгакова С. В., Тренева Е. В. Саркопеническое ожирение — актуальная проблема современной гериатрии. Российский журнал гериатрической медицины. 2022;(4):228-35. doi:10.37586/2686-8636-4-2022-228-235.
10. Khadra D, Itani L, Tannir H, et al. Association between sarcopenic obesity and higher risk of type 2 diabetes in adults: A systematic review and meta-analysis. World J Diabetes. 2019;10(5):311-23. doi:10.4239/wjd.v10.i5.311.
11. Мисникова И. В., Ковалева Ю. А., Климина Н. А. Саркопеническое ожирение. РМЖ. 2017;25(1):24-9.
12. Петелина Т. И., Мусихина Н. А., Гапон Л. И. и др. Сравнительная характеристика параметров липидного спектра и маркеров сосудистого воспаления в группах пациентов со стабильной стенокардией при наличии и отсутствии сахарного диабета 2 типа. Сахарный диабет. 2017;20(3):194-200. doi:10.14341/7959.
13. Шаврин А.П., Ховаева Я. Б., Черешнев В. и др. Маркеры воспаления в процессе развития атеросклероза. Кардиоваскулярная терапия и профилактика. 2009;8(3):13-5.
14. Chung GE, Park HE, Lee H, et al. Sarcopenic Obesity Is Significantly Associated With Coronary Artery Calcification. Front Med (Lausanne). 2021;8:651961. doi:10.3389/fmed.2021.651961.
15. Cho Y, Park HS, Huh BW, et al. Non-Alcoholic Fatty Liver Disease with Sarcopenia and Carotid Plaque Progression Risk in Patients with Type 2 Diabetes Mellitus. Diabetes Metab J. 2023;47(2):232-41. doi:10.4093/dmj.2021.0355.
16. He J, Huang M, Li N, Zha L, et el. Genetic Association and Potential Mediators between Sarcopenia and Coronary Heart Disease: A Bidirectional Two-Sample, Two-Step Mendelian Randomization Study. Nutrients. 2023;15(13):3013. doi:10.3390/nu15133013.
17. Зуйкова А.А., Шевцова В.И., Шевцов А.Н. и др. Саркопеническое ожирение у коморбидных пациентов. Клиническая практика. 2022;13(4):60-7. doi:10.17816/clinpract112438.
18. Cruz-Jentoft AJ, Bahat G, Bauer J, et al. Writing Group for the European Working Group on Sarcopenia in Older People 2 (EWGSOP2), and the Extended Group for EWGSOP2. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 2019;48(1):16-31. doi:10.1093/ageing/afy169.
19. Гурьева И. В., Онучина Ю. С., Дымочка М.А. и др. Особенности саркопении и состава тела на основании биоимпедансометрии у пациентов с сахарным диабетом 2 типа. Вопросы диетологии. 2017;7(3):11-9. doi:10.20953/2224-5448-2017-3-11-19.
20. Gorial FI, Sayyid OS, Al Obaidi SA. Prevalence of sarcopenia in sample of Iraqi patients with type 2 diabetes mellitus: A hospital based study. Diabetes Metab Syndr. 2020;14(4):413-6. doi:10.1016/j.dsx.2020.04.021.
21. Yang Q, Zhang Y, Zeng Q, et al. Correlation Between Diabetic Peripheral Neuropathy and Sarcopenia in Patients with Type 2 Diabetes Mellitus and Diabetic Foot Disease: A CrossSectional Study. Diabetes Metab Syndr Obes. 2020;13:377-86. doi:10.2147/DMSO.S237362.
22. Chiu CY, Yang RS, Sheu ML, et al. Advanced glycation endproducts induce skeletal muscle atrophy and dysfunction in diabetic mice via a RAGE-mediated, AMPK-down-regulated, Akt pathway. J Pathol. 2016;238:470-82. doi:10.1002/path.4674.
23. O'Neill ED, Wilding JPH, Kahn CR, et al. Absence of insulin signalling in skeletal muscle is associated with reduced muscle mass and function: evidence for decreased protein synthesis and not increased degradation. Age. 2010;32:209-22. doi:10.1007/s11357-009-9125-0.
24. Хорошунова Е.А., Самойлова Ю. Г., Матвеева М. В. и др. Оценка методов диагностики саркопении у лиц с нарушением углеводного обмена на современном этапе. Профилактическая медицина. 2022;25(10):116-21. doi:10.17116/profmed202225101116.
25. Xu Z, Zhang P, Chen Y, et al. Comparing SARC-CalF With SARC-F for Screening Sarcopenia in Adults With Type 2 Diabetes Mellitus. Front Nutr. 2022;9:803924. doi:10.3389/fnut.2022.803924.
26. Курмаев Д. П., Булгакова С. В., Тренева Е. В. и др. Нутритивная поддержка в комплексной программе профилактики и лечения саркопении (обзор литературы). Российский журнал гериатрической медицины. 2023;1(13):29-38. doi:10.37586/2686-8636-1-2023-29-38.
27. Наумов A.B., Деменок Д. В., Онучина Ю. С. и др. Инструментальная диагностика остеосаркопении в схемах и таблицах. Российский журнал гериатрической медицины. 2021;3(7):350-6. doi:10.37586/2686-8636-3-2021-350-356.
28. Тополянская С.В. Саркопения, ожирение, остеопороз и старость. Сеченовский вестник. 2020;11(4):23-35. doi:10.47093/2218-7332.2020.11.4.23-35.
29. Baek SJ, Nam GE, Han KD, et al. Sarcopenia and sarcopenic obesity and their association with dyslipidemia in Korean elderly men: the 2008-2010 Korea National Health and Nutrition Examination Survey. J Endocrinol Invest. 2014;37:247-60 doi:10.1007/s40618-013-0011-3.
30. Nishikawa H, Asai A, Fukunishi S, et al. Metabolic Syndrome and Sarcopenia. Nutrients. 2021;13(10):3519. doi:10.3390/nu13103519.
31. Habib SS, Alkahtani S, Alhussain M, et al. Sarcopenia Coexisting with High Adiposity Exacerbates Insulin Resistance and Dyslipidemia in Saudi Adult Men. Diabetes Metab Syndr Obes. 2020;13:3089-97. doi:10.2147/DMSO.S260382.
32. Попыхова Э. Б., Степанова Т.В., Лагутина Д.Д. и др. Роль сахарного диабета в возникновении и развитии эндотелиальной дисфункции. Проблемы Эндокринологии. 2020;66(1):47-55. doi:10.14341/probl12212.
Об авторах
Ю. Г. СамойловаРоссия
Самойлова Юлия Геннадьевна — доктор медицинских наук, профессор кафедры факультетской терапии с курсом клинической фармакологии, заведующий кафедрой детских болезней с курсом эндокринологии.
Томск
М. В. Матвеева
Россия
Матвеева Мария Владимировна — доктор медицинских наук, профессор кафедры педиатрии с курсом эндокринологии ФГБОУ ВО СибГМУ Минздрава России.
Томск
Е. А. Хорошунова
Россия
Хорошунова Екатерина Анатольевна — аспирант кафедры, врач-эндокринолог.
Томск; Северск
Д. В. Подчиненова
Россия
Подчиненова Дарья Васильевна — кандидат медицинских наук, доцент кафедры детских болезней с курсом эндокринологии.
Томск
Л. Л. Максимова
Россия
Максимова Лариса Леонидовна — кандидат медицинских наук, врач-эндокринолог.
Северск
Г. Г. Горбач
Россия
Горбач Гэрэлма Геннадьевна — врач-эндокринолог.
Северск
А. Б. Тривоженко
Россия
Тривоженко Александр Борисович — доктор медицинских наук, заведующий отделением функциональной диагностики, профессор кафедры клинической физиологии и функциональной диагностики.
Северск; Москва
В. А. Авхименко
Россия
Авхименко Виктор Александрович — кандидат медицинских наук, генеральный директор.
Северск
Дополнительные файлы
Что известно о предмете исследования?
- Сахарный диабет (СД) 2 типа, ожирение, артериальная гипертензия ассоциированы с высоким риском развития сердечно-сосудистых катастроф.
- Саркопения при СД 2 типа может быть кардиометаболическим предиктором.
Что добавляют результаты исследования?
- У пациентов с СД 2 типа и саркопенией регистрируются изменения композиционного состава тела и дислипидемия.
- Пресаркопения при СД 2 типа ассоциирована с вариабельностью артериального давления, повышенной массой миокарда и признаками атеросклероза сосудов нижних конечностей, а саркопения — с более высоким уровнем среднего диастолического артериального давления.
Рецензия
Для цитирования:
Самойлова Ю.Г., Матвеева М.В., Хорошунова Е.А., Подчиненова Д.В., Максимова Л.Л., Горбач Г.Г., Тривоженко А.Б., Авхименко В.А. Кардиометаболические факторы риска у пациентов с сахарным диабетом 2 типа и саркопенией. Кардиоваскулярная терапия и профилактика. 2024;23(1):3655. https://doi.org/10.15829/1728-8800-2024-3655. EDN: GGXZHV
For citation:
Samoilova Yu.G., Matveeva M.V., Khoroshunova E.A., Podchinenova D.V., Maksimova L.L., Gorbach G.G., Trivozhenko A.B., Avkhimenko V.A. Cardiometabolic risk factors in patients with type 2 diabetes and sarcopenia. Cardiovascular Therapy and Prevention. 2024;23(1):3655. (In Russ.) https://doi.org/10.15829/1728-8800-2024-3655. EDN: GGXZHV
JATS XML

























































