Перейти к:
Перикард удален, анасарка осталась. Случай мультидисциплинарного ведения констриктивного перикардита
https://doi.org/10.15829/1728-8800-2025-4157
EDN: ZROLNL
Аннотация
Представлен клинический случай пациента 70 лет, у которого экссудативно-констриктивный перикардит дебютировал с момента вакцинации от SARS-CoV-2 (Severe Acute Respiratory Syndrome CoronaVirus 2), и в течение полугода прогрессировал в виде нарастания отечно-асцитического синдрома, рефрактерного к терапии. Через год, после перенесенного COVID-19 (COrona VIrus Disease 2019), отмечались признаки нарастания сердечной недостаточности, сопровождающиеся повышением уровня провоспалительных маркеров, индикаторов повреждения сердечной мышцы. Диагноз экссудативно-констриктивного перикардита выставлен еще через 9 мес. на стадии анасарки. Трудности диагностики заключались в том, что перикард оставался неутолщенным по данным радиологических методов, имелись расхождения в данных мультиспиральной компьютерной томографии (МСКТ) и эхокардиографии. Проведена декортикация сердца, однако в течение 2 мес. после операции не было достигнуто значимого регресса отечно-асцитического синдрома (ОАС), сохранялось повышение уровней маркеров воспаления, что было расценено как полисерозит. Было решено назначить противовоспалительную терапию анакинрой и колхицином с успешным разрешением ОАС в течение 2 мес. Генно-инженерный препарат был постепенно отменен, прием колхицина продолжен до года. При контрольных обследованиях через 6, 12, 18 мес. обострений не наблюдалось, функциональный класс сердечной недостаточности сохраняется на уровне NYHA (New York Heart Association) 1. Пациент получает минимальную терапию в виде: эплеренон 25 мг, торасемид 5 мг и аторвастатин 20 мг.
Заключение. Особенность течения перикардита в данном клиническом случае заключается в быстро прогрессирующем нарастании с весьма скудными проявлениями воспалительной реакции, прогрессировании при повторной стимуляции антигенами вирусов, быстрым развитием констрикции без значимого утолщения листков перикарда. Сохраняющийся полисерозит может быть причиной резистентного к терапии ОАС у пациентов после перикардэктомии. Следует учитывать возможность наличия торпидного воспаления у пациентов с ОАС.
Ключевые слова
Для цитирования:
Сукмарова З.Н., Мацкевич Л.А., Андреенко Е.Ю., Береговская С.А., Максимова О.Б., Евсеев Е.П., Никитюк Т.Г., Драпкина О.М. Перикард удален, анасарка осталась. Случай мультидисциплинарного ведения констриктивного перикардита. Кардиоваскулярная терапия и профилактика. 2025;24(1):4157. https://doi.org/10.15829/1728-8800-2025-4157. EDN: ZROLNL
For citation:
Sukmarova Z.N., Matskevich L.A., Andreenko E.Yu., Beregovskaya S.A., Maksimova O.B., Evseev E.P., Nikityuk T.G., Drapkina O.M. Pericardium is removed, but the anasarca remains. Multidisciplinary management of constrictive pericarditis: a case report. Cardiovascular Therapy and Prevention. 2025;24(1):4157. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4157. EDN: ZROLNL
Введение
Несмотря на развитие визуализирующих и хирургических методов ведения больных с заболеваниями сердца, диагностика и лечение констриктивного перикардита все еще сопряжены с большими трудностями.
Клинический случай
Информация о пациенте. Пациент Р (мужчина) до 70 лет считал себя здоровым человеком. В апреле 2021г возникло недомогание, снижение толерантности к нагрузкам, дискомфорт в груди, совпавшие по срокам с вакцинацией от SARS-CoV-2 (Severe Acute Respiratory Syndrome CoronaVirus 2). В августе-сентябре 2021г манифестировали и постепенно нарастали отеки нижних конечностей. В ноябре пациент обратился в поликлинику, где была проведена компьютерная томография (КТ) органов грудной клетки и выявлены застойные изменения в обоих легких, пневмофиброз, гидроперикард. По данным эхокардиографии (ЭхоКГ) выявлено расхождение листков перикарда до 12 мм, фракция выброса (ФВ) левого желудочка (ЛЖ) 62%, систолическое давление в легочной артерии — норма. Проводился онкопоиск: КТ органов брюшной полости, колоноскопия, эзофагогастродуоденоскопия — без патологии. В общем и биохимическом анализе крови, кроме повышения уровня мочевой кислоты до 480 мкмоль/л, отклонений не зарегистрировано, в т.ч. N-концевого фрагмента предшественника мозгового натрийуретического пептида — 1,47 мкЕД/мл. Клиническое состояние расценено как хроническая сердечная недостаточность (ХСН) с сохранной ФВ, назначено лечение: эналаприл 10 мг/сут., дапаглифлозин 10 мг/сут., небиволол 5 мг/сут., торасемид 5 мг/сут., а также аллопуринол 100 мг/сут. Несмотря на регулярно принимаемую терапию, в феврале 2022г отметилось нарастание одышки и отеков нижних конечностей. При контроле ЭхоКГ зарегистрировано увеличение расхождения листков перикарда до 15 мм, повышение систолического давления в легочной артерии до 40 мм рт.ст. при сохраняющейся ФВ ЛЖ — 64%. При обследование исключены: острое повреждение миокарда (креатинфосфокиназа (КФК-МВ) — 13 ед/л), гипопротеинемия (белок — 70 г/л) и тяжелая хроническая почечная недостаточность (креатинин — 120 мкмоль/л). К терапии добавлен ибупрофен в дозе 800 мг/сут., а также скорректирована основная схема лечения: карведилол 12,5 мг/сут., лизиноприл 5 мг/сут., торасемид 5 мг/сут., аторвастатин 10 мг/сут. Значимого регресса явлений ХСН не отмечено.
В апреле 2022г пациент перенес COVID-19 (COrona VIrus Disease 2019) легкого течения, на фоне чего отметил увеличение дискомфорта в грудной клетке и одышки. При обращении к кардиологу, спустя период карантина (21 день), зарегистрировано повышение активности КФК-МБ до 98 ед/л, уровней С-реактивного белка (СРБ) до 49 мг/л, фибриногена до 5,1 г/л, впервые выявлена анемия (гемоглобин 114 г/л, эритроциты 3,71×1012/л) нейтрофилия 72%. Остальные показатели, включая белок (65 г/л), креатинин (98 мкмоль/л), мочевину (10 ммоль/л) и мочевую кислоту (215 мкмоль/л), показатели функции печени были в пределах нормальных значений. С учетом отсутствия ишемических изменений на электрокардиограмме и нарушений сократимости по ЭхоКГ продолжалось консервативное ведение хронической сердечной недостаточности (ХСН). В январе 2023г пациент обратился в НМИЦ терапии и профилактической медицины с жалобами на одышку минимальных напряжений, увеличение живота.
В результате физикального обследования отмечен акроцианоз, желтушность кожных покровов, индуративный отек кожи голеней, "лягушачий" живот, пульсация шейных вен. Частота сердечных сокращений 64 уд./мин, артериальное давление 120/80 мм рт.ст.
Предварительный диагноз
Пациенту выставлен предварительный диагноз: Отечно-асцитический синдром неясного генеза: гидроперикард, правосторонний гидроторакс, асцит. Фоновые заболевания: цирроз печени (?). ХСН с сохраненной ФВ (?). Гипертоническая болезнь III стадии, контролируемая, риск сердечно-сосудистых осложнений — 4. Хроническая болезнь почек 2 стадии.
Назначена терапия: бисопролол 2,5 мг/сут., спиронолактон 25 мг/сут., сакубитрил/валсартан 100 мг/сут., торасемид 10 мг/сут.
Диагностическая оценка
В анализах крови сохранялась анемия легкой степени, уровень СРБ 20 мг/л, тропонин I, определенный высокочувствительным методом, был негативным, однако отмечалось выраженное повышение уровня N-терминального фрагмента предшественника мозгового натрийуретического пептида — 1620 пг/мл. ЭхоКГ демонстрировала умеренное количество жидкости в полости перикарда (толщиной до 13 мм), ФВ 64%.
Дифференциальная диагностика
В стационаре проводилась дифференциальная диагностика. Исключались кардиомиопатии, цирроз печени, гипотиреоз, хроническая почечная недостаточность, ревматологические заболевания, онкологическая патология. Результаты анализа крови на маркеры основных иммуновоспалительных заболеваний и кардиотропных вирусов представлены в таблице 1. Диаскин тест был отрицательным. На электрокардиограмме обращал на себя внимание низкий вольтаж зубцов (рисунок 1). По ЭхоКГ локальная и глобальная систолическая функция ЛЖ не нарушены (ФВ 55%). Диастолическая дисфункция миокарда ЛЖ II типа. Митральная и трикуспидальная недостаточность 2 ст. Признаки констриктивной гемодинамики: дилатация и спадение <50% нижней полой вены и величина e’ (пиковая скорость движения миокарда во время раннего диастолического наполнения ЛЖ по данным тканевой допплерографии) тканевого допплера медиальной части митрального кольца >8 см/сек. Перикардиальный выпот ~120 мл. Также проведена мультиспиральная КТ органов грудной клетки, где кальциноза перикарда не выявлено, зарегистрированы признаки незначительного правостороннего гидроторакса, гидроперикарда, выраженного расширения нижней полой вены и умеренного уплотнения листков перикарда. КТ органов брюшной полости подтвердила выраженный асцит, отсутствие поражения печени и почек. По данным магнитно-резонансной томографии сердца признаков воспаления или фиброзных изменений миокарда не выявлено, выявлен гидроперикард по периметру, исключая верхушку и нижнебоковые отделы сердца (рисунок 2). Уплощение межжелудочковой перегородки.
Пациенту выставлен заключительный клинический диагноз "Хронический экссудативно-констриктивный перикардит. Атеросклероз аорты, коронарных и брахиоцефальных артерий. ХСН с сохраненной ФВ IIБ стадии, III функциональный класс (ФК) по NYHA (New York Heart Association). Гидроперикард. Асцит. Хроническая болезнь почек 3а стадии. Анемия хронических заболеваний, легкой степени тяжести. Гиперурикемия.
Таблица 1
Анализы крови на маркеры основных иммуновоспалительных заболеваний и кардиотропных вирусов
Показатель | Результат | Ед. изм. | Референсные пределы |
Ревматоидный фактор | не обнаружено | МЕд/мл | <30 |
Антитела к β-2-гликопротеину | 0,001 | ед./мл | <10 |
Антинуклеарный фактор | 1:160 | титр | <1:160 |
LE-клетки | не обнаружено | не обнаружено | |
Антитела к дсДНК | не обнаружено | МЕ/мл | <20 |
Антитела IgG к Sm | не обнаружено | Ед/мл | 0-15 |
Волчаночный антикоагулянт | не обнаружено | усл. ед. | 0,8-1,2 |
ДНК вируса простого герпеса I и II типа | не обнаружено | не обнаружено | |
ДНК вируса Варицелла-Зостер | не обнаружено | не обнаружено | |
ДНК Toxoplasma gondii | не обнаружено | не обнаружено | |
ДНК Parvovirus B19 (количественное исследование) | не обнаружено | копии/мл | не обнаружено |
ДНК вируса герпеса VI типа | не обнаружено | Ig ДНК HHV6/105 клеток | не обнаружено |
ДНК вируса Эпштейна-Барр | не обнаружено | Ig ДНК/105 клеток | не обнаружено |
ДНК цитомегаловируса | не обнаружено | Ig копий CMV/105 клеток | не обнаружено |
Антитела IgM к вирусу SARS-CoV-2, качественно | 0,8 | коэффициент позитивности | <1,1 |
Антитела IgG к вирусу SARS-CoV-2, качественно | 16,0 | коэффициент позитивности | <1,1 |
Антитела IgG к вирусу SARS-CoV-2, количественно | 520,0 | BAU/мл |
Примечание: ДНК — дезоксирибонуклеиновая кислота, SARS-CoV-2 — Severe Acute Respiratory Syndrome CoronaVirus 2.
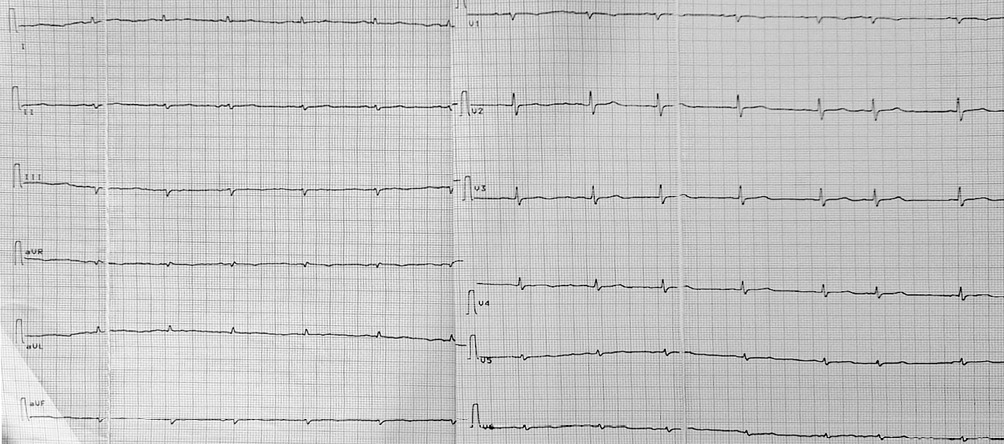
Рис. 1 Электрокардиограмма пациента с экссудативно-констриктивным перикардитом.
Ритм синусовый, частота сердечных сокращений 53 уд./мин. Отклонение электрической оси сердца влево. Низкий вольтаж зубцов. Единичные наджелудочковые экстрасистолы. Блокада передне-верхнего разветвления левой ножки пучка Гиса, смещение максимального вольтажа R в V2-V3 в грудных отведениях.
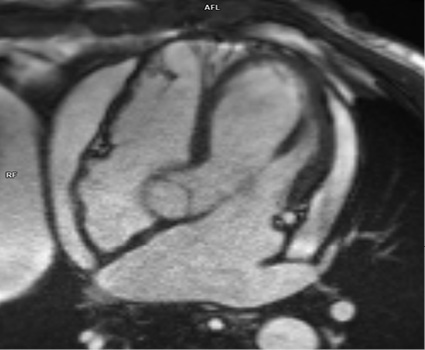
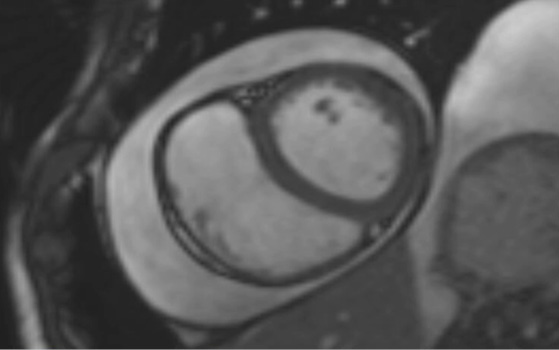
Рис. 2 Магнитно-резонансная томография сердца. 4-камерная и поперечная позиции.
Медицинские вмешательства
Проведена консультация кардиохирурга: рекомендовано оперативное лечение и проведение коронароангиографии для определения объема оперативного вмешательства. По данным коронарографии выявлен стеноз 70% в передней межжелудочковой артерии. Пациенту проведено оперативное лечение в ФГБНУ РНЦХ им. Б. В. Петровского: Субтотальная перикардэктомия. Маммарокоронарное шунтирование с передней межжелудочковой артерией. Интраоперационно подтвержден выраженный спаечный процесс листков перикарда, их минимальное утолщение, но выраженное фиброзное перерождение (рисунок 3). Эти данные были подтверждены результатами паталогоанатомического исследования: фрагменты перикарда, утолщенные за счет фиброза и склероза, отмечаются очаги лимфоцитарной инфильтрации. Заключение: Морфологическая картина хронического перикардита.
Несмотря на радикальное решение клинической проблемы, без осложнений прошедший периоперационный период и оптимальные условия для реабилитации, у пациента в течение 2 мес. сохранялась боль в груди, сердечная недостаточность III-IV ФК, анасарка. Больной был направлен на консультацию в НИИ ревматологии им. В. А. Насоновой. На проведенной ЭхоКГ регистрировалась ФВ ЛЖ 52% и нормализация диастолической функции ЛЖ и правого желудочка — Е/А (соотношение раннего и позднего пиковых скоростей наполнения ЛЖ) =1,7, Е/е* (соотношение ранних скоростей наполнения ЛЖ по данным допплера и тканевого допплера) =6,9, жидкость в полости перикарда нижне-верхушечной локализации (рисунок 4), экссудат в плевральных полостях ~ 600-800 мл, свободная жидкость между петлями кишечника. В лабораторных показателях отмечалось сохранение повышенных значений СРБ 15-10 мг/л. Дообследование в отношении наличия ревматологических заболеваний таковых не выявило. Учитывая признаки полисерозита (выпот в несколько серозных полостей с признаками воспалительной активности) в период после проведения перикардэктомии, пациенту было решено назначить противовоспалительную терапию. В течение первых 2 мес., под динамическим контролем, пациент получал комбинированную терапию колхицином 0,5 мг/сут. и ингибитором интерлейкина-1 (анакинра 100 мг/сут.). При этом боль и дискомфорт в груди регрессировали в течение недели, подавление экссудации в полость перикарда зафиксировано при контроле через 1 мес., в брюшной и плевральной полостях — через 2 мес. После этого генно-инженерный препарат был постепенно отменен, а прием колхицина продолжен до года.

Рис. 3 В операционном поле видны местами минимально утолщенные, но ригидные листки перикарда, ограничивающие оптимальную работу сердца.
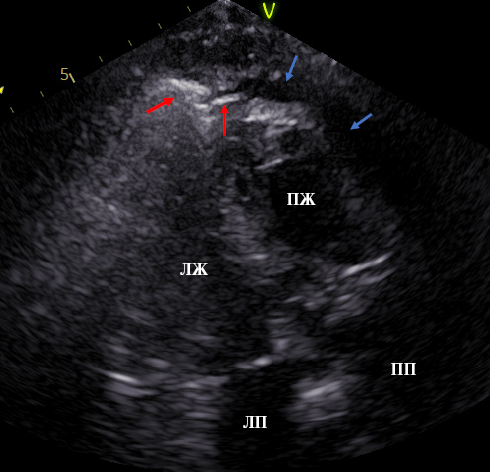
Рис. 4 Визуализация сердца из субкостального доступа. Граница резекции перикарда. Красными стрелками показаны остаточные лоскуты перикарда, синими — выпот (вероятно, с геморрагическим компонентом).
Примечание: ЛЖ — левый желудочек, ЛП — левое предсердие, ПЖ — правый желудочек, ПП — правое предсердие. Цветное изображение доступно в электронной версии журнала.
Динамика и исходы
При контрольном исследовании через 6 мес. от начала комбинированной противовоспалительной терапии (4 мес. после перикардэктомии и реваскуляризации) дискомфорт в области сердца не беспокоит, признаков застоя жидкости нет. Спустя 12 и 18 мес. на терапии аторвастатин 40 мг/сут., эплеренон 25 мг/сут., торасемид 5 мг/сут. компенсация ХСН оптимальная, боль в груди не рецидивировала, пациент может быстро ходить и выполнять работу по дому без одышки.
Обсуждение
Клинический случай демонстрирует сложность ведения констриктивного перикардита (КП) и необходимость мультидисциплинарного подхода. С одной стороны, история данного пациента представляет собой пример типичного течения актуального КП, особенностями которого является этиология — антиген SARS-CoV-2 (Severe Acute Respiratory Syndrome CoronaVirus 2), торпидность острой и подострой фазы перикардита у пожилых людей — без выраженной лихорадки и боли в груди, раннее развитие констриктивной гемодинамики (4 мес. после острого эпизода), когда еще отсутствуют выраженное утолщение перикарда и кальциноз, и, как следствие, поздняя диагностика и отсутствие адекватного противовоспалительного лечения. С другой стороны, КП является сложным диагнозом, который, в подавляющем большинстве случаев, устанавливают, как у данного пациента, методом исключения. Одним из основных аргументов дифференциального диагноза ХСН служит несоответствие нормальной сократимости ЛЖ и отечного синдрома. Несоответствие тяжелых признаков недостаточности кровообращения и сохранной систолической функции сердца, резистентность к проводимой квадротерапии позволили относительно рано диагностировать КП по минимальным критериям [1]. Следующей особенностью ведения данного пациента было довольно быстрое направление на оперативное лечение, хотя в большинстве клиник, где нет значительного опыта ведения нетуберкулезного КП, в отсутствие утолщения и кальциевого "панциря" перикарда, хирургическая тактика вызывает споры, т.к. ответственность за принятие решения должен на себя взять кардиолог по результатам весьма скудных данных ЭхоКГ без поддержки радиологов. В опытных центрах подобные случаи КП с "тонким" перикардом описаны именно при вирусном перикардите [2]. Показано, что, если КП неправильно диагностирован или лечение не проводится, уровень смертности от прогрессирования ХСН обычно превышает 90%, а при наличии показаний к операции, ее отсрочка приводит к снижению продолжительности жизни [3][4]. И главной особенностью данного случая явилось продолжающееся активное воспаление серозных оболочек, обусловившее отсутствие значимого клинического улучшения после успешно проведенной декортикации сердца.
Полисерозит представляет собой одновременное или близкое по времени последовательное воспаление нескольких серозных оболочек (плевра, перикард, брюшина), возникающее, как правило, в рамках генерализованного воспалительного процесса. Данное синдромальное обозначение используется, в основном, в ревматологии, но, по данным последних исследований, на первом месте среди его причин стоит онкология, на втором — инфекция, и только на третьем — ревматологические заболевания [5]. Другим признаком персистирующего системного процесса у пациента было стойкое повышение уровня СРБ и антинуклеарного фактора. Учитывая то, что перикардит является иммуновоспалительным заболеванием, т.е. локальное поражение сопровождается циркуляцией в крови провоспалительных цитокинов, антител и т.п., сопряженных с особенностями врожденного и приобретенного иммунитета, логично предположить, что работа с воспалением является не менее важной, чем с механическим осложнением. Кроме того, известно, что перикардэктомия сопровождается повреждением большого количества клеток миокарда и перикарда, а кровь, излившаяся в плевральную полость — является пирогенной средой, что может способствовать выработке дополнительного пула аутоантител к миокарду и провоспалительных субстанций. Мы подозреваем, что большинство пациентов после данного вида операции имеет затяжной восстановительный период, в т.ч. по этим причинам. По данным литературы, к моменту выписки после перикардэктомии нормализация ХСН с III-IV до I и II ФК (по NYHA) наблюдается только у 4% пролеченных, 4-21% имеют диастолическую дисфункцию в позднем послеоперационном периоде, т.е. большинство пациентов продолжают испытывать преходящие симптомы ХСН III-IV ФК (по NYHA), а у 5% из них происходит поздний летальный исход, в основном вследствие прогрессирования застойной ХСН, желудочковых аритмий, плевролегочной патологии [6][7]. Авторами данных и многих других работ показано, что провести тотальную перикардэктомию очень сложно технически, поэтому оставшиеся участки перикарда являются потенциальными источниками воспаления и экссудации, что произошло у описанного пациента. Современные методы индивидуально подобранной противовоспалительной терапии позволяют предотвратить осложнения и улучшить прогноз в данной группе больных.
Заключение
Полисерозит является иммуновоспалительным заболеванием, часто протекает под маской или в сочетании с ХСН и требует соответствующей комплексной терапии. Представленное клиническое наблюдение заставляет пересмотреть отношение к назначению адекватной противовоспалительной терапии в случаях неэффективности квадротерапии ХСН пациентов с сохранной систолической функцией и наличием провоспалительных маркеров, что позволит увеличить эффективность лечения, возможно уменьшить потребность в проведении перикардэктомии, сократить сроки регресса явлений ХСН в постоперационном периоде.
Прогноз. Внимание лечащих врачей и согласованная работа нескольких центров привели к клиническому успеху у данного пациента и улучшению отдаленного прогноза заболевания.
Информированное согласие у пациента получено.
Благодарности. Выражаем слова благодарности академику Насонову Евгению Львовичу, команде антицитокинового центра НИИ ревматологии, лично — Ароновой Евгении Сергеевне и Старковой Анне Сергеевне.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Welch TD, Ling LH, Espinosa RE, et al. Echocardiographic diagnosis of constrictive pericarditis: Mayo Clinic criteria. Circ Cardiovasc Imaging. 2014;7:526-34. doi:10.1161/CIRCIMAGING.113.001613.
2. Мироненко В.А., Куц Э.В, Макаренко В.Н. и др. Диагностика и хирургическое лечение (эпикардиальная декортикация) вирусного констриктивного эпикардита. Анналы хирургии. 2017;22(4):222-6. doi:10.18821/1560-9502-2017-22-4-222-226.
3. Nachum E, Sternik L, Kassif Y, et al. Surgical Pericardiectomy for Constrictive Pericarditis: A Single Tertiary Center Experience. Thorac Cardiovasc Surg. 2020;68:730-6. doi:10.1055/s-0038-1645869.
4. Nozohoor S, Johansson M, Koul B, et al. Radical pericardiectomy for chronic constrictive pericarditis. J Card Surg. 2018;33:301-7. doi:10.1111/jocs.13715.
5. Losada I, González-Moreno J, Roda N, et al. Polyserositis: a diagnostic challenge. Intern Med J. 2018;48(8):982-7. doi:10.1111/imj.13966.
6. Chowdhury UK, Subramaniam GK, Kumar AS, et al. Pericardiectomy for constrictive pericarditis: a clinical, echocardiographic, and hemodynamic evaluation of two surgical techniques. Ann Thorac Surg. 2006;81(2):522-9. doi:10.1016/j.athoracsur.2005.08.009.
7. Thompson JL, Burkhart HM, Dearani JA, et al. Pericardiectomy for pericarditis in the pediatric population. Ann Thorac Surg. 2009;88(5):1546-50. doi:10.1016/j.athoracsur.2009.08.003.
Об авторах
З. Н. СукмароваРоссия
Сукмарова Зульфия Н. — к.м.н., н.с., кардиолог
Москва
Л. А. Мацкевич
Россия
Мацкевич Людмила Алексеевна — зав. отделением функциональной диагностики
Москва
Е. Ю. Андреенко
Россия
К.м.н., с.н.с. отдела клинической кардиологии
Москва
С. А. Береговская
Россия
Зав. 1 кардиологическим отделением, врач-кардиолог
Москва
О. Б. Максимова
Россия
Врач кардиолог
Москва
Е. П. Евсеев
Россия
К.м.н., зав. кардиохирургическим отделением III (отделение хирургии пороков сердца)
Москва
Т. Г. Никитюк
Россия
Никитюк Татьяна Геннадиевна — к.м.н., врач функциональной диагностики Отдела клинической физиологии, инструментальной и лучевой диагностики
Москва
О. М. Драпкина
Россия
Драпкина Оксана Михайловна — д.м.н., профессор, академик РАН, директор
Москва
Дополнительные файлы
- Описан клинический случай констриктивного перикардита, особенностями которого является этиология — вакцинация или заражение SARS-CoV-2 (Severe Acute Respiratory Syndrome CoronaVirus 2), торпидность течения перикардита, особенно у пожилых людей — без выраженной лихорадки и боли в груди, гемодинамических нарушений констриктивного типа, при отсутствии выраженного утолщения перикарда и кальциноза сердечной сорочки, и как следствие — поздняя диагностика и назначение адекватного противовоспалительного лечения.
- Несмотря на проведенную перикардэктомию, спустя 2 мес. наблюдалось отсутствие закономерного регресса сердечной недостаточности, сохранялись повышенными маркеры иммуновоспаления: С-реактивный белок и антинуклеарный фактор.
- Противовоспалительная терапия полисерози-та колхицином и анакинрой позволили добить-ся полной компенсации сердечной недостаточности.
Рецензия
Для цитирования:
Сукмарова З.Н., Мацкевич Л.А., Андреенко Е.Ю., Береговская С.А., Максимова О.Б., Евсеев Е.П., Никитюк Т.Г., Драпкина О.М. Перикард удален, анасарка осталась. Случай мультидисциплинарного ведения констриктивного перикардита. Кардиоваскулярная терапия и профилактика. 2025;24(1):4157. https://doi.org/10.15829/1728-8800-2025-4157. EDN: ZROLNL
For citation:
Sukmarova Z.N., Matskevich L.A., Andreenko E.Yu., Beregovskaya S.A., Maksimova O.B., Evseev E.P., Nikityuk T.G., Drapkina O.M. Pericardium is removed, but the anasarca remains. Multidisciplinary management of constrictive pericarditis: a case report. Cardiovascular Therapy and Prevention. 2025;24(1):4157. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4157. EDN: ZROLNL
JATS XML

























































