Перейти к:
MYBPC3-ассоциированная кардиомиопатия: особенности течения и перспективы специфической терапии
https://doi.org/10.15829/1728-8800-2024-4257
EDN: FJXOAI
Аннотация
Генетически детерминированные кардиомиопатии (КМП) — это группа заболеваний, характеризующихся патологией миокарда, не обусловленной артериальной гипертензией, ишемической болезнью сердца, врожденными и приобретенными пороками. Благодаря развитию методов визуализации и молекулярно-генетической диагностики, к настоящему времени стало очевидно, что традиционная фенотипическая классификация не отвечает в полной мере современным потребностям из-за наличия клиникоморфологического и генотипического "перекреста" КМП. В то же время, в последние годы были получены данные о том, что генетический субстрат обладает существенно большей прогностической ценностью по сравнению с фенотипом и играет значимую роль в стратификации риска и выборе тактики ведения пациентов, а также проведении семейного скрининга. В совокупности это привело к смещению фокуса внимания с фенотипических особенностей в сторону генотипа как основы для современных классификаций КМП. Одним из примеров такого генотип-специфического подхода является выделение КМП, ассоциированной с вариантами гена MYBPC3, как самостоятельной нозологической единицы. Целью статьи является описание роли гена MYBPC3 и кодируемого им сердечного миозин-связывающего белка С в функционировании кардиомиоцитов, представление актуальных литературных данных о механизмах патогенеза, особенностях клинического течения и развивающихся стратегиях терапии MYBPC3-КМП, а также освещение текущих проблем и направлений будущих исследований в данной сфере.
Ключевые слова
Для цитирования:
Нефедова Д.А., Мясников Р.П., Куликова О.В., Драпкина О.М. MYBPC3-ассоциированная кардиомиопатия: особенности течения и перспективы специфической терапии. Кардиоваскулярная терапия и профилактика. 2024;23(12):4257. https://doi.org/10.15829/1728-8800-2024-4257. EDN: FJXOAI
For citation:
Nefedova D.A., Myasnikov R.P., Kulikova O.V., Drapkina O.M. MYBPC3-associated cardiomyopathy: features of the course and prospects for specific therapy. Cardiovascular Therapy and Prevention. 2024;23(12):4257. (In Russ.) https://doi.org/10.15829/1728-8800-2024-4257. EDN: FJXOAI
Введение
Генетически детерминированные кардиомиопатии (КМП) представляют собой группу заболеваний сердца, которые характеризуются патологией миокарда с его структурными и/или функциональными нарушениями и не могут быть обусловлены артериальной гипертензией, ишемической болезнью сердца, врожденными и приобретенными пороками. До настоящего момента традиционной остается классификация на основе фенотипа, согласно которой КМП подразделяют на гипертрофическую (ГКМП), дилатационную, рестриктивную, аритмогенную и некомпактную [1-4]. Однако с течением времени, благодаря широкому распространению визуализирующих методик (прежде всего, магнитно-резонансной томографии (МРТ) сердца с контрастированием) и молекулярно-генетической диагностики, классификация была существенно расширена, но также обнаружила свою недостаточность в связи с наличием фенотипического и генотипического "перекреста". Стало очевидным, что КМП со сходными клинико-морфологическими характеристиками являются генетически гетерогенными, тогда как варианты в различных генах могут быть связаны с разнообразными фенотипами наследственной патологии миокарда [3-6].
Необходимость создания оптимальной и практико-ориентированной классификации КМП привела к тому, что в последние годы было проведено множество исследований в данной сфере, которые были акцентированы, в первую очередь, на изучении роли генетического субстрата. Более глубокое понимание этиологии и патофизиологии первичных КМП позволило сделать вывод о том, что генотип обладает существенно большей прогностической ценностью по сравнению с фенотипом, поскольку выступает основой и определяет базовые механизмы развития заболевания сердца [1-4][6]. Установление генетической причины у каждого пациента обеспечивает более точную оценку течения болезни, в т.ч. вероятности развития таких осложнений как прогрессирующая сердечная недостаточность (СН), жизнеугрожающие нарушения ритма сердца (НРС) и внезапная сердечная смерть (ВСС) [4][6]. Наряду с этим, понимание молекулярной основы заболевания открывает перспективные возможности для разработки новых методов лечения КМП, что также усиливает персонализацию в ведении пациентов [2]. Помимо этого, рутинное генетическое тестирование может быть использовано для семейного скрининга, чтобы выявить пациентов на ранних стадиях, включая бессимптомную и преморфологическую, и улучшить прогноз заболевания [2-4][7]. В совокупности, полученные данные привели к смещению фокуса внимания с фенотипических особенностей в сторону генотипа как основы для современных классификаций КМП [3][4].
Одним из примеров подобного генотип-специфического подхода является нозологическое выделение КМП, ассоциированной с вариантами гена MYBPC3, которые наблюдаются приблизительно в половине случаев гипертрофического фенотипа и при других морфологических видах наследственной патологии миокарда [8-11].
Цель данной работы — описание роли гена MYBPC3 и кодируемого им сердечного миозин-связывающего белка С в функционировании кардиомиоцитов (КМЦ), а также механизмов патогенеза, особенностей клинического течения и прогноза, направлений терапии MYBPC3-КМП, развивающихся в настоящее время.
Методологические подходы
Проведен поиск актуальной информации за последние 5 лет в электронных базах данных eLibrary, PubMed по ключевым словам: "MYBPC3", "сердечный миозин-связывающий белок С", "гипертрофическая кардиомиопатия", "кардиомиопатия", "сердечная недостаточность", "внезапная сердечная смерть", "генная терапия". Поиск проводился по заголовкам, содержанию аннотаций, ключевым словам. Всего проанализировано 64 публикации. После тщательного отбора в качестве источников литературы выбрано 46 статей.
Результаты
Этиология и патогенез
В поперечно-полосатой мускулатуре имеет место экспрессия трех генов семейства MYBPC: первый из них — MYBPC1 — расположен на хромосоме 12q23.3 и кодирует медленную скелетную изоформу белка, второй — MYBPC2 — локализован на хромосоме 19q33.3 и кодирует быструю скелетную изоформу протеина и, наконец, третий ген — MYBPC3 — расположен на хромосоме 11p11.2 и отвечает за продукцию сердечного миозин-связывающего белка С (cMyBP-C), наблюдаемую исключительно в миокарде [8][12-18].
Впервые структура и последовательность гена MYBPC3 были описаны Carrier L, et al. в 1997г [12]. Кодируемый им протеин cMyBP-C содержит восемь иммуноглобулин-подобных и три фибронектин-подобных доменов и является одним из важнейших компонентов саркомера — основной сократительной единицы КМЦ [8][17]. cMyBP-C представляет собой гибкий стержнеобразный белок, расположенный поперечно в саркомерных А-дисках и связывающий между собой тяжелую цепь миозина в толстых филаментах, актин тонких филаментов и титин эластичных нитей, что способствует поддержанию структурной целостности саркомера, а также порядка и длины волокон [8][17-19]. Кроме того, считается, что протеин cMyBP-C играет решающую роль в регуляции взаимодействия между актином и миозином, а, соответственно, и в кинетике мышечного сокращения. Фосфорилирование белка cMyBP-C изменяет чувствительность филаментов к ионам кальция и приводит к ограничению подвижности головок миозина, следствием чего является уменьшение количества образующихся поперечных мостиков, снижение силы сокращения и улучшение расслабления [8][14][17-19].
В подавляющем большинстве случаев патогенные и вероятно-патогенные варианты саркомерных генов относятся к миссенс-вариантам, при которых белковый продукт синтезируется в полном объеме, однако его структура и функция изменены [9][18]. Иная ситуация имеет место с вариантами гена MYBPC3, среди которых преобладают нонсенс-варианты, варианты, приводящие к сдвигу рамки считывания, и варианты в сайтах сплайсинга, составляющие, по различным данным, от 60 до 91% [8][9][13][14][16][18][20]. В совокупности подобные варианты гена MYBPC3 приводят к возникновению стоп-кодона и преждевременной терминации синтеза протеина cMyBP-C. Вследствие этого образуются укороченные молекулы рибонуклеиновой кислоты, которые подвергаются быстрой деградации и на основе которых не происходит синтеза белка cMyBP-C [9][14][16]. В случае более частых гетерозиготных вариантов наблюдается аллельный дисбаланс, при котором имеется один нефункциональный аллель и второй полноценный аллель гена MYBPC3. Кроме того, отмечается гаплонедостаточность, поскольку экспрессия сохранного аллеля не позволяет поддерживать достаточный уровень протеина cMyBP-C в КМЦ [8-9][17][18]. В свою очередь, более редкие миссенс-варианты гена MYBPC3 приводят к неправильному сворачиванию субдоменов белка cMyBP-C, который может встраиваться в структуру саркомера и нарушать его функцию или подвергаться быстрому разрушению [8][13][20].
До настоящего времени механизмы, посредством которых недостаточный синтез протеина cMyBP-C вызывает сократительную дисфункцию саркомера, остаются не до конца изученными [8][14][18]. Согласно литературным данным последних лет, было обнаружено, что снижение уровня белка cMyBP-C в КМЦ приводит к нарушению конформационных изменений миозина, а именно повышению его аденозинтрифосфатазной (АТФ-азной) активности с увеличением количества поперечных мостиков, которые стойко сохраняются длительное время и не позволяют саркомеру перейти в состояние расслабления. Вследствие этого наблюдаются гиперконтрактильность, а также ухудшение релаксации КМЦ, лежащие в основе патогенеза MYBPC3-ассоциированной КМП [8][14][15][18]. Кроме того, недостаточный уровень протеина cMyBP-C в фибробластах миокарда приводит к повышению их активности с развитием выраженных и прогрессирующих фиброзных изменений сердечной мышцы [21].
Особенности клинического течения
Фенотипическая гетерогенность. Для КМП, связанной с вариантами гена MYBPC3, характерна выраженная фенотипическая гетерогенность, которая проявляется широким спектром клинических проявлений: от отсутствия структурной и функциональной патологии миокарда и малосимптомного фенотипа до тяжелой КМП с ранним дебютом, прогрессирующей СН, жизнеугрожающими НРС и ВСС [8][9][16][18][19][22-24]. Значительная вариабельность пенетрантности и экспрессивности заболевания наблюдается не только у пациентов с различными вариантами гена MYBPC3, но и у членов одной семьи, которые имеют один и тот же патогенный или вероятно-патогенный вариант [8][9]. Например, в систематическом обзоре ведущего американского эксперта по ГКМП Maron BJ, et al. (2022) был представлен клинический случай семьи с гипертрофическим фенотипом и вариантом гена MYBPC3: отец 62 лет имел апикальную аневризму левого желудочка (ЛЖ), в связи с чем в возрасте 58 лет ему был имплантирован кардиовертер-дефибриллятор (КВД); сын 37 лет перенес септальную миоэктомию в возрасте 33 лет по причине симптомной обструкции выносящего тракта ЛЖ (ВТЛЖ); старшей дочери 33 лет в связи с массивной гипертрофией миокарда (>30 мм) в возрасте 25 лет был имплантирован КВД с доставкой шоковой терапии в возрасте 31 года; младшая дочь 29 лет была клинически здорова (так называемый, генотип+/фенотип-) [23]. Помимо этого, в работе Rodríguez Junquera M, et al. (2022) были описаны три пары монозиготных близнецов, которые являлись носителями вариантов гена MYBPC3 и демонстрировали различную клиническую картину, в т.ч. в одной из пар первый близнец в возрасте 89 лет перенес септальную алкогольную аблацию в связи с тяжелой обструктивной формой ГКМП, тогда как второй брат 80 лет имел малосимптомный фенотип [8][25].
Принимая во внимание тот факт, что пациенты, имеющие идентичные варианты гена MYBPC3, отличаются значимой гетерогенностью клинико-морфологических проявлений, характеристики фенотипа, вероятно, обусловлены сложным взаимодействием различных детерминант. Несмотря на то, что вариант гена MYBPC3 является ключевым фактором и основой для развития КМП, на особенности течения и прогноза заболевания могут оказывать влияние иные аспекты, такие как генетический фон, в частности, наличие патогенных и вероятно-патогенных вариантов других генов, а также эпигенетические причины, факторы окружающей среды и неизвестные модификаторы [8][26].
Имеющиеся в настоящее время данные не позволяют полноценно объяснить столь высокую вариабельность фенотипа MYBPC3-ассоциированной КМП, что существенно затрудняет прогнозирование течения заболевания и персонализацию терапевтического подхода [8][9]. Ранее проведенные исследования с попытками установить более четкую корреляцию между генотипом и фенотипом были ограничены небольшими когортами пациентов и чрезмерной представленностью конкретных вариантов гена MYBPC3, в т.ч. уникальных [9][13]. В совокупности, это формирует потребность в проведении дальнейших исследований в данной области [8][9][13].
Модификаторы фенотипа. Несмотря на то, что в целом КМП, связанная с вариантами гена MYBPC3, имеет неблагоприятный клинический прогноз, вероятно, существуют различные факторы, которые определяют более тяжелое течение заболевания [8][9][24]. Прежде всего, к таковым маркерам фенотипа можно отнести возраст пациентов, поскольку варианты гена MYBPC3 ассоциированы с преимущественно поздним дебютом КМП [8][24]. В связи с этим особую важность приобретают ранние диагностика и терапевтические вмешательства для замедления прогрессирования заболевания и улучшения прогноза [18].
Иным модификатором фенотипа являются гендерные особенности MYBPC3-ассоциированной КМП. Согласно литературным данным, более высокая пенетрантность, ранняя манифестация симптоматики и неблагоприятные клинические исходы характерны для пациентов мужского пола [8]. В частности, Adalsteinsdottir B, et al. (2020) были опубликованы результаты обсервационного исследования, где изучалась когорта пациентов, состоящая из 60 пробандов и 225 родственников первой степени родства, которые имели один и тот же вариант гена MYBPC3. Было продемонстрировано, что КМП чаще дебютирует в молодом возрасте у мужчин, однако риск развития заболевания в течение жизни не зависит от пола, а для женщин были характерны более тяжелые проявления на момент постановки диагноза [8][27]. Аналогично, в работе Field E, et al. (2022) был проведен анализ данных 62 пациентов с ГКМП и вариантами гена MYBPC3, показавший, что более ранняя манифестация и худшие клинические исходы заболевания наблюдались у пациентов мужского пола [8][28].
До настоящего момента единого мнения о том, насколько тип варианта гена MYBPC3 влияет на клинико-морфологические проявления КМП, не существует [9][13]. С одной стороны, имеются отдельные сообщения, свидетельствующие о более неблагоприятном прогнозе при наличии нонсенс-варианта гена по сравнению с миссенс-вариантами [8]. Напротив, в работах других исследователей подчеркивается, что миссенс-варианты гена MYBPC3 также могут приводить к тяжелому течению заболевания с высокой частотой осложнений. В частности, это отражено в результатах международного исследования Thompson AD, et al. (2021), в которое были включены 120 пациентов с ГКМП и миссенс-вариантами гена MYBPC3 [8][20]. Кроме того, значимую роль в развитии фенотипа играет степень недостаточности белка cMyBP-C в КМЦ. К настоящему времени имеются наблюдения, которые демонстрируют, что пациенты со сложными гетерозиготными или гомозиготными вариантами гена MYBPC3, как правило, отличаются более ранним дебютом заболевания, его прогрессирующим течением и высокими показателями смертности [8][16].
Перспективным направлением исследований также является поиск новых модификаторов фенотипа, в т.ч. биохимических маркеров. В последние годы были получены данные о том, что у пациентов с MYBPC3-ассоциированной КМП изменяется множество обменных процессов, в частности, метаболизм жирных кислот и стероидных гормонов, реакции протеолиза, что приводит к повышению в крови уровня таких биомаркеров как ацилкарнитины, гистидин, лизин и пурин [8][29]. В недавно опубликованной работе Jansen M, et al. (2023) были обнаружены восемь циркулирующих ацилкарнитинов, уровень которых напрямую коррелировал с тяжестью течения ГКМП, связанной с идентичным вариантом гена MYBPC3 [22]. В совокупности, выявленные биомаркеры кажутся многообещающими детерминантами фенотипа и стратификации риска, однако для определения их прогностической ценности необходимы дальнейшие исследования [8][22][29].
Морфологические проявления. Преимущественным морфологическим выражением патогенных и вероятно-патогенных вариантов гена MYBPC3 является ГКМП. При этом в случае данного фенотипа варианты гена MYBPC3 наблюдаются приблизительно в 50% случаев, выступая основным этиологическим фактором [8-11][13-16][18][23][24][26][30-33]. Впервые вариант гена MYBPC3 был описан при ГКМП Watkins H, et al. в 1995г [19][34]. Однако, учитывая гетерогенность проявлений, в последующем идентичные варианты гена MYBPC3 были верифицированы и при других кардиальных фенотипах. Согласно различным данным, варианты гена MYBPC3 обнаруживаются при дилатационной КМП с частотой от <1 до 2% случаев, тогда как преобладающими при данном виде ремоделирования являются варианты гена TTN, кодирующего белок титин (15-20% случаев), а также варианты генов LMNA (кодирует протеин преламин А), MYH7 и MYH6 (кодируют β- и α-изоформы тяжелой цепи миозина, соответственно), FLNC (кодирует белок филамин С) (в среднем 4-6% случаев) [7][35]. Тем не менее, в 2015г Haas J, et al. были опубликованы результаты многоцентрового исследования, в котором изучалась когорта из 639 пациентов с дилатационным фенотипом, при этом варианты гена MYBPC3 были вторыми по частоте среди всех генетических причин [8]. Кроме того, нельзя исключить, что дилатационный паттерн может являться не только независимым видом ремоделирования при вариантах гена MYBPC3, но и выступать как этап клинического континуума заболевания, при котором первично развивается гипертрофия миокарда, а затем, вследствие гибели КМЦ и заместительного фиброза, сердце становится гипокинетическим и далее дилатированным. Помимо этого, с меньшей вероятностью варианты гена MYBPC3 могут наблюдаться при рестриктивной КМП, а также синдроме некомпактного миокарда ЛЖ, характеризующегося значимой генетической гетерогенностью (варианты генов MYH7, ACTC1 (кодирует белок α-актин), TNNT2 (кодирует тропонин Т), MYBPC3, TPM1 (кодирует α-1-цепь белка тропомиозина) и TNNI3 (кодирует тропонин I) в совокупности составляют >20% случаев) [7][8][19][35][36].
Наряду с этим, для вариантов гена MYBPC3 может быть характерно наличие дефектов межпредсердной и межжелудочковой перегородок (МЖП), тогда как клапанная патология менее типична по сравнению с вариантами гена MYH7, второго по частоте этиологического фактора ГКМП (~33% случаев) [8][11][15][18][23][26][30-33]. Данные различия были продемонстрированы Velicki L, et al. (2020) в сравнительном исследовании, где участвовали 63 пациента с ГКМП (48 — с вариантами гена MYBPC3 и 15 — с вариантами гена MYH7): в случаях вариантов гена MYBPC3 отмечались менее высокая пенетрантность, тяжесть течения заболевания и более поздний возраст постановки диагноза, а также меньшая частота аномалий митрального клапана (19 vs 40%) и передне-систолического движения митральных створок (10 vs 33%) [8][32].
Традиционно считается, что характеристики гипертрофии миокарда при вариантах генов MYBPC3 и MYH7 крайне схожи [30][37]. Тем не менее, на основе литературных данных последних лет можно выделить некоторые различия в морфологическом паттерне, что представляет ценную диагностическую информацию и способствует более персонализированному ведению пациентов с ГКМП [37]. В подавляющем большинстве случаев для вариантов гена MYBPC3 характерна менее выраженная гипертрофия миокарда [8]. В исследовании Zhou N, et al. (2023) были проанализированы данные эхокардиографии (ЭхоКГ) и молекулярно-генетические тесты в 392 семьях, страдающих ГКМП (85 пациентов с вариантами гена MYBPC3 и 52 пациента с вариантами гена MYH7). Полученные результаты свидетельствуют о том, что для вариантов в обоих генах типична асимметричная гипертрофия миокарда МЖП, передней и боковой стенок ЛЖ, однако варианты гена MYBPC3 были ассоциированы с преимущественным утолщением средней части МЖП и более выраженной гипертрофией передней стенки ЛЖ. Кроме того, при вариантах гена MYBPC3 была зарегистрирована значимо меньшая частота обструкции ВТЛЖ (23,53 vs 48,08%) [30][37] (рисунок 1).
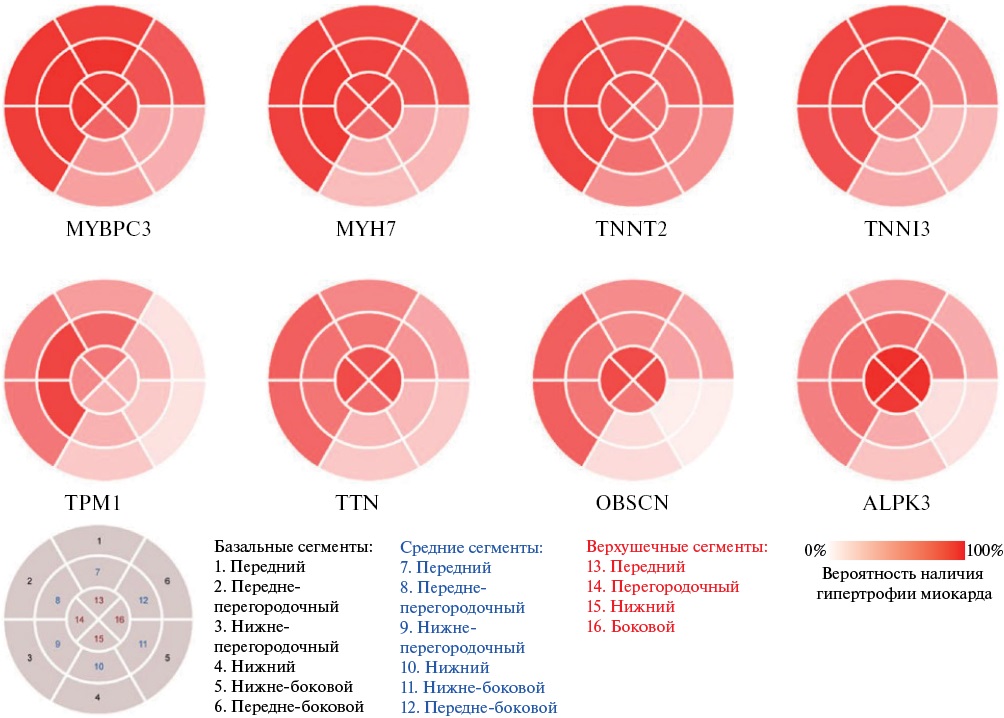
Рис. 1 Паттерн гипертрофии миокарда по данным ЭхоКГ в зависимости от генетического субстрата КМП. Адаптировано из работы Zhou N, et al. (2023) [37].
Примечание: КМП — кардиомиопатия, ЭхоКГ — эхокардиография.
В связи с особенностями патогенеза, для КМП, связанной с вариантами гена MYBPC3, характерно наличие выраженных фиброзных изменений миокарда [8][38]. De Frutos F, et al. (2023) были опубликованы результаты многоцентрового исследования по оценке МРТ сердца с контрастированием 577 пациентов с дилатационной КМП (11 пациентов с вариантами гена MYBPC3 и 15 пациентов с вариантами гена MYH7). При анализе были получены данные, показавшие, что позднее накопление гадолиния (ПНГ) при вариантах гена MYBPC3 отмечалось в 45,5% случаев и проявлялось неспецифическим паттерном контрастирования: 18,2% пациентов имели линейное срединное накопление, 18,2% — вовлечение правого желудочка и 9,1% — субэпикардиальное контрастирование. Напротив, при вариантах гена MYH7 ПНГ фиксировалось значительно реже (в 20% случаев) [39] (рисунок 2).

Рис. 2 Паттерн ПНГ в миокарде по данным МРТ сердца с контрастированием в зависимости от генетического субстрата КМП. Адаптировано из работы De Frutos F, et al. (2023) [39].
Примечание: КМП — кардиомиопатия, МРТ — магнитно-резонансная томография, ПНГ — позднее накопление гадолиния.
Иные особенности течения. Наблюдаемый прогрессирующий фиброз миокарда является морфологическим субстратом для развития систолической дисфункции ЛЖ и клиники СН при патогенных и вероятно-патогенных вариантах гена MYBPC3 [8][17][37]. Так, в ранее упомянутой работе Velicki L, et al. (2020) среди пациентов с вариантами гена MYBPC3 наиболее распространенным симптомом являлась одышка (44% случаев), тогда как у пациентов с вариантами гена MYH7 — сердцебиение (33% случаев) [32]. Помимо этого, в систематическом обзоре Beltrami M, et al. (2023) были проанализированы в динамике результаты ЭхоКГ 402 пациентов с ГКМП (251 — с вариантами гена MYBPC3 и 151 — с вариантами гена MYH7). Получены данные о том, что первично пациенты с вариантами гена MYBPC3 имели более низкую фракцию выброса (ФВ) ЛЖ по сравнению с вариантами гена MYH7 (66±8 vs 68±8%). Кроме того, вероятность развития систолической дисфункции с течением времени также была значительно выше в группе вариантов гена MYBPC3 (15 vs 5%). Таким образом, варианты гена MYBPC3 выступали как независимый предиктор снижения ФВ ЛЖ наравне с фибрилляцией предсердий и возрастом [30]. Аналогично, Miller RJH, et al. (2019) были опубликованы результаты исследования по оценке МРТ сердца с контрастированием 273 пациентов с ГКМП. При этом пациенты с вариантами гена MYBPC3 чаще имели систолическую дисфункцию в сравнении с вариантами гена MYH7, что подчеркивает различия в патофизиологии прогрессирования заболевания в данных группах [8][30][38].
Относительно выраженности диастолической дисфункции ЛЖ при вариантах гена MYBPC3 до настоящего времени единого мнения не существует. Ухудшение релаксации КМЦ и выраженный фиброз миокарда, лежащие в основе патогенеза, бесспорно, могут приводить к нарушению расслабления ЛЖ [8][14][15][18][21]. В ранее указанной работе Beltrami M, et al. (2023) распространенность диастолической дисфункции II/III ст. была сопоставима у пациентов с вариантами генов MYBPC3 и MYH7 [30]. Напротив, Velicki L, et al. (2020) была описана разница в соотношении E/e' (отношение ранней диастолической скорости потока митрального клапана к средней ранней диастолической скорости движения митрального кольца) между группами вариантов в генах MYBPC3 и MYH7 (8,8±3,3 и 13,9±6,9, соответственно) [32]. Исходя из этого, существует необходимость в дальнейшем изучении данного аспекта в будущих исследованиях.
Помимо прочего, прогрессирующие фиброзные изменения при MYBPC3-ассоциированной КМП являются основой для электрической нестабильности миокарда и часто приводят к развитию НРС, в т.ч. потенциально жизнеугрожающих желудочковых аритмий. Множество научных публикаций последних лет свидетельствуют о том, что варианты гена MYBPC3 связаны с более высоким риском ВСС по сравнению с вариантами в других саркомерных генах, а также данные пациенты значимо чаще подвергаются имплантации КВД [8][17][38-40]. В частности, это было продемонстрировано в исследовании Robyns T, et al. (2020), где участвовали 378 неродственных пациентов с ГКМП (80 пациентов с вариантами гена MYBPC3, 27 пациентов с вариантами гена MYH7 и 24 пациента с вариантами генов тропонинового комплекса): у носителей вариантов гена MYBPC3 чаще наблюдались желудочковые НРС и ВСС [8][41]. Полученные данные позволяют сделать вывод о том, что выявление патогенного или вероятно-патогенного варианта гена MYBPC3 играет существенную роль в стратификации риска, определении прогноза и выборе индивидуального подхода к тактике ведения пациентов, в т.ч. профилактике ВСС [4][8][39]. Иная ситуация обстоит с суправентрикулярными аритмиями. Так, например, в ранее описанной работе Velicki L, et al. (2020) было обнаружено, что частота возникновения фибрилляции предсердий у пациентов с вариантами гена MYBPC3 значительно ниже, чем при вариантах гена MYH7 (35 vs 60%) [8][32].
Перспективные стратегии лечения
В последние годы большое количество научных исследований было посвящено разработке высокоэффективных методик терапии КМП, которые позволили бы модифицировать клиническое течение и прогноз заболевания на этиопатогенетическом уровне. В первую очередь это относится к изучению возможностей специфической генной терапии. В частности, в 2023г биотехнологической компанией Tenaya Therapeutics (Сан-Франциско, США) было инициировано первое в мире нерандомизированное открытое исследование по изучению безопасности и эффективности заместительной генной терапии при MYBPC3-ассоциированной ГКМП (MyPEAK-1)1. В качестве лекарственного препарата всем пациентам будет проводиться однократная внутривенная инфузия TN-201 — рекомбинантного аденоассоциированного вируса серотипа 9 (AAV9), который содержит функциональную копию гена MYBPC3 и обладает тропностью к сердечной ткани. Пациенты будут разделены на две когорты в зависимости от дозы препарата: 3E13 вг (векторных геномов)/кг или 6E13 вг/кг. Среди критериев включения в исследование, помимо наличия варианта гена MYBPC3, были определены необструктивная форма ГКМП, II/III функциональный класс по классификации Нью-Йоркской ассоциации сердца (NYHA — New York Heart Association), ФВ ЛЖ ≥50%, уровень NT-proBNP (N-концевого промозгового натрийуретического пептида) ≥300 пг/мл, возраст 18-65 лет, наличие имплантированного КВД и титр нейтрализующих антител к AAV9 <10. В качестве первичных конечных точек после 5 лет наблюдения планируется оценка общего количества и тяжести нежелательных явлений, а также количества серьезных неблагоприятных реакций, связанных с исследуемым препаратом. Вторичной конечной точкой выбрано изменение балла по Канзасскому опроснику для больных КМП (KCCQ-CSS) к 52-й неделе наблюдения. Кроме того, запланирован анализ иных конечных точек, таких как уровень экспрессии векторного генома, рибонуклеиновой кислоты и белка cMyBP-C в образцах биопсии МЖП, динамика уровня NT-proBNP и тропонина I, процент пациентов с изменением функционального класса и динамика выраженности гипертрофии миокарда и диастолической дисфункции по данным ЭхоКГ. Первый пациент получил инфузию препарата в октябре 2023г, а в настоящее время продолжается набор пациентов для участия в исследовании. В ноябре 2024г на конгрессе Американской Ассоциации Сердца (AHA — American Heart Association) ожидается представление первичных результатов исследования [17][23].
Помимо технологии внедрения функциональной копии гена в организм, существует иное направление генной терапии — редактирование генома при помощи системы CRISPR-Cas9 (Clustered Regularly Interspaced Short Palindromic Repeats (CRISPR)-CRISPR associated protein 9). К настоящему моменту указанная методика была испытана на мышах и нечеловекообразных приматах, в результате чего получены доклинические данные, свидетельствующие об эффективности и значимом потенциале технологии в лечении наследственных заболеваний сердца [17]. Nie J, et al. (2023) опубликовали результаты исследования, в рамках которого была создана крысиная модель с ГКМП и вариантом гена MYBPC3. На третий день после рождения части крысят была введена система CRISPR-Cas9 с помощью вирусного вектора AAV9. При анализе через полгода отмечалось, что коррекция генома привела к восстановлению уровня белка cMyBP-C в КМЦ и сохранению нормального фенотипа по сравнению с крысятами, не подверженными указанному вмешательству [10].
Наравне с этиотропным аспектом терапии, в последние годы активно развивается направление патогенетического лечения КМП. В работе Helms AS, et al. (2020) было показано, что КМЦ, имеющие гетерозиготный вариант гена MYBPC3, обладают способностью замедлять скорость деградации протеина cMyBP-C, поддерживая его более высокий уровень, несмотря на аллельный дисбаланс и гаплонедостаточность. Таким образом, модуляция деградации белка cMyBP-C и экспрессии гена MYBPC3 могут являться перспективными подходами к лечению MYBPC3-ассоциированной КМП [9][14]. Кроме того, на данный момент в мире зарегистрирован препарат MYK-461 (мавакамтен), являющийся ингибитором миозиновой АТФ-азы. Его действие направлено на уменьшение количества поперечных мостиков, что сопряжено со снижением сократимости саркомера и улучшением релаксации КМЦ. Согласно опубликованным результатам исследований EXPLORER-HCM (Clinical Study to Evaluate Mavacamten (MYK-461) in Adults With Symptomatic Obstructive Hypertrophic Cardiomyopathy) и VALOR-HCM (Study to Evaluate Mavacamten in Adults With Symptomatic Obstructive HCM Who Are Eligible for Septal Reduction Therapy), препарат достоверно уменьшал массу миокарда, выраженность обструкции ВТЛЖ и повышал толерантность к физической нагрузке у пациентов с ГКМП [7][8][18][42-45]. Другой ингибитор миозиновой АТФ-азной активности — CK-274 (афикамтен) — в настоящее время проходит клинические испытания. Однако, по результатам исследования второй фазы REDWOOD-HCM (Dose-finding Study to Evaluate the Safety, Tolerability, PK, and PD of CK-3773274 in Adults With HCM) препарат также был эффективен и безопасен у пациентов с ГКМП независимо от наличия обструкции ВТЛЖ [7][45][46]. Полученные данные легли в основу исследования третьей фазы ACACIA-HCM (Aficamten Compared To Placebo In Adults With Symptomatic Non-Obstructive Hypertrophic Cardiomyopathy), первые результаты которого ожидаются летом 2026г2.
В совокупности, внедрение описанных методов терапии может позволить персонализировать тактику ведения пациентов, уменьшая и даже полностью редуцируя проявления ГКМП. В то же время, развитие указанных направлений лечения даст возможность снизить заболеваемость у носителей вариантов гена MYBPC3 на ранних стадиях, предотвращая прогрессирование болезни. Таким образом, данные методы воздействия на этиопатогенез КМП, связанной с вариантами гена MYBPC3, выступают как многообещающие стратегии терапии прежде неизлечимого заболевания сердца и являются основой для будущих исследований [8][9][17][18][23].
Заключение
Выделение MYBPC3-ассоциированной КМП как отдельной нозологической единицы является одним из примеров генотип-специфического подхода к классификации наследственной патологии миокарда. Акцентирование внимания на этиологии первичных КМП в перспективе будет способствовать лучшему пониманию патофизиологии развития болезни, а, следовательно, позволит персонализировать стратификацию риска и выбор тактики ведения пациентов, особенно в эпоху прогрессивно развивающейся генной терапии наследственных КМП.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. Study of Safety and Tolerability of TN-201 in Adults With Symptomatic MYBPC3 Mutation-associated HCM (MyPEAK-1). https://clinicaltrials.gov/study/NCT05836259?cond=Hypertrophic%20Cardiomyopathy&intr=TN-201&rank=1 (29.10.2024).
2. Phase 3 Trial to Evaluate the Efficacy and Safety of Aficamten Compared to Placebo in Adults With Symptomatic nHCM (ACACIA-HCM). https://clinicaltrials.gov/study/NCT06081894 (29.10.2024).
Список литературы
1. Miles C, Fanton Z, Tome M, et al. Inherited cardiomyopathies. BMJ. 2019;365:l1570. doi:10.1136/bmj.l1570.
2. Hassoun R, Budde H, Mügge A, et al. Cardiomyocyte Dysfunction in Inherited Cardiomyopathies. Int J Mol Sci. 2021;22(20):11154. doi:10.3390/ijms222011154.
3. Wang Y, Jia H, Song J. Accurate Classification of Non-ischemic Cardiomyopathy. Curr Cardiol Rep. 2023;25(10):1299-317. doi:10.1007/s11886-023-01944-0.
4. Мясников Р. П., Кузина Н. Н., Нефедова Д. А. и др. Десмоплакин и особенности течения десмоплакиновой кардиомиопатии. Российский кардиологический журнал. 2023;28(11):5648. doi:10.15829/1560-4071-2023-5648.
5. McKenna WJ, Judge DP. Epidemiology of the inherited cardiomyopathies. Nat Rev Cardiol. 2021;18(1):22-36. doi:10.1038/s41569-020-0428-2.
6. Paldino A, Dal Ferro M, Stolfo D, et al. Prognostic Prediction of Genotype vs Phenotype in Genetic Cardiomyopathies. J Am Coll Cardiol. 2022;80(21):1981-94. doi:10.1016/j.jacc.2022.08.804.
7. Arbelo E, Protonotarios A, Gimeno JR, et al. 2023 ESC Guidelines for the management of cardiomyopathies. Eur Heart J. 2023; 44(37):3503-626. doi:10.1093/eurheartj/ehad194.
8. Tudurachi BS, Zăvoi A, Leonte A, et al. An Update on MYBPC3 Gene Mutation in Hypertrophic Cardiomyopathy. Int J Mol Sci. 2023;24(13):10510. doi:10.3390/ijms241310510.
9. Glazier AA, Thompson A, Day SM. Allelic imbalance and haploinsufficiency in MYBPC3-linked hypertrophic cardiomyopathy. Pflugers Arch. 2019;471(5):781-93. doi:10.1007/s00424-018-2226-9.
10. Nie J, Han Y, Jin Z, et al. Homology-directed repair of an MYBPC3 gene mutation in a rat model of hypertrophic cardiomyopathy. Gene Ther. 2023;30(6):520-7. doi:10.1038/s41434-023-00384-3.
11. Ingles J, Goldstein J, Thaxton C, et al. Evaluating the Clinical Validity of Hypertrophic Cardiomyopathy Genes. Circ Genom Precis Med. 2019;12(2):e002460. doi:10.1161/CIRCGEN.119.002460.
12. Carrier L, Bonne G, Bährend E, et al. Organization and sequence of human cardiac myosin binding protein C gene (MYBPC3) and identification of mutations predicted to produce truncated proteins in familial hypertrophic cardiomyopathy. Circ Res. 1997;80(3):427-34. doi:10.1161/01.res.0000435859.24609.b3.
13. Helms AS, Thompson AD, Glazier AA, et al. Spatial and Functional Distribution of MYBPC3 Pathogenic Variants and Clinical Outcomes in Patients With Hypertrophic Cardiomyopathy. Circ Genom Precis Med. 2020;13(5):396-405. doi:10.1161/CIRCGEN.120.002929.
14. Helms AS, Tang VT, O'Leary TS, et al. Effects of MYBPC3 loss-offunction mutations preceding hypertrophic cardiomyopathy. JCI Insight. 2020;5(2):e133782. doi:10.1172/jci.insight.133782.
15. Marian AJ. Molecular Genetic Basis of Hypertrophic Cardiomyopathy. Circ Res. 2021;128(10):1533-53. doi:10.1161/CIRCRESAHA.121.318346.
16. Carrier L. Targeting the population for gene therapy with MYBPC3. J Mol Cell Cardiol. 2021;150:101-8. doi:10.1016/j.yjmcc.2020. 10.003.
17. Sheridan C. Genetic medicines aim straight for the heart. Nat Biotechnol. 2023;41(4):435-7. doi:10.1038/s41587-023-01745-4.
18. Toepfer CN, Wakimoto H, Garfinkel AC, et al. Hypertrophic cardiomyopathy mutations in MYBPC3 dysregulate myosin. Sci Transl Med. 2019;11(476):eaat1199. doi:10.1126/scitranslmed.aat1199.
19. Мясников Р. П., Куликова О. В., Мешков А. Н. и др. Сочетание некомпактного миокарда левого желудочка и гипертрофической кардиомиопатии в одной семье с патогенным вариантом нуклеотидной последовательности в гене MYBPC3 (rs397516037). Российский кардиологический журнал. 2020;25(10):4115. doi:10.15829/1560-4071-2020-4115.
20. Thompson AD, Helms AS, Kannan A, et al. Computational prediction of protein subdomain stability in MYBPC3 enables clinical risk stratification in hypertrophic cardiomyopathy and enhances variant interpretation. Genet Med. 2021;23(7):1281-7. doi:10.1038/s41436-021-01134-9.
21. Zou X, Ouyang H, Lin F, et al. MYBPC3 deficiency in cardiac fibroblasts drives their activation and contributes to fibrosis. Cell Death Dis. 2022;13(11):948. doi:10.1038/s41419-022-05403-6.
22. Jansen M, Schmidt AF, Jans JJM, et al. Circulating Acylcarnitines Associated with Hypertrophic Cardiomyopathy Severity: an Exploratory Cross-Sectional Study in MYBPC3 Founder Variant Carriers. J Cardiovasc Transl Res. 2023;16(6):1267-75. doi:10.1007/s12265-023-10398-2.
23. Maron BJ, Desai MY, Nishimura RA, et al. Diagnosis and Evaluation of Hypertrophic Cardiomyopathy: JACC State-of-theArt Review. J Am Coll Cardiol. 2022;79(4):372-89. doi:10.1016/j.jacc.2021.12.002.
24. Ananthamohan K, Stelzer JE, Sadayappan S. Hypertrophic cardiomyopathy in MYBPC3 carriers in aging. J Cardiovasc Aging. 2024;4(1):9. doi:10.20517/jca.2023.29.
25. Rodríguez Junquera M, Salgado M, González-Urbistondo F, et al. Different Phenotypes in Monozygotic Twins, Carriers of the Same Pathogenic Variant for Hypertrophic Cardiomyopathy. Life (Basel). 2022;12(9):1346. doi:10.3390/life12091346.
26. Gao J, Collyer J, Wang M, et al. Genetic Dissection of Hypertrophic Cardiomyopathy with Myocardial RNA-Seq. Int J Mol Sci. 2020;21(9):3040. doi:10.3390/ijms21093040.
27. Adalsteinsdottir B, Burke M, Maron BJ, et al. Hypertrophic cardiomyopathy in myosin-binding protein C (MYBPC3) Icelandic founder mutation carriers. Open Heart. 2020;7(1):e001220. doi:10.1136/openhrt-2019-001220.
28. Field E, Norrish G, Acquaah V, et al. Cardiac myosin binding protein-C variants in paediatric-onset hypertrophic cardiomyopathy: natural history and clinical outcomes. J Med Genet. 2022;59(8):768-75. doi:10.1136/jmedgenet-2021-107774.
29. Jansen M, Schuldt M, van Driel BO, et al. Untargeted Metabolomics Identifies Potential Hypertrophic Cardiomyopathy Biomarkers in Carriers of MYBPC3 Founder Variants. Int J Mol Sci. 2023;24(4):4031. doi:10.3390/ijms24044031.
30. Beltrami M, Fedele E, Fumagalli C, et al. Long-Term Prevalence of Systolic Dysfunction in MYBPC3 Versus MYH7Related Hypertrophic Cardiomyopathy. Circ Genom Precis Med. 2023; 16(4):363-71. doi:10.1161/CIRCGEN.122.003832.
31. Park J, Packard EA, Levin MG, et al. A genome-first approach to rare variants in hypertrophic cardiomyopathy genes MYBPC3 and MYH7 in a medical biobank. Hum Mol Genet. 2022;31(5):827-37. doi:10.1093/hmg/ddab249.
32. Velicki L, Jakovljevic DG, Preveden A, et al. Genetic determinants of clinical phenotype in hypertrophic cardiomyopathy. BMC Cardiovasc Disord. 2020;20(1):516. doi:10.1186/s12872-020-01807-4.
33. Бурнашева Г. А., Мясников Р. П., Куликова О. В. и др. Прогностическая ценность морфологических, биохимических, молекулярногенетических маркеров фиброза у пациентов с гипертрофической кардиомиопатией. Кардиоваскулярная терапия и профилактика. 2023;22(12):3839. doi:10.15829/1728-8800-2023-3839.
34. Watkins H, Conner D, Thierfelder L, et al. Mutations in the cardiac myosin binding protein-C gene on chromosome 11 cause familial hypertrophic cardiomyopathy. Nat Genet. 1995;11(4):434-7. doi:10.1038/ng1295-434.
35. Jordan E, Peterson L, Ai T, et al. Evidence-Based Assessment of Genes in Dilated Cardiomyopathy. Circulation. 2021;144(1):7-19. doi:10.1161/CIRCULATIONAHA.120.053033.
36. Park J, Lee JM, Cho JS. Phenotypic Diversity of Cardiomyopathy Caused by an MYBPC3 Frameshift Mutation in a Korean Family: A Case Report. Medicina (Kaunas). 2021;57(3):281. doi:10.3390/medicina57030281.
37. Zhou N, Weng H, Zhao W, et al. Gene-echocardiography: refining genotype-phenotype correlations in hypertrophic cardiomyopathy. Eur Heart J Cardiovasc Imaging. 2023;25(1):127-35. doi:10.1093/ehjci/jead200.
38. Miller RJH, Heidary S, Pavlovic A, et al. Defining genotype-phenotype relationships in patients with hypertrophic cardiomyopathy using cardiovascular magnetic resonance imaging. PLoS One. 2019;14(6):e0217612. doi:10.1371/journal.pone.0217612.
39. De Frutos F, Ochoa JP, Fernández AI, et al. Late gadolinium enhancement distribution patterns in non-ischaemic dilated cardiomyopathy: genotype-phenotype correlation. Eur Heart J Cardiovasc Imaging. 2023;25(1):75-85. doi:10.1093/ehjci/jead184.
40. Mori AA, Castro LR, Bortolin RH, et al. Association of variants in MYH7, MYBPC3 and TNNT2 with sudden cardiac death-related risk factors in Brazilian patients with hypertrophic cardiomyopathy. Forensic Sci Int Genet. 2021;52:102478. doi:10.1016/j.fsigen.2021.102478.
41. Robyns T, Breckpot J, Nuyens D, et al. Clinical and ECG variables to predict the outcome of genetic testing in hypertrophic cardiomyopathy. Eur J Med Genet. 2020;63(3):103754. doi:10.1016/j.ejmg.2019.103754.
42. Olivotto I, Oreziak A, Barriales-Villa R, et al. Mavacamten for treatment of symptomatic obstructive hypertrophic cardiomyopathy (EXPLORER-HCM): a randomised, double-blind, placebocontrolled, phase 3 trial. Lancet. 2020;396(10253):759-69. doi:10.1016/S0140-6736(20)31792-X.
43. Desai MY, Owens A, Wolski K, et al. Mavacamten in Patients With Hypertrophic Cardiomyopathy Referred for Septal Reduction: Week 56 Results From the VALOR-HCM Randomized Clinical Trial. JAMA Cardiol. 2023;8(10):968-77. doi:10.1001/jamacardio.2023.3342.
44. Pioner JM, Vitale G, Steczina S, et al. Slower Calcium Handling Balances Faster Cross-Bridge Cycling in Human MYBPC3 HCM. Circ Res. 2023;132(5):628-44. doi:10.1161/CIRCRESAHA.122.321956.
45. Ommen SR, Ho CY, Asif IM, et al. 2024 AHA/ACC/AMSSM/HRS/ PACES/SCMR Guideline for the Management of Hypertrophic Cardiomyopathy: A Report of the American Heart Association/ American College of Cardiology Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 2024;83(23):2324-405. doi:10.1016/j.jacc.2024.02.014.
46. Masri A, Sherrid MV, Abraham TP, et al. Efficacy and Safety of Aficamten in Symptomatic Nonobstructive Hypertrophic Cardiomyopathy: Results From the REDWOOD-HCM Trial, Cohort 4. J Card Fail. 2024:S1071-9164(24)00082-4. doi:10.1016/j.cardfail.2024.02.020.
Об авторах
Д. А. НефедоваРоссия
Дарья Антоновна Нефедова — лаборант-исследователь лаборатории персонализированной диагностики, профилактики и терапии некоронарогенных заболеваний сердца Института персонализированной терапии и профилактики, отдела клинической кардиологии.
Москва
Р. П. Мясников
Россия
Роман Петрович Мясников — к.м.н., руководитель лаборатории персонализированной диагностики, профилактики и терапии некоронарогенных заболеваний сердца Института персонализированной терапии и профилактики, в.н.с. отдела клинической кардиологии.
Москва
О. В. Куликова
Россия
Ольга Викторовна Куликова — к.м.н., с.н.с. лаборатории персонализированной диагностики, профилактики и терапии некоронарогенных заболеваний сердца Института персонализированной терапии и профилактики, отдела клинической кардиологии.
Москва
О. М. Драпкина
Россия
Оксана Михайловна Драпкина — д.м.н., профессор, директор, академик РАН.
Москва
Дополнительные файлы
Что известно о предмете исследования?
- Патогенные и вероятно-патогенные варианты гена MYBPC3 выступают основной причиной гипертрофической кардиомиопатии (КМП) (~50% случаев), а также могут лежать в основе развития других кардиальных фенотипов.
- Выделение MYBPC3-ассоциированной КМП как отдельной нозологической единицы является одним из примеров современного генотип-специфического подхода к классификации наследственной патологии миокарда. Однако до настоящего момента аспекты ведения таких пациентов остаются неоднозначными.
Что добавляют результаты исследования?
- В статье представлен обзор актуальных литературных данных об этиологии и патогенезе, особенностях клинического течения и перспективных стратегиях лечения MYBPC3-ассоциированной КМП.
- Подчеркнута необходимость применения персонализированного генотип-специфического подхода к стратификации риска, определению прогноза и выбору тактики ведения пациентов с MYBPC3-ассоциированной КМП, особенно учитывая развивающееся направление генной терапии заболевания.
Рецензия
Для цитирования:
Нефедова Д.А., Мясников Р.П., Куликова О.В., Драпкина О.М. MYBPC3-ассоциированная кардиомиопатия: особенности течения и перспективы специфической терапии. Кардиоваскулярная терапия и профилактика. 2024;23(12):4257. https://doi.org/10.15829/1728-8800-2024-4257. EDN: FJXOAI
For citation:
Nefedova D.A., Myasnikov R.P., Kulikova O.V., Drapkina O.M. MYBPC3-associated cardiomyopathy: features of the course and prospects for specific therapy. Cardiovascular Therapy and Prevention. 2024;23(12):4257. (In Russ.) https://doi.org/10.15829/1728-8800-2024-4257. EDN: FJXOAI
JATS XML

























































