Перейти к:
Фенотипы сосудистого старения в российской популяции — биологические и социально-поведенческие детерминанты
https://doi.org/10.15829/1728-8800-2021-2970
Аннотация
Цель. Оценить ассоциацию факторов сердечно-сосудистого риска с различными фенотипами сосудистого старения на примере популяционной выборки жителей Санкт-Петербурга в рамках исследования ЭССЕ-РФ (Эпидемиология сердечно-сосудистых заболеваний и их факторов риска в регионах Российской Федерации).
Материал и методы. Обследование популяционной выборки из 1600 жителей Санкт-Петербурга выполнено в рамках многоцентрового наблюдательного исследования ЭССЕ-РФ. Участниками был заполнен вопросник с оценкой факторов риска, выполнено определение биохимических показателей сыворотки крови, проведены антропометрия, измерение артериального давления. Оценка скорости распространения пульсовой волны (СРПВ) методом аппланационной тонометрии на аппарате SphygmoCor (AtCor, Австралия) выполнена у 524 человек, для анализа были отобраны 485 участников без сердечно-сосудистых осложнений в анамнезе. Значение СРПВ ≤10 перцентиля СРПВ для здоровых лиц в каждой возрастной группе было условно принято критерием наличия феномена супернормального сосудистого старения (SUPERNOVA), значение СРПВ ≥90 перцентиля — феномена преждевременного сосудистого старения (EVA), значение СРПВ от 10 до 90 перцентиля — феномена нормального сосудистого старения (NVA).
Результаты. Распространенность феномена SUPERNOVA составила 9,7%, фенотипа EVA — 18,8%, NVA — 71,5%. У пациентов с сосудистым фенотипом EVA чаще регистрировалась артериальная гипертензия (60,4%) в сравнении с респондентами с фенотипом SUPERNOVA (17%) и реже высокая физическая нагрузка — 39,6 vs 53,2%. У участников с феноменом SUPERNOVA значимо реже регистрировались ожирение, гипергликемия, инсулинорезистентность, гиперхолестеринемия, дислипопротеинемия и распространенность чрезмерного потребления алкоголя по сравнению с группой c фенотипом EVA.
Заключение. Помимо артериальной гипертензии и дислипопротеинемии значимым предиктором преждевременного старения было совокупное влияние ожирения, сопровождающееся нарушением углеводного обмена с инсулинорезистентностью и гипертриглицеридемией. Среди поведенческих факторов риска более выраженная физическая активность и разумное потребление алкоголя являлись факторами, ассоциированными с супернормальным старением.
Ключевые слова
Для цитирования:
Ротарь О.П., Бояринова М.А., Толкунова К.М., Могучая Е.В., Алиева А.С., Орлов А.В., Колесова Е.П., Ерина А.М., Усольцев Д.А., Солнцев В.Н., Баранова Е.И., Конради А.О., Шляхто Е.В. Фенотипы сосудистого старения в российской популяции — биологические и социально-поведенческие детерминанты. Кардиоваскулярная терапия и профилактика. 2021;20(5):2970. https://doi.org/10.15829/1728-8800-2021-2970
For citation:
Rotar O.P., Boiarinova M.A., Tolkunova K.M., Moguchaia E.V., Alievа A.S., Orlov A.V., Kolesova E.P., Erina A.M., Usoltsev D.A., Solntsev V.N., Baranova E.I., Konradi A.O., Shlyakhto E.V. Vascular aging phenotypes in Russian population — biological, social, and behavioral determinants. Cardiovascular Therapy and Prevention. 2021;20(5):2970. (In Russ.) https://doi.org/10.15829/1728-8800-2021-2970
Введение
Концепция “сосудистого возраста” в настоящее время привлекает все большее внимание исследователей в рамках оценки сердечно-сосудистых факторов риска (ФР), с целью определения наиболее оптимальных диагностических и терапевтических подходов к менеджменту сердечно-сосудистых и, в целом, кардиометаболических нарушений. По сравнению с хронологическим (паспортным) возрастом, биологический (сосудистый) возраст является мерой, которая более точно отражает структурные и функциональные изменения, происходящие в организме по мере его старения [1]. Можно предположить, что, воздействуя на факторы, определяющие сосудистый возраст, возможно замедлить и старение организма в целом, а, значит, повлиять и на ассоциированные с возрастом кардиометаболические заболевания. Известно, что с возрастом повышается сосудистая жесткость за счет снижения в артериальной стенке содержания эластина и увеличения количества коллагена [2]. В настоящее время “золотым стандартом” диагностики жесткости артерий является определение каротидно-феморальной скорости распространения пульсовой волны (СРПВ) [3]. Диагностика сосудистого возраста на основании определения артериальной жесткости является одним из способов оценки биологического возраста [4]. В зависимости от соотношения показателей хронологического и биологического возраста различают три фенотипа: преждевременное или раннее старение сосудов (EVA — early vascular aging) — жесткость артерий соответствует более старшему хронологическому возрасту, нормальное старение сосудов (NVA — normal vascular aging) [5] — показатели артериальной жесткости соответствуют паспортному возрасту человека, и супернормальное сосудистое старение (SUPERNOVA) — жесткость артерий соответствует показателям более младшего хронологического возраста [6]. Подразделение на фенотипы сосудистого старения, согласно лишь уровню жесткости артерий, является условным — следует понимать, что, хотя артериальная жесткость сама по себе является отражением целого ряда факторов, тот или иной тип старения сосудов является результирующим значением показателей сосудистой жесткости, кардиометаболического статуса, а также отягощающих (системное воспаление, окислительный стресс и др.) и протективных (достаточная физическая активность и др.) факторов. Кроме хронологического возраста на сосудистое старение могут оказывать влияние как биологические факторы (нарушение углеводного и липидного обмена), так и поведенческие и социоэкономические факторы. В настоящее время не вполне изучен вклад различных биологических и поведенческих факторов в формирование того или иного фенотипа сосудистого старения.
Цель работы — исследование ассоциации факторов сердечно-сосудистого риска с вероятностью наличия различных фенотипов сосудистого старения на примере популяционной выборки жителей Санкт-Петербурга в рамках исследования ЭССЕРФ.
Материал и методы
В рамках многоцентрового наблюдательного исследования ЭССЕ-РФ в 2012-2013гг случайным образом было скринировано 1600 жителей Санкт-Петербурга обоего пола в возрасте 24-65 лет. Исследование одобрено локальным этическим комитетом ФГБУ “НМИЦ им. В.А. Алмазова” Минздрава России (протокол № 193 от 08.10.2012). У респондентов было подписано информированное согласие, проведены антропометрия, измерение артериального давления (АД), определение биохимических показателей сыворотки крови и заполнен вопросник, состоящий из 12 модулей, разработанный на основе адаптированных международных методик [7].
Измерение массы тела проводилось на весах марки ВЭМ-150-Масса-К (Россия), роста при помощи ростомера РМ-1 Диакомс (Россия), окружности талии (ОТ) и бедер (ОБ) — с помощью стандартной гибкой сантиметровой ленты. Группы участников с абдоминальным ожирением были сформированы согласно критериям метаболического синдрома JIS 2009 [8]: мужчины и женщины с окружностью талии ≥94 см и ≥80 см, соответственно. Индекс массы тела (ИМТ) рассчитывался по формуле Кетле как отношение массы тела в кг к росту в м, возведенному в квадрат. Все респонденты были классифицированы на лиц с ожирением (ИМТ ≥30 кг/м2) и без ожирения (ИМТ <30 кг/м2).
С помощью автоматического тонометра “Omron” (Япония) выполнялось двукратное измерение АД на правой руке с интервалом 2 мин, после отдыха в течение 5 мин в положении сидя. Участники, имеющие уровень АД ≥140/90 мм рт.ст., а также принимающие антигипертензивную терапию, были определены в группу пациентов с артериальной гипертензией (АГ).
Исследование уровней в крови креатинина, глюкозы, инсулина, показателей липидного спектра — общего холестерина (ОХС), и ХС, входящего в состав липопротеинов низкой плотности (ЛНП), липопротеинов высокой плотности (ЛВП), а также триглицеридов (ТГ) — было выполнено натощак (AbbotArchitect 8000, США). Пациенты с нарушением углеводного обмена были разделены на группу гипергликемии натощак (уровень глюкозы ≥5,6 ммоль/л, но ≤6,9 ммоль/л) и с сахарным диабетом (СД) — сообщение пациента при опросе и/ или прием сахароснижающих препаратов. Индекс инсулинорезистентности рассчитывался по формуле: глюкоза крови натощак × инсулин × 0,138 (коэффициент, используемый для перевода пмоль/л в мкЕд/ мл)/22,5) — HOMA-IR (Homeostasis Model Assessment of Insulin Resistance) [9]. Инсулинорезистентность диагностировалась при значении индекса НОМА ≥2,6 [10]. По формуле CKD-EPI рассчитывалась скорость клубочковой фильтрации. Также были сформированы группы лиц с повышенным уровнем ХС ЛНП (>3,0 ммоль/л), сниженным уровнем ХС ЛВП (у мужчин <1,0 и у женщин <1,2 ммоль/л), что расценивалось как дислипопротеинемия, и повышенным уровнем ТГ (>1,7 ммоль/л) (гипертриглицеридемия); повышение уровня ОХС >4,9 ммоль/л расценивалось как гиперхолестеринемия. При разделении пациентов на группы учитывался прием гиполипидемической терапии [11].
Помимо биологических ФР были проанализированы следующие поведенческие и социально-экономические факторы: характер питания, статус курения, потребление алкоголя, продолжительность и качество сна, уровень образования, физическая активность, эмоциональный статус и уровень стресса. За избыточное потребление соли принималось досаливание готовой пищи и/или ежедневный/почти ежедневный прием соленых/ маринованных продуктов. Недостаточным считалось потребление свежих овощей и фруктов <3 штук в день, рыбы (200 г) <1-2 раз в нед. Избыточным считалось употребление ≥6 кусков/ложек сахара в день или ежедневный/ почти ежедневный прием сладостей/кондитерских изделий. Избыточное потребление жиров регистрировалось в случае использования для приготовления пищи сливочного масла или сливочного масла и животного жира и/ или добавления в пищу животного жира.
За достаточную физическую нагрузку была принята умеренная физическая нагрузка ≥150 мин/нед. Высокой физическая активность считалась в случае, когда умеренная физическая нагрузка респондента составляла >300 мин/нед. Нахождение в положении сидя >9 ч в будний день оценивалось как гиподинамия.
В ходе исследовании была выполнена оценка качества и продолжительности ночного и дневного сна. Недостаточной считалась длительность сна <6 ч/сут. Наличие трудностей с засыпанием диагностировалось в случае, когда участник испытывал сложности с тем, чтобы заснуть в течение минимум 30 мин >3 раз/нед. Нарушение поддержания сна определялось в случае, если обследуемый испытывал трудности с засыпанием после пробуждения в ночное время или ранним утром >3 раз/нед. [12].
Эмоциональный статус определяли с использованием Госпитальной шкалы депрессии и тревоги — HADS (Hospital Anxiety and Depression Scale) [13]. При количестве баллов 8-10 диагностировалась субклинически выраженная тревога/депрессия, а если участник набирал ≥11 баллов — клинически выраженная тревога/депрессия.
Для оценки уровня воспринимаемого стресса использовалась шкала Коена — Cohen’s Stress Scale/ Perceived Stress Scale [14]. Вопросник включает в себя две субшкалы, одна из которых измеряет субъективно воспринимаемый уровень напряженности ситуации, а вторая — степень усилий, прилагаемых для преодоления данной ситуации. Шкала воспринимаемого стресса позволяет определить, насколько стрессовым был предыдущий месяц жизни у респондентов. Высоким и очень высоким уровень стресса считался в том случае, когда сумма балов была ≥5.
К курящим относили лиц, выкуривающих хотя бы одну сигарету/папиросу в сут. или бросивших курить <1 года назад. Был рассчитан индекс курения по формуле: (стаж курения × количество сигарет в день)/20.
Методом интервьюирования получены данные о частоте, объеме и типе потребляемых респондентами алкогольных напитков. Для оценки количества потребляемого этанола использовался вопросник, предложенный в исследовании RLMS (The Russia Longitudinal Monitoring Survey) [15]. Согласно полученным данным, участники были ранжированы на группы: употребляющие умеренное (мужчины ≤168 г этанола/нед., женщины ≤84 г этанола/нед.) и употребляющие чрезмерное (мужчины >168 г этанола/нед., женщины >84 г этанола/нед.) количество этанола. Чрезмерное потребление алкоголя было оценено и другим способом — с помощью вопросника AUDIT (Alcohol Use Disorder Identification Test). Избыточным потребление алкоголя считалось в случае, когда суммарное количество баллов составляло 8 для мужчин и 7 для женщин [16].
Из представленной выборки случайным образом были отобраны 524 участника, которым была проведена оценка СРПВ методом аппланационной тонометрии на аппарате SphygmoCor (AtCor, Австралия). Расчет каротидно-феморального расстояния проводился по формуле, рекомендованной Консенсусом экспертов по сосудистой жесткости в 2012г [3]: расстояние от общей сонной артерии до общей бедренной артерии, см × 0,8. Электрокардиографические электроды накладывались на грудную клетку по стандартной методике. Аппланационным тонометром (диффузным полупроводниковым пьезокристаллическим чувствительным элементом) регистрировались пульсовые волны в течение 10 с: сначала в проекции общей сонной артерии слева, затем — общей бедренной артерии слева. С учетом введенного расстояния и времени прохождения пульсовой волны автоматически рассчитывалась СРПВ.
39 участников с ассоциированными клиническими состояниями в анамнезе (ишемическая болезнь сердца, инфаркт миокарда, инсульт в анамнезе) были исключены из анализа, других критериев исключения не было. Данные о сопутствующей патологии, не относящиеся к кардиометаболическим нарушениям, в настоящем исследовании не учитывались. Путем интервьюирования пациентов были собраны сведения о сопутствующей антигипертензивной, сахароснижающей и липидснижающей терапии.
Оценка значения СРПВ была скорректирована с учетом возраста, для этого исследуемые были разделены по возрасту на 5 групп: лица <30 лет, 30-39 лет, 40-49 лет, 50-59 лет, ≥60 лет. В качестве референсных значений СРПВ использовали данные, полученные в ходе крупного европейского исследования, которые представлены в статье [17]. Значение СРПВ ≤10 перцентиля СРПВ для здоровых лиц в каждой возрастной группе было критерием наличия феномена SUPERNOVA, значение СРПВ ≥90 перцентиля СРПВ для здоровых лиц было критерием наличия феномена EVA, а остальные участники вошли в группу нормального сосудистого старения — феномена NVA (таблица 1).
Таблица 1
Референсные значения СРПВ (м/с) в зависимости от возрастной группы

Математико-статистический анализ данных реализовывался с использованием программы IBM SPSS Statistics 20.0. Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Колмогорова-Смирнова. В случае описания количественных показателей, имеющих нормальное распределение, полученные данные объединялись в вариационные ряды, в которых проводился расчет средних арифметических величин (M) и стандартных отклонений (SD). Совокупности количественных показателей, распределение которых отличалось от нормального, описывались при помощи значений медианы (Me) и нижнего и верхнего квартилей (Q1-Q3). Номинальные данные описывались с указанием абсолютных значений (n) и процентных долей. При сравнении средних величин в нормально распределенных совокупностях количественных данных рассчитывался t-критерий Стьюдента. Для сравнения независимых совокупностей в случаях отсутствия признаков нормального распределения данных использовался U-критерий Манна-Уитни. Сравнение номинальных данных проводилось при помощи критерия χ2 Пирсона. Различия показателей считались статистически значимыми при уровне значимости p<0,05.
Результаты
Данные обследования 485 человек (217 мужчин и 268 женщин) были пригодны для анализа, распределение участников в зависимости от возраста и фенотипа сосудистого возраста представлено на рисунке 1.
Наиболее часто регистрируемый сосудистый фенотип в представленной выборке — это нормальное сосудистое старение (71,5%), максимальная распространенность которого представлена среди участников 30-60 лет. Общая распространенность феномена SUPERNOVA составила 9,7%, а фенотипа EVA — 18,8%. Результаты распределения фенотипов в зависимости от возраста требуют острожной трактовки, т.к. 12 пациентов из группы 60-65 лет были исключены из анализа в связи с наличием сердечно-сосудистых заболеваний (ССЗ) — возможно, эти пациенты характеризовались именно EVA фенотипом.
Результаты сравнительного анализа трех фенотипов сосудистого старения представлены в таблице 2.
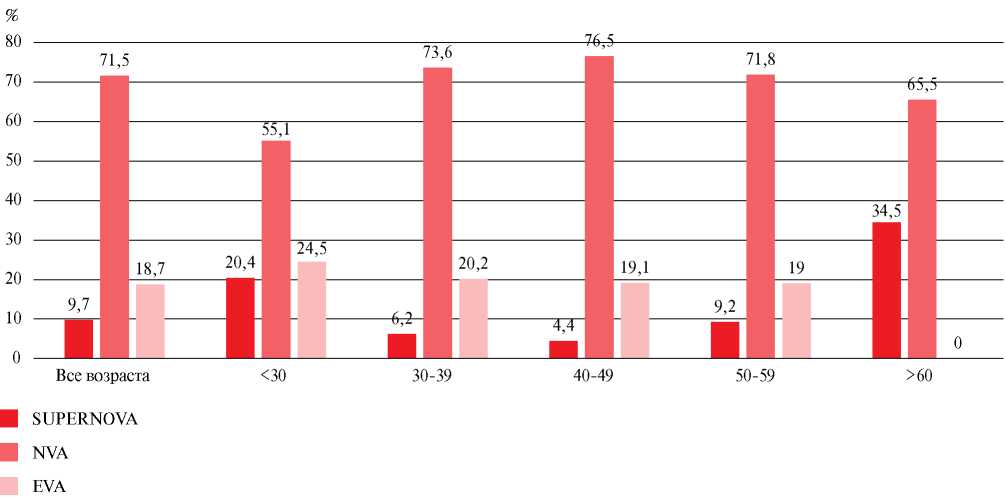
Рис. 1 Распространенность сосудистых фенотипов в зависимости от возраста.
Таблица 2
Сравнительный анализ биологических ФР в зависимости от фенотипа сосудистого старения
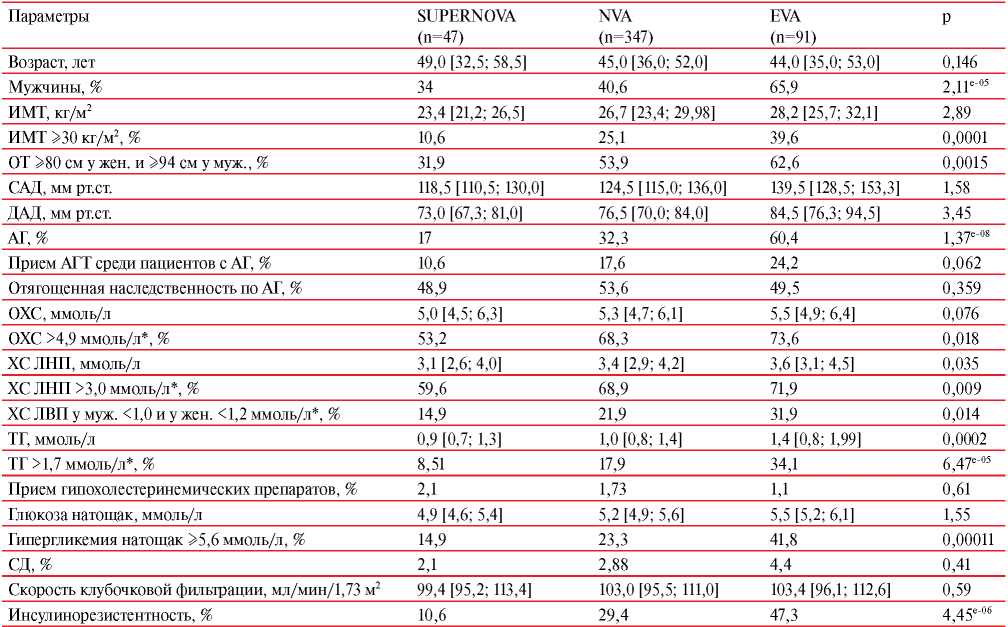
Примечание: САД — систолическое АД, ДАД — диастолическое АД, * — наличие гиполипидемической терапии.
Фенотип EVA значимо чаще выявлялся у мужчин (65,9%). Пациенты с SUPERNOVA имели самый благоприятный метаболический фон: значимо реже встречалось ожирение, нарушения липидного и углеводного обмена. Наиболее высокая распространенность АГ продемонстрирована в группе с синдромом EVA (60,4%), в то время как у респондентов с супернормальным сосудистым старением АГ зарегистрирована только в 17% случаев.
В таблице 3 представлена характеристика участников с различными сосудистыми фенотипами с учетом поведенческих и социально-экономических ФР.
Таблица 3
Характеристика участников с различными сосудистыми фенотипами с учетом поведенческих и социально-экономических ФР

Примечание: AUDIT — Alcohol Use Disorder Identification Test.
У пациентов с супернормальным старением (SUPERNOVA) была выявлена более высокая физическая активность, распространенность субклинической тревожности и более низкая распространенность чрезмерного потребления алкоголя по сравнению с пациентами с EVA фенотипом.
Обсуждение
В популяционной выборке, состоящей из 485 жителей Санкт-Петербурга без сердечно-сосудистых осложнений в возрасте 25-64 лет, которым была проведена оценка сосудистого возраста с помощью определения артериальной жесткости, распространенность феномена SUPERNOVA составила 9,7% и EVA — 18,8%.
В настоящей выборке феномен EVA был более распространен среди участников мужского пола (65,9%), что, вероятно, связано с более высокой распространенностью ФР среди мужского населения. В испанском исследовании EVA study с участием 501 участника без ССЗ распространенность EVA феномена составила 16,6% с преобладанием среди мужчин 28,9% [18]. При оценке возрастного распределения в испанской выборке распространенность фенотипа EVA составила 14,1% только в группе 35 лет, в то время как в остальных возрастных группах (45-75 лет) была продемонстрирована сопоставимая распространенность на уровне 16,6-16,9%. В российской выборке получены неожиданные результаты: максимальная распространенность фенотипа преждевременного старения зарегистрирована в самой молодой группе — 24,5%, при отсутствии таких пациентов в самой старшей возрастной группе. Данный факт можно объяснить тем, что пациенты >60 лет (n=12), исключенные по причине наличия ССЗ, могли быть именно лицами с фенотипом преждевременного сосудистого старения — в настоящий момент это установить невозможно. При оценке распространенности феномена супернормального старения наблюдается другая парадоксальная ситуация: максимальная распространённость наблюдается в самой старшей группе (34,5%). При субанализе этой подгруппы пациентов наблюдается более благоприятный профиль ФР по сравнению с остальными участниками группы супернормального старения: более высокая частота приема антигипертензивной терапии (АГТ): 66 vs 10,6%, приема статинов: 10 vs 2,1%, низкой распространенности курения: 10 vs 25,5%, отсутствия злоупотребления алкоголем и достаточной физической активностью: в 100% случаев.
При субанализе подгруппы молодых участников с феноменом EVA выявлены относительно высокая распространенность СД (16,6 vs 4,4% во всей группе EVA феномена), чрезмерного употребления алкоголя (16,6 vs 13,3%), и курения (курят в настоящий момент или курили в прошлом половина участников).
АД является одним из основных факторов, влияющих на артериальную жесткость. По результатам настоящего исследования самая высокая распространенность АГ выявлена среди участников с преждевременным сосудистым старением, а самая низкая — у лиц с SUPERNOVA фенотипом. Уровень АД и структурно-функциональные свойства сосудистой стенки тесно взаимосвязаны при развитии АГ. Сильная ассоциация предполагает, что их временная связь двунаправлена, как “улица с двусторонним движением”, основана на биологии сосудистой стенки и гемодинамике; т.е. они взаимно влияют на процесс старения [19]. В исследовании сердца Bogalusa авторы изучили временную связь между АД и показателями артериальной функции и установили, что повышенное АД предшествовало увеличению жесткости крупных артерий в молодом возрасте [20]. Однако механизмы, лежащие в основе развития АГ, могут быть различными в более молодом и более старшем возрастах. В другом исследовании было продемонстрировано, что артериальная жесткость является значимым независимым предиктором, способствующим повышению уровня АД, и развития АГ [21].
Возможно, что именно бóльшая комплаентность к антигипертензивной терапии способствовала предотвращению возраст-зависимых изменений при АГ. Согласно данным некоторых исследований, АГ — это неизбежное следствие старения, т.к. старение вызывает повышение жесткости артерий и нагрузки на миокард, а усиление периферического сопротивления провоцирует систолическую АГ. Постоянная АГТ затормаживает возникновение возраст-зависимой АГ, поэтому превентивное назначение препаратов для снижения АД может способствовать нормотензивному старению. Иными словами, старение неизбежно, а АГ предотвратима [22][23].
Еще одним из важных модифицируемых ФР сосудистого старения является ожирение. В исследовании Whitehall II, в котором приняли участие 3789 мужчин и 1383 женщины, было установлено, что каждое увеличение стандартного отклонения от средних значений ИМТ, ОТ, отношения ОТ/ ОБ и процента жировой массы независимо предсказывало прогрессивное увеличение СРПВ [24]. В настоящем исследовании у лиц с феноменом SUPERNOVA, в сравнении с участниками с EVA, ожидаемо реже встречалось общее и абдоминальное ожирение. В Балтиморском проспективном исследовании старения, в котором приняли участие 354 мужчин и 423 женщин 21-94 лет без значимых ССЗ, также была продемонстрирована связь между большей ОТ и увеличением СРПВ, которая была более выражена с возрастом у женщин [25]. Интересно отметить, что ассоциация более высокого уровня ИМТ, а также уровня ХС ЛНП с более жесткими артериями отмечается уже в подростковом возрасте [26]. Таким образом, можно предположить, что избыточная масса тела или ожирение, возникшие в молодом возрасте, и сохраняющиеся в течение жизни, будут приводить к ускоренному сосудистому старению во взрослом возрасте.
По результатам представленного исследования участники с SUPERNOVA имели более благоприятный метаболический статус по сравнению с лицами, которые имели сосудистый фенотип EVA или NVA. В исследовании Whitehall II у 4386 участников без СД индекс HOMA-IR был связан с прогрессированием СРПВ. Однако авторы отмечают, что дополнительная корректировка на ИМТ ослабила ассоциацию с индексом HOMA-IR [27]. Авторы предполагают, что даже у лиц без СД незначительные различия в глюкометаболическом статусе оказывают значимое влияние на сосудистую жесткость.
Существует достаточно доказательств благотворного влияния физических упражнений на состояние сосудистой стенки [28]. В исследовании Whitehall II, в котором 5196 взрослым дважды (в 65 лет и 70 лет) измеряли СРПВ, авторы продемонстрировали, что каждый час/нед. умеренной или интенсивной физической активности (занятие в фитнесс центре или велоспорт) был связан с более низким 5-летним прогрессированием СРПВ (на 0,02 м/с), тогда как каждый час сидячего времени был связан с бóльшим 5-летним прогрессированием СРПВ (на 0,007 м/с). Кроме того, увеличение физической активности было связано с более низким 5-летним прогрессированием СРПВ (на 0,16 м/с). По результатам исследования более активный образ жизни вели пациенты с супернормальным сосудистым старением, в то время как участники с преждевременным сосудистым старением более длительное время проводили в положении сидя, что согласуется с имеющимися данными о благоприятном влиянии физических упражнений на сосудистую стенку [29]. По результатам другого исследования авторы также продемонстрировали, что регулярные аэробные упражнения умеренной интенсивности, которые могут быть доступны большинству пациентов, способны снижать артериальную жесткость [30].
Группой авторов продемонстрировано, что недостаточная продолжительность сна связана с повышением симпатической активности и снижением секреции мелатонина, который обладает эндотелий-защитными свойствами, что, в свою очередь, может негативно влиять на эндотелиальную функцию [31]. В настоящем исследовании не было получено значимых различий ни в продолжительности, ни в качестве сна между подгруппами с различными фенотипами сосудистого старения. Возможно, отсутствие ассоциации сна с артериальной жесткостью в исследовании можно объяснить в целом достаточной средней продолжительностью сна у респондентов (7-8 ч) с очень небольшим процентом лиц, чья продолжительность сна составила <6,5 ч.
В настоящее время связь между потреблением алкоголя и сосудистой жесткостью изучена недостаточно хорошо. В одних исследованиях авторы предполагают положительное влияние небольших доз алкоголя на сосудистую жесткость [32], в то время как другие исследователи не выявляют никаких положительных эффектов [33]. Согласно данным проспективного когортного исследования, мужчины, регулярно потребляющие >112 г этанола/нед., имели более высокую СРПВ по сравнению с участниками с умеренным приемом алкоголя [34]. По результатам настоящей работы достоверные различия были продемонстрированы в распространённости употребления этанола между группами с различными сосудистыми фенотипами. Чрезмерное употребление алкоголя зарегистрировано в группе EVA, в то время как самая низкая распространенность избыточного потребления алкоголя была в группе SUPERNOVA.
Интересным является выявленный нами факт более низкого уровня субклинической тревожности у лиц с EVA фенотипом, в то время как у трети лиц с SUPERNOVA фенотипом определяется субклиническая тревожность. Здесь может участвовать несколько факторов. Как уже было продемонстрировано, лица с супернормальным старением сосудов являются более здоровыми по метаболическим показателям, а также физически более активными, что может быть отражением выраженной озабоченности собственным здоровьем, которая, в свою очередь, может переходить в тревожность из-за страха болезней. Пациенты с EVA фенотипом характеризуются избыточным потреблением алкоголя: известен механизм воздействия алкоголя на центральную нервную систему с активацией рецепторов гамма-аминомасляной кислоты (ГАМК) и/или увеличением высвобождения ГАМК. ГАМК является основным тормозным нейромедиатором в головном мозге, что также может приводить к более низкому уровню фоновой тревожности в данной группе пациентов. Однако хроническое потребление алкоголя приводит к толерантности ГАМК-рецепторов, истощению витаминов В1 и В9 и повышению уровня тревожности [35][36]. В настоящем исследовании суммарная длительность употребления алкоголя не уточнялась. Представляет интерес выявленная в исследованиях ассоциация приема АГТ с более низким уровнем тревоги и более благополучным психологическим состоянием [37]. В данном исследовании у лиц с фенотипом EVA отмечается самая высокая частота приема АГТ, а в группе фенотипа SUPERNOVA — низкая. По мнению авторов вышеуказанной публикации, ассоциация терапии со снижением уровня тревоги может объясняться влиянием антигипертензивных препаратов на гипоталамо-гипофизарно-надпочечниковую ось, которая, помимо участия в регуляции АД, является стресс-регулирующей системой. Кроме того, некоторые группы препаратов для лечения АГ (периндоприл, амлодипин) модифицируют уровень нейротрофического фактора головного мозга, что также ассоциируется с благоприятным психологическим статусом.
Артериальная жесткость отражает не только текущий артериальный ущерб (влияние возраста, ФР и внутреннюю восприимчивость к ним), но и его регрессию (когда происходит терапевтическое воздействие) или прогрессирование (когда воздействие продолжается или терапевтические влияния недостаточны). СРПВ отличается от обычного “снимка”, который врачи получают от своих пациентов, когда они измеряют только АД, уровень ХС и гликемию. Таким образом, артериальная жесткость имеет более высокое прогностическое значение для сердечно-сосудистых событий, чем классические оценки сердечно-сосудистого риска [38].
Заключение
На основании показателей артериальной жесткости, измеренной путем определения каротиднофеморальной скорости распространения пульсовой волны у 485 жителей Санкт-Петербурга 25-64 лет без диагностированных сердечно-сосудистых осложнений, были получены данные о распространенности различных фенотипов старения сосудов. Распространенность фенотипа раннего сосудистого старения — EVA — составила 18,8%, а суперномального сосудистого старения — SUPERNOVA — 9,7%. Феномен EVA был более распространен среди участников мужского пола (65,9%). Помимо артериальной гипертензии и дислипопротеинемии значимым предиктором преждевременного старения было совокупное влияние ожирения, сопровождающееся нарушением углеводного обмена с инсулинорезистентностью и гипертриглицеридемией. Среди поведенческих ФР более выраженная физическая активность и разумное потребление алкоголя являлись факторами, ассоциированными с супернормальным старением.
Определение раннего сосудистого старения и супернормального сосудистого старения может способствовать лучшему таргетному воздействию на ФР для замедления сосудистого старения и предотвращения развития сердечно-сосудистых осложнений.
Благодарности. Выражаем благодарность за участие в сборе материала и выполнении лабораторно-инструментальных исследований Паскарь Н.А., Темирову А.А., Парижской Е. Н., Карузину С.В., Дудоровой Е.А., Солдатенковой Н.А., Маликову К.Н., Тимофеевой Е.А., Баженовой Е.А., Беляевой О.Д.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Belsky DW, Caspi A, Houts R, et al. Quantification of biological aging in young adults. Proc Natl Acad Sci U S A. 2015;112:E4104-10. doi:10.1073/pnas.1506264112.
2. Nilsson PM, Boutouyrie P, Cunha P, et al. Early vascular ageing in translation: from laboratory investigations to clinical applications in cardiovascular prevention. J Hypertens. 2013;31(8):1517-26. doi:10.1097/HJH.0b013e328361e4bd.
3. Van Bortel LM, Laurent S, Boutouyrie P, et al. Expert consensus document on the measurement of aortic stiffness in daily practice using carotid-femoral pulse wave velocity. J Hypertens. 2012;30(3):445-8. doi:10.1097/HJH.0b013e32834fa8b0.
4. Groenewegen KA, den Ruijter HM, Pasterkamp G, et al. Vascular age to determine cardiovascular disease risk: a systematic review of its concepts, definitions, and clinical applications. Eur J Prev Cardiol. 2016;23(3):264-74. doi:10.1177/2047487314566999.
5. Koopman JJE, Kuipers RS. From arterial ageing to cardiovascular disease. Lancet. 2017;389(10080):1676-8. doi:10.1016/S0140-6736(17)30763-8.
6. Laurent S, Boutouyrie P, Cunha PG, et al. Concept of Extremes in Vascular Aging. Hypertension. 2019;74(2):218-28. doi:10.1161/HYPERTENSIONAHA.119.12655.
7. Научно-организационный комитет проекта ЭССЕ-РФ Эпидемиология сердечно-сосудистых заболеваний в различных регионах России (ЭССЕ-РФ). Обоснование и дизайн исследования. Профилактическая медицина. 2013;6:25-34.
8. Alberti KG, Eckel RH, Grundy SM, et al. International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; International Association for the Study of Obesity. Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation. 2009;120(16):1640-5. doi:10.1161/CIRCULATIONAHA.109.192644.
9. Matthews DR, Hosker JP, Rudenski AS, et al. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia. 1985;28(7):412-29. doi:10.1007/BF00280883.
10. Zhao D, Cho J, Kim MH, et al. Diabetes, glucose metabolism, and glaucoma: the 2005-2008 National Health and Nutrition Examination Survey. PloS One. 2014;9(11):e112460. doi:10.1371/journal.pone.0112460.
11. Кобалава Ж. Д., Конради А. О., Недогода С. В. и соавт. Артериальная гипертензия у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(3):3786. doi:10.15829/1560-4071-2020-3-3786.
12. Watson NF, Badr MS, Belenky G, et al. Joint Consensus Statement of the American Academy of Sleep Medicine and Sleep Research Society on the Recommended Amount of Sleep for a Healthy Adult: Methodology and Discussion. Sleep. 2015;38(8):1161-83. doi:10.5665/sleep.4886.
13. Zigmond AS, Snaith RP. The hospital anxiety and depression scale. Acta Psychiatr Scand. 1983;67(6):361-70. doi:10.1111/j.1600-0447.1983.tb09716.x.
14. Cohen S, Kamarck T, Mermelstein R. A global measure of perceived stress. J Health Soc Behav. 1983;24:385-96.
15. Peasey A, Bobak M, Kubinova R, et al. Determinants of cardiovascular disease and other non-communicable diseases in Central and Eastern Europe:rationale and design of the HAPIEE study. (Study protocol). BMC PublicHealth. 2006;6:255-64. doi:10.1186/1471-2458-6-255.
16. Saunders JB, Aasland OG, Babor TF, et al. Development of the Alcohol Use Disorders Identification Test (AUDIT): WHO collaborative project on early detection of persons with harmful alcohol consumption-II. Addiction. 1993;88(6):791-804. doi:10.1111/j.1360-0443.1993.tb02093.x.
17. Mattace-Raso F, Hofman A, Verwoert GC, et al. Reference values for arterial stiffness collaboration. Determinants of pulse wave velocity in healthy people and in the presence of cardiovascular risk factor: “Establishing normal and reference values”. Eur Heart J. 2010;31:2338-50. doi:10.1093/eurheartj/ehq165.
18. Gomez-Sanchez M, Gomez-Sanchez L, Patino-Alonso MC, et al; EVA Investigators. Vascular aging and its relationship with lifestyles and other risk factors in the general Spanish population: Early Vascular Ageing Study. J Hypertens. 2020;38(6):1110-22. doi:10.1097/HJH.0000000000002373.
19. Mitchell GF. Arterial stiffness and hypertension: chicken or egg? Hypertension. 2014;642:210-14. doi:10.1161/HYPERTENSIONAHA.114.03449.
20. Chen W, Li S, Fernandez C, et al. Temporal Relationship Between Elevated Blood Pressure and Arterial Stiffening Among MiddleAged Black and White Adults: The Bogalusa Heart Study. Am J Epidemiol. 2016;183(7):599-608. doi:10.1093/aje/kwv274.
21. Takase H, Dohi Y, Toriyama T, et al. Brachial-ankle pulse wave velocity predicts increase in blood pressure and onset of hypertension. Am J Hypertens. 2011;24(6):667-73. doi:10.1038/ajh.2011.19.
22. Nair T, Ram CVS. Normotensive aging: finally, an ‘iron in the fire'. J Hypertens. 2021;39(6):1102-3. doi:10.1097/HJH.0000000000002804.
23. The China PEACE Collaborative Group. Association of age and blood pressure among 3.3 million adults: insights from China PEACE million persons project. J Hypertens. 2021;39(6):1143-54. doi:10.1097/HJH.0000000000002793.
24. Brunner EJ, Shipley MJ, Ahmadi-Abhari S, et al. Adiposity, obesity, and arterial aging: longitudinal study of aortic stiffness in the Whitehall II cohort. Hypertension. 2015;66(2):294-300. doi:10.1161/HYPERTENSIONAHA.115.05494.
25. AlGhatrif M, Strait JB, Morrell CH, et al. Longitudinal trajectories of arterial stiffness and the role of blood pressure: The Baltimore Longitudinal Study of Aging. Hypertension. 2013;62(5):934-41. doi:10.1161/HYPERTENSIONAHA.113.01445.
26. Zachariah JP, Wang Y, Newburger JW, et al. Biological Pathways in Adolescent Aortic Stiffness. J Am Heart Assoc. 2021;10(6):e018419. doi:10.1161/JAHA.120.018419.
27. McEniery CM, Wilkinson IB, Johansen NB, et al. Nondiabetic Glucometabolic Status and Progression of Aortic Stiffness: The Whitehall II Study. Diabetes Care. 2017;40(4):599-606. doi:10.2337/dc16-1773.
28. Gomez-Marcos MA, Recio-Rodriguez JI, Patino-Alonso MC, et al. Relationship between physical activity and plasma fibrinogen concentrations in adults without chronic diseases. PLoS One. 2014;9(2):e87954. doi:10.1371/journal.pone.0087954.
29. Schmidt-Trucksass A, Weisser B. Vaskulares Altern, Hyper-tonie und korperliche Aktivitat [Vascular aging, arterial hypertension and physical activity]. Dtsch Med Wochenschr. 2011;136(46):2367-71. German. doi:10.1055/s-0031-1292053.
30. Wong A, Kwak YS, Scott SD, et al. The effects of swimming training on arterial function, muscular strength, and cardiorespiratory capacity in postmenopausal women with stage 2 hypertension. Menopause. 2018;26(6):653-8. doi:10.1097/GME.0000000000001288.
31. Agabiti-Rosei C, Favero G, De Ciuceis C, et al. Effect of long-term treatment with melatonin on vascular markers of oxidative stress/ inflammation and on the anticontractile activity of perivascular fat in aging mice. Hypertens Res. 2017;40(1):41-50. doi:10.1038/hr.2016.103.
32. Karimi L, Mattace-Raso FU, van Rosmalen J, et al. Effects of combined healthy lifestyle factors on functional vascular aging: The Rotterdam Study. J Hypertens. 2016;34:853-9. doi:10.1097/HJH.0000000000000861.
33. Charakida M, Georgiopoulos G, Dangardt F, et al. Early vascular damage from smoking and alcohol in teenage years: the ALSPAC study. Eur Heart J. 2019;40(4):345-53. doi:10.1093/eurheartj/ehy524.
34. O'Neill D, Britton A, Brunner EJ, et al. Twenty-Five-Year Alcohol Consumption Trajectories and Their Association with Arterial Aging: A Prospective Cohort Study. J Am Heart Assoc. 2017;6(2):e005288. doi:10.1161/JAHA.116.005288.
35. Xu H, Li H, Liu D, et al. Chronic Voluntary Alcohol Drinking Causes Anxiety-like Behavior, Thiamine Deficiency, and Brain Damage of Female Crossed High Alcohol Preferring Mice. Front Pharmacol. 2021;12:614396. doi:10.3389/fphar.2021.614396.
36. Wang SC, Chen YC, Chen SJ, et al. Alcohol Addiction, Gut Microbiota, and Alcoholism Treatment: A Review. Int J Mol Sci. 2020;21(17):6413. doi:10.3390/ijms21176413.
37. Korosi B, Laszlo A, Tabak A, et al. The impact of currently recommended antihypertensive therapy on depression and other psychometric parameters: preliminary communication. Neuropsychopharmacol Hung. 2017;19(1):11-22.
38. Boutouyrie P, Tropeano AI, Asmar R, et al. Aortic stiffness is an independent predictor of primary coronary events in hypertensive patients: a longitudinal study. Hypertension. 2002:39(1):10-5. doi:10.1161/hy0102.099031.
Об авторах
О. П. РотарьРоссия
Ротарь Оксана Петровна — доктор медицинских наук, главный научный сотрудник научно-исследовательской лаборатории эпидемиологии неинфекционных заболеваний Института сердца и сосудов.
Санкт-Петербург.
Тел.: +7 (812) 702-37-56
М. А. Бояринова
Россия
Бояринова Мария Анатольевна — младший научный сотрудник научно-исследовательской лаборатории эпидемиологии неинфекционных заболеваний Института сердца и сосудов.
Санкт-Петербург.
К. М. Толкунова
Россия
Толкунова Кристина Михайловна — аспирант Института сердца и сосудов.
Санкт-Петербург.
Е. В. Могучая
Россия
Могучая Екатерина Викторовна — младший научный сотрудник научно-исследовательской лаборатории эпидемиологии неинфекционных заболеваний Института сердца и сосудов.
Санкт-Петербург.
А. С. Алиева
Россия
Алиева Асият Сайгидовна — кандидат медицинских наук, научный сотрудник научно-исследовательской лаборатории эпидемиологии неинфекционных заболеваний, руководитель Центра атеросклероза и нарушений липидного обмена Института сердца и сосудов.
Санкт-Петербург.
А. В. Орлов
Россия
Орлов Александр Викторович — кандидат медицинских наук, руководитель медицинского направления.
Ялта, Гаспра, Республика Крым.
Е. П. Колесова
Россия
Колесова Екатерина Павловна — кандидат медицинских наук, научный сотрудник научно-исследовательской лаборатории эпидемиологии неинфекционных заболеваний Института сердца и сосудов.
Санкт-Петербург.
А. М. Ерина
Россия
Ерина Анастасия Максимовна — научный сотрудник научно-исследовательской лаборатории эпидемиологии неинфекционных заболеваний Института сердца и сосудов.
Санкт-Петербург.
Д. А. Усольцев
Россия
Усольцев Дмитрий Андреевич — младший научный сотрудник научно-исследовательской лаборатории популяционной генетики НИО генетических рисков и персонифицированной профилактики НЦМУ “Центра персонифицированной медицины”, программист Института трансляционной медицины.
Санкт-Петербург.
В. Н. Солнцев
Россия
Солнцев Владислав Николаевич — старший научный сотрудник научно-исследовательской лаборатории математического моделирования Института сердца и сосудов.
Санкт-Петербург.
Е. И. Баранова
Россия
Баранова Елена Ивановна — доктор медицинских наук, профессор, руководитель лаборатории метаболического синдрома Института эндокринологии, профессор кафедры факультетской терапии с курсом эндокринологии, кардиологии и функциональной диагностики им. Г.Ф. Ланга с клиникой.
Санкт-Петербург.
А. О. Конради
Россия
Конради Александра Олеговна — доктор медицинских наук, профессор, член-корреспондент РАН, заместитель генерального директора по научной работе Института сердца и сосудов, директор Института трансляционной медицины.
Санкт-Петербург.
Е. В. Шляхто
Россия
Шляхто Евгений Владимирович — доктор медицинских наук, профессор, академик РАН, генеральный директор.
Санкт-Петербург.
Рецензия
Для цитирования:
Ротарь О.П., Бояринова М.А., Толкунова К.М., Могучая Е.В., Алиева А.С., Орлов А.В., Колесова Е.П., Ерина А.М., Усольцев Д.А., Солнцев В.Н., Баранова Е.И., Конради А.О., Шляхто Е.В. Фенотипы сосудистого старения в российской популяции — биологические и социально-поведенческие детерминанты. Кардиоваскулярная терапия и профилактика. 2021;20(5):2970. https://doi.org/10.15829/1728-8800-2021-2970
For citation:
Rotar O.P., Boiarinova M.A., Tolkunova K.M., Moguchaia E.V., Alievа A.S., Orlov A.V., Kolesova E.P., Erina A.M., Usoltsev D.A., Solntsev V.N., Baranova E.I., Konradi A.O., Shlyakhto E.V. Vascular aging phenotypes in Russian population — biological, social, and behavioral determinants. Cardiovascular Therapy and Prevention. 2021;20(5):2970. (In Russ.) https://doi.org/10.15829/1728-8800-2021-2970
JATS XML

























































