Перейти к:
Артериальная кальцификация, атеросклероз и остеопороз: только клинические ассоциации или генетическая платформа?
https://doi.org/10.15829/1728-8800-2021-3034
Аннотация
Обзор посвящен обоснованию коморбидности двух мультифакторных заболеваний — атеросклероза (АС) и остеопороза (ОП). Множественные эпидемиологические, экспериментальные и клинические исследования подтвердили связь между этими заболеваниями, основанную на общих факторах риска и механизмах патогенеза. При этом для оценки ассоциаций между ОП и сердечно-сосудистыми заболеваниями, обусловленными АС, используют суррогатные маркеры — сосудистую кальцификацию или параметры сосудистой жесткости и минеральную плотность кости. Известно, что АС и ОП зависят от генотипа человека, и вызваны они взаимодействием между окружающей средой и генами. Модифицируемые факторы риска этих заболеваний во многом сходны, а общие черты патогенеза АС и ОП позволяют сформулировать концепцию о едином генетическом контроле механизмов их развития. Прогресс в молекулярных технологиях позволил проводить полногеномный поиск ассоциаций (Genome-Wide Association Study, GWAS) и успешно определять генетические маркеры, связанные одновременно с АС и ОП. Цель обзора — описать гены, связанные с риском развития АС, артериальной кальцификации и ОП, а также предоставить информацию о современном понимании общих генетических основ формирования атеросклеротической бляшки, отложения депозитов кальция в сосудистой стенке и снижения костной массы. Проведен анализ публикаций и поиск литературных источников в базах данных PubMed, Medline, Web of Science и Cochrane Library, начиная с 2000г. В статье описаны генетические маркеры, связанные с АС и ОП, отражены достижения в области генетики ОП и сердечно-сосудистых заболеваний, обусловленных АС, а также современные подходы и направления дальнейшего исследования этих заболеваний. Обзор можно адресовать практикующим врачам с целью разъяснения различных ассоциаций и механизмов, которые ведут к сочетанной патологии, с применением генетики.
Ключевые слова
Для цитирования:
Скрипникова И.А., Колчина M.А., Мешков А.Н., Киселева А.В., Драпкина О.М. Артериальная кальцификация, атеросклероз и остеопороз: только клинические ассоциации или генетическая платформа? Кардиоваскулярная терапия и профилактика. 2021;20(7):3034. https://doi.org/10.15829/1728-8800-2021-3034
For citation:
Skripnikova I.A., Kolchina M.A., Meshkov A.N., Kiseleva A.V., Drapkina O.M. Arterial calcification, atherosclerosis and osteoporosis: only clinical associations or a genetic platform? Cardiovascular Therapy and Prevention. 2021;20(7):3034. (In Russ.) https://doi.org/10.15829/1728-8800-2021-3034
Несмотря на прогресс современной медицины в отношении диагностики и лечения заболеваний, в структуре смертности населения развитых стран ведущее место продолжают занимать болезни системы кровообращения [1, 2]. Наряду с этим, частой причиной функциональной недостаточности и потери трудоспособности у взрослого населения является остеопороз (ОП). В ряде исследований последних лет показано, что сердечно-сосудистые заболевания (ССЗ), обусловленные атеросклерозом (АС), и смертность от них тесно связаны со снижением минеральной плотности кости (МПК) и остеопорозными переломами [3, 4]. АС характеризуется мультифокальным поражением артерий крупного и среднего калибра вследствие влияния генетических факторов и факторов окружающей среды. В патогенезе АС важную роль играет дисфункция эндотелия, воспаление сосудистой стенки, накопление холестерина (ХС) и отложение депозитов кальция в интиме. ОП — заболевание скелета, характеризующееся низкой костной массой, ухудшением микроархитектуры костей, которые приводят к увеличению хрупкости костей и, как следствие, к повышению риска низкоэнергетических переломов. Широко распространено мнение, что АС и ОП являются многофакторными заболеваниями, зависящими от генотипа человека, и вызваны взаимодействием между неблагоприятной окружающей средой и генетической предрасположенностью, оказывая влияние на сосудистую стенку или костную массу и другие показатели прочности костей, а возможно, одновременно на одни и те же органы и ткани.
Поскольку АС и ОП являются мультифакториальными заболеваниями, в их диагностике большое значение уделяется факторам риска (ФР), которые разделяют на модифицируемые, зависящие от образа жизни, поведения человека, и немодифицируемые, в т.ч. генетически обусловленные. Модифицируемые ФР неинфекционных заболеваний во многом сходны, а общие черты патогенеза АС и ОП наводят на мысль о едином генетическом контроле механизмов развития этих заболеваний.
В настоящее время накоплены многочисленные клинические и экспериментальные данные, которые доказывают, что уменьшение прочности костной ткани и проявления АС — это взаимосвязанные патологические состояния, имеющие общие патогенетические механизмы формирования и прогрессирования [5][6]. При этом ряд исследователей подтверждают ассоциации между ОП и ССЗ, обусловленными АС, прежде всего, с использованием суррогатных маркеров заболеваний — кальцификации аорты или коронарных артерий (КА) или параметров сосудистой жесткости и МПК [7]. В недавно проведенных исследованиях было установлено, что у пациентов с ОП кальцификация аорты имеет место чаще, чем у лиц с нормальной МПК [8][9]. Также выявлено, что у пациентов со снижением показателей МПК чаще повышена концентрация липидов (глицеролипиды, глицерофосфолипиды, сфинголипиды) в крови, развивается более тяжелый АС КА, значительно увеличивается риск развития инсульта и инфаркта миокарда (ИМ) [10][11]. Приведенные данные позволяют предположить, что нарастание частоты ОП, эктопической кальцификации и АС у одних и тех же пациентов может указывать на общие патофизиологические механизмы и, возможно, общие генетические детерминанты у этих заболеваний.
В последнее десятилетие были выполнены различные исследования, и предложены оригинальные подходы для выявления генов, отвечающих за развитие АС и ОП. Полногеномный анализ связей (genome-wide linkage analysis — GWLA) является классическим подходом для идентификации генов, вызывающих моногенные заболевания; однако он недостаточно эффективен при сложных полигенных заболеваниях, какими являются АС и ОП. Напротив, полногеномный поиск ассоциаций (genome-wide association study — GWAS) позволяет успешно определять множество генетических маркеров, связанных с АС и ОП. Именно с помощью GWAS можно идентифицировать частые генетические варианты, которые вносят существенный вклад в развитие распространенных мультифакториальных заболеваний. Другой альтернативный подход, секвенирование всего генома (whole genome sequencing — WGS), позволяет обнаруживать необычные и редкие генетические варианты при ОП и АС [12].
Цель данного обзора — описание генов, связанных с риском развития АС, артериальной кальцификации и ОП, а также предоставление информации о современном понимании общих генетических основ формирования атеросклеротической бляшки, отложения депозитов кальция в сосудистой стенке и снижения костной массы. Обзор адресован практикующим врачам для разъяснения различных ассоциаций и механизмов, которые ведут к сочетанной патологии, с применением генетики.
Материал и методы
Проведен поиск литературных источников и анализ публикаций в базах данных PubMed, Medline, Web of Science и Cochrane Library с использованием ключевых слов “генетика и атеросклероз”, “генетика и сосудистая кальцификация”, “генетика и остеопороз”, “связь сосудистой кальцификации с остеопорозом”, “связь атеросклероза с остеопорозом”. Глубина поиска составила >20 лет, начиная с 2000г.
Гены, ассоциированные со снижением костной массы и развитием переломов
В конце прошлого столетия было показано, что МПК является наследственным признаком. Исследования сибсов, страдающих ОП, продемонстрировали, что именно генетические факторы объясняют 60-85% индивидуальной изменчивости МПК [13]. Кроме того, риск перелома, обусловленный хрупкостью кости, по-видимому, имеет генетический компонент, поскольку в эпидемиологических исследованиях семейный анамнез переломов независимо от МПК ассоциировался с повышенной вероятностью перелома [14]. Можно предположить, что если наследуемость переломов не зависит от МПК, то вероятнее всего, она обусловлена другими факторами, такими как геометрия кости, метаболизм костной ткани или риск падений. Было продемонстрировано, что другие характеристики прочности костной ткани, такие как скорость проведения ультразвука или широковолновое затухание ультразвуковой волны, геометрия шейки бедра (ШБ), диапазон маркеров ремоделирования костной ткани, также находятся под контролем генетических факторов [15].
Выделяют как моногенные, так и полигенные формы ОП [16, 17]. Моногенные формы ОП связаны, в основном, с другими врожденными заболеваниями скелета, сопровождающимися снижением костной массы, такими как несовершенный остеогенез, обусловленный мутациями в генах COL1A1, COL1A2, CRTAP, P3H1 (LEPRE1), PPIB, FKBP10, IFITM5, PLOD2, SERPINF1, SERPINH1, SP7, аутосомно-доминантный гипофосфатемический рахит (мутация FGF-23), скелетная дисплазия (мутация SGMS2), гипофосфатазия (мутация TNSALP/ ALPL), витамин D-зависимый рахит (мутация СYP3A4), псевдопаратиреоидизм 1 и 2 типа (мутация GNAS), аутосомно-рецессивный гипофосфатемический рахит с гиперкальциурией (мутация DMP1, ENPP), синдром остеопороз-псевдоглиома (мутация LRP5), ювенильная болезнь Педжета (мутация TNFRSF11B), Х-сцепленная мутация PHEX), Х-сцепленный ОП (мутация PLS3), митохондриальная энцефаломиопатия с лактоацидозом и инсультоподобными эпизодами (митохондриальный геном), синдром Kearns-Sayre (митохондриальный геном), полиостеогенная фиброзная дисплазия (мутация GNAS) [16].
Первичный генерализованный ОП — мультифакториальное гетерогенное заболевание, при котором нет единственного гена, ответственного за развитие клинической картины, и для манифестации заболевания необходимо наличие множества аллелей риска в генах, ассоциированных с ОП. В настоящее время известно ~200 генных локусов, ассоциированных с ОП. Большинство исследований в масштабе всего генома было посвящено поиску ассоциаций генов с основным суррогатным маркером ОП — МПК. Они включают в себя гены, участвующие в регуляции костного и кальциевого обменов, такие как гены, кодирующие кальциотрофные и половые гормоны и их рецепторы, белки костного матрикса, цитокины, канонический Wnt — сигнальный путь, факторы роста и местные медиаторы и их рецепторы [18]. Оказалось, что снижение МПК в разных участках скелета контролируется разными генами. Было выявлено 14 из 35 исследуемых генов, ассоциированных с МПК ШБ, которые кодируют следующие белки: ZBTB40 — белок Zn-палец и домен BTB, содержащий белок 40; SHFM1 — субъединицу DSS1 26S протеасомного комплекса; WNT3 и WNT9В — сигнальные белки Wnt-3 и Wnt-9В, соответственно; ESR1 — эстрогеновый рецептор α; GPRC5C — рецептор, связанный с G-белком класс C, член C группы 5; CKAP5 — цитоскелет-ассоциированный белок 5; TSR1 — фактор созревания рибосом TSR1; CD63 — мембранный белок семейства тетраспанинов; TRAM1 — связанный с транслокацией мембранный белок 1; RC3H1 — домены безымянного пальца и CCCH 1 типа; FGFRL1 — рецептор фактора роста фибробластов 1; RAPGEF — белок, связывающий циклический аденозинмонофосфат; LOC286190 — неохарактеризованный LOC, и 19 из 53 генов, ассоциированных с МПК позвоночника, которые кодируют следующие белки: ZBTB40, SHFM1, ESR1, SPTBN1 — спектрин-β, неэритроцитарный 1; CD63; GAL — галактозный фактор транскрипции; ITGA7 — субъединицу интегрина-α 7; SARNP — SAP-домен содержащий рибонуклеопротеин; гены HOXB1, HOXB9, HOXB5, HOXB3, HOXB4 кодируют гомеобоксные белки Нох-В1, Нох-В9, Нох-В5, Нох-В3 и Нох-В4, соответственно; RPS24 — кодирует рибосомальный белок S24; LOC100134368 — неохарактеризованный LOC; IGHMBP2 — иммуноглобулин mu ДНК-связывающий белок 2; ZNF652 — Zn-палец-белок 652; PHB — прохибитин; BLOC1S1 — биогенез 1 субъединицы 1 комплекса связанных с лизосомами органелл [19].
Гены, ассоциированные с развитием АС и сосудистой кальцификации
Наследуемость ССЗ, обусловленных АС, варьирует от 40 до 60%, следовательно, примерно половина случаев заболевания в популяции может быть объяснена генетическими факторами.
Применение GWAS позволило идентифицировать множество генетических локусов, связанных с ишемической болезнью сердца (ИБС) (163 локуса) [20], и ФР, такими как сахарный диабет (243 локуса) [21], артериальная гипертензия, дислипидемия (ДЛП), абдоминальное ожирение и др. Все эти патологии оказывают влияние на минеральный обмен и подавляют механизмы, препятствующие образованию депозитов кальция в интиме или медии сосудистой стенки. Больше всего исследований проведено по поиску ассоциаций МПК с сосудистой кальцификацией и ДЛП. Фосфат кальция в форме гидроксиапатита (Ca10(PO4)6(OH)2) — основной компонент костной ткани. Эти кристаллы растут из везикул, продуцируемых остеобластами, и играют важную роль в формировании костной ткани. Васкулярные гладкомышечные клетки (ГМК) могут также секретировать подобные везикулы и способствовать образованию гидроксиапатита и его эктопическому отложению в сосудистой стенке, что получило название сосудистой кальцификации. В геноме человека обнаружено несколько локусов, связанных с наличием кальцификации КА и АС, которые суммированы в таблице 1.
Таблица 1
Гены, ассоциированные с васкулярной кальцификацией, в зависимости от механизма действия

Примечание: CCR2 — рецептор хемокина 2 типа, ACE — ангиотензинпревращающий фермент, ELAM-1 — эндотелиальная молекула адгезии лейкоцитов-1, или Е-селектин, EPHX2 — эпоксидгидролаза 2, GPx-1 — глютатионпероксидаза 1, MMP3 — матриксная металлопротеиназа 3, BMP — костный морфогенетический белок, MGP — матриксный гликопротеин, CALU — калуменин, VKORC1 — cубъединица 1 комплекса эпоксидредуктазы витамина К.
ДЛП является важным ФР АС и ее участие обсуждается в патогенезе ОП. В настоящее время, с применением технологии GWAS, выявлены гены, частые и редкие мутации в которых связаны с развитием моногенных и полигенных ДЛП и преимущественно ассоциированны с повышенными уровнями ХС липопротеинов низкой плотности (ЛНП) и/или триглицеридов (ТГ), и риском ИБС (таблица 2). Моногенные заболевания представляют собой наиболее яркие образцы влияния мутаций генов на повышение уровня ХС ЛНП в плазме крови и на развитие АС. К ним, в первую очередь, относятся семейная гиперхолестеринемия, развитие которой связано с мутациями в любом одном из четырех генов: LDLR, APOB, PCSK9, LDLRAP1; моногенные гипертриглицеридемии, связанные с мутациями в генах LPL, APOC2, APOA5, и целый ряд других моногенных ДЛП, связанных с мутациями в генах: APOC3, ANGPTL3, ANGPTL4, LRP6, LIPA, SLC25A40 [22][23]. Тем не менее, при хронических неинфекционных заболеваниях идентифицировать моногенные детерминанты невозможно, поскольку проявления этих заболеваний связаны с белками, кодируемыми несколькими основными генами. Успех в изучении наследственных факторов распространенных форм АС был достигнут благодаря исследованиям геновкандидатов, как in vitro, так и in vivo.
Таблица 2
Гены, связанные с ДЛП и риском ИБС
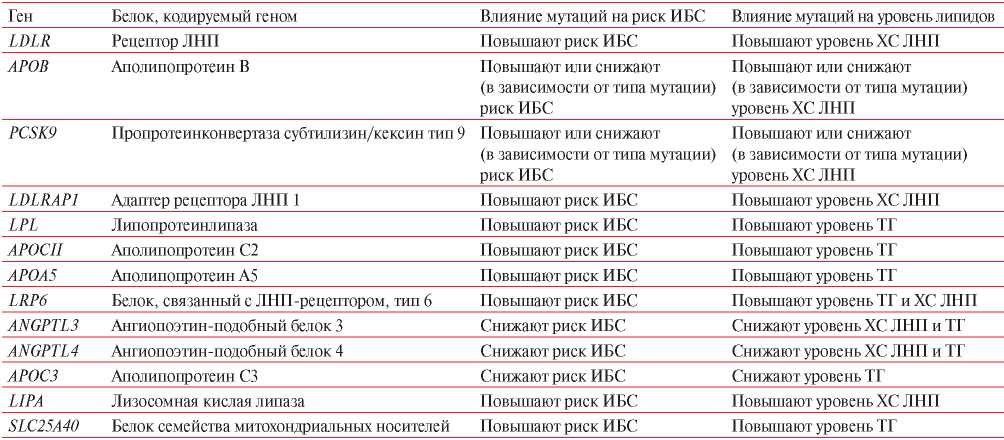
Примечание: ИБС — ишемическая болезнь сердца, ЛНП — липопротеины низкой плотности, ТГ — триглицериды, ХС — холестерин.
Общие гены-кандидаты для ОП и АС по данным ассоциативных исследований
Можно выделить общие генные локусы, ассоциированные как с ОП, так и АС в исследованиях генов-кандидатов и GWAS. К ним относятся геныкандидаты, кодирующие факторы, вовлеченные в патогенез этих заболеваний: цитокины, белки, участвующие в ремоделировании костной ткани и миокарда, рецепторы и т.д. В контексте сочетанной патологии обсуждались полиморфизмы следующих генов: интерлейкина 6 (IL6), рецептора витамина D (VDR), остеопротегерина (OPG), WNTсигнального пути (WNT16), ЛНП-рецептор связанного белка 6 (LRP 6), аполипопротеина Е (APOE), коллагена 1 типа (COL1A), кальций-чувствительного рецептора (CASR) и рецепторов, вовлеченных в гомеостаз кальция, ароматазы (CYP19A1), трансмембранного белка Клото (klotho) [24].
Ген рецептора витамина D (VDR)
Одним из многообещающих генов-кандидатов сочетанной патологии ОП и АС является ген рецептора витамина D (VDR) — витамина, который играет важную роль в регуляции гомеостаза кальция и метаболизма костей, с одной стороны, и в росте ГМК сосудов и возможно, в нестабильности и кальцификации АБ и сосудистой стенки, с другой. В последнее время полиморфизмы гена VDR, такие как VDR ApaI, VDR BsmI, VDR Cdx2, VDR FokI и VDR TaqI, получают все большее признание, поскольку в многочисленных исследованиях была подтверждена их связь с несколькими заболеваниями [25].
Большой объем опубликованных данных об этом гене и противоречивые результаты обусловили интерес, который в настоящее время сосредоточен на метаанализах, а не только на исследованиях отдельных ассоциаций гена VDR с МПК и переломами. Метаанализ гаплотипов, проведенный Thakkinstian A, et al. (2004), показал, что однонуклеотидные полиморфизмы (ОНП) VDR не были в значительной степени связаны с ОП, в то время как с гаплотипами Bat и BAt была выявлена достоверная связь, что демонстрирует важность исследований гаплотипов, а не отдельных ОНП [26]. В базе данных научного консорциума Genomos, включившем 26242 участника (18405 женщин) европеоидной расы, была оценена связь полиморфизмов Cdx2, FokI, BsmI, ApaI и TaqI с МПК ШБ, поясничного отдела позвоночника (ПОП) и переломами. Ассоциации полиморфизма TaqI с вариациями МПК или переломами не были доказаны, в то время как аллель А полиморфизма Cdx2 оказалась связанной с низким риском переломов позвонков [27].
В метаанализе, охватившем 58 исследований, изучали ассоциации между полиморфизмами гена VDR (VDR ApaI, VDR BsmI, VDR Cdx2, VDR FokI и VDR TaqI) и восприимчивостью к МПК и ОП у женщин в постменопаузе. Была продемонстрирована достоверная корреляция между полиморфизмами VDR ApaI, VDR FokI и развитием постменопаузального ОП. Анализ подгрупп показал, что полиморфизм VDR ApaI ассоциирован со снижением риска ОП у женщин европеоидной расы в постменопаузе. В азиатских популяциях полиморфизмы VDR BsmI и VDR FokI были связаны с повышенным риском постменопаузального ОП. Оказалось, что различные полиморфизмы гена VDR по-разному влияют на риск постменопаузального ОП и МПК, связь между полимофизмом VDR и костной массой довольно слабая и клиническое влияние этих вариантов остается неуточненным [28].
Таким образом, полиморфизмы VDR могут быть связаны с риском развития ССЗ. Генотип bb связан с низким уровнем циркулирующей активной формы витамина D (кальцитриола) и позиционирован как предиктор ИБС [29], что согласуется с представлениями об обратной связи между уровнем циркулирующего кальцитриола и наличием ИБС. Генетическая связь между полиморфизмом VDR и риском ИБС не была подтверждена исследованием в китайской популяции [30]. Однако в недавнем метаанализе, объединившем 7 исследований с участием 2306 человек и 4151 человек контрольной группы, было показано, что полиморфизм Fok1 может играть защитную роль при ИБС, а возможная защитная роль в генотипе СА Apa1 у пациентов с ИБС все еще нуждается в дополнительных исследованиях для подтверждения. В группе европеоидов обнаружена ассоциация с риском развития ИБС у носителей полиморфизмов Taq1, Apa1, Bsm1 [31].
Гены эстрогенных рецепторов альфа- и бета- (ESR1 и ESR2)
Эстрогены оказывают важное влияние на накопление и поддержание костной массы, поскольку рецепторы к эстрогенам обнаружены как на остеобластах, так и остеокластах. Большинство исследований было сосредоточено на микросателлите (TA) n в регуляторной области гена и на полиморфизме PvuII (также известном как c.454-397T>C или rs2234693) и XbaI (rs9340799) в интроне 1 гена ESR1. Однако результаты этих исследований оказались противоречивыми, что свидетельствовало о необходимости проведения крупномасштабных исследований и стандартизации методов. По результатам метаанализа Ioannidis J, et al. (2002), в который было включено 30 публикаций с участием 5834 женщин, было показано, что генотип ХХ ассоциировался с высокой МПК в ПОП и проксимальном отделе бедра, в то время как для полиморфизма PvuII никаких ассоциаций не выявлено [32]. В дальнейшем эти же авторы у носителей этого генотипа выявили снижение риска всех переломов на 19%, переломов позвонков на 35%. При этом ассоциации полиморфизмов с МПК оказались недостоверными.
В исследовании, проведенном Масловой К.А. и др. (2008) по анализу влияния полиморфизмов генов ESR1 и ESR2 на МПК в группах здоровых женщин в постменопаузальном периоде и имеющих ОП, было обнаружено накопление гомозиготного генотипа PP в группе ОП, генотипа xxppRR в группе ОП, а также генотипа xxPpRR в группе здорового контроля [33]. Относительный риск заболеть ОП для носителей генотипа xxppRR составил 3,7.
Ген ESR2 менее изучен в отношении связи с ОП, поскольку его роль в метаболизме костной ткани еще полностью не раскрыта и он, повидимому, играет роль в опосредовании эффекта эстрогена на рост и размер костей, но не на МПК. В крупном китайском исследовании случай-контроль, в котором приняли участие 752 пары, было изучено 12 ОНП гена ESR2 [34]. Статистически значимая ассоциация с МПК и риском переломов наблюдалась для Т1213С полиморфизма. У женщин-носителей аллеля С были отмечены низкие значения МПК позвоночника и бедра, и риск остеопорозных переломов возрастал в 2,2 раза вне зависимости от показателей МПК.
В недавнем метаанализе, проведенном Zhu H, et al. (2018) и охватившем 28 исследований, было показано, что каждый полиморфизм генов ESR1 и ESR2 может по-разному влиять на риск постменопаузального ОП и МПК у разных этнических групп [35]. Не наблюдалось значимой связи между полиморфизмами ESR1 XbaI, ESR PvuII и восприимчивостью к постменопаузальному ОП ни в целом, ни конкретно в европеоидной или в азиатской популяциях. В то же время ОНП G2014A был достоверно связан со снижением риска постменопаузального ОП в европейских популяциях, а ESR2 RsaI — как в общей популяции, так и среди азиатов. Женщины европеоидной расы с генотипами ESR1 XbaI XX и Xx имели более высокое значение Z-критерия (стандартное отклонение выше или ниже среднего показателя МПК у здоровых мужчин и женщин в возрасте 20-29 лет) ПОП, чем женщины с генотипом xx. Генотип ESR1 XbaI XX был связан с увеличением МПК в ШБ в общей популяции и европеоидной расе, повышением Z-критерия ШБ у азиатов и понижением Z-критерия ШБ у европеоидов. Также наблюдалась достоверная связь между генотипом ESR1 XbaI Xx и повышенным Z-критерием ШБ у азиатов и европеоидов. Генотип ESR1 PvuII PP был связан с низким значением МПК по Z-критерию в ПОП у европеоидов и низким Z-критерием в ШБ у азиатов. Генотип Pp у женщин с постменопаузальным ОП значимо коррелировал с низкой МПК ПОП в общей популяции, низким значением Z-критерия ШБ как в целом, так и в европеоидной и азиатской популяциях.
Эстрогены обладают сосудорасширяющим, противовоспалительным и антипролиферативным действием на сердечно-сосудистую систему и обеспечивают защиту от ИБС у женщин в постменопаузе. Lu H, et al. (2002) связали новый ОНП — 1989T/G в промоторе B ESR1 с риском ИБС, сделав вывод, что генотип GG может быть независимым предиктором ИБС у пациентов с семейной гиперхолестеринемией [36]. Кроме того, количество повторов (>17) (TA)n в регуляторной области ESR1 было значительно выше у женщин в постменопаузе с ИБС, чем у женщин без ИБС, но не у мужчин. Также известно, что полиморфизмы ESR1 PuII и XbaI могут влиять на тяжесть течения ИБС у женщин. Обнаружена ассоциация аллеля C PvuII и аллеля G XbaI с большим количеством пораженных артерий, выявляемых при коронароангиографии [37].
В метаанализе, включившем 10 контролируемых исследований, было показано, что генотип СС полиморфизма ESR1 PuII значимо связан с повышенным риском ИБС в китайской популяции [38]. В более крупном метаанализе (21 рандомизированное клиническое исследование), подтвердили взаимосвязь между полиморфизмом ESR1 PvuII и риском ИБС [39], но при стратификации по регионам значимая связь между полиморфизмом ESR1 PuII и риском ИБС наблюдалась только в азиатских популяциях, не распространяясь на европеоидов.
Ген α1 коллагена типа I (COLIA1)
Ген COLI1A1 кодирует цепь α1 коллагена I типа, который является основным белковым компонентом внеклеточного матрикса кости и, тем самым, влияет на риск ОП. Большинство исследований посвящено изучению ОНП +1245G>T (rs1800012), и -1997G>T (rs1107946) [40]. Генотип ss (T/T) связывают со снижением МПК, увеличением возрастной потери костной массы, нарушением способности остеобластоподобных клеток к эктопической минерализации in vitro, с аномалиями минерализации кости in vivo и более высоким риском переломов из-за изменения плотности и качества кости. Аллель T связан с аномально повышенным синтезом α1 цепи коллагена I, вызывающим дисбаланс между α1 и α2 цепями и снижением прочности кости и минерализации костного матрикса [41].
Один из метаанализов показал, что разные аллели Sp1 связаны с умеренными вариациями МПК, но со значительными изменениями риска переломов [42]. В недавнем крупном метаанализе было продемонстрировано, что в общей популяции женщин и женщин в постменопаузе ОНП +1245G>T (rs1800012) тесно связан с МПК ПОП и ШБ. Аллель s коррелировал со снижением МПК на этих участках, в то время как аллель S, наоборот, был связан с увеличением МПК. Не было отмечено значимых различий в показателях МПК ПОП и ШБ между двумя гомозиготными генотипами GG и TT полиморфизма -1997G>T (rs1107946), однако женщины с генотипом GT имели повышенный риск развития ОП [43].
Обнаружена связь гена COL1A1 и с ССЗ, т.к. доказано, что мутация гена COL1A1 приводит к синтезу дефектного белка, снижающего продолжительность жизни ГМК сосудов, способствуя ускоренному сосудистому старению за счет стрессиндуцированной гиперактивации β-галоктозидазы [44]. Известно, что сосудистое ремоделирование сопровождается развитием эндоваскулярного соединительнотканного матрикса вследствие активации фибробластов [45]. Гомозиготный генотип гена COL1A1 ассоциирован с образованием полноценной α-1 цепи коллагена I типа, который принимает участие в развитии соединительной ткани сосудистой стенки, поддерживая, тем самым, ее ремоделирование [44].
Ген трансформирующего фактора роста β1 (TGF-β1)
Ген TGF-β1 рассматривается как ген-кандидат, ответственный за качество костной массы и риск переломов [46]. Белок TGF-β1 продуцируется остеобластами и подавляет пролиферацию и активность остеокластов, а также стимулирует пролиферацию и дифференцировку преостеобластов. Основные исследованные ОНП гена TGF-β1 локализуются в регуляторной области (-1348C/T и -509C/T) и в экзоне 1 (29T/C Leu10Pro и 74G/C Arg25Pro). В ряде исследований были получены противоречивые результаты по связи гена с вариацией МПК и/или риском переломов, вследствие хрупкости костной ткани [47], однако ни в одном из них эффекты гаплотипов TGF-β1 не исследовались.
В рамках исследований консорциума Genomos был проведен стандартизованный анализ с включением 28924 участников из 10 европейских центров по генотипированию пяти ОНП гена TGF-β1, расположенных в экзонах 1 и 5 [48]. Однако ни у мужчин, ни и у женщин не было продемонстрировано ассоциации этих полиморфизмов или гаплотипов с вариациями МПК ПОП и ШБ и риском переломов. Обнаружена лишь слабая ассоциация между носителями редкого аллеля 788T ОНП 788C/T (Thr263Ile) в экзоне 5 и риском возникновения переломов позвонков.
Изучено влияние TGF-β1 и на сердечно-сосудистую систему. Он принимает участие в процессе сосудистого ремоделирования, ангиогенезе, иммунном ответе и воспалении. Хотя роль TGF-β1 в патогенезе АС признается, связь между концентрацией TGF-β1 в плазме крови и риском ИБС прослеживается не всегда [49]. Полиморфизм Arg25Pro в экзоне 1 был связан с различным риском эссенциальной гипертензии у этнических русских, с риском ИМ или артериальной гипертензии у пациентов европеоидной расы, но не коррелировал между этим полиморфизмом и риском ИМ и инсульта, тяжестью ИБС у пациентов из Австралии. Полиморфизм Leu10Pro в экзоне 1 был связан с предрасположенностью к ИМ в популяции из Японии. В метаанализе Lu Y, et al. (2012) показано, что риск ИБС у носителей минорных аллелей двух генетических вариантов (rs1800469 и rs1982073) в TGF-β1 выше на 15% [50].
Гены белков, связанных с рецептором ЛПН, 5 и 6 типов (LRP5 и LRP6)
Белок LRP5 и родственный ему гомолог LRP6 действуют как ко-рецепторы для передачи сигналов через канонический Wnt-сигнальный путь, который контролирует активность остеобластов и формирование костной ткани. Общие варианты генов LRP5 и LRP6 играют важную роль в метаболизме костной ткани, в связи с чем они были предложены как кандидатные гены ОП. В частности, в исследовании Ferrari SL, et al. (2004) была обнаружена связь между заменой 2047 G/A (V667M) в экзоне 9 и МПК ПОП и ростом мужчин, но не женщин [51]. При анализе роли четырех ОНП гена LRP5 и одного ОНП гена LRP6 в изменении МПК, геометрии кости и риска переломов было обнаружено, что аллель 1330Val (ОНП A1330V или rs3736228) гена LRP5 был связан со снижением МПК в ПОП и ШБ, а также с уменьшением тел позвонков и ширины ШБ у мужчин. У мужчин-носителей аллелей 1330Val и 1062Val риск переломов из за хрупкости был на 60% выше, чем у мужчин с отсутствием данных аллелей. В метаанализе Canto-Cetina T, et al. (2013), которые изучили влияние ОНП rs3736228 гена LRP5 на показатели МПК различных участков скелета у женщин в постменопаузе, были подтверждены результаты более ранних исследований, свидетельствующих, что лица с генотипом АА полиморфизма A1330V гена LRP5 имеют значительно более высокие показатели МПК ШБ и ПОП, чем обладатели AV и VV аллелей [52]. Метаанализ, объединивший результаты 19 исследований (n=25773), продемонстрировал, что лица с генотипом АА полиморфизма A1330V гена LRP5 по сравнению с остальными имеют более высокие показатели МПК в ПОП (на 200 мг/см2) и ШБ (на 100 мг/см2) [53]. При обследовании 1043 женщин без переломов (возраст 51-90 лет) и 394 женщин с переломами ШБ (возраст 60-90 лет) были обнаружены ассоциации ОНП в генах LRP5 (rs4988321) и LRP6 (rs11054704, rs2302685, rs10845493) с низкими значениями МПК и переломами позвонков [54]. В то же время достоверных ассоциаций ОНП гена LRP6 с переломами бедра получено не было.
Из базы консорциума Genomos у 37534 человек европеоидной расы из Европы и Северной Америки была проанализирована связь ОНП V667M и A1330V гена LRP5 и ОНП I1062V гена LRP6 с МПК, измеренной с помощью рентгеновской денситометрии, и риском переломов [55]. Аллели M667 и V1330 были связаны со снижением МПК позвоночника и ШБ и с повышенным риском переломов позвонков.
В последнее время накапливаются данные о генетической связи LRP6 с ранней ИБС и гиперхолестеринемией. У пациентов с ИБС было выявлено пять мутаций (K82N, S488Y, P1066T, P1206H и I1264V) в гене LRP6, которые могут способствовать развитию ИБС за счет значительного снижения как уровня белка LRP6, так и сигнальной активности Wnt [56]. Sarzani R, et al. (2011) показали, что полиморфизм rs2302685 гена LRP6 был тесно связан с АС сонных артерий у пациентов с артериальной гипертензией [57].
Ген ароматазы (CYP19A1)
Фермент ароматаза катализирует превращение андрогенов в эстрогены. Инактивирующие мутации гена CYP19A1 были связаны у обоих полов с повышением метаболизма костной ткани и, как следствие, со снижением МПК [58].
Полиморфизм в интроне IV в виде микросателлитных (TTTA)n повторов был связан с риском ОП. Анализ ОНП в когорте итальянских женщин в постменопаузе ассоциировал аллель (TTTA)12 с защитным действием против развития ОП. Женщины с бóльшим количеством повторов ОНП (>11) показали более высокие значения МПК в ПОП, чем женщины с низким количеством повторов (от 8 до 11). Однако молекулярный механизм, который может объяснить связь между активностью ароматазы и (TTTA)n повторами, до сих пор неизвестен.
Показана ассоциация гена CYP19A1 с развитием гипертонической болезни. Исследование Shimodaira M, et al. (2008) обнаружило связь между ОНП rs700518 и rs10046, а также гаплотипом, сцепленным с ОНП rs1870049 и rs10046 гена CYP19A1, с вариациями систолического и диастолического артериального давления [59]. Интересно, что ОНП rs700518 и rs10046 у лиц из группы риска по гипертонической болезни были обратно связаны с полом, что предполагает возможность использования их в качестве генетических маркеров гендерно-зависимого риска эссенциальной гипертензии. В исследовании Letonja M, et al. (2005) авторы пришли к выводу, что у субъектов европеоидной расы ОНП повторов (TTTA)n не влияет на генетическую предрасположенность к ИБС [60]. Bampali K, et al. (2015) провели обследование 189 мужчин и женщин, которые показали, что у мужчин ОНП rs10046 (C/T) гена CYP19A1 коррелирует с ИБС, и, что носители аллеля C имеют более высокую вероятность развития заболевания [61].
Ген интерлейкина 6 (IL6)
Определенный интерес в роли гена-кандидата представляет ген IL6, кодирующий цитокин, который принимает непосредственное участие в костном метаболизме и ССЗ. Белок IL-6 участвует в развитии иммунного ответа, запуская острую фазу воспаления, и во многих других процессах, протекающих в организме. Встречаемость аллеля С в популяции составляет 42%. Была показана ассоциация ОНП G174C в регуляторной зоне гена IL6 с низкой костной массой, измеренной в лучевой кости у женщин в постменопаузе [62], высоким артериальным давлением и повышенным кардиоваскулярным риском у мужчин [63]. У носителей аллеля G ~ в 2 раза повышен уровень ТГ, ХС липопротеинов очень низкой плотности, свободных жирных кислот, по сравнению с носителями C-аллеля. Это дает основание считать, что ОНП G(-174)C может играть важную роль в патогенезе развития нарушений липидного обмена. Была отмечена ассоциация значительно повышенного уровня С-реактивного белка (до +79%) и маркеров резорбции кости (до +32%) с уменьшением числа IL-6 протективных аллелей: G(-572)C и G(-174)C. Чем меньше в генотипе защитных аллелей, тем сильнее была выражена тенденция к снижению МПК ПОП.
В качестве общих генов-кандидатов ОП и АС предлагались на рассмотрение гены кальций-чувствительного рецептора (CARS), WNT-сигналов (WNT16) и белка Клото, дефицит которых у мышей приводил к развитию коронарной болезни и снижению МПК. Но поскольку в исследованиях на людях было получено больше отрицательных результатов, интерес к ним снизился. К тому же ассоциации этих генов с ОП и АС, как и многих других, не были подтверждены с помощью GWАS. Из известных генов-кандидатов только у LRP6 и ESR1 были подтверждены устойчивые связи с клиническими проявлениями и ОП, и АС. Тем не менее, обнаружены новые гены с подтвержденными GWAS ассоциациями как с ОП, так и с АС, однако функция некоторых из них остается пока мало изученной. На сегодняшний день выделено >10 генов, контролирующих механизмы развития обоих заболеваний [12][20] (таблица 3).
Таблица 3
Общие гены, кодирующие факторы, участвующие в патогенезе ОП и АС


Примечание: Апо — аполипопротеин, АС — атеросклероз, ДЛП — дислипидемия, ДНК — дезоксирибонуклеиновая кислота, ИБС — ишемическая болезнь сердца, ИМ — инфаркт миокарда, МПК — минеральная плотность кости, ЛВП — липопротеины высокой плотности, ЛНП — липопротеины низкой плотности, ТГ — триглицериды, ХС — холестерин, цАМФ — циклический аденозинмонофосфат, ШБ — шейка бедра.
В настоящее время большое значение придается созданию шкал прогнозирования риска заболеваний с целью их раннего выявления и своевременного назначения терапии. Используемые шкалы оценки риска ССЗ и ОП (SCORE — Systematic Coronary Risk Evaluation и FRAX — Fracture Risk Assessment Tool) основаны на клинических ФР и не содержат генетической информации. Эти шкалы могут использоваться только у лиц >40 лет и не позволяют определять вероятность заболевания в более раннем возрасте. Поскольку генетические факторы в течение жизни не меняются, они могут быть оценены в раннем детстве, включение их в оценку риска частых мультифакториальных заболеваний, таких как ОП и АС, позволит начинать профилактику этих заболеваний уже с детского и подросткового возрастов и контролировать их развитие в дальнейшей жизни. Сегодня уже предпринимаются попытки усовершенствования шкал риска хронических заболеваний, использующих клинические показатели путем интеграции в них генетических маркеров.
Заключение
В заключение следует подчеркнуть, что, хотя неблагоприятные факторы окружающей среды, такие как нерациональное питание, курение, злоупотребление алкоголем и сопутствующие заболевания играют важную роль в развитии АС и ОП, генетические факторы являются определяющими ФР как ССЗ, обусловленных АС, так и переломов, связанных с хрупкостью костной ткани. Идентификация генетических факторов, ответственных за предрасположенность к развитию ССЗ и ОП, имеет фундаментальное значение для одновременной профилактики обоих заболеваний и создания новых методов лечения до возникновения сердечно-сосудистого события и перелома.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Institute of Medicine. 2010. Promoting Cardiovascular Health in the Developing World: A Critical Challenge to Achieve Global Health. Fuster K, Kelly BB, editors. Washington, DC: The National Academies Press. 2010; 482 p. doi:10.17226/12815. ISBN: 978-0-309-14774-3.
2. Townsend N, Wilson L, Bhatnagar P, et al. Cardiovascular disease in Europe: epidemiological update 2016. Eur Heart J. 2016;37(42):3232-45. doi:10.1093/eurheartj/ehw334.
3. Lampropolos CE, Papaioannou I, D’Cruz DP. Osteoporosis — a risk factor for cardiovascular disease? Nat Rev Rheumatol. 2012;8(10):587-98. doi:10.1038/nrrheum.2012.120.
4. Muniyappa R, Tella SH. Osteoporosis and Cardiovascular Disease in the Elderly. Conn’s Handbook of Models for Human Aging, 2nd Edition. 2018;4(53):721-33. doi:10.1016/B978-0-12-811353-0.00053-1.
5. Zhang Y, He B, Wang H, et al. Associations between bone mineral density and coronary artery disease: a meta-analysis of crosssectional studies. Arch Osteoporos. 2020;15(1):24. doi:10.1007/s11657-020-0691-1.
6. Алиханова Н. А., Скрипникова И. А., Ткачева О. Н. и др. Ассоциация параметров сосудистой жесткости и субклинического атеросклероза с костной массой у женщин в постменопаузе. Кардиоваскулярная терапия и профилактика. 2016;15(2):51-6. doi:10.15829/1728-8800-2016-2-51-56.
7. Rodríguez AJ, Scott D, Hodge A, et al. Associations between hip bone mineral density, aortic calcification and cardiac workload in community-dwelling older Australians. Osteoporos Int. 2017;28(7):2239-45. doi:10.1007/s00198-017-4024-1.
8. Rajamannan NM. Osteocardiology. Cardiac bone formation. London: Springer; 2018. ISBN: 978-3-319-64994-8.
9. Скрипникова И.А., Колчина М.А., Косматова О.В. и др. Оценка доклинических проявлений атеросклероза коронарных и периферических артерий и параметров костной прочности у женщин. Рациональная Фармакотерапия в Кардиологии. 2020;16(6):868-75. doi:10.20996/1819-6446-2020-11-02.
10. Mishra BH, Mishra PP, Mononen N, et al. Lipidomic architecture shared by subclinical markers of osteoporosis and atherosclerosis: The Cardiovascular Risk in Young Finns Study. Bone. 2020;131:115160. doi:10.1016/j.bone.2019.115160.
11. Dobnig H, Hofbauer L. Osteoporosis and atherosclerosis: common pathway. J Clin Endocrinol. 2009;2(3):12-6.
12. Yuan J, Tickner J, Mullin BH, et al. Advanced Genetic Approaches in Discovery and Characterization of Genes Involved with Osteoporosis in Mouse and Human. Front Genet. 2019;10:288. doi:10.3389/fgene.2019.00288.
13. Guéguen R, Jouanny P, Guillemin F, et al. Segregation analysis and variance components analysis of bone mineral density in healthy families. J Bone Miner Res. 1995;10(12):2017-22. doi:10.1002/jbmr.5650101223.
14. Andrew T, Antioniades L, Scurrah KJ, et al. Risk of wrist fracture in women is heritable and is influenced by genes that are largely independent of those influencing BMD. J Bone Miner Res. 2005;20(1):67-74. doi:10.1359/JBMR.041015.
15. Clark GR, Duncan EL. The genetics of osteoporosis. Br Med Bull. 2015;113(1):73-81. doi:10.1093/bmb/ldu042.
16. Hannan FM, Newey PJ, Whyte MP, et al. Genetics of skeletal disorders. Handbook of Experimental pharmocology. 2020;262. ISBN: 978-3-030-57377-5.
17. Robinson ME, Rauch F. Mendelian bone fragility disorders. Bone. 2019;126:11-7. doi:10.1016/j.bone.2019.04.021.
18. Миргалиева Р.Я., Хуснутдинова Э.К., Хусайнова Р.И. Генетические основы остеопороза. Медицинская генетика. 2018;17(7):3-10. doi:10.25557/2073-7998.2018.07.3-10.
19. Mo XB, Lu X, Zhang YH, et al. Gene-based association analysis identified novel genes associated with bone mineral density. PLoS One. 2015;10(3):e0121811. doi:10.1371/journal.pone.0121811.
20. Erdmann J, Kessler T, Munoz Venegas L, et al. A decade of genome-wide association studies for coronary artery disease: the challenges ahead. Cardiovasc Res. 2018;114(9):1241-57. doi:10.1093/cvr/cvy084.
21. Mahajan A, Taliun D, Thurner M, et al. Fine-mapping type 2 diabetes loci to single-variant resolution using high-density imputation and islet-specific epigenome maps. Nat Genet. 2018;50(11):1505-13. doi:10.1038/s41588-018-0241-6.
22. Meshkov A, Ershova A, Kiseleva A, et al. The LDLR, APOB, and PCSK9 Variants of Index Patients with Familial Hypercholesterolemia in Russia. Genes (Basel). 2021;12(1):66. doi:10.3390/genes12010066.
23. Чепетова Т. В., Мешков А. Н. Гипертриглицеридемия: этиология, патогенез, диагностика. Кардиоваскулярная терапия и профилактика. 2006;5(5):94-100.
24. den Uyl D, Nurmohamed MT, van Tuyl LH, et al. (Sub)clinical cardiovascular disease is associated with increased bone loss and fracture risk; a systematic review of the association between cardiovascular disease and osteoporosis. Arthritis Res Ther. 2011;13(1):R5. doi:10.1186/ar3224.
25. Qin G, Dong Z, Zeng P, et al. Association of vitamin D receptor BsmI gene polymorphism with risk of osteoporosis: a metaanalysis of 41 studies. Mol Biol Rep. 2013;40(1):497-506. doi:10.1007/s11033-012-2086-x.
26. Thakkinstian A, D’Este C, Eisman J, et al. Meta-analysis of molecular association studies: vitamin D receptor gene polymorphisms and BMD as a case study. J Bone Miner Res. 2004;19(3):419-28. doi:10.1359/JBMR.0301265.
27. Uitterlinden AG, Ralston CH, Brandi ML, et al. The association between common vitamin D receptor gene variations and osteoporosis: a participant–level metaanalysis. Ann Int Med. 2006;145(4):255-64. doi:10.7326/0003-4819-145-4-200608150-00005.
28. Zhang L, Yin X, Wang J, et al. Associations between VDR Gene Polymorphisms and Osteoporosis Risk and Bone Mineral Density in Postmenopausal Women: A systematic review and Meta-Analysis. Sci Rep. 2018;8(1):981. doi:10.1038/s41598-017-18670-7.
29. Van Schooten FJ, Hirvonen A, Maas LM, et al. Putative susceptibility markers of coronary artery disease: association between VDR genotype, smoking, and aromatic DNA adduct levels in human right atrial tissue. FASEB J. 1998;12(13):1409-17. doi:10.1096/fasebj.12.13.1409.
30. Pan XM, Li DR, Yang L, et al. No association between vitamin D receptor polymorphisms and coronary artery disease in a Chinese population. DNA Cell Biol. 2009;28(10):521-5. doi:10.1089/dna.2009.0908.
31. Lu S, Guo S, Hu F, et al. The Associations Between the Polymorphisms of Vitamin D Receptor and Coronary Artery Disease: A Systematic Review and Meta-Analysis. Medicine (Baltimore). 2016;95(21):e3467. doi:10.1097/MD.0000000000003467.
32. Ioannidis JP, Stavrou I, Trikalinos TA, et al. Association of polymorphisms of the estrogen receptor alpha gene with bone mineral density and fracture risk in women: a metaanalysis. J Bone Miner Res. 2002;17(11):2048-60. doi:10.1359/jbmr.2002.17.11.2048.
33. Маслова К. А., Крылов М. Ю., Торопцова Н.В. и др. Полиморфизмы генов эстрогеновых рецепторов α и β при постменопаузальном остеопорозе. Научно-практическая ревматология. 2008;46(3):16-22. doi:10.14412/1995-4484-2008-654.
34. Kung AWC, Lai BMH, Ng MYM, et al. T-1213C polymorphism of estrogen receptor beta is associated with low bone mineral density and osteoporotic fractures. Bone. 2006;39(5):1097-106. doi:10.1016/j.bone.2006.04.029.
35. Zhu H, Jiang J, Wang Q, et al. Associations between ERα/β gene polymorphisms and osteoporosis susceptibility and bone mineral density in postmenopausal women: a systematic review and meta-analysis. BMC Endocr Disord. 2018;18(1):11. doi:10.1186/s12902-018-0230-x.
36. Lu H, Higashikata T, Inazu A, et al. Association of estrogen receptor-alpha gene polymorphisms with coronary artery disease in patients with familial hypercholesterolemia. Arterioscler Thromb Vasc Biol. 2002;22(5):817-23. doi:10.1161/01.atv.0000014424.18209.21.
37. Alevizaki M, Saltiki K, Cimponeriu A, et al. Severity of cardiovascular disease in postmenopausal women: associations with common estrogen receptor alpha polymorphic variants. Eur J Endocrinol. 2007;156(4):489-96. doi:10.1530/EJE-06-0685.
38. Wei CD, Zheng HY, Wu W, et al. Meta-analysis of the association of the rs2234693 and rs9340799 polymorphisms of estrogen receptor alpha gene with coronary heart disease risk in Chinese Han population. Int J Med Sci. 2013;10(4):457-66. doi:10.7150/ijms.5234.
39. Ding J, Xu H, Yin X, Zhang FR, et al. Estrogen receptor α gene PvuII polymorphism and coronary artery disease: a metaanalysis of 21 studies. J Zhejiang Univ Sci B. 2014;15(3):243-55. doi:10.1631/jzus.B1300220.
40. Kostik MM, Smirnov AM, Demin GS, et al. Genetic polymorphisms of collagen type I α1 chain (COL1A1) gene increase the frequency of low bone mineral density in the subgroup of children with juvenile idiopathic arthritis. EPMA J. 2013;4(1):15. doi:10.1186/1878-5085-4-15.
41. Stewart TL, Roschger P, Misof BM et al. Association of COLIA1 Sp1 alleles with defective bone nodule formation in vitro and abnormal bone mineralization in vivo. Calcified Tissue International. 2005;77(2):113-8. doi:10.1007/s00223-004-0188-8.
42. Mann V, Ralston SH. Meta-analysis of COL1A1 Sp1 polymorphism in relation to bone mineral density and osteoporotic fracture. Bone. 2003;32(6):711-7. doi:10.1016/s8756-3282(03)00087-5.
43. Moradifard S, Hoseinbeyki M, Emam MM, et al. Association of the Sp1 binding site and -1997 promoter variations in COL1A1 with osteoporosis risk: The application of meta-analysis and bioinformatics approaches offers a new perspective for future research. Mutat Res. 2020;786:108339. doi:10.1016/j.mrrev.2020.108339.
44. Vafaie F, Yin H, O’Neil C, et al. Collagenase-resistant collagen promotes mouse aging and vascular cell senescence. Aging Cell. 2014;13(1):121-30. doi:10.1111/acel.12155.
45. Yu FY, Yang SC, Ji ES. The role of adventitia in hypoxic vascular remodeling. Sheng Li Xue Bao. 2018;70(2):211-6.
46. Cohen MM Jr. TGF beta/Smad signaling system and its pathologic correlates. Am J Med Genet A. 2003;116A(1):1-10. doi:10.1002/ajmg.a.10750.
47. McGuigan FE, Macdonald HM, Bassiti A, et al. Large-scale population-based study shows no association between common polymorphisms of the TGFB1 gene and BMD in women. J Bone Miner Res. 2007;22(2):195-202. doi:10.1359/jbmr.061016.
48. Langdahl BL, Uitterlinden AG, Ralston SH, et al. Largescale analysis of association between polymorphisms in the transforming growth factor beta 1 gene (TGFB1) and osteoporosis: the GENOMOS study. Bone. 2008;42(5):969-81. doi:10.1016/j.bone.2007.11.007.
49. Najar RA, Ghaderian SM, Panah AS. Association of transforming growth factor-β1 gene polymorphisms with genetic susceptibility to acute myocardial infarction. Am J Med Sci. 2011;342(5):365- 70. doi:10.1097/MAJ.0b013e318215908a.
50. Lu Y, Boer JM, Barsova RM, et al. TGFB1 genetic polymorphisms and coronary heart disease risk: a meta-analysis. BMC Med Genet. 2012;13:39. doi:10.1186/1471-2350-13-39.
51. Ferrari SL, Deutsch S, Choudhury U, et al. Polymorphisms in the low-density lipoprotein receptor-related protein 5 (LRP5) gene are associated with variation in vertebral bone mass, vertebral bone size, and stature in whites. Am J Hum Genet. 2004;74(5):866-75. doi:10.1086/420771.
52. Canto-Cetina T, Polanco Reyes L, González Herrera L, et al. Polymorphism of LRP5, but not of TNFRSF11B, is associated with a decrease in bone mineral density in postmenopausal MayaMestizo women. Am J Hum Biol. 2013;25(6):713-8. doi:10.1002/ajhb.22464.
53. Yi J, Cai Y, Yao Z, et al. Genetic analysis of the relationship between bone mineral density and low-density lipoprotein receptor-related protein 5 gene polymorphisms. PLoS One. 2013;8(12):e85052. doi:10.1371/journal.pone.0085052.
54. Riancho JA, Olmos JM, Pineda B, et al. Wnt receptors, bone mass, and fractures: gene-wide association analysis of LRP5 and LRP6 polymorphisms with replication. Eur J Endocrinol. 2011;164(1):123-31. doi:10.1530/EJE-10-0582.
55. van Meurs JB, Trikalinos TA, Ralston SH, et al. Large-scale analysis of association between LRP5 and LRP6 variants and osteoporosis. Journal of the American Medical Association. 2008;299(11):1277-90. doi:10.1001/jama.299.11.1277.
56. Xu Y, Gong W, Peng J, et al. Functional analysis LRP6 novel mutations in patients with coronary artery disease. PLoS One. 2014;9(1):e84345. doi:10.1371/journal.pone.0084345.
57. Sarzani R, Salvi F, Bordicchia M, et al. Carotid artery atherosclerosis in hypertensive patients with a functional LDL receptor-related protein 6 gene variant. Nutr Metab Cardiovasc Dis. 2011;21(2):150-6. doi:10.1016/j.numecd.2009.08.004.
58. Morishima A, Grumbach MM, Simpson ER, et al. Aromatase deficiency in male and female siblings caused by a novel mutation and the physiological role of estrogens. J Clin Endocrinol Metab. 1995;80(12):3689-98. doi:10.1210/jcem.80.12.8530621.
59. Shimodaira M, Nakayama T, Sato N, et al. Association study of aromatase gene (CYP19A1) in essential hypertension. Int J Med Sci. 2008;5(1):29-35. doi:10.7150/ijms.5.29.
60. Letonja M, Peterlin B, Bregar D, et al. Are the T/C polymorphism of the CYP17 gene and the tetranucleotide repeat (TTTA) polymorphism of the CYP19 gene genetic markers for premature coronary artery disease in Caucasians? Folia Biologica. 2005;51(3):76-81.
61. Bampali K, Grassos C, Mouzarou A, et al. Genetic Variant in the CYP19A1 Gene Associated with Coronary Artery Disease. Genet Res Int. 2015;2015:820323. doi:10.1155/2015/820323.
62. Garnero P, Borel O, Sornay-Rendu E, et al. Association between a functional interleukin-6 gene polymorphism and peak bone mineral density and postmenopausal bone loss in women: the OFELY study. Bone. 2002;31(1):43-50. doi:10.1016/s8756-3282(02)00810-4.
63. Humphries SE, Luong LA, Ogg MS, et al. The interleukin-6-174 G/C promoter polymorphism is associated with risk of coronary heart disease and systolic blood pressure in healthy men. Eur Heart J. 2001;22(24):2243-52. doi:10.1053/euhj.2001.2678.
Об авторах
И. А. СкрипниковаРоссия
Скрипникова Ирина Анатольевна — доктор медицинских наук, руководитель отдела профилактики остеопороза
Москва
M. А. Колчина
Россия
Колчина Мария Александровна — младший научный сотрудник отдела профилактики остеопороза
Москва
А. Н. Мешков
Россия
Мешков Алексей Николаевич — кандидат медицинских наук, руководитель лаборатории молекулярной генетики
Москва
А. В. Киселева
Россия
Киселева Анна Витальевна — кандидат биологических наук, старший научный сотрудник лаборатории молекулярной генетики
Москва
О. М. Драпкина
Россия
Драпкина Оксана Михайловна — доктор медицинских наук, профессор, член-корреспондент РАН, директор
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Скрипникова И.А., Колчина M.А., Мешков А.Н., Киселева А.В., Драпкина О.М. Артериальная кальцификация, атеросклероз и остеопороз: только клинические ассоциации или генетическая платформа? Кардиоваскулярная терапия и профилактика. 2021;20(7):3034. https://doi.org/10.15829/1728-8800-2021-3034
For citation:
Skripnikova I.A., Kolchina M.A., Meshkov A.N., Kiseleva A.V., Drapkina O.M. Arterial calcification, atherosclerosis and osteoporosis: only clinical associations or a genetic platform? Cardiovascular Therapy and Prevention. 2021;20(7):3034. (In Russ.) https://doi.org/10.15829/1728-8800-2021-3034
JATS XML

























































