Перейти к:
Создание коллекции биологических образцов разного типа, полученных от пожилых пациентов, для изучения взаимосвязей клинических, системных, тканевых и клеточных биомаркеров накопления сенесцентных клеток при старении
https://doi.org/10.15829/1728-8800-2021-3051
Аннотация
При старении происходит нарушение способности организма поддерживать гомеостаз тканей и их эффективного восстановления после повреждений путем сложно регулируемого баланса между гибелью и обновлением клеток. Показано, что это может быть связано с избыточным накоплением в различных тканях сенесцентных (СК), или стареющих, клеток, что приводит к активации хронического асептического воспаления, дисфункции тканей и, в итоге, к развитию возраст-ассоциированных заболеваний. Для оценки вклада СК в развитие старения организма человека и патогенез таких заболеваний ведется поиск их релевантных биомаркеров. Для успешной трансляции в клиническую практику подходов, направленных на регуляцию содержания СК в различных тканях, необходимо изучение взаимосвязей между установленными клиническими биомаркерами старения и развития возраст-ассоциированных заболеваний, системными показателями старения и биомаркерами СК на тканевом и клеточном уровнях.
Цель. Разработка и описание алгоритмов действий для создания биобанка образцов, полученных от пациентов в возрасте >65 лет, в целях изучения биомаркеров накопления СК.
Материал и методы. Для сбора образцов была выстроена система взаимодействия между несколькими научными, клиническими и инфраструктурными подразделениями многопрофильного медицинского центра. На этапе преаналитической подготовки были разработаны нормативно-правовые акты, в т.ч. информированные согласия для пациентов, а также протоколы для каждого этапа исследования.
Результаты. Сформирована дорожная карта с разработанными алгоритмами действий для всех участников исследования, удобной и доступной системой аннотирования и хранения биологических образцов. К настоящему времени в коллекцию включены биологические образцы 7 различных типов (сыворотка периферической крови, образцы тканей, фиксированные в формалине и заключенные в парафиновые блоки, образцы разных типов клеток, выделенных из периферической крови, кожи и жировой ткани, образцы дезоксирибонуклеиновой и рибонуклеиновой кислот, кондиционированные среды для анализа секретома клеток), полученных от 82 пациентов. Накоплены массивы соответствующих анамнестических, клинических и лабораторных данных, а также результатов экспериментальных исследований по оценке биомаркеров СК. С использованием коллекции проводится исследование по изучению взаимосвязей между клиническими, тканевыми и клеточными биомаркерами накопления СК и разработке подходов к регуляции их содержания в организме человека.
Заключение. Создание коллекции биологических образцов, с использованием которых от одного пациента получены данные на молекулярном, клеточном, тканевом и организменном уровнях, открывает широкие возможности для исследований в области персонифицированной медицины и изучения механизмов развития воз-раст-ассоциированных заболеваний.
Ключевые слова
Для цитирования:
Сорокина А.Г., Орлова Я.А., Григорьева О.А., Новоселецкая Е.С., Басалова Н.А., Александрушкина Н.А., Виговский М.А., Кириллова К.И., Балацкий А.В., Самоходская Л.М., Данилова Н.В., Дьячкова У.Д., Федотов Д.А., Акопян А.А., Какоткин В.В., Асратян Д.А., Акопян Ж.А., Ефименко А.Ю. Создание коллекции биологических образцов разного типа, полученных от пожилых пациентов, для изучения взаимосвязей клинических, системных, тканевых и клеточных биомаркеров накопления сенесцентных клеток при старении. Кардиоваскулярная терапия и профилактика. 2021;20(8):3051. https://doi.org/10.15829/1728-8800-2021-3051
For citation:
Sorokina A.G., Orlova Ya.A., Grigorieva O.A., Novoseletskaya E.S., Basalova N.A., Alexandrushkina N.A., Vigovsky M.A., Kirillova K.I., Balatsky A.V., Samokhodskaya L.M., Danilova N.V., Dyachkova U.D., Fedotov D.А., Akopyan A.A., Kakotkin V.V., Asratyan D.A., Akopyan Zh.A., Efimenko A.Yu. Creation of a collection of different biological sample types from elderly patients to study the relationship of clinical, systemic, tissue and cellular biomarkers of accumulation of senescent cells during aging. Cardiovascular Therapy and Prevention. 2021;20(8):3051. (In Russ.) https://doi.org/10.15829/1728-8800-2021-3051
Введение
Старение — многофакторный биологический процесс, вызывающий прогрессирующее ухудшение состояния многих органов и тканей [1]. Возраст является фактором риска таких хронических патологий, как онкологические [2], сердечнососудистые [3] и нейродегенеративные заболевания [4], метаболический синдром [5] и др. Выявление, так называемых, признаков, или биомаркеров, старения стало преимуществом для исследований в этой области, поскольку оно позволило изучить патофизиологические механизмы и отсрочить появление множества связанных с возрастом синдромов и симптомов [6]. Среди всех признаков старения механизмы клеточного старения считаются ключевыми факторами этого комплексного процесса [7] и их исследование становится одной из первостепенных задач.
Ведущей теорией, объясняющей процессы старения организма, является теория сенесцентности (лат. “senex” — старение), предполагающая накопление с возрастом во всех тканях сенесцентных клеток (СК). Сенесцентность рассматривают как временную или постоянную остановку клеточного роста: СК задерживаются в фазе G1 или G2/M клеточного цикла и в них активируются механизмы устойчивости к апоптозу, что затрудняет элиминацию этих клеток. Показано, что при этом они приобретают специфический секреторный фенотип, ассоциированный со старением — SASP (senescence-associated secretory phenotype), для которого характерна повышенная продукция провоспалительных цитокинов, хемокинов, белков, разрушающих внеклеточный матрикс, и других просенесцентных факторов, нарушающих структуру и функцию окружающих клеток и ткани в целом [8]. Важно отметить, что относительно небольшое количество стареющих клеток (10%) достаточно для распространения клеточного старения на окружающие клетки в ткани, а также на другие ткани через SASP. При этом при некоторых хронических заболеваниях, например, при сахарном диабете, в СК дополнительно развивается ответ на повреждение дезоксирибонуклеиновой кислоты, что увеличивает нарушение гомеостаза в тканях и распространение просенесцентных повреждающих сигналов [7].
В клинической практике разрабатываются различные подходы к регулированию активности СК. Так, ограничение калорийности без недоедания в настоящее время является наиболее эффективным негенетическим вмешательством для замедления старения, и предполагается, что оно может снизить нагрузку на клетки, связанную со старением [9]. В частности, показано, что определенные типы диет могут снизить уровень СК в печени и кишечнике мышей [10]. Однако в этой области требуются углубленные исследования, поскольку в настоящее время работы, как правило, выполнены на одном типе клеток или органе, что ограничивает информацию, которая может быть получена в отношении индукции старения. До сих пор большинство исследований in vitro, связанных со старением, или данных, показывающих влияние избытка/недостатка питательных веществ на этот процесс, представлены на фибробластах в качестве клеточной модели. Следовательно, необходимы исследования клеток другого типа, например, эндотелиальных, которые особенно склонны к повреждению и дисфункции во время старения, а также изучение старения в компартменте постнатальных стволовых и прогениторных клеток.
Безусловно, выделяют фенотипические отличительные признаки старения, но ученых, в первую очередь, интересуют молекулярные маркеры, которые могут отражать механизмы, лежащие в основе возрастного статуса. В идеале необходимы количественные биомаркеры, которые позволили бы конкретно определять биологический возраст (здоровое старение) человека, независимо от его предрасположенности к болезни (ускоренное старение). Очевидно, что биомаркеры должны соответствовать ряду критериев, в т.ч. они должны прогнозировать скорость старения, определяться, по возможности, неинвазивно или с использованием малоинвазивных методик, давать возможность многократно осуществлять исследование, не причиняя вреда человеку. Кроме того, биомаркеры должны быть индикаторами биологических процессов, патогенных процессов или фармакологических реакций на терапевтическое вмешательство [11].
Таким образом, для оценки вклада СК в развитие старения организма человека и патогенез таких заболеваний ведется поиск их релевантных биомаркеров. Для успешной трансляции в клиническую практику подходов, направленных на регуляцию содержания СК в различных тканях, необходимо изучение взаимосвязей между установленными клиническими биомаркерами старения и развитием возраст-ассоциированных заболеваний, системными показателями старения и биомаркерами СК на тканевом и клеточном уровнях. В рамках биобанкирования биоматериалов человека необходимо обеспечить возможность анализа таких маркеров в разных типах биологических образцов от одного пациента, что представляет собой непростую задачу. Поэтому целью настоящей работы были разработка и описание алгоритмов действий для создания биобанка образцов, полученных от пациентов в возрасте ≥65 лет, для изучения биомаркеров накопления СК.
Материал и методы
Включение пациентов в исследование. В исследование, проводимое на базе Медицинского научно-образовательного центра (МНОЦ) МГУ им. М.В. Ломоносова, было включено 82 пациента мужского и женского пола в возрасте ≥65 лет, направленных на плановое оперативное вмешательство, предполагающее проведение хирургического разреза в области передней брюшной стенки или крупных суставов и отвечающих критериям включения/невключения. Всем пациентам проводили оценку жесткости артериальной стенки (скорость распространения пульсовой волны, центральное аортальное давление), а также осуществляли забор биоматериалов (периферическая кровь, кожа, подкожная жировая клетчатка), из которых затем выделяли клетки различного типа, и проводили подготовку образцов тканей для гистологического анализа с целью оценки различных биомаркеров СК.
Критерии включения:
- Пациенты мужского и женского пола в возрасте ≥65 лет, способные понимать цели настоящего исследования и соблюдать требования протокола.
- Наличие подписанного пациентом информированного согласия (ИС) на участие в исследовании.
- Показания к плановому оперативному вмешательству, предполагающему проведение хирургического разреза в области передней брюшной стенки или крупных суставов.
Критерии невключения:
- острый инфаркт миокарда, перемежающаяся хромота или острое нарушение мозгового кровообращения в анамнезе;
- хроническая сердечная недостаточность III-IV функционального класса;
- онкологические или системные заболевания в анамнезе;
- психические, физические и прочие причины, не позволяющие адекватно оценивать свое поведение и правильно выполнять условия протокола исследования;
- наличие в анамнезе любого существенного, по мнению врача-исследователя, состояния/заболевания или обстоятельства, препятствующего включению в исследование;
- неспособность/нежелание пациента предоставить подписанное информированное согласие на участие в исследовании;
- противопоказания для проведения оперативного лечения на момент включения.
Все работы по созданию и использованию коллекции были одобрены решением Локального этического комитета МНОЦ МГУ им. М.В. Ломоносова (№ 7 от 29.10.2018г). Работа по созданию коллекции была разделена на несколько этапов. В рамках преаналитического этапа сотрудники научного и клинического отделов совместно проводили планирование исследования и организацию логистики с учётом ресурсов медицинского центра. На этом этапе были разработаны нормативноправовые акты, в т.ч. ИС для пациентов и протоколы действий для каждого этапа исследования, составлена дорожная карта движения материалов (рисунок 1).
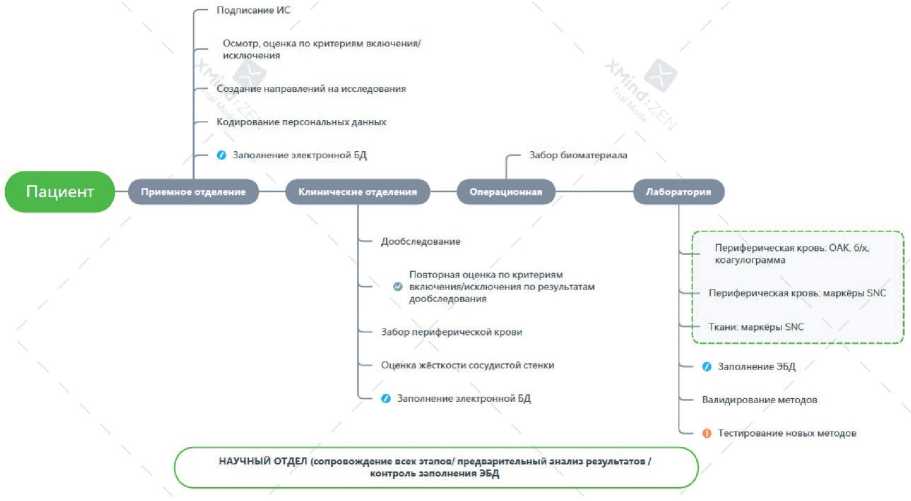
Рис. 1. Этапы получения биоматериалов от одного пациента и ассоциированных с ними данных для создания коллекции.
При поступлении в приёмное отделение пациент проходил процедуру скрининга, получал ИС, врачтерапевт отвечал на все возникающие вопросы и в дальнейшем поддерживал контакт с пациентом на протяжении всего участия в исследовании. После подписания ИС осуществляли забор периферической крови у пациента (до 20 мл), в условиях клинического отделения проводили неинвазивное исследование жёсткости артерий. В процессе хирургического вмешательства в асептических условиях операционной забирали образцы биоматериала (подкожная жировая ткань в количестве 1-5 мл и участок кожи 3-5 мм2) для гистологического анализа и выделения клеток.
В лабораторных подразделениях (клинико-диагностическая лаборатория и отдел патоморфологии) проводили первичную обработку поступивших образцов биоматериала и внутреннюю маркировку с использованием штрих-кодирования. В научном подразделении (Институт регенеративной медицины МНОЦ) проводили выделение и культивирование клеток по отработанным ранее протоколам. Все ассоциированные с биологическими образцами данные вводили в унифицированную электронную базу данных, включавшую как раздел с ограниченным доступом с идентификационными данными, объединяющими внутренние кодировки всех подразделений, участвующих в формировании коллекции, так и раздел с расширенным доступом с деперсонифицированными данными, характеризующими все полученные биологические образцы.
Получение биологических образцов для создания коллекции. Взятие периферической крови проводилось медицинской сестрой в пластиковые пробирки объёмом 9 мл с добавленной в качестве антикоагулянта динатриевой соли этилендиаминтетрауксусной кислоты (ЭДТА). Для перемешивания крови с антикоагулянтом после взятия материала необходимо было перевернуть пробирку 2-3 раза. Из периферической крови выделяли мононуклеарные клетки в градиенте плотности на фиколле (ПанЭко, Россия). Мононуклеары, выделенные по стандартному протоколу, отмывали два раза фосфатным буфером (ПанЭко, Россия) и центрифугировали при 300 g в течение 5 мин, после чего клетки ресуспендировали в 1% растворе бычьего сывороточного альбумина (Sigma, США) в фосфатном буфере и считали их количество с помощью прибора Countess II FL Automated Cell Counter (ThermoFisher, США). Аликвоты мононуклеаров крови (1:4:1) окрашивали флуоресцентными антителами к маркерным белкам отдельных субпопуляций CD34 (флуорофор APC), CD3 (флуорофор FITC) и к изотипическому контролю (IgG) для CD34 (флуорофор APC). Для аликвоты с мечением на CD3 на проточном цитофлуориметре/сортере BD FACSAria III (BD BioSciences, США) провели сортинг клеток (CD3+). Субпопуляция CD3+ клеток была заморожена в осадке на -80оС для экспериментов с целью оценки уровня мРНК ингибиторов клеточного цикла р16 и р21 методом полимеразной цепной реакции (ПЦР). Часть выделенных клеток использовали для определения показателя длины теломер в лейкоцитах с использованием коммерческого набора Absolute Human Telomere Length Quantification qPCR Assay Kit (ScienCell, #8918), согласно протоколам, рекомендованным производителем.
Оставшиеся после выделения мононуклеарных клеток образцы плазмы передавали в клинико-диагностическую лабораторию, где образцы аликвотировали, часть аликвот замораживали при -20оС как часть коллекции, а часть использовали для определения содержания в периферическом кровотоке ряда секретируемых стареющими клетками факторов (такими как уровень отдельных цитокинов и факторов роста в крови, включая компоненты SASP) с помощью соответствующих коммерческих наборов для иммуноферментного анализа.
Образцы кожи и подкожной жировой ткани, полученные от пациентов, разделяли на 2 части. Одна часть была предназначена для определения в тканях содержания СК, которые экспрессировали ингибитор клеточного цикла р16/INK4a. Для этого образцы кожи и подкожной жировой ткани, полученные в ходе операции, фиксировали в 10% забуференном нейтральном формалине в течение 24-48 ч после забора материала. Гистологическая проводка осуществлялась по стандартной методике с использованием 8 смен изопропилового спирта (общая продолжительность — 5,5 ч, температура 37оС) и 3 смен парафина (общая продолжительность — 5 ч, температура 62оС). Затем препараты заливали в парафиновые блоки, которые длительно хранили при комнатной температуре. Далее с парафиновых блоков изготавливали срезы толщиной 3-4 мкм, которые монтировали на предметные стекла (Menzel GmbH&Co KG, Германия). Окрашивание проводили по стандартной методике с использованием гематоксилина Майера и эозина (PanReac AppliChem, Испания) и изучали препараты под световым микроскопом Leica DM LB2 для контроля качества получения биологических образцов в составе коллекции с целью последующего определения в тканях содержания СК.
Вторую часть полученных тканей использовали для выделения дифференцированных специализированных клеток (фибробластов) и мезенхимных стволовых/стромальных клеток (МСК). Для этого образцы тканей помещали в стерильный солевой раствор Хэнкса (ПанЭко, Россия), содержащий 5-кратную концентрацию антибиотиков (500 ед./мл пенициллина, 500 ед./мл стрептомицина, HyClone, США). Извлекали биоптат из раствора в условиях стерильного ламинарного бокса. Затем для выделения фибробластов дермы очищали биоптат от хирургической пленки и прилежащей жировой ткани, измельчали ножницами и помещали кусочки дермы в стерильную чашку Петри. Сверху кусочки придавливали стерильным покровным стеклом и добавляли в чашку полную среду роста DMEM (HyClone, США), содержащую 10% фетальной бычьей сыворотки (ФБС) (HyClone, США), 1% раствора антибиотиков (100 ед./мл пенициллина, 100 ед./мл стрептомицина, HyClone, США). Через 7-14 сут. визуально при помощи микроскопа детектировали фибробласты, выползшие на поверхность культуральной чашки из экспланта. Остатки экспланта удаляли из чашки, прикрепившиеся клетки снимали раствором трипсина (HyClone, США) и рассаживали равномерно.
Для получения МСК в условиях стерильного ламинарного бокса механически измельчали жировую ткань с помощью ножниц, после чего смешивали с раствором коллагеназы I типа (200 ед./мл) (Wornington, США) и диспазы (40 ед./мл) (Sigma, США) при соотношении объема ткани к объему ферментативного раствора 1:2. Инкубировали ткань при 37оС от 40 до 60 мин, периодически интенсивно встряхивая. К полученной суспензии добавляли равный объем среды роста AdvanceSTEM™ (HyClone, США) с 10% Advance Stem Supplement (HyClone, США) для инактивации ферментов и центрифугировали при 200 g 10 мин. Фракцию адипоцитов и супернатант удаляли. Полученный осадок ресуспендировали в 10 мл свежей полной среды роста, после чего пропускали через сито диаметром 100 мкм (BD Falcon, США) для удаления дебриса. Центрифугировали полученную суспензию клеток при 200 g 5 мин. Супернатант удаляли, к осадку добавляли стерильную дистиллированную воду для лизиса эритроцитов. Через 2 мин к суспензии добавляли 1/10 объема 10-кратного раствора фосфатно-солевого буфера для восстановления осмомолярности. Полученную суспензию центрифугировали при 200 g 5 мин, ресуспендировали клетки в среде роста. Клетки подсчитывали с помощью автоматического счетчика клеток Countess (InvitroGen, США) и высаживали в чашки Петри в количестве 50 тыс. кл./мл. Инкубировали при 37оС, 5% СО2. На следующий день в чашках меняли среду роста на свежую для удаления неприкрепленных клеток.
Для культивирования МСК жировой ткани использовали среду роста AdvanceSTEM™ (HyClone, США) с 10% Advance Stem Supplement (HyClone, США), 1% антибиотиков (100 ед/мл пенициллина и 100 ед./мл стрептомицина, HyClone, США), 1% GlutaMAX (Gibco, США). Среду меняли на свежую каждые 3 дня. По мере достижения клетками 80-90% конфлюента клетки пассировали, для чего из чашки Петри отбирали среду роста, промывали прикрепленные клетки раствором Версена, а затем инкубировали в растворе диссоциирующего агента HyQTase (HyClone, США) в течение 5 мин. Открепившиеся клетки собирали в чашки, добавляли равный раствор полной среды роста и центрифугировали при 200 g 5 мин. Полученный осадок ресуспендировали в свежей порции среды роста и высаживали на чашки Петри в количестве 50 тыс. кл./мл.
Для оценки жизнеспособности клеточных линий клетки первого пассажа снимали с чашек Петри, как описано выше, подсчитывали их количество и определяли жизнеспособность с помощью окрашивания трипановым синим. Для этого 10 мкл суспензии клеток смешивали с 10 мкл трипанового синего (Gibco, США), помещали 10 мкл суспензии в слайд и подсчитывали число светлых клеток (жизнеспособные) и темных (мертвые) с помощью автоматического счетчика клеток Countess (InvitroGen, США). Жизнеспособность рассчитывали, как соотношение живых клеток к их общему количеству. Жизнеспособность клеточных линий на первом пассаже составляла 90,5±4,5%.
Для оценки скорости роста и пролиферативного потенциала клеток МСК жировой ткани и фибробласты кожи первого пассажа высаживали в 6-луночный планшет (100 тыс. кл./лунку), после чего планшет помещали в автоматизированную систему IncuCyte® ZOOM Live Cell Analysis System (Essen Bioscience, США) для прижизненной съемки состояния клеточной культуры. Съемку осуществляли с периодичностью 1 раз/ч в течение 96 ч (16 полей зрения/лунку). Встроенное программное обеспечение прибора позволяет оценивать площадь, занятую клетками, с помощью наложения “маски” на полученные изображения и, таким образом, вычислять процент конфлюента клеточной культуры. Увеличение конфлюента прямо коррелирует с увеличением числа клеток, что позволяет судить о скорости роста клеточной культуры по вычисляемым параметрам времени лаг-фазы и времени прироста монослоя за 48, 72 и 96 ч. Лаг-фаза — период времени, необходимого клеткам для прикрепления к пластику и подготовки к митотическому делению. В это время клетки не пролиферируют. Быстрый переход клеток из лаг-фазы (короткий период времени) в фазу активного деления (экспоненциального роста) свидетельствует о способности клеток к быстрой адаптации и высоких пролиферативных свойствах. На полученных с помощью системы IncuCyte® ZOOM изображениях был проведен анализ пролиферативного потенциала клеточных культур. Для каждой клеточной линии была получена кривая пролиферации, отражающая увеличение плотности монослоя с течением времени.
С целью анализа секретóма клеток получали образцы кондиционированной среды. Для этого МСК жировой ткани или фибробластов 2-го пассажа высаживали в чашку Петри, наращивали до получения 80-90% монослоя. Трижды промывали монослой с помощью раствора Хэнкса по 5 мин для удаления остатков сыворотки. После этого добавляли 2,2 мл соответствующей среды роста без сыворотки, содержащей 1% бычьего сывороточного альбумина, и культивировали в течение 72 ч. Полученную кондиционированную среду собирали с чашки, центрифугировали при 500 g 10 мин для удаления клеточного дебриса, собирали супернатант, добавляли коктейль ингибиторов протеаз. Образцы кондиционированной среды аликвотировали, замораживали и хранили при -80оC. Клетки снимали с чашки Петри, как описано выше, и подсчитывали их число для дальнейшей стандартизации количества секретированных в среду факторов на число клеток-продуцентов.
Криохранение выделенных клеточных линий осуществляли следующим образом. МСК жировой ткани или фибробластов дермы 1-го пассажа снимали с чашек Петри, центрифугировали при 200 g 5 мин, супернатант отбирали, а полученный осадок ресуспендировали в среде для криохранения клеточных линий Synth-a-Freeze (Gibco, США) в концентрации 1 млн кл./мл. Полученную суспензию помещали в криопробирки в количестве 0,5 или 1 млн кл и замораживали в штативах CoolCell (Biocision, США) со снижением температуры на 1оС/мин при -80оC. Через 24 ч крипробирки с клетками переносили в крихранилище и помещали в жидкий азот при температуре -196оC, при которой осуществляли хранение образцов. Таким образом, была создана коллекция клеточных линий от пациентов ≥65 лет. От каждого пациента в коллекцию было заложено не <2 ампул с клетками, жизнеспособность клеток перед заморозкой составляла не <85%.
Часть полученных клеточных образцов подвергали дальнейшей обработке с целью оценки абсолютной длины теломерных участков хромосом и активности теломеразы в выделенных клетках с использованием коммерческих наборов Absolute Human Telomere Length Quantification qPCR Assay Kit (ScienCell, #8918) и Telomerase Activity Quantification qPCR Assay Kit (TAQ) (ScienCell, #8928), соответственно, согласно протоколам, рекомендованным производителем. Для этого часть клеток 2-го пассажа, предназначенных для выделения нуклеиновых кислот, в состоянии конфлюента промывали 2 раза раствором фосфатно-солевого буфера (ПанЭко) и добавляли к прикрепленным клеткам 200 мкл коммерческого RLT-лизис-буфера (Qiagen), после чего собирали клеточный лизат с лунки планшета с помощью стерильного скребка, помещали в пробирку типа эппендорф, замораживали и хранили при -80оC.
Другую часть клеток 2-го пассажа, предназначенных для выделения белка и дальнейшего анализа методом иммуноблоттинга, промывали 2 раза раствором фосфатносолевого буфера (ПанЭко) и добавляли к прикрепленным клеткам 100 мкл лизис-буфера (Qiagen) с предварительно добавленным коктейлем ингибиторов протеаз без разведения (Sigma). Клеточный лизат собирали с лунки планшета с помощью стерильного скребка, помещали в пробирку типа эппендорф, замораживали и хранили при -80оC.
Результаты
Для формирования коллекции необходимо было организовать работу нескольких подразделений, в т.ч. 4-х клинических отделений и 3-х лабораторных подразделений (рисунок 2). За каждым подразделением, помимо специализированных опций, были закреплены дополнительные функции для обеспечения системного выполнения исследования. Заполнение электронной базы данных было распределено между всеми участниками исследования, контроль соответствия и своевременности заполнения, а также устранение технических нестыковок осуществляли сотрудники научного отдела. Ряд функций был распределён с учётом возможной взаимозаменяемости исполнителей.

Рис. 2. Организация работы отделений в рамках исследования.
Примечание: ПО — приемное отделение, ХО — хирургическое отделение, ОТО — отделение травматологии и ортопедии, КДО — клиникодиагностическое отделение, ОКП — отделение клинической патологии.
В исследование было включено 82 пациента (соотношение муж/жен — 1/3,7) в возрасте от 65 до 90 лет (средний возраст 71,6 года, медиана 71 год). У всех пациентов был собран анамнез, проведено объективное обследование, перед хирургическим вмешательством проведен забор периферической крови, оценена жесткость артериальной стенки неинвазивным методом, осуществлен забор кожи и подкожно-жировой клетчатки в рамках оперативного вмешательства.
Для всех пациентов получены данные общего и биохимического анализов крови, коагулограммы. Кроме того, проведен анализ липидного профиля, на основании которого с учётом возраста и сопутствующих заболеваний оценивали риска развития сердечно-сосудистых событий пациентов по шкале SCORE (Systematic COronary Risk Evaluation). В качестве установленного клинического биомаркера сосудистого старения у всех пациентов оценена жесткость сосудистой стенки магистральных артерий неинвазивным осциллометрическим методом в положении сидя и лежа с помощью диагностической системы “BPLab Vasotens”.
К настоящему времени в коллекцию включены биологические образцы 7 различных типов (сыворотка периферической крови, образцы тканей, фиксированные в формалине и заключенные в парафиновые блоки, образцы разных типов клеток, выделенных из периферической крови, кожи и жировой ткани, образцы дезоксирибонуклеиновой и рибонуклеиновой кислот, кондиционированные среды для анализа секретóма клеток с целью количественной оценки компонентов SASP). В базе данных объединены массивы соответствующих анамнестических, клинических и лабораторных данных, а также результатов экспериментальных исследований по оценке биомаркеров СК в разных типах биологических образцов. Следует отметить, что не для всех пациентов, включенных в исследование, удалось выделить жизнеспособные клеточные линии из тканей, способные к пролиферации в культуре, поэтому для части пациентов в составе коллекции образцы выделенных из тканей клеток обоих типов отсутствуют. Для большинства пациентов были сформированы криоколлекции клеточных линий, выделенных из разных тканей: дермальных фибробластов как дифференцированных специализированных клеток, и МСК, содержащих субпопуляцию мультипотентных стволовых клеток.
Обсуждение
Создание уникальной биологической коллекции, включающей биологические образцы различного типа, полученные от пациентов старшей возрастной группы, оказалось трудной и интересной задачей, которая была с успехом реализована. На каждом этапе от планирования исследования и организации процесса до этапов хранения и поддержания процесса набора биоматериала возникали определенные сложности: для части из них находились простые решения, для некоторых обсуждение оптимального выхода продолжается до сих пор.
В этой статье хотелось бы поднять ряд вопросов, которые необходимо учитывать при разработке методических подходов и рекомендаций в области биобанкирования при создании подобных коллекций.
Конфиденциальность и безопасность vs доступность данных. Одной из целей организации биобанков является широкая доступность для исследователей накопленной и качественно собранной информации. В то же время при формировании и хранении больших данных исследователи сталкиваются с проблемой поиска методов защиты персональных данных. В данном случае выбрана система кодирования данных, где в индивидуальном коде пациента указывался доступ к результатам анамнеза, лабораторных и инструментальных данных без предоставления информации об индивидуальных персональных данных.
При создании системы индивидуального кодирования следует учитывать количество символов в одном коде и возможность перевода буквенного/цифрового кода в штрих-код. Помимо увеличения риска технических ошибок, проблема состоит в том, что на определённых этапах лабораторных исследований маркировка биообразцов была ограничена (длинный код сложно указать на ограниченном пространстве). Это потребовало введения новой упрощённой системы кодирования уже по ходу проведения исследования и осложнило дальнейшую работу из-за необходимости соотносить данные от нескольких систем кодирования.
Информированность пациентов. В ИС пациентам предоставлена возможность самостоятельно выбрать и указать ограничения, в которых биоматериалы и данные могут/не могут быть использованы (см. Приложение 1 с ИС). Такая формулировка позволяет пациентам занимать активную позицию, вовлекаться в процесс обсуждения исследования и разделять ответственность.
Кроме того, следует отметить, что с учётом низкого уровня информированности населения о правилах, целях и особенностях создания биобанков в России, пациентам требуется дополнительная информационная поддержка и после подписания ИС. Предпочтительным оставалось индивидуальное общение пациента с лечащим врачом или научным сотрудником, в то время как бумажные и электронные ИС не содержали полной информации, поскольку запросы пациентов значимо превышали требования к ИС. Представлялось целесообразным создание универсальных бумажных и электронных брошюр для пациентов по соответствующей тематике, а также отдельное создание пула ответов на наиболее частые вопросы, касающиеся безопасности пациентов при участии в донорстве биоматериала (например, бот-система).
Передача образцов, отслеживание и маркировка. Необходимым условием для организации набора биообразцов является наличие нескольких лечебных и диагностических профилей медицинского учреждения на одной территории. Для улучшения качества взаимодействия между подразделениями, передачи и контроля движения биологического материала создавали и активно использовали электронные средства коммуникации (системы быстрых уведомлений мессенджеров), что позволяло оперативно информировать о текущей ситуации всех участников исследования. Это особенно важно при необходимости быстрой передачи биоматериалов в другие подразделения, например, для выделения клеточных линий, когда от скорости этого процесса зависит эффективность выделения клеток и их жизнеспособность.
Кроме того, активно использовали несколько типов систем обратной связи для оперативного корректирования тактики по тому или иному пациенту.
Дублирование электронных лабораторных направлений бумажными имело как преимущества, так и недостатки (например, сложная маркировка тяжело наносилась на часть материалов, но она же позволяла не дублировать забор крови, если пациенту необходимо было плановое обследование в рамках госпитализации), поэтому в данном вопросе окончательный консенсус между подразделениями ещё не достигнут.
Даже в условиях территориальной доступности всех отделений-участников исследования между собой, наличия инфраструктуры биобанка и продуманной системы маркировки, возникали непредвиденные логистические и организационные проблемы, которые не удавалось предвидеть заранее. Так, путь биоматериала был организован по конвейерной схеме, когда каждый следующий этап предполагал успешное прохождение предыдущего (забор материала в операционной осуществлялся только после того, как пациент прошёл двойную систему контроля соответствия критериям включения/невключения). Однако возникали ситуации, когда результаты исследования приходили позднее проведённых последующих манипуляций: гемолиз крови в пробирке, не удалось взять материал во время оперативного вмешательства в связи с объективными сложностями, во время операции выявляли заболевание, препятствующее участию пациента в исследовании. Это приводило к тому, что в данных на некоторых пациентов появлялись пропуски, которые невозможно было заполнить, что влияло и на статистическую обработку, и на аналитическую справку при работе с базой данных. Использование сложных статистических методов при анализе результатов позволяет корректировать эти проблемы, однако при определенных дизайнах исследований такие особенности могут создать сложности, что необходимо учитывать при работе с биологическими коллекциями.
Контроль качества на различных этапах исследования. По мере проведения исследования и прохождения всех этапов создания подобной коллекции стало очевидно, что необходима дополнительная опция контроля качества проведения каждой фазы исследования. В первую очередь, это касалось клинических подразделений. В частности, необходимо было провести калибровку по минимально необходимому количеству крови/ткани для различных отделений. Так, например, забор кожи и жировой ткани технически значимо отличался при различных оперативных вмешательствах (изначально обязательным условием было только требование к типу ткани и неиспользование коагулятора при ее заборе), в дальнейшем потребовалось введение дополнительных разъяснений по забору при каждом типе оперативного вмешательства. Благодаря своевременной информационной поддержке научного отдела и оперативным перестроениям работы клинических отделов большинство данных задач были решены.
Заключение
На базе Университетской клиники МГУ удалось создать уникальную коллекцию биологических образцов различных типов, с помощью которых от одного пациента старшей возрастной группы стало возможным получение экспериментальных данных, отражающих накопление СК на молекулярном, клеточном, тканевом и организменном уровнях. Осуществить задуманное удалось благодаря наличию мультидисциплинарной команды и организации взаимодействия, при котором все этапы исследования проводили в медицинском центре и не привлекали к работе внешние учреждения. Наличие современной инфраструктуры для биобанкирования, включая системы хранилищ, как информационных, так и для биологических образцов различных типов, позволило создать доступную и удобную в использовании коллекцию и ассоциированную с ней базу данных для изучения взаимосвязей между клиническими, тканевыми и клеточными биомаркерами старения.
Создание биобанка такого типа открывает широкие возможности для исследований в области персонифицированной медицины и изучения механизмов развития возраст-ассоциированных заболеваний. Полученные данные могут быть использованы и для разработки новых подходов к регуляции содержания СК клеток в организме человека.
Отношения и деятельность. Исследование выполнено в рамках государственного задания МНОЦ МГУ им. М.В. Ломоносова и Междисциплинарной научно-образовательной школы “Молекулярные технологии живых систем и синтетическая биология” МГУ им. М.В. Ломоносова. Работа выполнена без задействования грантов и финансовой поддержки от общественных, некоммерческих и коммерческих организаций.
Список литературы
1. Kirkwood TBL. Understanding the odd science of aging. Cell. 2005;120(4):437-47 doi:10.1016/j.cell.2005.01.027.
2. Magalhaes JP de. How ageing processes influence cancer. Nat Rev Cancer. 2013;13(5):357-65. doi:10.1038/nrc3497
3. North BJ, Sinclair DA. The intersection between aging and cardiovascular disease. Circulation Res. 2012;110(8):1097-108. doi:10.1161/CIRCRESAHA.111.246876.
4. Lardenoije R, Pishva E, Lunnon K, et al. Neuroepigenetics of Aging and Age-Related Neurodegenerative Disorders. Prog Mol Biol Transl Sci. 2018;158:49-82. doi: 10.1016/bs.pmbts.2018.04.008.
5. Dominguez LJ, Barbagallo M. The biology of the metabolic syndrome and aging. Curr Opin Clin Nutr Metab Care. 2016;19(1):5-11. doi:10.1097/MC0.0000000000000243.
6. Lopez-Otin C, Blasco MA, Partridge L, et al. The hallmarks of aging. Cell. 2013;153(6):1194-217 doi:10.1016/j.cell.2013.05.039.
7. McHugh D, Gil J. Senescence and aging: Causes, consequences, and therapeutic avenues. J Cell Biol. 2018;217(1):65-77 doi:10.1083/jcb.201708092.
8. Ozcan S, Alessio N, Acar MB, et al. Unbiased analysis of senescence associated secretory phenotype (SASP) to identify common components following different genotoxic stresses. Aging. 2016;8(7):1316-29. doi:10.18632/aging.100971.
9. Maduro AT, Luis C, Soares R. Ageing, cellular senescence and the impact of diet: an overview. Porto Biomed J. 2021;6(1):e120. doi:10.1097/j.pbj.0000000000000120.
10. Wang C, Maddick M, Miwa S, et al. Adult-onset, short-term dietary restriction reduces cell senescence in mice. Aging. 2010;2(9):555-66. doi:10.18632/aging.100196.
11. Hernandez-Segura A, Nehme J, Demaria M. Hallmarks of Cellular Senescence. Trends Cell Biol. 2018;28(6):436-53. doi:10.1016/j.tcb.2018.02.001.
Об авторах
А. Г. СорокинаРоссия
Анна Григорьевна Сорокина — научный сотрудник отдела возраст-ассоциированных заболеваний.
Тел.: +7 (915) 098-28-55
Я. А. Орлова
Россия
Яна Артуровна Орлова — доктор медицинских наук, доцент, ученый секретарь, заведующий отделом возраст-ассоциированных заболеваний, заведующий кафедрой терапии
О. А. Григорьева
Россия
Ольга Александровна Григорьева — кандидат биологических наук, младший научный сотрудник лаборатории репарации и регенерации тканей Института регенеративной медицины
Е. С. Новоселецкая
Россия
Екатерина Сергеевна Новоселецкая — лаборант-исследователь лаборатории репарации и регенерации тканей Института регенеративной медицины, аспирант кафедры биохимии и молекулярной медицины
Н. А. Басалова
Россия
Наталия Андреевна Басалова — лаборант-исследователь лаборатории репарации и регенерации тканей Института регенеративной медицины, аспирант кафедры биохимии и молекулярной медицины
Н. А. Александрушкина
Россия
Наталья Андреевна Александрушкина — лаборант-исследователь лаборатории генно-клеточной терапии Института регенеративной медицины, аспирант кафедры биохимии и молекулярной медицины
М. А. Виговский
Россия
Максим Александрович Виговский — лаборант-исследователь лаборатории репарации и регенерации тканей Института регенеративной медицины, аспирант кафедры биохимии и молекулярной медицины
К. И. Кириллова
Россия
Карина Игоревна Кириллова — научный сотрудник отдела лабораторной диагностики
А. В. Балацкий
Россия
Александр Владимирович Балацкий — кандидат медицинских наук, старший научный сотрудник отдела лабораторной диагностики
Л. М. Самоходская
Лариса Михайловна Самоходская — кандидат медицинских наук, доцент, заведующий отделом лабораторной диагностики, старший научный сотрудник Евразийского центра по продовольственной безопасности (Аграрный центр), доцент факультета
Н. В. Данилова
Россия
Наталья Владимировна Данилова — кандидат медицинских наук, старший научный сотрудник отдела клинической патологии, ассистент кафедры физиологии и общей патологии
У. Д. Дьячкова
Россия
Ульяна Денисовна Дьячкова — студент
Д. А. Федотов
Россия
Данила Алексеевич Федотов — студент
А. А. Акопян
Россия
Анна Александровна Акопян — стажер по совместительству, отдел возраст-ассоциированных заболеваний
В. В. Какоткин
Россия
Виктор Викторович Какоткин — аспирант кафедры общей и специализированной хирургии
Д. А. Асратян
Россия
Давид Альбертович Асратян — кандидат медицинских наук, руководитель отделения
Ж. А. Акопян
Россия
Жанна Алексеевна Акопян — кандидат медицинских наук, зам. директора, заведующий кафедрой клинического моделирования и мануальных навыков
А. Ю. Ефименко
Россия
Анастасия Юрьевна Ефименко — кандидат медицинских наук, заведующий лабораторией репарации и регенерации тканей, доцент кафедры биохимии и молекулярной медицины
Дополнительные файлы
Рецензия
Для цитирования:
Сорокина А.Г., Орлова Я.А., Григорьева О.А., Новоселецкая Е.С., Басалова Н.А., Александрушкина Н.А., Виговский М.А., Кириллова К.И., Балацкий А.В., Самоходская Л.М., Данилова Н.В., Дьячкова У.Д., Федотов Д.А., Акопян А.А., Какоткин В.В., Асратян Д.А., Акопян Ж.А., Ефименко А.Ю. Создание коллекции биологических образцов разного типа, полученных от пожилых пациентов, для изучения взаимосвязей клинических, системных, тканевых и клеточных биомаркеров накопления сенесцентных клеток при старении. Кардиоваскулярная терапия и профилактика. 2021;20(8):3051. https://doi.org/10.15829/1728-8800-2021-3051
For citation:
Sorokina A.G., Orlova Ya.A., Grigorieva O.A., Novoseletskaya E.S., Basalova N.A., Alexandrushkina N.A., Vigovsky M.A., Kirillova K.I., Balatsky A.V., Samokhodskaya L.M., Danilova N.V., Dyachkova U.D., Fedotov D.А., Akopyan A.A., Kakotkin V.V., Asratyan D.A., Akopyan Zh.A., Efimenko A.Yu. Creation of a collection of different biological sample types from elderly patients to study the relationship of clinical, systemic, tissue and cellular biomarkers of accumulation of senescent cells during aging. Cardiovascular Therapy and Prevention. 2021;20(8):3051. (In Russ.) https://doi.org/10.15829/1728-8800-2021-3051
JATS XML

























































