Перейти к:
Патогенез атеросклероза через призму нарушения функций микрососудов
https://doi.org/10.15829/1728-8800-2021-3076
Аннотация
В статье обсуждаются разные точки зрения исследователей на формирование атеросклероза. Приводятся факты, подтверждающие “холестериновую теорию атерогенеза”. Обращается внимание на возможное участие в развитии атеросклероза микрососудов кровеносной системы — vasa vasorum.
Для цитирования:
Аронов Д.М., Бубнова М.Г., Драпкина О.М. Патогенез атеросклероза через призму нарушения функций микрососудов. Кардиоваскулярная терапия и профилактика. 2021;20(7):3076. https://doi.org/10.15829/1728-8800-2021-3076
For citation:
Aronov D.M., Bubnova M.G., Drapkina O.M. Atherosclerosis pathogenesis from the perspective of microvascular dysfunction. Cardiovascular Therapy and Prevention. 2021;20(7):3076. https://doi.org/10.15829/1728-8800-2021-3076
Хорошо известно, что важные мировые открытия сопровождались тяжелым трудом по признанию их современниками. Не избежал этой участи и Аничков Н. Н., создавший “холестериновую теорию атеросклероза”, эффективно действующую при лечении и профилактике атеросклероза. В 1913г он опубликовал в патологоанатомическом журнале “Zentral Allg Pathol Pathol Anat” статью о главной роли холестерина (ХС) в развитии экспериментального атеросклероза [1].
Долгое время работа Аничкова Н. Н. оставалась неизвестной. Слава и известность пришли к нему в 30-х гг XXв, когда он представил на конференции “Международного общества географической патологии” данные по частоте атеросклеротических поражений в разных странах в зависимости от социальной и профессиональной принадлежности. Это было первой серьезной работой в мире, заложившей основы медицинской эпидемиологии, которая развивалась как одна из заслуг Аничкова Н.Н. Но наиболее важной заслугой Аничкова Н.Н. считается создание им “холестериновой теории атеросклероза” [2][3].
В настоящее время вся тактика и практика медицинских действий по атеросклерозу выполняется именно по методологии Аничкова Н. Н. Ведущая роль ХС при атеросклерозе заключается в необходимости контроля его уровня и снижения повышенного уровня до установленных целевых значений. К сожалению, его открытие преследовали неудачи с признанием. Еще в 1992г академик Климов А. Н. резко осадил некоего Davies Н, выступившего по поводу концепции атеросклероза и лично против Аничкова Н. Н. [4]. В обзоре, опубликованном в 1990г в International Journal of Cardiology, Davies H выразил откровенно уничижительное отношение к холестериновой концепции атерогенеза и к ее первооткрывателю [5]: “Представляется интересным заметить, наконец, что скармливание холестерина кроликам (имеются в виду классические опыты Аничкова Н. Н. и Халатова С.С. по созданию холестериновой модели экспериментального атеросклероза), возвестившее новую липидную эру, свершилось в России примерно в то же время, что и большевистская революция. Оба события, каждое своим путем, оказали влияние на человечество этого столетия, отвергая другие более значимые явления. Было бы еще более интересным, если бы конец столетия ознаменовался одновременным отрицанием этих обоих событий и порожденных ими положений, потому что они оказались хуже, чем удовлетворительными”. Заметим, что вряд ли уместно сопоставлять такое социальное явление, как Октябрьская революция в России, какой бы оценки она ни заслуживала, и чисто научное открытие — создание Аничковым Н. Н. и Халатовым С. С. в 1913г холестериновой модели атеросклероза у кроликов [4]. Кроме того, Климов А. Н. представил образцы заголовков статей, критиковавших Аничкова Н.Н. [5] (сведения об авторах по Климову А.Н.):
— “Противоречия о холестерине, как поступать дальше” (Heyden S, Williams S, 1982);
— “Холестерин плазмы крови — валет и джокер сердца” (Oliver MF, 1981);
— “Сага о холестерине: что происходит со здоровьем?” (Oliver MF, 1987);
— “Холестериновая образовательная программа: не голый ли король” (Palumbo PJ, 1988);
— “Холестериновый миф” (Moore TJ, 1989) и т.д.
До настоящего времени высказываются разные взгляды на патогенез атеросклероза. Авторы недавно вышедший книги “Патогенез атеросклероза и нарушение функции микрососудов” (2019) Haverich A и Boyle ЕС считают, что атеросклероз первично зарождается в тканях микрососудов (vasa vasorum, лимфатические сосуды) и лишь позже процесс переносится на интиму коронарных и других артерий [6]. Этот путь развития атеросклероза впервые обращает внимание врачей на то, что происходит в стенке артерий не только в интиме, но в медиальном слое и адвентиции. Свою концепцию развития атеросклероза авторы подкрепляют огромным списком литературы (список состоит из 886 статей), включая работы XIX, XX и XXIвв.
Основная идея этих авторов заключается в том, что атеросклероз не является следствием гиперхолестеринемии. Далее они продолжают: “… и, хотя большинство исследований сосредоточено на эндотелии основного сосуда, мы обосновываем гипотезу, что именно эндотелий vasa vasorum более подвержен нарушениям функции на всех стадиях заболевания” [6]. По их мнению, первичная причина атеросклероза — это патология системы vasа vasorum. В переводе с латинского “vasа vasorum” означают “сосуды в сосудах” (в стенке артерий и вен). Vasa vasorum — это микрососуды кровеносной системы, которые снабжают стенки средних и крупных артерий, а также вен питательными веществами и кислородом, а также участвуют в выведении продуктов естественного метаболизма и элементов, участвующих в патологических процессах в сосудистой стенке. Vasa vasorum не образуют сплетений, а, скорее, играют роль функциональных концевых артерий.
Более интенсивное изучение vasa vasorum, безусловно, полезно; но это не означает, что нарушение функции vasa vasorum имеет решающее значение в патогенезе атеросклероза, где главным действующим фактором является ХС. По мнению Haverich A и Boyle ЕС, “…атеросклероз начинается “Снаружи внутрь” — т.е. к интиме”, но не наоборот, как до сих пор считается: “От интимы — к адвентиции”, т.е. к стенке артерии. По-новому оценивая патогенез этой болезни, авторы гипотезы практически проводят полную ревизию механизмов развития атеросклероза [6]. Авторы основываются на некоторых собственных результатах, не имеющих особого значения в низвержении холестериновой теории атеросклероза. Другая часть собственных результатов подкрепляется обширным новым материалом о малоизвестных клиницистам микрососудах сердца.
На рисунке 1 представлена схема развития vasa vasorum по концепции Haverich A и Boyle ЕС [6]. Vasa vasorum берут начало от всех крупных артерий вплоть до бифуркационных сегментов сосудов эпикарда. Существуют также венозные vasa vasorum, которые отводят кровь из артериальной системы в венозную. Система vasа vasorum развивается постепенно — от рождения до взрослого человека и сходна с ростом годовых колец у дерева (рисунок 1). Со временем количество слоев клеток интимы vasa vasorum возрастает: от 1-2 слоев на первом году жизни до 10-15 слоев к 15 годам и далее до 25-30 слоев во взрослом состоянии. Этот процесс связан с состоянием интимы, которая с годами диффузно утолщается (это называется диффузным утолщением интимы). Этот феномен был открыт Капитолиной Волковой, ученицей Аничкова Н.Н. Известно, что адаптивное утолщение интимы не зависит от уровня гиперхолестеринемии. Атеросклеротические бляшки (АСБ) развиваются из уже утолщенной интимы. Полагают, что если критическая величина утолщения превышена, то гипоксические условия во внешней части медии и адвентиции приведут к запуску ангиогенеза и формированию vasa vasorum [6].
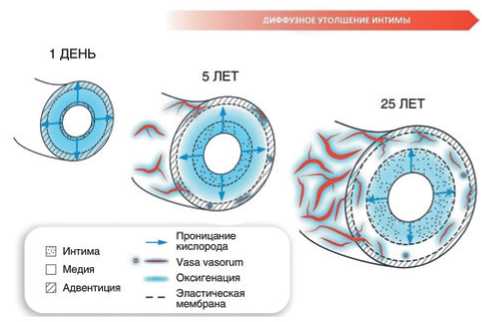
Рис. 1. Зависимое от возраста развитие vasa vasorum облегчает питание и оксигенацию слоев сосудистой стенки. Адаптировано из [6].
Vasa vasorum у молодых людей впервые появляются только в адвентиции и с возрастом, при утолщении интимы, vasа vasorum проникают во внешние две трети медии, адвентицию и внешний слой медии. В это же время кровь снабжает питательными веществами сам сосуд, в т.ч. внутренний слой артерии (кровью снабжается только локальная часть артерии). Обрабатываемая площадь артерии автономна, она никак не связана с областями перфузии других частей и других сосудов, кроме ограниченной части под интимой. Vasa vasorum могут подвергаться кратковременному сдавливанию артериальной стенкой при наличии ее отека. Они регулируют свой тонус и сосудистую перфузию, поскольку обогащены собственными гладкомышечными клетками и соединительной тканью [7].
Трехслойная структура стенки кровеносных сосудов распространяется на все артерии с некоторыми различиями. Внешний слой артерий — адвентиция (tunica externa) — состоит из богатой коллагеном соединительной ткани с эластическими волокнами, содержащими фибробласты, нервные, периваскулярные, маршановы клетки, макрофаги, Т-лимфоциты, тучные и дендритные клетки.
Второй слой — медия (tunica media) — отделен от адвентиции эластичной мембраной. Медия состоит из кругообразно расположенных пластин гладкомышечных клеток, соединительной ткани и эластичных волокон. Интима (tunica interna) — внутренняя оболочка артерии, состоящая из одного слоя клеток эндотелия и соединительной эластической прослойки — субэндотелия. В последние годы во всех слоях стенки артерий обнаружены стволовые клетки, входящие в состав сосудов, и клетки других видов (макрофаги, фолликулярные и дендритные клетки).
Лимфатическая система представлена сетью начальных лимфатических капилляров, которые дренируются в посткапилляры и затем в собирающие лимфатические сосуды. Они состоят исключительно из эндотелия, прикрепляющегося коллагеновыми волокнами к базальной мембране. Жидкость поступает в эти слепо оканчивающиеся капилляры посредством абсорбции, которая способствует контактам между проницаемыми клетками эндотелия [6]. К тому же сказывается градиент давления, способствующий движению жидкости из интерстициального пространства в лимфатические капилляры. Лимфатические сосуды участвуют во всасывании и метаболизме жиров, а также в иммунном обмене. Избыточный ХС удаляется из клеток в составе липопротеинами высокой плотности и транспортируется лимфой в кровь и обратно в печень, откуда ХС выводится из организма. Этот факт свидетельствует о положительной роли лимфы в предотвращении атеросклероза. Лимфатические сосуды обладают отдельным кровоснабжением, в которых имеются vasa vasorum [6].
Можно согласиться с мнением Haverich A и Boyle ЕС, что микрососуды в стенках кровеносных и лимфатических сосудов не получают должного внимания исследователей и нередко их патология игнорируется. Действительно, в течение многих лет ученые редко обращали внимание на роль vasa vasorum в происхождении атеросклероза.
Некоторые вопросы, которые освещают Haverich A и Boyle ЕС, требуют применения трехмерной визуализации артерий с помощью оптической когерентной томографии и магнитно-резонансной томографии. При изучении изображений, полученных у пациентов с пораженными атеросклерозом и кальцифицированными артериями, выявляется их значительная неоднородность. Таким образом, очевидно, что микрососуды действительно принимают определенное участие в кровоснабжении артерий сердца, но отнюдь не основной ее части [6].
Технический прогресс в компьютерной томографии позволил верифицировать атеросклеротические поражения. Подробные сравнения между левой и правой аорто-подвздошно-бедренной осями, полученные у пациентов с кальцифицированными артериями, во многих случаях показывают удивительно симметричную картину двусторонней кальцификации. В то же время наблюдается высокая степень асимметрии в кальцифицированных сосудах нижней половины тела. В этих случаях основные сегменты окружности артериальной стенки на самом деле не имеют атеросклеротических изменений.
На основании изображений, полученных с помощью компьютерной томографии, можно высказать и другое важное наблюдение: АСБ в определенном артериальном сегменте распределены неравномерно. Скорее видно точечное или фрагментарное распределение кальцификатов. Кроме того, кальцификация не обнаруживается в висцеральных артериях, а также в глубине бедренной артерии далее, чем на 1-2 см после ее отхождения от общей бедренной артерии. Таким образом, с одной стороны, наблюдается симметрия между левой и правой подвздошной и бедренной артериями, с другой стороны, отмечается минимальная симметрия атеросклеротического поражения в определенных сегментах артерий нижних конечностей. Определено, что в более крупных артериях заболевание выражено гораздо сильнее, чем в мелких.
Общеизвестно, что маммарная артерия, за очень редкими исключениями, не поражается атеросклерозом. То же относится к интрамуральным участкам коронарных артерий, которые всегда свободны от атеросклеротических изменений, даже у пациентов с очень обширными кальцифицированными и некальцифицированными АСБ в сегментах коронарных артерий. Эти данные дали основание авторам Haverich A и Boyle ЕС считать, что такие различия отражают фундаментальные черты патогенеза атеросклероза, которые идут вразрез с догмой, утверждающей, что атеросклероз является генерализованным заболеванием [6].
Знаменитый иммунолог и лауреат Нобелевской премии за 1908г И. И. Мечников высказал предположение, что избыток белка в рационе человека потенциально токсичен и ускоряет процесс старения. Вдохновленный гипотезой И. И. Мечникова, молодой экспериментатор-патолог Игнатовский А. И., работавший в Военномедицинской академии в Санкт-Петербурге, провел эксперименты на кроликах, которых он кормил большим количеством мяса, яиц и молока. Он обнаружил, что у кроликов, находящихся на богатой белками диете, помимо изменений печени, селезенки и почек, наблюдались выраженные изменения артерий, напоминавшие атеросклероз у человека. Позднее он постепенно сузил диапазон факторов питания и показал, что к изменениям сосудов приводило простое добавление в пищевой рацион ХС, выделенного из яичных желтков. Вслед за этой работой его коллега, Аничков Н.Н., проверил идею о том, что эти изменения связаны с воздействием ХС, и начал эксперименты, в которых кормил кроликов очищенным ХС. Он обнаружил, что ХС вызывает изменения артерий, которые выглядят сходно с атеросклеротическими изменениями у человека, наблюдающимися при вскрытии. Поэтому Аничков Н. Н. был убежден, что именно ХС пищи является причиной атеросклероза. Он слегка пересмотрел свою теорию в 1924г, и в результате появилась “холестериновая гипотеза” или “липидная гипотеза” — концепция, согласно которой высокие уровни ХС в крови приводят к отложению липидов на стенках сосудов [6].
“Атеросклероз не является генерализованным заболеванием” — этот тезис противников Аничкова Н. Н. важен по разным причинам. Генерализованное заболевание представляется им как заболевание, протекающее стандартно по всем своим показателям. Если в каких-то сосудах вследствие болезни появляются бляшки, они должны быть во всех сосудах. Негенерализованность атеросклероза в понимании Haverich A и Boyle ЕС позволяет им дискредитировать ишемическую болезнь сердца (ИБС) как не идентичную атеросклерозу коронарных артерий. По их мнению, ИБС не имеет отношения к атеросклерозу. Вследствие такого подхода результаты многочисленных крупнейших исследований, обогативших медицинскую терапевтическую практику, особенно в последние два-три десятилетия, можно признать “негодными” [8][9].
Как известно, в практической медицине и научной литературе применяется термин “ишемическая болезнь сердца” как некий аналог атеросклероза коронарных артерий. В ряде исследований обсуждается весьма актуальный вопрос об инфаркте миокарда (ИМ) при отсутствии стеноза в артериях, т.е. так называемый необструктивный вариант острого ИМ или острого коронарного синдрома (ОКС). MINOCA (Myocardial infarction with non-obstructive coronary arteries, необструктивный ИМ) — это синдром, характеризующийся клиническими признаками ИМ с нормальной коронарной ангиографией; допускается стеноз артерии до 50% просвета артерии [10-12]. Их диагностика достаточно сложна, а в определенной степени невозможна. По данным Niccoli G и Camici PG (2020) частота подобных вариантов ИМ составляет ~10% (точнее — в пределах 4,6-11,1% случаев), и это достаточно малая часть от всех случаев острого ИМ [10]. Вместе с тем, 90% острых ИМ и ОКС вполне доступны для точного диагноза и назначения необходимого лечения. Легко согласиться с тем, что диагноз ИБС не всегда соответствует своему названию, но огульно отрицать его достоинства было бы гораздо более серьезной ошибкой, чем обходиться без него.
Механизмы, лежащие в основе MINOCA, разнообразны. Недавно предложенная классификация выделяет эпикардиальные (нестабильная АСБ, не обнаруживаемая при ангиографии, эпикардиальный спазм или расслоение коронарных артерий) и микрососудистые причины. Последние, в свою очередь, можно разделить на внутренние (микрососудистый спазм, синдром такоцубо и коронарная эмболизация) и внешние (миокардит). Нестабильные АСБ и расслоение коронарных артерий, разрыв или эрозия АСБ попадают под классификацию ИМ I типа. Дисфункциональная микроциркуляция вызывает некроз миокарда с последующим сдавливанием просвета из-за отека миокарда. Кардиомиопатия такоцубо часто проявляется как ОКС с изменениями сегмента ST и обычно сопровождается повышением уровней маркеров некроза миокарда. Клиническая картина в некоторых случаях может быть более тяжелой, с острой сердечной недостаточностью вплоть до шока.
Прогноз MINOCA вариабелен и зависит от основной причины с клиническими подгруппами высокого риска. Правильная диагностическая процедура включает тесты первого уровня (клинические/ анамнестические, электрокардиограмму, ферменты некроза миокарда, транскардиальную эхокардиографию, коронарную ангиографию, вентрикулографию) и тесты второго уровня (внутрикоронарную ангиографию, коронарный вазомоторный тест, магнитно-резонансную томографию сердца). Летальность при необструктивном варианте острого ИМ, по данным разных авторов, значительно ниже, чем при обычных формах ИМ: 1,1-5,8% vs 2,1-14% [10].
Эксперименты Аничкова Н.Н. по добавлению ХС в пищевой рацион кроликов были первыми, в которых пищевые жиры были связаны с процессом заболевания, — идея, которая позднее была развита в 1950-х гг, но она вновь подверглась серьезному пересмотру [8][9][13]. В указанных статьях уже заголовки поражают своей грубостью. Откровенно говоря, получается так, что негенерализованность — лучший вариант заболевания, т.к. у человека не формируются атероматозные бляшки во всех артериях.
Говоря об атеросклерозе, ряд авторов пытаются развенчать некоторые неверные, с их точки зрения, представления. Первое: атеросклерозом страдают не только люди, но и многие виды животных: травоядные, всеядные и хищники. Второе: значимость в развитии атеросклероза таких факторов риска (ФР) как ожирение, отсутствие физической активности и высокое содержание насыщенных жиров в рационе.
В том, что атеросклерозом заболевают и некоторые животные, нет ничего особенного. Наоборот, этот факт свидетельствует о большей распространенности атеросклероза в нашем мире. У ряда животных атеросклероз развивается при гиперхолестеринемии, что еще раз доказывает тесную связь атеросклероза с повышенным уровнем ХС в крови. Оппоненты утверждают, что атеросклероз на самом деле является древним заболеванием, поскольку выраженный атеросклероз был обнаружен у многих мумий. Так, в исследовании HORUS (названном по имени древнеегипетского бога Гора), были обнаружены признаки атеросклероза у египетских и перуанских мумий, мумий народов пуэбло на юго-западе США и алеутов; все они представляют самые различные временные периоды, географические регионы и типы питания [14]. Атеросклероз обнаруживался у 37% всех мумий, средний возраст которых составлял 37 лет.
Наличие атеросклероза и у древних мумий никак не оспаривает представление о том, что атеросклероз — заболевание, неотрывно связанное с образом жизни. Жизнь человека во всех эпохах сопровождалась всевозможными тяготами, голодом, трагическими ситуациями, различными заболеваниями и, конечно, большим физическим напряжением. Кстати, о диете в древности: мумии, у которых был атеросклероз, оказывается, относились к числу знати и при жизни были любителями вкусно и жирно поесть [14].
На фоне идентичных системных рисков заболевания в пораженных и непораженных атеросклерозом участках артерий известны определенные анатомические области артериального древа с выраженными и опасными атеросклеротическими изменениями, в то время как другие области никогда не поражаются атеросклерозом. Эта клинико-патологическая картина вызывает у некоторых вопросы, результатом которых становится критический взгляд на современный патогенез атеросклероза, а именно: какие локальные факторы защищают определенные части артерий от атеросклероза на фоне системного влияния ФР? Ответить на этот вопрос действительно трудно. В первую очередь из-за того, что он выпадает из ряда вопросов, имеющих какое-то логическое обоснование.
С годами появлялось все больше исследований, где прослеживалась связь между количеством ХС в рационе и атеросклерозом, хотя ряд кардиологов и диетологов продолжали скептически относиться к этим утверждениям, поскольку с их точки зрения, доказательства отсутствовали [15].
Stehbens W — один из наиболее ярых противников холестериновой теории — утверждает, что гипотеза о связи ХС с заболеваниями сердца основывается на ложных предпосылках, таких как неверное использование термина “ИБС” как эквивалента коронарного атеросклероза, ложных данных по смертности, систематической ошибке при наборе больных по возрасту, и “слишком рьяных исследователях” [8][9]. Последние слова намекают на подделку. Другой противник Аничкова Н.Н. DuBroff R критикует заодно лечение статинами как ложно интерпретированные, поскольку препараты снижали смертность, обусловленную ИБС, а не атеросклерозом коронарных артерий; на общую смертность они часто не влияли [16].
Оппоненты Аничкова Н. Н. удивляются тому, что большинство исследователей верит, что снижение сердечно-сосудистой смертности в таких странах как США, где статины широко применяются, является следствием их применения. Авторы считают, что свой вклад могли внести другие ФР, например, отказ от курения, распространенность которого также снизилась. Переход на средиземноморскую диету, по данным ряда исследований, был столь же эффективен, как прием липидснижающих препаратов [17][18].
Крупное исследование Cho Y, et al. (2020) [19] дает доказательства важности статинов в снижении смертности. В исследовании наблюдали за 81729 пожилыми людьми азиатского происхождения в возрасте ≥75 лет без признаков ИБС. Для исследования эффективности статинов среди пожилых авторы включили в исследование 3670 пациентов: принимавших статины, начиная с 2012 по 2014гг, в соотношении 1:2 (это была контрольная группа лиц, не принимавших статины). У пациентов без статинотерапии, произошло 206 ИМ, 1025 инсультов, 761 смерть. У пациентов на фоне приема статинов, нежелательные сердечно-сосудистые события наблюдались реже: 116 ИМ, 637 инсультов, 137 смертей. Все различия в исходах между двумя группами сравнения высоко достоверны. Этот новейший результат показывает эффективность статинов в предупреждении не только острого ИМ и инсульта, но и смерти от любых причин [19].
Часто работу Аничкова Н.Н. критиковали в связи с крайне высокими уровнями ХС в сыворотке крови кроликов (500-1000 мг/дл). Сравнимые результаты ни разу не были получены у нетравоядных видов животных, например, у собак или крыс.
Как уже упоминалось, работы Аничкова Н.Н. оставались почти неизвестными на протяжении многих лет. Единственной публикацией на английском языке до 1950г была глава в первом издании “Arteriosclerosis” Cowdry (1933). Лишь в 1950г работы Аничкова Н.Н. по ХС и атеросклерозу получили международное признание, что произошло после публикации Gofman J, Lindgren FT, озаглавленной “Роль липидов и липопротеинов в атеросклерозе” [20].
В ней авторы специально оговаривают, что Аничков Н. Н. первым обнаружил связь между уровнем ХС в пищевом рационе и заболеваниями сосудов, и сообщают, что, используя методы Аничкова Н.Н., они подтвердили и расширили его выводы. Стоит напомнить, что группа Gofman J и Lindgren FT впервые успешно использовала аналитическое ультрацентрифугирование для разделения сыворотки крови на фракции липопротеинов низкой плотности (ЛНП) и липопротеинов высокой плотности [21]. Используя этот метод, они показали тесную корреляцию ЛНП с атеросклерозом как у кроликов, так и у человека [22]. Это вызвало огромный интерес к исследованиям по атеросклерозу, индуцируемому ХС, и к работам Аничкова Н.Н. через 40 лет после того, как он сделал первые открытия в этой области.
Оппоненты “холестериновой теории атеросклероза” нередко отрицательно оценивают исследования многих известных ученых и особенно Keys A — одного из наиболее известных своими крупными исследованиями. В 1953г он опубликовал данные по связи между смертностью от дегенеративного заболевания сердца и процентной долей жиров в общей калорийности рациона питания для населения шести разных стран (Япония, Италия, Англия и Уэльс, Австралия, Канада и США) [23]. У мужчин в возрасте 55-59 лет выявлялась тесная взаимосвязь между процентом жиров от общей калорийности рациона и смертностью от заболеваний сердца. В связи с этим Keys A сделал вывод, что пищевой рацион, т.е. фактор питания, был основным фактором, вносящим вклад в уровень липидов крови [24]. Выводы Keys A сразу же подверглись резкой критике со стороны Yerushalmy J и Hilleboe HE [25].
Keys A это не смутило, и в 1958г он начал “Исследование в семи странах”. Это было самое крупное клиническое исследование, в котором почти в течение 30 лет проспективно изучалась связь между образом жизни, питанием и распространенностью сердечно-сосудистых заболеваний (ССЗ) у мужчин среднего возраста из США, Японии, Греции, Югославии, Италии, Финляндии и Нидерландов [26]. Эти страны были выбраны вследствие различного уклада жизни, традиций питания, распространенности ФР и хронических заболеваний сердца и уровня смертности. Противники “холестериновой теории атеросклероза” высказывали предположение о том, что эти страны могли быть “отобраны” на основании ранее полученных результатов [25].
В начале 1980-х гг в США было начато крупное двойное слепое рандомизированное исследование “Исследование первичной коронарной профилактики” по изучению влияния снижения уровня ХС в плазме крови посредством медикаментозной терапии, которое спонсировал Национальный институт здоровья США. Было продемонстрировано статистически значимое снижение сердечно-сосудистых конечных точек после снижения уровня ХС в крови посредством лекарственных препаратов. Все участники исследования находились на диете с ограничением потребления ХС, поэтому исследование не позволяло напрямую оценить степень влияния снижения уровня ХС, вызванного диетой. Несмотря на это, после публикации результатов исследования, Национальный институт здоровья США организовал согласительную конференцию, где была выработана рекомендация по ограничению количества ХС в рационе и соблюдению диеты с низким содержанием жиров с преобладанием ненасыщенных жирных кислот [27].
Идея о том, что ХС вызывает атеросклероз, стала главенствующей в 1990-х гг. Это было время торжества “холестериновой теории атеросклероза” и выдающихся успехов в его лечении статинами, другими эффективными препаратами и немедикаментозными методами.
Холестериновая гипотеза атерогенеза утверждает, что высокие концентрации ХС ЛНП в крови вызывают атеросклероз, и, если это верно, можно ожидать, что снижение уровня ХС ЛНП будет приводить к уменьшению атеросклероза или, по крайней мере, остановит его развитие. Активная холестерин-снижающая терапия при атеросклерозе стала стандартной медицинской практикой после того, как в исследованиях со статинами было установлено снижение смертности от ИБС [28]. Было высказано предположение, что изначально рекомендованный в качестве целевого уровень ХС ЛНП <100 мг/дл (2,6 ммоль/л) следует уменьшить до <70 мг/дл (1,8 ммоль/л) или <55 мг/дл (1,4 ммоль/л) [29].
Одновременно накапливались данные многочисленных эпидемиологических исследований, которые поддерживали гипотезу о роли инфекции в развитии ССЗ. Титры антител к конкретным патогенам коррелировали с риском атеросклероза, наличием ССЗ и смертностью от них [30][31]. Однако были получены и противоречащие этому данные, согласно которым связь между наличием серологического ответа на инфекции и ССЗ отсутствовала.
Одна из наиболее тесных ассоциаций между острой инфекцией и сердечно-сосудистыми событиями — это связь между ИМ и респираторными инфекциями, особенно гриппом и внебольничной пневмонией. Острый ИМ чаще развивается зимой, когда увеличивается число респираторных инфекций [32]. Метаанализ 16 эпидемиологических исследований выявил статистически значимую зависимость между недавно перенесенной респираторной инфекцией и остановкой сердца [33]. Тот факт, что вакцинация от гриппа и пневмококковой инфекции статистически значимо снижает частоту ССЗ, — другой признак того, что острая инфекция играет определенную роль в поражении сердца [34].
Некоторые из наиболее значимых ассоциаций между хронической инфекцией и ССЗ включают H. pylori [35]. Есть также убедительные данные о том, что периодонтит — хроническая мультибактериальная инфекция десен — связан с ССЗ [36]. Плохое состояние зубов связано с ростом частоты ИМ, риск ИБС возрастает с ростом тяжести периодонтита [37]. В датском исследовании было обнаружено, что у пациентов с периодонтитом риск ССЗ вдвое выше, чем у пациентов со здоровыми деснами [38]. Недавно по результатам крупного голландского исследования, включавшего 60174 участника, был сделан вывод, что периодонтит является независимым ФР атеросклероза [39].
Роль воспаления в АСБ обсуждается уже давно, начиная с середины XIXв по идее Вирхова Р. [40]. Макроскопически заметное воспаление в эпикардиальных коронарных артериях при хирургической реваскуляризации у пациентов с ОКС было одним из исходных стимулов для исследователей Haverich A и Boyle ЕС [6]. Это местное проявление воспаления на участке острой окклюзии коронарных артерий отметили также интервенционные кардиологи в Греции. Ими описано заметное повышение температуры при ОКС на участке окклюзии по сравнению с другими участками артерий (проксимальными или дистальными сегментами той же артерии, ветвями коронарных артерий, остающимися с нормальной температурой) без атеросклероза. Теперь знаем, что воспаление само по себе играет важную роль на всех этапах атеросклероза, включая начало, прогрессирование и, наконец, развитие тромбоза [6].
C-реактивный белок (СРБ) является компонентом острой фазы воспалительного ответа и используется как маркер воспаления. В эпидемиологических исследованиях определение уровня СРБ в сыворотке крови высокочувствительным методом, что дает так называемый высокочувствительный показатель СРБ или вчСРБ, позволяет точно предсказать риск нежелательных сердечно-сосудистых событий [41][42]. Однако исследования у лиц с вариантами гена СРБ, которые приводят к разным уровням СРБ в плазме, четко показывают, что СРБ не участвует в патогенезе атеросклероза.
Мысль о том, что воспаление лежит в основе развития атеросклероза, не лишена смысла в свете других, ранее идентифицированных ФР. Действительно, воспаление часто сопровождает многие из ФР атеросклероза. Например, окисленные ЛНП и кристаллический ХС активируют инфламмасому NLRP3, что приводит к опосредуемой каспазой-1 активации и секреции провоспалительных цитокинов семейства интерлейкина (ИЛ)-1 [43].
Вследствие провоспалительной природы жировой ткани ожирение связано с повышенным уровнем системного воспаления [44]. Считается, что воспаление играет роль в развитии артериальной гипертонии; инфекционные заболевания, сахарный диабет, хронические болезни почек и курение также ассоциируются с повышенными уровнями системного воспаления [45]. Сообщается о связи клонального гемопоэза с риском развития атеросклероза. В мышиных моделях КГНП (клональный гемопоэз с неопределенным потенциалом) в макрофагах повышена экспрессия некоторых хемокинов и провоспалительных цитокинов [46][47]. Следовательно, воспаление представляет собой явление, общее почти для всех выявленных ФР атеросклероза. Поэтому было выдвинуто предположение, что оно является разумной мишенью как для профилактических, так и лечебных вмешательств.
В исследовании CANTOS (Canakinumab ANtiinflammatory Thrombosis Outcomes Study; Исследование противовоспалительных свойств канакинумаба) по исходам, связанным с тромбозом, изучали, может ли снижение воспаления у пациентов, ранее перенесших ИМ, снизить риск сердечно-сосудистых событий в будущем [48]. Действие канакинумаба направлено на подавление активности воспалительного цитокина — ИЛ-1β, который входит в состав инфламмасомы (NLRP3), взаимодействующей с ХС, что приводит к усилению воспаления. Используя моноклональные антитела, нейтрализующие ИЛ-1β (канакинумаб), исследователи не нашли изменений в уровне ХС ЛНП, но отметили статистически значимое снижение уровней вчСРБ и ИЛ-6. ИЛ-6 — другой воспалительный цитокин, активирующийся на следующих стадиях сигнального пути. У пациентов, получавших канакинумаб, на ~15% снижался риск ИМ, инсульта или смерти от сердечно-сосудистых причин, и на ~30% снижалась необходимость стентирования или аортокоронарного шунтирования [49]. Таким образом, это исследование дало первые прямые данные о том, что воспаление играет роль в развитии атеросклероза.
Важно отметить, что общая смертность в группе канакинумаба статистически значимо возросла вследствие роста частоты инфекций со смертельным исходом. Поэтому тактика, направленная на борьбу с воспалением, всегда должна учитывать наличие воспаления для должной иммунной защиты и заживления повреждений, а не только его негативное влияние на развитие атеросклероза.
Любой хороший эпидемиолог может напомнить нам, что ФР необязательно являются факторами, вызывающими заболевание. Например, осушение болот сокращает заболеваемость малярией. Однако нельзя делать ложный вывод, что болота вызывают малярию: на самом деле, это размножающиеся в болотах малярийные комары отвечают за распространение инфекции [6].
Считаем целесообразным процитировать высказывание Haverich A по рассматриваемой проблеме: “Основываясь на своих хирургических наблюдениях, я критически относился ко многим гипотезам, касающимся патогенеза атеросклероза, поскольку две важные парадигмы, по-видимому, неверны. Во-первых, атеросклероз не является генерализованным заболеванием, поскольку определенные части артериальной системы у человека почти никогда не поражаются атеросклерозом. Вовторых, заболевание не зарождается в эндотелии пораженного сосуда. Все больше данных и мои собственные наблюдения поддерживают теорию “снаружи внутрь” при зарождении и прогрессировании атеросклероза, когда воспаление сосудов начинается в адвентиции и распространяется внутрь, в направлении интимы” [6].
Справедливости ради, следует согласиться, что в течение долгих лет наука действительно обходилась без упоминания роли vasa vasorum в происхождении атеросклероза. Очевидно, дальнейшие исследования должны представить новые результаты, важные для полноты изучения атеросклероза, и отворить двери перед читателями о малоизвестной саге под названием “микрососуды сердца”.
Важный вопрос: где начинается атеросклероз? В редких случаях инфекционной агрессии, по-видимому, имеется возможность раннего зарождения атеросклероза в адвентиции артерии и переход болезни к интиме. Но этот вариант не является классическим вариантом атеросклероза и наблюдается редко. Что касается ранее обсуждаемой проблемы генерализованности процесса атеросклероза, то “негенерализованность” лучше “генерализованности”, потому что при генерализованном варианте, как показали авторы Haverich A и Boyle ЕС [6], течение болезни должно быть более тяжелым и, следовательно, приведет к большей летальности, чем при так называемой “негенерализованности”, т.е. при более щадящем варианте.
И наконец, хотелось бы снова вернуться к Аничкову Н.Н. и Халатову С.С. в связи с той негативной оценкой, которую им дал когда-то Davies Н. Об исследованиях Аничкова Н.Н. и Халатова С.С. написано много. Приведем здесь только одно высказывание известного американского патолога Dock W [50]: “Эксперименты, проведенные в Военно-медицинской академии и приведшие к нашим современным знаниям об атеросклерозе, замечательны во многих отношениях… Идея, что роковое заболевание может быть обусловлено избытком питательных веществ в пище, является революционной. Поэтому ранняя работа Аничкова Н. Н. сравнима с открытием Гарвеем кровообращения и Лавуазье дыхательного обмена кислорода и углекислоты”. Итак, научный подвиг Аничкова Н.Н. и его соратников оценен достойно [50].
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Anitschkow N, Chalatow S. Ueber experimentelle Cholesterinsteatose und ihre Bedeutung fuer die Entstehung einiger pathologischer Prozesse. Zentrbl Allg Pathol Pathol Anat. 1913;24:1-9.
2. Anichkov NN. Experimental arteriosclerosis in animals. In: Cowdry EV, editor, Arteriosclerosis: A survey of the problem. New York: MacMillan Publishing. 1933. p. 271-322.
3. Anitschow NN. Deuxieme conference international de pathologie geographyque. Oosthoek;1935.
4. Климов А. Н. К спорам о холестерине. Кардиология.1992;2:3-8.
5. Davies H. Atherogenesis and the coronary arteries of childhood. Int J Cardiol. 1990;28(3):283-91. doi:10.1016/0167-5273(90)90310-2.
6. Haverich A, Boyle E. Atherosclerosis Pathogenesis and Microvascular Dysfunction. Springer, 2019. 130 p. ISBN: 978-3-030-20244-6.
7. Kannel WB, Dawber TR, Kagan A, et al. Factors of risk in the development of coronary heart disease — six-year follow-up experience. The Framingham Study. Ann Intern Med. 1961;55:33- 50. doi:10.7326/0003-4819-55-1-33.
8. Stehbens WE. Coronary heart disease, hypercholesterolemia, and atherosclerosis I. False premises. Exp Mol Pathol. 2001;70:103-19. doi:10.1006/exmp.2000.2340.
9. Stehbens WE. Coronary heart disease, hypercholesterolemia, and atherosclerosis II. Misrepresented Data. Exp Mol Pathol. 2001;70:120-39. doi:10.1006/exmp.2000.2339.
10. Niccoli G, Camici PG. Myocardial infarction with non-obstructive coronary arteries: what is the prognosis? Eur Heart J. 2020;22(Suppl E):E40-5. doi:10.1093/eurheartj/suaa057.
11. Lüscher TF. Revisiting angina pectoris with and without obstructive coronary artery disease. Eur Heart J. 2018; 39(23):2119-22. doi:10.1093/eurheartj/ehy335.
12. Kaski JC, Crea F, Gersh BJ, Camici PG. Reappraisal of Ischemic Heart Disease. Circulation. 2018;138(14):1463-80. doi:10.1161/CIRCULATIONAHA.118.031373.
13. McMichael J. Fats and atheroma: an inquest. Br Med. 1979;1:173-5. doi:10.1136/bmj.1.6157.173.
14. Allam AH, Thompson RC, Wann LS, Miyamoto MI et al. Atherosclerosis in ancient Egyptian mummies: the Horus study. JACC Cardiovasc Imaging. 2011;4(4):315-27. doi:10.1016/j.jcmg.2011.02.002.
15. Dayton S, Pearce ML. Diet high in unsaturated fat. A controlled clinical trial. Minn Med. 1969;52:1237-42. doi:10.1161/01.cir.40.1s2.ii-1.
16. DuBroff R, de Lorgeril M. Cholesterol confusion and statin controversy. World J Cardiol. 2015;7:404-9. doi:10.4330/wjc.v7.i7.404
17. Chiuve SE, Fung TT, Rexrode KM, et al. Adherence to a low-risk, healthy lifestyle and risk of sudden cardiac death among women. JAMA. 2011;306(1):62-9. doi:10.1001/jama.2011.907.
18. Åkesson A, Larsson SC, Discacciati A, Wolk A. Low-risk diet and lifestyle habits in the primary prevention of myocardial infarction in men: a population-based prospective cohort study. J Am Coll Cardiol. 2014;64:1299-306. doi:10.1016/j.jacc.2014.06.1190.
19. Cho Y, Jeong Y, Seo DH, et al. Use of statin for the primary prevention of cardiovascular outcomes in elderly patients: A propensity-matched cohort study. Atherosclerosis. 2021;328:92- 9. doi:10.1016/j.atherosclerosis.2021.05.022.
20. Gofman JW, Lindgren F. The role of lipids and lipoproteins in atherosclerosis. Science. 1950;111:166-71. doi:10.1126/science.111.2877.166.
21. Gofman JW, Lindgren FT, Elliott H. Ultracentrifugal studies of lipoproteins of human serum. J Biol Chem. 1949;179:973-9.
22. Gofman JW, Jones HB, Lindgren FT, et al. Blood lipids and human atherosclerosis. Circulation. 1950;2:161-78. doi:10.1161/01.cir.2.2.161.
23. Keys A. Atherosclerosis: a problem in newer public health. J Mt Sinai Hosp N-Y. 1953;20:118-39.
24. Keys A, Anderson JT, Fidanza F, et al. Effects of diet on blood lipids in man. Clin Chem. 1955;1:34.
25. Yerushalmy J, Hilleboe HE. Fat in the diet and mortality from heart disease; a methodologic note. N Y State J Med. 1957;57:2343-54.
26. Keys A, Blackburn H, Menotti A, et al. Coronary heart disease in seven countries. Circulation. 1970; 41(Suppl 1):1-211.
27. Steinberg D. Lowering blood cholesterol to prevent heart disease. NIH Consensus Development Conference statement. Arterioscler Thromb Vasc Biol. 1985;5:404-12.
28. Scandinavian Simvastatin Survival Study Group. Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: The Scandinavian Simvastatin Survival Study (4S). Lancet. 1994;344:1383-9.
29. Mach F, Baigent C, Catapano AL, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Atherosclerosis. 2019;290:140-205. doi:10.1016/j.atherosclerosis.2019.08.014.
30. Jha HC, Prasad J, Mittal A. High immunoglobulin A seropositivity for combined Chlamydia pneumoniae, Helicobacter pylori infection, and high-sensitivity C-reactive protein in coronary artery disease patients in India can serve as atherosclerotic marker. Heart Vessels. 2008;23:390-6. doi:10.1007/s00380-008-1062-9.
31. Roberts ET, Haan MN, Dowd JB, Aiello AE. Cytomegalovirus antibody levels, infammation, and mortality among elderly Latinos over 9 years of follow-up. Am J Epidemiol. 2010;172:363-71. doi:10.1093/aje/kwq177.
32. Spencer FA, Goldberg RJ, Becker RC, Gore JM. Seasonal distribution of acute myocardial infarction in the second National Registry of Myocardial Infarction. J Am Coll Cardiol. 1998;31:1226-33. doi:10.1016/s0735-1097(98)00098-9.
33. Barnes M, Heywood AE, Mahimbo A, et al. Acute myocardial infarction and influenza: a meta-analysis of case-control studies. Heart. 2015;101:1738-47. doi:10.1136/heartjnl-2015-307691.
34. Vlachopoulos CV, Terentes-Printzios DG, Aznaouridis KA, et al. Association between pneumococcal vaccination and cardiovascular outcomes: a systematic review and metaanalysis of cohort studies. Eur J Prev Cardiol. 2015;22:1185-99. doi:10.1177/2047487314549512.
35. Diomedi M, Pietroiusti A, Silvestrini M, et al. CagA-positive Helicobacter pylori strains may influence the natural history of atherosclerotic stroke. Neurology. 2004;63:800-4. doi:10.1212/01.wnl.0000138025.82419.80.
36. Lockhart PB, Bolger AF, Papapanou PN, et al. Periodontal disease and atherosclerotic vascular disease: does the evidence support an independent association?: a scientific statement from the American Heart Association. Circulation. 2012;125:2520-44. doi:10.1161/CIR.0b013e31825719f3.
37. de Oliveira C, Watt R, Hamer M. Toothbrushing, inflammation, and risk of cardiovascular disease: results from Scottish Health Survey. BMJ. 2010;340:c2451. doi:10.1136/bmj.c2451.
38. Hansen GM, Egeberg A, Holmstrup P, Hansen PR. Relation of periodontitis to risk of cardiovascular and all-cause mortality (from a Danish nationwide cohort study). Am J Cardiol. 2016;118:489-93. doi:10.1016/j.amjcard.2016.05.036.
39. Beukers NGFM, van der Heijden GJMG, van Wijk AJ, Loos BG. Periodontitis is an independent risk indicator for atherosclerotic cardiovascular diseases among 60,174 participants in a large dental school in the Netherlands. J Epidemiol Community Health. 2017;71:37-42. doi:10.1136/jech-2015-206745.
40. Virchow R. Cellular pathology. 1860.
41. Emerging Risk Factors Collaboration, Kaptoge S, Di Angelantonio E, et al. C-reactive protein concentration and risk of coronary heart disease, stroke, and mortality: an individual participant meta-analysis. Lancet (London, England). 2010;375:132-40. doi:10.1016/S0140-6736(09)61717-7.
42. Wennberg P, Wensley F, Di Angelantonio E, et al. Haemostatic and inflammatory markers are independently associated with myocardial infarction in men and women. Thromb Res. 2012;129:68-73. doi:10.1016/j.thromres.2011.05.015.
43. Sheedy FJ, Grebe A, Rayner KJ, et al. CD36 coordinates NLRP3 inflammasome activation by facilitating intracellular nucleation of soluble ligands into particulate ligands in sterile infammation. Nat Immunol. 2013;14:812-20. doi:10.1038/ni.2639.
44. Després JP. Health consequences of visceral obesity. Ann Med. 2001;33:534-41. doi:10.3109/07853890108995963.
45. Altman R. Risk factors in coronary atherosclerosis atheroinflammation: the meeting point. Thromb J. 2003;1:1-11. doi:10.1186/1477-9560-1-4.
46. Jaiswal S, Natarajan P, Silver AJ, et al. Clonal hematopoiesis and risk of atherosclerotic cardiovascular disease. N Engl J Med. 2017;377(2):111-21. doi:10.1056/NEJMoa1701719.
47. Fuster JJ, MacLauchlan S, Zuriaga MA, et al. Clonal hematopoiesis associated with TET2 defciency accelerates atherosclerosis development in mice. Science. 2017;355:842-7. doi:10.1126/science.aag1381.
48. Ridker PM, Thuren T, Zalewski A, Libby P. Interleukin-1β inhibition and the prevention of recurrent cardiovascular events: rationale and design of the Canakinumab Anti-inflammatory Thrombosis Outcomes Study (CANTOS). Am Heart J. 2011;162:597-605. doi:10.1016/j.ahj.2011.06.012.
49. Ridker PM, Everett BM, Thuren T, et al. Antiinflammatory therapy with canakinumab for atherosclerotic disease. N Engl J Med. 2017;377:1119-31. doi:10.1056/NEJMoa1707914.
50. Dock W. Research in arteriosclerosis; the first fifty years. Ann Intern Med. 1958;49(3):699-705. doi:10.7326/0003-4819-49-3-699.
Об авторах
Д. М. АроновРоссия
Аронов Давид Меерович — доктор медицинских наук, профессор, заслуженный деятель науки РФ, главный научный сотрудник
Москва
М. Г. Бубнова
Россия
Бубнова Марина Геннадьевна — доктор медицинских наук, профессор, руководитель отдела реабилитации и вторичной профилактики сердечно-сосудистых заболеваний
Москва
О. М. Драпкина
Россия
Драпкина Оксана Михайловна — доктор медицинских наук, профессор, член-корреспондент РАН, директор
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Аронов Д.М., Бубнова М.Г., Драпкина О.М. Патогенез атеросклероза через призму нарушения функций микрососудов. Кардиоваскулярная терапия и профилактика. 2021;20(7):3076. https://doi.org/10.15829/1728-8800-2021-3076
For citation:
Aronov D.M., Bubnova M.G., Drapkina O.M. Atherosclerosis pathogenesis from the perspective of microvascular dysfunction. Cardiovascular Therapy and Prevention. 2021;20(7):3076. https://doi.org/10.15829/1728-8800-2021-3076

























































