Перейти к:
Мощность замедления и ускорения ритма сердца у больных с гипертрофической кардиомиопатией: результаты пятилетнего проспективного исследования
https://doi.org/10.15829/1728-8800-2022-3130
Аннотация
Цель. Изучение особенностей мощности замедления ритма (deceleration capacity, DС) и мощности ускорения ритма сердца (acceleration capacity, АС) у больных с гипертрофической кардиомиопатией (ГКМП) и оценка соотношений данных показателей с известными осложнениями и факторами риска внезапной сердечной смерти (ВСС).
Материал и методы. Обследованы 50 пациентов с ГКМП. Сопоставимая по полу и возрасту контрольная группа включала 50 лиц, не страдающих сердечно-сосудистыми заболеваниями. Всем пациентам проводили суточное мониторирование электрокардиограммы с определением DC и AC. Наблюдение осуществлялось в течение 5 лет. Летальные исходы зафиксированы у 6%, в т.ч. ВСС составила 4%.
Результаты. Больные с ГКМП характеризовались достоверно более низкими средними значениями DC — 5,5 [3,7; 7,4] vs 7,8 [7,1; 8,5] мс (p=0,0001) и достоверно более высокими значениями АС — -7,4 [-8,9; -5,8] vs -9,3 [-10,0; -8,6] мс (p=0,001) по сравнению с контрольной группой. У 36% пациентов с ГКМП выявлялись патологические значения DC ≤4,5 мс, в то время как у всех лиц в группе контроля значения этого показателя соответствовали благоприятному прогнозу (p=0,001). У пациентов с неустойчивой желудочковой тахикардией (нЖТ) снижение DC выявляли в 56% случаев, без нЖТ в 25,5% случаев (p=0,043), с хронической сердечной недостаточностью (ХСН) у 78% пациентов, без ХСН у 27% (p=0,016). У больных с ХСН (p=0,003) и пароксизмами фибрилляции предсердий (p=0,023) средние значение DC были достоверно ниже, чем у пациентов с отсутствием данных осложнений. ХСН явилась независимым предиктором снижения DC. Не выявлено соответствия снижения DC увеличению риска ВСС, рассчитанному с помощью калькулятора HCM Risk-SCD (шкала риска ВСС при ГКМП).
Заключение. Пациенты с ГКМП по сравнению со здоровыми лицами характеризуются более низкой DС и более высокой АС. Среди пациентов с ГКМП снижение DC характерно для больных с более тяжелым течением заболевания (с ХСН, пароксизмами ФП, нЖТ), однако целесообразность использования показателя в стратификации риска ВСС нуждается в уточнении.
Ключевые слова
Для цитирования:
Царегородцев Д.А., Букия И.Р., Халикова М.А., Окишева Е.А. Мощность замедления и ускорения ритма сердца у больных с гипертрофической кардиомиопатией: результаты пятилетнего проспективного исследования. Кардиоваскулярная терапия и профилактика. 2022;21(7):3130. https://doi.org/10.15829/1728-8800-2022-3130
For citation:
Tsaregorodtsev D.A., Bukia I.R., Khalikova M.A., Okisheva E.A. Deceleration and acceleration capacities of heart rate in patients with hypertrophic cardiomyopathy: results of a five-year prospective study. Cardiovascular Therapy and Prevention. 2022;21(7):3130. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3130
Введение
Наиболее частой причиной внезапной сердечной смерти (ВСС) в молодом возрасте является гипертрофическая кардиомиопатия (ГКМП). Нередко ГКМП протекает бессимптомно и ВСС бывает ее единственным проявлением [1][2]. Смертность пациентов с ГКМП от ВСС при естественном течении заболевания колеблется в пределах от 1 до 6%: у взрослых составляет до 3%, в детском и подростковом возрасте, а также в отдельных подгруппах взрослых пациентов — 4-6% [1-3]. Современные методы лечения ГКМП и профилактики ВСС позволяют существенным образом улучшить прогноз при этом заболевании [4][5].
Для осуществления мер по первичной профилактике Европейское общество кардиологов (ESC) в 2014г рекомендовало математическую модель, известную как “HCM Risk-SCD” (шкала риска ВСС при ГКМП), позволяющую рассчитывать 5-летний риск ВСС. В отличие от предыдущих рекомендаций в прогностическую модель не включен гипотензивный ответ при физических нагрузках, но добавлены возраст пациента, размер левого предсердия и максимальный градиент давления в выводном тракте левого желудочка (ВТ ЛЖ). По результатам расчета калькулятора HCM Risk-SCD выделяют низкий риск (5-летний риск ВСС <4%) — имплантируемый кардиовертер-дефибриллятор (ИКД) не показан, промежуточный риск (5-летний риск ВСС ≥4%, но <6%) — ИКД может быть имплантирован, и высокий риск (5-летний риск ВСС ≥6%), являющийся показанием для имплантации ИКД [2]. Однако результаты некоторых исследований показали неточность в прогнозировании ВСС с помощью этого метода и соответствующей ИКД-терапии [6-9]. Известно, часть больных с ИКД испытывают неоправданные шоки и осложнения после операции [10]. В связи с этим необходимо дальнейшее совершенствование методов стратификации риска ВСС у больных с ГКМП. Возможными предикторами могли бы стать неинвазивные электрофизиологические (электрокардиографические) показатели, с помощью которых оценивают дисбаланс вегетативной регуляции. К числу таких маркеров относят мощность замедления (deceleration capacity, DC) и мощность ускорения (acceleration capacity, AC) сердечного ритма, продемонстрировавшие возможность их применения для стратификации риска общей, сердечно-сосудистой смерти и ВСС у пациентов, перенесших инфаркт миокарда (ИМ) [11-13]. Однако особенности этих показателей у больных с ГКМП и возможность их использования для стратификации риска ВСС при данном заболевании не исследована.
Цель исследования — изучение особенностей DС и АС у больных с ГКМП и оценка соотношений данных показателей с известными осложнениями заболевания и факторами риска ВСС.
Материал и методы
В исследование были включены 50 пациентов с ГКМП (25 мужчин, 25 женщин, средний возраст 40 [ 18; 57] лет). Критерии включения и невключения представлены в таблице 1. Диагноз ГКМП определялся при увеличении толщины стенки левого желудочка (ЛЖ), которая не объяснялась исключительно повышением нагрузки давлением [2]. По результатам эхокардиографии толщина межжелудочковой перегородки (тМЖП) составила, в среднем, 1,8 [ 1,5; 2,2] см, толщина задней стенки (тЗС) — 1,4 [ 1,2; 1,5] см, у 6 пациентов толщина стенки ЛЖ была ≥3 см. Фракция выброса ЛЖ, в среднем, составляла 64 [ 56; 72]%. У 15 больных наблюдалась обструктивная форма заболевания (средний градиент давления в ВТ ЛЖ составил 45 [ 39; 74] мм рт.ст.). У 16 пациентов зарегистрированы эпизоды неустойчивой желудочковой тахикардии (нЖТ) при суточном мониторировании электрокардиограммы (СМ ЭКГ), у 6 выявлены случаи ВСС в семье, у 5 пациентов наблюдались обмороки неясного генеза. Семейная форма диагностирована у 9 больных. У 6 пациентов в анамнезе зарегистрированы пароксизмы фибрилляции предсердий (ФП). У 9 больных по клиническим признакам (одышка, отеки нижних конечностей) выявлены признаки хронической сердечной недостаточности (ХСН) [14]. По результатам применения калькулятора HCM Risk-SCD, пятилетний риск ВСС расценен как низкий у 29 (58%) пациентов, как промежуточный у 10 (20%) больных и как высокий у 11 (22%) пациентов. Основные клинические характеристики пациентов с различной степенью риска ВСС представлены в таблице 2. Сочетание ГКМП с гипертонической болезнью наблюдалось у 10 (20%) пациентов. Первая степень повышения артериального давления (АД) диагностирована у 8% больных, вторая у 12%.
Таблица 1
Критерии включения и невключения участников основной группы

Примечание: ГКМП — гипертрофическая кардиомиопатия, ИБС — ишемическая болезнь сердца, ФП — фибрилляция предсердий.
Таблица 2
Характеристика пациентов с ГКМП в зависимости от HCM Risk-SCD
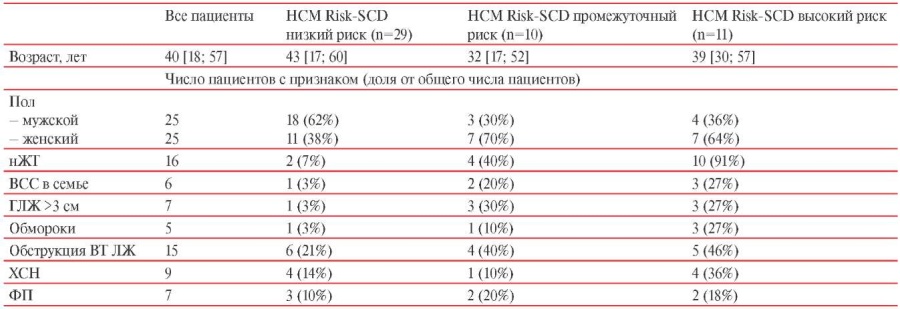
Примечание: ВСС — внезапная сердечная смерть, ВТ ЛЖ — выводной тракт левого желудочка, ГЛЖ — гипертрофия левого желудочка, нЖТ — неустойчивая желудочковая тахикардия, ФП — фибрилляция предсердий, ХСН — хроническая сердечная недостаточность, HCM Risk-SCD — шкала риска ВСС при ГКМП.
40 (80%) пациентам проводилась терапия бета-адреноблокаторами, амиодарон принимали 10 (20%) больных, блокаторы кальциевых каналов — 22% пациентов, ингибиторы ангиотензинпревращающего фермента — 32%, блокаторы ангиотензиновых рецепторов — 10% пациентов, петлевые диуретики — 10%, спиронолактон — 12% больных. Два пациента, страдавшие обструктивной формой ГКМП, ранее перенесли алкогольную септальную аблацию.
Контрольная группа, сопоставимая по полу и возрасту с группой ГКМП, состояла из 50 лиц (26 мужчин и 24 женщины), не страдающих сердечно-сосудистыми заболеваниями. Средний возраст участников составил 38 [ 17; 54] лет. Все участники основной и контрольной групп дали письменное информированное согласие на участие в исследовании, которое было одобрено и утверждено локальным этическим комитетом.
СМ ЭКГ проводили всем пациентам, включенным в исследование. Помимо стандартного определения частоты сердечных сокращений, нарушений ритма и проводимости, оценивались показатели DС и AС по методике Bauer A, et al. (2006) [11]. В основе метода лежит поэтапная компьютерная обработка ЭКГ, зарегистрированной при СМ ЭКГ. Для расчета DC из всей записи выделяются интервалы RR, которые длиннее, чем предыдущий интервал, а для вычисления AC — интервалы RR, короче предыдущего интервала. Нарушения ритма исключаются из анализа, как и эпизоды удлинения или укорочения интервалов RR на >5% с целью уменьшения количества ошибок, связанных с артефактами. Последующие преобразования включают определение сегментов вокруг опорных точек, фазовое выпрямление, усреднение сигнала в сегментах и определение средних значений всех RR интервалов для всех опорных точек. Последующий расчет DC и АС основан на определении формы импульса: центральное отклонение этой кривой отражает среднюю способность сердца замедлять или ускорять ритм при каждом последующем сокращении [15].
При анализе DC степень риска сердечно-сосудистых событий и ВСС определялась по критериям, описанным для больных, перенесших ИМ [11][13], где DС >4,5 мс была ассоциирована с благоприятным прогнозом, а при значениях ≤4,5 мс увеличивался риск общей, сердечно-сосудистой смерти и ВСС.
Всем участникам проводили контрольное СМ ЭКГ через 6 и 12 мес. В последующем наблюдение осуществлялось дистанционно в течение 5 лет (телефонный опрос пациентов или их родственников).
За время наблюдения 11 пациентам были имплантированы ИКД с целью первичной профилактики ВСС, трем — электрокардиостимуляторы по поводу синдрома слабости синусового узла. Трем пациентам с выраженной обструкцией ВТ ЛЖ выполнена миотомия гипертрофированной МЖП. За время наблюдения оправданных и неоправданных срабатываний ИКД не зафиксировано. В течение 5 лет зарегистрировано 3 (6%) смерти: две ВСС (через 5 и 23 мес. после включения в исследование) у больных, отказавшихся от имплантации ИКД, и одна смерть через 28 мес. после включения из-за острой сердечной недостаточности в послеоперационном периоде миоэктомии.
Статистический анализ. Данные представлены в виде медианы и интерквартильного размаха [Q25; Q75] или в % от общего числа пациентов. Достоверность различий оценивали с помощью критерия Манна-Уитни, критерия Уилкоксона, критерия χ2, точного критерия Фишера. Корреляционные взаимосвязи анализировали с помощью коэффициента ранговой корреляции Спирмена. Многофакторный анализ проведен с использованием логистической регрессии. Различия считали достоверными при p<0,05. Все расчеты осуществляли с помощью программного обеспечения SPSS версии 26.0.
Результаты
У пациентов с ГКМП значения DС были достоверно ниже, а значения АС достоверно выше по сравнению со здоровыми лицами (таблица 3). У 36% больных с ГКМП значения DС не превышали 4,5 мс, в то время как у всех участников группы контроля этот показатель был в пределах нормальных значений (p=0,001). Выявлена обратная корреляция умеренной силы DC с возрастом пациентов (rs=-0,452, p<0,001): для пациентов старшего возраста была характерна более низкая DC.
Таблица 3
Показатели DC/AC в основной и контрольной группах
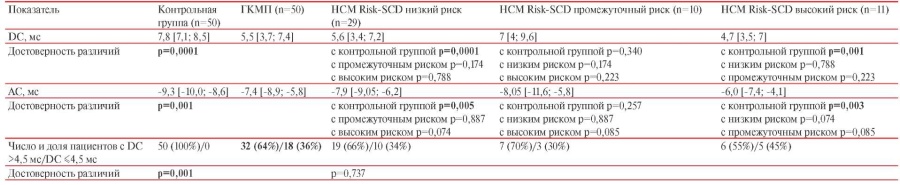
Средние абсолютные значения DC и АС у пациентов с ГКМП в подгруппах с низким и высоким риском ВСС по калькулятору HCM Risk-SCD не различались, как и доля больных с DC ≤4,5 мс (таблица 3). Таким образом, при применении критериев, ранее предложенных для больных ишемической болезнью сердца (ИБС) c целью стратификации риска смерти от сердечно-сосудистых причин и ВСС, не выявлено соответствия снижения DC увеличению риска ВСС, рассчитанному с помощью калькулятора HCM Risk-SCD. Из двух пациенток, умерших внезапно, одна имела промежуточный риск ВСС (4,77%) по HCM Risk-SCD, но DC была <4,5 мс, у второй — риск HCM Risk-SCD был высоким (6,46%), а DC >4,5 мс. У обеих пациенток была необструктивная форма ГКМП без признаков ХСН, регистрировались эпизоды нЖТ, а у одной и пароксизмы ФП. У пациента, умершего в постоперационном периоде, регистрировались пароксизмы ФП и имелись признаки ХСН, показатель DC был <4,5 мс, а риск ВСС по HCM Risk-SCD — низким.
Был проведен анализ показателей DС и АС в зависимости от наличия или отсутствия ряда факторов, используемых в стратификации риска ВСС у пациентов с ГКМП (нЖТ, необъяснимые синкопе, степень обструкции ВТ ЛЖ, случаи ВСС в семье), а также пароксизмов ФП и ХСН (таблица 4).
1) У пациентов с нЖТ в анамнезе по сравнению с больными без нЖТ средние значения DC и АС не различались (таблица 4). Однако доля больных с DC ≤4,5 мс была достоверно выше среди пациентов с нЖТ — 56 vs 25,5% у пациентов без нЖТ (p=0,043).
У 9 больных с нЖТ, зарегистрированной с помощью СМ ЭКГ одновременно с определением DС и АС, показатели AС были достоверно выше — -5,8 [ -7,01; -4,00] vs -7,9 [ -9,40; -6,05] мс (p=0,028), а показатели DС ниже — 3,6 [ 2,95; 6,10] vs 5,8 [ 4,05; 7,50] мс (p=0,05), чем у остальных 41 пациента.
2) Достоверных различий DС и АС при сравнении подгрупп с наличием и отсутствием случаев ВСС в семье, синкопальных состояний, обструкции ВТ ЛЖ не выявлено (таблица 4).
3) У 78% пациентов с ХСН показатели DС были ≤4,5 мс, в то время при отсутствии ХСН доля таких пациентов составила всего 27% (p=0,016). Средние значения AС были достоверно выше (p=0,006), а показатели DС достоверно ниже (p=0,003) при наличии ХСН (таблица 4).
4) У больных с ФП среднее значение DС было достоверно ниже, чем у пациентов без этой аритмии (p=0,023) (таблица 4). Данный факт не может быть объяснен сочетанием с ХСН или различиями в возрасте больных, т.к. пациенты с ФП и без ФП по возрасту не различались — 38 [ 38; 60] vs 40 [ 17; 57] лет (р=0,442), и лишь у двух больных с пароксизмами ФП (28,5%) имелись признаки ХСН.
5) При изучении зависимости DС/AС от выраженности гипертрофии ЛЖ (ГЛЖ) выявлены слабые корреляционные связи: 1) DC с тМЖП (rs=0,307, р<0,05) и с тЗС (rs=-0,364, р<0,05); 2) АС с тЗС (rs=0,359, р<0,05). Семь пациентов с толщиной стенки ЛЖ >3 см характеризовались достоверно более высокой DС (p=0,006), чем больные с ГЛЖ <3 см (таблица 4). Данный факт может быть объяснен более молодым возрастом пациентов со столь значимой ГЛЖ — 16 [ 16; 30] vs 43 [ 34; 59] лет (р<0,001). В целом, в выборке возраст больных обратно коррелировал с тМЖП: rs=-0,445, p<0,001.
Таблица 4
Показатели DC/АС у больных с ГКМП в зависимости от наличия нЖТ, степени ГЛЖ, синкопальных состояний, обструкции ВТ ЛЖ, ХСН и ФП
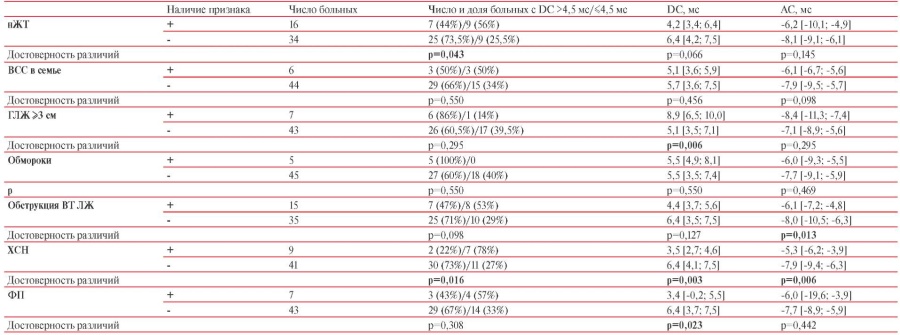
Примечание: р — достоверность различий между пациентами с наличием и отсутствием признака. ВСС — внезапная сердечная смерть, ВТ ЛЖ — выводной тракт левого желудочка, ГЛЖ — гипертрофия левого желудочка, нЖТ — неустойчивая желудочковая тахикардия, ФП — фибрилляция предсердий, ХСН — хроническая сердечная недостаточность.
Проведен многофакторный анализ для определения независимого предиктора снижения DС до значений, соответствующих высокому риску смерти от сердечно-сосудистых причин и ВСС в исследованиях у пациентов с ИБС. При этом учитывали наличие или отсутствие ХСН, ФП и нЖТ, зарегистрированной при СМ ЭКГ в день определения DC, т.е. клинические маркеры, при наличии которых средние показатели DС были достоверно ниже, чем при их отсутствии. По данным логистического анализа, независимым предиктором значений DC ≤4,5 мс явилось наличие ХСН (таблица 5).
Таблица 5
Влияние клинических факторов на нахождение DC в зоне высокого или среднего риска у больных с ГКМП (логистическая регрессия)

Примечание: Exp (β) — отношение шансов. нЖТ — неустойчивая желудочковая тахикардия, ФП — фибрилляция предсердий, ХСН — хроническая сердечная недостаточность.
При контрольных СМ ЭКГ через 6 и 12 мес. из анализа исключались пациенты с имплантированными антиаритмическими устройствами и подвергшиеся миоэктомии. Статистически значимой динамики средних значений DC и AC не выявлено (таблица 6).
Таблица 6
Динамика средних значений DC/АС у пациентов с ГКМП через 6 и 12 мес.

На рисунке 1 представлено графическое изображение кривой оценки показателя DC у пациентки 39 лет с диагнозом ГКМП, необструктивная форма. Гипертоническая болезнь II стадии, 2 ст. повышения АД, очень высокий риск сердечно-сосудистых осложнений. Нарушение ритма сердца: нЖТ. Гиперлипидемия II А типа. Ожирение 2 ст. Из анамнеза известно, что в течение нескольких лет периодически отмечались повышения АД до 165/100 мм рт.ст., по поводу чего не обследовалась, самостоятельно принимала периндоприл 5 мг/сут. с положительным эффектом. У сына больной (10 лет) при диспансерном обследовании диагностирована ГКМП и, поскольку это заболевание носит наследственный характер, пациентка была направлена на обследование. По результатам эхокардиографии — тМЖП 2,9 см, тЗС 1,4 см, фракция выброса ЛЖ 71%, максимальный градиент в ВТ ЛЖ — 10 мм рт.ст. При СМ ЭКГ выявлены 2 эпизода нЖТ из 9 и 12 комплексов QRS с частотой 150 уд./мин. Показатели DC соответствовали высокому риску неблагоприятного исхода (рисунок 1). По HCM Risk-SCD риск расценивался как промежуточный (4,77%). От имплантации ИКД больная отказалась, в связи с чем начато лечение амиодароном. При контрольных СМ ЭКГ через 2 и 4 нед. нЖТ не зарегистрирована. От последующего диспансерного наблюдения пациентка отказалась, самостоятельно отменила амиодарон. Умерла внезапно через 2 года от момента включения в исследование. В данном случае наблюдаем однонаправленные изменения по шкалам HCM Risk-SCD (промежуточный риск) и DC (высокий риск) у пациентки, умершей внезапно.
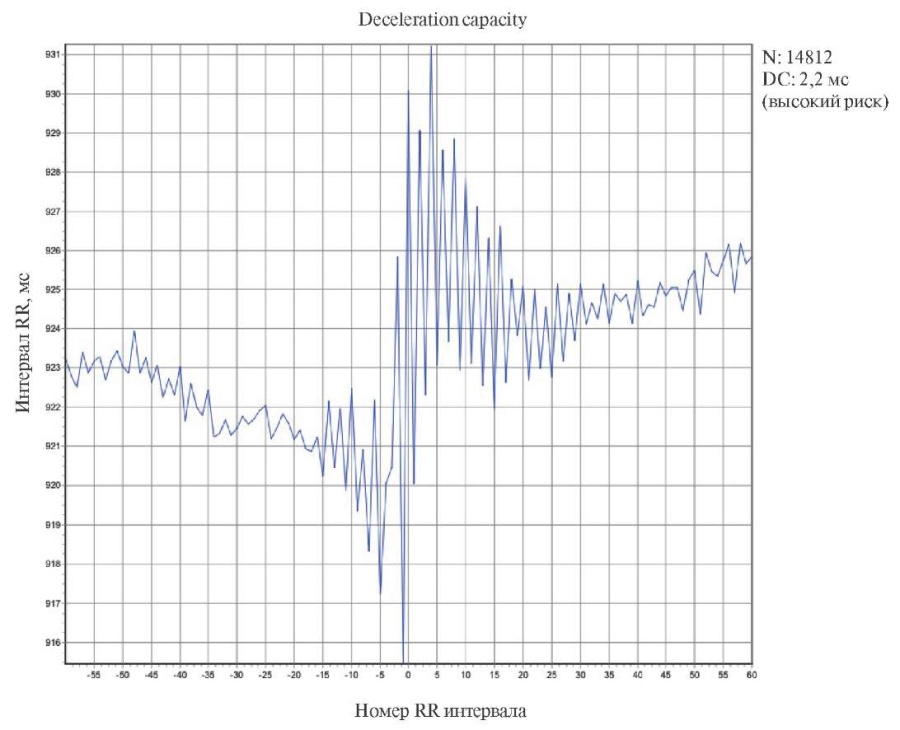
Рис. 1 Показатели DC у пациентки с ГКМП, умершей внезапно (клинический пример).
Обсуждение
В рамках настоящего исследования впервые была предпринята попытка изучить особенности показателей DС и AС у больных с ГКМП. Необходимо отметить, что среди пациентов не было лиц, имевших в анамнезе устойчивую желудочковую тахикардию или перенесших остановку кровообращения. Таким образом, речь шла о попытке применения методики для оценки риска ВСС именно в рамках первичной профилактики. Хотя пациенты с ГКМП имели более низкие значения DС и более высокие показатели AС по сравнению с контрольной группой, что свидетельствует о повышении симпатического влияния и снижении “парасимпатической защиты”, соответствия степени риска по критериям DC и калькулятору HCM Risk-SCD не выявлено. Дальнейшее наблюдение за пациентами в течение 5 лет, на первый взгляд, также не продемонстрировало каких-либо преимуществ использования DC в стратификации именно ВСС при ГКМП: лишь в одном из двух случаев ВСС DC свидетельствовало о высоком риске фатального исхода. В стратификации степени риска использовали градацию, разработанную для пациентов, перенесших ИМ [12], однако не исключено, что для пациентов с ГКМП должны применяться иные критерии. Невысокая частота летальных исходов и ограниченность выборки в настоящем исследовании не позволяют ответить на этот вопрос. Сопоставление двух шкал риска — попытка лишь косвенно оценить возможность применения DC и AC при ГКМП с целью стратификации риска ВСС.
Необходимо отметить, что факторы риска и механизмы, ведущие к развитию желудочковых тахиаритмий и ВСС, при ГКМП и ИБС или дилятационной кардиомиопатии принципиально различаются. Для большинства структурных заболеваний сердца основное значение имеет значительное снижение систолической функции и появление ХСН, что нашло отражение в современных рекомендациях по профилактике ВСС у таких пациентов [16]. Однако на настоящий момент не выявлено ни одного предиктора, специфически предсказывающего именно ВСС. Ремоделирование ЛЖ, снижение контрактильных свойств миокарда увеличивают риск не только фатальных тахиаритмий, но и смерти от прогрессирования ХСН. В целом, для ХСН любой этиологии характерно снижение парасимпатического влияния и повышение симпатической активности вегетативной нервной системы [17][18]. Видимо поэтому в целом ряде исследований маркеры вегетативного дисбаланса продемонстрировали свою эффективность в прогнозировании фатальных исходов у пациентов с постинфарктным кардиосклерозом. В классической работе Bauer A, et al. (2006) [11], включавшей 2711 больных, перенесших ИМ, DC <2,5 мс явилась предиктором летального исхода в течение 2 лет. Авторы отмечают, что при применении предложенных ими критериев и для оценки риска смерти от сердечно-сосудистых причин получены аналогичные результаты. В указанной выше работе риск ВСС не изучался, однако в следующем крупном исследовании тех же авторов [13], так называемая “тяжелая автономная дисфункция”, которая включала нарушение турбулентности ритма сердца и снижение DC <4,5 мс (т.е. были объединены критерии среднего и высокого риска), явилась предиктором не только общей и сердечно-сосудистой смерти, но и ВСС. Нами ранее получены сходные результаты: у больных, перенесших ИМ, снижение DC увеличивало не только риск сердечно-сосудистой смерти, но и ВСС при фракции выброса ЛЖ >40% [12]. Вместе с тем, прогностическая значимость снижения DC для стратификации риска именно ВСС при ИБС подтверждена не во всех исследованиях [19]. При ГКМП, в отличие от пациентов с ИБС, на настоящий момент ни одна из электрокардиографических методик, оценивающих вегетативный дисбаланс — ТРС, вариабельность ритма сердца (ВРС), не показала своей значимости в прогнозировании развития ВСС [20-22]. По данным El-Menyar A, et al. (2008), ТРС тесно связана с влиянием барорефлекса [23], а по данным Katarzynska-Szymanska A, et al. (2013), барорецепторная чувствительность при ГКМП не отличается от таковой у здоровых лиц [24]. Изменение ВРС, по мнению многих авторов, больше связано c тяжестью ХСН, чем с частотой ВСС [25][26]. По нашим данным [27], у больных ГКМП достоверно чаще выявляются нарушения ТРС по сравнению с здоровыми лицами, а больные страдающие ХСН, имеют более низкую ВРС. В этом контексте полученные данные по DC выглядят достаточно логичными: именно ХСН явилась независимым предиктором снижения DC. Однако, как фактор риска жизнеугрожающих аритмий при ГКМП, ХСН не имеет такого значения, как при многих других заболеваниях, а смертность пациентов с ГКМП от прогрессирования ХСН и необходимость трансплантации сердца при современных методах лечения невысоки — 0,9 и 1,6%, соответственно, при сроке наблюдения 6,6±5,3 лет [4].
Первичным аритмогенным субстратом при ГКМП является дезорганизация клеток гипертрофированной сердечной мышцы и замещение миокарда соединительной тканью. В настоящем исследовании мы не выявили непосредственной зависимости величины DC от степени ГЛЖ. Хотя существующие сейчас подходы к стратификации риска ВСС при ГКМП фактически основаны на ретроспективном статистическом анализе, а не на выявлении аритмогенного субстрата у конкретного больного, степень ГЛЖ является весьма существенным фактором, влияющим на риск ВСС. Вместе с тем, общая тенденция заключается в переходе от учета отдельных факторов риска к комплексному анализу целого ряда клинических данных, что и нашло воплощение в калькуляторе HCM Risk-SCD.
На наш взгляд, вопрос о возможностях неинвазивных электрофизиологических методик при ГКМП нельзя считать решенным. Научных исследований по этой теме немного и проводились они на небольших когортах пациентов. В ряде работ выводы сделаны на основании выявления связи данных показателей с нЖТ [28], что, по нашему мнению, не совсем правильно; нЖТ является лишь одним из факторов риска ВСС, и не тождественна устойчивым желудочковым тахиаритмиям, приводящим к летальному исходу, хотя и в нашем исследовании более половины пациентов с нЖТ имели “патологические” значения DC. Что касается пароксизмальной формы ФП, то более низкие значения DC у данной группы пациентов можно объяснить как исходными нарушениями вегетативного баланса, способствующими развитию этой аритмии наряду с органическими изменениями сердца, так и тяжестью основного заболевания и, как следствие, появлению ФП.
Таким образом, низкие значения DC у больных ГКМП могут отражать более тяжелое течение заболевания, характеризующееся наличием ХСН, пароксизмов ФП, нЖТ. Место методики в стратификации риска ВСС нуждается в дальнейшем уточнении.
К ограничениям нашего исследования, помимо указанного небольшого объема выборки, можно отнести тот факт, что исследование проводилось на фоне лекарственной терапии, что могло повлиять на полученные результаты. Кроме того, группа больных ГКМП была достаточно разнородной как по демографическим показателям — отметим влияние возраста на величину DC [29][30], так и по ряду клинических характеристик — наличие или отсутствие обструкции ВТ ЛЖ, пароксизмов ФП, ХСН.
Заключение
Пациенты с ГКМП по сравнению со здоровыми лицами характеризуются более низкой DС и более высокой АС. Среди пациентов с ГКМП снижение DC характерно для больных с более тяжелым течением заболевания (с ХСН, пароксизмами ФП, нЖТ), однако целесообразность использования показателя в стратификации риска ВСС еще нуждается в уточнении.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. 2011 ACCF/AHA Guideline for the Diagnosis and Treatment of Hypertrophic Cardiomyopathy: A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol. 2011;25:e212-60. doi:10.1016/j.jacc.2011.06.011.
2. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy. The Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J. 2014;35:2733-79. doi:10.1093/eurheartj/ehu284.
3. Monserrat L, Elliott PM, Gimeno JR, et al. Non-sustained ventricular tachicardia in hypertrophic cardiomyopathy: an independent marker of sudden death risk in young patients. J Am Coll Cardiol. 2003;42(5):873-9. doi:10.1016/s0735-1097(03)00827-1.
4. Maron BJ, Rowin EJ, Casey SA, et al. What Do Patients with Hypertrophic Cardiomyopathy Die from? Am J Cardiol. 2016;117(3):434-5. doi:10.1016/j.amjcard.2015.11.013.
5. Maron BJ. Clinical Course and Management of Hypertrophic Cardiomyopathy. N Engl J Med. 2018;379(7):655-68. doi:10.1056/NEJMra1710575.
6. Choi YG, Kim HK, Lee SC, et al. Validation of the hypertrophic cardiomyopathy risk-sudden cardiac death calculator in Asians. Heart. 2019;105(24):1892-7. doi:10.1136/heartjnl-2019-315160.
7. Nazer B, Dale Z, Carrassa G, et al. Appropriate and inappropriate shocks in hypertrophic cardiomyopathy patients with subcutaneous implantable cardioverter-defibrillators: An international multicenter study. Heart Rhythm. 2020;17(7):1107-14. doi:10.1016/j.hrthm.2020.02.008.
8. Zhu SY, Li Y, Huang W, et al. Feasibility of the 2014 European guidelines risk prediction model for sudden cardiac death in hypertrophic cardiomyopathy in Chinese patients. Zhonghua Xin Xue Guan Bing Za Zhi. 2017;45(5):404-8. doi:10.3760/cma.j.issn.0253-3758.2017.05.008.
9. Zegkos T, Tziomalos G, Parcharidou D, et al. Validation of the new American College of Cardiology/American Heart Association Guidelines for the risk stratification of sudden cardiac death in a large Mediterranean cohort with Hypertrophic Cardiomyopathy. Hellenic J Cardiol. 2021;S1109-9666(21)00126-3. doi:10.1016/j.hjc.2021.06.005.
10. O’Mahony C, Lambiase PD, Quarta G, et al. The long-term survival and the risks and benefits of implantable cardioverter defibrillators in patients with hypertrophic cardiomyopathy. Heart. 2012;98:116-25. doi:10.1136/hrt.2010.217182.
11. Bauer A, Kantelhardt JW, Barthel P, et al. Deceleration capacity of heart rate as a predictor of mortality after myocardial infarction: cohort study. Lancet. 2006;367:1674-81. doi:10.1016/S0140-6736(06)68735-7.
12. Сулимов В. А., Царегородцев Д. А., Окишева Е. А. Возможности использования новых неинвазивных предикторов в комбинированной оценке риска внезапной сердечной смерти у больных, перенесших инфаркт миокарда. Патология кровообращения и кардиохирургия. 2014;18(4):164-77. doi:10.21688/1681-3472-2014-4-164-177.
13. Bauer A, Barthel P, Schneider R, at al. Improved Stratification of Autonomic Regulation for risk prediction in post-infarction patients with preserved left ventricular function (ISAR-Risk). Eur Heart J. 2009;30(5):576-83. doi:10.1093/eurheartj/ehn540.
14. McDonagh TA, Metra M, Adamo M, at al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599-726. doi:10.1093/eurheartj/ehab368.
15. Bauer A, Kantelhardt JW, Bunde A, et al. Phase-rectified signal averaging detects quasi-periodicities in non-stationary data. Phys. A: Stat. Mech. Appl. 2006;364:423-34. doi:10.1016/j.physa.2005.08.080.
16. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC). Europace. 2015;17(11):1601-87. doi:10.1093/eurheartj/ehv316.
17. Algra A, Tijssen JG, Roelandt JR, et al. Heart rate variability from 24-hours electrocardiography and the 2-year risk for sudden death. Circulation. 1993;88(1):180-5. doi:10.1161/01.cir.88.1.180.
18. Scalvini S, Volterrani M, Zanelli E, et al. Is heart rate variability a reliable method to assess autonomic modulation in left ventricular dysfunction and heart failure? Assessment of autonomic modulation with heart rate variability. Int J Cardiol. 1998;67(1):9-17. doi:10.1016/s0167-5273(98)00252-6.
19. La Rovere MT, Pinna GD, Maestri R, et al. GISSI-HF Investigators. Autonomic markers and cardiovascular and arrhythmic events in heart failure patients: still a place in prognostication? Data from the GISSI-HF trial. Eur J Heart Fail. 2012;14(12):1410-9. doi:10.1093/eurjhf/hfs126.
20. Kawasaki T, Sakai C, Harimoto K, et al. Holter monitoring and long-term prognosis in hypertrophic cardiomyopathy. Cardiology. 2012;122(1):44-54. doi:10.1159/000338156.
21. Kawasaki T, Azuma A, Sakatani T, et al. Prognostic value of heart rate variability in patients with hypertrophic cardiomyopathy. J Electrocardiol. 2003;36(4):333-8. doi:10.1016/j.jelectrocard.2003.08.005.
22. Yamada S, Yoshihisa A, Hijioka N, et al. Autonomic Dysfunction in Cardiac Amyloidosis Assessed by Heart Rate Variability and Heart Rate Turbulence. Ann Noninvasive Electrocardiol. 2020;25(4):e12749. doi:10.1111/anec.12749.
23. El-Menyar A, Asaad N. T-wave alternans and sudden cardiac death. Crit Pathw Cardiol. 2008;7(1):21-8. doi:10.1097/HPC.0b013e318163f235.
24. Katarzynska-Szymanska A, Ochotny R, Oko-Sarnowska Z, et al. Shortening Baroreflex Delay in Hypertrophic Cardiomyopathy Patients — An Unknown Effect of Beta-Blockers. Br J Clin Pharmacol. 2013;75(6):1516-24. doi:10.1111/bcp.12027.
25. Tanabe T. Impaired heart rate variability in patients with symptomatic NYHA class II-III hypertrophic cardiomyopathy. Rinsho Byori. 1998;46(10):1030-6.
26. Döven O, Sayin T, Güldal M, et al. Heart rate variability in hypertrophic obstructive cardiomyopathy: association with functional classification and left ventricular outflow gradients. Int J Cardiol. 2001;77(2-3):281-6. doi:10.1016/s0167-5273(00)00447-2.
27. Царегородцев Д. А., Букия И. Р., Сулимов В. А. и др. Турбулентность ритма сердца и микровольтная альтернация зубца Т как маркеры риска внезапной сердечной смерти у больных с гипертрофической кардиомиопатией. Кардиология. 2013;53(9):40-6.
28. Trzos E, Kasprzak JD, Krzemińska-Pakuła M. The prevalence and the prognostic value of microvolt T-wave alternans in patients with hypertrophic cardiomyopathy. Ann Noninvasive Electrocardiol. 2011;16(3):276-86. doi:10.1111/j.1542-474X.2011.00443.x.
29. Lewek J, Wranicz JK, Guzik P, et al. Clinical and electrocardiographic covariates of deceleration capacity in patients with ST-segment elevation myocardial infarction. Cardiol J. 2009;16(6): 528-34.
30. Lewis MJ, Annandale J, D’Silva LA, et al. Influence of long-term oxygen therapy on cardiac acceleration and deceleration capacity in hypoxic patients with chronic obstructive pulmonary disease. Clin Physiol Funct Imaging. 2021;31(4):258-65. doi:10.1111/j.1475-097X.2011.01010.x.
Об авторах
Д. А. ЦарегородцевРоссия
Царегородцев Дмитрий Александрович — кандидат медицинских наук, врач сердечно-сосудистый хирург, доцент кафедры факультетской терапии № 1 института клинической медицины им. Н.В. Склифосовского.
Москва.
И. Р. Букия
Россия
Букия Илона Ревазиевна — кандидат медицинских наук, врач-кардиолог, ассистент кафедры факультетской терапии № 1 института клинической медицины им. Н.В. Склифосовского.
Москва.
Тел.: +7 (926) 582-88-39
М. А. Халикова
Россия
Халикова Манижа Абдухалиловна — врач-кардиолог, аспирант кафедры факультетской терапии № 1 института клинической медицины им. Н.В. Склифосовского.
Москва.
Е. А. Окишева
Россия
Окишева Елена Андреевна — кандидат медицинских наук, врач-кардиолог, ассистент кафедры факультетской терапии № 1 института клинической медицины им. Н.В. Склифосовского.
Москва.
Дополнительные файлы
Рецензия
Для цитирования:
Царегородцев Д.А., Букия И.Р., Халикова М.А., Окишева Е.А. Мощность замедления и ускорения ритма сердца у больных с гипертрофической кардиомиопатией: результаты пятилетнего проспективного исследования. Кардиоваскулярная терапия и профилактика. 2022;21(7):3130. https://doi.org/10.15829/1728-8800-2022-3130
For citation:
Tsaregorodtsev D.A., Bukia I.R., Khalikova M.A., Okisheva E.A. Deceleration and acceleration capacities of heart rate in patients with hypertrophic cardiomyopathy: results of a five-year prospective study. Cardiovascular Therapy and Prevention. 2022;21(7):3130. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3130
JATS XML

























































