Перейти к:
Повышенная чувствительность к варфарину в практике терапевта. Клинический случай
https://doi.org/10.15829/1728-8800-2023-3392
Аннотация
Антикоагулянты широко используются в клинической практике для снижения риска развития сердечно-сосудистых осложнений. Однако имеются ассоциированные клинические состояния, требующие мониторинга за системой коагуляции в связи с повышенным риском развития кровотечений. В клинической практике известны случаи повышенной чувствительности к варфарину, обусловленные полиморфизмами ряда генов. Прием варфарина в такой ситуации часто проявляется массивными кровотечениями, угрожающими жизни пациента. Пациентка Л., 67 лет, поступила в терапевтическое отделение клиники ФГБОУ ВО РостГМУ Минздрава России в марте 2022г. Накануне она отметила появление выраженных болей в животе, появление неоформленного стула с примесью неизмененной крови. При амбулаторном обследовании установлено повышение уровня международного нормализованного отношения до 9,42, тромбинового времени >30 сек. Признаков первичной патологии желудочно-кишечного тракта не выявлено. Из анамнеза известно, что 21.01.2022г пациентке выполнено протезирование аортального клапана механическим протезом, в связи с чем был назначен вар-фарин в дозе 2,5 мг/сут. После установления гипокоагуляции варфа-рин был отменен. Выполнен фармакогенетический анализ, который установил носительство полиморфизмов генов системы цитохрома Р450, гомозиготную мутацию 1075А>С (CYP2C9 (*3/*3)) и гетерозиготную мутацию гена витамин К-редуктазы VKORC1 G(-1639)A (VKORC1 GA). Рассчитана индивидуальная дозировка варфарина согласно рекомендациям международного консорциума фармакогенетики варфарина, которая составила 9 мг/нед. После корректировки дозы варфарина уровень международного нормализованного отношения снизился до 3,61, тромбинового времени до 13 сек. Пациентка выписана с рекомендациями соблюдать индивидуальную схему приема варфарина и контролировать показатели коагулограммы. Наличие повышенной чувствительности к варфарину не является причиной для его полной отмены в ситуациях, требующих длительного приема антикоагулянтов. В связи с этим необходима настороженность врача при назначении пациенту варфарина, понимание причин и методов диагностики повышенной чувствительности к варфарину и своевременная коррекция его дозировки.
Ключевые слова
Для цитирования:
Левицкая Е.С., Кастанаян А.А., Леонова Г.Н., Яковлев А.А., Затонский С.А., Ганенко Л.А. Повышенная чувствительность к варфарину в практике терапевта. Клинический случай. Кардиоваскулярная терапия и профилактика. 2023;22(1):3392. https://doi.org/10.15829/1728-8800-2023-3392
For citation:
Levitskaya E.S., Kastanayan A.A., Leonova G.N., Yakovlev A.A., Zatonsky S.A., Ganenko L.A. Warfarin hypersensitivity in the internist's practice: a case report. Cardiovascular Therapy and Prevention. 2023;22(1):3392. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3392
Введение
В современной клинической практике применение антикоагулянтов широко востребовано и необходимо для улучшения краткосрочного и отдаленного прогнозов. История открытия антикоагулянтов кумаринового ряда начинается с 1921г, а опыт клинического применения — с 1954г [1]. В 1921г было установлено, что у животных, питающихся сеном донника, развивались обширные гематомы, и они погибали из-за множественных кровотечений. Оказалось, что в составе сена донника имелся дикумарол, предотвращавший свертывание крови, т.е. являвшийся антикоагулянтом. В дальнейшем дикумарол был использован как родентицид для крыс, и был назван "Варфарин" — аббревиатура научно-исследовательской организации, занимавшейся испытанием производных дикумарола (Warfarin — Wisconsin Alumni Research Foundation и "arin" — производное дикумарола). После открытия антидота к неуправляемой гипокоагуляции, которым являлся витамин К, варфарин, под названием кумадин, в 1954г был одобрен к применению в клинической практике. Варфарин является непрямым антикоагулянтом, подавляющим синтез витамин К-зависимых факторов свертывания (II, VII, IX и X) и антикоагулянтных протеинов С и S в печени [2]. С изучением фармакологических особенностей варфарин стал применяться для профилактики тромбоэмболических осложнений при фибрилляции предсердий, тромбозов глубоких вен голеней, патологии клапанного аппарата сердца. Однако применение варфарина сочетается с некоторыми трудностями — необходимостью контроля международного нормализованного отношения (МНО) 1 раз в 4-6 нед., лабильностью цифр МНО, зависящей от изменения диеты, перекрестного действия некоторых лекарственных средств, узким целевым диапазоном МНО, генетической предрасположенностью к резистентности к варфарину. Данные явления приводят к нестабильности коагуляции, т.е. риску развития кровотечений или тромбоэмболических осложнений.
В клинической практике известны случаи повышенной чувствительности к варфарину, обусловленные наличием полиморфизмов ряда генов. Прием среднетерапевтической дозировки варфарина в такой ситуации часто проявляется массивными кровотечениями, угрожающими жизни пациента. Известно, что гипокоагуляцию вызывают полиморфизмы ~30 генов [3], главным образом, генов в системе цитохрома Р450 и гена субъединицы 1 комплекса эпоксид-редуктазы витамина К (VKORC1) [4]. По результатам проведенных исследований установлено, что наибольшую значимость в определении чувствительности к варфарину имеют одиночные нуклеотидные полиморфизмы в генах CYP2C9, CYP4F2 и VKORC1 [5-7]. Два специфических генетических полиморфизма в генах CYP2C9 и VKORC1 объясняют ~30-40% вариаций ответа на варфарин и могут передаваться будущим поколениям по аутосомно-доминантному типу.
По результатам российского исследований ВАРФАГЕН (Открытое рандомизированное, проспективное исследование по сравнению фармакогенетического и стандартного подходов к подбору дозы варфарина c целью оптимизации периода достижения терапевтических значений, стабильности МНО и частоты кровотечений в российской популяции пациентов, нуждающихся в терапии антагонистом витамина К) были даны рекомендации по эффективному использованию варфарина в клинической практике [6], а именно, применение фармакогенетического тестирования на определение индивидуальной эффективной дозировки варфарина с использованием анализа мутации в генах VKORC1 и CYP2C9. Показано, что генетические модификации VKORC1 А/А, CYP2C9 *2/*2, *2/*3, *3/*3 и отсутствие VKORC1 GG и CYP2C9 1*1, являются показателями повышенной чувствительности к варфарину [6].
В когорте Международного фармакогенетического консорциума варфарина IWPC (International Warfarin Pharmacogenetics Consortium) было выявлено 44,8% пациентов, чувствительных к варфарину. В группе с отсутствием чувствительности наиболее часто определялись два генотипа —VKOCR1 G/G; CYP2C9 *1/*1 (24,6%) и VKORC1 A/G; CYP2C9 *1/*1 (25,4%), в то время как в группе с повышенной чувствительностью и очень высокой чувствительностью двумя наиболее распространенными генотипами были VKOCR1 G/A; CYP2C9 *1/*2 (6,6%) и VKORC1 A/A; CYP2C9*1/*1 (25,5%) и VKOCR1 G/A; CYP2C9 *2/*3 (0,5%) и VKORC1 A/A; CYP2C9 *1/*3 (2,4%), соответственно [5].
При наличии повышенной чувствительности к варфарину необходим подбор индивидуальной дозировки, позволяющей соблюдать целевой диапазон МНО. К применению в клинической практике предложена формула для расчета дозы варфарина в нед., основанная на вариантах полиморфизма генов, ответственных за чувствительность к варфарину, согласно данным международного консорциума фармакогенетики варфарина (IWPC Warfarin dose calculator, http://www.warfarindosing.org) [8][9].
Представление данного клинического случая необходимо для повышения настороженности врача при назначении пациенту варфарина, понимания причин и методов диагностики повышенной чувствительности к варфарину и своевременной коррекции его дозировки.
Клинический случай
Информация о пациенте. Пациентка Л., 67 лет, европеоидной расы, поступила в терапевтическое отделение клиники ФГБОУ ВО РостГМУ Минздрава России 17.03.2022г. При поступлении пациентка предъявляла жалобы на периодически возникающие боли ноющего характера по всей поверхности живота, больше в околопупочной области, продолжительностью до 1,0-1,5 ч, не имеющие связи с приемом пищи, ощущение вздутия и урчания в животе, стул жидкой консистенции до 3 раз/сут. с примесью неизмененной крови, общую слабость.
Из расспроса пациентки установлено, что в ночь с 14 на 15 марта 2022г она отметила появление выраженных болей по всей поверхности живота, ощущение вздутия в кишечнике, появление неоформленного стула до 3 раз/сут. с примесью неизмененной крови. Данные симптомы послужили поводом обратиться в поликлинику по месту жительства. Из представленной первичной медицинской документации установлено, что при осмотре острой хирургической патологии не обнаружено. В тот же день, 15.03.2022г, выполнено обследование пациентки в амбулаторно-поликлинических условиях. Лабораторные данные: гемоглобин — 116 г/л, лейкоциты — 8,4×109/л, тромбоциты — 189×109/л, скорость оседания эритроцитов (СОЭ) 40 мм/ч, уровни билирубина, аланинаминотрансферазы, аспартатаминотрансферазы, амилазы, креатинина, мочевины — в пределах референсных значений. Регистрировалось повышение уровня МНО до 9,42, тромбиновое время >30 сек., фибриноген — 4,4 г/л.
Из анамнеза также было известно, что 21.01.2022г пациентке выполнено протезирование аортального клапана механическим протезом Medtronic № 21 по поводу критического стеноза и недостаточности аортального клапана. С конца января 2022г был назначен варфарин в начальной дозе 2,5 мг/сут., которую в дальнейшем пациентка не увеличивала, т.к., со слов пациентки, значения МНО сохранялись в пределах 2,6-3,0 при регулярном самостоятельном контроле на портативном анализаторе.
После получения коагулограммы от 15.03.2022г варфарин был отменен. Врачом поликлиники по месту жительства назначено симптоматическое лечение — дюспаталин, альмагель, хилак форте. Самочувствие пациентки Л. оставалось неудовлетворительным — сохранялись боли в животе, неоформленный стул до 3 раз/сут. с примесью крови.
17.03.2022г пациентка была направлена на консультацию к гастроэнтерологу клиники РостГМУ. На догоспитальном этапе проведено лабораторно-инструментальное обследование пациентки. Общий анализ крови (ОАК) от 17.03.2022г — гемоглобин 94,7 г/л, лейкоциты 8,16×109/л, эритроциты 3,37×1012/л, тромбоциты 190,0×109/л, СОЭ — 46 мм/ч. Коагулограмма (17.03.2022г) — активированное парциальное тромбопластиновое время >1 мин, протромбиновое время 65 сек., МНО — 5,83, тромбиновое время >30 сек., фибриноген — сгусток крови не образуется. При выполнении ультразвукового исследования органов брюшной полости выявлены признаки выраженного метеоризма, деформации желчного пузыря, диффузных изменений поджелудочной железы, жидкости в межпетельном пространстве правой подвздошной области, утолщения стенок тонкого кишечника. Пациентка осмотрена хирургом с последующим заключением об отсутствии данных, свидетельствующих об острой хирургической патологии. Пациентка госпитализирована в терапевтическое отделение клиники с целью осуществления диагностического поиска патологического процесса и определения тактики медикаментозного лечения.
Из хронических заболеваний у пациентки имеется наружный геморрой и хронический колит, установленные в апреле 2021г, гипертоническая болезнь II стадии, контролируемая артериальная гипертензия (АГ), риск 2 (умеренный), аутоиммунный тиреоидит, установленный 3 года назад, по поводу которого получает L-тироксин 50 мкг с формированием эутиреоидного состояния.
Анализ фармакологического анамнеза не выявил прием препаратов, способных увеличить риск кровотечения на фоне приема варфарина.
Со слов пациентки вредных привычек, в частности курения, не имеет.
Результаты физикального осмотра. Физикальное обследование пациентки Л. позволило установить состояние средней степени тяжести, температура тела =36,7° С, индекс массы тела =27 кг/м2, частота дыхательных движений =16/мин, частота сердечных сокращений = пульс =86 уд./мин, артериальное давление на обеих руках =120/75 мм рт.ст., смещение границ относительной тупости сердца влево, болезненность кишечника в правой и левой подвздошных областях (в проекции сигмовидной, нисходящей и восходящей ветви ободочной, поперечно-ободочной кишок) при поверхностной и глубокой пальпации. Обследование других органов и систем патологических изменений не выявило.
С учетом наличия жалоб на боли в животе и неизмененной крови в кале, признаков выраженной гипокоагуляции, анемии, необходимым являлся диагностический поиск источника желудочно-кишечного кровотечения и установление его причины.
По результатам копрологического исследования, выполненного 22.03.2022г, установлено отсутствие эритроцитов, признаков воспаления и патологических примесей. На спиральной компьютерной томографии органов брюшной полости (18.03.2022г) признаков скопления крови в брюшной полости не выявлено. Эзофагогастродуоденоскопия (22.03.2022г) установила хронический гастрит, дуоденит. После выполнения видеоколоноскопии с биопсией кишечника (22.03.2022г) обнаружены наружный геморрой, хронический поверхностный умеренно выраженный колит, отек стромы, дивертикулез толстой кишки, признаки спаечного процесса брюшной полости.
Несмотря на то, что признаков явного или скрытого кровотечения в период госпитализации не отмечалось, наличие гипохромной анемии, выраженной гипокоагуляции, обнаружение хронического колита и дивертикулеза кишечника при видеоколоноскопии позволяли предполагать предшествующее госпитализации кровотечение из желудочно-кишечного тракта, источник которого не был установлен.
Предварительный диагноз. Кровотечение из желудочно-кишечного тракта неуточненное на фоне терапии варфарином. Критический аортальный стеноз и недостаточность аортального клапана. Протезирование аортального клапана механическим протезом (Medtronic 21) 21.01.2022г. Гипертоническая болезнь II стадии. Контролируемая АГ, риск 2 (умеренный).
Временная шкала. На рисунке 1 представлена хронология течения болезни, ключевые события и прогноз пациентки Л.
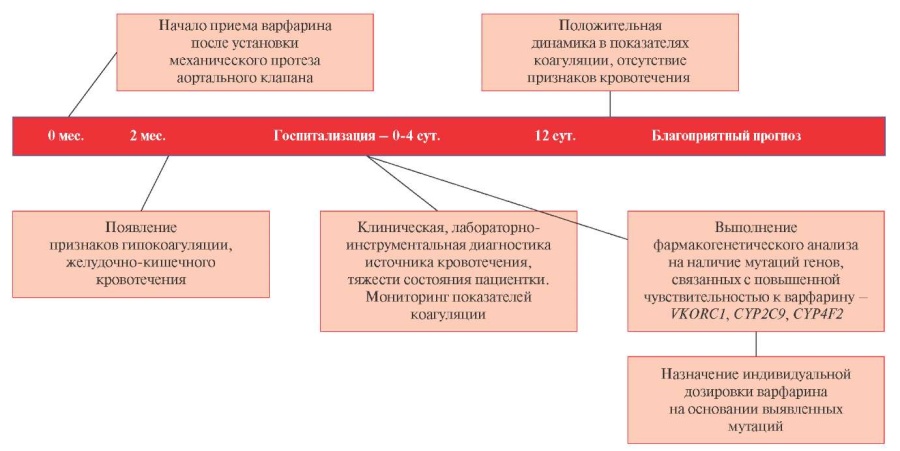
Рис. 1 Пациентка Л.: хронология течения болезни, ключевые события и прогноз.
Диагностическая оценка. Было предположено, что вероятной причиной гипокоагуляции и вызванного ею желудочно-кишечного кровотечения являлась генетически обусловленная повышенная чувствительность к варфарину. 20.03.2022г был выполнен фармакогенетический анализ на наличие мутаций по трем генетическим маркерам, связанным с повышенной чувствительностью к варфарину — VKORC1, CYP2C9, CYP4F2.
Установлено носительство полиморфизмов генов системы цитохрома Р450, гомозиготная мутация 1075А>С (CYP2C9 (*3/*3)) и гетерозиготная мутация гена витамин К-редуктазы VKORC1 G(-1639)A
(VKORC1 GA). На рисунке 2 представлен расчет индивидуальной дозировки варфарина для Л., согласно рекомендациям IWPC с учетом выявленных полиморфизмов генов и других показателей [9]. Индивидуальная расчетная доза варфарина составила 9 мг/нед.
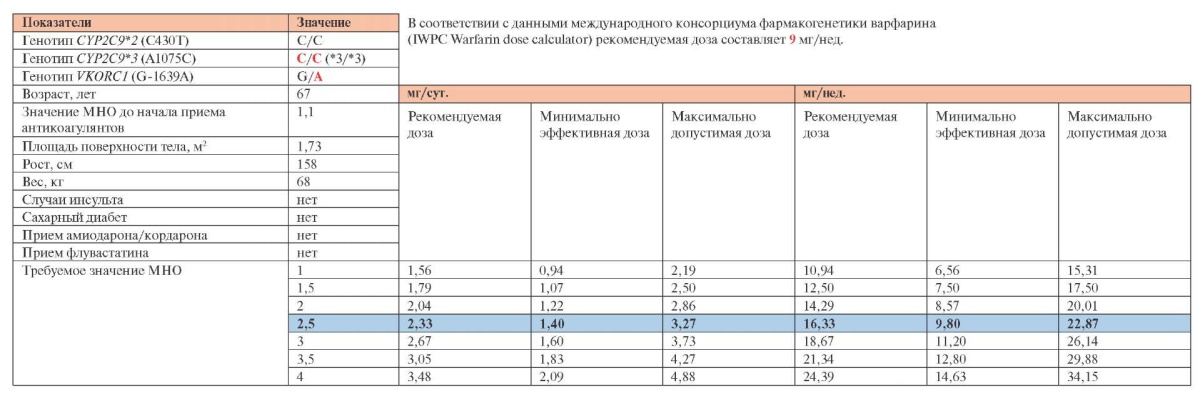
Рис. 2 Расчет индивидуальной дозировки варфарина для пациентки Л. согласно рекомендациям IWPC [9].
Проведены консультации клинического фармаколога и гематолога.
На основании полученного анализа генетического полиморфизма клиническим фармакологом подобрана индивидуальная дозировка варфарина по 1,25 мг (1/2 таблетки) каждый день. Суммарная дозировка варфарина в нед. составила 8,75 мг. Увеличение до расчетной дозировки варфарина 9 мг/нед. было невозможно, т.к. потребовалось бы деление таблетки варфарина на 0,25 мг, что невыполнимо. Превышение расчетной дозы варфарина сочетается с высоким риском кровотечений.
Заключение врача гематолога — вторичная гипокоагуляция на фоне терапии варфарином; постгеморрагическая (железодефицитная) анемия легкой степени; носительство генетических полиморфизмов генов системы цитохрома Р450 (гомозиготная мутация 1075А>С) (CYP2C9 (*3/*3)) и гетерозиготная мутация гена витамин К-редуктазы VKORC1 G(-1639)A (VKORC1 GA). Рекомендован прием препаратов железа и возобновление приема варфарина после достижения МНО 3,0-3,5 в дозировках, рекомендуемых клиническим фармакологом.
На рисунках 3, 4 представлена динамика основных показателей ОАК и коагулограммы на догоспитальном этапе и в период госпитализации пациентки в терапевтическом отделении.
Изменения показателей коагулограммы и ОАК свидетельствуют о начале положительной динамики под влиянием назначения индивидуальной схемы дозирования варфарина и лечения анемии препаратами железа.
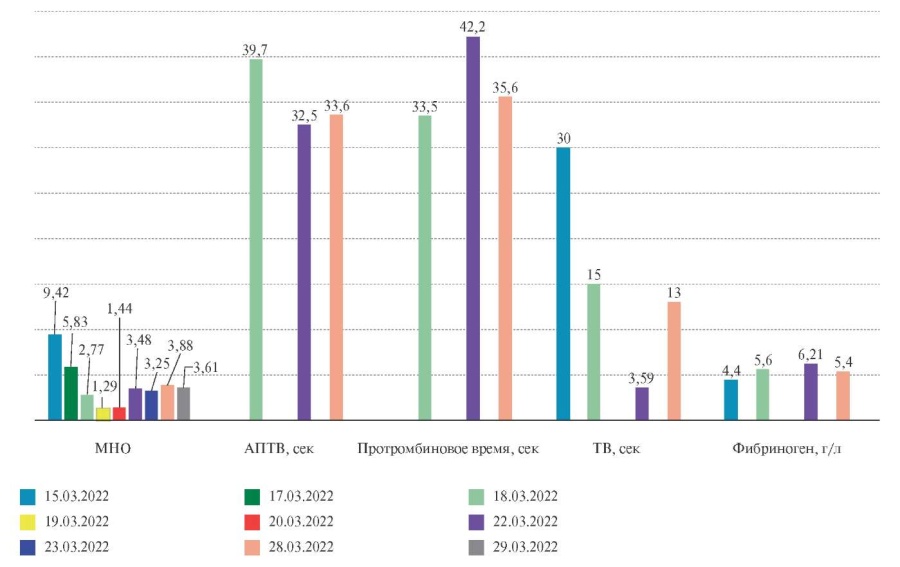
Рис. 3 Динамика показателей коагулограммы на догоспитальном этапе и в период госпитализации пациентки.
Примечание: АПТВ — активированное парциальное тромбиновое время, МНО — международное нормализованное отношение, ТВ — тромбиновое время. Цветное изображение доступно в электронной версии журнала.
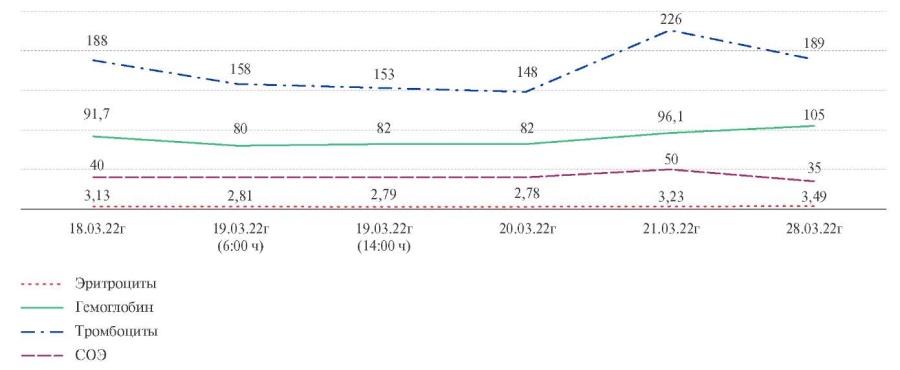
Рис. 4 Динамика основных показателей ОАК в период госпитализации пациентки.
Примечание: СОЭ — скорость оседания эритроцитов.
Важно отметить, что в биохимическом анализе крови, в общем анализе мочи отклонений от референсных значений нормы установлено не было. Уровень С-реактивного белка при поступлении составлял 12 мг/л, а при выписке снизился до 6 мг/л.
Клинический диагноз. На основании полученных данных пациентке Л. был выставлен клинический диагноз.
Основной диагноз: Хронический энтероколит, обострение. Дивертикулярная болезнь толстой кишки с преимущественным поражением сигмовидной кишки без явлений дивертикулита. Хронический геморрой.
Осложнения: желудочно-кишечное кровотечение неуточненное на фоне приема варфарина, обусловленное повышенной чувствительностью (носительство генетических полиморфизмов генов системы цитохрома Р450, гомозиготная мутация 1075А>С (CYP2C9 (*3/*3)) и гетерозиготная мутация гена витамин К-редуктазы VKORC1 G(-1639)A (VKORC1 GA). Хроническая железодефицитная анемия лёгкой степени.
Сопутствующий диагноз: Критический аортальный стеноз и недостаточность аортального клапана. Протезирование аортального клапана механическим протезом (Medtronic 21) 21.01.2022г.
Гипертоническая болезнь II стадии. Контролируемая АГ, риск 2(умеренный).
Дифференциальный диагноз. Проведенный диагностический поиск не позволил установить явный источник кровотечения. Однако жалобы пациентки, наличие анемического синдрома, выраженная гипокоагуляция позволяют сделать заключение о кровотечении из желудочно-кишечного тракта, которое развилось до госпитализации. С учетом отсутствия источника кровотечения, фармакологического анамнеза пациентки, регулярного приема варфарина в низких дозах, заключения врача-гематолога об отсутствии первичных причин гипокоагуляции, можно предполагать наличие повышенной чувствительности к варфарину, обусловленную полиморфизмом генов системы цитохрома Р450 и витамин К-редуктазы. Проведенный фармакогенетический анализ на наличие мутаций по трем генетическим маркерам, связанным с повышенной чувствительностью к варфарину —VKORC1, CYP2C9, CYP4F2, позволил установить гомозиготную мутацию 1075А>С (CYP2C9 (*3/*3)) и гетерозиготную мутацию гена витамин К-редуктазы VKORC1 G(-1639)A (VKORC1 GA). Возникает вопрос: почему у пациентки увеличились показатели МНО спустя 1,5 мес. после начала терапии варфарином? Ответить на этот вопрос достаточно сложно с учетом известного факта о возможном достижении терапевтического уровня МНО уже через 3-5 сут. после начала приема варфарина. Возможно, в начале приема варфарина пациентка не имела потенциального источника кровотечения, т.е. обострение имеющихся хронических заболеваний кишечника случилось позже. Кроме того, уверенности в достоверности полученных значений МНО при самоконтроле на портативном анализаторе нет.
Таким образом, полученные данные результатов обследования пациентки подтвердили диагноз неуточненного желудочно-кишечного кровотечения на фоне приема варфарина, обусловленное повышенной чувствительностью. Положительная динамика в показателях коагулограммы и коррекции анемического синдрома после начала приема варфарина по индивидуально подобранной схеме, является подтверждением правильно установленного диагноза.
Медицинские вмешательства описаны в разделе диагностическая оценка.
Динамика и исходы. На фоне приема варфарина по индивидуально подобранной схеме, согласно установленным данным генетического полиморфизма, отмечалась стабилизация показателей коагуляции, тенденция к коррекции анемического синдрома. Пациентка Л. привержена к терапии и в дальнейшем не отмечала появления симптомов желудочно-кишечного кровотечения или иных симптомов. При соблюдении индивидуально подобранной схемы лечения варфарином, контроле показателей МНО прогноз благоприятный.
Пациентка была выписана со следующими рекомендациями:
- контроль коагулограммы 1 раз в 5-7 дней до формирования стабильных показателей МНО в диапазоне 2,0-3,0;
- прием варфарина в индивидуально подобранной дозировке в нед. — 1,25 мг ежедневно;
- прием препаратов железа под контролем уровня гемоглобина, исследование уровня ферритина крови, через 4 нед. для определения продолжительности лечения препаратами железа;
- продолжение приема препаратов для лечения сопутствующих заболеваний по рекомендации специалистов.
Обсуждение
Гиперчувствительность к варфарину является редким патологическим явлением. Однако отсутствие настороженности в диагностике может привести к массивным кровотечениям, исходом которых может являться смерть пациента или инвалидизирующие осложнения.
Патогенетической основой гиперчувствительности к варфарину является полиморфизм генов, которые контролируют метаболизм витамина К или фармакокинетику варфарина. Важно отметить, что каких-либо других симптомов, позволяющих заподозрить аномалию данных генов, нет. Иными словами, развитие гипокоагуляторных состояний на фоне приема варфарина является единственным клиническим признаком.
Взаимосвязь метаболизма варфарина с геном VKORC1 обусловлена ингибированием фермента эпоксид-редуктазы, необходимого для воспроизводства витамина К в печени из его эпоксидной формы — предшественника витамина К. Таким образом, снижение синтеза фермента эпоксид-редуктазы вследствие аномального генетического контроля приводит к блокированию факторов свертывания даже при минимальных дозировках антагониста витамина К и, как следствие, гипокоагуляции. Система цитохрома Р450 является семейством ферментов, отвечающих за метаболизм лекарственных средств. Установлено, что дефект в одном из генов, кодирующих ферменты цитохрома Р450, а именно CYP2C9, является причиной нарушения метаболизма варфарина и развития гипокоагуляции [10].
В современной литературе, особенно отечественной, имеется ограниченное количество сведений, касающихся необходимости выполнения фармагенетического анализа при подборе дозы варфарина, а также освещения проблемы в виде клинических случаев. Мнение ряда авторов, а также результаты исследований позволяют полагать, что при подборе дозировки варфарина всем пациентам необходимо выполнять фармакогенетический анализ с целью более быстрого достижения целевых значений МНО, а также для предотвращения развития кровотечений [4][6]. Такой подход позволил бы повысить эффективность использования варфарина в целом и максимально уменьшить количество случаев нежелательных явлений. К сожалению, на сегодняшний день в реальной клинической практике фармакогенетический анализ не только не является рутинным методом диагностики, но и используется крайне редко.
В представленном клиническом случае продемонстрирован пример гиперчувствительности к варфарину из реальной клинической практики. Своевременное обращение пациентки за амбулаторной помощью, выполнение коагулограммы и отмена варфарина позволили избежать развития необратимых осложнений, таких как мозговой инсульт, массивные полостные кровотечения, смерть. Однако необходимо иметь в виду, что клиническая картина гипокоагуляторных процессов могла начаться с осложнений. Дальнейшее обследование пациентки позволило сделать заключение о наличии генетических полиморфизмов и, в дальнейшем, рассчитать индивидуальную дозировку варфарина. Именно благодаря знаниям патогенетических механизмов гиперчувствительности к варфарину и возможных методов диагностики позволили минимизировать риск текущих осложнений, новых кровотечений и в то же время эффективно проводить в дальнейшем профилактику сердечно-сосудистых осложнений в виде тромбозов и тромбоэмболий.
Заключение
Изложенный клинический случай представляет высокий интерес для практического врача любой специальности, поскольку развитие выраженной гипокоагуляции может привести к осложнениям, угрожающим жизни пациента, а также состояниям, значительно снижающим его социальную активность и трудоспособность в отдаленном периоде. Наличие гиперчувствительности к варфарину не является причиной для его полной отмены в ситуациях, требующих длительного приема антикоагулянтов. Безусловно, при заболеваниях не связанных с наличием протезов клапанного аппарата сердца, или некоррегируемыми пороками митрального клапана, терапевтическая тактика после стабилизации процессов коагуляции намного проще и более комфортна для пациента и заключается в назначении прямых оральных антикоагулянтов. Однако в ситуациях, при которых варфарин является единственным препаратом, контролирующим коагуляцию, знание особенностей метаболизма варфарина и его генетического контроля может помочь избежать необоснованную отмену препарата и снизить риск жизнеугрожающих кровотечений.
Прогноз для пациента. Прогноз благоприятный, поскольку не произошло необратимых осложнений, пациентка привержена к терапии, а именно ориентирована на длительный прием варфарина в индивидуальной дозировке с регулярным контролем МНО.
Информированное согласие. От пациентки получено письменное добровольное информированное согласие на предоставление информации о данных ее заболевания.
Благодарности. Авторы благодарят пациентку Л. за разрешение представить данные ее заболевания и за содействие в процессе лечения.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Ramachandran S, Pitchai S. Story of warfarin: From rat poison to lifesaving drug. Indian J Vasc Endovasc Surg. 2018;5:174-5. doi:10.4103/ijves.ijves_49_18.
2. Самбялова А. Ю., Баирова Т. А., Беляева Е. В. и др. Полиморфизм генов CYP2C9, CYP4F2, VKORC1 в популяции бурят. Генетика. 2020;56(12):1427-34. doi:10.31857/S0016675820120127.
3. AL-Eitan LN, Almasri AY, Al-Habahbeh SO. Effects of coagulation factor VII polymorphisms on warfarin sensitivity and responsiveness in Jordanian cardiovascular patients during the initiation and maintenance phases of warfarin therapy. Pharmgenomics Pers Med. 2019;12:1-8. doi:10.2147/PGPM.S189458.
4. Буркова Т. В., Гончарова И. А. Генетические факторы, влияющие на эффективность и безопасность длительной антикоагулянтной терапии. Кардиоваскулярная терапия и профилактика. 2013;12(3):89-94. doi:10.15829/1728-8800-2013-3-89-94.
5. Ma Z, Cheng G, Wang P, et al. Clinical Model for Predicting Warfarin Sensitivity. Sci Rep. 2019;9:12856. doi:10.1038/s41598-019-49329-0.
6. Груздева А. А., Хохлов А. Л., Ильин М. В. Оральные антикоагулянты в профилактике тромбоэмболических осложнений у кардиологических пациентов: анализ применения в Российской Федерации. Качественная клиническая практика. 2020;1:69-79. doi:10.37489/2588-0519-2020-1-69-79.
7. Мубаракшина О.А., Сомова М.Н., Батищева Г.А. Фармакогенетика варфарина: современное состояние вопроса. Лекция. Consilium Medicum. 2019;21(10):74-8. doi:10.26442/20751753.2019.10.190412.
8. Баирова Т. А., Самбялова А. Ю., Рычкова Л. В. и др. Фармакогенетический алгоритм дозирования варфарина в российской популяции. Acta biomedica scientifica. 2019;4(3):40-4. doi:10.29413/ABS.2019-4.3.5.
9. Gage BF, Eby C, Johnson JA, et al. Use of pharmacogenetic and clinical factors to predict the therapeutic dose of warfarin. Clin Pharmacol Ther. 2008;84(3):326-31. doi:10.1038/clpt.2008.10.
10. Pratt VM, Cavallari LH, Del Tredici AL. Recommendations for Clinical Warfarin Genotyping Allele Selection. A Report of the Association for Molecular Pathology and the College of American Pathologists. J Mol Diagn. 2020;22(7):847-59. doi:10.1016/j.jmoldx.2020.04.204.
Об авторах
Е С ЛевицкаяРоссия
Доктор медицинских наук, доцент кафедры внутренних болезней № 2.
Ростов-на-Дону
А А Кастанаян
Россия
Доктор медицинских наук, профессор, заведующий кафедрой внутренних болезней № 2, зав. терапевтическим отделением № 2 клиники.
Ростов-на-Дону
Г Н Леонова
Россия
Врач-гастроэнтеролог терапевтического отделения № 2 клиники.
Ростов-на-Дону
А А Яковлев
Россия
Доктор медицинских наук, профессор, заведующий кафедрой гастроэнтерологии и эндоскопии.
Ростов-на-Дону
С А Затонский
Россия
Кандидат медицинских наук, доцент кафедры внутренних болезней № 2.
Ростов-на-Дону
Л А Ганенко
Россия
Врач терапевтического отделения № 2 клиники.
Ростов-на-Дону
Дополнительные файлы
Что известно о предмете исследования?
- В настоящее время известны методы диагностики повышенной чувствительности к варфарину, однако их использование в клинической практике не имеет широкого применения.
- Отсутствие рутинных методов диагностики, определяющих вероятность наличия повышенной чувствительности к варфарину, повышает риск жизнеугрожающих кровотечений.
Что добавляют результаты исследования?
- В представленном клиническом случае демонстрируется ранняя верификация повышенной чувствительности к варфарину с помощью фармакогенетического анализа на наличие мутаций по трем генетическим маркерам — VKORC1, CYP2C9, CYP4F2, на основании которого определяется индивидуальная эффективная дозировка варфарина, позволяющая предотвратить развитие жизнеугрожающих кровотечений.
Рецензия
Для цитирования:
Левицкая Е.С., Кастанаян А.А., Леонова Г.Н., Яковлев А.А., Затонский С.А., Ганенко Л.А. Повышенная чувствительность к варфарину в практике терапевта. Клинический случай. Кардиоваскулярная терапия и профилактика. 2023;22(1):3392. https://doi.org/10.15829/1728-8800-2023-3392
For citation:
Levitskaya E.S., Kastanayan A.A., Leonova G.N., Yakovlev A.A., Zatonsky S.A., Ganenko L.A. Warfarin hypersensitivity in the internist's practice: a case report. Cardiovascular Therapy and Prevention. 2023;22(1):3392. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3392

























































