Перейти к:
Влияние длительного хранения образцов сывороток крови в условиях биобанка для проведения популяционных сероэпидемиологических исследований
https://doi.org/10.15829/1728-8800-2022-3407
Аннотация
Цель. Оценить сохранность антител класса IgG при долгосрочном хранении образцов сыворотки крови на примере специфических к вирусам кори и краснухи антител.
Материал и методы. В исследовании использованы образцы сыворотки крови из коллекции отдела эпидемиологии ФГБУ НИЦЭМ им. Н. Ф. Гамалеи Минздрава России, которые были исследованы на наличие антител IgG к вирусам кори и краснухи сразу по поступлению в лабораторию, заморожены и хранились при температуре -70о C (n=180). Повторное исследование образцов проводили по прошествии 20 мес. (n=90) и 6 лет (n=90).
Результаты. При повторном исследовании после 20 мес. хранения имело место снижение среднего уровня антител к вирусу кори на 13,1% (р<0,05) — от 0,36 (0,08-1,21) до 0,31 (0,02-1,2) МЕ/ мл и на 11,8% (р<0,05) — от 151,4 (45-235) до 133,5 (72-198) МЕ/ мл к вирусу краснухи; р<0,05 в обоих случаях. При этом количество серонегативных образцов не изменилось. После 6-летнего периода хранения средний уровень антител в отношении кори снизился на 33,8% (р<0,05) — от 0,72 (0,4-1,79) до 0,34 (0,18-1,14) МЕ/мл и только два образца стали серонегативными. Показано, что чем выше был уровень IgG в нативных образцах, тем более было выражено его снижение при повторном исследовании.
Заключение. Хранение образцов сыворотки крови в биобанке в течение 20 мес. при температуре -70о C обеспечивает сохранность IgG к вирусам кори и краснухи, и является основой достоверности результатов будущих исследований.
Ключевые слова
Для цитирования:
Ноздрачева А.В., Семененко Т.А. Влияние длительного хранения образцов сывороток крови в условиях биобанка для проведения популяционных сероэпидемиологических исследований. Кардиоваскулярная терапия и профилактика. 2022;21(11):3407. https://doi.org/10.15829/1728-8800-2022-3407
For citation:
Nozdracheva A.V., Semenenko Т.A. Influence of long-term storage of blood serum samples in a biobank for population-based seroepidemiologic studies. Cardiovascular Therapy and Prevention. 2022;21(11):3407. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3407
Введение
Основным методом проведения эпидемиологических исследований в отношении актуальных инфекционных болезней является изучение популяционного иммунитета к соответствующим возбудителям. Своевременная оценка риска развития вспышек и эпидемий среди населения, основанная на использовании указанного метода, позволяет "выиграть время" для планирования и проведения профилактических мероприятий [1][2]. Значимость популяционных исследований различных аспектов инфекционной патологии стала основанием для формирования паспортизированной коллекции образцов сывороток крови. Использование материалов банка сывороток крови позволяет проводить широкомасштабные научные исследования, которые в значительной мере расширяют представления об особенностях эпидемиологических процессов многих инфекций [3]. С каждым годом в мире увеличивается число биобанков, растет спектр и перечень направлений исследовательской работы с их привлечением [4-6]. Тем не менее, многие вопросы касающиеся, в т.ч. организации и стандартизации процессов в биобанке, требуют изучения и уточнения [7][8]. В связи с этим следует отметить, что период хранения биообразцов в банке может исчисляться как днями и неделями, так и десятилетиями, что ставит вопрос о достоверности и воспроизводимости результатов популяционных исследований, проведенных с использованием долго хранимых биообразцов.
Значительное количество современных научных работ посвящены вопросам оценки стабильности биохимических аналитов (ионный состав, гормоны, холестерин и т.д.), а также разнообразных белковых фракций в образцах сыворотки крови [9-12]. Изучение сохранности антител IgG при проведении исследования популяционного иммунитета в отношении инфекций представлено фрагментарно, несмотря на актуальность такого рода работ [13][14].
Стабильность — это способность биологического материала сохранять первоначальные свойства определенного маркера в течение некоторого периода времени в некоторых пределах при хранении в заданных условиях. Для количественного определения стабильности используют в т.ч. вычисление доли проб, в которых после хранения уровень исследуемого маркера был изменен. Критическое значение указанной доли образцов в разных исследованиях варьирует в небольших пределах и, в среднем, составляет 15% [11]. Стабильность проб биологического материала на преаналитическом этапе зависит от температуры окружающей среды, механических воздействий (например, встряхивание проб при транспортировке) и, главное, времени.
Образцы сыворотки и плазмы крови стандартно хранят при температуре -70° C и ниже, т.к. большинство биохимических и иммунологических показателей не отличаются высокой степенью стабильности при хранении на -20 — -30° C (допустимо в течение 3 нед.). Экспериментально показано, что биообразцы могут храниться в течение 24 ч до биохимического исследования, при увеличении этого времени до 36 ч отмечаются процессы деградации аналитов [12][15].
Наиболее оптимальным для обеспечения сохранности биообразцов является использование высокопроизводительных автоматизированных систем хранения биологического материала, однако возможно также использование морозильных камер с температурой хранения от -70 до -80° C [5][6][9]. Для обеспечения стабильности всех маркеров важным является быстрое замораживание образцов сыворотки и плазмы, т.к. при затягивании этого процесса образуются кристаллы льда, которые разрывают молекулы, особенно белковые. Поэтому сразу после центрифугирования аликвотированные образцы необходимо замораживать при температуре ≤-70° C. При этом размораживание их следует производить медленно, при +4° C (на льду) [3].
Маркеры, представленные белковыми фракциями, являются наиболее стабильными при хранении. По результатам исследования интерлейкинов различных классов установлено, что при продолжительности хранения 2 нед. их уровень изменяется по-разному в зависимости от температурных условий. Так, при температуре 2-8° C средний их уровень в образцах сыворотки крови снижался (-15%), а при более глубоком замораживании до -80° C увеличивался (+17%) [10]. При этом температура хранения -20° C в течение того же периода времени не влияла на уровень исследуемого маркера.
Среди всех классов иммуноглобулинов (IgA, IgM, IgE, IgG) IgG является наиболее стабильным. По некоторым данным уровень IgG в образцах сыворотки крови не изменяется в течение 8 мес. при температуре -20° C, в то время как для IgM и IgE этот период сокращается до полугода1. Экспериментальные исследования сохранности IgG при долгосрочном хранении при низких температурах (≤-70° C) требуют значительных временных затрат, и представлены в научной литературе фрагментарно, в то время как актуальность таких работ на сегодняшний день очевидна.
Цель исследования — оценить сохранность антител класса IgG при долгосрочном хранении образцов сыворотки крови на примере специфических к вирусам кори и краснухи антител.
Материал и методы
В исследовании использованы образцы сыворотки крови (n=180) от случайно выбранных условно здоровых лиц, проживающих в Москве, из коллекции отдела эпидемиологии ФГБУ "НИЦЭМ им. Н. Ф. Гамалеи" Минздрава России (Москва). Все образцы коллекции, использованные для проведения работы, собраны, первично исследованы и заморожены в один день. Формирование указанной коллекции биообразцов одобрено Комитетом по биомедицинской этике ФГБУ "НИЦЭМ им. Н. Ф. Гамалеи" Минздрава России (Протокол № 2 от 04.02.2016г).
Взятие крови осуществляли из локтевой вены с помощью системы однократного применения BD Vacutainer Safety-Lok (Becton Dickinson and Company, США) в количестве 4-5 мл в лечебно-профилактическом учреждении по соглашению о научном сотрудничестве. Для сбора и хранения образцов крови применяли пробирки с активатором свертывания. После доставки в лабораторию для отделения сыворотки образцы цельной крови центрифугировали (10 тыс. об./мин в течение 15 мин при температуре 18-25° C), затем аликвотировали и маркировали с помощью штрихкодов. Хранение полученных аликвот при низких температурах (-70° C) осуществляли в криопробирках (производство Axygen Scientific, США) с завинчивающимися крышками, исключающими самопроизвольное вскрытие.
Образцы сывороток крови были исследованы 3-кратно: сразу после поступления в лабораторию, по завершении 20 мес. хранения при температуре -70° C, после 6 лет хранения при температуре -70° C. Для предотвращения повторных циклов замораживания/оттаивания для исследования использовали разные аликвоты. Однократное размораживание биообразцов проводили постепенно по ступенчатой схеме, включающей последовательное выдерживание в температурных интервалах: 1) -20 — -22° C (сут.); 2) +4° — +6° C (сут.); 3) +19° — +21° C (2 ч).
Изучение напряженности иммунитета к вирусам кори и краснухи в каждом образце сыворотки крови осуществляли методом твердофазного непрямого иммуноферментного анализа (ИФА) с использованием отечественных тест-систем производства ЗАО "ВекторБест" ("Векто-корь IgG", "Векто-рубелла IgG") однократно без повторов. Все исследования выполнены в соответствии с инструкциями фирмы-изготовителя: серопозитивными считались образцы, в сыворотке крови которых определялись специфические IgG-антитела к вирусу кори на уровне ≥0,18 МЕ/мл (cut off), к вирусу краснухи ≥10 МЕ/мл (cut off). В случаях определения значения меньше указанных уровней, образец считался отрицательным, и обследованный пациент учитывался как серонегативный.
Согласно протоколу, исследование включало две серии опытов.
Опыт 1: изучение влияния условий хранения образцов сывороток крови (n=90, №№ 1-90) при температуре -70° C в течение 20 мес. Для этого были исследованы, проанализированы и сопоставлены уровни специфических IgG к вирусам кори и краснухи в нативных образцах (сразу при поступлении в лабораторию) и по прошествии указанного периода хранения (повторно).
Опыт 2: изучение влияния условий хранения образцов сывороток крови (n=90, №№ 91-180) при температуре -70° C в течение 6 лет. Для этого были исследованы, проанализированы и сопоставлены уровни специфических IgG к вирусу кори в нативных образцах (сразу при поступлении в лабораторию) и по прошествии указанного периода хранения (повторно).
Статистическая обработка данных осуществлялась с помощью программ Microsoft Excel и STATISTICA 12.0. Уровни значимости альфа и бета установлены равными 5% (т.е. значение р<0,05, рассматривается как значимое, а анализ имел 95%-ю мощность). Для статистического анализа полученных значений уровня специфических IgG на каждом этапе исследования было оценено распределение исследуемых величин (критерий Шапиро-Уилка), использованы соответствующие методы описательной статистики — рассчитаны следующие показатели: медиана (Me) и интерквартильный размах (Q25-Q75). Для проверки достоверности различий между группами обследованных использовался критерий Вилкоксона (Т). Критическое значение (Tкрит) для него согласно табличным данным при n=90 удовлетворяло неравенству Tкрит>466. Для оценки корреляционной связи использовался коэффициент корреляции Спирмена (ρ).
Результаты
При использовании критерия Шапиро-Уилка установлено, что распределение серопозитивных образцов с разным уровнем антител к вирусу кори и краснухи не соответствовало "нормальному" закону (распределению Гаусса) при р<0,001 (рисунки 1, 2). В связи с этим результаты исследования в дальнейшем были охарактеризованы непараметрическими методами описательной статистики.
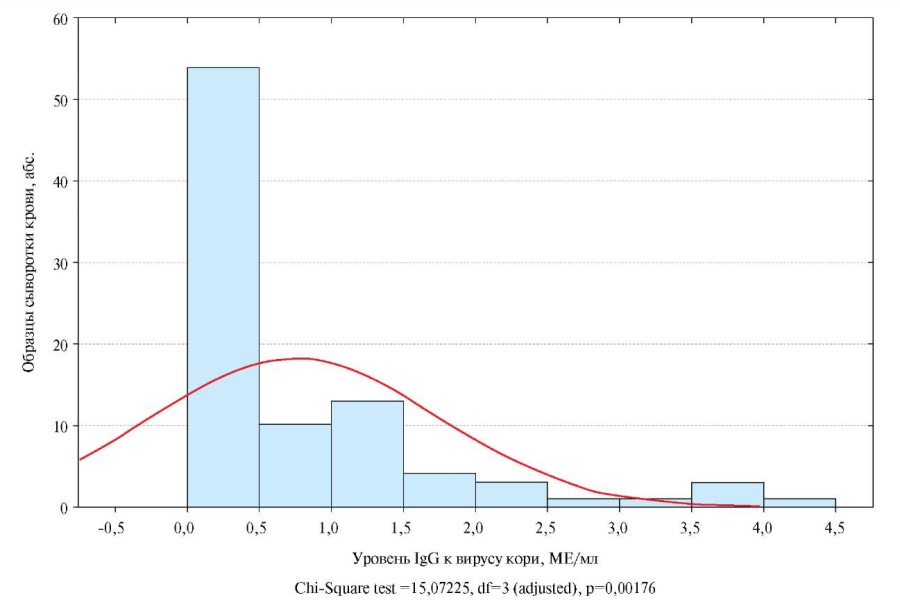
Рис. 1 Распределения лиц с разным уровнем антител (IgG) к вирусу кори среди серопозитивных (гистограмма) в сравнении с "нормальным" законом (красный график).

Рис. 2 Распределения лиц с разным уровнем антител (IgG) к вирусу краснухи среди серопозитивных (гистограмма) в сравнении с "нормальным" законом (красный график).
Согласно результатам опыта 1 установлено, что продолжительность хранения 20 мес. при температуре -70° C оказала приемлемое влияние на уровень антител к вирусам кори и краснухи. Доля проб, в которых после хранения уровень исследуемого маркера был изменен, не превышала 15%. При повторном исследовании средний уровень антител в отношении вируса кори снизился на 13,1%: от 0,36 (0,08-1,21) до 0,31 (0,02-1,2) МЕ/мл) и на 11,8%: от 169,5 (45-235) до 160,5 (72-198) МЕ/мл) в отношении вируса краснухи (рисунки 3, 4). Указанные различия оказались статистически значимы: так, критерий Вилкоксона для кори составил Т=26 (р<0,05), для краснухи Т=31 (р<0,05), что удовлетворяло неравенству Т<Tкрит.

Рис. 3 Диаграмма размаха для распределения уровней антител в отношении вируса кори в нативных образцах сыворотки крови и после хранения в течение 20 мес. (опыт 1).

Рис. 4 Диаграмма размаха для распределения уровней антител в отношении вируса краснухи в нативных образцах сыворотки крови и после хранения в течение 20 мес. (опыт 2).
Стоит отметить, что некоторые образцы сыворотки крови были серонегативными (доля их составила 36,7% к вирусу кори и 10% к вирусу краснухи) при первичном исследовании (уровень IgG в них был <0,18 МЕ/мл и 10 МЕ/мл, соответственно). Кроме того, в 20% случаев уровень IgG оказался достаточно небольшим и находился в пределах от 0,18 до 0,5 МЕ/мл (корь) и от 10 до 200 МЕ/мл (краснуха). С учетом данных о снижении среднего уровня антител после хранения ожидаемым было увеличение численности образцов с уровнем IgG ниже порового при повторном исследовании, что, в конечном итоге, не нашло подтверждения полученными результатами. Так, количество серонегативных образцов к возбудителям обеих инфекций не изменилось по прошествии 20 мес. хранения, т.е. не произошло снижения уровня специфических антител до неопределяемого в образцах, имевших значения, близкие к пограничному — cut off =0,18 МЕ/мл (корь) и cut off =10 МЕ/мл (краснуха).
Установлено, что чем выше был уровень IgG в нативном образце сывороток крови, тем более выраженным было его снижение при повторном исследовании (рисунок 5).

Рис. 5 Распределение уровня антител IgG к вирусу кори в образцах сыворотки крови при первичном и повторном исследованиях (опыт 1).
Видно, что в отношении кори исследуемые показатели в пределах 1 МЕ/мл практически совпадали при первичном и повторном исследовании, тогда как при значениях >2 МЕ/мл разница была более выраженной и достигла максимума в образцах с высоким (>4 МЕ/мл) уровнем IgG. Аналогичные данные были получены и в отношении краснухи. Значения уровня специфических антител >250 МЕ/мл выявлены только в нативных образцах.
Согласно результатам опыта 2 установлено, что продолжительность хранения в течение 6 лет при температуре -70° C существенно не повлияла на сохранность IgG к вирусу кори. Так, при повторном исследовании средний уровень антител в отношении возбудителя этой инфекции снизился на 33,8%: от 0,72 (0,4-1,79) до 0,0,34 (0,181,14) МЕ/мл). Критерий Вилкоксона в опыте 2 для кори составил Т=276 (р<0,05), что также как в опыте 1, удовлетворяло неравенству Т<Tкрит. (рисунок 6).

Рис. 6 Диаграмма размаха для распределения уровней антител в отношении вируса кори в нативных образцах сыворотки крови и после хранения в течение 6 лет (опыт 2).
Доля серонегативных в нативных образцах была меньше, чем по результатам опыта 1 и составила 21,1%, тогда как доля образцов с невысоким уровнем антител в пределах 0,18-0,5 МЕ/мл была больше — 37,8%. Установлено, что за 6-летний период хранения образцов только два из них, имевшие первоначальные уровни антител 0,3 и 0,4 МЕ/мл, стали серонегативными при повторном исследовании.
Выявленная в опыте 1 тенденция прослеживалась и в опыте 2 — чем выше был уровень IgG в нативных образцах сывороток крови, тем более выраженным было его снижение при повторном исследовании. Для наглядности такой зависимости на рисунке 7 мы упорядочили указанные значения в выборке от меньшего к большему, и представили их попарно (первичное и повторное исследование). Корреляционный анализ выявил сильную положительную связь между уровнем антител при первичном исследовании и разницей (Δ) между первичным и повторным результатом для каждого образца сыворотки крови (ρ=0,83 при р>0,00001).

Рис. 7 Распределение образцов сыворотки крови в соответствии с уровнем антител IgG к вирусу кори при первичном и повторном исследованиях по мере возрастания значений (опыт 2).
Обсуждение
Полученные в настоящей работе данные согласуются с результатами других исследователей. Так, показано, что при хранении биообразцов в течение 6 лет при температуре -70° C уровни показателей липидного профиля, инсулина и тиреотропного гормона снизились незначительно, что свидетельствовало о правомочности длительного хранения биообразцов с перспективой проведения дальнейших лабораторных исследований [9]. Аналогичные результаты были получены для других биохимических показателей [12][15], а также для разных классов цитокинов [10].
Особенностью серологических исследований является то, что распределение значений уровня антител IgG имеет смещение, и не подчиняется нормальному закону, что согласуется с данными научной литературы [16][17]. В связи с этим небольшие значения вблизи cut off наиболее многочисленны в выборке значений уровня указанного маркера, что часто приводит к трудностям в их интерпретации и делении на серопозитивные и серонегативные образцы. Более того, проблема усугубляется при долгосрочном хранении, когда средний уровень IgG смещается еще больше в сторону небольших значений, что может отразиться на достоверности результатов будущих исследований. Однако обнаруженный нами эффект большей "точности" измерения именно низких значений по сравнению с высокими значениями уровня антител к вирусам кори и краснухи при повторном исследовании с отсутствием перехода через границу cut off в исследуемых образцах (из области серопозитивных значений в область серонегативных), может нивелировать снижение среднего в выборке. Такой результат, на наш взгляд, является крайне важным для исследований популяционного иммунитета к возбудителям инфекционных заболеваний, в частности кори и краснухи, т.к. основным критерием защищенности населения в отношении соответствующих возбудителей является именно долевое распределение серонегативных и серопозитивных лиц. При этом распределение лиц с разным уровнем антител среди серопозитивных играет меньшую роль.
Причины обнаруженного эффекта могут быть различными и, возможно, являются следствием молекулярных и биохимических характеристик иммуноглобулинов IgG. Однако, на наш взгляд, наиболее очевидным объяснением могут быть особенности методики постановки ИФА. Согласно инструкции по применению набора реагентов "Векто-корь IgG" и "Векто-рубелла IgG", определение уровня антител в сыворотке крови происходит после построения калибровочного графика (метод кусочно-линейной аппроксимации) в соответствии со значениями оптической плотности в калибровочных образцах и соотнесения с ними фактически полученных значений оптической плотности в пробах. Однако при построении такого графика используют калибровочные образцы с увеличивающимся "шагом" друг относительно друга, а именно: 0,15; 0,5; 1; 2; 5 МЕ/мл (корь) и 10, 50, 100, 200, 800 МЕ/мл (краснуха). Таким образом, понятно, что точность измерения при высоких значениях ниже, чем при низких. Это связано с необходимостью в практической медицине выявления, прежде всего лиц иммунных и неиммунных к возбудителю, для чего реализована возможность постановки качественного варианта ИФА с тем же набором реагентов.
Ожидаемым результатом является большее влияние периода хранения в 6 лет на сохранность IgG к вирусу кори в сыворотке крови по сравнению с 20-месячным сроком. Однако и оно, с нашей точки зрения, не является критичным для качества последующих исследований популяционного иммунитета. Несмотря на то, что среднее значение уровня антител уменьшилось на 33,8%, только 2 образца из 90 стали серонегативными (т.е. 2% из исследуемой выборки). Здесь следует учитывать, что чувствительность набора реагентов в отношении вируса кори составляет 0,07 МЕ/мл (инструкция по применению набора реагентов). Так, диапазон значений для контрольного образца составляет 1,1-1,8 МЕ/мл, что в процентном выражении соответствует колебанию в 38,9%. Таким образом, полученные результаты опыта 2, свидетельствуют об отсутствии критического влияния 6-летнего периода хранения на достоверность будущих популяционных исследований. В качестве ограничения следует отметить, что в проведенной нами работе некоторые особенности преаналитического этапа, такие как продолжительность транспортировки от места взятия крови до лаборатории, условия хранения биоматериала и прочие, не были учтены. Это теоретически могло отразиться на полученных результатах [18]. Например, в отношении некоторых цитокинов было показано, что указанные факторы влияют на результаты исследования [10]. Кроме того, хранение образцов в лаборатории в нашем случае предполагало использование низкотемпературных морозильных камер, что сопровождалось необходимостью применения ручного труда и, в свою очередь, могло отразиться на результатах. Указанные объективные ограничения были учтены при формировании протокола исследования: так, максимально возможно сокращена длительность всех манипуляций с образцами сыворотки крови. Суммарно закладка на хранение образцов проведена не позднее 12 ч с момента взятия цельной крови, а хранение их при повторном исследовании в условиях комнатной температуры (+19 — +21° C) не превышало 2 ч, тогда как по результатам исследования интерлейкинов, менее стойких по сравнению с иммуноглобулинами, допускается их хранение до 24 ч [18-20].
Заключение
В соответствии с полученными результатами исследования можно сделать общий вывод, что хранение образцов сывороток крови при низких температурах позволяет обеспечить сохранность IgG к вирусам кори и краснухи на достаточно продолжительный срок для будущих исследований. Очевидно, что по возможности необходимо минимизировать период хранения и в идеале проводить лабораторный анализ в день взятия биопробы. Однако в современных условиях стремительного развития отрасли биобанкирования и трансляционной медицины в целом, хранение образцов для будущих исследований является неизбежным, и диктует необходимость оптимизации используемых технологий и процедур в биобанках. Ввиду того, что Ig являются одним из самых стойких маркеров, используемых при проведении исследований, а метод ИФА — одним из самых надежных, популяционные исследования на их основе имеют широкую перспективу использования материалов биобанков.
Шестилетний период хранения биообразцов при температуре -70° C оказал некоторое влияние на уровень антител к вирусу кори, что выразилось в снижении медианы на 33%. Для определения принципиальной значимости таких изменений необходимо проведение дополнительных исследований и определения четких количественных критериев оценки, которые в настоящее время отсутствуют. Тем не менее, учитывая особенности методики постановки ИФА, а также то, что указанные образцы используются для проведения популяционных серологических исследований, по мнению авторов, такое изменение не является критичным. Очевидно, что актуальным является продолжение изучения влияния условий хранения, в т.ч. температуры и продолжительности, для определения момента наступления необратимых изменений биообразцов, делающих их непригодными для повторных исследований.
Отношения и деятельность. Работа выполнена при поддержке Государственного задания Минобрнауки РФ № FZWN-2020-0017.
1. Методические рекомендации "Организация преаналитического этапа при централизации лабораторных исследований". Одобрены на заседании профильной комиссии Минздрава России по клинической лабораторной диагностике. Москва, 30 мая 2013г.
Список литературы
1. Семененко Т.А., Акимкин В. Г. Сероэпидемиологические исследования в системе надзора за вакциноуправляемыми инфекциями. Журнал микробиологии, эпидемиологии и иммунобиологии. 2018;2:87-94. doi:10.36233/0372-9311-2018-2-87-94.
2. Ноздрачева А.В., Грицик А.А., Кузин С.Н. и др. Оценка фактической восприимчивости отдельных групп декретированного населения к вирусам кори, краснухи и эпидемического паротита. Вестник РГМУ. 2017;5:54-8.
3. Семененко Т.А., Ананьина Ю.В., Боев Б.В. и др. Банки биологических ресурсов в системе фундаментальных эпидемиологических и клинических исследований. Вестник Российской академии медицинских наук. 2011;10:5-9.
4. Henderson MK, Goldring K, Simeon-Dubach D. Advancing professionalization of biobank business operations: A worldwide survey. Biopreserv Biobank. 2019;17:71-5. doi:10.1089/bio.2018.0079.
5. Долудин Ю.В., Борисова А. Л., Покровская М. С. и др. Современные передовые практики и рекомендации по биобанкированию. Клиническая лабораторная диагностика. 2019;64(12):769-76. doi:10.18821/0869-2084-2019-64-12-769-776.
6. Покровская М. С., Борисова А. Л., Сивакова О.В. и др. Управление качеством в биобанке. мировые тенденции и опыт биобанка ФГБУ "НМИЦ профилактической медицины" Минздрава России. Клиническая лабораторная диагностика. 2019;64(6):380-4. doi:10.18821/0869-2084-2019-64-6-380-384.
7. Anisimov SV, Granstrem OK, Meshkov AN, et al. National association of biobanks and biobanking specialists: new community for promoting biobanking ideas and projects in Russia. Biopreserv Biobank. 2021;19(1):73-82. doi:10.1089/bio.2020.0049.
8. Schultze AE, Irizarry AR. Recognizing and Reducing Analytical Errors and Sources of Variation in Clinical Pathology Data in Safety Assessment Studies. Toxicol Pathol. 2017;45(2):281-7. doi:10.1177/0192623316672945.
9. Козлова В. А., Метельская В.А., Покровская М. С. и др. Изучение стабильности биохимических маркеров при непрерывном длительном хранении сыворотки крови и при однократном размораживании. Кардиоваскулярная терапия и профилактика. 2020;19(6):2736. doi:10.15829/1728-8800-2020-2736.
10. Verberk IM, Nossent EJ, Bontkes HJ, et al. Preanalytical sample handling effects on blood cytokine levels: quality control of a COVID-19 biobank. Biomark Med. 2021;15(12):987-97. doi:10.2217/bmm-2020-0770.
11. Vincent FB, Nim HT, Lee JPW, et al. Effect of storage duration on cytokine stability in human serum and plasma. Cytokine. 2019;113:453-7. doi:10.1016/j.cyto.2018.06.009.
12. Peakman TC, Elliott P. The UK Biobank sample handling and storage validation studies. Int J Epidemiol. 2008;37:1-26. doi:10.1093/ije/dyn019.
13. Ноздрачева А. В., Асатрян М. Н., Рыбак Л. А. и др. Совершенствование эпидемиологической диагностики в системе надзора за корью при помощи новых методов информационного обеспечения. Эпидемиолоия и инфекционные болезни. Актуальные вопросы. 2022;2:12-9. doi:10.18565/epidem.2022.12.2.12-9.
14. Ноздрачева А.В., Асатрян М. Н., Рыбак Л.А. и др. Совершенствование информационного обеспечения расследования случаев кори с применением новых программных средств. Санитарный врач. 2022;5:316-25. doi:10.33920/med08-2205-01.
15. Elliott P, Peakman TC. UK Biobank. The UK Biobank sample handling and storage protocol for the collection, processing and archiving of human blood and urine. Int J Epidemiol. 2008;37(2):234-44. doi:10.1093/ije/dym276.
16. Ноздрачева А.В., Семененко Т.А. Состояние популяционного иммунитета к кори в России: систематический обзор и метаанализ эпидемиологических исследований. Журнал микробиологии, эпидемиологии и иммунобиологии. 2020;97(5):445-57. doi:10.36233/0372-9311-2020-97-5-7.
17. Ноздрачева А.В., Семененко Т.А., Асатрян М. Н. и др. Иммунологическая восприимчивость населения мегаполиса к кори на этапе ее элиминации. Эпидемиология и Вакцинопрофилактика. 2019;18(2):18-26. doi:10.31631/2073-3046-2019-18-2-18-26.
18. Giavarina D, Lippi G. Blood venous sample collection: Recom - mendations overview and a checklist to improve quality. Clin Biochem. 2017;50(10-11):568-73. doi:10.1016/j.clinbiochem.2017.02.021.
19. Lippi G, Guidi GC, Mattiuzzi C, et al. Preanalytical variability: the dark side of the moon in laboratory testing. Clin Chem Lab Med. 2006;44(4):358-65. doi:10.1515/CCLM.2006.073.
20. Kang F, Li W, Xia X, et al. Three years’ experience of quality monitoring program on pre-analytical errors in china. J Clin Lab Anal. 2021;35(3):e23699. doi:10.1002/jcla.23699.
Об авторах
А. В. НоздрачеваРоссия
Ноздрачева Анна В. — кандидат медицинских наук, научный сотрудник отдела эпидемиологии
Москва
Т. А. Семененко
Россия
Семененко Татьяна Анатольевна — доктор медицинских наук, профессор, руководитель отдела эпидемиологии
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Ноздрачева А.В., Семененко Т.А. Влияние длительного хранения образцов сывороток крови в условиях биобанка для проведения популяционных сероэпидемиологических исследований. Кардиоваскулярная терапия и профилактика. 2022;21(11):3407. https://doi.org/10.15829/1728-8800-2022-3407
For citation:
Nozdracheva A.V., Semenenko Т.A. Influence of long-term storage of blood serum samples in a biobank for population-based seroepidemiologic studies. Cardiovascular Therapy and Prevention. 2022;21(11):3407. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3407

























































