Перейти к:
Содержание матриксных металлопротеиназ в крови больных артериальной гипертонией с высоким сердечно-сосудистым риском на фоне терапии статинами
https://doi.org/10.15829/1728-8800-2022-3422
Аннотация
Цель. Провести сравнительную оценку влияния аторвастатина и розувастатина в составе комплексной терапии больных артериальной гипертонией (АГ) с высоким сердечно-сосудистым риском на уровень матриксных металлопротеиназ -1, -9 (ММП-1, ММП-9) и тканевых ингибиторов матриксных металлопротаназ -1, -4 (ТИМП-1, ТИМП-4).
Материал и методы. В исследование включены 140 больных АГ,
которые на фоне антигипертензивной терапии получали аторвастатин 20 мг/сут. в течение года; в последующем этот препарат
был заменен на розувастатин, который у трех групп участников исследования применялся в дозах 10 мг/сут. (n=96), 20 мг/сут. (n=24), 40 мг/сут. (n=26). Пациентам были проведены стандартные клинико-лабораторные и инструментальные исследования. В сыворотке крови пациентов определяли уровни ММП-1, ММП-9 и ТИМП-1, ТИМП-4.
Результаты. Больные, применявшие розувастатина в дозе 40 мг/сут., имели более выраженное снижение ММП-1, чем при лечении розувастатином в дозе 10 и 20 мг/сут. (p<0,05), при этом различий в динамике ММП-1 при лечении малыми и средними дозами не выявлено. Розувастатин оказывал менее выраженное влияние на ММП-9, чем на ММП-1, при этом повышение дозы розувастатина не влияло на интенсивность снижения ММП-9 (p>0,05). Содержание ТИМП-1 и ТИМП-4 при приеме розувастатина возрастало, более выраженный дозозависимый прирост ТИМП-1 отмечен при приеме розувастатина 20 мг/сут. и 40 мг/сут., наибольший прирост ТИМП-4 — при использовании розувастатина в дозе 40 мг/сут. Аторвастатин не оказывал значимого влияния на показатели ММП-1 и ММП-9, ТИМП-1 и ТИМП-4.
Заключение. Длительное применение розувастатина (10 мг/сут., 20 мг/сут., 40 мг/сут.) в составе комплексной терапии больных с высоким сердечно-сосудистым риском влияет на параметры метаболизма эластина и коллагена сосудистой стенки, уменьшая уровень ММП-1, ММП-9 и увеличивая содержание ТИМП-1, ТИМП-4 в крови.
Ключевые слова
Для цитирования:
Михин В.П., Осипова О.А., Воротынцева В.В., Перуцкий Д.Н., Головина Н.И. Содержание матриксных металлопротеиназ в крови больных артериальной гипертонией с высоким сердечно-сосудистым риском на фоне терапии статинами. Кардиоваскулярная терапия и профилактика. 2022;21(10):3422. https://doi.org/10.15829/1728-8800-2022-3422
For citation:
Mikhin V.P., Osipova O.A., Vorotyntseva V.V., Perutsky D.N., Golovina N.I. Content of matrix metalloproteinases in the blood of hypertensive patients with a high cardiovascular risk receiving statin therapy. Cardiovascular Therapy and Prevention. 2022;21(10):3422. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3422
Введение
Высокая распространенность артериальной гипертонии (АГ) (>40%) [1] является ведущим фактором сердечно-сосудистого риска (ССР) среди взрослого населения Российской Федерации [2]. Одним из ключевых органов-мишений АГ, наряду с миокардом, является стенка артерий [3]. Именно поражение сосудистой стенки на фоне АГ служит одним из провоцирующих факторов развития атеросклеротического поражения артерий. Наряду с дисфункцией сосудистого эндотелия, важнейшую роль в развитии гипертонической ангиопатии с последующим присоединением атеросклеротического поражения [4] играет нарушение эластичности сосудистой стенки [5].
Высокая концентрация ангиотензина II, ассоциированная с АГ, инициирует ремоделирование матрикса, повышает содержание коллагена и активирует свободнорадикальные процессы в сосудистой стенке [6-9]. Ангиотензин II стимулирует экспрессию воспалительных цитокинов и факторов роста в матриксе, что способствует развитию общевоспалительной реакции, ремоделированию сосудистой стенки и увеличению ее жесткости [10][11], которые ассоциируются с высоким ССР [5].
При сочетании АГ и гиперхолестеринемии, либо недостижении целевого уровня холестерина (ХС), соответствующего степени сосудистого риска, прогрессирование поражения сосудистой стенки с развитием атеросклеротического процесса значительно ускоряется [12][13]. В этой связи представляется патогенетически оправданным, с точки зрения профилактики поражения сосудистой стенки, применение ингибиторов ангиотензинпревращающего фермента либо сартанов, ангиопротективный механизм которых очевиден, а эффект уже доказан. Вторым важным компонентом профилактики развития атеросклероза служат гиполипидемические средства, в частности статины [12-14], однако ангиопротективный эффект препаратов этой группы связывают, как правило, исключительно с их гиполипидемическими свойствами и способностью уменьшать накопление ХС в сосудистой стенке и снижать воспалительную активность [15]. При этом подробно описана способность статинов, в частности розувастатина, уменьшать жесткость сосудистой стенки [16]. Однако механизмы реализации способности статинов увеличивать эластичность сосудистой стенки остаются малоизученными. Имеются отдельные работы, описывающие снижение уровня коллагена и повышение содержания эластина при длительной терапии питавастатином [17][18]. При этом механизмы воздействия статинов на процессы коллагенобразования у пациентов с АГ и высоким ССР остаются неясными [19]. Жестко-эластические свойства сосудистой стенки определяются соотношением эластина и коллагена (в норме 1:1), синтез и деградация которых регулируется матриксными металлопротеиназами (ММП) и их тканевыми ингибиторами (ТИМП). ММП-1, -2, -9, -13 (коллагеназы) регулируют деградацию коллагена (преимущественно I и III типов, содержащихся в сосудистой стенке, в меньшей степени — II, VII, VII, X, XI типов), ММП-9 (желатиназа) регулирует деградацию эластина, ТИМП (1-4) замедляет расщепление коллагена за счет ингибирования металлопротеиназ: ТИМП-1 ингибирует ММП-1, -7, -9, -13; ТИМП-4 ингибирует ММП-2, -14. Нарушение соотношения содержания эластина и коллагена лежит в основе увеличения жесткости сосудистой стенки. При прогрессировании атеросклероза снижается концентрация ТИМП-1, развивается дисбаланс в степени деградации коллагена и эластина в соединительно-тканном матриксе, что приводит к снижению прочности фиброзной покрышки астеросклеротической бляшки, ее разрыву и развитию тромботических осложнений, в частности, острого коронарного синдрома [20].
Аналогичные процессы, обуславливающие ремоделирование миокарда у больных АГ с высоким ССР, также регулируются ММП, но другими их подтипами [21].
Отмечено, что плазменные уровни ТИМП-1 у мужчин выше, чем у женщин. Нормальный уровень ТИМП-1 увеличивается с возрастом. Концентрация ТИМП-1 напрямую коррелирует с индексом массы тела, индексом атерогенности. Стабильность фиброзной капсулы атеромы определяется состянием коллагеновых структур, стабильность которых регулируется ММП и ТИМП. В этой связи представляется целесообразным оценить влияние статинов на механизмы регуляции метаболизма коллагена сосудистой стенки [22].
Цель исследования — провести сравнительную оценку влияния аторвастатина (20 мг/сут.) и розувастатина (10 мг/сут., 20 мг/сут., 40 мг/сут.) в составе комплексной терапии больных АГ с высоким ССР на уровень ММП-1, ММП-9 и ТИМП-1, ТИМП-4.
Материал и методы
В исследование включены 140 больных АГ II стадии, 2-3 степени с высоким ССР (оценивался по таблице SCORE-1 — Systematic Coronary Risk Evaluation) в возрасте 45-59 лет, средний возраст 55,4±4,3 (мужчин — 118, женщин — 22), продолжительность АГ 5-12 лет. Критерии включения: высокий ССР, наличие АГ II стадии, 2-3 ст., гиперхолестеринемия, для коррекции которой показаны статины, отсутствие в анамнезе применения гиполипидемических средств, наличие гипотензивной терапии, возраст 45-59 лет. Включение в исследование проходило в рамках оценки эффективности гиполипидемической терапии при высоком ССР в реальной амбулаторно-клинической практике. Критерии невключения в исследование: наличие нарушения углеводного обмена, курение, индекс массы тела >35 кг/м2.
Индекс массы тела у включенных в исследование больных составлял 25-35 кг/м2 (избыточная масса тела или ожирение I ст.). Основные факторы ССР — АГ и гиперхолестеринемия (уровень общего ХС — 6-8 ммоль/л). При включении в исследование больным в условиях амбулаторно-поликлинического наблюдения был назначен аторвастатин 20 мг/сут., который они получали в течение 1 года, но не достигли целевого уровня ХС и ХС липопротеинов низкой плотности (ЛНП), в связи с чем аторвастатин был заменен на розувастатин 10 мг/сут. В случае недостижения целевого уровня ХС и ХС ЛНП в течение 4 нед., доза препарата увеличивалась до 20 мг/сут., а при недостижении целевого уровня ХС и ХС ЛНП в течение последующих 4 нед., доза увеличивалась до 40 мг/сут., далее в случае недостижения целевых уровней к лечению дополнялся эзатимиб 10 мг/сут. (в соответствии с Российскими рекомендациями, VI пересмотр) [23]. После назначения эзатемиба больные из исследования исключались. Продолжительность лечения розувастатином составляла 18 мес., при этом дозу 10 мг/сут. получали 90 пациентов, 20 мг/сут. — 24, 40 мг/сут. — 26 больных. Количество больных, включенных в исследование, в ходе его выполнения не изменилось.
В качестве антигипертензивной терапии больные получали эналаприл 20-40 мг/сут., индапамид ретард 1,5 мг/сут., при недостижении целевого артериального давления лечение дополняли метопрололом 100150 мг/сут., дозовые режимы определялись эффективностью терапии. Для повышения приверженности к лечению при включении в исследование и каждые 6 мес. в процессе наблюдения с больными проводились индивидуальные беседы о значимости непрерывной гиполипидемической и антигипертензивной терапии, необходимости достижения целевых показателей липидного профиля и артериального давления.
Наряду с определением в крови концентрации ХС, ХС ЛНП и других параметров липидного спектра, а также аспартатаминотрансферазы, аланинаминотрансферазы (не превышали 3-кратного значения верхней границы нормы), креатинфосфокиназы (не превышала верхней границы нормы), в крови оценивали концентрацию ММП-1, ММП-9, ТИМП-1, ТИМП-4 до начала лечения статинами, через 1 год от начала приема аторвастатина и через 6, 12 и 18 мес. от начала лечения розувастатином.
Содержание всех исследуемых параметров — ММП1, ММП-9, ТИМП-1, ТИМП-4 — определяли в сыворотке крови методом твердофазного иммуноферментного анализа (BCM Diagnostics), на многоканальном анализаторе Multiscan FC. Оценивали оптическую плотность образца при длине волны 450 нм и 510 нм в соответствии с инструкцией производителя.
С целью получения референтных значений исследуемых параметров в исследование была включена контрольная группа здоровых доноров-добровольцев — мужчин (15 человек в возрасте 25-40 лет), у которых однократно оценивалось содержание ММП-1, ММП-9, TИМП-1, ТИМП-4 в сыворотке крови.
Статистический анализ результатов исследования выполнен с использованием Statistica 6,0. Характер распределения выборки оценивался по критерию Шапиро-Уилка. Данные, отличные от нормального распределения, представлены в виде медианы — Me и интерквартального интервала Q25; Q75. При статистической обработке использовались методы непараметрической статистики. Достоверность различий между количественными признаками в сравниваемых выборках оценивались по критерию Манна-Уитни, использовали ранговый дисперсионный анализ по Фридмену (Friedman ANOVA — сравнение непараметрических параметров ≥3 групп — апостериорный анализ), критерий Вилкоксона (для парного сравнения групп) с учетом поправки Бонферрони. Уровнем критической значимости (р) считали значения <0,05.
Исследование соответствовало принципам Хельсинкской декларации; одобрено региональным Этическим комитетом при ФГБОУ ВО "Курский государственный медицинский университет" Минздрава России (протокол № 40 от 07.12.2017); все пациенты подписывали информированное согласие.
Результаты
Оценка исходного содержания в крови металлопротеиназ (таблица 1) показала, что концентрация ММП-1 во всех исследуемых группах была выше референтных значений у здоровых лиц (в соответствии с инструкцией производителя) и концентрации, определеной в крови здоровых доноров контрольной группы — 12,8 [ 10,1; 16,2] нг/мл (p<0,05). Содержание ММП-9 во всех исследуемых группах также было выше референтных значений (в соответствии с инструкцией производителя) и здоровых доноров контрольной группы — 134,7 [ 121,4; 143,2] нг/мл (p<0,05).
Таблица 1
Содержание ММП-1, ММП-9 в сыворотке крови больных высокого CCР
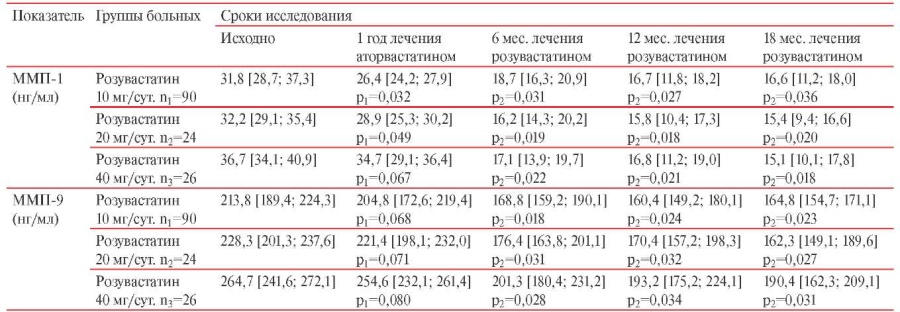
Примечание: р1 — достоверность различий между исходными значениями и полученными на фоне 12 мес. терапии аторвастатином, р2 — достоверность различий результатов после 12 мес. лечения аторвастатином и указанными сроками терапии розувастатином.
У включенных в исследование больных исходный уровень как ТИМП-1, так и ТИМП-4 был выше, чем у здоровых лиц контрольной группы — 413,2 [ 401,1; 434,6] нг/мл (p<0,05); 175,8 [ 162,4; 183,6] нг/мл (p<0,05), соответственно (таблица 2).
Таблица 2
Содержание ТИМП-1, ТИМП-4 в сыворотке крови больных высокого ССР
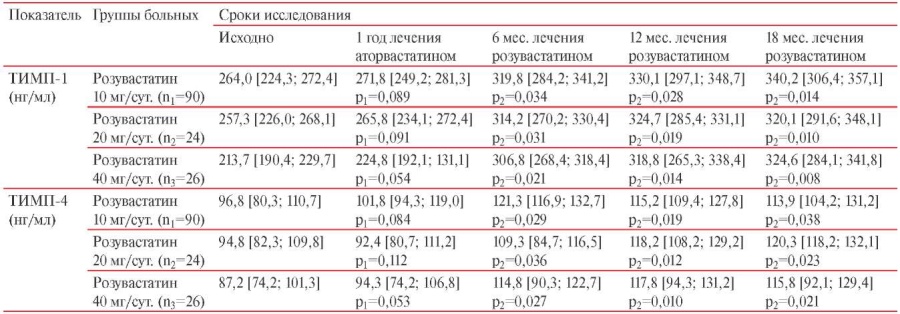
Примечание: р1 — достоверность различий между исходными значениями и полученными на фоне 12 мес. терапии аторвастатином, р2 — достоверность различий результатов после 12 мес. лечения аторвастатином и указанными сроками терапии розувастатином.
При этом достоверных различий по содержанию в крови ММП-1, ММП-9 между группами не выявлено, за исключением группы, в которой для достижения целевого уровня ХС ЛНП потребовалось применять розувастатин в дозе 40 мг/сут., величина ММП-9 в этой группе была выше, чем в остальных группах (p<0,05). В этой же группе отмечено и более низкое содержание ТИМП-1 (p<0,05).
Анализ изменений содержания ММП-1 в результате терапии аторвастатином (таблица 1, рисунок 1) показал, что наибольшее снижение концентрации ММП-1 (на 15,1%) наблюдалось только у больных первой группы, получавших впоследствии розувастатин в дозе 10 мг/сут., в других группах изменение содержания ММП-1 незначительное: у больных второй группы, получавших впоследствии розувастатин в дозе 20 мг/сут. — на 7,4%; у больных третьей группы, получавших впоследствии розувастатин в дозе 40 мг/сут. достоверных изменений не зафиксировано.
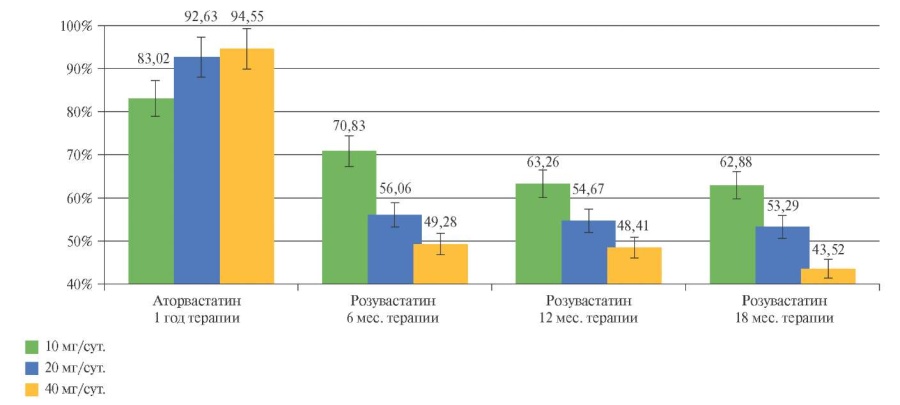
Рис. 1 Содержание ММП-1 в сыворотке крови больных АГ высокого риска на фоне терапии аторвастатином и розувастатином в различных дозовых режимах. Исходный уровень параметра принят за 100%.
Замена аторвастатина на розувастатин в течение 6 мес. сопровождалась (здесь и далее: в сравнении с исходным уровнем исследуемого параметра) снижением концентрации ММП-1 при приеме розувастатина в дозе 10 мг/сут. на 41,2%, в дозе 20 мг/сут. — на 49,7%, в дозе 40 мг/сут. — на 53,4% (p<0,05 в сравнении с уровнем после приема аторвастатина). Терапия розувастатином в дозе 10 мг/сут. в течение 12 мес. сопровождалась дальнейшим снижением концентрации ММП-1 на 47,5%, к 18 мес. — сохранялась на достигнутом уровне. Применение розувастатина в дозе 20 мг/сут. в течение 12 и 18 мес. не приводило к дальнейшему снижению ММП-1, ее концентрация сохранялась на достигнутом уровне (p<0,05 в сравнении с уровнем после приема аторвастатина). В группе пациентов, получавших терапию розувастатином 40 мг/сут. в течение 12 и 18 мес., содержание ММП-1 фактически сохранялось на достигнутом уровне и составляло 54,3 и 58,8% от исходного уровня, соответственно (p<0,05).
Обращает на себя внимание, что в первые 6 мес. терапии отмечались дозозависимые различия в степени динамики ММП-1: прием розувастатина 10 мг/сут. приводил к меньшему приросту содержания ММП-1, чем 20 или 40 мг/сут. (р<0,05), хотя различий в эффективности между последними дозами не выявлено (p>0,05).
Анализ динамики содержания ММП-9 показал (таблица 1, рисунок 2), что на фоне терапии аторвастатином в любом из дозовых режимов отсутствуют изменения со стороны указанного параметра. При приеме розувастатина в различных дозовых режимах (10 мг/сут., 20 мг/сут., 40 мг/сут.) отмечалось снижение концентрации ММП-9 к 6 мес. — на 21,1; 22,7 и 23,9%, соответственно; к 12 мес. — на 25,0; 25,4 и 28,0%; к 18 мес. — на 22,9; 28,9 и 28,1%, соответственно (p<0,05 в сравнении с уровнем после приема аторвастатина).
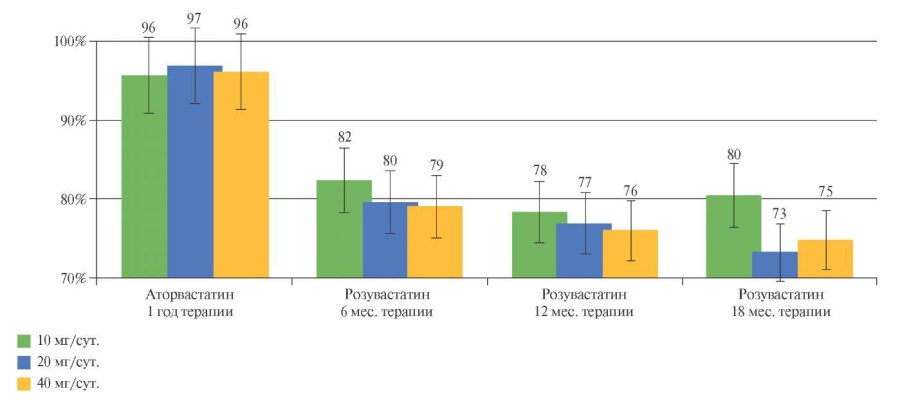
Рис. 2 Содержание ММП-9 в сыворотке крови больных АГ высокого риска на фоне терапии аторвастатином и розувастатином в различных дозовых режимах. Исходный уровень параметра принят за 100%.
Анализ динамики содержания TИМП-1 показал (таблица 2, рисунки 3 и 4), что на фоне терапии аторвастатином в каждой из трех групп отсутствуют достоверные изменения со стороны указанного параметра (р>0,05). В группе пациентов, в дальнейшем принимавших розувастин 10 мг/сут., к 6 мес. терапии отмечалось повышение TИМП-1 на 21,1%, к 12 мес. — на 25,0%, к 18 мес. — на 28,9% (p<0,05). В группе пациентов, принимавших розувастин 20 мг/сут., к 6 мес. терапии отмечалось повышение TИМП-1 на 22,1%, к 12 мес. — на 26,2%, к 18 мес. — на 24,4%. При приеме розувастатина 40 мг/сут., к 6 мес. терапии отмечалось повышение TИМП-1 на 43,6%, к 12 мес. — на 49,2%, к 18 мес. — на 51,9%. Обращает на себя внимание, что наибольшее повышение содержания TИМП-1 наблюдалось в группе пациентов, принимавших розувастатин в дозе 40 мг/сут. (p<0,05). Различий в эффективности розувастатина в дозах 10 и 20 мг/сут. не отмечено (p<0,05).
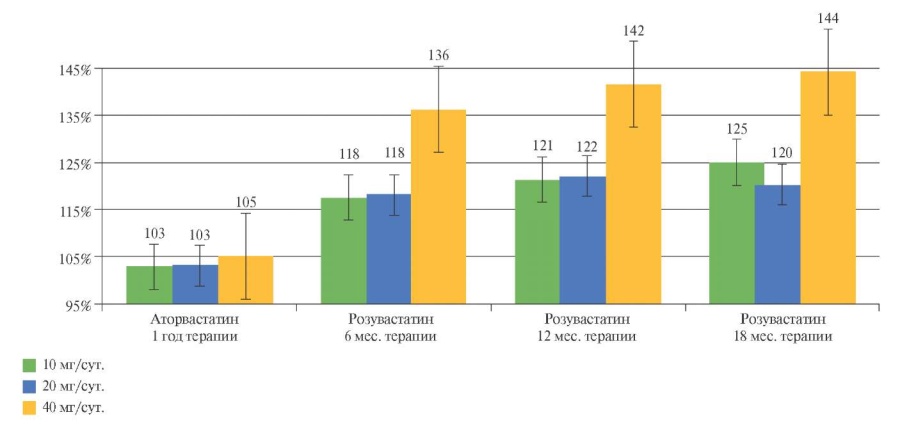
Рис. 3 Содержание ТИМП-1 в сыворотке крови больных АГ высокого и очень высокого ССР на фоне терапии аторвастатином и розувастатином в различных дозовых режимах. Исходный уровень параметра принят за 100%.
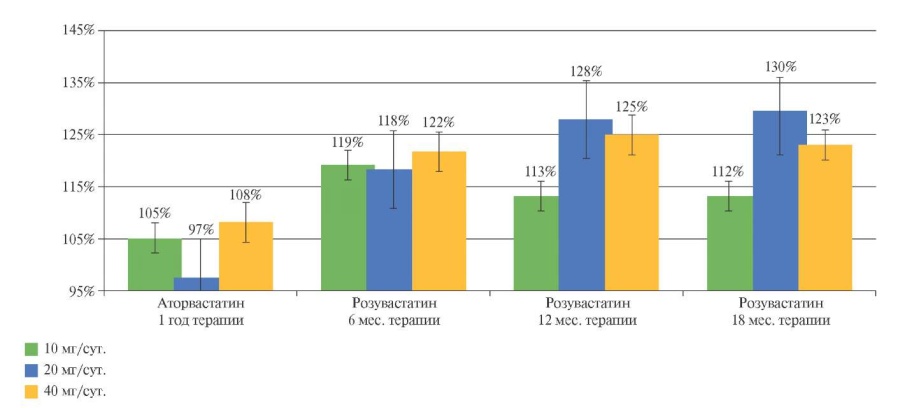
Рис. 4 Содержание ТИМП-4 в сыворотке крови больных АГ высокого и очень высокого ССР на фоне терапии аторвастатином и розувастатином в различных дозовых режимах. Исходный уровень параметра принят за 100%.
При анализе динамики концентрации TИМП-4 на фоне терапии аторвастатином в каждой из трех групп (таблица 2, рисунки 3 и 4) отмечалось отсутствие достоверных изменений со стороны указанного параметра (р>0,05). В группе пациентов, принимавших розувастин 10 мг/сут., к 6 мес. терапии отмечалось повышение содержания TИМП-4 на 25,3%, к 12 мес. — на 19,0%, к 18 мес. — на 17,7%. В группе пациентов, принимавших розувастин 20 мг/сут., к 6 мес. терапии отмечалось повышение TИМП-9 на 15,3%, к 12 мес. — на 24,7%, к 18 мес. — на 26,9%. При приеме розувастатина 40 мг/сут., к 6 мес. терапии отмечалось повышение TИМП-9 на 31,7%, к 12 мес. — на 35,1%, к 18 мес. — на 32,8% (p<0,05).
При замене аторвастатина на розувастатин уже к 6 мес. терапии наблюдалось достоверное повышение содержания TИМП-9. При этом на фоне терапии розувастатином в дозах 20 и 40 мг/сут. отмечалась более выраженная динамика ТИМП-9 к 12 и 18 мес. терапии (р<0,05). Значимых различий по влиянию на концентрацию ТИМП-9 между средними и высокими дозами розувастатина не обнаружено (р>0,05).
Обсуждение
Полученные результаты свидетельствуют о повышенном содержании (в отличие от здоровых людей) ММП-1 и ММП-9 и низкой концентрации ТИМП-1 и ТИМП-4 в крови больных АГ с высоким ССР. Длительное применение розувастатина (10 мг/сут.; 20 мг/сут.; 40 мг/сут.) в составе комплексной терапии больных АГ с высоким ССР влияет на параметры метаболизма эластина и коллагена сосудистой стенки, уменьшая уровень ММП1, ММП-9 и увеличивая содержание ТИМП-1, ТИМП-4, что согласуется с имеющимися на сегодняшний день данными, в частности, о повышении ММП-2 и ММП-9 при АГ [24][25] и увеличении в крови ММП-2 и ММП-9 у животных при экспериментальных моделях гипертензии [26][27]. Такие изменения ассоциируются с развитием гипертонической ангиопатии, за счет нарушения протеолиза коллагена IV типа, инициирующего процессы миграции и инфильтрации сосудистого эндотелия с формированием атеросклеротического поражения, увеличением жесткости артериального русла [25][28][29]. Повышение уровня ММП-9 в клинической практике было отмечено при гипертоническом кризе [30].
Полученные в результате настоящего исследования данные свидетельствуют о неоднозначном влиянии статинов на уровень исследуемых ММП у пациентов с АГ и высоким ССР: аторвастатин (10 мг/сут.) фактически не влияет на содержание ММП-1, ММП-9 и уровень ТИМП-1 и ТИМП-4 в отличие от розувастатина, позитивное воздействие которого на процессы метаболизма коллагена было продемонстрировано в исследовании.
Таким образом, больные, у которых целевой уровень ХС ЛНП был достигнут применением розувастатина в дозе 40 мг/сут. имели более выраженное снижение ММП-1, чем при лечении розувастатином в дозах 10 и 20 мг/сут. (p<0,05), при этом дозовых различий при лечении малыми и средними дозами не наблюдалось. При лечении аторвастатином не происходило существенных изменений концентрации ММП-1.
Розувастатин оказывал менее выраженное влияние на ММП-9, чем на ММП-1, при этом повышение дозы розувастатина не влияло на характер и интенсивность снижения ММП-9 (p<0,05).
Заключение
Больные АГ с высоким ССР характеризуются, в сравнении со здоровыми лицами, более высоким содержанием в крови ММП-1, ММП-9 и низкой концентрацией ТИМП-1 и ТИМП-4.
Применение аторвастатина (20 мг/сут. в течение 12 мес.) у больных АГ с высоким ССР не оказывают существенного влияния на содержание ММП1, ММП-9, ТИМП-1, ТИМП-4.
Длительная терапия розувастатином больных АГ с высоким ССР сопровождается снижением в крови уровня ММП-1, ММП-9, повышением ТИМП-1 и ТИМП-4. Позитивная зависимость изменения исследуемых параметров от дозы розувастатина отмечена лишь в отношении ММП-1, ТИМП-1, ТИМП-4 при приеме розувастатина 40 мг/сут.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Бойцов С.А., Баланова Ю.А., Шальнова С.А. и др. от имени участников исследования ЭССЕ-РФ. Артериальная гипертония среди лиц 25-64 лет: распространенность, осведомленность, лечение и контроль. По материалам исследования ЭССЕ. Кардиоваскулярная терапия и профилактика. 2014;13(4):4-14. doi:10.15829/1728-8800-2014-4-4-14.
2. Кобалава Ж. Д., Конради А. О., Недогода С. В. и др. Артериальная гипертензия у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(3):3786. doi:10.15829/1560-4071-2020-3-3786.
3. Портнова Е.В. Анализ поражения органов-мишений у пациентов с гипертонической болезнью и суправентрикулярными нарушениями ритма на фоне когнитивных нарушений. Фундаментальные исследования. 2013;9(3):448-52.
4. Осадчук М. А., Солоденков К. С. Медиаторы воспаления: роль в развитии сосудистых поражений и оценке кардиоваскулярного риска. Кардиология и сердечно-сосудистая хирургия. 2016;9(4):63-72. doi:10.17116/kardio20169463-72.
5. Остроумова О. Д., Кочетков А. И., Копченов И. И. и др. Жесткость сосудистой стенки у пациентов с артериальной гипертонией. Системные гипертензии. 2015;12(2):43-8. doi:10.26442/SG29073.
6. Фатенков О.В., Симерзин В.В., Гаглоева И.В. и др. Эндотелиальная дисфункция как предиктор субклинического и манифестного атеросклероза. Наука и инновации в медицине. 2018;3(3):39-46. doi:10.35693/2500-1388-2018-0-3-39-46.
7. Кац Я.А., Пархонюк Е.В., Акимова Н. С. Жесткость сосудистой стенки с позиции повреждения соединительной ткани при сердечно-сосудистых заболеваниях. Фундаментальные исследования. 2013;5(3):189-95.
8. Колпакова А.Ф. Нарушение эластических свойств артерий и функции эндотелия: современные способы коррекции и профилактики. Кардиоваскулярная терапия и профилактика. 2015;14(3):75-81. doi:10.15829/1728-8800-2015-3-75-81.
9. Голиков А. П., Бойцов С.А., Михин В. П. и др. Свободнорадикальное окисление и сердечно-сосудистая патология: коррекция антиоксидантами. Лечащий врач. 2003;4:1-5.
10. Шевченко О. П., Шевченко А. О. Ангиотензин II и инфаркт миокарда. Рациональная Фармакотерапия в Кардиологии. 2008;4(3):105-10. doi:10.20996/1819-6446-2008-4-3-105-110.
11. Барсуков А. В., Корнейчук Н. Н., Шустов С.Б. Высокорениновые артериальные гипертензии: от симптома к диагнозу. Вестник СевероЗападного государственного медицинского университета имени И. И. Мечникова. 2017;9(2):7-18. doi:10.17816/mechnikov2017927-18.
12. Михин В. П., Жиляева Ю. А., Воротынцева В.В. и др. Гиполипидемическая и плейотропная эффективность розувастатина у больных артериальной гипертонией с высоким сердечно-сосудистым риском в условиях длительного амбулаторного наблюдения. Российский кардиологический журнал. 2016;(12):90-6. doi:10.15829/1560-4071-2016-12-90-96.
13. Михин В. П., Жиляева Ю.А., Чернятина М.А. и др. Гиполипидемическая и плейотропная эффективность дженерических статинов у пациентов высокого сердечно-сосудистого риска в амбулаторной практике. Русский медицинский журнал. 2016;19:1263-70. doi:10.15829/1560-4071-2016-12-90-96.
14. Окуневич В. И. Гиполипидемическая терапия дислипопротеидемий статинами: их роль в комплексном лечении атеросклероза. Обзоры по клинической фармакологии лекарственной терапии. 2004;3(4):2-14. doi:10.17816/RCF193291-301.
15. Яковенко Е.И., Мамедов М.Н. Влияние метаболических эффектов статинов на клинические проявления атеросклероза. Российский кардиологический журнал. 2012;2:85-90.
16. Драпкина О.М., Палаткина Л.О., Зятенкова Е.В. Плейотропные эффекты статинов. Влияние на жесткость сосудов. Врач. 2012;9:5-9.
17. Семенова А. Е., Сергиенко И.В. Место питавастатина в лечении и профилактике сердечно-сосудистых заболеваний. Атеросклероз и дислипидемии. 2017;3:33-45.
18. Драпкина О.М., Гегенава Б.Б. Статины и углеводный обмен. Эффективная фармакотерапия. 2015;32:24-31.
19. Бубнова М. Г. Нежелательные эффекты терапии статинами: реальные доказательства. Кардиосоматика. 2019;10(1):51-61.
20. Ceron CS, Luizon MR. Plasma matrix metalloproteinases in coronary artery disease patients. Eur J Clinical Investigation. 2016;46(1):104-5. doi:10.1111/eci.12537.
21. Прудников А. Р., Щупакова А. Н. Матриксные металлопротеиназы: роль в развитии постинфарктного ремоделирования миокарда. Регионарное кровообращение и микроциркуляция. 2018;17(1):13-24. doi:10.24884/1682-6655-2018-17-1-13-24.
22. Григоркевич О. С., Мокров Г.В., Косова Л.Ю. Матриксные металлопротеиназы и их ингибиторы. Фармакокинетика и Фармакодинамика. 2019;(2):3-16. doi:10.24411/2587-7836-2019-10040.
23. Ежов М. В., Сергиенко И. В., Аронов Д.М. и др. Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Атеросклероз и дислипидемии. 2017;3(28):5-22.
24. Ahmed SH, Clark LL, Pennington WR, et al. Matrix metalloproteinases/tissue inhibitors of metalloproteinases: relationship between changes in proteolytic determinants of matrix composition and structural, functional, and clinical manifestations of hypertensive heart disease. Circulation. 2006;113(17):2089-96. doi:10.1161/CIRCULATIONAHA.105.573865.
25. Yasmin, McEniery CM, Wallace S, et al. Matrix metalloproteinase-9 (MMP-9), MMP-2, and serum elastase activity are associated with systolic hypertension and arterial stiffness. Arterioscler Thromb Vasc Biol. 2005;25(2):372. doi:10.1161/01.ATV.0000151373.33830.41.
26. Castro MM, Rizzi E, Figueiredo-Lopes L, et al. Metalloproteinase inhibition ameliorates hypertension and prevents vascular dysfunction and remodeling in renovascular hypertensive rats. Atherosclerosis. 2008;198(2):320-31. doi:10.1016/j.atherosclerosis.2007.10.011.
27. Flamant M, Placier S, Dubroca C, et al. Role of matrix metalloproteinases in early hypertensive vascular remodeling. Hypertension. 2007;50(1):212-8. doi:10.1161/HYPERTENSIONAHA.107.089631.
28. Sluijter JP, de Kleijn DP, Pasterkamp G. Vascular remodeling and protease inhibition — bench to bedside. Cardiovasc Res. 2006;69(3):595-603. doi:10.1016/j.cardiores.2005.11.026.
29. Basalyga DM, Simionescu DT, Xiong W, et al. Elastin degradation and calcification in an abdominal aorta injury model: role of matrix metalloproteinases. Circulation. 2004;110(22):3480-7. doi:10.1161/01.CIR.0000148367.08413.E9.
30. Valente FM, de Andrade DO, Cosenso-Martin LN, et al. Plasma levels of matrix metalloproteinase-9 are elevated in individuals with hypertensive crisis. BMC Cardiovasc Disord. 2020;20(1):132. doi:10.1186/s12872-020-01412-5.
Об авторах
В. П. МихинРоссия
Вадим Петрович Михин — доктор медицинских наук, профессор, заведующий кафедрой внутренних болезней № 2.
Курск
О. А. Осипова
Россия
Ольга Александровна Осипова — доктор медицинских наук, профессор, заведующий кафедрой госпитальной терапии Медицинского института.
Белгород
В. В. Воротынцева
Россия
Валерия Вадимовна Воротынцева — врач-терапевт.
Курск
Д. Н. Перуцкий
Россия
Дмитрий Николаевич Перуцкий — доцент кафедры госпитальной терапии Медицинского института.
Белгород
Н. И. Головина
Россия
Наталья Ивановна Головина — аспирант кафедры госпитальной терапии Медицинского института.
Белгород
Дополнительные файлы
Рецензия
Для цитирования:
Михин В.П., Осипова О.А., Воротынцева В.В., Перуцкий Д.Н., Головина Н.И. Содержание матриксных металлопротеиназ в крови больных артериальной гипертонией с высоким сердечно-сосудистым риском на фоне терапии статинами. Кардиоваскулярная терапия и профилактика. 2022;21(10):3422. https://doi.org/10.15829/1728-8800-2022-3422
For citation:
Mikhin V.P., Osipova O.A., Vorotyntseva V.V., Perutsky D.N., Golovina N.I. Content of matrix metalloproteinases in the blood of hypertensive patients with a high cardiovascular risk receiving statin therapy. Cardiovascular Therapy and Prevention. 2022;21(10):3422. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3422
JATS XML

























































