Перейти к:
Реактогенность различных схем вакцинации против COVID-19
https://doi.org/10.15829/1728-8800-2022-3476
Аннотация
В период распространения все большего количества новых штаммов SARS-CoV-2 (Severe Acute Respiratory Syndrome CoronaVirus 2, коронавирус 2, вызывающий тяжелый острый респираторный дистресс-синдром) крайне важна не только оценка иммуногенности и эффективности, но и безопасности различных комбинаций вакцин против вируса SARS-CoV-2. В результате применения вакцин ожидаемо с различной частотой могут возникать чрезмерные иммунологические реакции и связанные с ними признаки и симптомы.
Цель. Сравнительная оценка реактогенности различных (гетерологичных и гомологичных) схем вакцинации против COVID-19 (COronaVIrus Disease 2019, новая коронавирусная инфекция) в рамках проспективного наблюдательного исследования.
Материал и методы. У лиц в возрасте ≥18 лет при отсутствии противопоказаний к вакцинации использовали два вида вакцин при первичной вакцинации и ревакцинации: Гам-КОВИД-Вак и КовиВак: группа I (n=97) — Гам-КОВИД-Вак на каждом этапе первичной и повторной вакцинации; группа II (n=7) — ГамКОВИД-Вак на каждом этапе первичной вакцинации, КовиВак на каждом этапе повторной вакцинации; группа III (n=42) — КовиВак на каждом этапе первичной вакцинации, Гам-КОВИДВак на каждом этапе повторной вакцинации; группа IV (n=38) — КовиВак на каждом этапе первичной и повторной вакцинации. Всем участникам в динамике определяли уровень IgG к рецепторсвязывающему домену поверхностного гликопротеина S (spike) коронавируса SARS-CoV-2 и Т-клеточный иммунитет (Т-СПОТ) к SARS-CoV-2. Для контроля состояния плазменного гемостаза использовали метод динамической тромбофотометрии (воссоздание пространственного процесса образования сгустка от стенки сосуда). Оценивали локальные и системные нежелательные явления.
Результаты. Количество вакцинированных лиц с наличием повышения температуры тела выше 370 С после 1 этапа ревакцинации было значимо (p<0,05) больше в группе I — 37,5% и группе II — 57,1% по сравнению с вакцинированными лицами, относящимися к IV группе. При этом после 2 этапа ревакцинации в целом отмечен меньший процент вакцинированных с наличием гипертермии. В I группе вакцинированных отмечен больший процент лиц (22,9%), жалующихся на появление слабости после I этапа ревакцинации по сравнению с вакцинированными лицами IV группы — 5,2%. Отмечено увеличение скорости роста фибринового сгустка в III группе на этапе ревакцинации.
Заключение. Применение различных схем ревакцинации (гомологичных и гетерологичных) не было сопряжено с развитием серьезных нежелательных явлений. Возникшие локальные и системные реакции были кратковременны, и не потребовали госпитализации. Отмечены более выраженные системные реакции в виде кратковременного повышения температуры и появления слабости при использовании вакцины Гам-КОВИД-Вак. За время наблюдения случаев артериального или венозного тромбоза зарегистрировано не было.
Для цитирования:
Драпкина О.М., Бернс С.А., Горшков А.Ю., Рыжакова Л.Н., Жданова О.В., Чащин М.Г., Литинская О.А. Реактогенность различных схем вакцинации против COVID-19. Кардиоваскулярная терапия и профилактика. 2022;21(12):3476. https://doi.org/10.15829/1728-8800-2022-3476
For citation:
Drapkina O.M., Berns S.A., Gorshkov A.Yu., Ryzhakova L.N., Zhdanova O.V., Chaschin M.G., Litinskaya O.A. Reactogenicity of various COVID-19 vaccination regimens. Cardiovascular Therapy and Prevention. 2022;21(12):3476. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3476
Введение
Всемирная организация здравоохранения (ВОЗ) 11.02.2020г присвоила официальное название инфекции, вызванной новым коронавирусом, — коронавирусная болезнь 2019 (Coronavirus disease 2019, COVID-19). Международный комитет по таксономии вирусов 11.02.2020г озвучил официальное название возбудителя инфекции — коронавирус 2 тяжелого острого респираторного синдрома (Severe Acute Respiratory Syndrome-related CoronaVirus 2, SARS-CoV-2). 11.03.2020г ВОЗ объявила о начале пандемии COVID-191. Пандемия коронавирусной инфекции, вызванной вирусом SARS-CoV-2 (COVID-19), продолжается уже >2 лет, и по состоянию на 28.10.2022г было зарегистрировано >620 млн подтвержденных случаев заболевания COVID-192.
Единственным способом специфической профилактики коронавирусной инфекции служит вакцинация против вируса SARS-CoV-2. В настоящее время в Российской Федерации зарегистрированы следующие вакцины против COVID-19: векторные, вакцины на основе пептидных антигенов ("ЭпиВакКорона", "АВРОРА-КоВ"), вакцина коронавирусная инактивированная цельновирионная ("КовиВак") и вакцина субъединичная рекомбинантная ("Конвасэл")1.
Первой в мире зарегистрированной вакциной для профилактики COVID-19 стала векторная вакцина "Гам-КОВИД-Вак", и в настоящее время в России наиболее многочисленная группа вакцин относится именно к векторным вакцинам — "ГамКОВИД-Вак-Лио", "Спутник Лайт", "Гам-КОВИДВак-М", "Гам-КОВИД-Вак" — капли назальные, "Салнавак" — капли назальные.
Накопленный опыт вакцинальной кампании демонстрирует, что преодоление таких проблем, как снижение эффективности вакцин в отношении новых вариантов вируса, а также прогрессирующее уменьшение поствакцинального иммунитета с течением времени, возможно благодаря бустерной вакцинации (ревакцинации) [1]. В период распространения все большего количества новых штаммов SARS-CoV-2 крайне важна не только оценка иммуногенности и эффективности различных комбинаций вакцин, но и их безопасности. В результате применения вакцин ожидаемо с различной частотой могут возникать чрезмерные иммунологические реакции и связанные с ними признаки и симптомы, включая лихорадку и боль в руке в месте инъекции. Способность вакцины вызывать такого рода реакции носит название реактогенности. В то же время общественность продолжает беспокоить риск развития поствакцинальных осложнений, возможно связанных с гипериммунным ответом, в частности тромботических осложнений. Так, периодически появляются сообщения о повышенном риске тромбообразования среди вакцинированных против COVID-19. В то же время, группа экспертов из Великобритании, Норвегии и Германии опубликовала данные о состоянии, которое предложено называть "вакциноиндуцированной иммунной тромботической тромбоцитопенией" [2].
В настоящее время существуют два основных режима бустерной вакцинации: гомологичный, при котором первичную и повторную вакцинацию проводят вакцинами одного типа, и гетерологичный, когда вакцинацию выполняют вакцинами разных типов с различающимся механизмом действия3.
Цель исследования — в рамках проспективного наблюдательного исследования сравнительная оценка реактогенности различных (гетерологичных и гомологичных) схем ревакцинации против COVID-19.
Материал и методы
Представленная работа демонстрирует результаты продолжающегося в настоящее время на базе ФГБУ "Национальный медицинский исследовательский центр терапии и профилактической медицины" Минздрава России исследования САТУРН (Сравнительная оценкА реактогенносТи и иммУногенности гетеРологичных схем вакциНации против COVID-19); государственное задание № 122013100211-8. Использовались два вида вакцин при первичной вакцинации и ревакцинации: ГамКОВИД-Вак и КовиВак.
КовиВак — вакцина против COVID-19 на основе инактивированного вируса — содержит антиген инактивированного коронавируса SARS-CoV-2 (штамм AYDAR-1, инактивирован β-пропиолактоном).
Гам-КОВИД-Вак состоит из двух компонентов (двух векторов). Компонент 1 содержит рекомбинантные аденовирусные частицы 26 серотипа, в которых содержится ген белка S вируса SARS-CoV-2. Компонент 2 — аденовирусные рекомбинантные частицы 5 серотипа, которые содержат ген белка S вируса SARS-CoV-24.
Критерии включения: возраст ≥18; отсутствие противопоказаний к вакцинации; проживание в Москве и Московской области; подписание информированного согласия.
Критерии исключения/невключения: наличие противопоказаний к вакцинации; перенесенная ранее новая коронавирусная инфекция; предшествовавшая вакцинация против вируса SARS-CoV-2; отказ от участия в исследовании.
В данном исследовании запланировано проведение пяти визитов: Визит 1 (исходный — I этап первичной вакцинации), Визит 2 (14/21 день — II этап первичной вакцинации), Визит 3 (I этап ревакцинации — через 6 мес. после введения первого компонента при первичной вакцинации), Визит 4 (II этап ревакцинации), Визит 5 — через 12 мес. после I этапа первичной вакцинации.
Исследуемые группы вакцинированных лиц:
Группа I (n=97) — введение Гам-КОВИД-Вак на каждом этапе первичной и повторной вакцинации;
Группа II (n=7) — Гам-КОВИД-Вак на каждом этапе первичной вакцинации, КовиВак на каждом этапе повторной вакцинации;
Группа III (n=42) — КовиВак на каждом этапе первичной вакцинации, Гам-КОВИД-Вак на каждом этапе повторной вакцинации;
Группа IV (n=38) — введение КовиВак на каждом этапе первичной и повторной вакцинации.
На Визите 1 проводили получение письменного Информированного согласия, сбор анамнеза. Кроме того, на всех визитах запланирован сбор жалоб и объективный осмотр всех участников, забор крови для проведения биобанкирования, иммунологического анализа: определение уровня специфических антител к гликопротеину SARS-CoV-2 IgG; определение уровня специфических антител к гликопротеину SARS-CoV-2 IgM (качественный); определение уровня IgG к рецептор-связывающему домену поверхностного гликопротеина S (spike) коронавируса SARS-CoV-2); измерение температуры тела. Кроме того, на Визитах 1, 3 и 5 осуществляли забор крови для определения Т-клеточного иммунитета (Т-СПОТ) к SARS-CoV-2.
На каждом Визите помимо рутинной коагулограммы для контроля состояния плазменного гемостаза использовали метод динамической тромбофотометрии (воссоздание пространственного процесса образования сгустка от стенки сосуда). С этой целью применяли диагностическую лабораторную систему "Регистратор тромбодинамики Т-2" (ГемаКор, Россия). Оценивали такие параметры пространственно-временнóй динамики роста фибринового сгустка, как: задержка роста сгустка (Tlag), скорость роста сгустка (V), начальная (Vi) и стационарная скорости роста (Vst), размер сгустка через 30 мин (CS), а также плотность сгустка (D) и время появления спонтанных сгустков (Tsp) [3].
Все участники исследования имели возможность выбрать, какой вакциной прививаться. В данной работе обсуждаются результаты, полученные на Визитах 3 и 4 и последующем 2-месячном наблюдении за участниками исследования.
Проводили оценку следующих параметров безопасности: общая частота всех нежелательных явлений (НЯ); частота локальных поствакцинальных реакций в месте введения препарата (в течение 7 дней после первичной и повторной вакцинации: эритема в месте инъекции; болезненность; отек; увеличение регионарных лимфатических узлов; уплотнение в месте инъекции; зуд в месте инъекции); частота системных поствакцинальных реакций (в течение 7 дней после первичной и повторной вакцинации: повышение температуры тела, в т.ч. оценка выраженности лихорадки; озноб; ухудшение общего самочувствия, недомогание; головная боль; головокружение; снижение аппетита; бессонница; тошнота, рвота, диспепсия; диарея; боль в теле или мышечная слабость; потливость; боли в суставах; боль в животе; судороги; миалгия; увеличение регионарных лимфатических узлов; изменения со стороны слизистых оболочек); частота локальных поствакцинальных реакций в месте введения препарата в течение 21 дня после первичной и повторной вакцинации; частота системных поствакцинальных реакций в течение 42 дней после первичной вакцинации; частота токсических поствакцинальных осложнений (септические состояния, генерализованная инфекция); частота аллергических поствакцинальных осложнений (полиморфная сыпь, отек Квинке, артралгия, анафилактический шок); частота неврологических поствакцинальных осложнений (энцефалит, неврит, полиневрит).
Проведение данного исследования осуществлялось в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации "Этические принципы проведения медицинских исследований с участием человека в качестве субъекта исследования" от 1964г с последующими изменениями и дополнениями; Правилами надлежащей клинической практики Евразийского Экономического Союза (утверждены Решением Совета Евразийской экономической комиссии от 03.11.2016г № 79); Приказом Минздрава РФ от 01.04.2016г № 200н "Об утверждении Правил надлежащей клинической практики"; Федеральным законом Российской Федерации от 12.04.2010г № 61-ФЗ "Об обращении лекарственных средств" (в текущей редакции), а также руководящими документами ICH, в т.ч. руководством E6 Good Clinical Practice (ICH E6 GCP). Перед включением в исследование субъекту предоставлялась письменная информация и устное разъяснение о целях, задачах и методах проведения исследования, а также об ожидаемой пользе и возможном риске, связанными с участием в исследовании. Кроме того, субъекты были поставлены в известность о добровольном характере участия в исследовании и о том, что субъект имеет право отказаться от участия в исследовании в любой момент, и что этот отказ не повлияет на качество предоставляемой ему медицинской помощи.
В общей группе вакцинированных отмечено практически одинаковое количество мужчин и женщин — 91 (51%) и 93 (49%), соответственно. Распределение по возрасту показало наибольший процент лиц молодого (48%) и среднего возраста (36%). Лица пожилого возраста составили 12%, старческого — 4%, средний возраст — 45 [37-54] лет. У 39% вакцинированных лиц отмечена избыточная масса тела и у 23% — ожирение, курили 18% вакцинированных. Патология органов дыхания имела место у 8%, органов пищеварения — у 21%, сердечно-сосудистой системы — у 29% вакцинированных лиц.
Клиническая характеристика участников исследования, получавших различные схемы ревакцинации против вируса SARS-CoV-2, представлена в таблице 1. Исследуемые группы статистически значимо не различались по таким представленным параметрам, как пол, возраст, индекс массы тела.
Для статистической обработки результатов применяли программы IBM SPSS v. 24 и MedCalc v. 20.104. Переменные представлены в виде медианы (Me) и интерквартильного размаха (Q25; Q75), для долей и частот данные представлены в процентах. Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро-Уилка. Для сравнения количественных переменных в двух группах использовался критерий U-Манна-Уитни, в трех и более группах — критерий Краскела-Уоллиса. Качественные переменные сравнивались с помощью критерия χ2. Для анализа повторных измерений, связанных с одним и тем же индивидуумом, использовался критерий Фридмана. Уровень значимости различий считался достоверным при p<0,05.
Результаты
В таблице 2 представлено количество вакцинированных лиц с наличием/отсутствием гипертермии на I и II этапах ревакцинации против вируса SARS-CoV-2. Продемонстрировано, что количество вакцинированных лиц с наличием повышения температуры тела >37 С после I этапа ревакцинации было значимо (p<0,05) больше в группе I (введение Гам-КОВИД-Вак на каждом этапе первичной и повторной вакцинации) — 37,5% и группе II (ГамКОВИД-Вак на каждом этапе первичной вакцинации, КовиВак на каждом этапе повторной вакцинации) — 57,1% по сравнению с вакцинированными лицами, относящимися к IV группе (введение КовиВак на каждом этапе первичной и повторной вакцинации). При этом после II этапа ревакцинации в целом отмечен меньший процент вакцинированных с наличием гипертермии. Достоверных различий между исследуемыми группами не было.
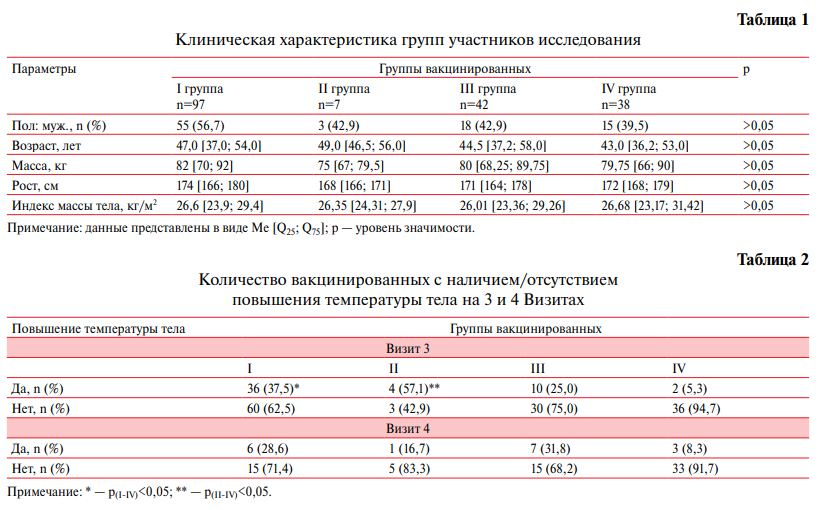
При оценке количества вакцинированных лиц с наличием локальных реакций в месте инъекции вакцины достоверных различий между исследуемыми группами не получено.
В исследуемых группах вакцинированных лиц после I и II этапа ревакцинации был проведен анализ НЯ (таблица 3). Выявлены значимые (p<0,05) различия лишь в I группе вакцинированных (введение Гам-КОВИД-Вак на каждом этапе первичной и повторной вакцинации), в которой отмечена более высокая доля лиц (22,9%), жалующихся на появление слабости после I этапа ревакцинации по сравнению с вакцинированными лицами IV группы (введение КовиВак на каждом этапе первичной и повторной вакцинации) — 5,2%.
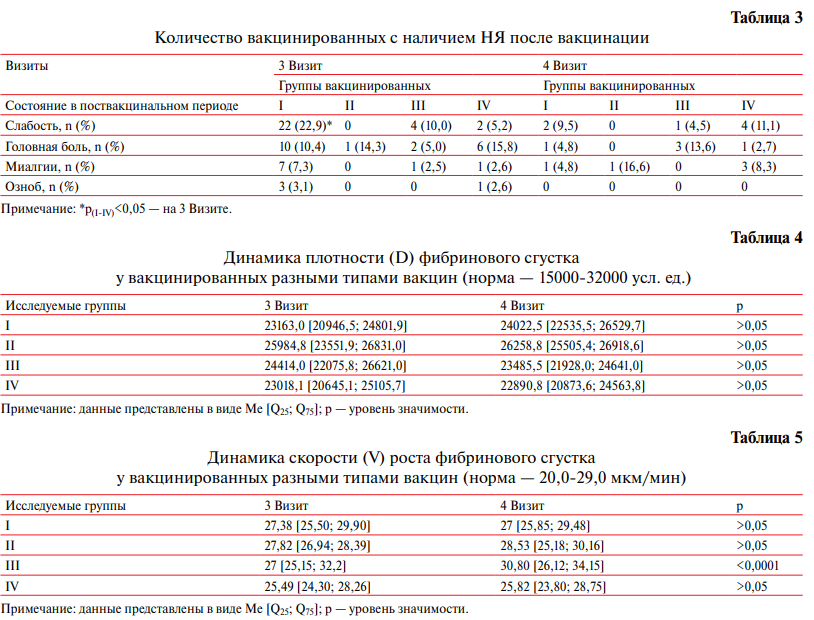
В таблице 4 и 5 представлены результаты динамики ряда параметров интегральной оценки плазменного гемостаза (плотности (D) и скорости роста (V) фибринового сгустка) у вакцинированных лиц разными типами вакцин.
Как свидетельствуют результаты (таблица 4), достоверных различий по динамике плотности (D) фибринового сгустка у ревакцинированных разными схемами вакцинации не выявлено. В I и II группах отмечалась лишь тенденция к увеличению плотности фибринового сгустка, а в III и IV — тенденция к уменьшению, однако все значения не выходили за пределы референсных величин. Относительно динамики скорости роста фибринового сгустка у вакцинированных разными типами вакцин получены значимые (p<0,0001) различия в III группе вакцинированных (КовиВак на каждом этапе первичной вакцинации, Гам-КОВИД-Вак на каждом этапе повторной вакцинации) — отмечено увеличение этого показателя от I этапа ревакцинации ко II этапу, причем величина V выходила за пределы референсных значений (30,80 мкм/мин).
Обсуждение
При анализе влияния на организм человека вакцинации и особенно ревакцинации против вируса SARS-CoV-2 крайне важны не только данные об эффективности доступных в настоящее время вакцин, но и тщательная оценка их профиля безопасности.
В апреле 2022г в журнале JAMA Cardiology были опубликованы результаты широкомасштабного исследования, в котором приняли участие 23,1 млн жителей Дании, Финляндии, Норвегии и Швеции в возрасте от 12 лет. Основной целью исследования стало определение связи вакцинации против SARSCoV-2 с риском возникновения миокардита и перикардита в зависимости от типа вакцины, количества введенных доз, пола и возраста участников. Изучались исходы после введения одного из 4-х видов вакцин против SARS-CoV-2: BNT162b2 (Pfizer-BioNTech), mRNA-1273 (Moderna), AZD1222 (AstraZeneca) и Ad26.COV2.S (Janssen). У мужчин и женщин, получивших два компонента вакцины BNT162b2 или mRNA-1273, вторая доза была ассоциирована с более высоким риском развития миокардита. При этом миокардит чаще развивался после второй дозы mRNA-1273, чем после второй дозы BNT162b2, а самым высоким риск был среди мужчин от 16 до 24 лет. Авторы исследования указывают, что риск развития миокардита, связанный с вакцинацией против SARS-CoV-2, должен быть учтен и соотнесен с преимуществами этих вакцин [4].
Результаты еще одного крупного исследования свидетельствуют об отсутствии повышения риска острого повреждения печени после вакцинации против COVID-19. Исследователи оценивали развитие острого повреждения печени в течение первых 56 дней после второй дозы вакцины BNT162b2 или CoronaVac. По сравнению с невакцинированными лицами вакцинация не ассоциировалась с повышением риска острого повреждения печени ни после первой, ни после второй дозы BNT162b2 или CoronaVac. Все случаи острого повреждения печени после вакцинации были несерьезными и нелетальными [5].
В проводимом нами исследовании в ходе ревакцинации не было выявлено ни одного случая миокардита, перикардита, либо повреждения печени на протяжении в среднем 2-месячного наблюдения. Abou Saleh I, et al. (2022) также показали, что вакцинация против SARS-CoV-2 у пациентов с острым миокардитом в анамнезе не связана с риском рецидива миокардита или серьезными побочными эффектами [6].
Профиль безопасности вакцины BNT162b2 характеризовался кратковременной болью от слабой до умеренной в месте инъекции, утомляемостью и головной болью. Частота серьезных НЯ была низкой и аналогичной в группах вакцинированных и плацебо [7][8].
Систематический анализ, включивший обзор 11 исследований вакцинированных лиц против вируса SARS-CoV-2, выявил, что в основном реакции на фоне вакцинации от COVID-19 были от легкой до умеренной степени тяжести, и при этом нивелировались в течение 3-4 дней. Наиболее часто встречались такие локальные реакции, как боль, отек и гиперемия в месте инъекции. К системным реакциям относили астению, лихорадку, миалгию и головную боль [9]. В исследовании Ad26.COV2.S оценивали эффективность и безопасность вакцины в подгруппе пациентов >60 лет (14672 человек). Установлено, что эффективность вакцины была несколько ниже, а местные и системные поствакцинальные реакции возникали реже, чем у пациентов более молодого возраста [10].
В исследованиях вакцин BNT162b2, мРНК1273 в подгруппе пациентов >65 лет (>7 тыс. человек) эффективность вакцинации была сопоставима с эффективностью в общей группе для обоих исследований, а местные и системные НЯ также реже встречались в старших возрастных категориях [11][12].
В обзоре исследований вакцин от COVID-19, зарегистрированных на территории Европейского союза, наиболее частые побочные эффекты включали локальные реакции в виде болезненности и эритемы места инъекции с последующими неспецифическими системными эффектами (миалгия, озноб, утомляемость, головная боль и лихорадка), которые быстро разрешались [13]. В ходе наблюдения за вакцинированными лицами в исследовании САТУРН продемонстрировано, что значимо чаще встречались такие системные реакции, как лихорадка и слабость у вакцинированных после I этапа ревакцинации при использовании гомологичной схемы (введение Гам-КОВИД-Вак на каждом этапе первичной и повторной вакцинации) и лихорадка — в случае применения гетерологичной схемы (Гам-КОВИД-Вак на каждом этапе первичной вакцинации, КовиВак на каждом этапе повторной вакцинации) по сравнению с вакцинированными гомологичной схемой с использованием КовиВака на каждом этапе первичной и повторной вакцинации. Достоверных различий по частоте развития местных реакций у лиц при использовании разных схем ревакцинации получено не было.
Еще одна проблема, которая широко обсуждается при вакцинации и ревакцинации против COVID-19, это развитие тромботических событий. После применения векторных вакцин ChadOx1 nCoV-19/AZD1222 (AstraZeneca) и Ad26.COV2.S (Janssen/Johnson&Johnson) отмечались случаи развития тромбоза с тромбоцитопенией по механизму, схожему с развитием гепарин-индуцированной тромбоцитопении, большинство из которых произошли у женщин в возрасте до 60 лет [14-16]. Однако частота развития подобных событий среди вакцинированных была крайне низкой, а причинно-следственная связь остается неподтвержденной [14]. В Европе суммарно было зарегистрировано 30 случаев преимущественно венозных тромбоэмболических событий среди ~5 млн вакцинированных ChAdOx1-S [17]. Li X, et al. (2022) количественно оценили сравнительный риск тромбоза с синдромом тромбоцитопении или тромбоэмболических осложнений, связанных с использованием вакцин против COVID-19 на основе аденовируса, по сравнению с вакцинами на основе мРНК в странах Европы.
В этом многонациональном исследовании наблюдалось общее увеличение риска тромбоцитопении на 30% после первой дозы вакцины ChAdOx1-S, а также тенденция к увеличению риска венозного тромбоза с синдромом тромбоцитопении после Ad26. COV2.S по сравнению с BNT162b2 [18].
В рамках российского исследования СИРИУС (Состояние Иммунной системы и исходы у лиц, вакциниРованных протИв вирУСа SARS-CoV2) оценивали влияние вакцин КовиВак и Гам-КОВИД-Вак на показатели плазменного гемостаза при изучении параметров глобального теста тромбодинамики у вакцинированных лиц. Было продемонстрировано, что вакцинация КовиВак и Гам-КОВИД-Вак не оказывает статистически значимого влияния на свертываемость крови; более того, за время наблюдения не было зарегистрировано ни одного случая артериального или венозного тромбоза, также не было зарегистрировано ни одного случая развития серьезных НЯ [19].
В ходе исследования САТУРН у ревакцинированных разными схемами вакцинации продемонстрировано отсутствие достоверных различий касательно динамики плотности (D) фибринового сгустка, при этом динамика скорости роста фибринового сгустка в III группе вакцинированных (КовиВак на каждом этапе первичной вакцинации, Гам-КОВИД-Вак на каждом этапе повторной вакцинации) была значимо выше от I этапа ревакцинации ко II этапу. Однако стоит отметить, что величина V (30,80 мкм/мин) выходила за пределы референсных значений несущественно (норма — 20,0-29,0 мкм/мин); кроме того, полученные изменения требуют дальнейшего изучения и сопоставления с клоттинговыми тестами, отражающими различные звенья гемостаза. Кроме того, за время наблюдения не было зарегистрировано ни одного случая артериального или венозного тромбоза.
Заключение
Согласно полученным данным, применение различных схем ревакцинации (гомологичных и гетерологичных) не было сопряжено с развитием серьезных НЯ. Возникшие локальные и системные реакции были кратковременны и не потребовали госпитализации. Отмечены более выраженные системные реакции в виде кратковременного повышения температуры и появления слабости при использовании вакцины Гам-КОВИД-Вак. За время наблюдения не были зарегистрированы случаи артериального или венозного тромбоза.
Безусловно, полученные данные требуют дальнейшего изучения и осмысления в ходе последующего наблюдения за ревакцинированными лицами, включенными в исследование САТУРН.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. Министерство здравоохранения РФ "Временные методические рекомендации "Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)". Версия 16. https://static-0.minzdrav.gov.ru/system/attachments/attaches/000/060/193/original/ВМР_COVID-19_V16.pdf (18.08.2022)".
2. WHO Coronavirus (COVID-19) Dashboard With Vaccination Data n.d. WHO. https://covid19.who.int/ (12 October 2022).
3. WHO. Interim statement on booster doses for COVID-19 vaccination 2021. https://www.who.int/news/item/22-12-2021-interimstatement-on-booster-doses-for-covid-19-vaccination---Update22-December-2021 (12 April 2022).
4. Регистрационное удостоверение ЛП-006395 от 11.08.2020 ГамКОВИД-Вак Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARSCoV-2 (Филиал "Медгамал" ФГБУ "НИЦЭМ им. Н. Ф. Гамалеи" Минздрава России). https://grls.rosminzdrav.ru/InstrImg/0001460267/0000615293/%D0%9B%D0%9F006423[2020]_0.pdf (16 Marth 2021).
Список литературы
1. Драпкина О. М., Бернс С. А., Горшков А. Ю. и др. Бустерная вакцинация против вируса SARS-CoV-2: основные проблемы и пути их решения. Комплексные проблемы сердечно-сосудистых заболеваний. 2022;11(2):196-203. doi:10.17802/2306-1278-2022-11-2-196-203.
2. Klok F, Pai M, Huisman M, et al. Vaccine-induced immune thrombotic thrombocytopenia. Lancet Haematol. 2022;9(1):e7380. doi:10.1016/S2352-3026(21)00306-9.
3. Баландина А. Н., Кольцова Е. М., Шибеко А. М. и др. Тромбодинамика: новый подход к диагностике нарушений системы гемостаза. Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2018;17(4):114-26. doi:10.24287/1726-1708-2018-17-4114-126.
4. Pillay J, Gaudet L, Wingert A, et al. Incidence, risk factors, natural history, and hypothesised mechanisms of myocarditis and pericarditis following covid-19 vaccination: living evidence syntheses and review. BMJ. 2022;378:e069445. doi:10.1136/bmj2021-069445.
5. Wong CKH, Mak LY, Au ICH, et al. Risk of acute liver injury following the mRNA (BNT162b2) and inactivated (CoronaVac) COVID-19 vaccines. J Hepatol. 2022;77(5):1339-48. doi:10.1016/j.jhep.2022.06.032.
6. Abou Saleh I, Hayek A, Azar L, et al. Safety of SARS-CoV-2 vaccination in people with a history of acute myocarditis. Eur Heart J. Acute Cardiovascular Care. 2022;11(Suppl 1):i167. doi:10.1093/ehjacc/zuac041.124.
7. Mason TF, Whitston M, Hodgson J, et al. Effects of BNT162b2 mRNA vaccine on COVID-19 infection and hospitalisation amongst older people: matched case control study for England. BMC Med. 2021;19:275. doi:10.1186/s12916-02102149-4.
8. Dagan N, Barda N, Kepten E, et al. BNT162b2 mRNA Covid-19 Vaccine in a Nationwide Mass Vaccination Setting. N Engl J Med. 2021;384:1412-23. doi:10.1056/NEJMoa2101765.
9. Kaur R, Dutta S, Bhardwaj P, et al. Adverse Events Reported from COVID-19 Vaccine Trials: A Systematic Review. Indian J Clin Biochem. 2021;1:13. doi:10.1007/s12291-021-00968-z.
10. Sadoff J, Gray G, Vandebosch A, et al. Safety and Efficacy of Single-Dose Ad26.COV2.S Vaccine against Covid-19. N Engl J Med. 2021;384(23):2187-201. doi:10.1056/NEJMoa2101544.
11. Baden L, El Sahly H, Essink B, et al. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. N Engl J Med. 2021;384(5):403-16. doi:10.1056/NEJMoa2035389.
12. Polack F, Thomas S, Kitchin N, et al. Safety and efficacy of the BNT162b2 mRNA Covid-19 vaccine. N Engl J Med. 2020;383:2603-15. doi:10.1056/NEJMoa2034577.
13. Hernández A, Calina D, Poulas K, et al. Safety of COVID-19 vaccines administered in the EU: Should we be concerned? Toxicol Rep. 2021;8:871-9. doi:10.1016/j.toxrep.2021.04.003.
14. See I, Su J, Lale A, et al. US Cases Reports of Cerebral Venous Sinus Thrombosis With Thrombocytopenia After Ad26.COV2.S Vaccination. JAMA. 2021;325(24):2448-56. doi:10.1001/jama.2021.7517.
15. Schultz N, Sørvoll I, Michelsen A, et al. Thrombosis and Thrombocytopenia after ChAdOx1 nCoV-19 Vaccination. N Engl J Med. 2021;384(22):2124-30. doi:10.1056/NEJMoa2104882.
16. Greinacher A, Thiele T, Warkentin T, et al. Thrombotic Thrombocytopenia after ChAdOx1 nCov-19 Vaccination. N Engl J Med. 2021;384(22):2092-101. doi:10.1056/NEJMoa2104840.
17. Wise J. Covid-19: European countries suspend use of OxfordAstraZeneca vaccine after reports of blood clots. BMJ. 2021;372:n699. doi:10.1136/bmj.n699.
18. Li X, Burn E, Duarte-Salles T, et al. Comparative risk of thrombosis with thrombocytopenia syndrome or thromboembolic events associated with different covid-19 vaccines: international network cohort study from five European countries and the US. BMJ. 2022;379. doi:10.1136/bmj-2022-071594.
19. Драпкина О. М., Бернс С. А., Горшков А. Ю. и др. Ассоциация гуморального иммунного статуса и параметров тромбодинамики после вакцинации Гам-КОВИДВак и КовиВак. Кардиоваскулярная терапия и профилактика. 2022;21(6): 3295. doi:10.15829/1728-8800-2022-3295.
Об авторах
О. М. ДрапкинаРоссия
Доктор медицинских наук, профессор, академик РАН, директор.
Москва
С. А. Бернс
Россия
Доктор медицинских наук, профессор, профессор кафедры терапии и общей врачебной практики Института профессионального образования и аккредитации.
Москва
А. Ю. Горшков
Россия
Кандидат медицинских наук, зам. директора по научной и амбулаторно-поликлинической работе.
Москва
Л. Н. Рыжакова
Россия
Кандидат медицинских наук, главный врач консультативно-диагностического центра.
Москва
О. В. Жданова
Россия
Врач терапевт консультативно-диагностического центра.
Москва
М. Г. Чащин
Россия
Научный сотрудник отдела фундаментальных и прикладных аспектов ожирения.
Москва
О. А. Литинская
Россия
Кандидат медицинских наук, зав. клинико-диагностической лабораторией.
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Драпкина О.М., Бернс С.А., Горшков А.Ю., Рыжакова Л.Н., Жданова О.В., Чащин М.Г., Литинская О.А. Реактогенность различных схем вакцинации против COVID-19. Кардиоваскулярная терапия и профилактика. 2022;21(12):3476. https://doi.org/10.15829/1728-8800-2022-3476
For citation:
Drapkina O.M., Berns S.A., Gorshkov A.Yu., Ryzhakova L.N., Zhdanova O.V., Chaschin M.G., Litinskaya O.A. Reactogenicity of various COVID-19 vaccination regimens. Cardiovascular Therapy and Prevention. 2022;21(12):3476. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3476
JATS XML

























































