Перейти к:
Биоресурсные коллекции: алгоритмы формирования и функционирования, фундаментальная и прикладная значимость (на примере НМИЦ онкологии им. Н.Н. Блохина)
https://doi.org/10.15829/1728-8800-2023-3654
Аннотация
Биоресурсная коллекция ФГБУ "НМИЦ онкологии им. Н. Н. Блохина" Минздрава России — это уникальный структурированный биобанк, объединивший в себе разные типы первичных и дочерних образцов и обеспечивающий возможность их всесторонней характеристики, включая как общепринятые показатели, так и специфические виды исследований. В клиническом подразделении центра депонированы образцы парафиновых блоков, замороженный материал, кровь и ее производные. В НИИ центра собрана коллекция коммерческих и уникальных клеточных линий человека и перевиваемых штаммов, полученных из клинического материала, а также клетки лабораторных животных (линии культур клеток и перевиваемые штаммы), преимущественно мышиного происхождения. Предоставляемые клеточные линии проходят многостадийный конт роль качества, включающий подтверждение подлинности, оценку жизнеспособности и определение оптимальных условий культивирования, анализ межвидовой и внутривидовой контаминации, изучение туморогенности и воспроизводимости на бестимусных мышах Balb/c-nude и др. Также в Биоресурсной коллекции представлены гибридомные клоны, продуцирующие антитела к широкому спектру мишеней. Центр предоставляет возможность проведения доклинических исследований с использованием образцов Биоресурсной коллекции для получения научных и регуляторных данных об антипролиферативной активности новых агентов или способов лечения злокачественных новообразований.
Ключевые слова
Для цитирования:
Кособокова Е.Н., Калинина Н.А., Барышникова М.А., Покровский В.С., Солопова О.Н., Богуш Т.А., Косоруков В.С. Биоресурсные коллекции: алгоритмы формирования и функционирования, фундаментальная и прикладная значимость (на примере НМИЦ онкологии им. Н.Н. Блохина). Кардиоваскулярная терапия и профилактика. 2023;22(11):3654. https://doi.org/10.15829/1728-8800-2023-3654
For citation:
Kosobokova E.N., Kalinina N.A., Baryshnikova M.A., Pokrovsky V.S., Solopova O.N., Bogush T.A., Kosorukov V.S. Bioresource collections: algorithms for development and functioning; basic and applied significance. Cardiovascular Therapy and Prevention. 2023;22(11):3654. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3654
Введение
С развитием технологий анализа больших массивов данных стала очевидной необходимость создания организации, аккумулирующей ассоциированную с клиническими образцами информацию и обеспечивающей ее доступность для широкого круга пользователей. В современном мире задача подбора образцов для исследования по конкретным характеристикам должна иметь простое и удобное решение с минимальными временными затратами. Так сформировалось понятие биобанка, как сложной структуры, обеспечивающей принятие, хранение, выдачу не только образцов, но и сопряженных с ними данных, и осуществляющей весь комплекс мероприятий надлежащим образом и в соответствии с регламентирующими документами [1-3].
В мире постепенно развивался процесс организации биобанков на базе созданных ранее биоресурсных коллекций научно-исследовательских институтов или некоммерческих организаций. В России данный процесс идет с некоторым отставанием, что облегчает задачу за счет построения структуры на основе уже существующей нормативной базы с учетом опыта других стран [2].
Наиболее активно в этой области ведет работы профессиональное сообщество частных лиц и организаций, занимающихся биобанкированием — International Society for Biological and Environmental Repositories (ISBER), прилагающее много усилий для разработки стандартов, национальных руководств и повышения качества управления биорепозиториями. Передовые практики ISBER служат основой для многих процедур, направленных на повышение эффективности эксплуатации и управления перемещением, на обучение и адаптацию, поддержку внедрения биобанком стандартов и проведение аккредитации [4]. Организованная подобным образом структура обеспечивает возможность мультидисциплинарного подхода при исследованиях предоставляемых образцов. Контроль и прослеживаемость образцов на всех этапах их жизненного цикла позволяют реализовать схему получения разных типов образцов от одного донора, оценить пригодность материала для тех или иных видов исследований, а детальное описание преаналитических этапов и многостадийная характеристика обеспечивают полноценное описание образцов, предоставляемых заказчику. Все это возможно реализовать только в рамках внедрения биобанком единой системы управления и контроля качества (КК) [1][5].
Сбор образцов и формирование коллекции ведется в ФГБУ "НМИЦ онкологии им. Н. Н. Блохина" Минздрава России с конца 70-х гг ХХв и на данный момент коллекция насчитывает >16000 единиц хранения. В рамках реализации проекта, поддержанного Министерством науки и высшего образования Российской Федерации (соглашение № 075-15-2021-1060 от 28 сентября 2021г) проведена инвентаризация и составлен реестр образцов. Настоящая статья посвящена проведенной работе по формированию биоколлекции и реализации мер, направленных на внедрение передовых практик в области биобанкирования.
Структура Биоресурсной коллекции ФГБУ "НМИЦ онкологии им. Н. Н. Блохина" Минздрава России
Компоненты Биоресурсной коллекции ФГБУ "НМИЦ онкологии им. Н. Н. Блохина" Минздрава России представлены на рисунке 1. Биобанк, будучи сложной структурой, обеспечивает прием, хранение, выдачу не только образцов, но и связанных с ними данных, и гарантирует контроль выполнения всего комплекса мероприятий надлежащим образом и в соответствии с регламентирующими документами [1].

Рис. 1 Структура Биоресурсной коллекции
ФГБУ "НМИЦ онкологии им. Н. Н. Блохина" Минздрава России.
Информационная составляющая биобанка, как правило, представлена двумя основными типами: стандартизированная информация, формирующая основную базу данных (собирается в обязательном порядке для всех образцов) [6], и информация, получаемая в результате исследования биоматериала (актуально для организаций, занимающихся научной деятельностью) [3]. Для управления качеством стандартизированной информации, предоставляемой при выдаче образца, рекомендуется имплементация рекомендаций BRISQ (Biospecimen Reporting for Improved Study Quality) [7] и системы кодировки SPREC (Standard PREanalytical Code) [8][9].
Таким образом, при правильной организации функционирования биобанк:
- защищает права и интересы доноров благодаря соблюдению этико-правовых норм (наличие одобрения этического комитета, добровольного информированного согласия);
- обеспечивает КК предоставляемого материала за счет контроля процессов получения, перемещения, характеристики образцов, систематизации и соблюдения условий хранения;
- обеспечивает доступность информации об образцах коллекций.
Полноценная реализация такого подхода делает биобанк ценной структурой для проведения исследований в самых разных областях: фундаментальные, прикладные, популяционные исследования и другие направления.
Образцы Биоресурсной коллекции
Современные подходы к решению научных задач требуют применения разных типов образцов (опухолевая и нормальная ткань, препараты крови и другие биологические жидкости, ногти, волосы и т.д.) и форматов пробоподготовки (фиксация в формалине, заключение в парафиновый блок, криоконсервация, фиксация в стабилизаторе рибонуклеиновой кислоты (РНК) и т.д.). Ценным преимуществом Биоресурсной коллекции ФГБУ "НМИЦ онкологии им. Н. Н. Блохина" Минздрава России является возможность сбора и предоставления широкого спектра различных типов образцов, их производных и ассоциированных с ними данных (рисунок 2), благодаря взаимодействию клинических и научно-исследовательских подразделений центра. Организация сбора образцов — сложная задача, требующая согласованного взаимодействия различных структур центра. Только четкое соблюдение регламентированных процедур забора материала, транспортировки и временного хранения обеспечивает высокое качество депонируемых образцов [5].
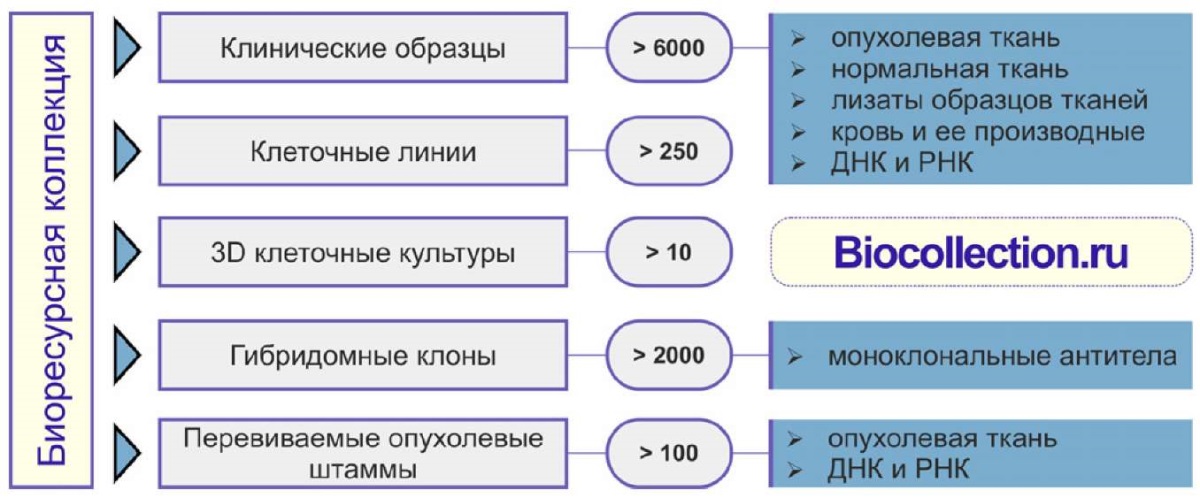
Рис. 2 Образцы Биоресурсной коллекции
ФГБУ "НМИЦ онкологии им. Н. Н. Блохина" Минздрава России.
Примечание: ДНК — дезоксирибонуклеиновая кислота,
РНК — рибонуклеиновая кислота.
Поступающий в коллекцию образец регистрируется и направляется на временное хранение до момента перемещения в основное хранилище коллекции. При необходимости, в зависимости от типа образца, проводится первичный КК, после чего выполняются исследования по его характеристике [10].
Клеточные линии
Для клеточных линий ключевыми показателями КК являются жизнеспособность и отсутствие контаминации. В рамках первичного контроля в карантинной зоне проводится анализ межвидовой контаминации (рисунок 3). С целью контроля внеклеточной контаминации бактериями и грибами клеточная линия культивируется в полной ростовой среде без добавления антибиотиков и антимикотиков при 37º С в условиях 5% углекислого газа (СО2). По истечении 72 ч среда пропускается через фильтр с диаметром пор 0,45 мкм, задерживающий бактериальные и дрожжевые клетки. Фильтр помещается в ростовую среду без добавления антибиотиков и антимикотиков и инкубируется в течение недели при 37º С в условиях 5% СО2. Наличие бактериальной и дрожжевой контаминации в среде оценивается визуально под микроскопом.

Рис. 3 Жизненный цикл клеточной линии Биоресурсной коллекции
ФГБУ "НМИЦ онкологии им. Н. Н. Блохина" Минздрава России.
Контроль контаминации микоплазмой осуществляется методом полимеразной цепной реакции (ПЦР) с использованием набора MycoReport (Евроген, Россия) и последующей электрофоретической детекцией в агарозном геле [10]. В случае обнаружения контаминации микоплазмой клеточная линия изымается и депонируется в отдельный репозиторий (до получения очищенной от микоплазмы культуры), а для восстановления коллекции используются более ранние пассажи. Исключение составляют уникальные клеточные линии, для которых нет возможности возобновления. В таком случае проводится лечение с использованием набора Myco-3 (PanReac Applichem, Германия), основанного на антибиотике Ципрофлоксацин, относящемся к группе фторхинолонов. Лечение проводится в течение 14 дней в среде, содержащей антибиотик (1 мкг/мл), со сменой среды каждые 2-3 дня. Следующие 2 нед. клетки культивируются в среде без антибиотика, после чего проводится повторный анализ на присутствие микоплазмы. Кроме того, при потоковом культивировании для каждого 10 пассажа обеспечивается контроль контаминации микоплазмой.
Для определения вирусной контаминации эффективно применяется быстрый и точный метод ПЦР с детекцией в режиме "реального времени". В список определяемых видов включены основные высокопатогенные контаминанты культур клеток человека, такие как вирус гепатита С (HCV), вирус гепатита B (HBV), вирус иммунодефицита человека типа 1 (HIV-1) и типа 2 (HIV-2), вирус Эпштейна-Барр (EBV), цитомегаловирус (CMV) и вирус герпеса 6 типа (HHV6). Данный состав перекрывается тремя зарегистрированными в РФ наборами производства научно-производственной лаборатории ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, которые имеют достаточную для наших задач чувствительность и специфичность в отношении указанных вирусов: Амплисенс EBV/CMV/HHV6-скрин-FL, Амплисенс HCV/HBV/HIV-FL, Амплисенс EBV/CMV/HHV6-скрин-FL [10].
При полном соответствии критериям "чистоты" образец передается в основную зону для наращивания и проведения исследований для его характеристики.
Определяющую роль при оценке качества клеточной линии играет показатель жизнеспособности. Образцы в Биоресурсной коллекции представлены либо криоконсервированной, либо культивируемой линией. В первом случае для оценки жизнеспособности клеточная линия размораживается с использованием автоматизированной системы оттаивания для криопробирок ThawSTAR CFT2 (Astero Bio, США) и количество клеток оценивается на автоматическом счетчике Luna-II (Logos Biosystems, Корея) методом исключения красителя трипанового синего. Повторный контроль проводится через 72 ч.
Для характеристики клеточных линий человека в Биоресурсной коллекции используются показатели туморогенности и воспроизводимости при подкожном введении 10 млн клеток мышам линии Balb/c nude. При ежедневном осмотре оценивается общее состояние животных, двигательная активность, внешний вид. С 3-5-го дня 1-2 раза/нед. проводится взвешивание мышей и измерение размера опухолей с использованием штангенциркуля в трех взаимно перпендикулярных плоскостях: длина, ширина и высота. Объем рассчитывается по формуле: V=π/6×L×W×H, где L — длина, W — ширина и H — высота. Линия клеток считается туморогенной, если в течение наблюдения (максимальный срок 60 дней) после трансплантации наблюдается формирование опухолевого узла объемом >100 мм³, увеличивающегося в размерах. В случае отрицательного результата возможно проведение повторного исследования с использованием препарата внеклеточного матрикса Матригель®, повышающего туморогенность образцов опухолевых клеток. В этом случае суспензия опухолевых клеток смешивается с препаратом Матригель® в объемном соотношении 1:1. Модель опухоли считается воспроизводимой, если кинетика роста опухолевых узлов воспроизводится не менее чем в двух пассажах.
Одним из ключевых методов характеристики клеточных линий является кариотипирование. Большое количество аномалий, возникающих в опухолевых клетках, значительно усложняет идентификацию хромосом и интерпретацию кариотипа. Зачастую протокол отрабатывается для каждой клеточной линии: подбираются условия синхронизации клеток для обеспечения максимального количества клеток в фазе митотического деления, оптимизируются условия фиксации. По итогам кариотипирования показано, что опухолевые клетки проявляют высокую хромосомную нестабильность в результате репликационного стресса; а модальное число хромосом не только значительно отличается от нормального кариотипа, но и варьирует от линии к линии [11].
Для подтверждения подлинности и проверки внутривидовой контаминации клетками других линий человека применяется метод профилирования на основе коротких тандемных повторов (short tandem repeat, STR) с использованием набора COrDIS "ЭКСПЕРТ 26" (Гордиз, Россия), валидированного для молекулярно-генетической идентификации личности на основе мультиплексного ПЦР-анализа. Полученный профиль сравнивается с результатами открытых баз данных — ECACC (European Collection of Autenticated Cell Cultures, Европейская коллекция аутентифицированных клеточных культур), ATCC (American Type Culture Coillection, Американская коллекция типовых культур), DSMZ (Deutsche Sammlung von Microorganismen und Zelikulturen, Немецкая коллекция микроорганизмов и клеточных линий) [12].
C учетом того, что полнота и разносторонность характеристик биологического материала напрямую влияет на его востребованность и ценность для научных исследований, все культуры клеток Биоресурсной коллекции ФГБУ "НМИЦ онкологии им. Н. Н. Блохина" Минздрава России охарактеризованы по экспрессии клинически значимых опухолевых маркёров метастатической активности, по уровню мишеней гормональной терапии и контрольных точек иммунитета [13][14]. Важно отметить, что в соответствии с запросами пользователей предусмотрено расширение спектра молекулярного фенотипирования, для чего созданы методология таких исследований и инструментальный парк. Более того, для части образцов клеточных линий меланомы проведено полноэкзомное секвенирование с аннотацией мутаций по перечню ключевых генов, которые вовлечены в процесс канцерогенеза, определяют разные аспекты агрессивности течения онкологического заболевания и являются ориентирами при выборе тактики лечения. Таким образом, результаты секвенирования и молекулярного фенотипирования культур клеток представляют огромный интерес для фундаментальных и прикладных исследований. В совокупности, это является, пожалуй, уникальной возможностью, предоставляемой ФГБУ "НМИЦ онкологии им. Н. Н. Блохина" Минздрава России.
В Биоресурсной коллекции представлены и коммерческие, и уникальные клеточные линии, полученные сотрудниками центра. Широкая представленность нозологических форм (рисунок 4) позволяет пользователям подобрать оптимальную панель для своих исследований. Коллекция постоянно пополняется за счет закупок, взаимодействий с другими биобанками и получения уникальных клеточных линий.

Рис. 4 Диаграмма распределения по нозологическим формам образцов клеточных линий
Биоресурсной коллекции ФГБУ "НМИЦ онкологии им. Н. Н. Блохина" Минздрава России.
При получении первичной клеточной линии биологический материал из операционного блока НИИ клинической онкологии им. Н. Н. Трапезникова ФГБУ "НМИЦ онкологии им. Н. Н. Блохина" Минздрава России с соблюдением условий стерильности помещается в емкость, заполненную на 2/3 транспортировочной средой (RPMI-1640, 2% FBS, 2 мМ L-глутамина, 10 мкг/мл гентамицина) и транспортируется в исследовательскую лабораторию при температуре, соответствующей температуре тела человека. До момента начала обработки материала проходит не >30 мин. Суспензию получают при помощи метода механической дезагрегации материала BD Medimachine (BD Biosciences, США) с использованием стерильных одноразовых камер Medicons (BD Biosciences, США) с диаметром отверстий 50 мкм в течение 1-2 мин. Для избавления от крупных фрагментов ткани суспензию пропускают через стерильные нейлоновые фильтры Filcons с диаметром пор 70 мкм (BD Biosciences, США). Для получения клеточной линии суспензию переносят в ростовую среду (RPMI-1640, содержащую 20% FBS, 1% HEPES, 1% NEAA, 2 мМ L-глутамина, 0,01 мг/мл гентамицина, с последующим переводом на полную RPMI-1640 с 10% FBS) и помещают в СО2-инкубатор при 37º С в атмосфере 5% СО2. Через 24 ч меняют среду культивирования на свежую. Смену среды затем производят каждые 3-4 дня в зависимости от скорости пролиферации. Клеточную линию считают стабильной (иммортализованной) по достижении 20-го пассажа без снижения пролиферативной активности.
Морфологический материал
Морфологический материал собирается в рамках реализации проектов или договоров в соответствии с прописанными требованиями к параметрам и характеристикам образцов в зависимости от предназначения и целевого исследования. На основании технического задания заказчика или методологии научно-исследовательской работы формулируются критерии включения пациента в исследование, определяется размер выборки, разрабатывается протокол исследования для утверждения этической комиссией.
КК морфологического материала — актуальная и непростая задача. В качестве показателей качества материала используются такие параметры, как объем ткани, доля опухолевых клеток, отсутствие очагов некроза, условия и длительность хранения, верификация опухолевого материала, полнота данных и др. ФГБУ "НМИЦ онкологии им. Н. Н. Блохина" Минздрава России имеет возможность передавать морфологические образцы, подготовленные с использованием различных методов фиксации и пробоподготовки: фиксация замораживанием в жидком азоте, химическая фиксация (формалин, FFPE — Formalin Fixed Paraffin-Embedded, фиксированные в формалине парафинизированные образцы), в стабилизирующих нуклеиновые кислоты растворах, подготовка суспензий единичных клеток и др.
Кровь и ее производные
Образцы крови и ее производных собираются в соответствии с требованиями заказчика, прописанными в техническом задании, и в зависимости от последующих исследований. На этом основан выбор типа пробирок-вакутейнеров и используемого в них антикоагулянта, протокола пробоподготовки, условий хранения и транспортировки, которые могут варьировать от комнатной температуры до -80º С. Помимо цельной крови, центр также предоставляет образцы сыворотки и плазмы, подготовленные в соответствии со стандартной операционной процедурой (СОП).
Качество образца крови определяет возможность проведения исследования и воспроизводимость результатов. Для гарантии предоставления качественного материала проводится четкий контроль соблюдения протоколов процедур пробоподготовки, температурных режимов хранения и транспортировки. Для образцов плазмы и сыворотки учитываются также такие показатели качества, как гемолиз и хилёз, способные привести к искажению результатов исследований.
Гибридомные клоны
Значимой частью Биоресурсной коллекции ФГБУ "НМИЦ онкологии им. Н. Н. Блохина" Минздрава России являются гибридомные клоны и моноклональные антитела. Начало работы по получению гибридом было положено еще в 80-х гг прошлого столетия А. Ю. Барышниковым. Сегодня в коллекции насчитывается >2 тыс. гибридомных клонов, продуцирующих моноклональные антитела против различных молекул и структур белковой и небелковой природы. Для гибридомных клонов разработаны протоколы оценки их жизнеспособности, контаминации, асцитогенности и антителопродукции. Для характеристики моноклональных антител проводится определение специфичности, аффинности, области применения, принадлежности к иммуноглобулиновым субклассам и, в отдельных случаях, оценка их биологической активности.
Генетический материал
Из любого типа образцов, предлагаемых центром, может быть выделен генетический материал (ГМ). Для получения дезоксирибонуклеиновой кислоты (ДНК) чаще всего используются образцы тканей (как свежий хирургический материал, так и парафиновые блоки фиксированных формалином тканей) и кровь (цельная кровь, мононуклеарные клетки, а также плазма и сыворотка). В случае необходимости получения РНК требуются более строгие условия: фиксация свежеиссеченного материала в специальном стабилизаторе IntactRNA (Евроген, Россия) или RNAlater (Thermo FS, США), максимальное сокращение периода от момента забора материала до начала выделения нуклеиновой кислоты (в идеале не >30 мин). Также возможно проведение выделения РНК из парафиновых блоков, однако cледует иметь в виду, что в таком случае ГМ будет сильно фрагментирован и подойдет не для любого исследования. Сотрудники центра владеют методами выделения свободно циркулирующей ДНК из плазмы и сыворотки крови; в т.ч. есть опыт одновременного выделения из образцов крови геномной ДНК, РНК, белков и свободно циркулирующей ДНК. В зависимости от целей исследования, типа образцов и необходимого ГМ разрабатывается протокол.
КК образца ДНК подразумевает спектрофлуориметрическую оценку концентрации на Qubit 4 (Thermo FS, США) с использованием набора Qubit 1X dsDNA HS Assay Kit (Thermo FS, США). Качество и количество выделенной ДНК определяется спектрофотометрическим методом по поглощению при 260 нм на нанофотометре NP80 (Implen, Германия). Качество выделенной ДНК оценивается по соотношению оптических плотностей при длинах волн 230, 260 и 280 нм. A260/A280 (содержание протеинов) должно быть между 1,8 и 2,05 и A260/A230 (загрязнение органическими соединениями или хаотропными агентами) >1,8.
Концентрация РНК оценивается спектрофлуориметрически на Qubit 4 (Thermo FS, США) с использованием набора Qubit RNA BR Assay Kit (Thermo FS, США). Оценка качества и количества выделенной РНК проводится на приборе BioАnalyzer 2100 (Agilent Technologies, США) с использованием набора RNA 6000 Nano/Pico Chip (Agilent Technologies, США), определяется RNA Integrity Number (RIN).
КК организации процессов
В соответствии с ГОСТ Р ИСО 203871 биобанк устанавливает, документирует и внедряет процедуры, определяющие деятельность на протяжении всего жизненного цикла образца в коллекции. Система КК в области биобанкирования2,3, предполагает разработку и применение стандартных операционных процедур (СОП), определяющих правила, методики, последовательность действий, направленных на обеспечение прослеживаемости на всех этапах, а также отражающих частоту и ключевые стадии проведения контролирующих процедур [1]. В соответствии с этими требованиями необходимо:
- наличие СОП по каждому из этапов для каждого из типов образцов;
- обязательное проведение процедуры валидации в соответствии с требованиями ISO 218994 для методов обработки, разработанных на основе действующих государственных и международных стандартов;
- применение стандартных методов обработки только после верификации и заключения о соответствии всем заранее установленным требованиям4;
- помимо регламентирующих все процессы документов, наличие записей, подтверждающих выполнение этих процедур (журналы, бланки, протоколы, отчеты и др.);
- в обязательном порядке должно быть определено ответственное лицо, управляющее процессом и несущее ответственность за результат.
При реализации проекта "Создание и развитие биоресурсной коллекции генетически и фенотипически охарактеризованных клеточных линий и первичных опухолей человека" в рамках соглашения о предоставлении из федерального бюджета гранта в форме субсидии с Министерством науки и высшего образования Российской Федерации в течение 2022г нами было разработано порядка 30 СОП, касающихся всех ключевых процессов, начиная от маркировки, учета, транспортировки и хранения до узко специализированных исследований для характеристики клеточной линии. В последующем планируется расширение перечня и адаптация имеющихся СОП с учетом изменения номенклатуры используемых реактивов и расширения перечня исследований.
Передача материала в биобанк осуществляется после подписания информированного добровольного согласия, разработанного с соблюдением этико-правовых норм и законодательных регламентов, определяющего варианты использования предоставляемых образцов и обеспечивающего защиту прав и интересов донора. Используемая в нашем центре модель общего расширенного согласия подразумевает однократное активное выражение согласия донором на использование образцов и ассоциированной с ними информации для текущего и любых будущих исследований.
Информатизация
КК процессов и образцов в биобанке невозможен без информатизации, направленной на автоматизацию процессов управления Биоресурсной коллекцией. В ФГБУ "НМИЦ онкологии им. Н. Н. Блохина" совместно с ООО "ГеномЭксперт" разработана информационная система, обеспечивающая учет данных по образцам и коллекциям, автоматизацию процессов движения образцов в хранилищах, возможность выдачи аналитической сводки по образцам и их параметрам. Благодаря использованию единой нормативно-справочной информации (справочники и классификаторы) для описания образцов стали возможными организация единой базы и автоматизация сквозных процессов, обеспечивающих прослеживание перемещения образца на всех этапах его жизненного цикла от введения в коллекцию до выдачи заказчику или утилизации. Система обеспечивает управление цифровыми паспортами биообразцов и коллекций, формирует реестры образцов, обеспечивает учет и настройку мест хранения, ведет мониторинг условий хранения в биобанке. Организация структуры распределения ролей и настройка разграничения прав доступа к разделам и операциям в информационной системе позволяет строго контролировать этапность и выполняемость процессов, определяя круг лиц, ответственных за формирование заявок на размещение или выдачу образцов, создание баз данных в целях проведения научных исследований, а также ведение единой нормативно-справочной информации в области биобанкирования.
Центр коллективного пользования
С целью повышения доступности образцов и обеспечения качества оказания услуг с использованием материалов Коллекции в ФГБУ "НМИЦ онкологии им. Н. Н. Блохина" зарегистрирован Центр коллективного пользования, предоставляющий широкий спектр услуг (рисунок 5).

Рис. 5 Центр коллективного пользования
ФГБУ "НМИЦ онкологии им. Н. Н. Блохина" Минздрава России.
На базе Центра коллективного пользования выполняются научные исследования с использованием образцов Биоресурсной коллекции, что отражено в публикациях, например, в работе [15].
Модели ксенографтов опухолей человека, как CDX (cell line derived xenograft), так и PDX (patient-derived xenograft), широко используются в проведении научных исследований [16-18].
Заключение
Реализация комплексного подхода к функционированию биобанка ФГБУ "НМИЦ онкологии им. Н. Н. Блохина" Минздрава России гарантирует предоставление образцов высокого качества и углубленной характеристики. С условиями предоставления образцов можно ознакомится на сайте Биоресурсной коллекции https://biocollection.ru/.
Двухгодичная практика работы биобанка позволила сформулировать основные задачи биобанка:
- Сбор и процессинг биологического материала, создание специализированных коллекций;
- Сбор первичной информации и характеристика образцов;
- Ответственное и безопасное хранение образцов и ассоциированной ними информации;
- Контроль качества образцов и предоставляемой информации;
- Обеспечение менеджмента качества работы биобанка;
- Соблюдение этических норм работы биобанка;
- Информатизация работы биобанка и обеспечение доступности данных;
- Взаимодействие с другими биобанками;
- Оказание услуг биобанкирования и процессинга образцов;
- Оказание образовательных услуг в области биобанкирования.
Отношения и деятельность. Работа выполнена при финансовой поддержке Министерства науки и высшего образования РФ в рамках научно-исследовательской работы № 075-15-2021-1060 "Создание и развитие биоресурсной коллекции генетически и фенотипически охарактеризованных клеточных линий и первичных опухолей человека".
1. ГОСТ Р ИСО 20387 — 2021. Национальный стандарт Российской Федерации. Биотехнология. Биобанкинг. Общие требования.
2. ГОСТ Р ИСО 59781 — 2021/ISO/TR 22758:2020. Биотехнология. Биобанкинг. Общие требования. Биобанкинг. Руководство по внедрению ИСО 20387.
3. ГОСТ Р ИСО 9001 — 2015. Национальный стандарт Российской Федерации. Системы менеджмента качества. Требования.
4. ISO 21899:2020 Biotechnology. Biobanking. General requirements for the validation and verification of processing methods for biological material in biobanks.
Список литературы
1. Анисимов С. В., Ахмеров Т. М., Балановский О. П. и др. Биобанкирование. Национальное руководство. М.: ООО "Издательство ТРИУМФ", 2022. 308 с. ISBN: 9785936733222.
2. Косилкин С. В. Опыт правового регулирования деятельности биобанков в зарубежной практике и развитие российского законодательства. Вестник Университета имени О. Е. Кутафина. 2020;4(68):7987. doi:10.17803/23115998.2020.68.4.079087.
3. Крюкова Е. С., Рузанова В. Д. Правовой режим биобанков в отечественном законодательстве. Юридический вестник Самарского университета. 2021;7(1):5762. doi:10.18287/2542047X2021715762.
4. Snapes Е, Simeon Dubach D. ISBER Best Practices for Repositories, Moving Toward the Fifth Edition. Biopreservation and Biobanking. 2022;20(1):1078. doi:10.1089/bio.2022.29102.ejs.
5. Борисова А. Л., Покровская М. С., Мешков А. Н. и др. Стандарт по биобанкированию ISO 20387. Анализ требований и опыт внедрения. Клиническая лабораторная диагностика. 2020;65(9):58792. doi:10.18821/086920842020659587592.
6. Малеина М. Н. Правовой статус биобанка (банка биологических материалов человека). Право. Журнал Высшей школы экономики. 2020;1:98117. doi:10.17323/20728166.2020.1.98.117.
7. Moore HM, Kelly AB, Jewell SD, et al. Biospecimen reporting for improved study quality (BRISQ). J Proteome Res. 2011;10(8):342938. doi:10.1021/pr200021n.
8. Lehmann S, Guadagni F, Moore H, et al. Standard Preanalytical Coding for Biospecimens: Review and Implementation of the Sample PREanalytical Code (SPREC). Biopreserv Biobank. 2012;10(4):я36674. doi:10.1089/bio.2012.0012.
9. Betsou F, Bilbao R, Case J, et al. Standard PREanalytical Code Version 3.0. Biopreserv Biobank. 2018;16(1):912. doi:10.1089/bio.2017.0109.
10. Калинина Н. А., Мальченкова А. А., Кособокова Е. Н. Стратегия контроля качества клеточных линий человека и животных в биоресурсной коллекции. Коллекции культур клеток человека и животных: современные вызовы и сетевые решения. В кн: Сборник тезисов докладов Всероссийской школы конференции, Санкт Петербург, 2223 июня 2022 года. СПб.: Федеральное государственное автономное образовательное учреждение высшего образования "Санкт Петербургский политехнический университет Петра Великого", 2022:567. doi:10.18720/SPBPU/2/id22118.
11. Барышников А. Ю., Бурова О. С., Воронина Е. С. и др. Клеточные линии меланомы человека. СПб.: Издательство "Наукоемкие технологии", 2017. 174 с. ISBN: 9785990941236.
12. Кособокова Е. Н., Мальченкова А. А., Калинина Н. А. и др. Использование метода профилирования на основе коротких тандемных повторов для подтверждения подлинности клеточных линий в биобанках. Кардиоваскулярная терапия и профилактика. 2022;21(11):3386. doi:10.15829/1728880020223386.
13. Bogush TA, Basharina AA, Eliseeva BK, et al. A new approach to EMT diagnostics in epithelial tumors: Double immunofluorescent staining and flow cytometry. Biotechniques. 2020;69(4):18. doi:10.2144/btn20200024.
14. Bogush TA, Basharina AA, Scherbakov AM, et al. Tumor cell panel with characterized expression of PDL1 for preclinical studies of anticancer drugs and immune checkpoint inhibitors’ interaction. Moscow Univ Chem Bull. 2023;77(1):1924. doi:10.3103/S0027131422070045.
15. Нифонтова Г. О., Калениченко Д. В., Барышникова М. А. и др. Нанозонды на основе флуоресцентных полупроводниковых нанокристаллов и однодоменных антител для высокочувствительной детекции рецептора эпидермального фактора роста в опухолевых клетках. Российский биотерапевтический журнал. 2023;22(1):6875. doi:10.17650/1726978430232216875.
16. Machulkin AE, Uspenskaya AA, Zyk NY, et al. PSMAtargeted small molecule docetaxel conjugate: Synthesis and preclinical evaluation. Eur J Med Chem. 2022;227:113936. doi:10.1016/j.ejmech.2021.113936.
17. Morozova E, Abo Qoura L, Anufrieva N, et al. Daidzein directed methionine γlyase in enzyme prodrug therapy against breast cancer. Biochimie. 2022;201:17783. doi:10.1016/j.biochi.2022.05.007.
18. Machulkin AE, Nimenko EA, Zyk NU, et al. Synthesis and Preclinical Evaluation of Small Molecule Prostate Specific Membrane Antigen Targeted Abiraterone Conjugate. Molecules. 2022;27(24):8795. doi:10.3390/molecules27248795.
Об авторах
Е. Н. КособоковаРоссия
Екатерина Николаевна Кособокова — кандидат биологических наук, ведущий научный сотрудник лаборатории молекулярно-генетической диагностики и персонализированной медицины НИИ Экспериментальной диагностики и терапии опухолей.
Москва
Н. А. Калинина
Россия
Надежда Александровна Калинина — младший научный сотрудник лаборатории молекулярно-генетической диагностики и персонализированной медицины НИИ Экспериментальной диагностики и терапии опухолей.
Москва
М. А. Барышникова
Россия
Мария Анатольевна Барышникова — кандидат фармакологических наук, заведующий лабораторией экспериментальной диагностики и биотерапии опухолей НИИ Экспериментальной диагностики и терапии опухолей.
Москва
В. С. Покровский
Россия
Вадим Сергеевич Покровский — доктор медицинских наук, заведующий лабораторией биохимических основ фармакологии и опухолевых моделей НИИ Экспериментальной диагностики и терапии опухолей.
Москва
О. Н. Солопова
Россия
Ольга Николаевна Солопова — кандидат биологических наук, заведующий лабораторией биоресурсной коллекции клеточных линий и первичных опухолей НИИ Экспериментальной диагностики и терапии опухолей.
Москва
Т. А. Богуш
Россия
Татьяна Анатольевна Богуш — доктор биологических наук, ведущий научный сотрудник, профессор лаборатории молекулярно-генетической диагностики и персонализированной медицины НИИ Экспериментальной диагностики и терапии опухолей.
Москва
В. С. Косоруков
Россия
Вячеслав Станиславович Косоруков — кандидат биологических наук, директор НИИ Экспериментальной диагностики и терапии опухолей.
Москва
Дополнительные файлы
Что известно о предмете исследования?
- Организованный и функционирующий надлежащим образом биобанк, как структура, предоставляющая гарантированно качественные образцы и ассоциированные с ними данные, играет ключевую роль в проведении качественных и воспроизводимых исследований.
Что добавляют результаты исследования?
- На примере организации биобанка на базе ФГБУ "НМИЦ онкологии им. Н. Н. Блохина" Минздрава России, как комплексной структуры, обеспечивающей получение, хранение, описание и предоставление образцов надлежащего качества, даны конкретные рекомендации для специалистов по биобанкированию.
Рецензия
Для цитирования:
Кособокова Е.Н., Калинина Н.А., Барышникова М.А., Покровский В.С., Солопова О.Н., Богуш Т.А., Косоруков В.С. Биоресурсные коллекции: алгоритмы формирования и функционирования, фундаментальная и прикладная значимость (на примере НМИЦ онкологии им. Н.Н. Блохина). Кардиоваскулярная терапия и профилактика. 2023;22(11):3654. https://doi.org/10.15829/1728-8800-2023-3654
For citation:
Kosobokova E.N., Kalinina N.A., Baryshnikova M.A., Pokrovsky V.S., Solopova O.N., Bogush T.A., Kosorukov V.S. Bioresource collections: algorithms for development and functioning; basic and applied significance. Cardiovascular Therapy and Prevention. 2023;22(11):3654. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3654
JATS XML

























































