Перейти к:
Использование пищевых продуктов, фортифицированных метилированными формами витаминов группы В, для профилактики гипергомоцистеинемии
https://doi.org/10.15829/1728-8800-2023-3680
EDN: KZITPY
Аннотация
Цель. Изучение связи уровня гомоцистеина крови человека с генетическими и эпигенетическими факторами и оценка возможности коррекции уровня гомоцистеина с применением продуктов, обогащенных метилированными формами витаминов группы В.
Материал и методы. В исследование включено 20 человек (6 мужчин и 14 женщин) в возрасте 24-67 лет (средний возраст — 41,5 лет). Соотношение жировой и мышечной массы тела определяли методом биоимпедансометрии. Концентрацию гомоцистеина в плазме крови измеряли с помощью иммунохимического анализатора. Анализ полиморфизма генов фолатного цикла проводили с помощью полимеразной цепной реакции. Статистическую обработку материала, обучения и прогнозирования данных выполняли с применением искусственных нейронных сетей (ИНС). Уровни гомоцистеина до 3-месячного курса потребления фортифицированных продуктов обозначены как Hc1, после — Hc2.
Результаты. Уровень гомоцистеина крови участников до приема фортифицированных фруктово-ягодных батончиков варьировал от 6,5 до 24,2 мкмоль/л, составив, в среднем, 12,45±2,9 мкмоль/л. После 3-месячного приема, уровень гомоцистеина крови снизился до диапазона 7,1-18 мкмоль/л и, в среднем, составил 10,87±2,6 мкмоль/л (p=0,028). Гипергомоцистеинемия была выявлена у двух женщин (19,7 и 24,2 мкмоль/л) и одного мужчины (17,1 мкмоль/л). После потребления ими фруктово-ягодных батончиков наблюдалось значительное снижение уровня гомоцистеина крови — с 19,7 до 14,3 мкмоль/л, с 24,2 до 14,1 мкмоль/л и с 17,1 до 15,5 мкмоль/л, соответственно. Выявлена значимая средняя корреляция между значениями Hc1 и Hc2 (детектировано смещение значений), которая составила (r=0,579; p<1×10-5). Отмечены корреляции между уровнем гомоцистеина крови и индексом массы тела, а также ответами участников о наличии у них повышенного уровня глюкозы крови и частотой ответов о желании снизить массу тела (p<6,74×10-5).
Заключение. Полученные результаты демонстрируют значимое снижение гомоцистеина крови у всех участников при приеме продуктов питания, фортифицированных метилдеривативами витаминов группы B (p=0,028). У лиц, придерживающихся диетических ограничений, отмечено более выраженное снижение уровня гомоцистеина (p<6,74×10-5).
Ключевые слова
Для цитирования:
Балашова М.С., Муталлибзода Ш., Велина Д.А., Швабская О.Б., Горбачев В.В., Никитин И.А. Использование пищевых продуктов, фортифицированных метилированными формами витаминов группы В, для профилактики гипергомоцистеинемии. Кардиоваскулярная терапия и профилактика. 2023;22(9):3680. https://doi.org/10.15829/1728-8800-2023-3680. EDN: KZITPY
For citation:
Balashova M.S., Mutallibzoda Sh., Velina D.A., Shvabskaya O.B., Gorbachev V.V., Nikitin I.A. Fortified foods with methylated forms of B vitamin for the prevention of hyperhomocysteinemia. Cardiovascular Therapy and Prevention. 2023;22(9):3680. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3680. EDN: KZITPY
Введение
Гомоцистеин является непротеиногенной аминокислотой, которая образуется в организме в процессе метаболизма метионина. Высокие уровни гомоцистеина в плазме крови могут наблюдаться при нарушениях метаболизма фолатного и метионинового циклов и быть ассоциированы с риском развития сердечно-сосудистых заболеваний, в т.ч. мозгового инсульта, стеноза периферических артерий и венозным тромбозом [1]. Показано также, что высокий уровень этого метаболита коррелирует с недоразвитием нервной трубки в пренатальный и эмбриональный периоды [2].
Фолаты (витамин B9), а также их производные ди-, три-, полиглутаматы, которые обладают тем же биологическим эффектом, выступают кофактором для ферментов фолатного цикла, функционирование которого критически важно для многих биохимических процессов, таких как обмен аминокислот, метилирование дезоксирибонуклеиновой кислоты (ДНК) и др. [1][3][4]. Фолаты, поступающие с пищей, в нативной форме проникнуть сквозь гематоэнцефалический барьер не способны. Лишь после целого ряда преобразований под воздействием ферментов эти витамины трансформируются в биодоступную форму — метилфолаты. Скорость метилирования фолатов зависит от активности ферментов, участвующих в реакциях реметилирования и транссульфурации, в которых фолаты, витамины В12 и В6 необходимы в качестве кофакторов [5-8].
Недостаточное потребление фолатов с пищей является причиной дефицита данного нутриента в организме. Недостаток характеризуется низкой концентрацией фолатов в крови с сопутствующим повышением концентрации общего гомоцистеина, что является фактором риска врожденных нарушений плода, а также развития хронических неинфекционных заболеваний [1][5-7].
Проведенные исследования выявили ассоциации между полиморфизмами генов фолатного цикла и метаболизмом гомоцистеина [8]. Распространенный вариант полиморфизма C677T в гене, кодирующем фермент MTHFR, является наиболее известным генетическим фактором, влияющим на уровень метаболитов фолиевой кислоты. Фермент MTHFR катализирует трансформацию 5,10-метилентетрагидрофолата в биологически активную форму — 5-метилфолат. Вследствие снижения активности этого фермента носитель полиморфизма C677T имеет повышенный риск развития гипергомоцистеинемии. Частый однонуклеотидный полиморфизм C677T в гене MTHFR представляет собой замену цитозина на тимин в положении 677, которая приводит к замещению аланина валином в белке. Эта замена приводит к снижению активности фермента на 30% у гетерозигот и на 60% у гомозигот [9]. Активность фермента MTHFR имеет решающее значение для поддержания количества доступного фолата при реметилировании гомоцистеина. Носители аллеля T имеют более низкую активность фермента [10], сопряженную с повышенной концентрацией гомоцистеина [11]. Частота этого полиморфизма варьирует между различными этническими группами и географическими регионами (таблица 1) [12].
Таблица 1
Распространенность варианта MTHFR C677T в различных популяциях [12]
Регион | Распространенность |
Азия | От 30% у китайцев до 38% у индонезийцев |
Северная и Южная Америка | От 11% у афроамериканцев Южной Каролины до 45% у индейцев Бразилии |
Африка | От отсутствия у представителей племени денди до 0,09% у берберов |
Европа | От 19% у жителей Великобритании до 55% у испанцев |
Россия | От 29% у жителей Московского региона до 32% у жителей Сибири |
Еще одним белком фолатного цикла является метионин синтаза (MTR), которая ответственна за реметилирование гомоцистеина. MTR обеспечивает перенос метильной группы из 5-метилтетрагидрофолата на гомоцистеин, что приводит к образованию метионина. Ферменту MTR необходим витамин B12 (кобаламин) в качестве кофермента для образования комплекса кобаламин(I)MTR, который участвует в переносе метильной группы. Таким образом, метионин-синтаза-редуктаза (МТRR) необходима для реверсии окисленного кобаламина (II) в СН3-кобаламин (III) для поддержания активности МТR [13]. Полиморфизм гена MTR по нуклеотиду A2756G связан с заменой аденина на гуанин в положении 2756 и ассоциируется со снижением уровня гомоцистеина в плазме крови [14].
Фермент MTRR участвует в восстановлении активности MTR [15]. Полиморфизм A66G в 4 раза снижает активность фермента MTRR и способствует умеренному повышению уровня гомоцистеина в плазме крови. Данный полиморфизм высоко распространен в популяции, частота гетерозиготных носителей аллеля A66G составляет ~45,0-50,0%, а гомозиготных ~25,0% [14].
Соблюдение рациона питания с высоким содержанием витаминов группы B может помочь преодолеть негативные последствия для здоровья у людей-носителей полиморфизма генов фолатного цикла. Для того чтобы обойти метаболические ограничения преобразования фолатов, возможно потребление их активной формы 5-метилфолата. Ранее было упомянуто, что ферменту MTR необходим витамин B12 (кобаламин) в качестве кофермента для образования комплекса кобаламин(I)MTR. Учитывая, что при полиморфизме гена фолатного цикла MTRR A66G снижается способность переноса метильной группы ферментом MTRR к MTR и, следовательно, возможность реактивации MTR, для носителей полиморфизма гена MTRR A66G важно потреблять CH3-кобаламин для постоянного образования связи CH3-кобаламин MTRR в процессе поддержания активности MTR. Витамин B6 является кофактором ряда ферментов, в т.ч. цистатион-β-синтазы [14-17].
Проведенные исследования показывают, что снижение уровня гомоцистеина возможно путем потребления дополнительного количества витаминов группы В и метилированных форм витаминов группы B для носителей полиморфизмов генов фолатного цикла [13].
Ранее нами было проведено исследование по оценке распространенности дефицита фолатов с применением частотного опросника полуколичественной оценки характера питания (FFQ) Кембриджского университета (V2.53, University of Cambridge, Cambridge, UK), в котором участвовало 106 человек [18]. Всем респондентам было предложено выбрать частоту потребления различных продуктов за последние 12 мес. Опрошенная группа включала 61 (57,7%) женщину и 45 (42,5%) мужчин, средний возраст — 23 года. Отмечено, что у 56,6% респондентов наблюдался относительный недостаток потребления фолатов (<200 мкг/сут.). Эти результаты демонстрируют актуальность разработки обогащенных фолатами продуктов питания.
Настоящее пилотное исследование было направлено на изучение возможности снижения уровня гомоцистеина в крови 3-месячным приемом метилфолата, метилкобаламина и пиридоксина гидрохлорида в составе разработанных пищевых продуктов для персонализированного питания (фруктово-ягодные батончики).
При этом не исключалась возможность нахождения корреляции между уровнем гомоцистеина в крови участников и иными негенетическими параметрами. Выявление таких корреляций было поставлено в качестве дополнительной задачи в настоящем исследовании. Известно, что при проверке статистических гипотез на малых выборках, когда некоторые статистические методы обладают недостаточной мощностью, одним из эффективных выходов из сложившейся ситуации является применение методов непараметрической статистики [19], а именно ресемплинга с генерацией данных группы участников, совмещенных с последующими алгоритмами машинного обучения, базирующихся на применении искусственной нейронной сети (ИНС).
По своей сути ИНС представляет собой матрицу с нелинейной регрессией, ячейки которой связаны между собой и структура которой частичным образом имитирует взаимодействие биологических нейронов, что и дало название этому подходу [20][21]. В настоящее время ИНС показала возможность ее применения для решения сложных математических задач [22][23], а также для моделирования ситуации с использованием полученных результатов [24].
Таким образом, цель данного исследования — изучить связь уровня гомоцистеина крови человека с генетическими и эпигенетическими факторами, а также оценить возможность коррекции уровня гомоцистеина с применением продуктов, обогащенных метилфолатом и метилпроизводными кобаламина и пиридоксина гидрохлорида.
Материал и методы
Основные этапы исследования представлены на рисунке 1.
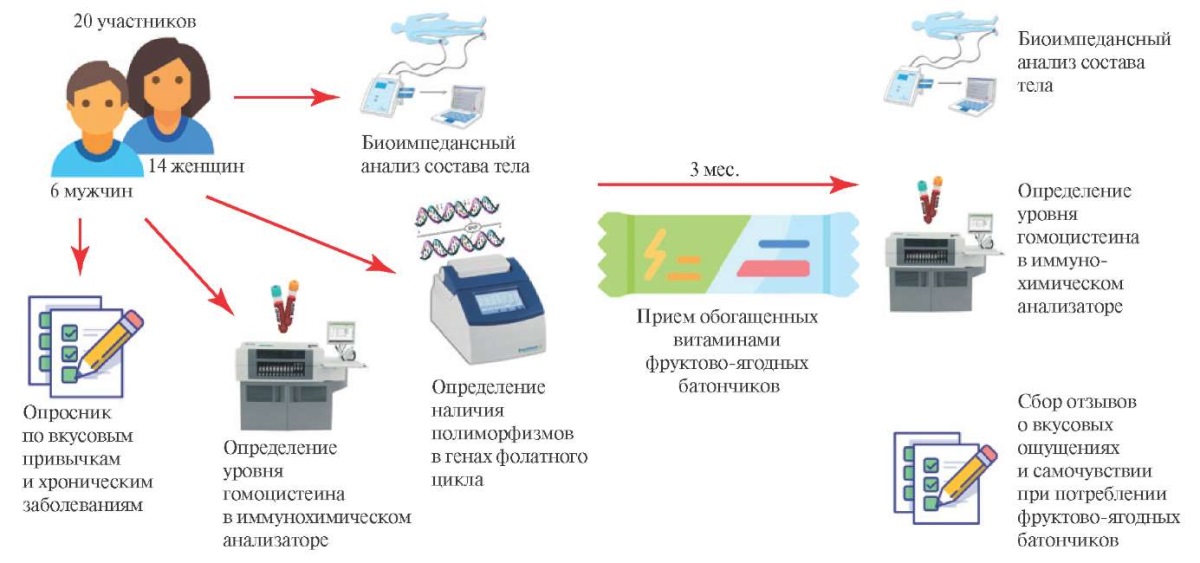
Рис. 1 Схема исследования влияния фортифицированных продуктов питания
на уровень гомоцистеина крови.
В исследовании приняли участие 20 человек. Половозрастные характеристики группы: 6 мужчин и 14 женщин в возрасте 24-67 лет (средний возраст — 41,5 год).
Критериями включения являлись отсутствие приема витаминных комплексов, содержащих фолаты, витамины В6 и В12 за 6 мес. до проведения исследования, а также добровольное информированное согласие на участие. Исследование было одобрено на заседании локального этического комитета при ФГБОУ ВО "Московский государственный университет технологий и управления им. К. Г. Разумовского" (Протокол № 2 от 06.07.2023г).
Определение соотношения жировой и мышечной МТ проводили методом биоимпедансометрии с использованием прибора АИСТ. Обработку результатов проводили в программе ООО "Диамант", Санкт-Петербург, v.12.03.2021г. Биоимпедансометрия проводилась дважды, до и после 3-месячного периода приема разработанных продуктов.
Определение концентрации гомоцистеина в плазме крови проводилось с помощью иммунохимического анализатора Architect i2000sr, (Abbott Laboratories, США), в качестве референса принимались значения 5,0-15,0 мкмоль/л. Определение уровня гомоцистеина проводилось дважды для каждого участника, до и после 3-месячного потребления разработанных продуктов.
Анализ полиморфизма генов, кодирующих ферменты фолатного цикла, проводился с помощью полимеразной цепной реакции в режиме реального времени на амплификаторе CFX96 (Bio-Rad, США) с использованием набора реагентов для определения единичных замен в ДНК последовательностях генов ферментов фолатного цикла производства СИНТОЛ (Россия). В набор входят реагенты для выявления вариантов генов MTHFR 677 С>T (rs1801133), MTHFR 1298 A>C (rs1801131), MTR 2756 A>G (rs1805087), MTRR 66 A>G (rs1801394). Определение полиморфизмов в генах фолатного цикла проводилось один раз для каждого участника — перед началом эксперимента.
Для анализа пищевых привычек и семейной предрасположенности к алиментарно-обусловленным заболеваниям была сформирована анкета из 20 вопросов.
Статистическая обработка материала и обучение ИНС. Материалом для анализа послужили данные лабораторных исследований по определению полиморфизма единичных мутаций 4 локусов, расположенных в 3 генах (MTHFR 677 C>T (A222V) rs1801134; MTHFR 1298 A>C (E429A) rs1801132; MTR 2756 A>G (D919G) rs1805088; MTRR 66 A>G (I22M) rs1801395). Все значения для анализа в ИНС получили свои кодировки. Уровни гомоцистеина до 3-месячного курса потребления фортифицированных продуктов обозначены как Hc1, после — Hc2. Сводная таблица значений создавалась в приложении Microsoft Excel 2010 и включала ряд индивидуальных параметров для каждого участника: пол, возраст, рост, вес, пищевые привычки, значения гомоцистеина и глюкозы крови, процент жировой МТ и т.д.).
Для прогнозирования данных с помощью ИНС применялся алгоритм, описанный ранее [21]. Уровень отклонений (дельта) выходных данных от приходящихся на входной слой ИНС составил не >0,0003 (или 0,03%).
Для нивелирования статистического влияния малой выборки (20 человек) проводился ресемплинг методом бутстрепирования при допущении, что все параметры, полученные от участников, распределяются независимо друг от друга. Полученные при ресемплинге данные (1001 человек) загружались в "обученную ИНС", которая на основании этих данных прогнозировала значения гомоцистеина для каждого индивидуума из вновь генерированной выборки (как если бы респондент участвовал в исследовании, и на начало, и конец исследования обладал бы случайным набором характеристик). Подобный подход с применением ИНС позволил выявить корреляции между изучаемыми показателями. Полученные величины анализировались с применением классических методов статистики (корреляция по Пирсону) на предмет их отклонения от H0. По отношению к итоговым значениям применялась поправка Бонферрони. Значения более p<6,74×10-5 (p=0,05/количество попарных сравнений — 741 случай) признавались статистически незначимыми.
Результаты и обсуждение
Участникам эксперимента было предложено ответить на ряд вопросов о пищевых привычках и состоянии здоровья. Итоговые значения опроса представлены в таблице 2.
Для оценки семейной предрасположенности участникам было предложено отметить наличие или отсутствие хронических заболеваний у родственников 1 ст. родства (родители, дети, родные братья и сестры). Результаты сбора семейного анамнеза представлены в таблице 3. От 15 до 40% участников имели семейную предрасположенность к сердечно-сосудистым и онкологическим заболеваниям, как и повышение уровней холестерина и глюкозы крови.
Результаты поиска однонуклеотидных полиморфизмов (single nucleotide polymorphism, SNP) представлены в таблице 4.
Таблица 2
Результаты опроса о состоянии здоровья и наличию заболеваний
№ | Вопросы | Ответы участников |
1 | Имеется ли у Вас (или выявлялось ранее) повышение уровня холестерина крови? | Да — 40% |
2 | Имеется ли у Вас (или выявлялось ранее) повышение уровня глюкозы крови? | Да — 15% |
3 | Имеются ли у Вас какие-либо хронические заболевания? | Хронический гастрит — 30% Боли в суставах — 20% Гипотиреоз — 10% Сахарный диабет 2 типа, панкреатит, остеопороз — по 5% |
Таблица 3
Оценка семейного анамнеза
Заболевание | Наличие близкого родственника с данным заболеванием |
Ишемическая болезнь сердца | 15% |
Артериальная гипертензия | 40% |
Боли в суставах | 40% |
Хронический гастрит | 10% |
Бронхиальная астма | 20% |
Сахарный диабет | 35% |
Онкологическое заболевание | 25% |
Нет хронических заболеваний | 20% |
Таблица 4
Анализ наличия SNP в генах фолатного цикла
Полиморфизм | Форма | Количество участников |
MTHFR 677 C> T (A222V) rs1801134 | Гомозиготная | 3 |
Гетерозиготная | 9 | |
MTHFR 1298 A> C (E429A) rs1801132 | Гомозиготная | 2 |
Гетерозиготная | 9 | |
MTHFR 677 C> T (A222V) rs1801134 MTHFR 1298 A> C (E429A) rs1801132 | Компаунд-гетерозиготная | 3 |
MTR 2756 A> G (D919G) rs1805088 | Гомозиготная | 1 |
Гетерозиготная | 6 | |
MTRR 66 A> G (I22M) rs1801395 | Гомозиготная | 6 |
Гетерозиготная | 13 |
Примечание: SNP — single nucleotide polymorphism (однонуклеотидный полиморфизм).
Исследование уровня гомоцистеина крови до и после приема разработанных пищевых продуктов
Определение уровня гомоцистеина крови до и после потребления фруктово-ягодных батончиков проводилось с соблюдением норм этики клинических исследований ФГАОУ ВО "Первый МГМУ им. И. М. Сеченова" и с письменного согласия участников исследований.
Количество метилфолата, метилкобаламина и пиридоксина гидрохлорида во фруктово-ягодных батончиках составляло 400 мкг, 3 мкг и 2 мг, соответственно. Такие дозировки были рассчитаны с учетом анализа литературы и оценки потребления витаминов группы В с использованием метода FFQ [2][11].
Без различий между группами мужчин и женщин, уровень гомоцистеина крови участников исследования до приема фортифицированных фруктово-ягодных батончиков находился в диапозоне от 6,5 до 24,2 мкмоль/л, среднее значение 12,45±2,9 мкмоль/л (12,5±2,13 мкмоль/л в группе мужчин и 12,42±3,28 мкмоль/л в группе женщин). После 3-месячного приема уровень гомоцистеина крови снизился и варьировал от 7,1 до 18 мкмоль/л, составив, в среднем, 10,87±2,6 мкмоль/л (11,35±2,53 мкмоль/л у мужчин и 10,7±2,64 мкмоль/л у женщин), также без значимых различий между группами мужчин и женщин. При сравнении концентрации искомого метаболита в группах до и после приема фортифицированных продуктов было найдено статистически значимое различие (p=0,028), как среди мужчин, так и среди женщин.
Потребление обогащенной пищевой продукции сопровождалось снижением уровня гомоцистеина крови до референсных значений у лиц с исходной гипергомоцистеинемией. Так, гипергомоцистеинемия (уровень гомоцистеина >15 мкмоль/л) была выявлена у двух женщин (19,7 и 24,2 мкмоль/л). Обе женщины были носителями генотипа MTHFR 677 T/T, ассоциированного с наибольшей выраженностью предрасположенности к гипергомоцистеинемии. После потребления ими фруктово-ягодных батончиков наблюдалось значительное снижение уровня гомоцистеина крови у обеих участниц до референсных значений (на 5,4 мкмоль/л — с 19,7 до 14,3 мкмоль/л и на 10,1 мкмоль/л с 24,2 до 14,1 мкмоль/л). У данных участниц отмечено наиболее выраженное снижение гомоцистеина из всей группы испытуемых. Также гипергомоцистеинемия (17,1 мкмоль/л) выявлена у одного мужчины без полиморфизма MTHFR 677 T/T, но с наличием полиморфизма (MTHFR 1298 A>C, MTR 2756 A>G, MTRR 66 A>G) в гетерозиготной форме. После приема батончиков у данного участника также отмечено снижение значения гомоцистеина крови до 15,5 мкмоль/л.
В целом, после приема батончиков только у 4-х испытуемых уровень гомоцистеина крови (14,1-14,8 мкмоль/л) находился в пределах нормальных значений. У остальных же участников исследования после вмешательства наблюдалось как незначительное повышение, так и понижение уровня гомоцистеина крови.
Полученные данные указывают, что 3-месячный прием пищевых продуктов, содержащих метилфолат, метилкобаламин и пиридоксина гидрохлорид, может оказывать влияние на снижение уровня гомоцистеина крови лиц с полиморфизмов генов фолатного цикла. Однако, следует акцентировать, что в рамках настоящей работы — это единичные наблюдения, которые, безусловно, должны быть продолжены, согласно критериям доказательной медицины, в рандомизированных контролируемых исследованиях в группах участников, имеющих схожие клинические характеристики.
Анализ состава тела методом биоимпедансометрии до и после приема разработанных пищевых продуктов
Показатели ИМТ перед проведением эксперимента варьировали в диапазоне от 17,53 до 42,97 кг/м², в среднем, ИМТ составил 25,46 кг/м². Средний ИМТ среди женщин составил 25,25±4,77 кг/м² и 25,97±3,66 кг/м² среди мужчин. Значения ИМТ после проведения эксперимента были близки к исходному диапазону и варьировали от 18,4 до 43 кг/м², составив, в среднем, 25,34 кг/м². Средний ИМТ среди женщин составил 25,3±4,8 кг/м², среди мужчин — 25,6±3,46 кг/м².
Процент жировой ткани в теле участников перед проведением эксперимента находился в диапазоне значений от 13,8 до 44,7%. Среднее значение в группе было 25,05%, более высокий показатель выявлен среди женщин — 26,7±5,8% и меньший среди мужчин — 21,2±3,9%.
Процент жировой ткани участников после проведения эксперимента находился в пределах от 16,7 до 44,2%, в среднем, он составил 24,97%. Процент жировой ткани среди женщин составил, в среднем, 26,9±5,4%, среди мужчин — 20,8±2,68%.
Прием фруктово-ягодных батончиков не оказывал существенного влияния на средние показатели ИМТ и процент жировой ткани ни среди женщин, ни среди мужчин. За время эксперимента у 13 участников МТ существенно не изменилась (±2 кг), у 1 участника МТ снизилась на 7 кг. Следует отметить, что данный участник соблюдал собственную программу питания для снижения МТ. У 3 участников отмечена прибавка МТ на 2,5-4 кг и у 1 участницы — на 15 кг. Участница с самым большим приростом МТ была носителем полиморфизмов генов фолатного цикла и имела самый высокий показатель ИМТ среди испытуемых. Уровень гомоцистеина крови у данной участницы до потребления фруктово-ягодных батончиков составлял 19,7 мкмоль/л, однако, как уже отмечалось ранее, на фоне приема обогащенной продукции он снизился. Эти результаты согласуются с результатами исследований о связи избыточного веса и ожирения у носителей Т-аллеля полиморфизма rs1801133 гена MTHFR с низким потреблением фолатов и повышением уровня гомоцистеина крови [12][17]. Несмотря на значительный прирост МТ у данной участницы, прием обогащенного пищевого продукта, сопровождался снижением уровня гомоцистеина крови до референсных значений (14,3 мкмоль/л). Однако такая выраженная прибавка МТ требует более детального изучения и результаты обследования этой участницы за рамками представленной работы.
Итоги прогнозирования с помощью ИНС
Попарные сравнения изучаемых показателей с Hc1 выявили значимые корреляции только с частью оцениваемых параметров, которые представлены в таблице 5. Обращает на себя внимание умеренная отрицательная корреляция с частотой потребления красного мяса; возможным объяснением может быть то, что лица, реже включающие в рацион красное мясо, потребляют больше растительных продуктов, в т.ч. и пищевые источники фолатов. Зависимость между величинами Hc1 и полом участников, продолжительностью ночного сна, ИМТ, МТ, частотой мутаций (MTR 2756 A>G и MTRR 66 A>G) не выявили статистически значимой или выраженной корреляции (р>0,05 или r<0,25). Также не было отмечено значимых корреляций между Hc2 и возрастом участников, частотой потребления красного мяса, ИМТ, частотой мутаций MTHFR 1298 A>C, MTR 2756 A>G, MTRR 66 A>G. Результаты расчета остальных корреляций проведенного анализа представлены в таблице 5. Следует отметить, что только в 4 случаях корреляция носила умеренный или высокий уровень, все остальные результаты корреляций имели либо слабый уровень, либо были незначимыми.
Таблица 5
Корреляции между Hc1 и Hc2 и остальными группами данных
№ | Попарное сравнение с Hc1 | r | Попарное сравнение с Hc2 | r |
1 | Частота потребления красного мяса | -0,31 | Частота ответов участников о повышенном уровне глюкозы у них в крови | -0,24 |
2 | Частота ответов участников о повышенном уровне глюкозы у них в крови | -0,24 | Рост | -0,21 |
3 | Генетический MTHFR 1298 A>C | -0,17 | ИМТ¹ | 0,12 |
4 | Возраст | -0,16 | Количество часов сна | 0,12 |
5 | Окружность талии | -0,15 | Количество приемов пищи | 0,14 |
6 | Количество приемов пищи | -0,12 | Биологический пол | 0,15 |
7 | Жировая МТ | 0,12 | Частота ответов о желании похудеть | 0,73 |
8 | Жировая МТ¹ | 0,17 | ||
9 | Частота ответов участников о повышенном уровне холестерина у них в крови | 0,24 | ||
10 | Частота мутации MTHFR 677 C>T | 0,35 | ||
11 | Частота ответов о желании похудеть | 0,55 |
Примечание: из таблицы были убраны значения корреляции при p>6,74×10-5,
r — величина корреляции по Пирсону; значения более r=0,3
(умеренный уровень корреляции и выше) выделены чертой;
¹ — значения, полученные по биоимпендансному анализу состава тела
после курса приема разработанных продуктов.
Hc1 — уровень гомоцистеина до 3-месячного курса
потребления фортифицированных продуктов
и Hc2 — уровень гомоцистеина после 3-месячного курса
потребления фортифицированных продуктов.
Самая высокая корреляция выявлена между значениями Hc1 и Hc2 и желанием участников снизить МТ. Полученные результаты в определенной мере согласуются с научными данными о связи фолат-дефицитных состояний с повышенной МТ [12][17]. Однако на показатель МТ обоснованно влияет и ряд других факторов (сочетанный вклад), по этой причине для выявления и ранжирования содействия этих факторов необходимо продолжить исследования в этой области.
Не отрицая физиологического влияния метилированных производных витаминных препаратов, можно предположить, что уровень гомоцистеина до и после курса приема разработанных продуктов питания связан и с психологическими установками самих участников. А именно, часть участников данного эксперимента, согласно анкетированию, отнеслись к исследованию как к реальной возможности скорректировать МТ (высказанные желания, как минимум, половины участников похудеть, более того некоторые из этих участников действительно начали снижение МТ). Не исключено, что участники, высказавшие желание снизить МТ, корректировали свой рацион более выраженно, чем остальные участники исследования, что позволило снизить калорийность пищевой нагрузки. Результаты научных исследований показывают, что потребление высококалорийной пищи приводит к повышению уровня гомоцистеина за счет истощения пула метионина как источника метильных групп [17].
Возможно, более сильная мотивация к снижению МТ могла косвенно отразиться на величине снижения уровня гомоцистеина в крови, по причине более внимательного отношения к своему рациону. У тех, кто высказал желание похудеть, снижение уровня гомоцистеина составило 1,67 мкмоль/л, а у тех, кто такого желания не высказывал при анкетировании, — 1,48 мкмоль/л, с тенденцией к статистической значимости (p=0,059).
Более важными, на наш взгляд, являются полученные результаты о корреляции мутаций в гене MTHFR с уровнем гомоцистеина крови. Ранее схожие зависимости были продемонстрированы при популяционных генетических исследованиях при выявлении единичных мутаций [9-12].
В целом, настоящая работа — это пилотное исследование. Однако полученные результаты согласуются с данными, ранее опубликованными в научной литературе, хотя и ставят новые вопросы для исследовательских работ и поиска ответов на них. Выполненное на малой группе участников исследование обосновало необходимость в более глубоких исследованиях с выделением целевых контингентов и проведением клинических протоколов по методу случай-контроль. Несомненно, ввиду важности темы коррекции фолат-дефицитных состояний, поисковые работы в данном направлении целесообразно продолжать.
Заключение
В ходе эксперимента по приему разработанных фруктово-ягодных батончиков, обогащенных метилфолатом, метилкобаламином и пиридоксина гидрохлоридом, было обнаружено значимое снижение уровня гомоцистеина крови (p=0,028) в группе участников исследования.
Использование в анализе алгоритмов машинного обучения позволило выявить корреляции между уровнями гомоцистеина и ИМТ, наличием в анамнезе повышенного уровня глюкозы крови (p<6,74×10-5) и желанием участников скорректировать МТ.
Полученные результаты также позволяют прогнозировать перспективность исследований в области анализа связи уровня гомоцистеина крови с такими показателями, как уровень глюкозы крови и склонность к ожирению, также, как и продолжения поиска новых форм и подходов фортификации пищевой продукции для более эффективной коррекции фолат-дефицитных состояний.
Отношения и деятельность. Исследование выполнено за счет гранта Российского научного фонда № 22-26-00242, https://rscf.ru/project/22-26-00242/.
Список литературы
1. Koklesova L, Mazurakova A, Samec M, et al. Homocysteine metabolism as the target for predictive medical approach, disease prevention, prognosis, and treatments tailored to the person. EPMA J. 2021;12;4:477-505. doi:10.1007/s13167-021-00263-0.
2. Crider KS, Qi YP, Yeung LF, et al. Folic Acid and the Prevention of Birth Defects: 30 Years of Opportunity and Controversies. Ann Rev Nutr. 2022;42:423-52. doi:10.1146/annurev-nutr-043020-091647.
3. Rui WY, Zheng L, Han LH, et al. Research Progress on the Correlation between Hyperhomocysteinemia and Arteriosclerosis Obliteran. J Biomed Res Environ Sci. 2022;3(10):1257-68. doi:10.37871/jbres1587.
4. Venn BJ, Green TJ, Moser R, et al. Increases in blood folate indices are similar in women of childbearing age supplemented with [6 S]5-methyltetrahydrofolate and folic acid. J Nutr. 2002;132;11:33535. doi:10.1093/jn/132.11.3353.
5. Seshadri S, Beiser A, Selhub J, et al. Plasma homocysteine as a risk factor for dementia and Alzheimer's disease. New Engl J Med. 2002;346;7:476-83. doi:10.1056/NEJMoa011613.
6. Andari Sawaya R, Jaffe J, Friedenberg L, et al. Vitamin, mineral, and drug absorption following bariatric surgery. Curr Drug Metab. 2012;13;9:1345-55. doi:10.2174/138920012803341339.
7. Blom HJ, Smulders Y. Overview of homocysteine and folate metabolism. With special references to cardiovascular disease and neural tube defects. J Inherit Metab Dis. 2011;34:75-81. doi:10.1007/s10545-010-9177-4.
8. Ménézo Y, Patrizio P, Alvarez S, et al. MTHFR (methylenetetrahydrofolate reductase: EC 1.5. 1.20) SNPs (single-nucleotide polymorphisms) and homocysteine in patients referred for investigation of fertility. J Assist Reprod. Genet. 2021;38;9:23839. doi:10.1007/s10815-021-02200-6.
9. Tsang BL, Devine OJ, Cordero AM, et al. Assessing the association between the methylenetetrahydrofolatereductase (MTHFR) 677C>T polymorphism and blood folate concentrations: a systematic review and meta-analysis of trials and observational studies. Am J Clin Nutr. 2015;101:1286-94. doi:10.3945/ajcn.114.099994.
10. Li MN, Wang HJ, Zhang NR, et al. MTHFR C677T gene polymorphism and the severity of coronary lesions in acute coronary syndrome. Medicine (Baltimore). 2017;96(49):e9044. doi:10. 1097/MD.0000000000009044.
11. Liew SC, Gupta ED. Methylenetetrahydrofolate reductase (MTHFR) C677T polymorphism: epidemiology, metabolism and the associated diseases. Eur J Med Genet. 2015;58;1:1-10. doi: 10.1016/j.ejmg.2014.10.004.
12. Kalashnikova EA, Kokarovceva SN. Polymorphism of folate metabolism genes and human diseases. Medical Genetics. 2005;8:386-91. (In Russ.) Калашникова Е. А., Кокаровцева С. Н. Полиморфизм генов фолатного обмена и болезни человека. Медицинская генетика. 2005;8:386-91.
13. Hiraoka M, Kagawa Y. Genetic polymorphisms and folate status. Congenit Anom (Kyoto). 2017;57(5):142-9. doi:10.1111/cga.12232.
14. Shrubsole MJ, Gao YT, Cai Q, et al. MTR and MTRR Polymorphisms, Dietary Intake, and Breast Cancer Risk. Cancer Epidemiol Biomarkers Prev. 2006;15(3):586-8. doi:10.1158/1055-9965.EPI-05-0576.
15. Xu A, Wang W, Jiang X. The roles of MTRR and MTHFR gene polymorphisms in congenital heart diseases: a meta-analysis. Biosci Rep. 2018;38(6):BSR20181160. doi:10.1042/BSR20181160.
16. Guo QN, Wang HD, Tie LZ, et al. Parental genetic variants, MTHFR 677C>T and MTRR 66A>G, associated differently with fetal congenital heart defect. Biomed Res Int. 2017:3043476. doi: 10.1155/2017/3043476.
17. Погожева А. В., Сорокина Е. Ю., Аристархова Т. В. Изучение связи полиморфизма rs 1801133 гена MTHFR с дефицитом фолиевой кислоты у больных ожирением. Альманах клинической медицины. 2018;46;3:254-7. doi:10.18786/2072-0505-2018-46-3-254-257.
18. Балашова М. С., Никитин И. А., Орлова О. Ю. и др. Потребление фолатов: обзор литературы и результаты анкетирования с помощью адаптированного опросника Food Frequency Questionnaire. Вопросы диетологии. 2023;13(1):219. doi:10.20953/2224-5448-2023-1-21-29.
19. Sokal RR, Rohlf FJ. Biometry: The Principles and Practice of Statistics in Biological Research. 4th ed. W. H. Freeman: New York, 2012:937. ISBN: 978-0-7167-8604-7.
20. Николенко С., Кадурин А., Архангельская Е. Глубокое обучение. Погружение в мир нейронных сетей. СПб.: Питер, 2018. p. 480. ISBN: 978-5-4461-1537-2.
21. Gorbachev V, Nikitina M, Velina D, et al. Artificial Neural Networks for Predicting Food Antiradical Potential. Appl. Sci. 2022;12:6290. doi:10.3390/app12126290.
22. Song Q, Zheng YJ, Yang J. Effects of Food Contamination on Gastrointestinal Morbidity: Comparison of Different MachineLearning Methods. International Journal of Environmental Research and Public Health. 2019;16;5:838. doi:10.3390/ijerph16050838.
23. Guiné RPF. The Use of Artificial Neural Networks (ANN) in Food Process Engineering. IJFE. 2019;15-21. doi:10.18178/ijfe.5.1.15-21.
24. Gorbachev V, Nikulchev E, Kosenkov AN, et al. Estimating the Mass of Food Components Necessary for the Utilization of Free Radical Particles in the Human Body. Int J Environ Res Public Health. 2022;19:15574. doi:10.3390/ijerph192315574.
Об авторах
М. С. БалашоваРоссия
Мария Сергеевна Балашова — кандидат медицинских наук, доцент кафедры медицинской генетики Института клинической медицины им. Н. В. Склифосовского
Москва
Ш. Муталлибзода
Россия
Шерзодхон Муталлибзода — ассистент кафедры биотехнологий продуктов питания из растительного и животного сырья МГУТУ им. К.Г. Разумовского (ПКУ), младший научный сотрудник НИЛ "Биотехнологии пищевых систем" кафедры пищевых технологий и биоинженерии РЭУ им. Г.В. Плеханова
Москва
Д. А. Велина
Россия
Дарья Александровна Велина — младший научный сотрудник НИЛ "Биотехнологии пищевых систем" кафедры пищевых технологий и биоинженерии
Москва
О. Б. Швабская
Россия
Ольга Борисовна Швабская — научный сотрудник лаборатории эпидемиологии питания
Москва
В. В. Горбачев
Россия
Виктор Валерьевич Горбачев — младший научный сотрудник НИЛ "Биотехнологии пищевых систем" кафедры пищевых технологий и биоинженерии
Москва
И. А. Никитин
Россия
Игорь Алексеевич Никитин — доктор технических наук, доцент, заведующий кафедрой биотехнологий продуктов питания из растительного и животного сырья МГУТУ им К.Г. Разумовского (ПКУ); заведующий кафедрой пищевых технологий и биоинженерии РЭУ им Г.В. Плеханова
Москва
Что известно о предмете исследования?
- Уровень гомоцистеина крови зависит от ряда генетических и эпигенетических факторов.
- У лиц с полиморфизмами генов фолатного цикла (MTHFR, MTR и MTRR) имеются нарушения метаболизма гомоцистеина.
Что добавляют результаты исследования?
- Выявлены корреляции между уровнем гомоцистеина и ИМТ, а также наличием в анамнезе повышенного уровня глюкозы крови. Отмечено, что участники исследования, соблюдавшие диетические ограничения, на момент окончания исследования имели более низкие уровни гомоцистеина крови, чем лица, находящиеся на обычном рационе питания (p<6,74×10-5).
- Коррекция уровня гомоцистеина крови возможна с помощью применения пищевых продуктов, обогащенных метилфолатом, метилпроизводными кобаламина и пиридоксина гидрохлоридом.
Рецензия
Для цитирования:
Балашова М.С., Муталлибзода Ш., Велина Д.А., Швабская О.Б., Горбачев В.В., Никитин И.А. Использование пищевых продуктов, фортифицированных метилированными формами витаминов группы В, для профилактики гипергомоцистеинемии. Кардиоваскулярная терапия и профилактика. 2023;22(9):3680. https://doi.org/10.15829/1728-8800-2023-3680. EDN: KZITPY
For citation:
Balashova M.S., Mutallibzoda Sh., Velina D.A., Shvabskaya O.B., Gorbachev V.V., Nikitin I.A. Fortified foods with methylated forms of B vitamin for the prevention of hyperhomocysteinemia. Cardiovascular Therapy and Prevention. 2023;22(9):3680. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3680. EDN: KZITPY
JATS XML

























































