Перейти к:
Факторы, определяющие прогноз после плановой реваскуляризации миокарда у больных ишемической болезнью сердца с мультифокальным атеросклеротическим поражением
https://doi.org/10.15829/1728-8800-2023-3689
EDN: RKNHSL
Аннотация
Цель. Выявить факторы, определяющие прогноз после плановой реваскуляризации миокарда у больных ишемической болезнью сердца (ИБС) с мультифокальным атеросклерозом (МФА).
Материал и методы. Исследование основано на проспективном РЕГистре Антитромботической ТерАпии (РЕГАТА-1), ClinicalTrials NCT04347200 (1500 больных стабильной ИБС, 78,6% мужчин, возраст 65±8,7 лет). Отобрано 238 больных с МФА, критериями которого являлась многососудистая ИБС (не <2-х артерий) в сочетании со стенозирующим поражением (≥50%) как минимум одного из периферических сосудистых бассейнов. Условием отбора было выполнение плановой реваскуляризации миокарда с последующей двойной антитромбоцитарной терапией в течение как минимум 6-12 мес. Проанализированы прогноз-определяющие негативные исходы, а именно — тромботические осложнения (ТО) в любых сосудистых бассейнах и геморрагические осложнения (BARC 2-5). Результаты. Медиана наблюдения составила 859 дней, интерквартильный размах [523;1665]. В структуре осложнений преобладали тромбозы: суммарная частота ТО составила 18,5% (в т.ч. фатальных — 4,2%), а суммарная частота кровотечений — 7,5% (в т.ч. BARC 3-1,7%). Предикторами ТО оказались: курение (отношение рисков (ОР)=2,18), перенесенные более года назад инфаркт миокарда (ОР=2,6) и ишемический инсульт/транзиторная ишемическая атака (ОР=2,81), а также реваскуляризация с помощью чрескожного коронарного вмешательства (ЧКВ) в сравнении с коронарным шунтированием. Для ЧКВ прогноз был хуже в случае неполной реваскуляризации, а также при ограничении вмешательства ≤2 сегментами артерий и суммарной длине стентов <26 мм. Среди всех предикторов неблагоприятного прогноза наиболее значимым оказалось выполнение подобных ЧКВ "высокого риска" в сочетании с двойной антитромбоцитарной терапией <12 мес. (ОР=6,7).
Заключение. Впервые выявлены предикторы развития ТО у больных ИБС и МФА, которые позволят улучшить вторичную профилактику у категории больных, обладающей крайне высоким риском ТО.
Ключевые слова
Для цитирования:
Хакимова М.Б., Комаров А.Л., Кривошеева Е.Н., Миронов В.М., Курбанов С.К., Кузякина С.О., Яровая Е.Б., Панченко Е.П. Факторы, определяющие прогноз после плановой реваскуляризации миокарда у больных ишемической болезнью сердца с мультифокальным атеросклеротическим поражением. Кардиоваскулярная терапия и профилактика. 2023;22(9):3689. https://doi.org/10.15829/1728-8800-2023-3689. EDN: RKNHSL
For citation:
Khakimova M.B., Komarov A.L., Krivosheeva E.N., Mironov V.M., Kurbanov S.K., Kuzyakina S.O., Yarovaya E.B., Panchenko E.P. Factors determining the prognosis after elective myocardial revascularization in patients with coronary artery disease with multifocal atherosclerosis. Cardiovascular Therapy and Prevention. 2023;22(9):3689. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3689. EDN: RKNHSL
Введение
Ишемическая болезнь сердца (ИБС) и, в первую очередь, ее стабильные проявления занимают лидирующее место в структуре заболеваемости населения Российской Федерации и других развитых стран [1]. Не вызывает сомнений потребность в точной оценке прогноза при стабильной ИБС, учитывая "волнообразное" течение заболевания с плохо предсказуемыми обострениями, а также существующие в настоящее время возможности инвазивного и консервативного лечения, призванные улучшить исходы именно в группах высокого риска.
Еще со времен Фремингемского исследования была установлена взаимосвязь осложнений ИБС с клиническими факторами — курением, артериальной гипертонией, сахарным диабетом, гиперлипидемией и предшествующими тромботическими осложнениями (ТО) в коронарном и цереброваскулярном бассейнах [2]. В свою очередь, совершенствование ангиографических технологий и широкое внедрение в практику эндоваскулярных методов лечения ИБС способствовало поиску ангиографических предикторов неблагоприятного прогноза и формированию понятия "сложной" или "комплексной" процедуры чрескожного коронарного вмешательства (ЧКВ) [3], включающего многососудистое и/или протяженное стентирование, вмешательство на стволе левой коронарной артерии, единственном проходимом сосуде, хронической коронарной окклюзии.
Особое место в панели факторов риска (ФР) занимает распространенное или мультифокальное атеросклеротическое поражение (МФА), подразумевающее одновременное вовлечение в атеросклеротический процесс как минимум двух артериальных бассейнов. Применительно к обсуждаемой категории больных ИБС речь обычно идет о многососудистом поражении коронарного русла в сочетании с гемодинамически значимыми стенозами любых периферических артерий (чаще всего — сонных и/или нижних конечностей) [4]. По данным ряда крупных международных исследований, таких как REACH (The Reduction of Atherothrombosis for Continued Health) [5], AGATHA (a Global Atherothrombosis Assessment) [6], COMPASS (Cardiovascular Outcomes for People Using Anticoagulation Strategies) [7] и других, около четверти больных стабильной ИБС имеют критерии МФА, и именно эта категория пациентов характеризуется наиболее высоким риском ТО в любом из заинтересованных сосудистых бассейнов.
Согласно современным представлениям, лечение больных стабильной ИБС с МФА обычно включает реваскуляризацию пораженного сосудистого бассейна одновременно с интенсификацией антитромботической терапии, а именно — длительным назначением в дополнение к аспирину второго антитромботического препарата [8]. Структура прогноз-определяющих негативных исходов, равно как и панель ФР, сохраняющих прогностическую значимость в условиях такого комплексного подхода к лечению у обсуждаемой категории больных изучены недостаточно.
Вышеизложенное определило цель нашего исследования, направленного на поиск факторов, определяющих прогноз после плановой реваскуляризации миокарда у больных ИБС с МФА.
Материал и методы
Критерии отбора больных
Исследование основано на данных одноцентрового когортного проспективного РЕГистра Антитромботической ТерАпии (РЕГАТА-1), ClinicalTrials NCT04347200, созданного на базе ФГБУ "НМИЦ кардиологии имени акад. Е. И. Чазова" Минздрава России и соответствует основным этическим принципам проведения медицинских исследований согласно Хельсинкской декларации по правам человека. Все пациенты подписали информированное согласие на участие в регистре, протокол исследования был одобрен локальным этическим комитетом. Общее количество пациентов со стабильной ИБС, включенных в регистр, составило 1500 человек, среди которых была отобрана группа больных наиболее высокого риска (с МФА), имевших многососудистое поражение коронарного русла (не <2-х артерий) и гемодинамически значимое атеросклеротическое поражение (≥50%) как минимум одного из периферических сосудистых бассейнов. Еще одним критерием отбора было выполнение на этапе включения плановой реваскуляризации миокарда (ЧКВ или коронарного шунтирования — КШ) с последующим обязательным приемом двойной антитромбоцитарной терапии (ДАТТ) аспирином и клопидогрелом в течение как минимум 6-12 мес.
Не включали больных с противопоказаниями к ДАТТ, связанными, прежде всего, с высоким риском кровотечений [9], в т.ч. с анамнезом внутричерепного кровотечения, недавним кровотечением или анемией вследствие потери крови из желудочно-кишечного тракта, потребностью в приеме лечебных доз антикоагулянтов, выраженной почечной или печеночной недостаточностью, а также синдромом старческой хрупкости или астении и другими тяжелыми нарушениями функции органов и систем, способными оказать самостоятельное влияние на прогноз.
Проводимое лечение
Все больные на этапе включения были подвергнуты плановым процедурам ЧКВ (n=125) или КШ (n=113), а выбор метода реваскуляризации оставался на усмотрение лечащих врачей.
Среди пациентов, подвергнутых КШ, у 50% предоперационно по ангиографическим характеристикам и интраоперационно состояние коронарных артерий было расценено как "диффузное поражение". Для такой категории пациентов сохранялся принцип полной реваскуляризации миокарда, заключающийся в создании сложных коронарных реконструкций с использованием микрохирургической техники (протяженных шунтов бок-в-бок, эндартерэктомии из коронарных артерий, реваскуляризации артерий диаметром <1,5 мм) [10].
При выполнении ЧКВ ориентировались в первую очередь на степень стеноза, визуально определенную при ангиографии, дополнительные методы оценки (функциональные и структурные) использовались крайне редко. Регистровый характер исследования не позволил выполнить подсчет баллов по шкале SYNTAX (TAXUS Drug-Eluting Stent Versus Coronary Artery Bypass Surgery for the Treatment of Narrowed Arteries) у всех включенных больных. Тем не менее, сочли правильным оценить другие ангиографические характеристики, отражающие объем и сложность выполненной процедуры ЧКВ [3]. Так, у 37 (30,3%) пациентов вмешательство затрагивало ствол левой коронарной и/или проксимальный сегмент передней нисходящей артерии, а у 31 (25%) пациента выполняли реканализацию хронической окклюзии. Несмотря на имевшееся многососудистое поражение коронарных артерий (обязательный критерий включения), обращала на себя внимание относительно небольшая протяженность вмешательства. В пересчете на одного пациента число сосудистых сегментов, подвергнутых ЧКВ, как и число имплантированных стентов, равнялось 1 интерквартильному размаху (ИКР) [ 1; 2], а суммарная длина имплантированных стентов составила 32 мм, ИКР [ 24; 48 мм]. Логично, что в 30,3% случаев (n=37) полная реваскуляризация достигнута не была. Для выполнения вмешательства использовались исключительно современные стенты 2-3 поколения с лекарственным покрытием.
Все больные получали антиангинальную, антитромботическую, гиполипидемическую терапию согласно рекомендациям Российского кардиологического общества, действовавшим на момент включения в исследование. Всем пациентам была назначена ДАТТ — аспирин 75-100 мг/сут., клопидогрел 75 мг/сут. (43,8% принимали препарат оригинального производства) длительностью не <6-12 мес. не только после ЧКВ, но и после КШ. Последний подход, не нашедший пока отражения в рекомендациях РКО, входит в стандарты рутинной клинической практики "НМИЦ кардиологии" Минздрава России и относится к пациентам высокого риска окклюзии шунтов. Допускалось продление ДАТТ >12 мес. на усмотрение лечащего врача при хорошей переносимости препарата.
Плановые визиты в клинику осуществлялись через 6 и 12 мес. после проведения реваскуляризации миокарда, а 1 раз в 3 мес. проводилось телефонное анкетирование. Во время плановых визитов в клинику при необходимости осуществлялась коррекция гиполипидемической, антиангинальной и антигипертензивной терапии. Минимальный запланированный период наблюдения составлял 2 года. При отсутствии побочных эффектов и прогноз-определяющих исходов за первые 12 мес. в дальнейшем плановые визиты осуществлялись 1 раз в 12 мес.
Конечные точки исследования
ТО определяли как сумму следующих событий: сердечно-сосудистой смерти, острого коронарного синдрома (ОКС), ишемического инсульта (ИИ), транзиторной ишемической атаки (ТИА), тромбоэмболии легочной артерии, тромбоза периферических артерий, а также случаев усугубления клинической картины ишемии, определяющей потребность в проведении внеплановой ангиографии/реваскуляризации пораженного артериального бассейна.
Геморрагические осложнения (ГО) включали все случаи больших и клинически значимых кровотечений, определенных в соответствии с классификацией академического исследовательского консорциума — BARC (Bleeding Academic Research Consortium) 2-5.
Статистический анализ. При статистической обработке использовались стандартные пакеты программы Statistica 12.0 (Statsoft Inc., Tulsa, USA), MedCalc 20.0 (MedCalc Software Ltd, Ostende, Belgium) и R 4.2.2 (R Core Team, Vienna, Austria). Для сравнения дискретных переменных использовали критерий χ² Пирсона, при малом количестве наблюдений — точный тест Фишера. Для определения нормальности распределения количественных переменных использовали тест Шапиро-Уилка. При сравнении непрерывных переменных с нормальным распределением применяли t-тест для двух независимых выборок, и значения переменных представлялись как среднее и стандартное отклонение (М±SD). При сравнении количественных переменных, которые не соответствовали нормальному распределению, их значения представлялись в виде медиан (Me) с указанием ИКР (Q25-Q75), а для их сравнения применялся непараметрический ранговый критерий Манна-Уитни. Построение кривых дожития без ТО выполнено с помощью метода Каплана-Мейера. Для оценки достоверности полученных данных использовали логарифмический ранговый критерий, а также отдельно проводили расчет отношения рисков (ОР) между группами и их 95% доверительные интервалы (ДИ). Для выявления предикторов ТО использовали регрессионную модель пропорциональных рисков Кокса. При построении модели применяли прямой метод пошагового включения переменных (Forward). В модель вошли переменные со значением критерия статистической значимости по результатам однофакторного анализа <0,05. Для каждого показателя модели приведены ОР и их 95% ДИ.
Результаты
Характеристика больных, включенных в исследование (средний возраст 64,7±8,7 лет, 80% мужчин), и сопоставление групп с наличием и отсутствием ТО представлена в таблице 1.
Таблица 1
Клиническая характеристика больных ИБС и МФА,
включенных в исследование (n=238)
Показатель | Все пациенты, n=238 | ТО+ (1), n=44 | ТО- (2), n=194 | p (1 vs 2) |
Мужчины, n (%) | 191 (80) | 38 (86) | 153 (78,8) | 0,260 |
Возраст, лет (M±SD) | 64,7±8,7 | 63,8±9,4 | 65±8,5 | 0,416 |
ИМТ ≥30 кг/м², n (%) | 105 (44) | 14 (31,8) | 91 (47) | 0,069 |
Артериальная гипертония, n (%) | 218 (91,6) | 40 (90,9) | 178 (91,75) | 0,856 |
Сахарный диабет, n (%) | 76 (32) | 14 (31,8) | 62 (40) | 0,986 |
Курение в анамнезе, n (%) | 105 (44) | 28 (63,6) | 77 (39,7) | 0,004 |
Хроническая болезнь почек (СКФ <60 мл/мин), n (%) | 31 (13) | 3 (6,8) | 28 (14,4) | 0,176 |
ХСН с ФВ <50%, n (%) | 45 (19) | 13 (30) | 32 (16,5) | 0,046 |
ИБС | ||||
Индексная реваскуляризация на этапе включения в исследование ЧКВ/КШ, n (%) | 125 (52,5)/113 (47,5) | 29 (66)/15 (34,1) | 96 (50)/97 (50) | 0,057 |
Стенокардия напряжения 2-3 ФК | 215 (90,3) | 37 (84) | 178 (91,7) | 0,121 |
Повторные ОКС в анамнезе | 18 (7,56) | 6 (14) | 12 (6,2) | 0,092 |
ИМ в анамнезе >1 года назад, n (%) | 134 (56,3) | 32 (73) | 102 (52,6) | 0,015 |
Сопутствующий атеросклероз периферических артерий | ||||
Атеросклеротическое поражение брахиоцефальных артерий, n (%) | 221 (92,8) | 42 (95) | 179 (92,2) | 0,460 |
Атеросклеротическое поражение артерий нижних конечностей, n (%) | 90 (37,8) | 19 (43) | 71 (36,6) | 0,417 |
Перемещающаяся хромота IIA-IIБ стадии, n (%) | 62 (26) | 15 (34,1) | 47 (24,2) | 0,186 |
Аневризма брюшного отдела аорты, n (%) | 21 (8,8) | 4 (9) | 17 (8,7) | 0,945 |
Реваскуляризация периферических артерий в анамнезе, n (%) | 33 (13,8) | 7 (16) | 26 (13,4) | 0,665 |
ИИ и/или ТИА в анамнезе, n (%) | 33 (13,9) | 12 (27,3) | 21 (10,8) | 0,005 |
Количество пораженных сосудистых бассейнов | ||||
2 периферических бассейна + коронарные артерии, n (%) | 71 (29,8) | 15 (34) | 51 (26,2) | 0,298 |
≥3 периферических бассейна + коронарные артерии, n (%) | 20 (8,4) | 18 (40) | 66 (34) | 0,389 |
Примечание: данные представлены в виде Me (Q25-Q75), M±SD или n (%).
ИБС — ишемическая болезнь сердца,
ИИ — ишемический инсульт,
ИМТ — индекс массы тела,
ИМ — инфаркт миокарда,
КШ — коронарное шунтирование,
МФА — мультифокальный атеросклероз,
ОКС — острый коронарный синдром,
СКФ — скорость клубочковой фильтрации,
ТИА — транзиторная ишемическая атака,
ТО — тромботические осложнения,
ФВ — фракция выброса,
ФК — функциональный класс,
ХСН — хроническая сердечная недостаточность,
ЧКВ — чрескожное коронарное вмешательство.
Обращает на себя внимание весьма высокая частота ключевых ФР — медикаментозно компенсированной артериальной гипертонии (91,6%), курения в анамнезе (44%), индекса массы тела >30 кг/м² (44%), сахарного диабета (32%). Более половины пациентов перенесли инфаркт миокарда (ИМ) больше года назад (медиана от ИМ до включения в исследования составляет 20,4 мес.), каждый пятый больной имел хроническую сердечную недостаточность со сниженной фракцией выброса, в подавляющем большинстве случаев обусловленную постинфарктным кардиосклерозом.
В соответствии с критериями отбора все больные имели сопутствующие стенозы ≥50% как минимум одного из периферических сосудистых бассейнов, в т.ч. сонных артерий (92,8%) и артерий нижних конечностей (37,8%). Атеротромботический инсульт и/или ТИА (больше года назад) перенесли 13,8% пациентов, а клиника перемежающейся хромоты IIA-IIБ стадии отмечена у каждого четвертого больного.
Характеристика исходов, зарегистрированных в период проспективного наблюдения. Медиана наблюдения составила 859 дней (ИКР [ 523; 1665]). За этот период времени суммарная частота ТО составила 18,5% (в т.ч. фатальных — 4,2%), а суммарная частота ГО — 7,5% (в т.ч. BARC 3-1,7%), что соответствовало 7,2 случаев ТО на 100 пациенто-лет. Среди всех ТО большинство (81,8%) произошло в коронарном бассейне, в т.ч. внезапная сердечная смерть — 4 (1,7%) случая, ОКС — 7 (2,9%), потребность во внеплановой реваскуляризации из-за усугубления стенокардии с проведением ЧКВ и КШ соответственно — 21 (8,8%) и 1 (0,4%), и 18,2% в периферических сосудистых бассейнах, в т.ч. ишемический инсульт — 1 (0,4%), острая ишемия, обусловленная тромбозом периферических артерий — 6 (2,6%).
За все время наблюдения не было зарегистрировано ни одного фатального или жизнеугрожающего кровотечения. Частота ГО составила 2,96 случаев на 100 пациенто-лет Основными источниками кровотечений являлись слизистая верхних отделов желудочно-кишечного тракта (45% от всех ГО) и носовой полости — 4 случая (22% от всех ГО). Как видно из рисунка 1 А, большинство случаев кровотечений произошли в период ДАТТ, медиана приема которой составила около года (380 дней, ИКР [ 346; 447]). В отличие от кровотечений ТО регистрировались примерно с одинаковой частотой на протяжении всего периода наблюдения (медиана до развития ТО составила 703 дня, ИКР [ 353; 1033]. Анализ актуарной кривой не продемонстрировал каких-либо изменений накопительной частоты ТО (рисунок 1 Б) в связи с окончанием "стандартного" периода ДАТТ 6-12 мес.
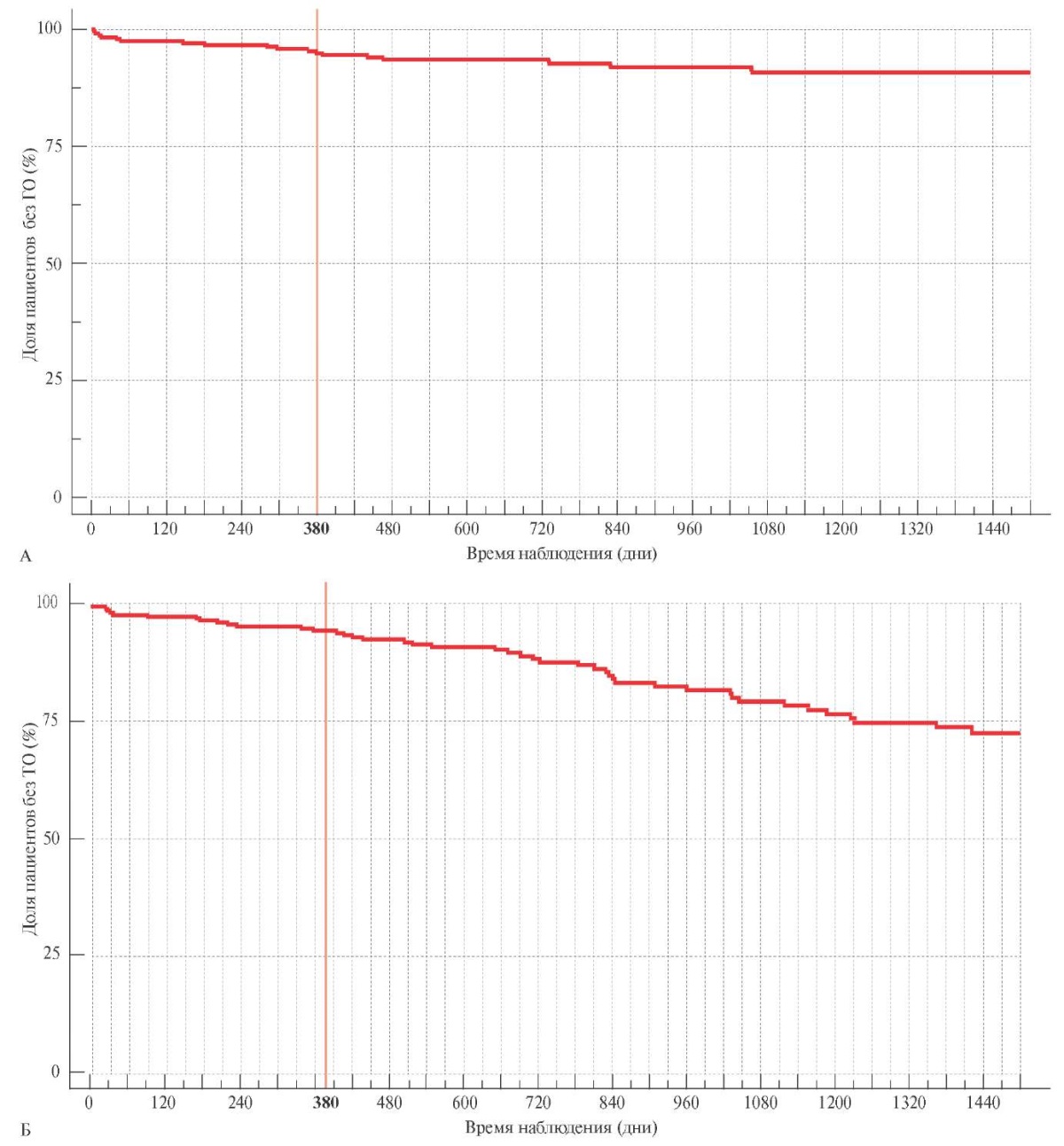
Рис. 1 Накопительные кривые ГО (А) и ТО (Б) за 1500 дней наблюдения.
Примечание: ГО — геморрагические осложнения,
ТО — тромботические осложнения.
Таким образом, несмотря на реваскуляризацию (ЧКВ с имплантацией стентов последних поколений или КШ) и назначение ДАТТ в течение как минимум "стандартного" периода времени, прогноз больных МФА определялся ТО, среди которых каждое пятое событие оказалось непосредственной причиной смерти. Учитывая структуру прогноз-определяющих негативных исходов, дальнейшее направление настоящей работы было связано с поиском предикторов ТО.
Поиск предикторов ТО у больных ИБС и МФА, подвергнутых реваскуляризации миокарда
Результаты однофакторного анализа продемонстрировали хорошо известную взаимосвязь ТО с "классическими" сосудистыми ФР. Действительно, группа пациентов с развившимися ТО характеризовалась достоверно большей исходной частотой курения, перенесенных ИМ и ИИ/ТИА, а также хронической сердечной недостаточностью со снижением фракции выброса (таблица 1). Кроме того, у больных, перенесших ТО в период проспективного наблюдения, несколько чаще выполнялась исходная коронарная реваскуляризация с помощью ЧКВ, нежели, чем КШ (66 vs 34,1%, р=0,056). У больных, переживших период наблюдения без осложнений, подобной разницы в отношении метода начальной реваскуляризации обнаружено не было.
Интересно, что в течение первого года от момента реваскуляризации различий в отношении ТО между группами ЧКВ и КШ не выявлено. По истечении этого срока (почти совпавшего с медианой прекращения ДАТТ) регистрировался статистически значимый прирост накопительной частоты ТО в группе пациентов, подвергнутых ЧКВ. К концу периода наблюдения доля больных без ТО в группах КШ и ЧКВ составила соответственно 0,82 vs 0,58 (ОР 2,78, 95% ДИ: 1,48-5,2; p=0,0013).
Напрямую сопоставлять группы ЧКВ и КШ было не вполне корректно, тем не менее, по основным клиническим ФР, полу, возрасту и сопутствующему поражению периферических артерий статистически значимых различий зарегистрировано не было. Учитывая достоверно худший прогноз, связанный с ЧКВ, мы сочли необходимым дополнительно проанализировать ангиографические характеристики, отражающие "комплексность" вмешательства и описанные нами в разделе "Материал и методы". По данным однофакторного анализа связь с развитием ТО после плановых ЧКВ продемонстрировали следующие показатели: вмешательство на ≤2 сегментах артерий (p=0,02, χ²=5,4), суммарная длина имплантированных стентов <26 мм (p=0,03, χ²=4,48 и ROC для выбора отрезного значения-AUC (площадь под кривой) =0,59, p=0,127), а также недостижение полной реваскуляризации миокарда (p=0,13, χ²=2,18). Как показано на рисунке 2 А, вероятность неблагоприятных исходов закономерно увеличивалась по мере накопления "бремени" ангиографических ФР. У лиц с сочетанием двух ФР частота ТО составила 32,7%, а у лиц с тремя ФР таковая превысила 35%.
Разумно было предположить, что неблагоприятное влияние на прогноз клинических и ангиографических ФР могло в той или иной степени быть модифицировано путем продления ДАТТ. Условия регистра никак не лимитировали лечащих врачей в отношении ДАТТ, медиана продолжительности которой, как мы уже указывали, составила около года. Исходя из этого, были сформированы практически одинаковые по мощности группы "стандартной" и "продленной" ДАТТ, для распределения в которые было условно принято отрезное значение продолжительности лечения, равное 12 мес.
Как видно из рисунка 2 Б, стандартной продолжительности ДАТТ было явно недостаточно для профилактики ТО у больных, подвергнутых ЧКВ высокого риска. Напротив, продление терапии в этом случае оказывало отчетливый положительный эффект, усиливающийся по мере продолжительности проспективного наблюдения.
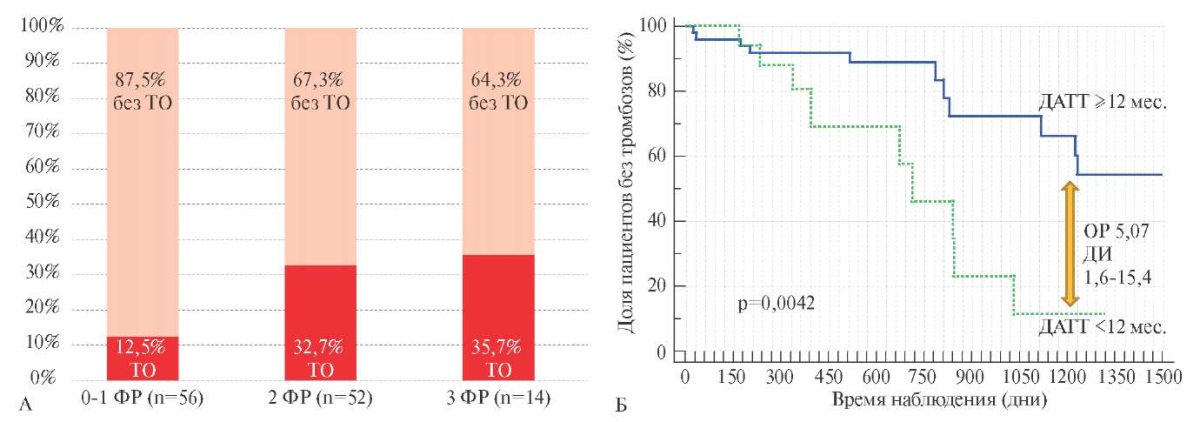
Рис. 2 Частота ТО после плановых ЧКВ
в зависимости от ангиографических ФР (А)
и продолжительности ДАТТ (Б).
На рисунке 2 А все больные имели ≥2 ангиографических ФР.
Примечание: ДАТТ — двойная антитромбоцитарная терапия,
ДИ — доверительный интервал,
ОР — отношение рисков,
ТО — тромботические осложнения,
ЧКВ — чрескожное коронарное вмешательство,
ФР — факторы риска.
К сожалению, улучшения исходов при продлении ДАТТ не было в других группах высокого риска, и в первую очередь — у больных с перенесенными до включения в исследование ИМ и/или ИИ/ТИА. Не было пользы от продленного лечения и у больных, подвергнутых КШ. Заметим при этом, что в настоящем фрагменте регистра речь шла исключительно о комбинации аспирина и клопидогрела. Другие варианты длительной ДАТТ не изучались.
Таким образом, исходя из данных однофакторного анализа, можно было полагать, что у больных с МФА развитие ТО зависело от ряда клинических и ангиографических факторов риска, метода выполнения реваскуляризации и продолжительности ДАТТ. Все эти факторы были включены в пошаговый регрессионный анализ, выполненный с поправкой на пол и возраст. Результаты поиска независимых предикторов ТО в модели пропорциональных рисков Кокса представлены на рисунке 3 (статистическая мощность модели в целом χ²=40; p<0,0001). Такие ФР, как курение, а также перенесенные тромботические эпизоды в коронарном и церебральном бассейнах сохранили значимость и в многофакторной модели. Среди всех предикторов неблагоприятного прогноза наиболее значимым оказалось выполнение ЧКВ "высокого риска" в сочетании с продолжительностью ДАТТ <12 мес. Такая стратегия реваскуляризации по сравнению с любыми другими сопровождалась увеличением риска развития ТО в 6,7 раза, 95% ДИ: 4,7-48 (p<0,0001) (рисунок 3).

Рис. 3 Независимые предикторы ТО у больных ИБС с МФА,
подвергнутых плановой реваскуляризации миокарда
(модель пропорциональных рисков Кокса).
ЧКВ "высокого риска" — наличие ≥2 ангиографических факторов:
вмешательство на ≤2 сегментах артерий,
суммарная длина имплантированных стентов <26 мм,
недостижение полной реваскуляризации миокарда.
Примечание: ДИ — доверительный интервал,
ИБС — ишемическая болезнь сердца,
МФА — мультифокальный атеросклероз,
ОР — отношение рисков,
ТИА — транзиторная ишемическая атака,
ТО — тромботические осложнения,
ЧКВ — чрескожное коронарное вмешательство.
Обсуждение
Анализируя результаты, следует, прежде всего, обратить внимание на проблему МФА, не утратившую своей актуальности со времен относительно старых и преимущественно "консервативных" клинических исследований и регистров [11]. Напомним, что суммарная частота ТО в регистре REACH составила 3,6-3,9% среди всех пациентов, в то время как в подгруппе с МФА — 7,1% за 2 года наблюдения, причем риск развития ТО возрастал по мере увеличения количества пораженных периферических бассейнов. Наши данные, полученные несколько десятилетий спустя на когорте больных МФА, получавших более совершенную медикаментозную терапию и дополнительно подвергнутых инвазивному лечению, по-прежнему демонстрируют неприемлемо высокую частоту ТО в различных сосудистых бассейнах, достигшую почти 20%. Интересно, что в течение всего периода наблюдения, превысившего 4 года, не было отмечено никакой тенденции к стабилизации атеротромботического процесса и уменьшению вероятности неблагоприятных исходов.
Столь неоптимистичный прогноз логично объясняется множеством сопутствующих ФР, определяющих высокую готовность к тромбозу. Речь идет о перенесенных ранее ТО (ИМ и ИИ/ТИА), сахарном диабете и курении. Кроме того, МФА, сам по себе, характеризуется выраженной активацией внутрисосудистого свертывания крови, и степень распространенности атеротромботического процесса тесно коррелирует с исходами больных МФА [12]. Подчеркнем, что в отличие от других исследований (например, REACH), мы использовали весьма жесткие критерии МФА, а именно — одновременное наличие ИБС с многососудистым поражением коронарного русла и периферического атеросклероза. Подобное "бремя атеротромботического процесса" и обусловливало развитие ТО практически у каждого пятого включенного пациента.
Принято считать, что реваскуляризация миокарда является одним из ключевых факторов, призванных улучшить прогноз больных ИБС, особенно имеющих многососудистое поражение коронарного русла. Данное положение, безусловно, справедливое для случаев ОКС, далеко не всегда подтверждается у стабильных больных. Набольшие вопросы вызывает целесообразность выполнения плановых ЧКВ. Ни одно из исследований начала XXI в. не смогло продемонстрировать преимуществ ЧКВ перед оптимальной медикаментозной терапией. Метаанализ этих исследований, опубликованный в 2012г, не обнаружил улучшения выживаемости или снижения риска ИМ после ЧКВ [13]. Одно из последних крупных исследований в этой области — ISHEMIA (International Study of Comparative Health Effectiveness With Medical and Invasive Approaches), отличительной особенностью которого было использование стентов последних поколений, также не выявило дополнительной пользы от ЧКВ, в т.ч. в подгруппах высокого риска, например, при сахарном диабете, традиционно определяющих прогноз при стенозах передней нисходящей артерии, тяжелой ишемии миокарда [14]. В свою очередь вынуждены констатировать явно неоптимальные исходы ЧКВ в сравнении с КШ у больных с МФА. Напомним, что в подгруппе ЧКВ использовались исключительно стенты низкой тромбогенности, однако в период проспективного наблюдения ТО перенес каждый пятый пациент.
Традиционный подход к стратификации риска инвазивного лечения заключается в оценке ангиографических характеристик и особенностей ЧКВ. Около 10 лет назад было введено понятие "комплексности" вмешательства, определяемого, в частности, количеством имплантированных стентов, их суммарной длиной, а также количеством сосудов, подвергнутых стентированию. Тогда же стали говорить, что такое протяженное, многососудистое ЧКВ наиболее опасно в отношении в отношении развития ТО (эта точка зрения не находит однозначного подтверждения в исследованиях последних лет со стентами очень низкой тромбогенности).
Очевидно, что у больных, включенных в наш регистр, эндоваскулярные хирурги как раз старались избегать таких комплексных процедур ЧКВ высокого риска. Как следствие, у значительной части больных реваскуляризация с помощью ЧКВ была неполной. Полагаем, что при многососудистом (особенно, диффузном) поражении относительно небольшая протяженность стентирования (обычно имплантировался один стент, длина которого составляла, в среднем, 32 мм) могла приводить к неполному покрытию атеросклеротических бляшек, развитию краевых диссекций и, наконец, к неоптимальному прилежанию балок стента к стенке сосуда.
Все эти ожидаемые недостатки закономерно нивелировались в группе КШ в связи с техникой операции, предусматривающей полную реваскуляризацию, включая дистальные анастамозы к пораженной артерии. Можно также полагать, что в случае ЧКВ у больных с многососудистым и многоуровневым поражением ситуация была бы улучшена с использованием методов внутрисосудистой визуализации, позволяющих минимизировать риски осложнений, связанных с выбором и техникой установки стента. Уместно в этой связи упомянуть данные рандомизированных исследований и регистров, сравнивавших имплантацию стентов с лекарственным покрытием под контролем внутрисосудистого ультразвука (ВСУЗИ) и под обычным ангиографическим контролем (как в нашем регистре) [15]. Было показано, что в случае ВСУЗИ постдилатация стентов использовалась чаще, размеры стентов, конечные минимальные диаметры просвета при использовании ВСУЗИ были увеличены и, соответственно, снижался риск мальпозиции. Также суммарно было имплантировано больше стентов, а медиана общей длины имплантированных стентов была выше, что логично снижало риск неполного покрытия атеросклеротических бляшек и развития краевых диссекций [16].
Очевидное преобладание тромбозов над кровотечениями в структуре прогноз-определяющих исходов диктует необходимость длительной многокомпонентной антитромботической терапии у обсуждаемых пациентов с МФА. В настоящем регистре такой доступной во всех отношениях опцией было сочетание аспирина с клопидогрелом. Начальная ДАТТ в течение, как минимум, 6-12 мес. с возможным продлением является стандартом в случае плановых ЧКВ. Назначение ДАТТ в течение того или иного срока после КШ менее изучено, особенно у стабильных больных. Имеются данные, что такое лечение может улучшить отдаленную проходимость венозных шунтов, в первую очередь, при выполнении операций без искусственного кровообращения. В рамках клинических регистров, отражающих реальную практику, в т.ч. в "НМИЦ кардиологии им. акад. Е. И. Чазова", ДАТТ после КШ назначается относительно часто в надежде улучшить прогноз после сложных в техническом отношении операций, особенно при диффузном поражении коронарных артерий [17].
Принимая во внимание все ограничения, связанные с наблюдательным характером регистра и отсутствием рандомизации, можно все же уверенно говорить об очевидной пользе продления ДАТТ после процедур ЧКВ. На первый взгляд, наши данные противоречат хорошо известному исследованию DAPT (Dual AntiPlatelet Therapy), также включавшему больных после ЧКВ [18]. Возможным объяснением могут быть различия в характеристиках пациентов. Доля лиц с анамнезом ОКС в исследовании DAPT была относительно невелика (~25%). Напомним также, что критерием включения в DAPT являлось отсутствие каких-либо осложнений в течение ближайшего года после ЧКВ, что определяло относительно невысокую вероятность последующих ишемических событий, и, как следствие, отсутствие выгоды от продленного антитромботического лечения. Наши больные, в свою очередь, были тяжелее, они характеризовались выраженным "бременем атеротромбоза" с одновременным вовлечением нескольких коронарных и периферических бассейнов.
По нашим данным, прогноз после ЧКВ у больных с МФА определяли ангиографические показатели, так или иначе отражающие неполноту реваскуляризации. При такой "неоптимальной" ЧКВ логично ожидать (ре)активацию атеротромботического процесса именно в местах травмированных бляшек, не покрытых стентами. Исходы в этих случаях могут быть улучшены путем продления ДАТТ, что и было показано в настоящей работе.
К сожалению, продленная ДАТТ не смогла модифицировать негативное влияние на прогноз ключевых клинических ФР. Речь идет о ранее перенесенных ТО — ИМ и ИИ/ТИА (рисунок 3). Уместно напомнить, что в настоящем фрагменте регистра не изучалась отличные от клопидогрела и, возможно, более эффективные, режимы продленного антитромботического лечения, включающие в дополнение к аспирину — тикагрелор 60 мг 2 раза/сут. или ривароксабан 2,5 мг 2 раза/сут.
Около 30,7% больных с МФА перенесли ИМ <3-х лет назад и, таким образом, скорее подходили под критерии назначения низкой дозы тикагрелора, определенные на основании исследования PEGASUS (Prevention of Cardiovascular Events (Death From Heart or Vascular Disease, Heart Attack, or Stroke) in Patients With Prior Heart Attack Using Ticagrelor Compared to Placebo on a Background of Aspirin) [19]. Как известно, эффекты такого лечения максимальны при отсутствии длительного перерыва после окончания обязательной ДАТТ, назначенной в связи с индексным ОКС. При перерыве в ДАТТ свыше года эффект тигагрелора практически полностью терялся. К сожалению, имеющаяся в сегодняшнем распоряжении база данных не дает возможности оценить характеристики больных, перенесших ИМ, которые могли бы иметь наибольшую пользу от длительного лечения тикагрелором. Заметим лишь, что медиана от ИМ до включения в настоящее исследование составила 20,4 мес. Таким образом, доля больных, у которых целесообразность тикагрелора не вызывала бы никаких сомнений, была невелика.
Еще одно основание для назначения тикагрелора — анамнез ЧКВ у больных с сопутствующим сахарным диабетом — исследование THEMIS PCI (Ticagrelor in patients with diabetes and stable coronary artery disease with a history of previous percutaneous coronary intervention) [20]. С формальной точки зрения, переход с клопидогрела на тикагрелор 60 мг мог бы быть осуществлен спустя 6 мес. у ~40% больных в группе ЧКВ, однако в реальной практике (по крайней мере, по нашим данным) этого практически не происходит.
Оговоримся, что в исследование PEGASUS не включались больные, подвергнутые КШ, а в исследования THEMIS и PEGASUS — больные с анамнезом ИИ. Подобных ограничений не было в исследовании аспирина с ривароксабаном (COMPASS) — комбинации, снижавшей риск любых ишемических событий, сосудистой смерти и смерти от любых причин. Как видно, профиль больных (стабильная ИБС c многососудистым поражением коронарного русла + периферический атеросклероз) наилучшим образом подходит под критерии COMPASS. Неудивительно, что с течением времени доля пациентов в настоящем регистре, получающих аспирин с ривароксабаном, неуклонно увеличивается. Крайне интересным и актуальным было бы напрямую сопоставить эффективность и безопасность двух вариантов многокомпонентной антитромботической терапии, включающей в дополнение к аспирину клопидогрел либо ривароксабан, что и планируется в дальнейшем1.
Заключение
Данные фрагмента регистра РЕГАТА-1 свидетельствуют, что прогноз больных ИБС с МФА определяется ТО, частота которых остается на неприемлемо высоком уровне, несмотря на реваскуляризацию миокарда с последующим назначением ДАТТ (аспирин + клопидогрел). Анализ предикторов ТО показал, что выполнение ЧКВ не является оптимальным способом улучшить прогноз у обсуждаемой категории больных, по крайней мере, в условиях стандартной продолжительности ДАТТ и отсутствии ВСУЗИ. У больных с ФР, определяющими высокую готовность к тромбообразованию (речь идет об анамнезе ИМ и ИИ/ТИА), продление ДАТТ с помощью клопидогрела не снижало риск ТО. В этих случаях логично использовать отличные от клопидогрела с аспирином режимы ДАТТ, ориентируясь на критерии исследований, в которых эти режимы были изучены.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. Панченко Е. П., Кривошеева Е. Н., Хакимова М. Б. и др. Сборник проектов конкурса "Всероссийская научная школа "Медицина молодая". Международный фонд развития биомедицинских технологий им. В. П. Филатова. г. Москва. 2023;566-76.
Список литературы
1. Бойцов С. А., Драпкина О. М., Шляхто Е. В. и др. Исследование ЭССЕ-РФ (Эпидемиология сердечно-сосудистых заболеваний и их факторов риска в регионах Российской Федерации). Десять лет спустя. Кардиоваскулярная терапия и профилактика. 2021;20(5):3007. doi:10.15829/1728-8800-2021-3007.
2. Wilson PWF. Established risk factors and coronary artery disease: the Framingham Study. Am J of Hypertension. 1994;7:7-12. doi: 10.1093/ajh/7.7.7S.
3. Giustino G, Chieffo A, Palmerini T, et al. Efficacy and safety of dual antiplatelet therapy after complex PCI. J Am Coll Cardiol. 2016;68(17):1851-64. doi:10.1016/j.jacc.2016.07.760.
4. Шукуров Ф. Б., Руденко Б. А., Фещенко Д. А. и др. Стратегия эндоваскулярного лечения пациента с сочетанным атеросклеротическим поражением коронарных и каротидных артерий. Кардиоваскулярная терапия и профилактика. 2022;21 (12):3442. doi:10.15829/1728-8800-2022-3442.
5. Suarez C, Zeymer U, Limbourg T, et al. Influence of polyvascular disease on cardiovascular event rates. Insights from the REACH Registry. Vascular Medicine. 2010;15(4):259-65. doi: 10.1177/1358863X103732.
6. Fowkes FG, Low LP, Tuta S, et al. Ankle-brachial index and extent of atherothrombosis in 8891 patients with or at risk of vascular disease: results of the international AGATHA study. Eur Heart J. 2006;27(15):1861-7. doi:10.1093/eurheartj/ehl114.
7. Connolly SJ, Eikelboom JW, Bosch J, et al. Rivaroxaban with or without aspirin in patients with stable coronary artery disease: an international, randomised, double-blind, placebo-controlled trial. Lancet. 2018;391(10117):205-18. doi:10.1016/S01406736(17)32458-3.
8. Кривошеева Е. Н., Комаров А. Л., Галяутдинов Д. М. и др. Отдаленные исходы коронарного шунтирования у больных с распространенным атеросклеротическим поражением коронарного и периферического сосудистых бассейнов (по данным регистра длительной антитромботической терапии РЕГАТА). Атеротромбоз. 2021;11(2):30-43. doi:10.21518/2307-1109-2021-11-2-30-43.
9. Российское кардиологическое общество (РКО). Стабильная ишемическая болезнь сердца. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4076. doi:10.15829/29/1560-4071-2020-4076.
10. Курбанов С. К., Власова Э. Е., Саличкин Д. В. и др. Госпитальные и годичные результаты коронарного шунтирования при диффузном поражении коронарных артерий. Кардиологический вестник. 2019;14(1):60-6. doi:10.17116/Cardiobulletin20191401160.
11. Комаров А. Л., Панченко Е. П. Частота поражений различных сосудистых бассейнов и медикаментозное лечение больных с высоким риском атеротромботических осложнений. Российские результаты международного исследования AGATHA. Кардиология. 2004; 44(11):39-44.
12. Федоткина Ю. А., Комаров А. Л., Добровольский А. Б. и др. Маркеры повреждения эндотелия, активации гемостаза и неоангиогенеза у больных активным раком и мультифокальным атеросклерозом: общие черты и особенности. Атеротромбоз. 2022;12(2):64-78. doi:10.21518/2307-1109-2022-12-2-64-78.
13. Pursnani S, Korley F, Gopaul R, et al. Percutaneous coronary intervention versus optimal medical therapy in stable coronary artery disease: a systematic review and meta-analysis of randomized clinical trials. Circ Cardiovasc Interv. 2012;5(4):476-90. doi:10.1161/CIRCINTERVENTIONS.112.970954.
14. Maron DJ, Hochman SJ, Reynolds HR, et al. Initial invasive or conservative strategy for stable coronary disease. New Engl J Med. 2020;382(15):1395-407. doi:10.1056/NEJMoa1915922.
15. Räber L, Mintz GS, Koskinas KC, et al. Clinical use of intracoronary imaging. Part 1: guidance and optimization of coronary interventions. An expert consensus document of the European Association of Percutaneous Cardiovascular Interventions. Eur Heart J. 2018;39(35):3281-300. doi:10.1093/eurheartj/ehy285.
16. Klersy C, Ferlini M, Raisaro A, et al. Use of IVUS guided coronary stenting with drug eluting stent: a systematic review and metaanalysis of randomized controlled clinical trials and high quality observational studies. Int J Cardiol. 2013;170(1):54-63. doi:10.1016/j.ijcard.2013.10.002.
17. Zhu Y, Xue Q, Zhang M, et al. Effect of ticagrelor with or without aspirin on vein graft outcome 1 year after on-pump and off-pump coronary artery bypass grafting. J Thorac Dis. 2020;12(9):491523. doi:10.21037/jtd-20-1177.
18. Mauri L, Kereiakes DJ, Yeh RW, et al. Twelve or 30 months of dual antiplatelet therapy after drug-eluting stents. N Engl J Med. 2014;371(23):2155-66. doi:10.1056/NEJMoa1409312.
19. Bonaca MP, Bhatt DL, Cohen M, et al. Long-term use of ticagrelor in patients with prior myocardial infarction. N Engl J Med. 2015;372(19):1791-800. doi:10.1056/NEJMoa1500857.
20. Bhatt DL, Steg PG, Mehta SR, et al. Ticagrelor in patients with diabetes and stable coronary artery disease with a history of previous percutaneous coronary intervention (THEMISPCI): a phase 3, placebo-controlled, randomised trial. Lancet. 2019;394(10204):1169-80. doi:10.1016/S0140-6736(19)31887-2.
Об авторах
М. Б. ХакимоваРоссия
Аспирант отдела клинических проблем атеротромбоза
Москва
А. Л. Комаров
Россия
Доктор медицинских наук, ведущий научный сотрудникотдела клинических проблем атеротромбоза
Москва
Е. Н. Кривошеева
Россия
Кандидат медицинских наук, младший научный сотрудник отдела клинических проблем атеротромбоза
Москва
В. М. Миронов
Россия
Кандидат медицинских наук, научный сотрудник научно-организационного отдела, врач 1-го отделения рентгенхирургических методов диагностики и лечения
Москва
С. К. Курбанов
Россия
Кандидат медицинских наук, младший научный сотрудник отдела сердечно-сосудистой хирургии
Москва
С. О. Кузякина
Россия
Лаборант в лаборатории биостатистики отдела эпидемиологии хронических неинфекционных заболеваний
Москва
Е. Б. Яровая
Россия
Доктор физико-математических наук, руководитель лаборатории биостатистики; профессор кафедры теории вероятностей механико-математического факультета
Москва
Е. П. Панченко
Россия
Доктор медицинских наук, профессор, руководитель отдела клинических проблем атеротромбоза
Москва
Дополнительные файлы
Что известно о предмете исследования?
- Мультифокальное атеросклеротическое (МФА) поражение — признанный фактор риска (ФР) тромботических осложнений (ТО) у больных стабильной ишемической болезнью сердца.
- Современный подход к лечению больных с МФА заключается в реваскуляризации миокарда и назначении, при отсутствии противопоказаний, многокомпонентной антитромботической терапии.
- Панель ФР, сохраняющих прогностическую значимость в условиях такого комплексного подхода, изучена недостаточно.
Что добавляют результаты исследования?
- Данные регистра РЕГАТА свидетельствуют, что прогноз больных ишемической болезнью сердца с МФА определяется ТО, частота которых остается на неприемлемо высоком уровне, несмотря на реваскуляризацию миокарда с последующим назначением двойной антитромбоцитарной терапии (ДАТТ) (аспирин + клопидогрел).
- Анализ предикторов ТО показал, что выполнение чрескожного коронарного вмешательства не является оптимальным способом улучшить прогноз у обсуждаемой категории больных, по крайней мере, в условиях стандартной продолжительности ДАТТ и отсутствии внутрисосудистого ультразвукового исследования.
- У больных с ФР, определяющими высокую готовность к тромбообразованию (речь идет об анамнезе инфаркта миокарда и ишемического инсульта/транзиторной ишемической атаки), продление ДАТТ с помощью клопидогрела не снижает риск ТО. В этих случаях логично использовать режимы ДАТТ, включающие тикагрелор или ривароксабан, ориентируясь на критерии исследований, в которых эти лекарства были изучены.
Рецензия
Для цитирования:
Хакимова М.Б., Комаров А.Л., Кривошеева Е.Н., Миронов В.М., Курбанов С.К., Кузякина С.О., Яровая Е.Б., Панченко Е.П. Факторы, определяющие прогноз после плановой реваскуляризации миокарда у больных ишемической болезнью сердца с мультифокальным атеросклеротическим поражением. Кардиоваскулярная терапия и профилактика. 2023;22(9):3689. https://doi.org/10.15829/1728-8800-2023-3689. EDN: RKNHSL
For citation:
Khakimova M.B., Komarov A.L., Krivosheeva E.N., Mironov V.M., Kurbanov S.K., Kuzyakina S.O., Yarovaya E.B., Panchenko E.P. Factors determining the prognosis after elective myocardial revascularization in patients with coronary artery disease with multifocal atherosclerosis. Cardiovascular Therapy and Prevention. 2023;22(9):3689. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3689. EDN: RKNHSL
JATS XML

























































