Перейти к:
Сердечно-сосудистые осложнения в некардиальной хирургии: что остается вне поля зрения?
https://doi.org/10.15829/1728-8800-2024-3748
EDN: HYXPTE
Аннотация
Цель. Оценить любые отклонения от нормальных критериев в деятельности сердечно-сосудистой системы в послеоперационном периоде, частоту их возникновения и влияние на течение послеоперационного периода у пациентов, которым были выполнены внесердечные оперативные вмешательства и в послеоперационном периоде по клиническим показаниям проведены обследования сердечно-сосудистой системы.
Материал и методы. В исследование включено 2937 пациентов. Оцениваемые конечные точки исследования — послеоперационные сердечно-сосудистые осложнения (ССО). Наряду с МАСЕ (Major acute coronary events, major adverse cardiac events, major adverse cardiovascular events) был проведен анализ любых отклонений от нормальных значений в деятельности сердечно-сосудистой системы в послеоперационном периоде: динамика ST-T на электрокардиограмме (ЭКГ), развитие острой или декомпенсация хронической сердечной недостаточности (СН), нарушения ритма и проводимости сердца, развитие эпизодов гипотонии или гипертонии, кровотечения, тромбоэмболические осложнения (ТЭО), развитие цереброваскулярных осложнений (ЦВО), послеоперационного делирия. Любые ССО составили группу ACVE (Any Cardio-Vascular Events — ACVE). Статистический анализ проводился с использованием программы StatTech v. 3.1.6 (разработчик — ООО "Статтех", Россия).
Результаты. Любые отклонения от нормального послеоперационного течения по классификации Clavien-Dindo составили 54,7%, 1 ст. — 33,9%, 2 ст. — 20,3%, 3 ст. — 1 случай, 4 ст. — 0,4%, 5 ст. — 0,1%. МАСЕ развились в 0,2% случаев. ACVE составили 13,3%, включая 2,3% — ЭКГ изменения ST-T, 6,3% — значимые колебания систолического артериального давления, 2,6% — нарушения ритма и проводимости сердца, 0,7% — СН, 2,4% — кровотечения, 1,1% — ТЭО, 0,3% — делирий. У 67 (17,5%) пациентов зарегистрировано ≥2 ССО. Сопоставление длительности госпитализации пациентов с ACVE, в частности с МАСЕ, отклонениями ЭКГ ST-T, СН, аритмией, эпизодами гипотонии или гипертонии, кровотечением, ТЭО, цереброваскулярными осложнениями, делирием в сравнении с группами пациентов без таковых осложнений выявило статистически значимые различия. ACVE составили 1/4 всех послеоперационных осложнений и 2/3 осложнений 2-5 ст. по классификации Clavien-Dindo.
Заключение. Расширили понятие ССО, объединили в ACVE совокупность любых отклонений в деятельности сердечно-сосудистой системы в послеоперационном периоде, подчеркнули не только клиническую значимость этих отклонений, но и экономическую целесообразность учета ACVE.
Для цитирования:
Мурашко С.С., Бернс С.А., Пасечник И.Н. Сердечно-сосудистые осложнения в некардиальной хирургии: что остается вне поля зрения? Кардиоваскулярная терапия и профилактика. 2024;23(1):3748. https://doi.org/10.15829/1728-8800-2024-3748. EDN: HYXPTE
For citation:
Murashko S.S., Berns S.A., Pasechnik I.N. Cardiovascular complications in non-cardiac surgery: what remains out of sight? Cardiovascular Therapy and Prevention. 2024;23(1):3748. (In Russ.) https://doi.org/10.15829/1728-8800-2024-3748. EDN: HYXPTE
Введение
Послеоперационные осложнения приводят к снижению качества жизни пациента, увеличивают период его нетрудоспособности, а в ряде случаев сокращают продолжительность жизни. Все случаи, связанные с послеоперационными осложнениями, увеличивают экономические затраты на оказание медицинской помощи. Необходимость строгого учета и анализа послеоперационных осложнений очевидна, однако на сегодняшний день в мире нет общепризнанной системы регистрации послеоперационных осложнений и единой классификации этих осложнений, четких определений самих осложнений [1]. Для оценки хирургических осложнений наиболее простой, понятной, удобной и широко применимой является классификация Clavien-Dindo. К послеоперационным хирургическим осложнениям, согласно определению по классификации Clavien-Dindo, относят любое негативное событие, возникшее во время госпитализации [2]. Систематический обзор результатов 38 исследований показал, что экономические затраты на случаи хирургического лечения пациентов зависят в т.ч. от тяжести осложнений, развившихся после операции, что отражается преимущественно в увеличении длительности госпитализации. [3]. Следует отметить, что даже осложнения 1 ст. в соответствии с усовершенствованной классификацией Clavien-Dindo удваивают послеоперационные расходы [4]. Для определения серьезных неблагоприятных сердечно-сосудистых событий (Major adverse cardiac events, major acute coronary events, major adverse cardiovascular events — МАСЕ) в послеоперационном периоде в клинических исследованиях принято рассматривать совокупность следующих трех конечных точек: госпитальная сердечно-сосудистая смерть, инфаркт миокарда (ИМ) и ишемический инсульт. Анализ 58 рандомизированных исследований, опубликованных в MEDLINE и EMBASE в 2010-2020гг, показал, что только в 13,8% исследований использовали 3 вышеперечисленные комбинированные конечные точки, в 15,5% случаев — ИМ и инсульт, а 51,7% исследований среди дефиниций МАСЕ рассматривали нестабильную стенокардию, сердечную недостаточность (СН), проведение реваскуляризации миокарда, нарушения ритма сердца и проводимости, тромбоэмболические события [5]. Наблюдаемые в последние десятилетия тенденции к снижению MACE до 1,4-0,5% [6][7] и рост количества исследований, которые не ограничиваются анализом трех общепризнанных дефиниций, свидетельствуют о потребности анализа более широкого спектра конечных точек, характеризующих послеоперационные сердечно-сосудистые осложнения (ССО), влияющие на послеоперационное течение заболеваний. Отсутствие единого подхода к стандартизации послеоперационных ССО затрудняет оценку и сравнение их между разными учреждениями и в разных исследованиях.
Цель — оценить любые отклонения от нормальных критериев в деятельности ССС в послеоперационном периоде, частоту их возникновения и влияние на течение послеоперационного периода у пациентов, которым были выполнены внесердечные оперативные вмешательства и в послеоперационном периоде по клиническим показаниям проведены обследования ССС.
Материал и методы
Проведено одноцентровое когортное ретроспективное исследование базы данных 3063 пациентов, которым были выполнены внесердечные оперативные вмешательства в ФГБУ "ОБП" в 2018 и 2020гг. Данные о демографических, клинических характеристиках пациентов и о проведенном оперативном вмешательстве были получены из бумажной формы стационарной истории болезни пациентов, оперированных в 2018г, и из электронной базы данных медицинской информационной системы ФГБУ "ОБП" "1С: Медицина. Больница" пациентов, оперированных в 2020г.
Критериями невключения в исследование были случаи оперативного вмешательства офтальмологического профиля в связи с узким спектром хирургического вмешательства и короткими сроками стационарного наблюдения (1-2 сут.) и эндокринологического профиля в связи с малым количеством оперативных вмешательств данного профиля.
Из 3063 стационарных историй болезни в исследование было отобрано 2937. Средний возраст пациентов составил 59 лет, интерквартильный размах (Q25-Q75) — 45-68 лет, 1514 женщин (51,4%), 1423 мужчин (48,6%). Хронические неинфекционные заболевания имели 1486 (50,6%) пациентов. Среди хронических неинфекционных заболеваний 88,7% (1318 пациентов) составляли хронические болезни системы кровообращения, 16,3% (248 пациента) — хронические болезни органов дыхания, 15,9% (236 пациентов) — новообразования, 22,8% (339 пациентов) — сахарный диабет 2 типа. Пациенты с хроническими сердечно-сосудистыми заболеваниями (ССЗ) в 94% случаев (1234 человека) принимали постоянную базисную терапию: β-блокаторы — 367 (30%) человек, ингибиторы ангиотензинпревращающего фермента/антагонисты рецепторов ангиотензина II — 599 (49%) человек, блокаторы кальциевых каналов — 226 (18%) человек, антиагреганты — 266 (22%) человек, антикоагулянты — 109 (9%) человек. Большинству пациентов оперативные вмешательства проводились в плановом порядке (2710 человек, 92,3%), в 227 (7,7%) случаях — экстренно. Характеристика области оперативного вмешательства представлена следующим спектром: 21,6% — урологические операции, 17,0% — гинекологические, 16,9% — травматолого-ортопедические, 14,6% — нейрохирургические, 12,7% — абдоминальные, 10% — эндоскопические, 3,5% — сосудистые, 2,3% — колопроктологические, 1,3% — операции на коже и подкожной клетчатке. При оперативных вмешательствах использовались следующие виды анестезии: комбинированная общая — в 37,5% случаев, внутривенная — 32,8%, регионарная — 17,5%, местная — 9,0%, сочетанная — 3,2%. Средняя длительность стационарного лечения составила 7 дней (Q25-Q75 — 3-11).
Хирургические осложнения оценивались в соответствии с усовершенствованной классификацией Clavien-Dindo, согласно которой к осложнениям 1 ст. были отнесены любые отклонения от нормы в послеоперационном периоде, которые не требовали хирургического, эндоскопического и радиологического вмешательства, проводилась стандартная консервативная терапия (жаропонижающие, анальгетики, диуретики, противорвотные средства, растворы электролитов, антибактериальная терапия раневой инфекции). К осложнениям 2 ст. были отнесены случаи, которые требовали расширения объема медикаментозной терапии, переливания крови и парентерального питания. При необходимости повторных оперативных, эндоскопических или радиологических вмешательств без или с общей анестезии случаи расценивались как осложнения 3а и 3b ст., соответственно. Осложнения 4 ст., при которых необходимо пребывание пациента в отделении интенсивной терапии, были подразделены на 4a — с недостаточностью функции одного органа и 4b — с полиорганной недостаточностью. Летальный исход расценивали как осложнения 5 ст.
Оцениваемые конечные точки исследования — послеоперационные ССО на госпитальном этапе. Нами был проведен анализ более широкого спектра показателей деятельности ССС, чем общепринятые дефиниции МАСЕ. По аналогии с классификацией хирургических осложнений Clavien-Dindo расценивали любые отклонения деятельности ССС от нормальных значений в послеоперационном периоде как любые ССО (Any Cardio-Vascular Events — ACVE): динамику ST-T на электрокардиограмме (ЭКГ) (рассматривалось как миокардиальное повреждение в случае повышения уровня сердечного тропонина (cTn) и как ЭКГ-изменения ST-T в отсутствие повышения уровня cTn), развитие острой или декомпенсацию хронической СН, нарушения ритма и проводимости сердца, включая пароксизмы фибрилляции предсердий, суправентрикулярной тахикардии, частой желудочковой экстрасистолии ≥3 класса по Лауну, впервые зарегистрированные нарушения проводимости или прогрессирование ранее имеющейся степени нарушений проводимости сердца, развитие эпизодов гипотонии (снижение систолического (САД) артериального давления (АД) <90 мм рт.ст.) или гипертонии (повышение САД >160 мм рт.ст.), кровотечения (кровопотеря >500 мл), тромбоэмболические осложнения (ТЭО), включая тромбоз глубоких вен и/или тромбоэмболию легочной артерии, развитие острой или декомпенсацию хронической цереброваскулярной болезни — цереброваскулярных осложнений (ЦВО), послеоперационный делирий. Вышеуказанные изменения со стороны ССС в совокупности с MACE составили группу ACVE.
Согласно источникам базы данных, в послеоперационном периоде лабораторная диагностика была проведена у 1413 (48%) пациентов, определение уровня кардиоспецифических тропонинов (сTnI, сTnT) — у 69 (2,3%) пациентов, регистрация и анализ ЭКГ — у 1133 (39%) пациентов, инструментальные исследования ССС (эхокардиография, холтеровское мониторирование ЭКГ, суточное мониторирование АД, цветное дуплексное сканирование артерий или вен, рентгенологическое исследование органов грудной клетки) — у 398 (13,6%) пациентов.
В соответствии с целью исследования протокол включал оценку влияния осложнений на послеоперационное течение заболевания — проведено сравнение продолжительности послеоперационного стационарного лечения у пациентов без послеоперационных осложнений и при развитии хирургических осложнений и ССО. Проанализирована значимость АСVE в структуре послеоперационных осложнений и влияние на длительность госпитализации.
Статистический анализ проводили с использованием программы StatTech v. 3.1.6 (разработчик — ООО "Стат-тех", Россия). Категориальные данные описывались с указанием абсолютных значений и процентных долей. Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро-Уилка (при числе исследуемых <50) или критерия Колмогорова-Смирнова (при числе исследуемых >50). В случае отличия распределения от нормального количественные данные описывались с помощью медианы (Me) и интерквартильного размаха (Q25-Q75). Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна-Уитни. Сравнение ≥3 групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью критерия Краскела-Уоллиса, апостериорные сравнения — с помощью критерия Данна с поправкой Холма. Сравнение процентных долей при анализе 4-польных, многопольных таблиц сопряженности выполнялось с помощью критерия χ² Пирсона (при значениях ожидаемого явления >10), точного критерия Фишера (при значениях ожидаемого явления <10). Для оценки диагностической значимости количественных признаков при прогнозировании определенного исхода, применяли метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определялось по наивысшему значению индекса Юдена.
Результаты
В исследуемой когорте пациентов в 45,3% случаев послеоперационный период протекал без особенностей, согласно усовершенствованной классификации Clavien-Dindo, в 33,9% требовалась консервативная терапия анальгетиками, антипиретиками, противорвотными, мочегонными препаратами и коррекция водно-электролитного баланса, в 20,3% — более широкий спектр медикаментозных препаратов и гемотрансфузии, в 1 случае — повторное оперативное вмешательство, в 0,4% — заместительная терапия в связи с органной недостаточностью, в 0,1% — зарегистрирован летальный исход (рисунок 1).

Рис. 1 Послеоперационные хирургические осложнения
по классификации Clavien-Dindo (%).
Примечание: ст — степень.
Значимые ССО развились у 5 (0,2%) человек из 2937 прооперированных пациентов — 2 летальных исхода на 3 сут. после экстренной абдоминальной операции и на 107 сут. после плановой травматологической операции у полиморбидных пациентов >80 лет на фоне полиорганной недостаточности, в т.ч. прогрессирующей сердечно-сосудистой недостаточности, 3 случая развития острого нарушения мозгового кровоснабжения по ишемическому типу на 2 сут. у пациентов 60, 63 и 69 лет, продолжавших последующее лечение в специализированных отделениях до 21 сут. В исследуемой выборке случаев развития ИМ в послеоперационном периоде не отмечено.
Частота развития любого отклонения сердечно-сосудистых показателей от нормальных значений в послеоперационном периоде составила 13,3%. Наиболее часто регистрировались колебания САД <90 мм рт.ст. или >160 мм рт.ст. — 6,3% случаев, нарушения ритма и проводимости сердца в 2,6% случаев, кровотечения — 2,4%, ЭКГ-изменения SТ-Т — 2,3%, ТЭО — 1,1%, СН — 0,7%, делирий — 0,3%. У 67 (17,5%) пациентов зарегистрировано ≥2 ССО. Частота развития послеоперационных осложнений представлена в таблице 1.
Таблица 1
Частота развития госпитальных послеоперационных осложнений
|
Показатель |
Категория |
n |
% |
95% ДИ |
|
Хирургические осложнения Clavien-Dindo |
нет осложнений |
1331 |
45,3 |
43,5-47,1 |
|
1 ст. |
995 |
33,9 |
32,2-35,6 |
|
|
2 ст. |
595 |
20,3 |
18,8-21,8 |
|
|
3 ст. |
1 |
0,0 |
0,0-0,2 |
|
|
4 ст. |
13 |
0,4 |
0,2-0,8 |
|
|
5 ст. |
2 |
0,1 |
0,0-0,2 |
|
|
ACVE |
нет |
2545 |
86,7 |
85,4-87,9 |
|
есть |
392 |
13,3 |
12,1-14,6 |
|
|
MACE |
нет |
2932 |
99,8 |
99,6-99,9 |
|
есть |
5 |
0,2 |
0,1-0,4 |
|
|
ЭКГ ST-T |
нет |
2868 |
97,7 |
97,0-98,2 |
|
есть |
69 |
2,3 |
1,8-3,0 |
|
|
СН |
нет |
2917 |
99,3 |
99,0-99,6 |
|
есть |
20 |
0,7 |
0,4-1,0 |
|
|
Аритмии |
нет |
2862 |
97,4 |
96,8-98,0 |
|
есть |
75 |
2,6 |
2,0-3,2 |
|
|
АД |
нет |
2751 |
93,7 |
92,7-94,5 |
|
есть |
186 |
6,3 |
5,5-7,3 |
|
|
ЦВО |
нет |
2932 |
99,8 |
99,6-99,9 |
|
есть |
5 |
0,2 |
0,1- 0,4 |
|
|
Делирий |
нет |
2927 |
99,7 |
99,4-99,8 |
|
есть |
10 |
0,3 |
0,2-0,6 |
|
|
ТЭО |
нет |
2904 |
98,9 |
98,4-99,2 |
|
есть |
33 |
1,1 |
0,8-1,6 |
|
|
Кровотечения |
нет |
2866 |
97,6 |
97,0-98,1 |
|
есть |
71 |
2,4 |
1,9-3,0 |
Примечание: АД — эпизоды гипотонии или гипертонии,
ДИ — доверительный интервал,
СН — сердечная недостаточность, ТЭО — тромбоэмболические осложнения,
ЦВО — цереброваскулярные осложнения, ЭКГ — электрокардиограмма,
ACVE — Any Cardio-Vascular Events, МАСЕ — Major Adverse Cardiac Events.
АСVЕ чаще развивались у пациентов >62 лет, что соответствовало наибольшему значению индекса Юдена, выше которого прогнозировались ACVE с чувствительностью и специфичностью модели 62,0 и 58,3%, соответственно. У лиц, страдающих ССЗ, шансы развития послеоперационных ССО были в >2,116 раза, по сравнению с пациентами без ССЗ, различия шансов были статистически значимыми (95% доверительный интервал (ДИ): 1,695-2,643). В случае экстренных оперативных вмешательств шансы ACVE были > в 1,790 раза, по сравнению с плановыми вмешательствами (95% ДИ: 1,274-2,516).
В таблице 2 представлены результаты сравнительного анализа длительности госпитализации в зависимости от развития послеоперационных осложнений.
Таблица 2
Анализ длительности госпитализации
в зависимости от послеоперационных осложнений
|
Показатель |
Категории |
Койко-дни (день) |
p |
||
|
Me |
Q25-Q75 |
n |
|||
|
Осложнения Clavien-Dindo |
нет осложнений |
4 |
2-8 |
1331 |
<0,001 p1 ст. — нет осложнений <0,001 p2 ст. — нет осложнений <0,001 p4 ст. — нет осложнений <0,001 p2 ст. — 1 ст. <0,001 p4 ст. — 1 ст.=0,028 |
|
1 ст. |
8 |
5-12 |
995 |
||
|
2 ст. |
9 |
6-14 |
595 |
||
|
3 ст. |
57 |
57-57 |
1 |
||
|
4 ст. |
20 |
11-21 |
13 |
||
|
5 ст. |
55 |
29-81 |
2 |
||
|
ACVE |
нет |
6 |
3-10 |
2545 |
<0,001 |
|
есть |
11 |
7-17 |
392 |
||
|
MACE |
нет |
7 |
3-11 |
2932 |
0,012 |
|
есть |
21 |
21-21 |
5 |
||
|
ЭКГ ST-T |
нет |
7 |
3-11 |
2868 |
<0,001 |
|
есть |
11 |
7-20 |
69 |
||
|
СН |
нет |
7 |
3-11 |
2917 |
<0,001 |
|
есть |
18 |
10-24 |
20 |
||
|
Аритмии |
нет |
7 |
3-10 |
2862 |
<0,001 |
|
есть |
14 |
10-21 |
75 |
||
|
АД |
нет |
7 |
3-10 |
2751 |
<0,001 |
|
есть |
9 |
7-14 |
186 |
||
|
ЦВО |
нет |
7 |
3-11 |
2932 |
<0,001 |
|
есть |
21 |
20-21 |
5 |
||
|
Делирий |
нет |
7 |
3-11 |
2927 |
0,002 |
|
есть |
14 |
9-22 |
10 |
||
|
ТЭО |
нет |
7 |
3-11 |
2904 |
<0,001 |
|
есть |
16 |
11-22 |
33 |
||
|
Кровотечения |
нет |
7 |
3-11 |
2866 |
<0,001 |
|
есть |
10 |
8-16 |
71 |
||
Примечание: АД — эпизоды гипотонии или гипертонии,
СН — сердечная недостаточность, ТЭО — тромбоэмболические осложнения,
ЦВО — цереброваскулярные осложнения, ЭКГ — электрокардиограмма,
ACVE — Any Cardio-Vascular Events, МАСЕ — Major Adverse Cardiac Events.
Получены достоверные различия продолжительности стационарного лечения пациентов с 1-й, 2-й, 4-й ст. осложнений согласно классификации Clavien-Dindo по сравнению с группой пациентов без осложнений (p<0,001), причем отмечено увеличение продолжительности госпитализации с увеличением степени осложнения.
Сопоставление длительности госпитализации пациентов с ACVE, включая MACE, отклонениями ЭКГ ST-T, СН, аритмией, эпизодами гипотонии или гипертонии, кровотечением, ТЭО, ЦВО, делирием в сравнении с группами пациентов без таковых осложнений выявило статистически значимые различия.
Развитие любых осложнений после некардиальных операций сопровождалось увеличением продолжительности стационарного лечения. Обращает на себя внимание тот факт, что ACVE с высокой степенью достоверности существенно влияли на увеличение сроков госпитализации.
Был проведен анализ любых отклонений от нормальных значений показателей деятельности ССС в послеоперационном периоде. В исследуемой группе 392 (13,3%) пациента имели ACVE, которые составили около 1/4 всех послеоперационных хирургических осложнений и 2/3 осложнений 2-5 ст. по классификации Clavien-Dindo, требовали проведения медикаментозной коррекции и других методов лечения, влияли на увеличение продолжительности стационарного лечения (рисунок 2).
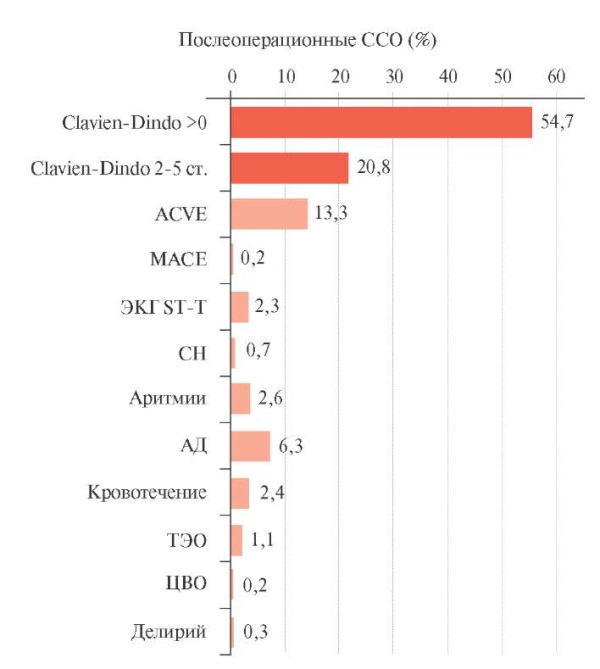
Рис. 2 Послеоперационные ССО (%).
Примечание: АД — эпизоды гипотонии или гипертонии,
СН — сердечная недостаточность,
ССО — сердечно-сосудистые осложнения, ТЭО — тромбоэмболические осложнения,
ЦВО — цереброваскулярные осложнения, ЭКГ — электрокардиограмма,
ACVE — Any Cardio-Vascular Events, МАСЕ — Major Adverse Cardiac Events.
Обсуждение
Согласно литературным данным в зависимости от сложности операции частота хирургических послеоперационных осложнений варьируется от 10,7 до 71,4% [4]. Согласно классификации Clavien-Dindo в нашем исследовании частота хирургических послеоперационных осложнений составила 54,7%, причем на долю осложнений 4 и 5 ст. пришлось лишь 0,5% (рисунок 1).
Исследования начала 2000-х гг свидетельствовали о развитии МАСЕ в 3,9% случаев [8]. C 2004 по 2013гг, согласно национальной базе данных госпитализаций США, отмечено снижение MACE с 3,1 до 2,6% (p для тренда <0,001; скорректированное отношение шансов (ОШ) 0,95; 95% ДИ: 0,94-0,97), преимущественно за счет уменьшения частоты периоперационной смерти (ОШ 0,79; 95% ДИ: 0,77-0,81) и ИМ (ОШ 0,87; 95% ДИ: 0,84-0,89). Однако тенденции данного периода наблюдения выявили увеличение частоты периоперационного инсульта с 0,52 до 0,77% (p для тренда <0,001; ОШ 1,79; ДИ: 1,73-1,86) [9]. Публикации последних лет указывают на устойчивую тенденцию к снижению МАСЕ до 1,4-0,5% [6][7][10]. Безусловно, такая значимая тенденция в снижении частоты развития МАСЕ стала возможной благодаря проведению во всем мире национальных проектов здравоохранения, совершенствованию медицинских технологий. Снижение риска смерти, в т.ч. после оперативных вмешательств, является основным клиническим подходом. Закономерно, что наибольшее количество исследований и, как результат, рекомендаций посвящено предупреждению развития жизнеопасных ССО. Периоперационное ведение пациентов согласно клиническим рекомендациям с применением передовых технологий отразилось и на наших показателях — развитие МАСЕ в 0,2% случаев, что коррелирует с мировыми тенденциями.
МАСЕ ассоциируют с тяжелыми осложнениями по классификации Clavien-Dindo. Попытки анализа не только МАСЕ после некардиальных операций предпринимались многими исследователями. Согласно результатам проспективного когортного исследования VISION (Vascular Events in Noncardiac Surgery Patients Cohort Evaluation (VISION) Substudy) 8 факторов независимо ассоциировалиcь с 30-дневной послеоперационной смертностью — тяжелые кровотечения (15,6%), миокардиальное повреждение (13,0%), сепсис (4,5%), инфекционные осложнения без сепсиса (5,4%), острое повреждение почек (0,3%), инсульт (0,3%), венозные ТЭО (0,7%), декомпенсация СН (0,9%), впервые зарегистрированный клинически значимый эпизод фибрилляции предсердий (ФП) (0,9%), причем первые 3 осложнения были причиной 44,9% случаев смерти [11].
В отечественном исследовании группы пациентов >65 лет с кардиальной патологией было отмечено, что пациенты с любыми отклонениями от нормы ЭКГ покоя имели повышенный риск развития ССО после плановых абдоминальных операций [12]. В исследовании BASEL-PMI (Basel Incidence, Patient Characteristics, Outcome and Possible Strategies to Improve Outcome of Perioperative Myocardial Injury After Non-cardiac Surgery) было продемонстрировано, что развитие миокардиального повреждения после внесердечной операции ассоциировало с увеличением 30-дневной смертности по сравнению с пациентами без данного осложнения (8,9 и 1,5%, соответственно) [13].
Данные литературы указывают на частоту развития ФП после некардиальных операций в 0,8-28% случаев и свидетельствуют о влиянии этого нарушения ритма на 3-кратное увеличение риска развития инсульта в течение 30 дней и 30-дневной смерти от всех причин [14]. Инсульт, ассоциированный с ФП, чаще развивается после экстракардиальных операций, чем у пациентов, перенесших операцию на сердце (отношение рисков 2,00; 95% ДИ: 1,70-2,35 vs 1,20; 95% ДИ: 1,07-1,34) [15]. В литературе имеются данные, свидетельствующие о том, что послеоперационная ФП ассоциировала с увеличением длительности пребывания в стационаре и увеличением экономических затрат [16].
Порой без должного внимания проходят колебания АД в периоперационном периоде, в частности, среднее АД <65 мм рт.ст. интраоперационно или <90 мм рт.ст. в палатах интенсивной терапии, но рандомизированные исследования обнаруживают сильные корреляции между гипотензией и повреждением миокарда, острым повреждением почек и смертью [17].
Оценка риска развития кровотечения или тромботических осложнений особенно актуальна у пациентов с кардиальными заболеваниями в периоперационном периоде при некардиальных вмешательствах и требует участия мультидисциплинарной бригады для выработки тактики ведения пациентов с соблюдением баланса системы гемостаза [18][19]. С одной стороны, прием антиагрегантных, антикоагулянтных препаратов, зачастую наряду с нестероидными противовоспалительными препаратами в периоперационном периоде увеличивает риск кровотечения, с другой стороны, преждевременное прекращение двойной антитромбоцитарной терапии после имплантации коронарного стента может привести к тромбообразованию. Начало XXI века ознаменовалось активным внедрением мероприятий по профилактике тромбообразований, однако, как показывают результаты исследования >9 млн пациентов, подвергшихся некардиальным хирургическим вмешательствам, доля фатальных ТЭО с 2005 по 2013гг снизилась с 9,2 до 6,9%, но выросла доля нефатальных ТЭО — с 0,09 до 0,1%. В исследовании отмечено, что развитие ТЭО ассоциировало с увеличением длительности госпитализации с 3 до 11 дней и с увеличением смертности до 8,2% по сравнению с 1,5% у пациентов без ТЭО [20].
Послеоперационный делирий диагностируют в 12-35% случаев. Гипо- и гипертензия являются одной из причин послеоперационного делирия. Развитие делирия коррелирует с увеличением продолжительности стационарного лечения, 3% смертностью в течение 60 дней после операции при плановых некардиальных операциях [21].
Ограничения данного наблюдения, обусловленные ретроспективным дизайном исследования, возможны в связи с ошибками информации, полученной из стационарных историй болезни. Диагностические исследования в послеоперационном периоде проводились при наличии клинических показаний. Наряду с ограничениями, ретроспективный дизайн когортного исследования представляет возможность получения наиболее достоверной информации об использовании методов диагностики и соотношении исходов в соответствии с реальной практикой.
Выделение ACVE, расширенного спектра ССО, способствовало бы новым проспективным исследованиям для выявления факторов риска данных осложнений, мер предупреждения, своевременного лечения, повышению эффективности некардиального оперативного вмешательства, снижению экономических затрат на лечение.
Таким образом, в настоящем исследовании мы впервые:
- объединили под понятием послеоперационные ССО (ACVE) любые отклонения в деятельности ССС в послеоперационном периоде;
- показали, что частота развития ACVE значительно превышает МАСЕ, причем тенденция снижения МАСЕ в представленном исследовании и в мире за последние десятилетия не распространяется на многие другие ACVE, частота которых остается на прежнем уровне или имеет тенденцию к росту;
- продемонстрировали, что развитие любых ACVE ведет к удлинению стационарного лечения и неминуемо влечет увеличение экономических затрат на лечение;
- обосновали целесообразность учета более широкого спектра ACVE, не ограничиваясь МАСЕ.
Заключение
Термины "послеоперационные кардиальные", или "ССО", или "ССО и ЦВО" не имеют стандартного определения и в разных исследованиях используются очень вариабельно. Отсутствие стандартных подходов к учету послеоперационных ССО ставит под сомнение возможность обоснованно использовать для сравнения результаты исследований и показатели различных медицинских учреждений. Многочисленные, при этом разрозненные, исследования свидетельствуют о клинических и экономических последствиях послеоперационных ССО. Систематические национальные стратегии затронули преимущественно мероприятия, направленные на снижение частоты МАСЕ. В данном исследовании мы расширили понятие ССО, объединили в категорию ACVE совокупность любых отклонений в деятельности ССС в послеоперационном периоде, подчеркнули не только клиническую значимость этих отклонений, но и экономическую целесообразность учета ACVE.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Мурашко С.С., Пасечник И.Н., Бернс С.А. Сердечно-сосудистые осложнения в некардиальной хирургии: что мы о них знаем? Кремлевская медицина. Клинический вестник. 2019;4:90-7. doi:10.26269/rg71-m772.
2. Manekk RS, Gharde P, Gattani R, et al. Surgical Complications and Its Grading: A Literature Review. Cureus. 2022;14(5):e24963. doi:10.7759/cureus.24963.
3. Patel AS, Bergman A, Moore BW, et al. The economic burden of complications occurring in major surgical procedures: a systematic review. Appl Health Econ Health Policy. 2013;11:577-92. doi:10.1007/s40258-013-0060-y.
4. Cen N, Hollier LH Jr. Review of "Clinical Validation of the Comprehensive Complication Index as a Measure of Postoperative Morbidity at a Surgical Department: A Prospective Study" by Roberto PL, et al in Ann Surg 268:838-844, 2018. J Craniofac Surg. 2019;30(6):1921. doi:10.1097/SCS.0000000000005291.
5. Bosco E, Hsueh L, McConeghy KW, et al. Major adverse cardiovascular event definitions used in observational analysis of administrative databases: a systematic review. BMC Med Res Methodol. 2021;21(1):241. doi:10.1186/s12874-021-01440-5.
6. Smilowitz NR, Berger JS. Perioperative Cardiovascular Risk Assessment and Management for Noncardiac Surgery: A Review. JAMA. 2020;324(3):279-90. doi:10.1001/jama.2020.7840.
7. Peterson BR, Cotton A, Foy AJ. Reevaluating the Cardiac Risk of Noncardiac Surgery Using the National Surgical Quality Improvement Program. Am J Med. 2021;134(12):1499-505. doi:10.1016/j.amjmed.2021.07.016.
8. Devereaux PJ, Goldman L, Cook DJ, et al. Perioperative cardiac events in patients undergoing noncardiac surgery: a review of the magnitude of the problem, the pathophysiology of the events and methods to estimate and communicate risk. CMAJ. 2005;173(6):627-34. doi:10.1503/cmaj.050011.
9. Smilowitz NR, Gupta N, Ramakrishna H, et al. Perioperative Major Adverse Cardiovascular and Cerebrovascular Events Associated With Noncardiac Surgery. JAMA Cardiol. 2017;2(2):181-7. doi:10.1001/jamacardio.2016.4792.
10. Сумин А.Н. Оценка и коррекция риска кардиальных осложнений при некардиальных операциях — что нового? Рациональная Фармакотерапия в Кардиологии. 2022;18(5): 591-9. doi:10.20996/1819-6446-2022-10-04.
11. Spence J, LeManach Y, Chan MTV, et al. Association between complications and death within 30 days after noncardiac surgery. CMAJ. 2019;191:E830-7. doi:10.1503/cmaj.190221.
12. Чомахидзе П. Ш., Мозжухина Н. В., Полтавская М. Г. и др. Применение методов функциональной диагностики для оценки кардиального риска у пациентов старше 65 лет или с наличием кардиальной патологии при плановых абдоминальных хирургических вмешательствах. Кардиология. 2019;59(1):69-78. doi:10.18087/cardio.2019.1.10210.
13. Puelacher C, Lurati Buse G, Seeberger D, et al. Perioperative Myocardial Injury After Noncardiac Surgery: Incidence, Mortality, and Characterization. Circulation. 2018;137(12):1221-32. doi:10.1161/CIRCULATIONAHA.117.030114.
14. AlTurki A, Marafi M, Proietti R, et al. Major Adverse Cardiovascular Events Associated With Postoperative Atrial Fibrillation After Noncardiac Surgery: A Systematic Review and Meta-Analysis. Circ Arrhythm Electrophysiol. 2020;13(1):e007437. doi:10.1161/CIRCEP.119.007437.
15. Lin MH, Kamel H, Singer DE, et al. Perioperative/Postoperative Atrial Fibrillation and Risk of Subsequent Stroke and/or Mortality. Stroke. 2019;50(6):1364-71. doi:10.1161/STROKEAHA.118.023921.
16. Dobrev D, Aguilar M, Heijman J, et al. Postoperative atrial fibrillation: mechanisms, manifestations and management. Nat Rev Cardiol. 2019;16(7):417-36. doi:10.1038/s41569-019-0166-5.
17. Sessler DI, Khanna AK. Perioperative myocardial injury and the contribution of hypotension. Intensive Care Med. 2018;44(6):811-22. doi:10.1007/s00134-018-5224-7.
18. Filipescu DC, Stefan MG, Valeanu L, et al. Perioperative management of antiplatelet therapy in noncardiac surgery. Curr Opin Anaesthesiol. 2020;33(3):454-62. doi:10.1097/ACO.0000000000000875.
19. Мурашко С.С., Пасечник И. Н., Бернс С. А. Прогнозирование тромбоэмболических осложнений в некардиальной хирургии. Кремлевская медицина. Клинический вестник. 2023;3:8-12. doi:10.48612/cgma/r6m6-9p9z-d4nd.
20. Smilowitz NR, Gupta N, Guo Y, et al. Trends in Perioperative Venous Thromboembolism Associated with Major Noncardiac Surgery. TH Open. 2017;1(2):e82-91. doi:10.1055/s-0037-1605360.
21. Лихванцев В. В., Улиткина О.Н., Резепов Н. А. Послеоперационный делирий: что нового предлагает нам руководство ESA-2017? Вестник анестезиологии и реаниматологии. 2017;14(2):41-7. doi:10.21292/2078-5658-2017-14-2-41-47.
Об авторах
С. С. МурашкоРоссия
Мурашко Светлана Степановна — кандидат медицинских наук, заместитель главного врача, доцент кафедры анестезиологии и реаниматологии.
Москва
С. А. Бернс
Россия
Бернс Светлана Александровна — доктор медицинских наук, профессор, заведующий кафедрой терапии и общей врачебной практики.
Москва
И. Н. Пасечник
Россия
Пасечник Игорь Николаевич — доктор медицинских наук, профессор, заведующий кафедрой анестезиологии и реаниматологии.
Москва
Дополнительные файлы
Что известно о предмете исследования?
- МАСЕ (Major Adverse Cardiac Events) не позволяют оценить значимость всех сердечно-сосудистых осложнений после некардиальных операций.
Что добавляют результаты исследования?
- Впервые предложено объединить любые отклонения в деятельности сердечно-сосудистой системы в послеоперационном периоде в категорию АCVE (Any Cardio-Vascular Events).
- АСVE составляет 1/4 всех послеоперационных осложнений и 2/3 осложнений 2-5 степени по классификации Clavien-Dindo.
- ACVE сопряжены с увеличением длительности стационарного лечения и экономических затрат.
Рецензия
Для цитирования:
Мурашко С.С., Бернс С.А., Пасечник И.Н. Сердечно-сосудистые осложнения в некардиальной хирургии: что остается вне поля зрения? Кардиоваскулярная терапия и профилактика. 2024;23(1):3748. https://doi.org/10.15829/1728-8800-2024-3748. EDN: HYXPTE
For citation:
Murashko S.S., Berns S.A., Pasechnik I.N. Cardiovascular complications in non-cardiac surgery: what remains out of sight? Cardiovascular Therapy and Prevention. 2024;23(1):3748. (In Russ.) https://doi.org/10.15829/1728-8800-2024-3748. EDN: HYXPTE
JATS XML

























































