Перейти к:
Геногеографические технологии популяционного биобанка как инструмент оценки эффектов отбора (на примере фармакогенетических биомаркеров сердечно-сосудистых заболеваний)
https://doi.org/10.15829/1728-8800-2023-3773
Аннотация
Значительные различия между генофондами народов России требуют разработки этно-регионально адаптированных фармакогенетических тестов и выявления приоритетных регионов для их внедрения.
Цель. Разработать геногеографическую технологию для выявления эффектов отбора на примере биомаркеров, значимых для фармакотерапии пациентов с сердечно-сосудистыми заболеваниями (ССЗ), с помощью популяционного биобанка и базы данных "Фармакогенетика популяций России и сопредельных стран".
Материал и методы. Образцы дезоксирибонуклеиновой кислоты (ДНК) Биобанка Северной Евразии из 20 метапопуляций коренного населения Европейской части России изучены по двум массивам данных: по 24 фармакогенетическим маркерам ССЗ (3170 образцов); по 1 276 191 полиморфным ДНК-маркерам аутосомного генома (1293 образца). По каждому массиву данных приведены оценки межпопуляционной изменчивости генофонда: разница между этими оценками характеризует давление отбора на каждый из 24 биомаркеров ССЗ. Создан геногеографический атлас, карты которого демонстрируют давление отбора на каждый биомаркер по степени отклонения от селективно-нейтральной изменчивости генофонда.
Результаты. 24 биомаркера ССЗ подразделены на три класса: близких к селективно-нейтральной изменчивости, подверженных стабилизирующему и дифференцирующему отбору. Для каждого из 24 биомаркеров ССЗ созданы геногеографические карты, выявляющие эффекты отбора в каждой из 20 метапопуляций. Большинство карт выявили популяции, находящиеся под давлением дифференцирующего отбора и поэтому являющиеся приоритетными для внедрения этно-регионально адаптированных фармакогенетических протоколов.
Заключение. Фармакогенетические маркеры и популяции, находящиеся под действием дифференцирующего отбора, требуют разработки этно-регионально адаптированных фармакогенетических тестов. Созданный картографический атлас отбора может служить основой для развития фармакогенетических исследований, проводимых методами геногеографии.
Ключевые слова
Для цитирования:
Балановская Е.В., Горин И.О., Пономарёв Г.Ю., Пылёв В.Ю., Белов Р.О., Почешхова Э.А., Абдуллаев Ш.П., Мирзаев К.Б., Сычев Д.А. Геногеографические технологии популяционного биобанка как инструмент оценки эффектов отбора (на примере фармакогенетических биомаркеров сердечно-сосудистых заболеваний). Кардиоваскулярная терапия и профилактика. 2023;22(11):3773. https://doi.org/10.15829/1728-8800-2023-3773
For citation:
Balanovskaya E.V., Gorin I.O., Ponomarev G.Yu., Pylev V.Yu., Belov R.O., Pocheshkhova E.A., Abdullaev Sh.P., Mirzaev K.B., Sychev D.A. Genogeographic technologies of a population biobank as a tool for assessing selection effects (using the example of pharmacogenetic biomarkers of cardiovascular diseases). Cardiovascular Therapy and Prevention. 2023;22(11):3773. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3773
Введение
Получение генетической информации о пациенте для индивидуализации фармакотерапии — выбора лекарственных препаратов, подбора и коррекции их доз на основании молекулярно-генетических особенностей пациента — становится важным трендом в медицине. Особые успехи фармакогенетических исследований достигнуты в кардиологической практике. Примером могут служить такие пары ген-препарат: CYP2C9, VKORC1, CYP4F2 [1] — варфарин (и другие антагонисты витамина К); CYP2C19 и ABCB1 — клопидогрел [2][3]; SLCO1B1 — статины [4]. Полиморфизмы ABCB1 детерминируют также изменение фармакокинетики антикоагулянтов прямого действия (дабигатран, ривароксабан, апиксабан) [5].
Современная медицинская помощь основывается на национальных и международных клинических рекомендациях "усредненному пациенту" [6], характеристики которого определены в рандомизированных клинических исследованиях жителей Европы и США. Однако основанные на них фармакогенетические рекомендации могут быть не валидными для населения других регионов мира [7], что требует от национальных органов здравоохранения их адаптации к собственному народонаселению. Знание геногеографии клинически значимых биомаркеров позволяет выделять популяции, для которых проведение фармакогенетического тестирования (ФГТ) будет приоритетным и обоснованным; такой подход исключит необоснованное назначение ФГТ для всех пациентов.
Во многих работах показано, что для народонаселения России характерна значительная этно-региональная изменчивость частот фармакогенетических маркеров [8-14], что приводит к необходимости адаптации фармакогенетических рекомендаций к конкретным популяциям и народам. Для выявления биомаркеров, требующих наибольшей адаптации ФГТ из-за значительных различий между популяциями, полезно использовать такой инструмент, как выявление эффектов отбора. Под давлением мощного стабилизирующего отбора межпопуляционные различия биомаркеров будут нивелироваться и тогда для большинства популяций региона будет приемлем стандартный протокол ФГТ. Но у той части биомаркеров, на которые действует дифференцирующий отбор, различия между популяциями становятся столь велики, что для них необходима разработка разных вариаций фармакогенетических протоколов. В этом случае целесообразно применение инструментария геногеографии, предлагающей легко читаемые карты, указывающие на действие разных типов отбора и его интенсивность в разных частях региона.
Наиболее простой способ выявления отбора — анализ отклонения межпопуляционных различий по данному биомаркеру от селективно-нейтрального уровня. Основные факторы микроэволюции популяций — дрейф генов и миграции — действуют на весь аутосомный геном одинаково и определяют единый для всех SNP (Single Nucleotide Polymorphism)-маркеров селективно-нейтральный уровень различий между популяциями. Поэтому увеличение таких межпопуляционных различий у конкретного биомаркера указывает на давление на него дифференцирующего отбора, а уменьшение различий — на действие стабилизирующего отбора [15-19].
Одним из наиболее применяемых методов для оценки межпопуляционных различий служит показатель FST (критерий Фишера для оценки межпопуляционных различий). Разработаны и описаны различные подходы к поиску значений FST, отличающихся от селективно-нейтрального уровня различий между популяциями [20]: ранжируя оценки FST по отдельным SNP-маркерам, приходят к выводу о влиянии отбора на маркеры с наибольшим отклонением от среднего уровня FST [21]. Этот метод применялся, например, для поиска маркеров, подверженных отбору, в популяциях афроамериканцев [22], в 7 популяциях североевропейского происхождения [23], для оценки функциональной значимости SNP-маркеров в массиве данных II фазы международного проекта HapMap (сокращенно от Haplotype Map — "карта гаплотипа" генома человека) [24].
Данный метод выявления эффектов отбора неоднократно использовался и для фармакогенетически значимых биомаркеров. Например, при анализе SNP-маркеров гена NOS1 (играющего решающую роль в иммунорегуляции и в неспецифической защите хозяина при таких инфекциях, как малярия, токсоплазмоз, лейшманиоз, трипаносомоз, шистосомоз) сравнение шести популяций Средиземноморья выявило отклонение от селективной нейтральности в марокканской популяции [25]. При оценке межпопуляционной вариабельности частот SNP-маркеров генов иммунного ответа (IL4, IL10, IL13, IL12A) показано действие дифференцирующего отбора на варианты rs2070874 и rs6441286 про- и противовоспалительных цитокинов в разных популяциях [26]. При анализе 1044 SNP-маркеров 243 фармакогенов с помощью двух независимых методов — IHS (integrated haplotype score, интегрированная оценка гаплотипов) и FST — обнаружено действие отбора [27] на фармакогены различных классов: ABCC6 (ген-переносчик многих противоопухолевых препаратов); UGT2B17 (ген, кодирующий фермент переноса глюкуроновой кислоты из уридиндифосфоглюкуроновой кислоты в разнообразные субстраты, включая стероидные гормоны и жирорастворимые лекарственные средства); SLC25A20 (ген, ассоциированный с дефицитом карнитин-ацилкарнитинтранслоказы, мутации в котором могут вызывать различные патологические состояния, такие как гипогликемия, остановка сердца, гепатомегалия, печеночная дисфункция и мышечная слабость).
Эти и другие исследования указывают, что выявление эффектов отбора через анализ межпопуляционных различий служит эффективным инструментом для обнаружения генов-кандидатов, имеющих наибольшее функциональное и медицинское значение для ряда популяций. Выявление фармакогенетических маркеров и популяций, наиболее подверженных дифференцирующему отбору, может стать важным инструментом в рамках стратегии перехода к персонализированной медицине при разработке региональных алгоритмов персонализации терапии различных нозологий, учитывающих генетические особенности местного населения, и для выделения отдельных регионов или популяций приоритетных для внедрения соответствующих протоколов ФГТ.
Цель работы — с помощью геногеографических технологий, опирающихся на популяционный биобанк и базу данных по фармакогенетике, оценить давление отбора на биомаркеры, значимые для персонализации фармакотерапии пациентов с сердечно-сосудистыми заболеваниями (ССЗ).
Материал и методы
Исследование основано на биообразцах популяционного Биобанка Северной Евразии (Москва) и информации базы данных "Фармакогенетика популяций России и сопредельных стран". Биобанк Северной Евразии предоставил 3170 образцов дезоксирибонуклеиновой кислоты (ДНК), которые были изучены по 24 биомаркерам ССЗ: ABCB1 (rs1045642), ABCB1 (rs4148738), ABCG2 (rs2231137), ABCG2 (rs2231142), ADRB1 (rs1801252), CES1 (rs2244613), CYP2C19 (rs12248560), CYP2C19 (rs4244285), CYP2C19 (rs4986893), CYP2C8 (rs10509681), CYP2C9 (rs1057910), CYP2C9 (rs1799853), CYP2D6 (rs1065852), CYP2D6 (rs28371725), CYP2D6 (rs3892097), CYP3A4 (rs2242480), CYP3A5 (rs776746), CYP4F2 (rs2108622), P2RY12 (rs2046934), PON1 (rs662), SLCO1B1 (rs4149056), VKORC1 (rs7294), VKORC1 (rs9923231), VKORC1 (rs9934438). Данные об их частотах в 61 популяции Европейской части России и сопредельных стран объединены с дополнительной информацией базы данных "Фармакогенетика популяций России и сопредельных стран".
Для анализа селективно-нейтральной изменчивости Биобанк Северной Евразии предоставил данные о 1401 образце, изученном по большому массиву SNP-маркеров аутосомного генома с помощью биочипа Infinium OmniExome BeadChip Kit (Illumina; США) на приборе iScan (Illumina; США). Первичный анализ и оценка качества этих данных проведены в программе GenomeStudio v2011.1, показатель CallRate составлял не <0,99. При фильтрации с помощью PLINK 1.9 [27] исключены SNP-маркеры, прочитанные менее чем у 90% образцов (geno 0,1), с частотой минорного варианта <1% (maf 0,01), тесно сцепленные SNP (R²>0,5); а также исключены образцы, у которых прочитано <95% SNP-маркеров (mind 0,05). В результате для анализа использованы 1 276 191 SNP-маркеров для 1293 образцов.
Оба массива данных Биобанка Северной Евразии ДНК репрезентативно представляют генофонды коренного населения европейской части России (таблица 1). Коллекции ДНК сформированы по единой технологии (детально описанной в [28]) в ходе многолетних экспедиционных обследований коренного населения: в выборки включены образцы неродственных между собой индивидов, предки которых на глубину не <3-х поколений относили себя к данному этносу и данной популяции [28]. Обследование проведено на добровольной основе с письменным информированным согласием, одобренным Этическим комитетом ФГБНУ "МГНЦ" (Заключение от 29.06.2020г).
Для корректного сравнения и формирования репрезентативных выборок оба массива популяционных данных объединены в 20 метапопуляций в соответствии с общностью этногенеза или региональной принадлежностью (таблица 1). Генетические различия FST между каждой парой из 20 метапопуляций рассчитаны с помощью программы smartpca пакета eigensoft [29]. Геногеографические карты построены с помощью программного пакета GeneGeo [30] методом средневзвешенной интерполяции со степенью весовой функции 2 и радиусом влияния 1200 км. В специальном окне легенды каждой карты указаны ее статистические характеристики: K — число исходных популяций для построения карты; min — минимальное значение признака; max — максимальное значение признака; avr — среднее значение признака; GST — межпопуляционные различия (аналог FST для двуаллельных маркеров).
Таблица 1
Состав и численность популяций, изученных по биомаркерам ССЗ,
и метапопуляций, по которым дана оценка селективно-нейтральной изменчивости
|
Популяции ССЗ |
Метапопуляции |
|||
|
Номера популяций на карте частоты ССЗ |
Состав популяций |
Выборка ССЗ, n (человек) |
Краткое условное название метапопуляции на карте |
Выборка в метапопуляциях, m (человек) |
|
1-4 |
Русский Север (Архангельская область) |
213 |
Поморы |
84 |
|
5-7 |
русские северных областей |
205 |
Русс-север |
95 |
|
8-10 |
русские центральных областей |
142 |
Русс-центр |
84 |
|
11, 12, 17 |
русские южных областей, казаки |
166 |
Русс-юг |
88 |
|
13-16 |
украинцы |
206 |
Украинцы |
78 |
|
18 |
белорусы |
50 |
– |
– |
|
19, 23 |
вепсы, ижора, водь |
87 |
Вепсы |
30 |
|
20-22 |
карелы, саамы |
157 |
Карелы |
30 |
|
24 |
финны-ингерманландцы |
37 |
– |
– |
|
25 |
ненцы |
21 |
– |
– |
|
26 |
удмурты, бесермяне |
90 |
Удмурты |
28 |
|
27-29 |
коми-пермяки |
218 |
Коми-пермяки |
47 |
|
30, 31 |
марийцы |
129 |
Марийцы |
31 |
|
32-34 |
чуваши |
134 |
Чуваши |
33 |
|
35, 36 |
татары Поволжья |
156 |
Татары |
54 |
|
37, 38 |
Мордовия (мокша, шокша, эрзя) |
155 |
Мордовия |
47 |
|
39, 40 |
башкиры |
100 |
Башкиры |
42 |
|
41, 42 |
угры (манси, ханты) |
96 |
Угры |
41 |
|
43-46 |
народы Западного Кавказа |
167 |
Запад. Кавказ |
86 |
|
47-48 |
народы европейской степи |
95 |
Степь |
83 |
|
49-50, 55-58 |
народы Центрального Кавказа и Закавказья |
265 |
Центр. Кавказ |
193 |
|
51-54 |
народы Восточного Кавказа |
155 |
Вост. Кавказ |
88 |
|
59-60 |
народы Зарубежной Европы |
90 |
Заруб. Европа |
31 |
|
61 |
калмыки |
36 |
– |
– |
|
Суммарно |
3170 |
Суммарно |
1293 |
|
Примечание: ССЗ — сердечно-сосудистые заболевания.
Результаты
Чтобы выявить давление отбора на биомаркер, необходимо получить две оценки: селективно-нейтрального уровня межпопуляционной изменчивости для данного региона и межпопуляционной изменчивости данного биомаркера в этом же регионе.
1. Оценка селективно-нейтрального уровня межпопуляционных различий FST
Для генофонда каждого региона характерен свой селективно-нейтральный уровень различий между популяциями: FST(NEUTR). Его значение одинаково для любых генетических маркеров данного региона, поскольку он задается не свойствами того или иного гена, а исключительно демографическими факторами — средним генетически эффективным размером популяций (Ne) и миграционными связями между популяциями региона (Me). Эти два демографических фактора и являются двумя основными, но противодействующими, силами микроэволюции популяций, которые в равной степени действуют на любые гены аутосомного генома. Чем меньше генетически эффективный размер популяции (Ne), тем сильнее дрейф генов, увеличивающий различия между популяциями. Чем интенсивнее генетически эффективные миграции (Me), тем больше нивелируются различия между популяциями, возникающие в результате дрейфа генов. Их взаимодействие и определяет селективно-нейтральный уровень межпопуляционных различий FST(NEUTR)=1/(4NeMe).
Есть два способа определения уровня селективно-нейтральной изменчивости FST(NEUTR) [15-19]. Прямой способ — через исключительно демографические оценки генетически эффективных размера популяций Ne и миграций Мe. Но корректные оценки Ne и Мe даже для небольшого региона получить крайне сложно: для их получения используются разные модели популяционной генетики, вызывающие вопросы об их применимости в каждом конкретном случае. Поэтому более надежным оказывается непрямой способ оценки FST(NEUTR) через среднюю межпопуляционную изменчивость совокупности генов (‾FST). Непрямой метод оценки селективно-нейтрального уровня различий между популяциями исходит из гипотезы, что каждый из совокупности анализируемых генетических маркеров находится под действием своего собственного вектора отбора, в результате которого для каждого i-того маркера характерен свой собственный показатель межпопуляционных различий FST(i). Поэтому усреднение оценок межпопуляционных различий по большой совокупности генов (среднее ‾FST) усредняет эти разнонаправленные векторы, нивелируя эффекты отбора до нуля и давая оценку селективно-нейтральной изменчивости: ‾FST=FST(NEUTR). Эта гипотеза неоднократно проверялась в регионах, для которых демографические оценки Ne и Мe считались корректными: было показано, что прямые (через Ne и Мe) и непрямые (через ‾FST) оценки практически совпадают. Поэтому обычно для оценки FST(NEUTR) используется непрямой метод (среднее ‾FST), но при этом важно, чтобы выборка маркеров была случайной по отношению к отбору и достаточно большой.
Для классических генетических маркеров научное сообщество пришло к выводу, что достаточно случайной выборки, включающей 50 генетических маркеров [15-19], но современные технологии позволяют значительно увеличивать выборки ДНК-маркеров в исследованиях, увеличивая тем самым надежность оценки селективно-нейтрального уровня различий между популяциями. В данной работе средняя оценка межпопуляционной изменчивости генофонда ‾FST получена по 1 276 191 SNP-маркеру аутосомного генома, что надежно обеспечивает ее нейтральность по отношению к отбору. Массив 1293 образцов представителей 57 популяций Восточной Европы Биобанка Северной Евразии (изученный по 1 276 191 SNP-маркеру) максимально полно охватывает разнообразие коренного народонаселения региона, включающего представителей трех языковых семей — алтайской, индоевропейской, уральской. Для более репрезентативной оценки ‾FST и увеличения выборки, популяции объединены в 20 метапопуляций (таблица 1) в соответствии с критериями генетического сходства и этногенетического родства. Итоговая средняя оценка селективно-нейтральной дифференциации популяций ‾FST, полученная по столь большому массиву анализируемых данных, составила ‾FST=1,24.
2. Средняя оценка давления отбора для 24 биомаркеров ССЗ
Выборка, изученная по 24 биомаркерам ССЗ (детально описанная в [12]), в 2,5 раза больше (nССЗ=3170), чем выборка для оценки селективно-нейтральной изменчивости (nNEUTR=2193, таблица 1). Однако некоторые биомаркеры изучены по меньшему числу образцов (таблица 2) и выборки малы для некоторых популяций. Поэтому для увеличения репрезентативности данных выборок показатели межпопуляционной изменчивости FST(i) для каждого i-того биомаркера ССЗ рассчитаны как средние не по 61 исходной популяции [12], а по 20 крупным метапопуляциям (таблица 2). Это позволяет провести корректное сравнение с теми же 20 метапопуляциями, по которым рассчитан уровень селективно-нейтральной изменчивости. Показатель FST(i) складывается из двух величин: а) общей для всех маркеров селективно-нейтральной величины ‾FST=1,24; б) тех различий между популяциями, которые возникают в результате действия отбора, индивидуальны для каждого маркера и накладываются на селективно-нейтральную изменчивость. В результате действия дифференцирующего отбора различия между популяциями FST(i) становятся больше, чем без отбора: FST(i)>‾FST, а воздействие стабилизирующего отбора уменьшает межпопуляционные различия: FST(i)<‾FST.
С помощью такого теста 24 биомаркера ССЗ, расположенные по убыванию значения FST(i), разделены на три условных класса: маркеры дифференцирующего отбора, селективно-нейтральные маркеры и маркеры стабилизирующего отбора (таблица 2). В настоящей работе мы не касаемся проблемы статистически значимого выделения границ между классами [16-19], поскольку на первом этапе решаем более простую задачу — создание рабочей технологии обнаружения эффектов отбора. Поэтому 8 биомаркеров с положительным знаком ∆>0,5 отклонения от селективно-нейтрального уровня условно отнесены к классу ДНК-маркеров, подверженных дифференцирующему отбору (FST(i)>‾FST). Следующие 8 биомаркеров, мало отличающихся от ‾FST (-0,5<∆<0,5), отнесены к классу условно селективно-нейтральных. Последние 8 ДНК-маркеров с наибольшим отрицательным отклонением от ‾FST (-1<∆<-0,5) условно отнесены к классу маркеров, подверженных стабилизирующему отбору (таблица 2). В таблице 3 для каждого из 24 биомаркеров ССЗ указаны характеристики их связи с лекарственными препаратами и заболеваниями.
Таблица 2
Оценка типа давления отбора для 24 биомаркеров ССЗ
по параметру отклонения от селективно-нейтрального уровня FST
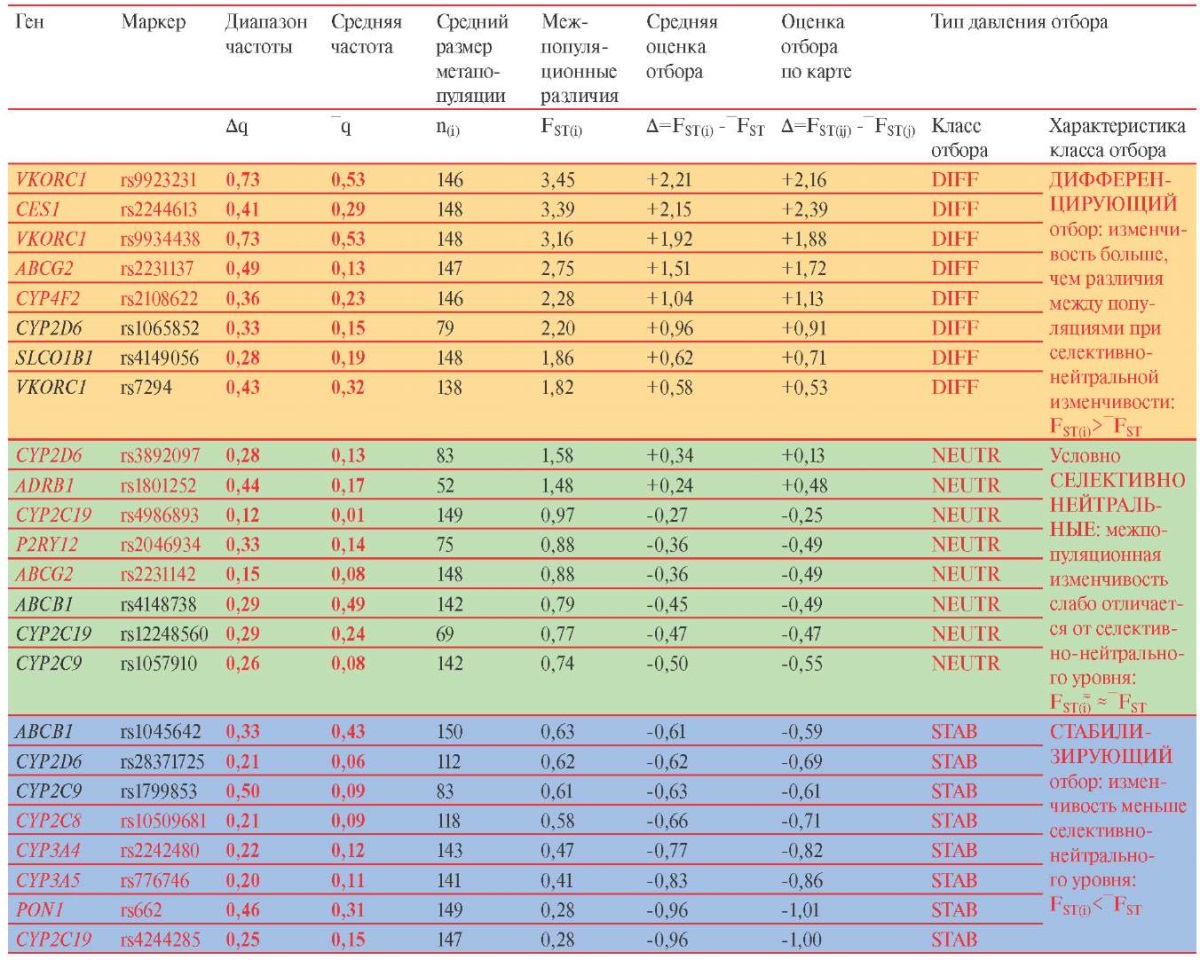
Примечание: ССЗ — сердечно-сосудистые заболевания,
DIFF — биомаркеры, отнесенные к классу действия дифференцирующего отбора,
NEUTR — условно селективно нейтральные биомаркеры,
STAB — биомаркеры, отнесенные к классу действия стабилизирующего отбора.
Цветное изображение доступно в электронной версии журнала.
Таблица 3
Характеристики 24 биомаркеров ССЗ:
эффект отбора, лекарственные препараты и нозологии,
для фармакотерапии которых могут использоваться
соответствующие лекарственные препараты

Примечание: ССЗ — сердечно-сосудистые заболевания,
DIFF — биомаркеры, отнесенные к классу действия дифференцирующего отбора,
NEUTR — условно селективно нейтральные биомаркеры,
STAB — биомаркеры, отнесенные к классу действия стабилизирующего отбора.
Цветное изображение доступно в электронной версии журнала.
3. Географическая изменчивость давления отбора
Полученные средние оценки давления отбора на 24 биомаркера ССЗ относятся только к народонаселению Европейской части России и сопредельных территорий (таблица 1). В других регионах действие отбора может быть иным, что требует отдельного исследования. Более того, действие отбора может быть неодинаковым в разных частях анализируемого региона. Поэтому средние оценки отбора (таблица 2) являются вполне достоверным указанием на то, какие именно биомаркеры требуют наиболее пристального изучения. Если биомаркеры подвержены действию сильного стабилизирующего отбора, то их межпопуляционные различия сглажены по сравнению с селективно-нейтральной изменчивостью. Но даже для этих биомаркеров геногеографический подход помогает выявить те части региона, где межпопуляционные различия все же велики. Дифференцирующий отбор, напротив, указывает на существенные отличия между популяциями региона по данному биомаркеру и на то, что для разных частей региона может потребоваться выделение отдельных групп популяций, в которых использование разных фармакогенетических протоколов будет клинически рациональным. Однако и здесь геногеография может помочь выделить те части региона, где дифференцирующий отбор ослаблен и стандартные подходы к лечению будут все же пригодны. Поэтому для биомаркеров, подверженных любым типам и интенсивности отбора, важно оценить, как отбор действует в разных частях ареала анализируемого региона.
Обнаружить особенности разных популяций региона в отношении действия отбора помогает атлас геногеографических карт отбора. Для его создания проведены следующие операции: а) для каждой (j) из 20 метапопуляций (их краткие названия приведены на картах отбора, а описание входящих в них популяций — в таблице 1) дана оценка межпопуляционной изменчивости FST(ij) для каждого i-того биомаркера ССЗ; б) для каждой (j) из 20 метапопуляций выявлен показатель селективно-нейтральных различий ‾FST(j); в) дана оценка отбора по i-тому биомаркеру для каждой j-той метапопуляции через отклонение от селективно-нейтрального уровня изменчивости (∆ij=FST(ij)-‾FST(j)); г) проведена интерполяция полученных оценок отбора ∆ij по ареалу карты. Подчеркнем, что и для карт, и для расчета средних оценок отбора ‾FST(i) оценки получены для одних и тех же 20 метапопуляций и потому полностью сопоставимы (таблица 2). Отличия средних оценок по 20 метапопуляциям от оценок, полученных по картам (таблица 2), связаны с тем, что геногеографическое картографирование позволяет учесть важнейшее свойство популяции — ее ареал. Поэтому карта, учитывая различия в размерах ареала метапопуляций и пространственные соотношения ареалов, дает более корректную оценку изменчивости отбора в географическом пространстве.
Для демонстрации пространственной изменчивости отбора из атласа выбрано по 5 карт каждого класса отбора, наиболее ярко его демонстрирующих: 5 карт биомаркеров, наиболее подверженных дифференцирующему отбору (рисунок 1); 5 карт биомаркеров, наиболее близких к селективно-нейтральной изменчивости (рисунок 2); 5 карт биомаркеров, наиболее подверженных стабилизирующему отбору (рисунок 3). Шкала на всех картах отбора одинакова (от -3 до +3 с интервалом 0,5), и чем интенсивнее отбор, тем интенсивнее окраска. Области с положительным знаком ∆FST, указывающие на действие дифференцирующего отбора, окрашены в красные тона, а территории стабилизирующего отбора с отрицательным знаком ∆FST показаны в синей гамме оттенков. Каждая из 15 карт отбора сопровождается картой геногеографической изменчивости частоты этого маркера в 61 исходной популяции (рисунки 1-3), где каждая исходная популяция обозначена номером, позволяющим найти ее описание в таблице 1. Для карт частот биомаркеров использована иная шкала: от 0 до 0,1 — с шагом 0,02; от 0,1 до 0,5 — с шагом 0,05; от 0,5 до 1 — с шагом 0,1.
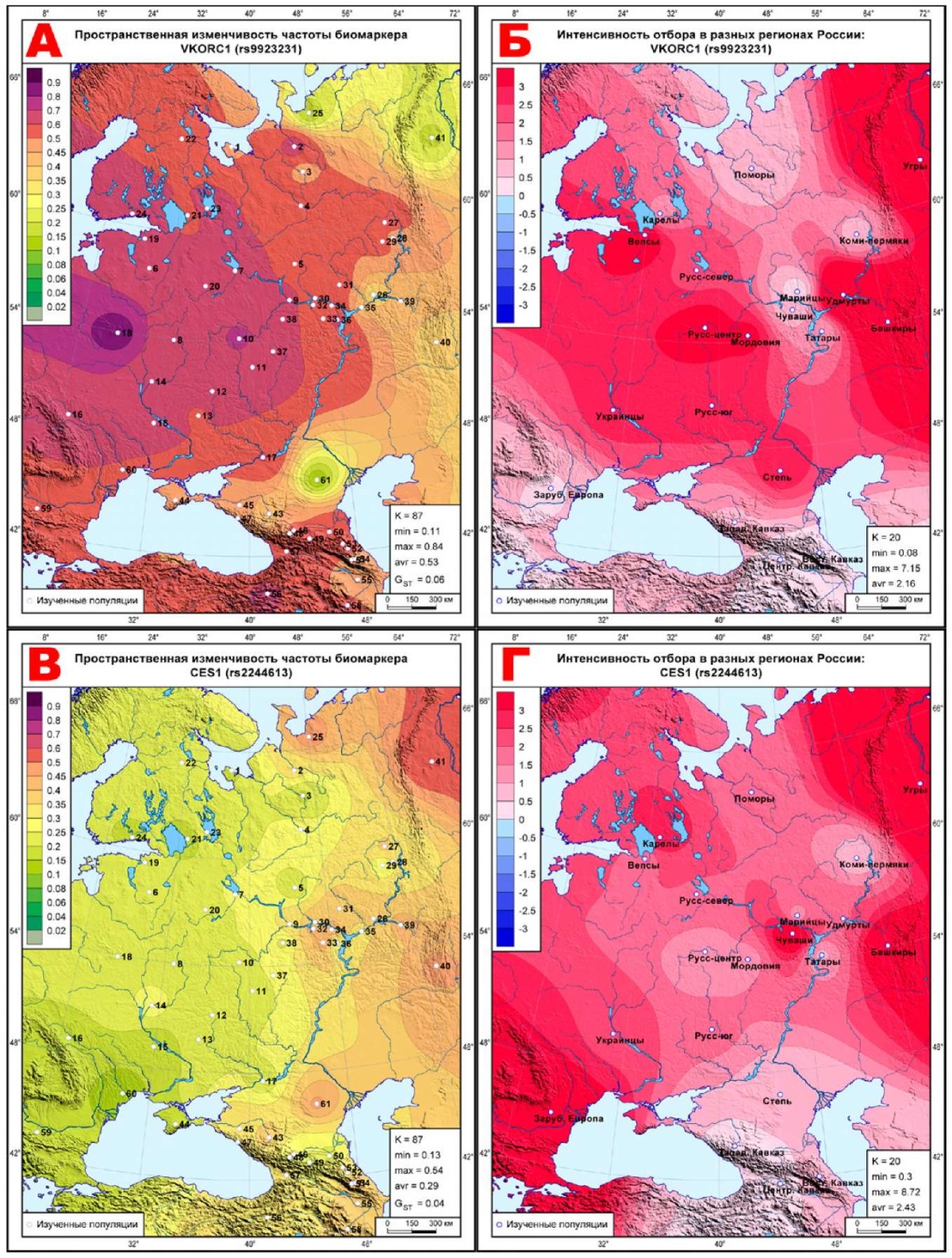
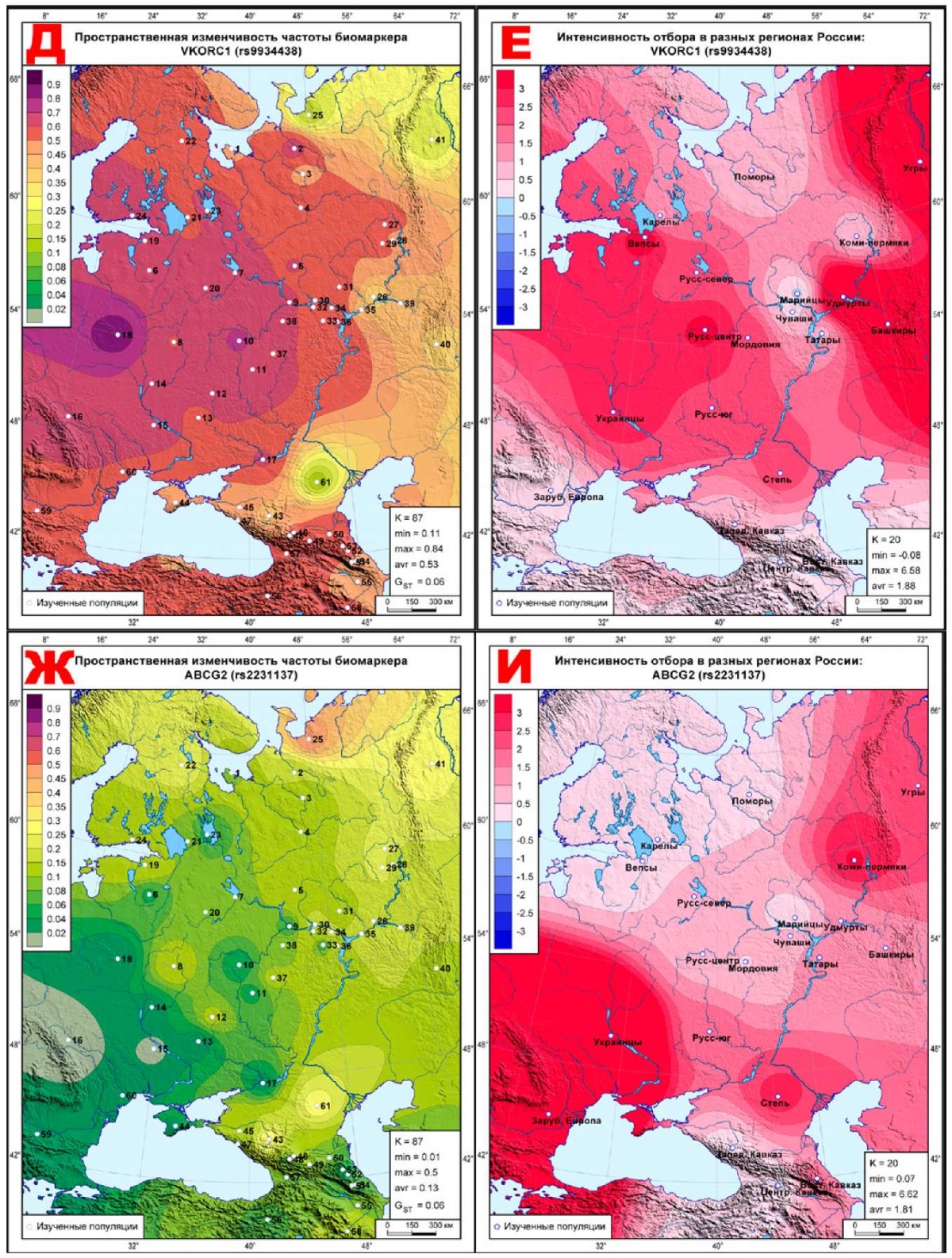
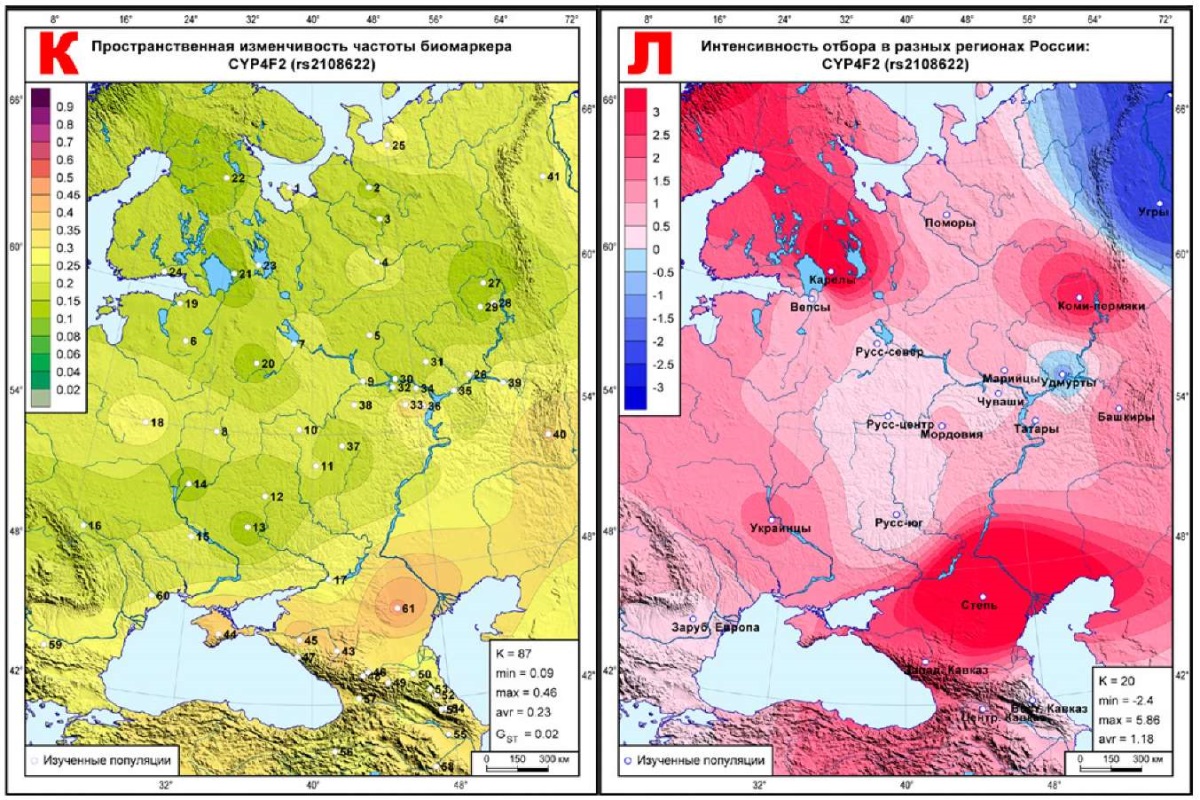
Рис. 1 Геногеография частоты (слева) и эффектов отбора (справа)
для фармакогенетических биомаркеров ССЗ,
подверженных дифференцирующему отбору:
А, Б: VKORC1 (rs9923231);
В, Г: CES1 (rs2244613);
Д, Е: VKORC1 (rs9934438);
Ж, И: ABCG2 (rs2231137);
К, Л: CYP4F2 (rs2108622).
Примечание: ССЗ — сердечно-сосудистые заболевания.
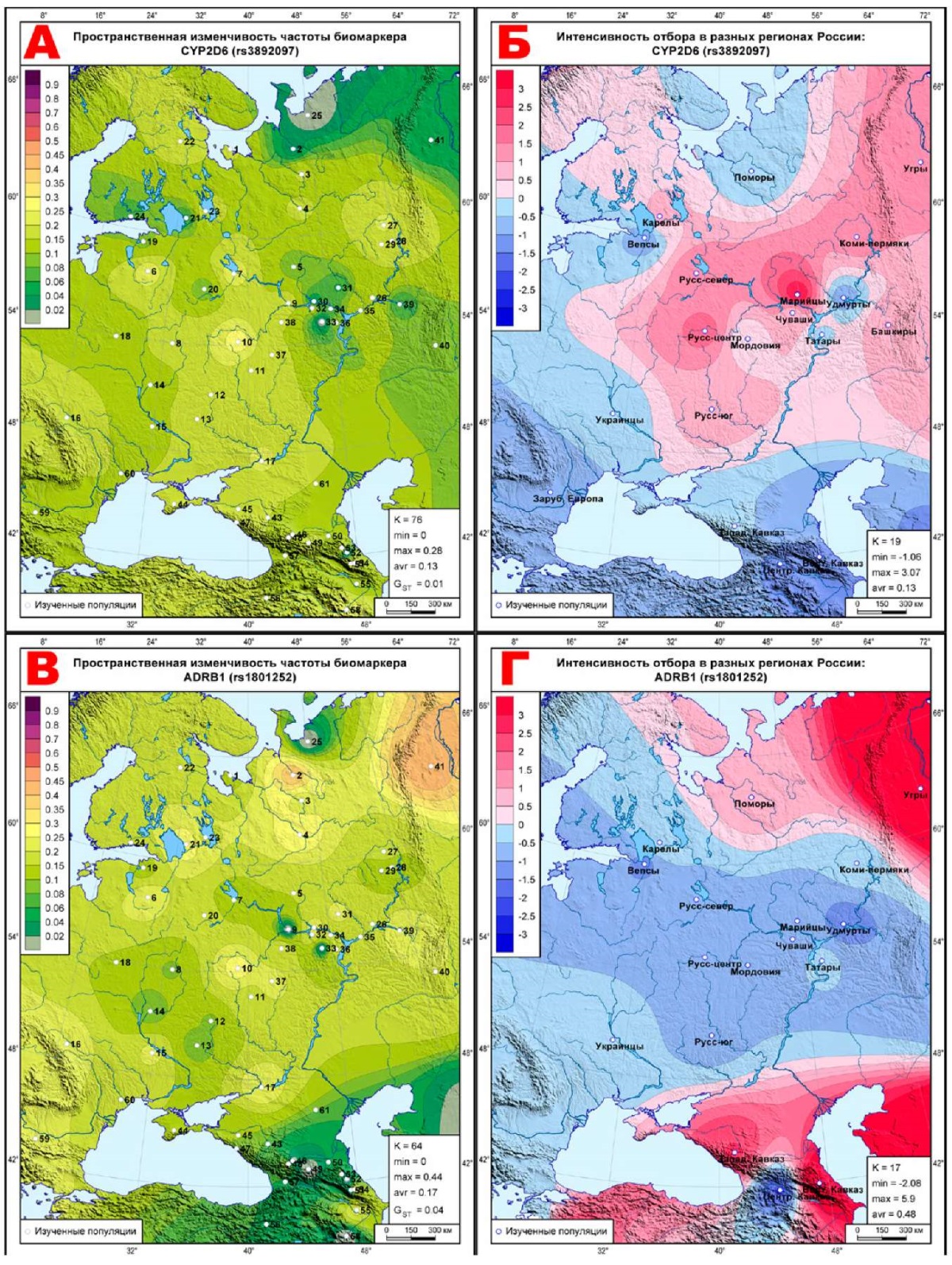
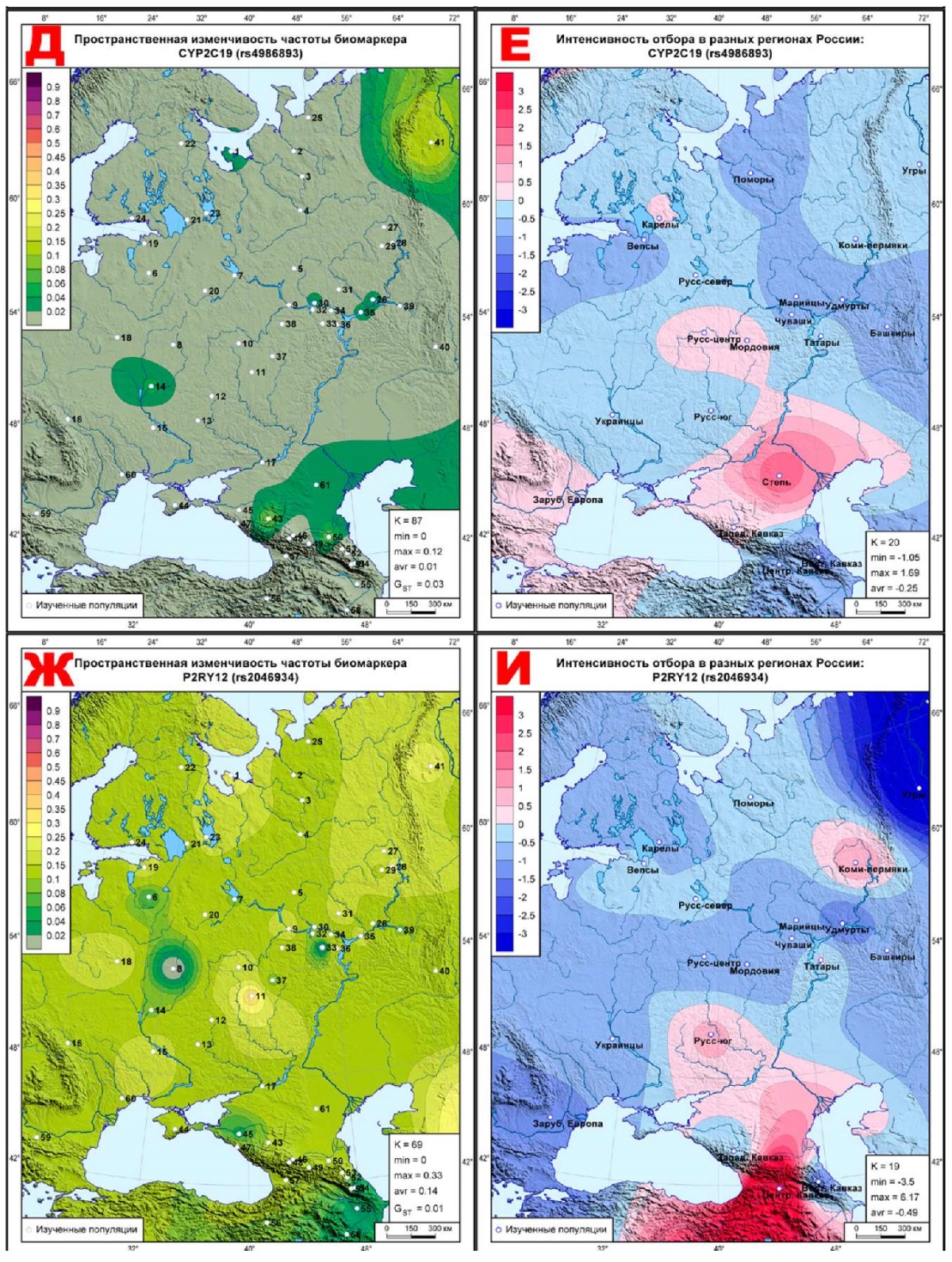
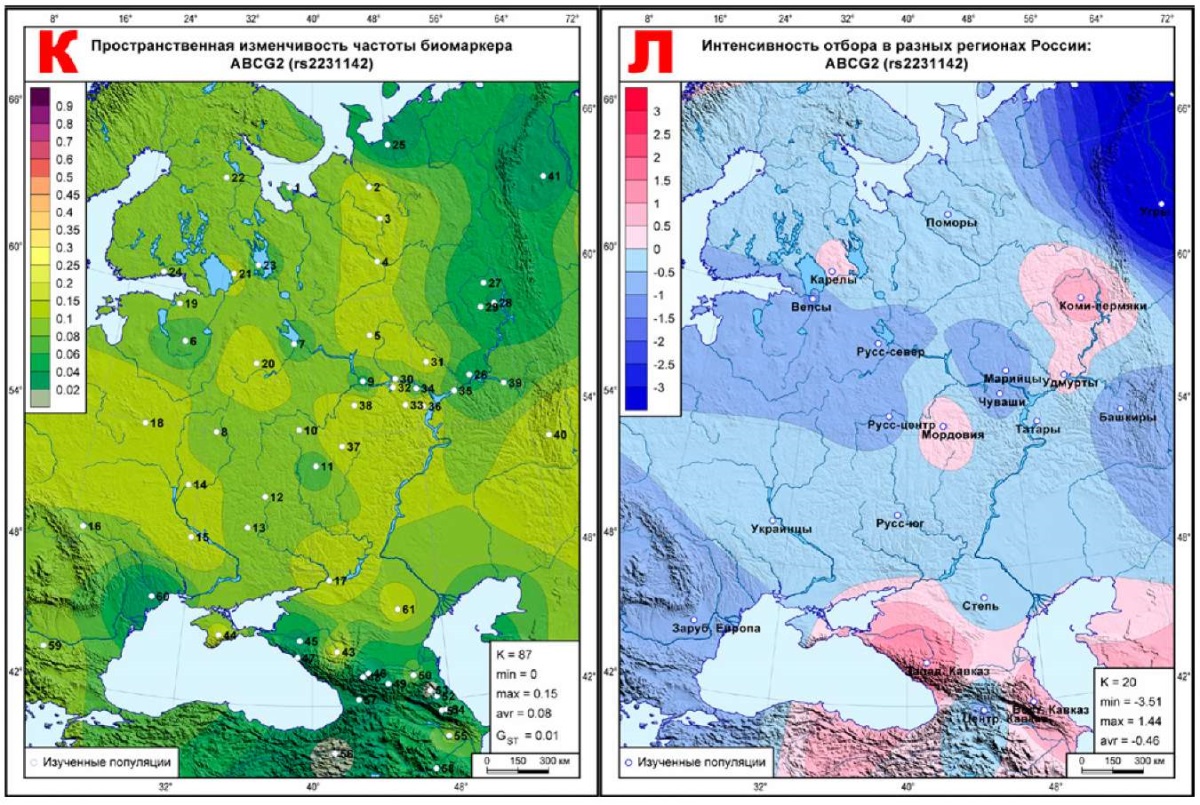
Рис. 2 Геногеография частоты (слева) и эффектов отбора (справа)
для фармакогенетических биомаркеров ССЗ,
условно селективно-нейтральных:
А, Б: CYP2D6 (rs3892097);
В, Г: ADRB1 (rs1801252);
Д, Е: CYP2C19 (rs4986893);
Ж, И: P2RY12 (rs2046934);
К, Л: ABCG2 (rs2231142).
Примечание: ССЗ — сердечно-сосудистые заболевания.
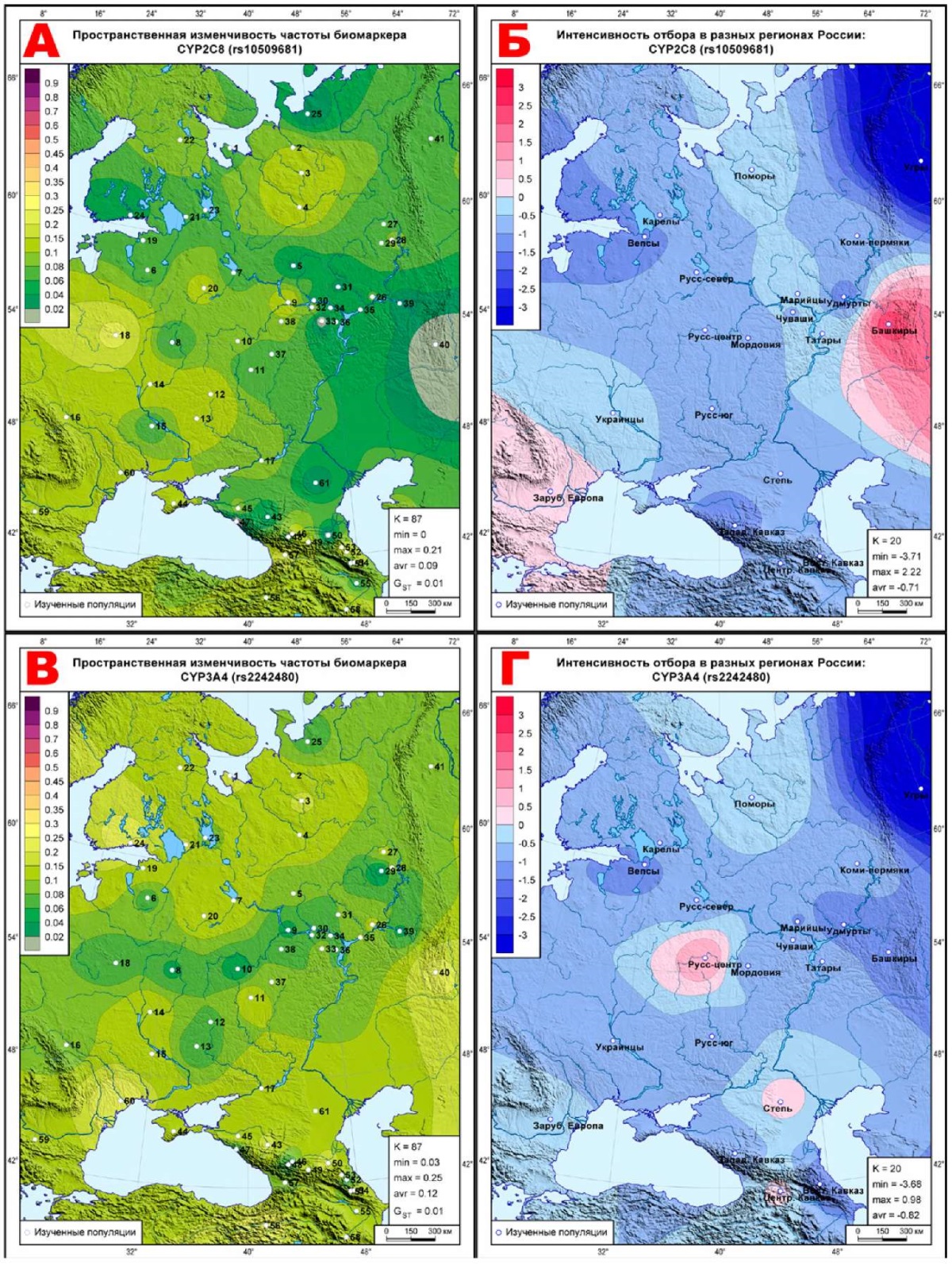
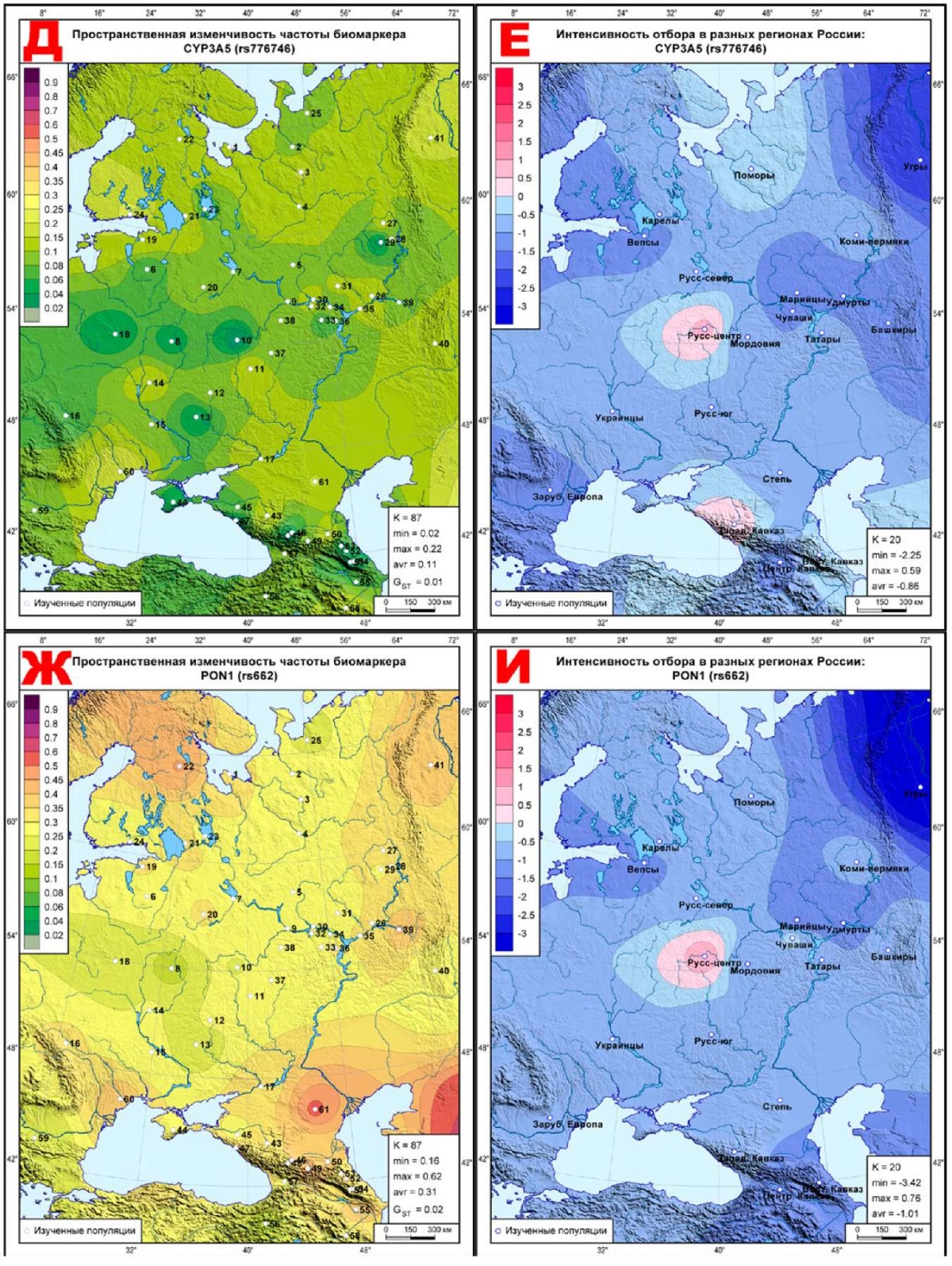
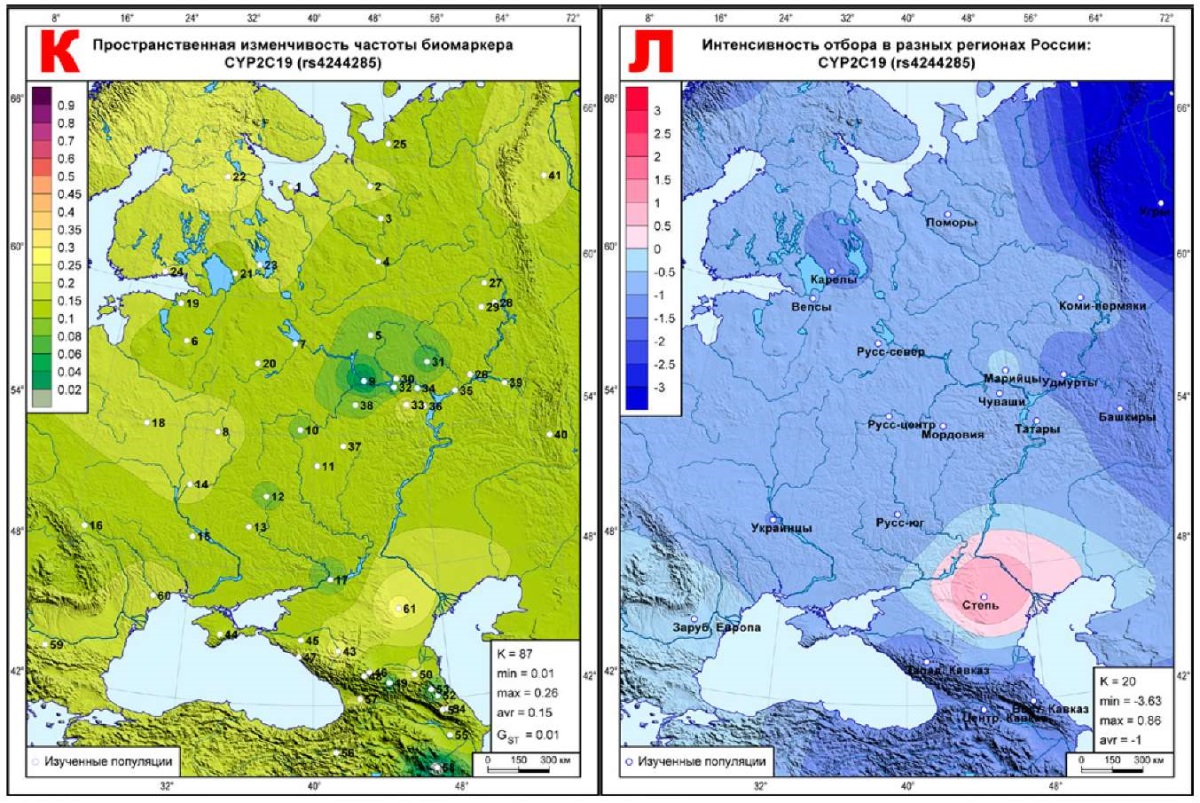
Рис. 3 Геногеография частоты (слева) и эффектов отбора (справа)
для фармакогенетических биомаркеров ССЗ,
подверженных стабилизирующему отбору:
А, Б: CYP2C8 (rs10509681);
В, Г: CYP3A4 (rs2242480);
Д, Е: CYP3A5 (rs776746);
Ж, И: PON1 (rs662);
К, Л: CYP2C19 (rs4244285).
Примечание: ССЗ — сердечно-сосудистые заболевания.
Геногеография дифференцирующего отбора
Весь ареал всех 5-и карт окрашен в красные тона дифференцирующего отбора, указывая на его действие во всех метапопуляциях. Исключение составляет карта (рисунок 1Л) CYP4F2*3 (rs2108622), где среднее давление дифференцирующего отбора (‾∆=1,04) меньше, чем у остальных 4-х биомаркеров (1,51<‾∆<2,21) этого класса (рисунок 1). И поэтому на карте этого маркера (рисунок 1Л) две метапопуляции обозначены синим цветом, указывающим на действие в этих метапопуляциях стабилизирующего отбора: для удмуртов ∆=-0,61, для угров ∆=-2,40. На остальных картах рисунка 1 отбор варьирует в рамках дифференцирующего отбора, но в некоторых метапопуляциях настолько смягчается, что уже близок к селективной нейтральности. Например, на рисунках 1Б и 1Е — такие метапопуляции обнаруживаются на юге и в Приуралье, на рисунке 1Г — на Западном и Центральном Кавказе, а на рисунке 1И, кроме Кавказа, уменьшение давления отбора уже охватывает метапопуляции северо-запада (карелы, вепсы, поморы), и далее снижение дифференцирующего отбора тянется до правобережья Волги. На рисунке 1Л отбор снижается до селективной нейтральности в центре ареала — во всех трех русских популяциях и у чувашей, а также в Зарубежной Европе и на Восточном Кавказе.
Геногеография условно селективно-нейтральной изменчивости
Карты этого класса окрашены в тона обоих типов отбора — дифференцирующего и стабилизирующего. Кроме двух интервалов (-0,5<∆<0,5) условной селективной нейтральности, видим и усиление отбора в ряде метапопуляций: на карте CYP2D6 (rs3892097) (рисунок 2Б) дифференцирующий отбор (красные тона) проявляется у центральных русских и марийцев, а стабилизирующий отбор — на юге ареала. На карте ADRB1 (rs1801252) (рисунок 2Г) дифференцирующий отбор ярко проявился на северо-востоке и на юге, а стабилизирующий — у вепсов, удмуртов и на Центральном Кавказе. Карта отбора CYP2C19 (rs4986893) (рисунок 2Е) уже почти вся окрашена в синие тона близости к стабилизирующему отбору, а дифференцирующий обнаружен только в степной метапопуляции. Схожую картину мы видим и на карте P2RY12 (rs2046934) (рисунок 2И), где выраженный дифференцирующий отбор сосредоточен на Кавказе, с невысокими значениями обнаруживается у коми и южных русских, а остальной ареал принадлежит синим тонам стабилизирующего отбора. Здесь уже нет выраженного дифференцирующего отбора — за пределы селективной нейтральности незначительно выходят лишь метапопуляции коми-пермяков и Кавказа. Но и стабилизирующий отбор ярко выражен лишь у угров, а в целом почти все метапопуляции близки к селективной нейтральности.
Геногеография стабилизирующего отбора
Карты этого блока продолжают тенденцию предыдущего: постепенное нарастание синих тонов стабилизирующего отбора с выявлением тех метапопуляций, где действует дифференцирующий отбор. Так, на карте CYP2C8 (rs10509681) (рисунок 3Б) коридор нейтральных значений тянется от поморов к татарам, переходя у башкир к ярко выраженному дифференцирующему отбору. Селективно-нейтральные значения на этой карте занимают юго-запад (украинцы, Зарубежная Европа). Полоса невысоких значений стабилизирующего отбора находится между этими двумя зонами нейтральных значений, простираясь от северо-запада до Кавказа. При этом ядро максимального стабилизирующего отбора (угры, ∆=-3,71) находится вблизи от ядра максимального дифференцирующего отбора (башкиры, ∆=+2,22). Остальные карты этого блока в целом схожи — везде максимальные значения стабилизирующего отбора приходятся на угров, ареалы селективно-нейтральных показателей почти исчезают, уступая ровному ландшафту стабилизирующего отбора. Он нарушается небольшими всплесками дифференцирующего отбора в двух метапопуляциях: у центральных русских на картах трех биомаркеров (∆=+0,98, CYP3A4 (rs2242480), рисунок 3Г; ∆=+0,59, CYP3A5 (rs776746), рисунок 3Е; ∆=+0,76, PON1 (rs662), рисунок 3И) и у степных народов на карте CYP2C19 (rs4244285), где ∆=+0,66 (рисунок 3Л).
Обсуждение
Предложенная геногеографическая технология позволяет выделять те биомаркеры и популяции, на которые стоит обратить внимание при разработке общей стратегии внедрения персонализированных подходов с использованием знаний фармакогенетики пациентов в том или ином регионе или в группе популяций.
Биомаркеры, находящиеся под давлением стабилизирующего отбора, близки по своим показателям у разных этнических групп региона. Селективно-нейтральные маркеры более изменчивы у разных народов. Биомаркеры, подверженные дифференцирующему отбору, значительно различаются в разных популяциях. Знание этих закономерностей позволяет выделять регионы и отдельные популяции, где внедрение и использование соответствующих фармакогенетических протоколов будет клинически и клинико-экономически обоснованным.
Различия по межпопуляционной изменчивости биомаркеров отчасти отражаются и в их частоте. Так, средняя частота биомаркеров (таблица 2) в классе дифференцирующего отбора (‾q=0,30) в ~2 раза выше средней частоты биомаркеров в двух других классах — и селективно-нейтральных (‾q=0,17), и подверженных стабилизирующему отбору (‾q=0,17). Но это лишь общая тенденция: ориентироваться только на показатель частоты нельзя. И в классе дифференцирующего отбора есть SNP-маркеры с невысокими частотами: ‾q=0,13 ABCG2 (rs2231137), ‾q=0,15 CYP2D6 (rs1065852), ‾q=0,19 SLCO1B1 (rs4149056). И в классах селективной нейтральности и стабилизирующего отбора встречаются биомаркеры с высокой средней частотой: ‾q=0,49 ABCB1 (rs4148738), ‾q=0,43 ABCB1 (rs1045642), ‾q=0,31 PON1 (rs662).
То же можно сказать и о размахе изменчивости (qMAX — qMIN): в среднем он в 2 раза больше (таблица 2) в классе дифференцирующего отбора (0,55), чем в других классах — и селективно-нейтральном (0,26), и стабилизирующего отбора (0,27). Но и из этой общей тенденции есть исключения. В классе дифференцирующего отбора есть SNP-маркеры с небольшим диапазоном вариации частоты (qMAX — qMIN): 0,33 CYP2D6 (rs1065852), 0,28 SLCO1B1 (rs4149056), а в других классах — маркеры с большим диапазоном частот: 0,44 ADRB1 (rs1801252), 0,46 PON1 (rs662).
Поэтому наиболее полезным инструментом оказывается не "средняя температура по больнице", а геногеографические карты: они дают не только общерегиональные, но и конкретные показатели отбора в конкретных популяциях. Приведенные карты геногеографического атласа отбора (рисунки 1-3) показывают, что даже на территориально близкие популяции могут действовать разные типы отбора (например, рисунки 1Л, 2И, 3Б). Здесь наиболее показателен Кавказ: например, для P2RY12 (rs2046934) на Западном Кавказе обнаружена селективно-нейтральная изменчивость, на Центральном Кавказе — дифференцирующий отбор, на Восточном Кавказе — стабилизирующий (рисунок 2И). Для маркера ADRB1 (rs1801252) наблюдается не меньшее разнообразие: на Центральном Кавказе действует стабилизирующий отбор, а на Западном и Восточном — дифференцирующий (рисунок 2Г). Если учесть, что для региона Восточной Европы в целом эти маркеры отнесены к селективно-нейтральным, становится очевидной необходимость использования геногеографических карт для анализа эффектов отбора в конкретных метапопуляциях. Чтение этих карт не требует специальной подготовки: популяции, требующие осторожности в применении стандартных фармакотерапевтических протоколов, на карте отмечены интенсивным красным цветом.
Ограничения исследования. Определенные ограничения исследования связаны с малым количеством исследованных биообразцов в отдельных регионах (средние объемы выборок указаны в таблице 2) по 6 биомаркерам: ADRB1 (rs1801252), CYP2D6 (rs1065852), CYP2D6 (rs3892097), CYP2C19 (rs12248560), CYP2C9 (rs1799853), P2RY12 (rs2046934).
Заключение
Геногеографические технологии отбора могут служить дополнительным инструментом при разработке этно-регионально адаптированных фармакогенетических протоколов и выявления приоритетных популяций для их внедрения.
Основой использования геногеографических технологий служит популяционный биобанк, содержащий биообразцы из основных популяций интересующего региона.
Для оценки отбора необходимо иметь базу данных фармакогенетических биомаркеров о данном регионе и базу данных с большой совокупностью других аутосомных SNP-маркеров, изученных в тех же популяциях и позволяющих оценить для них уровень селективно-нейтральных различий.
Данные этих двух баз необходимо организовать таким образом, чтобы они содержали данные об одних и тех же популяциях с репрезентативными выборками из каждой популяции.
Оценку отбора по данному биомаркеру можно получить сравнением оценки его межпопуляционных различий и оценки различий между этими же популяциями по большой совокупности аутосомных SNP-маркеров, которая дает точку отсчета — уровень селективно-нейтральной межпопуляционной изменчивости.
Те биомаркеры, изменчивость которых мало отличается от селективно-нейтральной, можно отнести к классу условно селективно-нейтральных. Если различия между популяциями по данному биомаркеру значительно меньше селективно-нейтральной изменчивости популяций, то этот биомаркер находится под действием стабилизирующего отбора. Если же межпопуляционные различия значительно превосходят селективно-нейтральный уровень, то данный биомаркер находится под давлением дифференцирующего отбора.
Именно биомаркеры, находящиеся под давлением дифференцирующего отбора, требуют разработки этно-регионально адаптированных подходов к использованию фармакогенетических протоколов.
Поскольку изменчивость и остальных биомаркеров обнаруживает отдельные популяции, находящиеся под действием дифференцирующего отбора, при выявлении приоритетных популяций для внедрения этно-регионально адаптированных подходов к использованию фармакогенетических протоколов необходимо использовать геногеографические карты отбора, указывающие на такие приоритетные популяции.
Благодарности. Авторы благодарят АНО "Биобанк Северной Евразии" за предоставление коллекций ДНК.
Отношения и деятельность. Исследование выполнено при поддержке гранта РНФ № 21-14-00363 (биоинформатический анализ, интерпретация результатов) и государственного задания Минобрнауки России для ФГБНУ "МГНЦ" (картографический и статистический анализ).
Список литературы
1. Johnson JA, Caudle KE, Gong L, et al. Clinical Pharmacogenetics Implementation Consortium (CPIC) guideline for pharmacogenetics guided warfarin dosing: 2017 update. Clin Pharmacol Ther. 2017;102(3):397404. doi:10.1002/cpt.668.
2. Lee CR, Luzum JA, Sangkuhl K, et al. Clinical pharmacogenetics implementation consortium guideline for CYP2C19 genotype and clopidogrel therapy: 2022 update. Clin Pharmacol Ther. 2022;112(5):95967. doi:10.1002/cpt.2526.
3. Mega JL, Close SL, Wiviott SD, et al. Genetic variants in ABCB1 and CYP2C19 and cardiovascular outcomes after treatment with clopidogrel and prasugrel in the TRITONTIMI 38 trial: a pharmacogenetic analysis. Lancet. 2010;376(9749):13129. doi:10.1016/S01406736(10)612731.
4. Cooper DeHoff RM, Niemi M, Ramsey LB, et al. The clinical pharmacogenetics implementation consortium guideline for SLCO1B1, ABCG2, and CYP2C9 genotypes and statin associated musculoskeletal symptoms. Clin Pharmacol Ther. 2022;111(5):100721. doi:10.1038/clpt.2014.125.
5. Kanuri SH, Kreutz RP. Pharmacogenomics of novel direct oral anticoagulants: newly identified genes and genetic variants. J Pers Med. 2019;9(1):7. doi:10.3390/jpm9010007.
6. Кукес В. Г., Сычев Д. А., Фейсал А. А. и др. Влияние индивидуальных особенностей пациентов на риск развития нежелательных лекарственных реакций. Вестник Росздравнадзора. 2011;(6):5963.
7. Степанов В. А. Геномы, популяции, болезни: этническая геномика и персонифицированная медицина. Acta Naturae. 2010;2(4):1834.
8. Mirzaev KB, Fedorinov DS, Ivashchenko DV, et al. ADME pharmacogenetics: future outlook for Russia. Pharmacogenomics. 2019;20(11):84765. doi:10.2217/pgs20190013.
9. Мирзаев К. Б., Федоринов Д. С., Иващенко Д. В. и др. Мультиэтнический анализ кардиологических фармакогенетических маркеров генов цитохрома Р450 и мембранных транспортеров в российской популяции. Рациональная фармакотерапия в кардиологии. 2019;15(3):393406. doi:10.20996/181964462019153393406.
10. Горин И. О., Петрушенко В. С., Записецкая Ю. С. и др. Применение популяционного биобанка для анализа частот клинически значимых ДНКмаркеров у населения России: биоинформатические аспекты. Кардиоваскулярная терапия и профилактика. 2020;19(6):2732. doi:10.15829/1728880020202732.
11. Балановская Е. В., Петрушенко В. С., Кошель С. М. и др. Картографический атлас распространения 45 фармакогенетических маркеров в народонаселении России и сопредельных стран. Вестник Российского государственного медицинского университета. 2020(6):3952. doi:10.24075/vrgmu.2020.080.
12. Пылев В. Ю., Агджоян А. Т., Горин И. О. и др. Популяционный биобанк как основа для выявления пространственной изменчивости клинически значимых фармакогенетических биомаркеров сердечно сосудистых заболеваний. Кардиоваскулярная терапия и профилактика. 2022;21(11): 3430. doi:10.15829/1728880020223430.
13. Balanovsky O, Petrushenko V, Mirzaev K, et al. Variation of genomic sites associated with severe Covid19 across populations: global and national patterns. Pharmacogenomics Pers Med. 2021;4:1391402. doi:10.2147/PGPM.S320609.
14. Балановская Е. В., Горин И. О., Петрушенко В. С. и др. Геногеография в России и мире SNPмаркеров гена LZTFL1, ассоциированных с тяжелым течением COVID19. Вестник Российского государственного медицинского университета. 2022;(5):3140. doi:10.24075/vrgmu.2022.047.
15. Балановская Е. В., Рычков Ю. Г. Этническая генетика: этногеографическое разнообразие генофонда народов мира. Генетика. 1990;26(1):11421.
16. Балановская Е. В., Нурбаев С. Д. Селективная структура генофонда. I. Возможности изучения. Генетика. 1997;33(11):1572.
17. Балановская Е. В., Нурбаев С. Д. Селективная структура генофонда. II. Стандартная технология определения через FST статистики. Генетика. 1998;34(9):130721.
18. Balanovska EV, Nurbaev SD. Selective structure of the gene pool. III. Technology of determination through FSTstatistics by means of numerical resampling. Genetics. 1998;34(10):143446. (In Russ.) Балановская Е.В, Нурбаев С. Д. Селективная структура генофонда. III. Технология определения через FSTстатистики с помощью численного ресэмплинга. Генетика. 1998;34(10):143446.
19. Piras I, Falchi A, Moral P, et al. Selective neutrality analysis of 17 STRs in Mediterranean populations. J Hum Genet. 2010; 55(4):20714. doi:10.1038/jhg.2010.7.
20. Lotterhos KE, Whitlock MC. Evaluation of demographic history and neutral parameterization on the performance of FST outlier tests. Mol Ecol. 2014;23(9):217892. doi:10.1111/mec.12725.
21. Bhatia G, Patterson N, Sankararaman S, et al. Estimating and interpreting FST: the impact of rare variants. Genome Res. 2013;23(9):151421. doi:10.1101/gr.154831.113.
22. Jin W, Xu S, Wang H, et al. Genomewide detection of natural selection in African Americans pre and postadmixture. Genome Res. 2012;22(3):51927. doi:10.1101/gr.124784.111.
23. McEvoy BP, Montgomery GW, McRae AF, et al. Geographical structure and differential natural selection among North European populations. Genome Res. 2009;19(5):80414. doi:10.1101/gr.083394.108.
24. Barreiro LB, Laval G, Quach H, et al. Natural selection has driven population differentiation in modern humans. Nat Genet. 2008;40(3):3405. doi:10.1038/ng.78.
25. Cherednichenko AA, Trifonova EA, Vagaitseva KV, et al. Association of the genenetic polymorphism of cytokines and their receptors with climate and geographic factors in human populations. Russ J Genet. 2014;50:11126. doi:10.1134/S1022795414100020.
26. Sivadas A, Salleh MZ, Teh LK, et al. Genetic epidemiology of pharmacogenetic variants in South East Asian Malays using whole genome sequences. Pharmacogenomics J. 2017;17(5): 46170. doi:10.1038/tpj.2016.39.
27. Chang CC, Chow CC, Tellier LC, et al. Second generation PLINK: rising to the challenge of larger and richer datasets. Gigascience. 2015;4(1):s1374201500478. doi:10.1186/s1374201500478.
28. Балановская Е. В., Жабагин М. К., Агджоян А. Т. и др. Популяционные биобанки: принципы организации и перспективы применения в геногеографии и персонализированной медицине. Генетика. 2016;52(12):137187. doi:10.7868/S001667581612002X.
29. Patterson N, Price AL, Reich D. Population structure and eigenanalysis. PLoS Genet. 2006;2(12):e190. doi:10.1371/journal.pgen.0020190.
30. Кошель С. М. Геоинформационные технологии в геногеографии. Современная географическая картография. 2012;15866.
Об авторах
Е. В. БалановскаяРоссия
Доктор биологических наук, профессор, главный научный сотрудник, заведующий лабораторией популяционной генетики человека.
Москва
И. О. Горин
Россия
Научный сотрудник лаборатории популяционной генетики человека.
Москва
Г. Ю. Пономарёв
Россия
Научный сотрудник лаборатории популяционной генетики человека.
Москва
В. Ю. Пылёв
Россия
Научный сотрудник лаборатории популяционной генетики человека, генеральный директор АНО "Биобанк Северной Евразии".
Москва
Р. О. Белов
Россия
Стажер сотрудник лаборатории популяционной генетики человека.
Москва
Э. А. Почешхова
Россия
Доктор медицинских наук, главный научный сотрудник лаборатории популяционной генетики человека, доцент, профессор кафедры биологии с курсом медицинской генетики.
Москва, Краснодар
Ш. П. Абдуллаев
Россия
Кандидат биологических наук, заведующий отделом предиктивных и прогностических биомаркеров НИИ молекулярной и персонализированной медицины.
Москва
К. Б. Мирзаев
Россия
Доктор медицинских наук, директор НИИ молекулярной и персонализированной медицины, проректор по научной работе и инновациям.
Москва
Д. А. Сычев
Россия
Академик РАН, доктор медицинских наук, профессор, профессор РАН, заведующий кафедрой клинической фармакологии и терапии им. акад. Б. Е. Вотчала, ректор.
Москва
Дополнительные файлы
Что известно о предмете исследования?
- Значительные различия между генофондами народов России требуют этно-региональной адаптации фармакогенетических тестов и выявления приоритетных регионов для их внедрения.
- Наиболее важны для решения этой задачи те фармакогенетические ДНК-маркеры и популяции, которые находятся под давлением дифференцирующего отбора.
Что добавляют результаты исследования?
- Сочетание геногеографической технологии, популяционного биобанка и базы данных по фармакогенетике позволило создать картографический атлас эффектов отбора для 24 фармакогенетических биомаркеров сердечно-сосудистых заболеваний.
- Карты атласа показывают, в каких популяциях России и по каким фармакогенам действует дифференцирующий отбор, и демонстрируют приоритетные популяции для внедрения этно-регионально адаптированных фармакогенетических протоколов.
Рецензия
Для цитирования:
Балановская Е.В., Горин И.О., Пономарёв Г.Ю., Пылёв В.Ю., Белов Р.О., Почешхова Э.А., Абдуллаев Ш.П., Мирзаев К.Б., Сычев Д.А. Геногеографические технологии популяционного биобанка как инструмент оценки эффектов отбора (на примере фармакогенетических биомаркеров сердечно-сосудистых заболеваний). Кардиоваскулярная терапия и профилактика. 2023;22(11):3773. https://doi.org/10.15829/1728-8800-2023-3773
For citation:
Balanovskaya E.V., Gorin I.O., Ponomarev G.Yu., Pylev V.Yu., Belov R.O., Pocheshkhova E.A., Abdullaev Sh.P., Mirzaev K.B., Sychev D.A. Genogeographic technologies of a population biobank as a tool for assessing selection effects (using the example of pharmacogenetic biomarkers of cardiovascular diseases). Cardiovascular Therapy and Prevention. 2023;22(11):3773. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3773
JATS XML

























































