Перейти к:
Создание в Ханты-Мансийском автономном округе — Югре коллекции биологических образцов пациентов, перенесших инфаркт миокарда
https://doi.org/10.15829/1728-8800-2023-3805
Аннотация
Цель. Создание коллекции образцов цельной крови, лейкоцитарной взвеси, геномной дезоксирибонуклеиновой кислоты у пациентов с инфарктом миокарда для фундаментальных и прикладных исследований в области медицины.
Материалы и методы. Сбор, транспортировка и обработка образцов биоматериала в биобанке медицинского института Сургутского государственного университета проведены по стандартным методикам с использованием рекомендаций, стандартных операционных процедур и национального руководства по биобанкированию.
Результаты. По состоянию на 1 сентября 2023г в коллекции собрано 744 аликвоты цельной крови и лейкоцитарной взвеси и выделено 108 образцов геномной дезоксирибонуклеиновой кислоты от 108 доноров, перенесших инфаркт миокарда. Аликвоты образцов из коллекции биобанка активно используются для ряда молекулярно-генетических исследований (генотипирование, массовое параллельное секвенирование).
Заключение. Собранная коллекция биологических образцов пациентов в биобанке на базе Сургутского государственного университета обеспечивает текущие и будущие научно- исследовательские проекты в кардиологии качественным биоматериалом.
Для цитирования:
Морозкина А.В., Воробьев А.С., Донников М.Ю., Коваленко Л.В., Сафронова М.Л., Гапурова А.Х., Николаев К.Ю. Создание в Ханты-Мансийском автономном округе — Югре коллекции биологических образцов пациентов, перенесших инфаркт миокарда. Кардиоваскулярная терапия и профилактика. 2023;22(11):3805. https://doi.org/10.15829/1728-8800-2023-3805
For citation:
Morozkina A.V., Vorobev A.S., Donnikov M.Yu., Kovalenko L.V., Safronova M.L., Gapurova A.Kh., Nikolaev K.Yu. Creation of a biosample collection from patients after myocardial infarction in the Khanty Mansi Autonomous Okrug — Yugra. Cardiovascular Therapy and Prevention. 2023;22(11):3805. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3805
Введение
Реализация важной задачи ранней диагностики сердечно-сосудистых заболеваний (ССЗ) невозможна без развития института биобанкирования. Современные клинические исследования обеспечивают поток клинических, инструментальных и лабораторных данных, которые хранятся в особых регистрах, специализированных для исследуемой патологии. По мере развития и внедрения персонализированной медицины представляется актуальным ведение регистров пациентов одновременно с накоплением образцов крови и ее компонентов в биобанках для изучения новых биохимических и генетических маркеров ССЗ [1][2]. С одной стороны, для надлежащей лабораторной практики необходимым условием является не только достаточное количество биообразцов, сбор которых может занять длительное время, но и высокое качество содержащихся в образцах нуклеиновых кислот и ряда других биохимических молекул, которые являются перспективными для исследований [3][4]. С другой стороны, относительная дороговизна экспресс-диагностики "у койки пациента" (point-of-care) обусловливает необходимость фармакогенетического тестирования в асинхронном режиме, а бурное развитие новых тест-систем позволяет изучать новые молекулы по мере их извлечения из хранимого биоматериала при возникающей потребности, что особенно актуально для пациентов с инфарктом миокарда (ИМ) [5].
Материал и методы
Диагностика ИМ основывалась на стандартных критериях (жалобы, биомаркеры, характерные изменения на электрокардиограмме), в соответствии с отечественными и международными клиническими рекомендациями [6][7].
Образцы биоматериала были последовательно собраны на этапе стационарного лечения в Бюджетном учреждении Ханты-Мансийский автономного округа — Югры Окружном кардиологическом диспансере "Центр диагностики и сердечно-сосудистой хирургии" (БУ ХМАО-Югры "ЦД и ССХ") в г. Сургуте у пациентов с ИМ. Сбор венозной крови проводили натощак в утренние часы в пробирки с этилендиаминтетрауксусной кислотой и транспортировали в течение 2 ч в термоконтейнере с хладоэлементами (+4º С) в биобанк Медицинского института (МИ) Сургутского государственного университета (СурГУ) с использованием стандартных операционных процедур, разработанных в генетической лаборатории МИ СурГУ и валидированных на основе рекомендаций Национального руководства по биобанкированию [5]. Период сбора образцов занял 6 мес.
При включении в исследуемую группу всеми пациентами было подписано информированное добровольное согласие на сбор и хранение образцов крови и ее компонентов в биобанке, одобренное локальным этическим комитетом СурГ У. Пациентам проведено полное разъяснение использования образцов биоматериала исключительно в научных целях. В исследование не включали пациентов, не подписавших информированное добровольное согласие, имеющих тяжелую сопутствующую соматическую патологию (терминальная хроническая болезнь почек, онкологическое заболевание с метастазированием, вирус иммунодефицита человека), ограничивающую вероятность выживания пациента по поводу ИМ.
В день доставки образцов в биобанк осуществлялось аликвотирование цельной крови с этилендиаминтетрауксусной кислотой в криопробирки объемом 1 мл в штативе на 96 лунок (LVL Technologies GmbH, Германия) и размещение на длительное хранение в морозильной камере (Haier DW-86L48) с постоянной температурой -80º С. Выделение геномной дезоксирибонуклеиновой кислоты (ДНК) (гДНК) осуществляли с помощью набора Blood DNA Mini Kit (Foregene, КНР). Микроаликвоту выделенного образца гДНК использовали для оценки качества и подготовки библиотек для проведения таргетного секвенирования; оставшийся объем размещали на длительное хранение при низкой температуре (см. выше). Измерение концентрации образцов проводили с использованием набора реагентов Qubit dsDNA HS Assay Kit и Lumiprobe QuDye dsDNA HS Assay Kit на флуориметре Qubit 3.0 (Thermo Fisher Scientific, США). Оценка качества гДНК и библиотек ДНК проведена согласно стандартным методам [5]. Оценка целостности и размеров образцов гДНК и библиотек ДНК проведена путем капиллярного гель-электрофореза на анализаторе Qsep100 (BiOptic, Тайвань). Чистота ДНК оценивалась по соотношению A260/A280 и A260/A230 на спектрофотометре BioMate160 (Thermo Fisher Scientific, США). Соотношение A260/A280 >1,8 и соотношение A260/A230 >2,0 соответствовало образцу гДНК высокого качества. Значение <1,8 могло указывать на загрязнение образца полипептидами, >2 — на возможную деградацию и наличие свободных нуклеотидов. Сравнение концентраций выполнили с применением однофакторного дисперсионного анализа (F).
Результаты
По состоянию на сентябрь 2023г общая емкость коллекции составляет 842 аликвоты, из них 744 — цельной крови, 108 — гДНК, полученных от 108 уникальных доноров, перенесших ИМ. Налажен стабильный поток образцов от клинической базы СурГУ БУ ХМАО-Югры "ЦД и ССХ". Сбор биоматериала продолжается, но уже сейчас очевидно, что коллекция является уникальной для ХМАО-Югры. Собранные образцы и ассоциированные с ними данные позволили начать проведение ряда прикладных научных проектов. Например, с использованием собранных образцов реализовано фармакогенетическое исследование по определению генотипов CYP2C19 и VEGFR методом полимеразной цепной реакции в реальном времени, а также таргетное секвенирование с кастомизированной таргетной панелью для поиска генетических маркеров сердечно-сосудистой патологии (Roche, США) [8].
Клинико-анамнестическая характеристика пациентов с ИМ, образцы которых были использованы для создания настоящей коллекции, представлена в таблице 1.
Таблица 1
Клинико-анамнестическая характеристика пациентов с ИМ (n=108)
|
Характеристики |
Количество больных |
|
|
n |
% |
|
|
Пол: — мужской (57,2±4,6 лет) — женский (61,7±5,9 лет) |
86 22 |
79,6 20,4 |
|
Тип ИМ: — с подъемом сегмента ST — без подъема сегмента ST |
67 41 |
62,0 38,0 |
|
Локализация ИМ: — передняя — задняя |
63 45 |
58,3 41,7 |
|
ИМ, развившийся: — впервые — повторно |
92 16 |
85,2 14,8 |
|
Классы Killip: — I — II — III — IV |
56 38 9 5 |
51,9 35,2 8,3 4,6 |
|
Артериальная гипертензия |
91 |
84,3 |
|
Сахарный диабет 2 типа |
20 |
18,5 |
Примечание: n — количество пациентов,
ST — отрезок кривой электрокардиограммы,
ИМ — инфаркт миокарда.
Преимущественное большинство в сформированной когорте составили пациенты мужского пола (79,6%), ИМ с подъемом сегмента ST был диагностирован у 62% лиц, ИМ передней локализации был установлен в 58,3% случаев; ИМ перенесли впервые 85,2% больных. Низкие классы Killip (I-II) острой сердечной недостаточности имели место у наибольшего количества пациентов (87,1%). Среди сопутствующих заболеваний артериальная гипертензия имела место у 84,3% пациентов; сахарный диабет 2 типа установлен в 18,5% случаев (таблица 1). Данная выборка из 108 лиц с ИМ является репрезентативным фрагментом общей когорты, состоящей из 742 пациентов с ИМ, у которых были собраны образцы крови на протяжении 11 лет (2012-2023гг) для оценки сывороточных уровней ряда информативных кардиальных биохимических маркеров и фармакогенетического тестирования. Полученные биомолекулярные данные наряду с клиническими характеристиками и показателями визуализации миокарда активно используются для построения предиктивных моделей оценки отдаленных исходов ИМ [9][10].
Сбор образцов был начат в январе 2023г, и по состоянию на 1 сентября 2023г коллекция включала 744 аликвоты цельной крови, лейкоцитарной взвеси и 108 образцов гДНК от 108 доноров. Среднее количество аликвот на один уникальный образец составило 6-8 пробирок (объемом 1 мл). Поступление образцов биоматериала доноров с патологией сердечно-сосудистой системы в биобанк в 2023г было равномерным, среднемесячный показатель составил 14 образцов (рисунок 1).
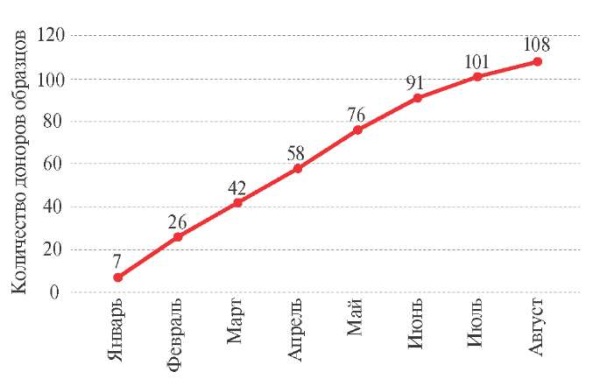
Рис. 1 Динамика прироста количества образцов
в коллекции биобанка СурГУ в 2023г.
В биобанке МИ СурГУ собирается коллекция образцов гДНК, выделенная из аликвот цельной крови, хранящихся при -80º С не >2 мес. Контроль качества образцов гДНК показал, что исследуемые образцы имеют высокую чистоту по соотношению А260/А280 и удовлетворительную по соотношению А260/А230, которая не снижается за период хранения (таблица 2). Диапазон 1,7≤A260/A230<2,0 считается пригодным для использования биообразца в молекулярно-генетических исследованиях [5].
Таблица 2
Оценка качества гДНК
|
Срок хранения, мес. |
n |
Концентрация ДНК, нг/мкл |
Соотношение А260/А280 |
Соотношение А260/А230 |
Индекс качества ДНК (DQN) |
|
M±m |
M±m |
M±m |
M±m |
||
|
<1 |
50 |
45,14±1,01 |
1,86±0,01 |
1,81±0,01 |
9,5±0,5 |
|
1-2 |
50 |
44,60±1,36 |
1,85±0,02 |
1,83±0,02 |
9,4±0,5 |
|
2-6 |
50 |
43,20±1,44 |
1,87±0,04 |
1,80±0,06 |
9,3±0,6 |
|
>6 |
20 |
43,08±1,48 |
1,88±0,03 |
1,81±0,09 |
9,2±0,7 |
Примечание: n — количество исследуемых образцов,
М — среднее значение,
m — стандартная ошибка;
A260/280 — отношение поглощения на длинах волн 260 и 280 нм,
А260/А230 — отношение поглощения на длинах волн 260 и 230 нм,
гДНК — геномная ДНК.
Анализ концентрации гДНК в образцах, выделенных из аликвот цельной крови в первые дни и недели после поступления в биобанк, показал, что хранение гДНК при -80º С в течение 6 мес. практически не влияет на концентрацию (F=1,25; р=0,291) (таблица 2). При количественной оценке целостности индекс качества (DNA Quality Number, DQN) был >7, что также свидетельствует о хорошем качестве образцов ДНК (таблица 2) [5. С. 223].
Оценка целостности библиотек ДНК на системе капиллярного электрофореза Qsep100 показала отсутствие чрезмерно коротких и сверхдлинных фрагментов (характерный паттерн приведен на рисунке 2). Качество библиотек через 6 мес. хранения соответствует рекомендованному производителем (Roche) медианному значению в 350-400 пар оснований (п.о.). В дальнейшем планируется проведение регулярной оценки качества образцов с более длительным сроком хранения (>6 мес.) при -80º С.

Рис. 2 Результаты капиллярного электрофореза для библиотеки ДНК
(образец №60К23Щ).
Примечание: изображение получено на приборе Qsep100TM (BiOptic, Тайвань)
с помощью программного обеспечения Q-AnalyzerTM.
RFU — относительные единицы флуоресценции (relative fluorescence units),
Length (bp) — длина фрагментов (п.о.),
п.о. — пар оснований.
Цветное изображение доступно в электронной версии журнала.
Очевидно, что стандартизация процедур сбора образцов биоматериала, их обработки, выделения гДНК на всех этапах создания коллекции обеспечивает высокую воспроизводимость получаемых результатов исследований.
Обсуждение
Успешное развитие разветвленной системы биобанков на Западе и в России подтверждает необходимость создания региональных "малых" (базовых) институтских биобанков, которые дают любому научно-образовательному учреждению возможность развернуть активную исследовательскую деятельность нового порядка и стать непосредственным участником развития методов трансляционной и персонализированной медицины — в частности, обеспечивая возможность поиска перспективных биомаркеров и ранней диагностики ССЗ [11-14]. Ввиду географических особенностей ХМАО-Югры и удаленности многих населенных пунктов, а также высокого риска смерти после перенесенного ИМ, своевременный сбор биологических образцов в период нахождения пациентов в стационаре очень важен. Однако длительное хранение крови и ее компонентов в стандартных лабораторных условиях невозможно из-за отсутствия низкотемпературных морозильников, системы бесперебойного электроснабжения и т.д., что в дальнейшем может сказаться на результатах исследований или привести к потере образцов.
Впервые в ХМАО-Югре был реализован проект создания региональной коллекции образцов биоматериала, полученных от пациентов с сердечно-сосудистой патологией. Размещение образцов биоматериала в биобанке МИ СурГУ позволило собрать и разместить на долговременное хранение репрезентативную выборку образцов. Для успешного проведения таргетного секвенирования к образцам ДНК предъявляются высокие требования: суммарная концентрация 100-150 нг в образце и достаточная степень очистки. В литературе накоплено достаточное количество информации о результатах долгосрочного хранения образцов цельной крови и гДНК, однако данные противоречивы. Большинство авторов указывают, что при длительном хранении цельной крови наблюдается снижение концентрации выделенной ДНК, но без изменения профиля метилирования и качества ДНК [15][16]; однако есть публикации, в которых не выявлена связь между временем хранения цельной крови и концентрацией выделенной ДНК [17]. Считается, что концентрация гДНК в элюатах с буферными растворами незначительно снижается в процессе хранения, в отличие от хранения замороженных образцов цельной крови. Оценка качества образцов, собранных в биобанке, подтверждает пригодность их использования для молекулярно-генетических исследований, включая секвенирование нового поколения. Аналогичный подход с использованием коллекции образцов, собранных в популяционном биобанке, применен для фармакогенетического тестирования пациентов с ССЗ в Восточной Европе, на Северном Кавказе, в Приуралье и Русской равнине [13].
Не менее важен централизованный электронный учет потока биообразцов и сопроводительной информации, обеспечивающие поддержание актуальной базы данных, интегрирующей все ключевые параметры коллекции и быстрый доступ к любому элементу коллекции для исследователей. Кроме того, в современных условиях становится актуальным создание дата-центра при биобанке, где будут храниться большие объемы биомедицинских данных (клинические, биомаркеры, генетика) о каждом пациенте, которые будут накапливаться по мере оценки новых молекул в его образцах и анализироваться с использованием методов биоинформатики и биостатистики, математической биологии, которые также постоянно совершенствуются и требуют надежного хранения анализируемой информации.
Проведенное исследование было ограничено сбором образцов биоматериала на одной клинической базе (БУ ХМАО-Югры "ЦД и ССХ", г. Сургут). Это было обосновано тем, что данная медицинская организация является региональным центром координации оказания медицинской помощи пациентам с болезнями системы кровообращения в ХМАО-Югре, в т.ч. обеспечивающим диагностику и лечение пациентов с ИМ в округе: по данным 2022г, в центре было пролечено 1077 (54%) больных ИМ от общего количества (1999) данной категории пациентов в округе. Еще одним ограничением настоящего исследования явился отбор в исследуемую когорту пациентов только с ИМ (без включения больных хронической ишемической болезнью сердца), что было определено необходимостью последующего таргетного секвенирования коллекции образцов биоматериала для поиска лиц с генетически обусловленным высоким риском повторных сердечно-сосудистых катастроф и формирования из них фокусной группы интенсивного наблюдения с применением телемедицинских технологий.
Заключение
Актуальность сбора образцов биоматериала у пациентов с перенесенным ИМ подтверждается наличием негативного прогноза в контексте высокого риска смерти и низкой мобильности из-за постинфарктной сердечной недостаточности. В ХМАО-Югре в силу суровых климатических условий и низкой плотности населения, проживающего на обширной территории, создание регионального биобанка путем объединения организационных усилий как клинического учреждения, так и высшего учебного заведения, позволяет проводить изучение новых биомаркеров и разрабатывать современные методы терапии и профилактики ССЗ. Таким образом, коллекция образцов биоматериала, созданная на базе биобанка МИ СурГУ, призвана обеспечить текущие и будущие научно-исследовательские проекты качественным биоматериалом, в т.ч. за счет пробоподготовки и долговременного хранения образцов высокого качества в соответствии с разработанными стандартными операционными процедурами.
Отношения и деятельность. Исследование выполнено при финансовой поддержке Фонда научно-технологического развития Югры в рамках научного проекта № 2022-05-04.
Список литературы
1. Гненная Н. В., Тимофеева С. В., Ситковская А. О. и др. Создание коллекции образцов компонентов крови больных множественной миеломой. Кардиоваскулярная терапия и профилактика. 2021;20(8):3043. doi:10.15829/1728880020213043.
2. Илларионов Р. А., Косякова О. В., Вашукова Е. С. и др. Особенности создания коллекции образцов беременных женщин на разных сроках гестации для поиска ранних биомаркеров преждевременных родов. Кардиоваскулярная терапия и профилактика. 2020;19(6):2708. doi:10.15829/1728880020202708.
3. Долудин Ю. В., Лимонова А. С., Козлова В. А. и др. Сбор и хранение ДНКсодержащего биоматериала и выделенной ДНК. Кардиоваскулярная терапия и профилактика. 2020;19(6): 2730. doi:10.15829/1728880020202730.
4. Калинин Р. С., Голева О. В., Илларионов Р. А. и др. Формирование биобанка в структуре научных и лечебно диагности ческих учреждений и перспективы межрегиональной интеграции Кардиоваскулярная терапия и профилактика. 2022;21(11): 3401. doi:10.15829/1728880020223401.
5. Анисимов С. В., Ахмеров Т. М., Балановский О. П. и др. Биобанкирование. Национальное руководство. М: ООО "Издательство Триумф", 2022. 308 с. ISBN: 9785936733222.
6. Thygesen K, Alpert J, Jaffe A, et al. Fourth Universal Definition of Myocardial Infarction (2018). Circulation. 2018;138(20):e61851. doi:10.1161/CIR.0000000000000617.
7. Аверков О. В., Дупляков Д. В., Гиляров М. Ю. и др. Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы. Клинические рекомендации 2020. Рос сийский кардиологический журнал. 2020;25(11):4103. doi:10.15829/1560407120204103.
8. Воробьев А. С., Лифшиц Г. И., Зеленская Е. М. и др. Результаты исследования клинически значимых генотипов CYP2C19 у больных инфарктом миокарда в условиях северного региона России. Российский кардиологический журнал. 2023; 28(10):5533. doi:10.15829/1560407120235533.
9. Vorobev AS, Kashtalap VV, Urvantseva IA, et al. Association of cardiovascular biomarkers with myocardial and coronary imaging characteristics in patients having acute myocardial infarction and type 2 diabetes mellitus. Complex Issues of Cardiovascular Diseases. 2021;10(2S):1046. doi:10.17802/230612782021102S104106.
10. Во робьев А. С., Коваленко Л. В., Николаев К. Ю. и др. Клинико прогностическое значение тканевого ингибитора металлопротеиназы1 в развитии ремоделирования миокарда у пациентов, перенесших инфаркт миокарда с зубцом Q. Атеросклероз. 2019;15(2):1723. doi:10.15372/ATER20190203.
11. Борисова А. Л., Покровская М. С., Мешков А. Н. и др. Стандарт по биобанкированию ISO 20387. Анализ требований и опыт внедрения. Клиническая лабораторная диагностика. 2020;65(9):58792. doi:10.18821/086920842020659587592.
12. Покровская М. С., Борисова А. Л., Метельская В. А. и др. Роль биобанкирования в организации крупномасштабных эпидемиологических исследований. Кардиоваскулярная терапия и профилактика. 2021;20(5):2958. doi:10.15829/1728880020212958.
13. Пылев В. Ю., Агджоян А. Т., Горин И. О. и др. Популя ционный биобанк как основа для выявления пространственной изменчивости клинически значимых фармако генетических биомаркеров сердечнососудистых заболеваний. Кардиоваскулярная терапия и профилактика. 2022;21(11):3430. doi:10.15829/1728880020223430.
14. Кит О. И., Тимофеева С. В., Ситковская А. О. и др. Биобанк ФГБУ "НМИЦ онкологии" Минздрава России как ресурс для проведения исследований в области персонифицированной медицины. Современная онкология. 2022;24(1):611. doi:10.26442/18151434.2022.1.201384.
15. Bulla A, Witt B, Ammerlaan W, et al. Blood DNA Yield but Not Integrity or Methylation Is Impacted After Long Term Storage. Biopreserv Biobank. 2016;14(1):2938. doi:10.1089/bio.2015.0045.
16. Скирко О. П., Мешков А. Н., Ефимова И. А. и др. Срок хранения образцов цельной крови в биобанке и выход выделенной из нее дезоксирибонуклеиновой кислоты при проведении генетических исследований. Кардиоваскулярная терапия и профилактика. 2020;19(6):2726. doi:10.15829/1728880020202726.
17. Chen WC, Kerr R, May A, et al. The Integrity and Yield of Genomic DNA Isolated from Whole Blood Following Long Term Storage at 30оC. Biopreserv Biobank. 2018;16(2):10613. doi:10.1089/bio.2017.0050.
Об авторах
А. В. МорозкинаРоссия
Анна Владимировна Морозкина — кандидат биологических наук, ведущий научный сотрудник научно- образовательного центра медицинского института.
Сургут
А С Воробьев
Россия
Кандидат медицинских наук, ведущий научный сотрудник научно- образовательного центра, доцент кафедры кардиологии медицинского института, врач-кардиолог отдела госпитализации с телемедицинским центром, зам. заведующий кафедрой кардиологии.
Сургут
М Ю Донников
Россия
Кандидат медицинских наук, врач-лабораторный генетик, ведущий научный сотрудник научно- образовательного центра медицинского института.
Сургут
Л В Коваленко
Россия
Доктор медицинских наук, директор медицинского института, заведующий кафедрой патофизиологии и общей патологии.
Сургут
М Л Сафронова
Россия
Магистрант института естественных и технических наук, эксперт центра коллективного пользования.
Сургут
А Х Гапурова
Россия
Магистрант института естественных и технических наук, лаборант центра коллективного пользования.
Сургут
К Ю Николаев
Россия
Доктор медицинских наук, профессор кафедры кардиологии, заведующий лабораторией неотложной терапии.
Сургут, Новосибирск
Дополнительные файлы
Что известно о предмете исследования?
- Благодаря стандартизации работы, биобанки обеспечивают высокое качество сохраняемых образцов биоматериала для разнообразных видов биомедицинских исследований.
- Коллекция образцов биоматериала пациентов с сердечно-сосудистыми заболеваниями с подробной сопровождающей информацией позволяет выполнять как ретроспективный анализ, так и прогнозирование исходов социально-значимых заболеваний.
Что добавляют результаты исследования?
- Собрана и описана уникальная для региона ХМАО-Югра коллекция образцов биологического материала пациентов, перенесших инфаркт миокарда.
- Качество образцов и сопроводительной информации позволяют эффективно использовать биоматериал в молекулярно-генетических исследованиях, в т.ч в формате сотрудничества между разными научными коллективами.
Рецензия
Для цитирования:
Морозкина А.В., Воробьев А.С., Донников М.Ю., Коваленко Л.В., Сафронова М.Л., Гапурова А.Х., Николаев К.Ю. Создание в Ханты-Мансийском автономном округе — Югре коллекции биологических образцов пациентов, перенесших инфаркт миокарда. Кардиоваскулярная терапия и профилактика. 2023;22(11):3805. https://doi.org/10.15829/1728-8800-2023-3805
For citation:
Morozkina A.V., Vorobev A.S., Donnikov M.Yu., Kovalenko L.V., Safronova M.L., Gapurova A.Kh., Nikolaev K.Yu. Creation of a biosample collection from patients after myocardial infarction in the Khanty Mansi Autonomous Okrug — Yugra. Cardiovascular Therapy and Prevention. 2023;22(11):3805. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3805
JATS XML

























































