Перейти к:
Выраженность и продолжительность иммунного ответа у лиц разных возрастных категорий после ревакцинации против вируса SARS-COV-2
https://doi.org/10.15829/1728-88002023-3870
EDN: BNPDIS
Аннотация
В статье обсуждаются вопросы эффективности и безопасности применения гомологичных и гетерологичных схем ревакцинации против вируса SARS-CoV-2 (Severe Acute Respiratory Syndromerelated CoronaVirus-2) у лиц разных возрастных групп.
Цель. Изучение выраженности и продолжительности иммунного ответа у лиц разных возрастных групп после ревакцинации против вируса SARS-COV-2.
Материал и методы. Исследование выполнено в рамках проспективного регистра САТУРН (Сравнительная оценкА реактогенносТи и иммУногенности гетеРологичных схем вакциНации против COVID-19), в который включались лица, получившие различные схемы ревакцинации против вируса SARS-CoV-2 (гомои гетерологичные схемы) на основе комбинации двух вакцин: Гам-КОВИД-Вак и КовиВак. В группу I (n=106) вошли лица, получившие гомологичную схему ревакцинации препаратом Гам-КОВИД-Вак, в группу II (n=54) — с гетерологичной схемой препаратами Гам-КОВИД-Вак и КовиВак, в группу III (n=40) — получившие гомологичную схему ревакцинации препаратом КовиВак. Кроме того, все участники исследования были разделены на две возрастные категории: 60 лет и старше (n=33) и моложе 60 лет, (n=167). В рамках программы у всех пришедших на вакцинацию против вируса SARS-CoV-2 в консультативно-диагностический центр, оценивался анамнез, а также на каждом визите выполнены: анализ крови с определением количественного уровня специфических антител класса IgG к поверхностному S белку вируса SARS-CoV-2, интегральная оценка системы плазменного гемостаза методом тромбодинамики. На 1, 3 и 5 визитах выполнялся забор крови для оценки уровня активности Т-клеточного иммунитета (официальное название теста T-Spot.COVID, компания Oxford Immunotec) к вирусу SARS-CoV-2.
Результаты. Проведение ревакцинации у лиц ≥60 лет обеспечивает напряженность гуморального (количественный уровень специфических антител класса IgG к поверхностному S белку вируса SARSCoV-2) и клеточного иммунитета (панель А для количественной оценки специфически сенсибилизированных Т-лимфоцитов к Spike antigens (поверхностный антиген) и панель B — к нуклеокапсидному антигену (ядерный антиген)) к вирусу SARS-CoV-2, сопоставимого с таковым у лиц более молодого возраста (<60 лет). На фоне ревакцинации не было отмечено усиления тромбогенного потенциала плазмы крови у вакцинированных вне зависимости от возраста.
Заключение. В группе вакцинированных ≥60 лет сформировался адекватный гуморальный и клеточный иммунный ответ, сохранявшийся на протяжении года после ревакцинации, причем продемонстрирован даже более напряженный клеточный иммунитет по сравнению с вакцинированными <60 лет. Тромбогенный потенциал плазмы крови на фоне вакцинации и ревакцинации не повышался вне зависимости от возраста.
Ключевые слова
Для цитирования:
Драпкина О.М., Бернс С.А., Чащин М.Г., Горшков А.Ю., Жданова О.В., Рыжакова Л.Н. Выраженность и продолжительность иммунного ответа у лиц разных возрастных категорий после ревакцинации против вируса SARS-COV-2. Кардиоваскулярная терапия и профилактика. 2023;22(12):3870. https://doi.org/10.15829/1728-88002023-3870. EDN: BNPDIS
For citation:
Drapkina O.M., Berns S.A., Chashchin M.G., Gorshkov A.Yu., Zhdanova O.V., Ryzhakova L.N. Severity and duration of immune response in people of different age categories after SARS-CoV-2 revaccination. Cardiovascular Therapy and Prevention. 2023;22(12):3870. (In Russ.) https://doi.org/10.15829/1728-88002023-3870. EDN: BNPDIS
Введение
В 2020г мировое сообщество вступило в эру пандемии новой коронавирусной инфекции, вызванной SARS-CoV-2 (Severe Acute Respiratory Syndrome-related CoronaVirus-2). На сегодняшний день хорошо известны осложнения и негативные последствия перенесенной новой коронавирусной инфекции как с позиций соматического и психического здоровья, так и с точки зрения полученных материальных затрат. Так, социально-экономическое бремя COVID-19 (COrona VIrus Disease 2019) в Российской Федерации в 2020г составило ~5,4 трлн рублей (5% от номинального объема валового внутреннего продукта в 2020г) [1].
Известен факт, что значительную долю тяжелых больных в сезонный подъем заболеваемости острой респираторной вирусной инфекцией составляют пациенты с коморбидной патологией с одновременным поражением сердечно-сосудистой, бронхолегочной, пищеварительной, эндокринной и других систем. Большинство таких пациентов находятся в возрасте ≥60 лет [2-4].
Справедлив этот факт и для пациентов, инфицированных вирусом SARS-CoV-2. В исследовании OpenSAFELY (популяция >17 млн человек, ~11 тыс. смертельных случаев, связанных с COVID-19) риск летального исхода, связанного именно с COVID-19, был ассоциирован с мужским полом, пожилым возрастом, низким доходом, сахарным диабетом (СД), хроническими болезнями органов дыхания, заболеваниями системы крови, онкологической патологией [5].
Основная демографическая тенденция современного общества большинства стран, включая Россию — постепенное увеличение доли лиц старших возрастных групп (старение населения), что связано, в значительной степени, с увеличением продолжительности жизни. По сути, обозначенная проблема является уже интернациональной. Объективная реальность демонстрирует, что увеличение числа лиц старших возрастных групп приводит к повышению численности граждан, испытывающих трудности с решением, в первую очередь, медицинских проблем.
Известно, что разработка мер специфической профилактики играет существенную роль в борьбе с коронавирусной инфекцией. Массовая вакцинация (первоначально — первичная, а впоследствии — ревакцинация) против вируса SARS-CoV-2 направлена как на снижение заболеваемости COVID-19, так и на уменьшение выраженности тяжелых форм заболевания и проявлений постковидного синдрома [6][7]. Несмотря на доказанную эффективность и безопасность вакцинации против COVID-19, введение иммунобиологического лекарственного препарата может быть связано с рядом негативных последствий, что было продемонстрировано в некоторых публикациях [8].
Изучение бустерных вакцин, включая вакцины BioNTech/Pfizer, Moderna, Oxford AstraZeneca, Sputnik V, Sinopharm и Covaxin, продолжается и в настоящее время. В частности, представляет определенный интерес оценка эффективности, безопасности и их вклада в формирование длительного иммунитета против вируса SARS-CoV-2 [9].
Цель исследования — изучение выраженности и продолжительности иммунного ответа у лиц разных возрастных групп после ревакцинации против вируса SARS-CоV-2.
Материал и методы
Исследование выполнено в рамках проспективного регистра САТУРН (Сравнительная оценкА реактогенносТи и иммУногенности гетеРологичных схем вакциНации против COVID-19), в который включались лица, получившие различные схемы ревакцинации против SARS-CoV-2 (гомо- и гетерологичные схемы) на основе комбинации двух вакцин: Гам-КОВИД-Вак и КовиВак. Все участники имели возможность выбрать, какой из вакцин проводить ревакцинацию, и подписали информированное согласие на участие. Всего в исследовании участвовало 200 респондентов, которые в зависимости от выбранной схемы были разделены на 3 группы.
В группу I (n=106) вошли лица, получившие гомологичную схему ревакцинации препаратом Гам-КОВИД-Вак (2-компонентная вакцина, на базе двух различных аденовирусных векторов, несущих ген S-протеина вируса SARS-CoV-2, первый компонент содержит частицы рекомбинантного аденовируса 26 серотипа, второй компонент — 5 серотипа), в группу II (n=54) — лица, получившие гетерологичную схему препаратами Гам-КОВИД-Вак и КовиВак, в группу III (n=40) — получившие гомологичную схему ревакцинации препаратом КовиВак (содержит антиген инактивированного коронавируса SARS-CoV-2 — штамм AYDAR-1, инактивирован β-пропиолактоном).
Критерии включения: возраст ≥18 лет, отсутствие противопоказаний к вакцинации, повторная вакцинация от вируса SARS-CoV-2, проживание в Москве и Московской области. Критерии невключения: отказ от участия в исследовании.
Кроме того, все участники исследования были разделены на две возрастные категории: 60 лет и старше (n=33) и моложе 60 лет (n=167).
В рамках программы у всех пришедших на вакцинацию против вируса SARS-CoV-2 в консультативно-диагностический центр оценивался анамнез, а также на каждом визите выполнены: анализ крови для определения количественного уровня специфических антител класса IgG к поверхностному S белку вируса SARS-CoV-2 (реагент фирмы Abbott для определения CoV-2 IgG; исследование выполнялось на иммунохимическом анализаторе Architect i2000R). Также на каждом визите проводилась интегральная оценка системы плазменного гемостаза методом тромбодинамики (ТД) на аппарате лабораторной диагностической системы "Регистратор тромбодинамики Т-2" с использованием реактивов фирмы ООО "ГемаКор". Оценивались такие диагностические параметры ТД, как: Tlag (мин) — время, которое проходит от момента контакта плазмы с активирующей поверхностью до непосредственного начала роста сгустка; Cs (мкм) — размер сгустка на 30-й мин; V (мкм/мин) — скорость роста сгустка; Vi (мкм/мин) — начальная скорость роста сгустка; Tsp (мин) — время появления спонтанных сгустков в объеме плазмы; Vst (мкм/мин) — стационарная скорость роста сгустка вдали от активной поверхности; D (усл. ед.) — плотность и размеры сгустка [10].
На 1, 3 и 5 визитах выполнялся забор крови для оценки уровня активности Т-клеточного иммунитета (официальное название теста T-Spot.COVID, компания Oxford Immunotec) к SARS-CoV-2, включая панель А для количественной оценки специфически сенсибилизированных Т-лимфоцитов к Spike antigens (поверхностный антиген — ТклА) и панель B — к нуклеокапсидному антигену (ядерный антиген — ТклВ).
Участники наблюдались на протяжении 19-22 мес. Визит 1 соответствовал I этапу первичной вакцинации, 2 визит — II этапу первичной вакцинации, на 3 визите (через 6 мес. после 1 визита) выполнялся I этап ревакцинации, на 4 визите — II этап ревакцинации, визит 5 — через 12 мес. после I этапа первичной вакцинации, 6 визит — через 19-22 мес. после I этапа первичной вакцинации.
Анализ полученных данных проводился с использованием программного обеспечения Microsoft Office Excel. В работе применялся пакет статистических программ SPSS Statistica v.26 и MedCalc v. 20.104. Оценка распределения количественных переменных выполнялась с помощью критерия Шапиро-Уилка. Предположение о нормальности распределения показателей было отвергнуто во всех случаях. Количественные данные представлялись в виде медианы (Me) и интерквартильного размаха [Q25; Q75]. Качественные показатели в виде абсолютных значений и долей — n (%). Сравнение двух несвязанных групп по количественным показателям выполнялось с помощью непараметрического критерия U-Манна-Уитни, трех групп — критерия Краскела-Уоллиса. Оценка статистической значимости изменения количественных показателей в динамике для трех периодов выполнялось с помощью критерия Фридмана, с последующим попарным сравнением тестом Уилкоксона. Для сопоставления групп по качественным характеристикам использовался критерия χ2 Пирсона. Уровень значимости различий считался достоверным при p<0,05. Контроль уровня ошибки первого рода при выполнении множественных попарных сравнений выполнялся с использованием поправки Бонферрони.
Результаты
Подробная характеристика участников исследования, получивших различные вакцины против вируса SARS-CoV-2, представлена в таблице 1. По демографическим параметрам исследуемые группы статистически значимо не различались (p>0,05).
При разделении участников исследования по возрасту (таблица 2) выявлено, что лица более старшего возраста имели тенденцию к большей величине индекса массы тела (28,08 vs 26,20 кг/м2; p=0,050), наличию злокачественных новообразований любой локализации (9,1 vs 2,4%; p=0,056), у них гораздо реже отмечался факт курения (3 vs 21%; p=0,014) и чаще — наличие хронического панкреатита в анамнезе (6,1 vs 0,6%; p=0,018), артериальной гипертензии (57,6 vs 23,4%; p<0,001), ишемической болезни сердца (18,2 vs 1,2%; p<0,001), дислипидемии (9,1 vs 0,6%; p<0,002), нарушений ритма и проводимости сердца (12,1 vs 0,6%; p<0,001), СД 2 типа (12,6 vs 0,6%; p<0,001).
В таблице 3 представлена информация о частоте использования исследуемых вакцин против вируса SARS-CoV-2 в различных возрастных группах. Достоверных различий выявлено не было (p>0,05). В целом, наиболее часто применялась гомологичная схема Гам-КОВИД-Вак, на втором месте по частоте — гетерологичная схема (Гам-КОВИД-Вак + КовиВак).
Далее был проведен анализ показателей, отражающих гуморальный иммунитет и напряженность клеточного иммунитета на разных этапах исследования. В таблице 4 приведены уровни титров IgM и IgG к S-гликопептиду вируса SARS-CoV-2, отражающие гуморальный иммунитет, и величины ТклА и ТклВ, демонстрирующие активность Т-клеточного иммунитета. Достоверных различий между указанными параметрами не выявлено (p>0,05).
В таблице 5 представлены результаты анализа интегральных показателей плазменного гемостаза, оцененных методом ТД. Достоверные различия получены только для величины параметра D, характеризующего плотность образования фибринового сгустка и его структуру, который оказался выше у пациентов ≥60 лет: 24771,00 vs 23028,36 усл. ед. (p=0,023).
Изучены аналогичные показатели на 5 визите (таблица 6 и 7). Уровень титра IgG к S-гликопептиду вируса SARS-CoV-2 в группе вакцинированных ≥60 лет оказался достоверно выше (540,00 vs 520,00; p=0,038) аналогичного показателя у лиц <60 лет.
Напряженность клеточного иммунитета оценивалась по количеству активных Т-клеток, реагирующих на стимуляцию поверхностным (Панель А) (ТклА) и ядерным (Панель В) (ТклВ) антигеном. Значение ≥8 указывает на положительный результат, 5-7 — пограничный, ≤4 — отрицательный результат. Несмотря на то, что достоверных различий между лицами разных возрастных групп в напряженности клеточного иммунитета не выявлено, следует отметить, что именно у лиц ≥60 лет отмечался пограничный результат ТклА, реагирующих как на стимуляцию Spike Ag вируса SARS-CoV-2, так и Nucleocapsid Ag вируса SARS-CoV-2.
Оценивая тромботический потенциал плазмы крови, необходимо особо отметить факт достоверного удлинения Tlag (p=0,029) и Cs (p=0,039) у лиц более молодого возраста.
На 6 визите достоверных различий в изучаемых параметрах выявлено не было.
В таблице 8 представлена динамика с 3 по 6 визит параметров гуморального и клеточного иммунитета у вакцинированных лиц разных возрастных групп.
Для лиц более старшего возраста (≥60 лет) уровень IgG к S-гликопептиду вируса SARS-CoV-2 снизился с 540,0 до 520,0 BAU/ml (p<0,001), в то время как у лиц в возрасте <60 лет величина данного показателя, напротив, увеличилась с 499,0 до 520,0 BAU/ml (p<0,001). Однако достоверных различий между разными возрастными группами в уровне IgG не получено.
В группе вакцинированных лиц ≥60 лет напряженность клеточного иммунитета при исследовании числа активных Т-клеток, реагирующих на стимуляцию поверхностным (Панель А) антигеном c 3 по 5 визит значимо не изменилась (p=0,092), отражая пограничный результат, в то время как число активных Т-клеток, реагирующих на стимуляцию Nucleocapsid Ag вируса SARS-CoV-2 (Панель В) достоверно (p=0,028) увеличилась с 4 до 5, т.е. с отрицательного результата изменилось на пограничный.
В отношении вакцинированных лиц <60 лет отмечена иная динамика. Напряженность клеточного иммунитета при исследовании числа активных Т-клеток, реагирующих на стимуляцию поверхностным (Панель А) антигеном c 3 по 5 визит продемонстрировала четкую тенденцию (p=0,059) к снижению с 5 до 4, в то время как число активных Т-клеток, реагирующих на стимуляцию Nucleocapsid Ag вируса SARS-CoV-2 (Панель В) достоверно (p<0,001) снизилась с 4 до 1, т.е. с пограничного результата изменилась на отрицательный.
При оценке ключевого параметра ТД — V (средняя скорость роста сгустка) (рисунок 1) у пациентов ≥60 лет наблюдалось снижение скорости V на 6 визите на 11,4% по сравнению со значением этого показателя на 3 визите, однако при попарном сравнении различия оказались статистически незначимыми (р=0,026). В группе <60 лет значение V достоверно увеличилось на 12,4% к 5 визиту (р=0,0074), а к 6 визиту отмечался возврат показателя к исходному значению (р=0,550).
Таблица 1
Общая характеристика участников исследования
Показатель | Группа | р | ||
I (n=106) | II (n=54) | III (n=40) | ||
Женский, n (%) | 46 (43,4) | 31 (57,4) | 24 (60,0) | 0,099 |
Мужской, n (%) | 60 (56,6) | 23 (42,6) | 16 (40,0) | |
Индекс массы тела, кг/м2 | 26,5 [ 23,5; 29,5] | 26,1 [ 23,4; 29,4] | 26,7 [ 23,3; 31,2] | 0,990 |
Избыточная масса тела, n (%) | 40 (37,7) | 24 (44,4) | 13 (32,5) | 0,487 |
Ожирение, n (%) | 25 (23,6) | 11 (20,4) | 11 (27,5) | 0,722 |
Курение, n (%) | 24 (22,6) | 8 (14,8) | 4 (10,0) | 0,161 |
Таблица 2
Характеристики включенных участников исследования разного возраста
Показатель | Me [Q25; Q75] (n=33) ≥60 лет | Me [Q25; Q75] (n=167) <60 лет | p |
Возраст на момент включения, годы | 69,00 [ 63,00; 75,00] | 42,00 [ 36,00; 50,00] | <0,001 |
Вес, кг | 80,00 [ 72,00; 90,00] | 79,50 [ 69,00; 91,00] | 0,585 |
Индекса массы тела, кг/м2 | 28,08 [ 25,51; 31,51] | 26,20 [ 22,96; 29,40] | 0,050 |
Избыточная масса тела, n (%) | 15 (45,5) | 62 (37,1) | 0,369 |
Ожирение, n (%) | 10 (30,3) | 37 (22,2) | 0,313 |
Женский пол, n (%) | 18 (54,5) | 83 (49,7) | 0,611 |
Мужской пол, n (%) | 15 (45,5) | 84 (50,3) | |
Курение, n (%) | 1 (3,0) | 35 (21,0) | 0,014 |
Хронический бронхит, n (%) | 1 (3,0) | 12 (7,2) | 0,376 |
Бронхиальная астма, n (%) | 0 (0,0) | 7 (4,2) | 0,231 |
Гастрит, n (%) | 6 (18,2) | 21 (12,6) | 0,389 |
Язвенная болезнь, n (%) | 0 (0,0) | 4 (2,4) | 0,369 |
Хронический панкреатит, n (%) | 2 (6,1) | 1 (0,6) | 0,018 |
Хронический холецистит, n (%) | 2 (6,1) | 2 (1,2) | 0,068 |
Гастроэзофагеальная рефлюксная болезнь, n (%) | 1 (3,0) | 2 (1,2) | 0,429 |
Желчекаменная болезнь, n (%) | 2 (6,1) | 2 (1,2) | 0,068 |
Артериальная гипертензия, n (%) | 19 (57,6) | 39 (23,4) | <0,001 |
Ишемическая болезнь сердца, n (%) | 6 (18,2) | 2 (1,2) | <0,001 |
Дислипидемия, n (%) | 3 (9,1) | 1 (0,6) | 0,002 |
Нарушения ритма и проводимости, n (%) | 4 (12,1) | 1 (0,6) | 0,001 |
СД 2 типа, n (%) | 4 (12,1) | 1 (0,6) | 0,001 |
Онкопатология любой локализации, n (%) | 3 (9,1) | 4 (2,4) | 0,056 |
Заболевания щитовидной железы, n (%) | 1 (3,0) | 11 (6,6) | 0,432 |
Мочекаменная болезнь, n (%) | 1 (3,0) | 1 (0,6) | 0,199 |
Подагра, n (%) | 0 (0,0) | 2 (1,2) | 0,528 |
Аллергия, n (%) | 0 (0,0) | 3 (1,8) | 0,438 |
Анемия, n (%) | 0 (0,0) | 1 (0,6) | 0,656 |
Примечание: Ме — медиана, СД — сахарный диабет.
Таблица 3
Частота применения разных вакцин против вируса SARS-CoV-2 среди участников исследования 60 лет и старше, и моложе 60 лет
Группа | ≥60 лет (n=33) | <60 лет (n=167) | p (df=2) |
Гам-КОВИД-Вак, n (%) | 16 (48,5) | 90 (53,9) | 0,669 |
Гам-КОВИД-Вак + КовиВак, n (%) | 11 (33,3) | 43 (25,7) | |
КовиВак, n (%) | 6 (18,2) | 34 (20,4) |
Таблица 4
Показатели клеточного и гуморального иммунитета к вирусу SARS-CoV-2 на 3 визите у вакцинированных лиц разного возраста
Показатель | Me [Q25; Q75] (n=31) ≥60 лет | Me [Q25; Q75] (n=164) <60 лет | p |
IgM, BAU/ml | 0,40 [ 0,30; 0,80] | 0,40 [ 0,30; 0,80] | 0,994 |
IgG, BAU/ml | 540,00 [ 478,00; 561,00] | 499,00 [ 362,00; 540,00] | 0,156 |
ТклА | 6,00 [ 2,00; 27,00] | 5,00 [ 1,00; 13,00] | 0,266 |
ТклВ | 4,00 [ 1,00; 10,50] | 4,00 [ 0,00; 11,00] | 0,529 |
Примечание: Ме — медиана, ТклА — панель А, ТклВ — панель В.
Таблица 5
Показатели тромбодинамики на 3 визите у вакцинированных лиц разного возраста
Показатель | Me [Q25; Q75] (n=33) ≥60 лет | Me [Q25; Q75] (n=167) <60 лет | р |
Tlag, мин | 0,90 [ 0,80; 0,98] | 0,82 [ 0,75; 0,95] | 0,253 |
Vi, мкм/мин | 48,89 [ 47,20; 52,80] | 49,10 [ 46,60; 53,09] | 0,963 |
Vs, мкм/мин | 27,31 [ 25,50; 30,13] | 27,22 [ 25,15; 30,34] | 0,965 |
V, мкм/мин | 27,31 [ 25,50; 30,13] | 27,22 [ 25,12; 30,44] | 0,946 |
D, усл. ед. | 24771,00 [ 22829,00; 26427,54] | 23028,36 [ 20454,65; 24956,73] | 0,023 |
Tsp, мин | 27,80 [ 25,50; 27,85] | 26,30 [ 23,00; 29,20] | 0,882 |
Cs, мкм | 1073,30 [ 1014,00; 1160,40] | 1072,40 [ 1007,50; 1172,74] | 0,922 |
Примечание: Ме — медиана, Tlag — время, которое проходит от момента контакта плазмы с активирующей поверхностью до непосредственного начала роста сгустка, Cs — размер сгустка на 30-й мин, V — скорость роста сгустка, Vi — начальная скорость роста сгустка, Tsp — время появления спонтанных сгустков в объеме плазмы, Vst — стационарная скорость роста сгустка вдали от активной поверхности, D — плотность и размеры сгустка.
Таблица 6
Показатели клеточного и гуморального иммунитета к вирусу SARS-CoV-2 на 5 визите у вакцинированных лиц разного возраста
Показатель | Me [Q25; Q75] (n=10) ≥60 лет | Me [Q25; Q75] (n=73) <60 лет | p |
IgM, BAU/ml | 0,40 [ 0,40; 0,55] | 0,40 [ 0,30; 0,60] | 0,462 |
IgG, BAU/ml | 540,00 [ 525,00; 561,00] | 520,00 [ 457,00; 540,00] | 0,038 |
ТклА | 6,00 [ 1,25; 15,50] | 4,00 [ 0,00; 12,00] | 0,292 |
ТклВ | 5,00 [ 1,75; 25,00] | 1,00 [ 0,00; 8,00] | 0,096 |
Примечание: Ме — медиана, ТклА — панель А, ТклВ — панель В.
Таблица 7
Показатели тромбодинамики на 5 визите у вакцинированных лиц разного возраста
Показатель | Me [Q25; Q75] (n=10) ≥60 лет | Me [Q25; Q75] (n=73) <60 лет | p |
Tlag, мин | 0,90 [ 0,80; 0,95] | 1,00 [ 0,90; 1,20] | 0,029 |
Vi, мкм/мин | 52,00 [ 48,30; 56,60] | 54,70 [ 48,92; 57,40] | 0,743 |
Vs, мкм/мин | 27,55 [ 25,65; 29,22] | 30,30 [ 28,45; 32,50] | 0,105 |
V, мкм/мин | 27,55 [ 25,65; 29,22] | 30,60 [ 28,40; 34,40] | 0,081 |
D, усл. ед. | 22947,00 [ 21896,00; 25791,50] | 21892,00 [ 19205,00; 24218,50] | 0,131 |
Tsp, мин | 15,40 [ 15,40; 15,40] | 20,70 [ 15,80; 23,30] | 0,321 |
Cs, мкм | 1045,50 [ 962,00; 1101,25] | 1160,50 [ 1105,50;1240,25] | 0,039 |
Примечание: Ме — медиана, Tlag — время, которое проходит от момента контакта плазмы с активирующей поверхностью до непосредственного начала роста сгустка, Cs — размер сгустка на 30-й мин, V — скорость роста сгустка, Vi — начальная скорость роста сгустка, Tsp — время появления спонтанных сгустков в объеме плазмы, Vst — стационарная скорость роста сгустка вдали от активной поверхности, D — плотность и размеры сгустка.
Таблица 8
Динамика показателей клеточного и гуморального иммунитета с 3 по 6 визит у вакцинированных лиц разного возраста
Показатель | Me [Q25; Q75] (n=7) ≥60 лет | Me [Q25; Q75] (n=56) <60 лет | ||||||
3 визит | 5 визит | 6 визит | p | 3 визит | 5 визит | 6 визит | p | |
IgG, BAU/ml | 540,0 [ 478,0; 561,0] | 540,0 [ 525,0; 561,0] | 520,0 [ 520,0; 530,0] | <0,001 | 499,0 [ 362,0; 540,0] | 520,0 [ 457,0; 540,0] | 520,0 [ 472,7; 540,0] | <0,001 |
ТклА | 6,0 [ 2,0; 27,0] | 6,0 [ 1,2; 15,5] | – | 0,092 | 5,0 [ 1,0; 13,0] | 4,0 [ 0,00; 12,0] | – | 0,059 |
ТклВ | 4,00 [ 1,00; 10,50] | 5,00 [ 1,75; 25,00] | – | 0,028 | 4,0 [ 0,0; 11,0] | 1,0 [ 0,0; 8,0] | – | <0,001 |
Примечание: Ме — медиана, ТклА — панель А, ТклВ — панель В.
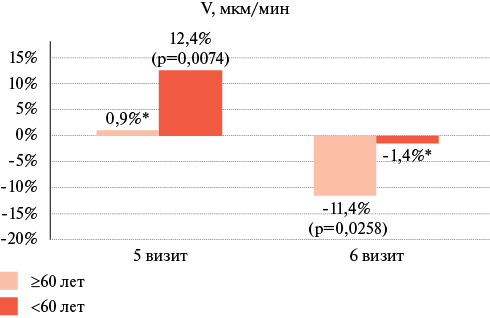
Рис. 1 Динамика показателя скорости роста сгустка (V) у вакцинированных лиц на 5 и 6 визитах, относительно значения, зарегистрированного на 3 визите.
Примечание: * — p>0,05.
Обсуждение
Долгосрочная эффективность вакцин и выраженность сформированного поствакцинального иммунитета, особенно на фоне проведения ревакцинации от COVID-19, остаются дискутабельной темой [11-13]. До сих пор открытым остается и вопрос в отношении эффективности и безопасности вакцинации/ревакцинации против вируса SARS-COV-2 у лиц пожилого возраста [14], что и явилось поводом проведения настоящего исследования.
Пациенты старшей возрастной группы закономерно характеризовались большей частотой сопутствующей патологии, ассоциированной с сердечно-сосудистыми заболеваниями: ожирение, ишемическая болезнь сердца, артериальная гипертензия, СД 2 типа, дислипидемия, нарушения ритма и проводимости сердца.
Стоит отметить, что по частоте использования исследуемых вакцин против вируса SARS-CoV-2 лица разных возрастных групп существенно не различались. Максимально часто применялась гомологичная схема вакцинации против вируса SARS-CoV-2 с использованием Гам-КОВИД-Вак.
Исходно, перед началом ревакцинации, лица разного возраста не имели достоверных различий по напряженности гуморального и Т-клеточного иммунитета. Однако в динамике к 5 визиту в группе вакцинированных лиц ≥60 лет как уровень титра IgG к S-гликопептиду вируса SARS-CoV-2, так и напряженность клеточного иммунитета оказались выше по сравнению с аналогичными показателями вакцинированных лиц более молодого возраста.
Резюмируя описанные выше изменения, можно предположить, что ревакцинация против вируса SARS-CoV-2 оказывает не меньший эффект у лиц пожилого возраста, позволяя поддерживать поствакцинальный иммунитет в достаточном напряжении, что особенно важно с учетом полиморбидного фона у этой категории лиц.
Гордейчик И. В. и др. (2023) сообщили о безопасности и иммуногенности инактивированной цельновирионной вакцины КовиВак в клинических испытаниях в возрастных группах 18-60 и 60+ [14] в ходе проведения рандомизированного двойного слепого плацебо-контролируемого многоцентрового клинического исследования I/II фазы. На 42-й день после 1-й вакцинации частота сероконверсии у участников, которые были серонегативными при скрининге, составила 86,9%, при среднем геометрическом титре нейтрализующих антител (nAB) 1:20. Увеличение продукции IFN-γ пептидстимулированными Т-клетками наблюдалось на 14 и 21 день после 1-й вакцинации. В заключение авторы отмечают, что инактивированная вакцина КовиВак продемонстрировала хорошую переносимость и безопасность с частотой сероконверсии >85% после полного курса вакцинации у участников, которые были серонегативными при скрининге в обеих возрастных группах: 18-60 и 60+.
На сегодняшний день в литературе представлены случаи венозных тромбоэмболических осложнений как на фоне протекания COVID-19, так и после вакцинации от вируса SARS-CoV-2 [15]. Принимая во внимание дискуссию в отношении возможных тромботических рисков, связанных с вакцинацией, а тем более с ревакцинацией, нами проведено изучение интегральных показателей, отражающих плазменный гемостаз среди лиц разного возраста.
В ходе анализа было продемонстрировано, что у вакцинированных ≥60 лет на 6 визите наблюдалось снижение на 11,4% скорости такого ключевого показателя, как V, отражающего склонность к тромбообразованию, по сравнению со значением показателя на 3 визите. В группе <60 лет значение V, напротив, достоверно увеличилось на 12,4% к 5 визиту, а к 6 визиту отмечался возврат показателя к исходному значению.
В настоящее время в литературе отсутствуют аналогичные работы, касающиеся изучения плазменного гемостаза путем оценки ТД у вакцинированных лиц. Нами ранее (2021) было продемонстрировано отсутствие статистически значимого изменения показателей ТД в течение 42 сут. после введения 1-го компонента вакцин Гам-КОВИД-Вак и КовиВак [16].
Toubasi AA, et al. (2022) продемонстрировали безопасность 28 вакцин, в т.ч. Гам-КОВИД-Вак, отметив, что случаи непосредственно тромбоэмболических эпизодов были чрезвычайно редкими, и их частота после заражения COVID-19 была значительно выше, чем после приема вакцины против вируса SARS-CoV-2 [8].
К ограничениям настоящей работы следует отнести лимитированный объем выборки.
Заключение
В результате настоящей работы получены описательные данные параметров гуморального и клеточного иммунитета, а также плазменного гемостаза у лиц разных возрастных групп, ревакцинированных против вируса SARS-CoV-2.
Продемонстрировано, что лица старшей возрастной группы отвечают на ревакцинацию против вируса SARS-CoV-2 в адекватной степени, демонстрируя даже более напряженный клеточный иммунитет по сравнению с вакцинированными <60 лет. Кроме того, на фоне ревакцинации не было отмечено усиления тромбогенного потенциала плазмы крови у вакцинированных лиц вне зависимости от возраста.
Отношения и деятельность. Исследование выполнено в рамках государственного задания № 122013100211-8.
Список литературы
1. Колбин А. С., Гомон Ю. М., Балыкина Ю. Е. и др. Социально-экономическое и глобальное бремя COVID-19. Качественная Клиническая Практика. 2021;(1):2434. doi:10.37489/2588-0519-2021-1-24-34.
2. Dong M, Liu T, Li G. Association between acute infections and risk of acute coronary syndrome: a meta-analysis. Int J Cardiol. 2011; 147(3):479-82. doi:10.1016/j.ijcard.2011.01.035.
3. Wiegand JA, Torgersen C, Bloechlinger S, et al. Influenza A(H1N1) infection and severe cardiac dysfunction in adults: a case series. Wien Klin Wochenschr. 2011;123(3-4):120-3. doi:10.1007/s00508-010-1520-0.
4. Tseng GS, Hsieh CY, Hsu CT, et al. Myopericarditis and exertional rhabdomyolysis following an infl uenza A (H3N2) infection. BMC Infect Dis. 2013;13:283. doi:10.1186/1471-2334-13-2834-6.
5. Williamson EJ, Walker AJ, Bhaskaran K, et al. Factors associated with COVID-19-related death using OpenSAFEL Y. Nature. 2020; 584(7821):430-6. doi:10.1038/s41586-020-2521-4.
6. Logunov DY, Dolzhikova IV, Shcheblyakov DV, et al.; Gam-COVIDVac Vaccine Trial Group. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet. 2021;397(10275):671-81. doi:10.1016/S01406736(21)00234-8.
7. Krammer F. SARS-CoV-2 vaccines in development. Nature. 2020; 586(7830):516-27. doi:10.1038/s41586-020-2798-3.
8. Toubasi AA, Al-Sayegh TN, Obaid YY, et al. Efficacy and safety of COVID-19 vaccines: A network meta-analysis. J Evid Based Med. 2022;15(3):245-62. doi:10.1111/jebm.12492.
9. Logunov DY, Dolzhikova IV, Zubkova OV, et al. Safety and immunogenicity of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine in two formulations: two open, non-randomised phase 1/2 studies from Russia. Lancet. 2020; 396(10255):887-97. doi:10.1016/S0140-6736(20)31866-3.
10. Баландина А. Н., Кольцова Е. М., Шибеко А. М. и др. Тромбодинамика: новый подход к диагностике нарушений системы гемостаза. Вопросы гематологии/ онкологии и иммунопатологии в педиатрии. 2018;17(4):114-26. doi:10.24287/1726-1708-2018-17-4-114-126.
11. König M, Torgauten HM, Tran TT, et al. Immunogenicity and Safety of a Third SARS-CoV-2 Vaccine Dose in Patients with Multiple Sclerosis and Weak Immune Response after COVID-19 Vaccination. JAMA Neurol. 2022;79:307-9. doi:10.1001/jamaneurol.2021.5109.
12. Levin EG, Lustig Y, Cohen C, et al. Waning Immune Humoral Response to BNT162b2 Covid-19 Vaccine over 6 Months. N Engl J Med. 2021;385:e84. doi:10.1056/NEJMoa2114583.
13. Crawford KH, Dingens AS, Eguia R, et al. Dynamics of Neutralizing Antibody Titers in the Months After Severe Acute Respiratory Syndrome Coronavirus 2 Infection. J Infect Dis. 2021; 223:197-205. doi:10.1093/infdis/jiaa618.
14. Gordeychuk IV, Kozlovskaya LI, Siniugina AA, et al. Safety and Immunogenicity of Inactivated Whole Virion COVID-19 Vaccine CoviVac in Clinical Trials in 18-60 and 60+ Age Cohorts. Viruses. 2023;15(9):1828. doi:10.3390/v15091828.
15. Yamada S, Asakura H. Coagulopathy and Fibrinolytic Pathophysiology in COVID-19 and SARS-CoV-2 Vaccination. Int J Mol Sci. 2022;23(6):3338. doi:10.3390/ijms23063338.
16. Драпкина О. М., Бернс С. А., Горшков А. Ю. и др. Параметры тромбодинамики у лиц, вакцинированных против вируса SARS-CoV-2. Профилактическая медицина. 2021;24(12):2430. doi:10.17116/profmed20212412124.
Об авторах
О. М. ДрапкинаРоссия
Оксана Михайловна Драпкина — д.м.н., профессор, академик РАН, директор.
Москва
С. А. Бернс
Россия
Светлана Александровна Бернс — д.м.н., профессор, руководитель отдела изучения патогенетических аспектов старения, зав. кафедрой терапии Института профессионального образования и аккредитации.
Москва
М. Г. Чащин
Россия
Михаил Георгиевич Чащин — к.м.н., н.с. отдела фундаментальных и прикладных аспектов ожирения.
Москва
А. Ю. Горшков
Россия
Александр Юрьевич Горшков — к.м.н., зам. директора по научной и амбулаторно-поликлинической работе.
Москва
О. В. Жданова
Россия
Ольга Вячеславовна Жданова — врач-терапевт.
Москва
Л. Н. Рыжакова
Россия
Лидия Николавевна Рыжакова — к.м.н., главный врач КДЦ.
Москва
Дополнительные файлы
Что известно о предмете исследования?
- Демографическая тенденция современного общества большинства стран — увеличение доли лиц старших возрастных групп.
- Появление новых штаммов вируса SARS-CoV-2 — серьезная медицинская проблема, особенно для пожилых людей.
- Специфическим методом профилактики новой коронавирусной инфекции является вакцинация.
Что добавляют результаты исследования?
- С учетом снижения эффективности поствакцинального иммунитета с течением времени ревакцинация позволяет увеличить продолжительность защиты от тяжелого течения COVID-19.
- Лица как молодого возраста, так и более старшей возрастной группы, отвечая на ревакцинацию против вируса SARS-CoV-2, демонстрируют адекватный гуморальный и напряженный клеточный иммунитет.
Рецензия
Для цитирования:
Драпкина О.М., Бернс С.А., Чащин М.Г., Горшков А.Ю., Жданова О.В., Рыжакова Л.Н. Выраженность и продолжительность иммунного ответа у лиц разных возрастных категорий после ревакцинации против вируса SARS-COV-2. Кардиоваскулярная терапия и профилактика. 2023;22(12):3870. https://doi.org/10.15829/1728-88002023-3870. EDN: BNPDIS
For citation:
Drapkina O.M., Berns S.A., Chashchin M.G., Gorshkov A.Yu., Zhdanova O.V., Ryzhakova L.N. Severity and duration of immune response in people of different age categories after SARS-CoV-2 revaccination. Cardiovascular Therapy and Prevention. 2023;22(12):3870. (In Russ.) https://doi.org/10.15829/1728-88002023-3870. EDN: BNPDIS
JATS XML

























































