Перейти к:
Индекс жесткости левого предсердия в определении сердечной недостаточности с сохраненной фракцией выброса
https://doi.org/10.15829/1728-8800-2024-3901
Аннотация
Цель. Изучить возможности анализа индекса жесткости левого предсердия (Left Atrial Stiffness Index, LASI) при эхокардиографии (ЭхоКГ) покоя в диагностике сердечной недостаточности с сохраненной фракцией выброса (СНсФВ) в зависимости от результата диастолического стресс-теста (ДСТ).
Материал и методы. ДСТ проводили при недостаточном количестве критериев для заключения о повышенном давлении заполнения левого желудочка по данным традиционной ЭхоКГ покоя. Обследовано 100 больных (52,0% мужчин, 66,1±5,4 года); пациенты с отношением E/e' (отношение ранней диастолической скорости трансмитрального потока (Е) к ранней диастолической скорости движения фиброзного кольца митрального клапана (е')) >15 при ДСТ составили группу I (n=45), пациенты c E/e' <15 — группу II (n=55). Метод отслеживания движения пятен (speckle tracking echo) использован для оценки деформации резервуарной фазы левого предсердия (left atrial reservoir strain, LASr).
Результаты. Между группами были выявлены статистически значимые различия по полу (40,0% мужчин в группе I и 61,8% в группе II, соответственно; р=0,044), индексу массы тела (32,9 [29,5;36,0] и 29,6 [27,3;31,8] кг/м2; р=0,001), стадии артериальной гипертонии (2,9±0,3 и 2,5±0,8, р=0,037), наличию ишемической болезни сердца (88,9 и 67,3%; р=0,016), функциональному классу хронической сердечной недостаточности по NYHA (New York Heart Association) (2,0±0,4 и 1,5±0,7; р=0,003). При проведении ЭхоКГ покоя выявлены достоверные различия по индексу объема левого предсердия (31,9 [28,5;36,0] и 27,8 [24,1;34,6] мл/м2; р=0,039), отношению E/e' (10,9 [9,7;12,5] и 9,3 [7,4;10,8]; р<0,001), LASr (23,5 [19,3;28,3] и 28,9 [25,6;32,2]%, р<0,001) и LASI (0,46 [0,38;0,56] и 0,30 [0,25;0,39]; р<0,001). При проведении ROC-анализа наибольшая площадь под кривой (AUC), оптимальные чувствительность и специфичность в определении СНсФВ наблюдались у LASI (AUC=0,829, р<0,001; 77,8 и 74,5%, соответственно); меньшие значения качества классификации показала шкала H2FPEF (шкала для диагностики сердечной недостаточности с сохраненной фракцией выброса Американской ассоциации кардиологов (предложена клиникой Mayo, 2018)) (AUC=0,701, р=0,001; 66,7 и 69,1%); алгоритм HFA-PEFF (Heart Failure Association score) не имел достоверной значимости в претестовом выявлении СНсФВ (AUC=0,608, р=0,065; 53,3 и 61,8%).
Заключение. LASI с точкой отсечения >0,38 имеет наибольшую способность в определении СНсФВ среди возможных методов ее претестовой диагностики.
Ключевые слова
Для цитирования:
Широков Н.Е., Ярославская Е.И., Костерин М.Д., Криночкин Д.В., Горбатенко Е.А., Енина Т.Н., Мусихина Н.А. Индекс жесткости левого предсердия в определении сердечной недостаточности с сохраненной фракцией выброса. Кардиоваскулярная терапия и профилактика. 2024;23(4):3901. https://doi.org/10.15829/1728-8800-2024-3901
For citation:
Shirokov N.E., Yaroslavskaya E.I., Kosterin M.D., Krinochkin D.V., Gorbatenko E.A., Enina T.N., Musikhina N.A. Left atrial stiffness index in the identification of heart failure with preserved ejection fraction. Cardiovascular Therapy and Prevention. 2024;23(4):3901. (In Russ.) https://doi.org/10.15829/1728-8800-2024-3901
Введение
Для сердечной недостаточности с сохраненной фракцией выброса (СНсФВ) характерно сочетание диастолической дисфункции (ДД) и высокого давления заполнения (ДЗ) левого желудочка (ЛЖ), клинически проявляющееся одышкой. У ряда пациентов диагностировать это состояние при проведении традиционной трансторакальной эхокардиографии (ЭхоКГ) в состоянии покоя не представляется возможным. Моделировать условия возникновения одышки — физическую нагрузку (ФН) — с одновременной оценкой диастолического резерва позволяет диастолический стресс-тест (ДСТ) [1].
В то же время, для части пациентов ФН, достаточная для диагностики СНсФВ, может быть ограничена ввиду сопутствующих заболеваний. К тому же, результаты применения валидных вариантов претестовой диагностики СНсФВ — HFA-PEFF (Heart Failure Association score, диагностический алгоритм СНсФВ, предложенный Европейским обществом кардиологов) и H2FPEF (Heart Failure with Preserved Ejection Fraction, шкала для диагностики СНсФВ, предложенная Американской ассоциацией кардиологов) имеют низкое соответствие между собой [2]. Поэтому необходим поиск метода определения СНсФВ, выступающего в качестве альтернативы ДСТ.
Ключевое звено современного инструментального определения СНсФВ при ЭхоКГ покоя основано на заключении об увеличении среднего давления в полости левого предсердия (ЛП) [3]. При нормальном среднем давлении в ЛП бóльшая часть его наполнения приходится на резервуарную фазу (ЛП во время сокращения ЛЖ служит резервуаром для легочного венозного потока). Однако с увеличением давления в ЛП происходит смещение наполнения ЛП в следующую фазу — кондуитную [3]. Применяя метод отслеживания движения пятен (Speckle Tracking Echo, STE), можно количественно оценить деформацию резервуарной фазы левого предсердия (Left Atrial reservoir Strain, LASr), снижение которой характерно для СНсФВ [4].
Цель — изучить возможности анализа индекса жесткости левого предсердия (Left Atrial Stiffness Index, LASI) при ЭхоКГ покоя в диагностике СНсФВ в зависимости от результата ДСТ.
Материал и методы
Исследование одномоментное, соответствует стандартам надлежащей клинической практики (Good Clinical Practice) и положениям Хельсинкской Декларации. Протокол исследования одобрен локальным этическим комитетом (№ протокола 184 от 16.03.2023). Информированное согласие получено от всех пациентов, включенных в исследование.
Пациентам с артериальной гипертонией (АГ), ишемической болезнью сердца (ИБС), ожирением, имеющим жалобы на одышку, болевой синдром/дискомфорт в грудной клетке при ФН, проводилась стресс-ЭхоКГ с горизонтальной велоэргометрической пробой (ВЭМ).
Для отбора больных применен диагностический алгоритм, представленный в текущих рекомендациях по оценке диастолической функции ЛЖ [5]. Критерии включения: ДД со снижением ранней диастолической скорости движения фиброзного кольца митрального клапана, оцененной при помощи тканевой допплерографии (Tissue Doppler Imaging, TDI); недостаточное количество критериев для заключения о повышенном ДЗ ЛЖ по данным традиционной ЭхоКГ покоя (отсутствие 2-х либо 3-х положительных критериев из 3-х возможных). Учитывали отношение Е/е’ (отношение ранней диастолической скорости трансмитрального потока (Е) к ранней диастолической скорости движения фиброзного кольца митрального клапана (е’)) >14, индекс объема ЛП >34 мл/м2, скорость трикуспидальной регургитации >2,8 м/с. Критерии невключения: гемодинамически значимые врожденные/приобретенные пороки сердца; облитерирующий атеросклероз артерий нижних конечностей; тромбофлебит, флеботромбоз нижних конечностей.
В дальнейшем проводили ДСТ в рамках стресс-ЭхоКГ с ВЭМ согласно действующим рекомендациям [6][7] и согласованному мнению экспертов [1]. Критерием положительного ДСТ для диагностики СНсФВ считали увеличение Е/e’ ≥15 [7][8]. Критерием стресс-индуцированной ишемии считали появление нарушения локальной сократимости миокарда ЛЖ, соответствующее бассейну кровоснабжения пораженной коронарной артерии (≥3 из 16 сегментов ЛЖ) [9]. Критерии исключения: недостижение частоты сердечных сокращений (ЧСС), достаточной для завершения ДСТ. Обследовано 100 больных (52,0% мужчин, 66,1±5,4 года). Пациенты с положительным ДСТ (рисунок 1) составили группу I (n=45); пациенты c отрицательным ДСТ — группу II (n=55). Клинико-функциональная характеристика представлена в таблицах 1-4.
Использованы ультразвуковой аппарат экспертного класса General Electric (GE) Vivid E9 (USA) с матричным датчиком M5S-D (1,5-4,6 МГц), велоэргометр GE eBike (USA). Данные сохранены в формате DICOM. Обработка изображений, кинопетель осуществлялась на рабочей станции IntelliSpace Cardiovascular, платформе Tote (Philips, USA) в соответствии с текущими рекомендациями [10][11]. Метод STE применен для оценки Liars и глобальной продольной деформации левого желудочка (Global Longitudinal Strain, GLS) [10][12]. Для достижения целевого ЧСС (85% от максимального/до появления симптомов, не позволяющих продолжение стресс-теста, использовали ступени в 25 Ватт с увеличением ФН каждые 2 мин. Каданса составлял 60 об./мин.
Статистический анализ проводили с помощью пакета программ SPSS vol. 23 (USA). Для определения нормальности распределения использован критерий Колмогорова-Смирнова. Для анализа количественных величин несвязанных групп при их нормальном распределении использовали t-критерий Стьюдента; результаты представлены в виде M±SD (М — среднее арифметическое, SD — среднеквадратичное отклонение). Для анализа количественных величин при распределении, отличном от нормального, использовали критерий Манна-Уитни; результаты представлены в виде медианы (Me) и интерквартильного размаха (Q25;Q75). Качественные величины сравнивали критерием χ2 Пирсона. Для оценки и сравнения диагностических методов использован ROC-анализ. Оптимальную точку отсечения находили с помощью построения графика ROC-кривой, расчета индекса Юдена. За уровень статистической значимости различий переменных принимали значение p<0,05.
Результаты
Между группами выявлены статистически значимые различия по полу — в группе I меньше мужчин; стадии АГ, наличию ИБС; индексу массы тела (ИМТ) и наличию ожирения; функциональному классу хронической сердечной недостаточности по классификации NYHA (New York Heart Association) и количеству баллов диагностического алгоритма HFA-PEFF, шкалы H2FPEF — показатели были статистически значимо более высокими в группе I (таблица 1). Стоит отметить отсутствие достоверных различий по уровню N-концевого промозгового натрийуретического пептида (NT-proBNP) при медиане его концентрации выше референсного значения в 125 пг/мл в обеих группах (таблица 1).
При анализе проводимой медикаментозной терапии статистически значимых различий между группами выявлено не было за исключением приема статинов — в группе I лекарственные препараты использованы чаще (таблица 2) (уровень холестерина липопротеинов низкой плотности 2,7±1,1 ммоль/л в группе I и 2,8±1,0 ммоль/л — в группе II; р=0,490).
При анализе традиционных показателей ЭхоКГ в группе I в сравнении с группой II выявлены достоверные различия по индексированному объему ЛП, массе миокарда (индексированной по росту) и параметрам, характеризующим ДЗ ЛЖ: скоростям пиков Е и А трансмитрального потока, отношению E/e’ (таблица 3). Следует указать на отсутствие статистически значимых различий по ранней диастолической скорости движения кольца митрального клапана, оцененной при помощи TDI. При анализе результатов применения метода STE в группе I в сравнении с группой II было выявлено достоверное снижение LASr и LASI (таблица 3).
При анализе показателей, полученных во время проведения ДСТ, были выявлены статистически значимые различия по всем характеристикам повышения ДЗ ЛЖ. Обнаружены достоверные различия по толерантности больных к ФН и причине преждевременной остановки стресс-ЭхоКГ с ВЭМ — одышке (таблица 4).
Для поиска метода, который может рассматриваться как альтернатива ДСТ в определении СНсФВ, протестированы LASI, HFA-PEFF и H2FPEF — проведен ROC-анализ. Наибольшая площадь под кривой (AUC), оптимальные чувствительность и специфичность наблюдались у LASI (рисунок 2, таблица 5). При сравнении ROC-кривых и AUC были выявлены статистически значимые различия в качестве диагностики между LASI и HFA-PEFF (р=0,001, разность AUC 0,221); между LASI и H2FPEF достоверных различий не выявлено (р=0,054, разность AUC 0,128). Наибольшее значение индекса Юдена (0,523) с чувствительностью 77,8% и специфичностью 74,5% соответствовало значению LASI, равному 0,38.
Таблица 1
Клинико-функциональная характеристика (n=100)
|
Признак |
Группа I (n=45) СНсФВ |
Группа II (n=55) без СНсФВ |
р |
|
Пол, муж, % |
40,0 |
61,8 |
0,044 |
|
Возраст, лет |
66,9±5,0 |
65,4±5,7 |
0,148 |
|
АГ, % |
100,0 |
98,2 |
0,363 |
|
АГ, стадия, % 0 1 2 3 |
0,0 0,0 8,9 91,1 |
1,8 12,7 14,5 70,9 |
0,037 |
|
АГ, риск, % 1 2 3 4 |
0,0 0,0 8,9 91,1 |
1,8 5,5 12,7 80,0 |
0,265 |
|
ИБС, % |
88,9 |
67,3 |
0,016 |
|
Стенокардия напряжения, ФК по NYHA, % 0 1 2 3 |
20,0 13,3 62,2 4,4 |
43,6 10,9 41,8 3,6 |
0,095 |
|
ИМ в анамнезе, % |
15,6 |
18,2 |
0,794 |
|
Пароксизмальная ФП, % |
13,3 |
10,9 |
0,764 |
|
СД 2 типа, % |
35,6 |
30,9 |
0,673 |
|
ИМТ, кг/м2 |
32,9 [ 29,5;36,0] |
29,6 [ 27,3;31,8] |
0,001 |
|
Ожирение, % |
71,1 |
47,3 |
0,025 |
|
СН по NYHA, % 0 I II III |
0,0 8,9 86,7 4,4 |
7,3 34,5 54,5 3,6 |
0,003 |
|
Т6Х, мин |
401,8±63,0 |
421,7±65,9 |
0,165 |
|
HFA-PEFF, балл |
5,0 [ 3,5;5,0] |
4,0 [ 3,0;5,0] |
0,047 |
|
HFA-PEFF, ≥5 баллов |
53,3 |
38,2 |
0,159 |
|
H2FPEF, балл |
5,0 [ 3,5;5,0] |
3,0 [ 3,0;5,0] |
<0,001 |
|
H2FPEF, ≥5 баллов |
66,7 |
30,9 |
0,001 |
|
NT-proBNP, пг/мл |
246,8 [ 90,6;428,1] |
170,7 [6 9,2;320,5] |
0,176 |
|
NT-proBNP >125 пг/мл, % (1 балл HFA-PEFF) |
71,4 |
60,0 |
0,279 |
|
NT-proBNP >220 пг/мл, % (2 балла HFA-PEFF) |
54,8 |
42,0 |
0,295 |
Примечание: АГ — артериальная гипертония, ИБС — ишемическая болезнь сердца, ИМ — инфаркт миокарда, ИМТ — индекс массы тела, СД — сахарный диабет, СНсФВ — сердечная недостаточность с сохраненной фракцией выброса, Т6Х — тест 6-минутной ходьбы, ФК — функциональный класс, ФП — фибрилляция предсердий; HFA-PEFF — Heart Failure Association score (диагностический алгоритм сердечной недостаточности с сохраненной фракцией выброса Европейского общества кардиологов), H2FPEF — шкала для диагностики сердечной недостаточности с сохраненной фракцией выброса Американской ассоциации кардиологов, NT-proBNP — N-концевой промозговой натрийуретический пептид, NYHA — New York Heart Association (Нью-Йоркская ассоциация сердца).
Таблица 2
Проводимая медикаментозная терапия
|
Препарат, % |
Группа I (n=45) |
Группа II (n=55) |
р |
|
БАБ |
75,6 |
56,4 |
0,059 |
|
ИАПФ |
31,1 |
34,5 |
0,831 |
|
БРА |
60,0 |
52,7 |
0,545 |
|
АМКР |
6,7 |
13,0 |
0,340 |
|
Диуретики |
40,0 |
38,2 |
0,853 |
|
БКК |
26,7 |
27,3 |
0,946 |
|
Моксонидин |
6,7 |
14,5 |
0,336 |
|
АСК |
53,3 |
41,8 |
0,315 |
|
Клопидогрел |
8,9 |
5,6 |
0,699 |
|
Тикагрелор |
0,0 |
1,8 |
0,363 |
|
Антикоагулянты |
17,8 |
9,1 |
0,240 |
|
Статины |
84,4 |
63,6 |
0,024 |
|
ААС |
6,7 |
1,8 |
0,324 |
|
Ингибиторы SGLT2 |
13,6 |
3,6 |
0,134 |
Примечание: ААС — антиаритмические средства, АМКР — антагонисты минералокортикоидных рецепторов, АСК — ацетилсалициловая кислота, БАБ — β-адреноблокаторы, БКК — блокаторы кальциевых каналов, БРА — блокаторы рецепторов ангиотензина II, ИАПФ — ингибиторы ангиотензинпревращающего фермента, SGLT2 — sodium-glucose cotransporter-2 (натрий-глюкозный котранспортер-2).
Таблица 3
ЭхоКГ характеристика
|
Показатель |
Группа I (n=45) |
Группа II (n=55) |
р |
|
Морфологический статус |
|||
|
МЖП, мм |
12,8±1,8 |
12,7±1,9 |
0,717 |
|
ЗСЛЖ, мм |
11,1±1,1 |
11,0±1,4 |
0,674 |
|
ММ ЛЖ, г/м2 |
220,0 [ 192,0;253,0] |
219,0 [ 181,0;240,0] |
0,442 |
|
индекс ММ ЛЖ, г/м2 |
114,0 [ 105,8;131,7] |
109,0 [ 94,4;127,1] |
0,283 |
|
индекс ММ ЛЖ, г/м2,7 при ИМТ >25 кг/м2 |
63,2 [ 55,2;69,0] |
52,6 [ 44,8;61,0] |
<0,001 |
|
КДО ЛЖ, мл |
80,0 [ 70,0;94,5] |
84,0 [ 74,0;97,0] |
0,733 |
|
КДО ЛЖ индекс, мл/м2 |
43,2±8,7 |
44,2±9,0 |
0,578 |
|
Переднезадний размер ЛП, мм |
40,8±3,8 |
39,5±4,1 |
0,082 |
|
Объем ЛП, мл |
61,4±13,2 |
56,7±14,1 |
0,088 |
|
ИОЛП, мл/м2 |
31,9 [ 28,5;36,0] |
27,8 [ 24,1;34,6] |
0,039 |
|
Дилатация ЛП (ИОЛП >34 мл/м2), % |
40,0 |
29,1 |
0,292 |
|
Объем ПП, мл |
41,2±10,1 |
41,7±9,3 |
0,834 |
|
Размер ПЖ, мм |
27,8±2,5 |
28,2±2,6 |
0,520 |
|
Функциональный статус |
|||
|
ФВ ЛЖ, % |
65,3±4,2 |
65,6±4,4 |
0,737 |
|
СДЛА, мм рт.ст. |
25,3±5,4 |
23,7±5,0 |
0,132 |
|
Пик Е, см/с |
68,0 [ 62,0;82,0] |
58,0 [ 49,0;70,0] |
<0,001 |
|
Пик А, см/с |
90,0 [ 80,0;102,5] |
80,0 [ 69,0;95,0] |
0,005 |
|
Е/А |
0,76 [ 0,65;0,9] |
0,72 [ 0,6;0,87] |
0,233 |
|
TDI e’ sept, см/с |
5,7±1,2 |
5,6±1,2 |
0,637 |
|
TDI e’ lat, см/с |
7,4±1,4 |
7,5±1,5 |
0,817 |
|
E/e’ average |
10,9 [ 9,7;12,5] |
9,3 [ 7,4;10,8] |
<0,001 |
|
GLS, % |
18,2±2,6 |
18,6±2,7 |
0,474 |
|
GLS <18%, % |
41,7 |
37,5 |
0,822 |
|
LASr Bi-plane, % |
23,5 [ 19,3;28,3] |
28,9 [ 25,6;32,2] |
<0,001 |
|
LASr 4Ch, % |
22,9 [ 19,9;28,0] |
28,0 [ 25,0;31,4] |
<0,001 |
|
LASr 2Ch, % |
24,8 [ 20,3;29,3] |
29,5 [ 25,5;33,4] |
<0,001 |
|
LASr <23%, % |
42,2 |
5,5 |
<0,001 |
|
LASI |
0,46 [ 0,38;0,56] |
0,30 [ 0,25;0,39] |
<0,001 |
|
LASI ≥0,38 |
77,8 |
27,3 |
<0,001 |
Примечание: ЗС — задняя стенка, ИОЛП — объем левого предсердия, индексированный по площади поверхности тела, ЛЖ — левый желудочек, ЛП — левое предсердие, КДО — конечно-диастолический объем, ММ — масса миокарда, МЖП — межжелудочковая перегородка, ПЖ — правый желудочек, ПП — правое предсердие, СДЛА — систолическое давление в легочной артерии, ФВ — фракция выброса; E/e’ average — усредненное отношение ранней диастолической скорости трансмитрального потока (Е) к ранней диастолической скорости движения фиброзного кольца митрального клапана (е’), GLS — Global Longitudinal Strain (глобальная продольная деформация), LASr — Left Atrial reservoir Strain (деформация фазы резервуара левого предсердия), LASI — Left Atrial Stiffness Index (индекс жесткости левого предсердия), TDI e’ lit — left ventricular annular velocity assessed by Tissue Doppler Imaging, peak e’ lateral (ранняя диастолическая скорость движения латеральной части кольца митрального клапана), TDI e’ sept — left ventricular annular velocity assessed by Tissue Doppler Imaging, peak e’ septal (ранняя диастолическая скорость движения стальной части кольца митрального клапана), 2Ch — two-chamber view (2-камерная позиция апикального доступа), 4Ch — four-chamber view (4-камерная позиция апикального доступа), Bi-plane — использование среднего значения 2Ch и 4Ch.
Таблица 4
Стресс-ЭхоКГ с ВЭМ
|
Показатель |
Группа I (n=45) |
Группа II (n=55) |
р |
|
Пик Е, ФН, см/с |
123,0 [ 112,5;131,5] |
90,0 [ 72,0;108,0] |
<0,001 |
|
TDI e’ sept, ФН, см/с |
8,0 [ 7,0;8,0] |
9,0 [ 7,0;10,0] |
0,002 |
|
TDI e’ lat, ФН, см/с |
9,0 [ 8,0;10,0] |
11,0 [ 9,0;13,0] |
<0,001 |
|
Е/е’ average, ФН |
14,7 [ 13,5;15,7] |
9,3 [ 7,8;10,3] |
<0,001 |
|
Е/е’ sept, ФН |
16,7 [ 14,6;18,0] |
10,4 [ 9,0;12,4] |
<0,001 |
|
Градиент ТР ФН, мм рт.ст. |
35,0 [ 23,5;45,5] |
29,5 [ 18,8;41,3] |
0,014 |
|
DFRI |
10,1 [ 6,8;14,0] |
18,1 [ 11,6;26,3] |
<0,001 |
|
Толерантность к ФН, Ватт |
75,0 [ 75,0;100,0] |
100,0 [ 75,0;100,0] |
0,008 |
|
Продолжительность стресс-теста, мин |
5,6±1,4 |
6,7±1,8 |
0,001 |
|
Максимальная ЧСС, уд./мин |
102,0 [ 98,0;110,0] |
110,0 [ 98,0;125,0] |
0,012 |
|
Одышка в качестве причины остановки теста, % |
68,9 |
16,4 |
<0,001 |
|
Стресс-индуцированная ишемия, % |
11,1 |
12,7 |
0,300 |
Примечание: стресс-ЭхоКГ с ВЭМ — стресс-эхокардиография с горизонтальной велоэргометрической пробой, ТР — трикуспидальная регургитация, ФН — физическая нагрузка, ЧСС — частота сердечных сокращений; DFRI — Diastolic Functional Reserve Index (диастолический функциональный резерв), E/e’ average — усредненное отношение ранней диастолической скорости трансмитрального потока (Е) к ранней диастолической скорости движения фиброзного кольца митрального клапана (е’), TDI e’ lat — left ventricular annular velocity assessed by Tissue Doppler Imaging, peak e’ lateral (ранняя диастолическая скорость движения латеральной части кольца митрального клапана), TDI e’ sept — left ventricular annular velocity assessed by Tissue Doppler Imaging, peak e’ septal (ранняя диастолическая скорость движения септальной части кольца митрального клапана).
Таблица 5
Характеристика диагностических методов для выявления СНсФВ, выступающих в качестве альтернативы ДСТ
|
Показатель |
Значение |
AUC |
95% ДИ |
р |
Чувствительность |
Специфичность |
|
LASI |
≥0,38 |
0,829 |
0,749-0,908 |
<0,001 |
77,8 |
74,5 |
|
H2FPEF |
≥5 |
0,701 |
0,599-0,803 |
0,001 |
66,7 |
69,1 |
|
HFA-PEFF |
≥5 |
0,608 |
0,498-0,718 |
0,065 |
53,3 |
61,8 |
Примечание: ДИ — доверительный интервал, ДСТ — диастолический стресс-тест, СНсФВ — сердечная недостаточность с сохраненной фракцией выброса, AUC — площадь под кривой, LASI — Left Atrial Stiffness Index (индекс жесткости левого предсердия), HFA-PEFF — Heart Failure Association score (диагностический алгоритм сердечной недостаточности с сохраненной фракцией выброса Европейского общества кардиологов), H2FPEF — шкала для диагностики сердечной недостаточности с сохраненной фракцией выброса Американской ассоциации кардиологов.
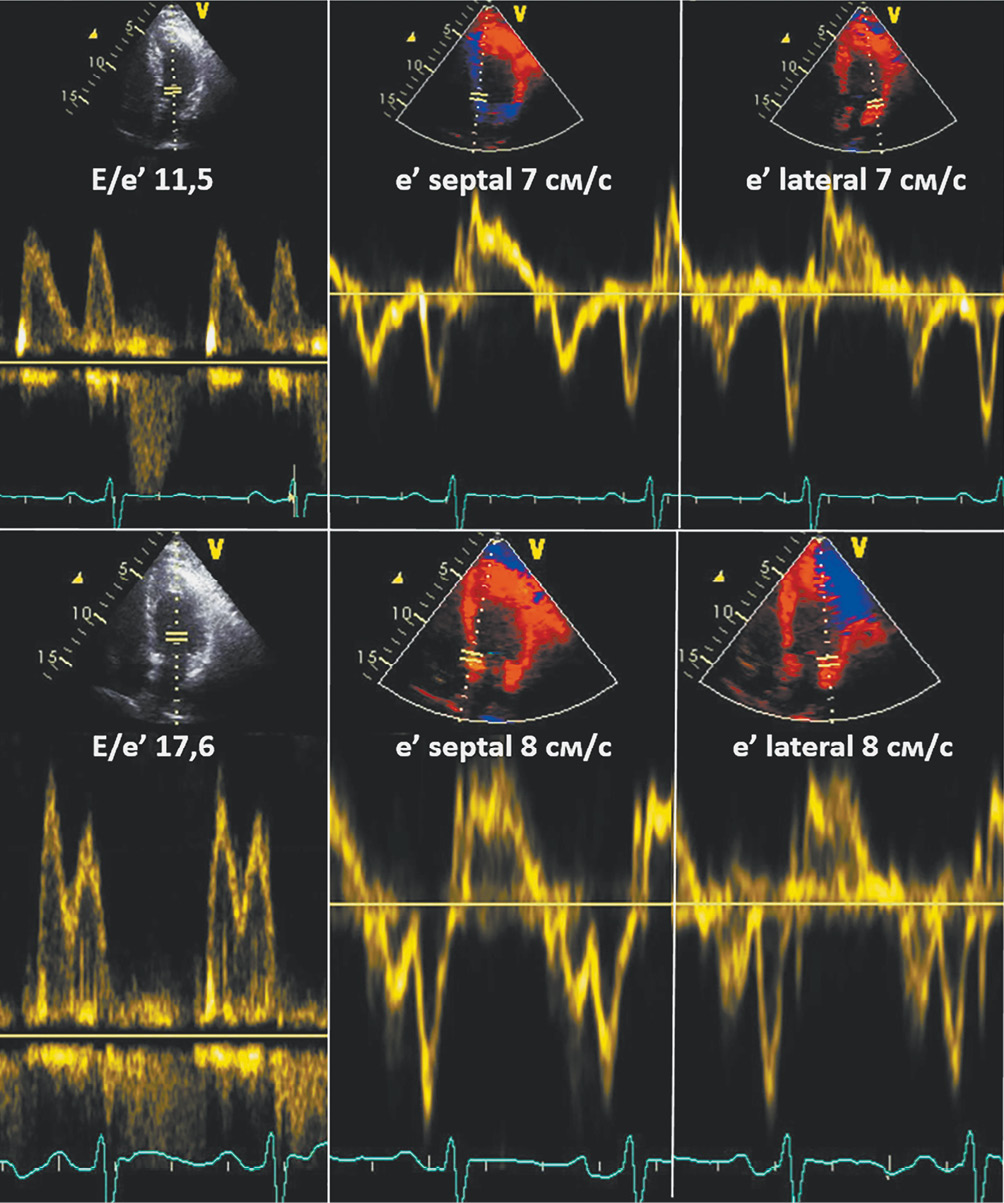
Рис. 1 Диагностика СНсФВ при проведении стресс-ЭхоКГ с ВЭМ.
Представлен положительный ДСТ у пациента с исходной (при проведении ЭхоКГ покоя) ДД и неопределенным ДЗ ЛЖ: E/e’ — 11,5, ИОЛП — 27,8 мл/м2, СДЛА — 26 мм рт.ст. (отсутствие 2 либо 3 положительных критериев из 3 возможных при использовании алгоритма рекомендаций по оценке диастолической функции ЛЖ). Верхняя панель: анализ параметров трансмитрального потока, движения кольца митрального клапана при ЭхоКГ покоя. Нижняя панель: превышение референсного значения отношения E/e’ (≥15) — ключевого признака повышения ДЗ ЛЖ — при проведении стресс-ЭхоКГ с ВЭМ.
Примечание: ДД — диастолическая дисфункция, ДЗ — давление заполнения, ДСТ — диастолический стресс-тест, ИОЛП — объем левого предсердия, индексированный по площади поверхности тела, ЛЖ — левый желудочек, СДЛА — систолическое давление в легочной артерии, СНсФВ — сердечная недостаточность с сохраненной фракцией выброса, стресс-ЭхоКГ с ВЭМ — стресс-эхокардиография с горизонтальной велоэргометрической пробой, E/e’ — отношение ранней диастолической скорости трансмитрального потока (Е) к ранней диастолической скорости движения фиброзного кольца митрального клапана (е’).
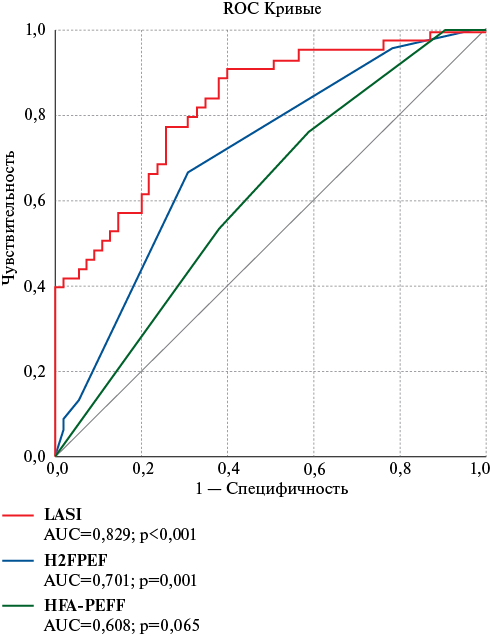
Рис. 2 ROC-кривые диагностических методов для выявления СНсФВ, выступающих в качестве альтернативы ДСТ.
Примечание: ДСТ — диастолический стресс-тест, СНсФВ — сердечная недостаточность с сохраненной фракцией выброса; LASI — Left Atrial Stiffness Index (индекс жесткости левого предсердия), HFA-PEFF — Heart Failure Association score (диагностический алгоритм сердечной недостаточности с сохраненной фракцией выброса Европейского общества кардиологов), H2FPEF — шкала для диагностики сердечной недостаточности с сохраненной фракцией выброса Американской ассоциации кардиологов (предложена клиникой Mayo, 2018).
Обсуждение
В настоящее время в ряде профильных центров страны стресс-ЭхоКГ с ВЭМ используется для диагностики как ИБС (стресс-индуцированная ишемия), так и СНсФВ (снижение диастолического резерва) [13][14]. Национальное согласованное мнение экспертов по проведению ДСТ было опубликовано в 2020г [1]. Предпринимаются попытки совершенствовать алгоритмы диагностики СНсФВ, в т.ч. с использованием современных методов визуализации миокарда [4][15]. Растет интерес в отношении анализа фазовой деформации ЛП, который может получить более широкое распространение [3][4][16][17].
Неспособность миокарда ЛЖ к адекватному растяжению и прогрессирующее увеличение ДЗ ЛЖ в раннюю диастолу описывается ростом отношения E/e’; угнетение растяжения стенок ЛП в резервуарную фазу/увеличение среднего давления в ЛП выражается снижением LASr [3]. Таким образом, LASI [18][19] — отношение E/e' к LASr — может выступать концептуальной мерой соответствия/комплаенса функций ЛП и ЛЖ, демаскируя формирующийся псевдонормальный тип ДД (рисунок 3). По нашим данным, способность LASI (при проведении ЭхоКГ покоя) в определении СНсФВ (подтверждение при ДСТ) была выше инструментально-лабораторного алгоритма HFA-PEFF и сопоставима с клинико-инструментальной шкалой H2FPEF (рисунок 2, таблица 5).
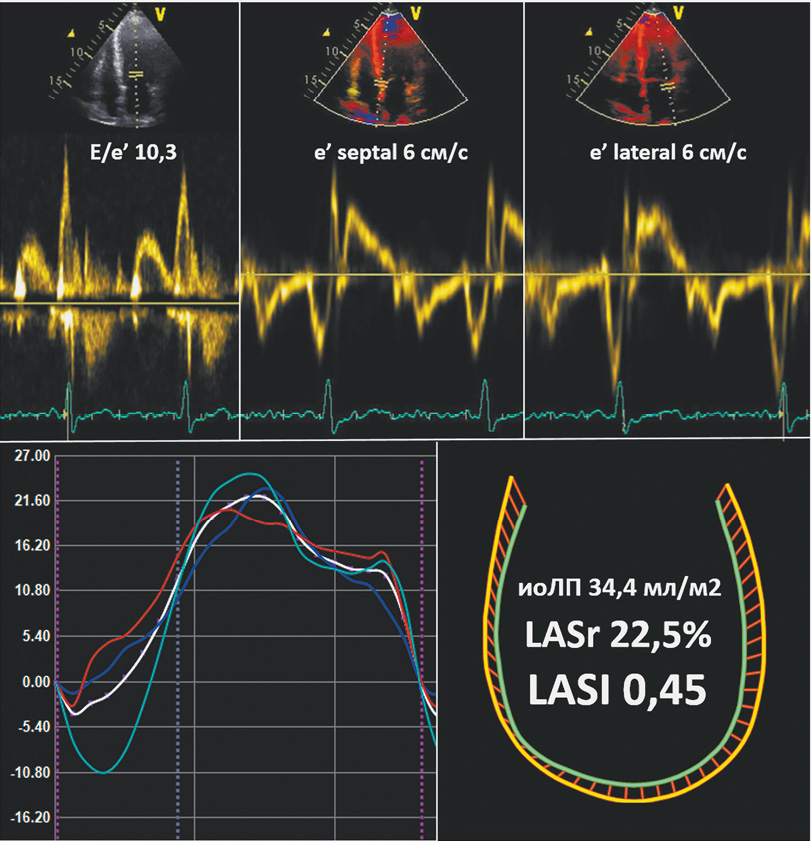
Рис. 3 Увеличение LASI у больного СНсФВ (E/e’ — 18,9 при проведении ДСТ) и исходной ДД с неопределенным ДЗ ЛЖ (при проведении ЭхоКГ покоя): E/e’ — 10,3, ИОЛП — 34,4 мл/м2, СДЛА — 20 мм рт.ст. (отсутствие 2 либо 3 положительных критериев из 3 возможных при использовании алгоритма рекомендаций по оценке диастолической функции ЛЖ).
Примечание: ДД — диастолическая дисфункция, ДЗ — давление заполнения, ДСТ — диастолический стресс-тест, ИОЛП — объем левого предсердия, индексированный по площади поверхности тела, ЛЖ — левый желудочек, СДЛА — систолическое давление в легочной артерии, СНсФВ — сердечная недостаточность с сохраненной фракцией выброса, стресс-ЭхоКГ с ВЭМ — стресс-эхокардиография с горизонтальной велоэргометрической пробой; LASr — Left Atrial Reservoir Strain (деформация фазы резервуара левого предсердия), LASI — Left Atrial Stiffness Index (индекс жесткости левого предсердия), E/e’ — отношение ранней диастолической скорости трансмитрального потока (Е) к ранней диастолической скорости движения фиброзного кольца митрального клапана (е’).
Авторы шкалы H2FPEF рассматривают ожирение (включенный критерий ИМТ >30 кг/м2 имеет 2 балла, АГ — только 1 балл) как доминирующую причину СНсФВ [20]. Ожирение сопровождается хроническим низкоинтенсивным иммунным воспалением, поэтому у ряда больных формируется кардиометаболический фенотип СНсФВ [21]. Метавоспаление, миокардиальный стресс и интерстициальный фиброз тесно взаимосвязаны в контексте инициации и развития СНсФВ, поэтому следует указать на "парадокс ожирения" в контексте диагностики этого синдрома [4][22]. Традиционно для выявления СНсФВ принято использовать оценку уровня NT-proBNP, однако концентрация этого биомаркера миокардиального стресса становится ниже при увеличении ИМТ. Согласно нашим данным, между группами не было различий по медиане концентрации NT-proBNP. При этом ~50% больных с СНсФВ имели NT-proBNP <220 пг/мл, ~30% >125 пг/мл (референс, предложенный HFA-PEFF). На это следует обратить внимание, т.к. у пациентов с СНсФВ и низким уровнем NT-proBNP отмечен высокий риск смерти/повторной госпитализации в сравнении с больными без этого синдрома [23].
Следует отметить, что метавоспаление наблюдается при многих наиболее распространенных сердечно-сосудистых заболеваниях: метаболической кардиомиопатии (ожирение, резистентность тканей к инсулину, сахарный диабет 2 типа), АГ, хронической болезни почек, ИБС [4]. По нашим данным, большинство указанных заболеваний чаще встречались у больных СНсФВ. Вне зависимости от причины метавоспаления циркулирующие в коронарном микроциркуляторном русле провоспалительные цитокины провоцируют избыточную продукцию активных форм кислорода. Окислительный стресс в свою очередь ведет к дефициту сигнального пути "оксид азота-циклический гуанозинмонофосфат-протеин киназа G", способствуя угнетению растяжения кардиомиоцитов [4]. Наряду с этим, следующим возможным шагом изучения СНсФВ может быть фенотипирование (подход, при котором больные с одним гетерогенным синдромом — СНсФВ — группируются по совокупностям признаков), которое, вероятно, будет ориентировать на выбор оптимального комплекса препаратов, влияющего на прогноз [21][24].
Таким образом, LASI и H2FPEF возможно использовать в качестве альтернативы ДСТ (рисунок 2, таблица 5). В дальнейшем актуальным представляется совершенствование инструментально-лабораторных способов претестовой диагностики СНсФВ с акцентом на биомаркеры, участвующие в синтезе коллагена [4][25].
Ограничения исследования. Размер выборки соответствует ограничениям малых групп.
Заключение
LASI с точкой отсечения ≥0,38 имеет наибольшую способность в определении СНсФВ среди возможных методов ее претестовой диагностики.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Овчинников А.Г., Агеев Ф.Т., Алёхин М.Н. и др. Диастолическая трансторакальная стресс-эхокардиография с дозированной физической нагрузкой в диагностике сердечной недостаточности с сохраненной фракцией выброса: показания, методология, интерпретация результатов. Кардиология. 2020;60(12):48-63. doi:10.18087/cardio.2020.12.n1219.
2. Nikorowitsch J, Bei der Kellen R, Kirchhof P, et al. Applying the ESC 2016, H2FPEF, and HFA-PEFF diagnostic algorithms for heart failure with preserved ejection fraction to the general population. ESC Heart Fail. 2021;8(5):3603-12. doi:10.1002/ehf2.13532.
3. Ovchinnikov AG, Potekhina A, Belyavskiy E, et al. Left atrial dysfunction as the major driver of heart failure with preserved ejection fraction syndrome. J Clin Ultrasound. 2022;50(8):1073-83. doi:10.1002/jcu.23318.
4. Широков Н. Е., Ярославская Е. И., Криночкин Д. В. и др. Принципы диагностики сердечной недостаточности с сохраненной фракцией выброса. Российский кардиологический журнал. 2023;28(3S):5448. doi:10.15829/1560-4071-2023-5448.
5. Nagueh SF, Smiseth OA, Appleton CP, et al. Recommendations for the evaluation of left ventricular diastolic function by echocardiography: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur J Echocardiogr. 2016;17(12):1321-60. doi:10.1016/j.echo.2016.01.011.
6. Pellikka PA, Arruda-Olson A, Chaudhry FA, et al. Guidelines for Performance, Interpretation, and Application of Stress Echocardiography in Ischemic Heart Disease: From the American Society of Echocardiography. J Am Soc Echocardiogr. 2020;33(1):1-41.e8. doi:10.1016/j.echo.2019.07.001.
7. Lancellotti P, Pellikka PA, Budts W, et al. The Clinical Use of Stress Echocardiography in Non-Ischaemic Heart Disease: Recommendations from the European Association of Cardiovascular Imaging and the American Society of Echocardiography. J Am Soc Echocardiogr. 2017;30(2):101-38. doi:10.1016/j.echo.2016.10.016.
8. Pieske B, Tschope C, De Boer RA, et al. How to diagnose heart failure with preserved ejection fraction: the HFA-PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). Eur Heart J. 2019;40(40):3297-317. doi:10.1093/eurheartj/ehz641.
9. Knuuti J, Wijns W, Saraste A, et al. ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020;41(3):407-77. doi:10.1093/eurheartj/ehz425.
10. Lang RM, Badano LP, Mor-Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr. 2015;28(1):1-39.e14. doi:10.1016/j.echo.2014.10.003.
11. Джиоева О.Н., Максимова О.А., Рогожкина Е.А. и др. Особенности протокола трансторакального эхокардиографического исследования у пациентов с ожирением. Российский кардиологический журнал. 2022;27(12):5243. doi:10.15829/1560-4071-2022-5243.
12. Badano LP, Kolias TJ, Muraru D, et al. Standardization of left atrial, right ventricular, and right atrial deformation imaging using two-dimensional speckle tracking echocardiography: a consensus document of the EACVI/ASE/Industry Task Force to standardize deformation imaging. Eur Heart J Cardiovasc Imaging. 2018;19(6):591-600. doi:10.1093/ehjci/jey042.
13. Абраменко Е. Е., Рябова Т. Р., Ёлгин И. И., Рябов В. В. Диагностическая значимость стресс-эхокардиографии c физической нагрузкой на горизонтальном велоэргометре у пациентов с острым коронарным синдромом без подъема сегмента ST низкого риска. Российский кардиологический журнал. 2023;28(8):5409. doi:10.15829/1560-4071-2023-5409.
14. Карев Е. А., Малев Э.Г., Вербило С. Л. и др. Одышка при физической нагрузке: диагностические возможности стресс-эхокардиографии. Кардиология. 2021;61(2):62-8. doi:10.18087/cardio.2021.2.n1320.
15. Драпкина О.М., Джиоева О.Н. Современные эхокардиографические критерии сердечной недостаточности с сохраненной фракцией выброса: не только диастолическая дисфункция. Кардиоваскулярная терапия и профилактика. 2020;19(2): 2454. doi:10.15829/1728-8800-2020-2454.
16. Сережина Е. К., Обрезан А. Г. Значимость эхокардиографической оценки деформации миокарда левого предсердия в ранней диагностике сердечной недостаточности с сохраненной фракцией выброса. Кардиология. 2021;61(8):68-75. doi:10.18087/cardio.2021.8.n1418.
17. Мазур Е.С., Мазур В.В., Баженов Н.Д. и др. Стрейн левого предсердия как предиктор результата диастолического стресс-теста у больных артериальной гипертензией. Кардиология. 2022;62(9):9-17. doi:10.18087/cardio.2022.9.n2206.
18. Kim D, Seo JH, Choi KH, et al. Prognostic Implications of Left Atrial Stiffness Index in Heart Failure Patients With Preserved Ejection Fraction. JACC Cardiovasc Imaging. 2023;16(4):435-45. doi:10.1016/j.jcmg.2022.11.002.
19. Zhu S, Lin Y, Zhang Y, et al. Prognostic relevance of left atrial function and stiffness in heart failure with preserved ejection fraction patients with and without diabetes mellitus. Front Cardiovasc Med. 2022;9:947639. doi:10.3389/fcvm.2022.947639.
20. Reddy YN, Carter RE, Obokata M, et al. A simple, evidence-based approach to help guide diagnosis of heart failure with preserved ejection fraction. Circulation. 2018;138(9):861-70. doi:10.1161/CIRCULATIONAHA.118.034646.
21. Агеев Ф. Т., Овчинников А. Г. Лечение пациентов с сердечной недостаточностью и сохраненной фракцией выброса: опора на клинические фенотипы. Кардиология. 2022;62(7):44-53. doi:10.18087/cardio.2022.7.n2058.
22. Obokata M, Reddy YNV, Pislaru SV, et al. Evidence Supporting the Existence of a Distinct Obese Phenotype of Heart Failure With Preserved Ejection Fraction. Circulation. 2017;136(1):6-19. doi:10.1161/CIRCULATIONAHA.116.026807.
23. Verbrugge FH, Omote K, Reddy YNV, et al. Heart failure with preserved ejection fraction in patients with normal natriuretic peptide levels is associated with increased morbidity and mortality. Eur Heart J. 2022;43(20):1941-51. doi:10.1093/eurheartj/ehab911.
24. Сережина Е.К., Обрезан А. Г. Особенности фенотипирования пациентов с сердечной недостаточностью с сохраненной фракцией выброса. Российский кардиологический журнал. 2023;28(3S):5348. doi:10.15829/1560-4071-2023-5348.
25. Гракова Е. В., Копьева К. В., Гусакова А. М. и др. Роль гуморальных маркеров в патогенезе сердечной недостаточности с сохраненной фракцией выброса левого желудочка у больных с неокклюзирующим коронарным атеросклерозом. Российский кардиологический журнал. 2022;27(10):5162. doi:10.15829/1560-4071-2022-5162.
Об авторах
Н. Е. ШироковРоссия
Широков Никита Евгеньевич — к.м.н., врач ультразвуковой диагностики, н.с. лаборатории инструментальной диагностики научного отдела инструментальных методов исследования.
Томск
Е. И. Ярославская
Россия
Ярославская Елена Ильинична — д.м.н., врач ультразвуковой диагностики, в.н.с., зав. лабораторией инструментальной диагностики научного отдела инструментальных методов исследования.
Томск
М. Д. Костерин
Россия
Костерин Михаил Дмитриевич — лаборант-исследователь лаборатории инструментальной диагностики научного отдела инструментальных методов исследования.
Томск
Д. В. Криночкин
Россия
Криночкин Дмитрий Владиславович — к.м.н., зав. отделением ультразвуковой диагностики, с.н.с. лаборатории инструментальной диагностики научного отдела инструментальных методов исследования.
Томск
Е. А. Горбатенко
Россия
Горбатенко Елена Александровна — м.н.с. лаборатории инструментальной диагностики научного отдела инструментальных методов исследования.
Томск
Т. Н. Енина
Россия
Енина Татьяна Николаевна — д.м.н., в.н.с. отделения артериальной гипертонии и коронарной недостаточности, врач-кардиолог.
Томск
Н. А. Мусихина
Россия
Мусихина Наталья Алексеевна — к.м.н., в.н.с., зав. отделением неотложной кардиологии научного отдела клинической кардиологии.
Томск
Дополнительные файлы
Что известно о предмете исследования?
- Сердечная недостаточность с сохраненной фракцией выброса (СНсФВ) инструментально диагностируется при проведении диастолического стресс-теста (моделирование физической нагрузки с одновременной оценкой диастолического резерва).
- Известные методы претестовой диагностики СНсФВ имеют низкую согласованность.
Что добавляют результаты исследования?
- Признаки повышения давления заполнения левого желудочка (E/e’ и Left Atrial reservoir Strain) при проведении эхокардиографии покоя выше у больных с СНсФВ.
- Left Atrial Stiffness Index в сравнении с алгоритмами HFA-PEFF и H2FPEF имеет наибольшую диагностическую возможность определения СНсФВ.
Рецензия
Для цитирования:
Широков Н.Е., Ярославская Е.И., Костерин М.Д., Криночкин Д.В., Горбатенко Е.А., Енина Т.Н., Мусихина Н.А. Индекс жесткости левого предсердия в определении сердечной недостаточности с сохраненной фракцией выброса. Кардиоваскулярная терапия и профилактика. 2024;23(4):3901. https://doi.org/10.15829/1728-8800-2024-3901
For citation:
Shirokov N.E., Yaroslavskaya E.I., Kosterin M.D., Krinochkin D.V., Gorbatenko E.A., Enina T.N., Musikhina N.A. Left atrial stiffness index in the identification of heart failure with preserved ejection fraction. Cardiovascular Therapy and Prevention. 2024;23(4):3901. (In Russ.) https://doi.org/10.15829/1728-8800-2024-3901

























































