Перейти к:
Связь сывороточных уровней белков теплового шока с выраженностью венозного застоя у пациентов с острой декомпенсацией сердечной недостаточности с сохраненной фракцией выброса
https://doi.org/10.15829/1728-8800-2024-4037
EDN: HXKJTD
Аннотация
Цель. Анализ ассоциаций сывороточных уровней белков теплового шока (БТШ) — БТШ27, БТШ70 и кардиоваскулярного БТШ (квБТШ), с наличием острой декомпенсации и признаками венозного застоя у больных с сердечной недостаточностью с сохраненной фракцией выброса (СНсФВ).
Материал и методы. Обследовано 80 больных с СНсФВ в возрасте 50-85 лет: 60 — с острой декомпенсацией и 20 — с компенсированной СНсФВ. Уровни БТШ анализировали иммуноферментным методом с использованием наборов реактивов AssayPro (США) и Cloud-Clone (КНР/США) с детекцией на фотометре Multiskan FC.
Результаты. Медианы уровней БТШ27, БТШ 70 и квБТШ у больных с острой декомпенсацией СНсФВ были статистически значимо выше, чем у больных с компенсированной СНсФВ. В группе больных с декомпенсированной СНсФВ с незначительным венозным застоем медианы БТШ27 (0,58 нг/мл) и квБТШ (905 пг/мл) статистически значимо ниже медиан в группе больных с умеренным или выраженным венозным застоем — 1,67 нг/мл и 1028 пг/мл, соответственно. Медианы БТШ27 и квБТШ у больных с количеством B-линий в одном сегменте ≥3 были статистически значимо выше медиан маркеров у больных с количеством B-линий <3 более чем в 3,6 раз и 1,2 раза, соответственно.
Заключение. Выявлена связь сывороточных концентраций БТШ27, БТШ70 и квБТШ с наличием острой декомпенсацией СНсФВ, при этом для БТШ27 и квБТШ показана взаимосвязь с выраженностью застойных явлений, оцениваемых по VExUS (Venous Excess UltraSound) и B-линиям.
Ключевые слова
Для цитирования:
Тимофеев Ю.С., Афаунова А.Р., Иванова А.А., Веденикин Т.Ю., Джиоева О.Н., Метельская В.А., Покровская М.С., Драпкина О.М. Связь сывороточных уровней белков теплового шока с выраженностью венозного застоя у пациентов с острой декомпенсацией сердечной недостаточности с сохраненной фракцией выброса. Кардиоваскулярная терапия и профилактика. 2024;23(6):4037. https://doi.org/10.15829/1728-8800-2024-4037. EDN: HXKJTD
For citation:
Timofeev Yu.S., Afaunova A.R., Ivanova A.A., Vedenikin T.Yu., Dzhioeva O.N., Metelskaya V.A., Pokrovskaya M.S., Drapkina O.M. Interaction of serum heat shock proteins’ levels with the severity of venous congestion in patients with acute decompensated heart failure with preserved ejection fraction. Cardiovascular Therapy and Prevention. 2024;23(6):4037. (In Russ.) https://doi.org/10.15829/1728-8800-2024-4037. EDN: HXKJTD
Введение
Больше половины всех пациентов с сердечной недостаточностью (СН) в Российской Федерации имеют СН с сохраненной фракцией выброса (ФВ) (СНсФВ), и ее распространенность продолжает увеличивается по отношению к СН с низкой ФВ (СНнФВ). СНсФВ представляет собой сложное гетерогенное заболевание, сопряженное с высокой смертностью и госпитализациями на фоне ее декомпенсации. Сложность диагностики и патофизиологических механизмов, увеличение заболеваемости делают СНсФВ одной из актуальных проблем современной кардиологии [1][2].
Основным инструментальным методом диагностики СНсФВ является эхокардиография (ЭхоКГ). При проведении ЭхоКГ оцениваются систолическая и диастолическая функция левого желудочка (ЛЖ), признаки ремоделирования миокарда и другие структурные и функциональные изменения, необходимые для установления диагноза [3]. В стандартный протокол ЭхоКГ входит оценка диаметра и степени коллабирования нижней полой вены (НПВ), однако этих параметров недостаточно для полноценной оценки застойных явлений у пациентов с декомпенсацией СНсФВ. С этой целью в клинической практике все активнее применяются такие методы, как ультразвуковое исследование (УЗИ) легких с оценкой B-линий, а также протокол VExUS (VEnous excess UltraSound) для оценки выраженности венозного застоя [4][5]. Протокол VExUS включает измерение диаметра НПВ, а также пошаговую оценку допплеровских кривых в портальной, печеночных и почечных венах, что позволяет определить степень и характер застойных явлений. Его польза для прогнозирования исходов у пациентов с декомпенсацией СНсФВ изучена в отечественных и зарубежных работах [6][7]. Однако применение описанных выше методик часто ограничивается временем, отведенным на обследование пациента, и недостаточной квалификацией специалистов, что делает необходимым поиск новых прогностических биомаркеров СНсФВ.
Значительную роль в патогенезе СН играет клеточный стресс — реакция клетки на действие комплекса метаболических, митохондриальных, воспалительных, окислительных факторов, в результате которого развивается так называемый ответ белков теплового шока (БТШ) (HSR — heat shock response), декомпенсация которого приводит к развитию патологических замкнутых кругов, обусловленных в т.ч. гиперсекрецией БТШ [8]. БТШ представляют собой молекулярные шапероны, которые в физиологических условиях внутри клетки выполняют протективные функции, поддерживая целостность структуры внутриклеточных белков, тогда как их гиперсекреция во внеклеточную среду не только свидетельствует о недостаточности компенсаторных механизмов, но и сопровождается усилением хронического воспаления [9-12]. БТШ могут рассматриваться как факторы, характеризующие клеточный стресс на разных уровнях биологической организации и с различной тканеспецифичностью. Для биохимической оценки клеточного стресса могут рассматриваться как низкомолекулярные "малые" БТШ, отвечающие за независимое от аденозинтрифосфата (АТФ) звено — например, БТШ27, так и высокомолекулярные БТШ, отвечающие за АТФ-зависимую реакцию на клеточный стресс, среди которых наиболее изучен БТШ70 [13-15]. HSPb7 или кардиоваскулярный БТШ (квБТШ) выполняет функцию шаперона актиновых микрофиламентов и обладает кардиоспецифичностью, однако этот белок исследовался главным образом в экспериментальных моделях [16]. Таким образом, дополнительные маркеры, включая ультразвуковые критерии застойных явлений и биохимические показатели, характеризующие клеточный стресс, могут дополнять традиционные маркеры прогноза и оценки степени тяжести СНсФВ [17-19]. Большинство предыдущих исследований включали главным образом пациентов с СН с низкой и промежуточной фракцией выброса, тогда как СНсФВ в этом аспекте остается недостаточно исследованной.
Цель работы — анализ ассоциаций сывороточных уровней БТШ (БТШ27, БТШ70 и квБТШ) с наличием острой декомпенсации и признаками венозного застоя у больных СНсФВ.
Материал и методы
В исследование включено 80 больных с диагнозом СНсФВ в возрасте от 50 до 85 лет, среди которых было 20 пациентов с компенсированной СНсФВ, проходивших лечение в ФГБУ "НМИЦ ТПМ" Минздрава России в период с 01.09.2023 по 01.03.2024, а также 60 больных с клинической картиной острой декомпенсации СНсФВ, госпитализированных в ГКБ им. В. В. Вересаева г. Москвы в тот же период времени.
Критерии включения: возраст 50-85 лет, для обеих групп — наличие подтвержденного диагноза СНсФВ в соответствии с критериями, представленными в клинических рекомендациях: ФВ ЛЖ >50%, наличие симптомов и признаков СН, структурные и/или функциональные изменения, свидетельствующие о наличии диастолической дисфункции [20]. В группу декомпенсации включались лица с признаками острой декомпенсации СНсФВ. Под острой декомпенсацией подразумевается усугубление ранее присутствовавших симптомов и признаков СН (одышка, ортопноэ, застойные явления и др.) на фоне триггерного события — колебаний артериального давления, нарушений ритма и проводимости сердца (брадикардия, пароксизм фибрилляции предсердий), или без провоцирующих факторов; повышение уровня N-концевого промозгового натрийуретического пептида (NT-proBNP) >900 пг/мл у пациентов 50-75 лет и >1800 пг/мл у пациентов >75 лет [3].
Критерии невключения в исследование: острое нарушение мозгового кровообращения в течение последних 3 мес., онкологические заболевания и проведенная химиотерапия, лучевая терапия, тяжелый порок клапанов сердца, заболевания, которые сопровождаются симптомами, сходными с таковыми при СН (хроническая обструктивная болезнь легких, бронхиальная астма), тяжелые нарушения ритма и проводимости, требующие электрокардиостимуляции.
Исследование было выполнено в соответствии со стандартами Надлежащей клинической практики и принципами Хельсинкской декларации. Все пациенты подписывали информированное согласие при поступлении. Протокол исследования был одобрен локальным этическим комитетом ФГБУ "НМИЦ ТПМ" Минздрава России — № 04-05/23 от 18.09.2023г.
На момент исследования пациенты с СНсФВ получали лечение по показаниям в рамках лечения основного и сопутствующих заболеваний. В группе с декомпенсированной СНсФВ наиболее часто назначаемой группой препаратов были блокаторы ренин-ангиотензин-альдостероновой системы (РААС) — 85,0%, в равных долях диуретики (50,0%) и β-адреноблокаторы (48,3%), в остальном по структуре назначенной терапии получены следующие данные: пероральные антикоагулянты — 43,3%, антагонисты минералокортикоидных рецепторов — 11,7%, ингибиторы натрий-глюкозного котранспортера 2 типа — 10,0%. В группе пациентов с компенсированной СНсФВ все пациенты получали блокаторы РААС (100%), у 85,0% назначены β-адреноблокаторы, у 55,0% диуретики, у 50,0% пероральные антикоагулянты, у 20,0% антагонисты минералокортикоидных рецепторов.
Пациентам, включенным в исследование, проводилась трансторакальная ЭхоКГ по стандартному протоколу с оценкой диастолической функции и рутинные лабораторные исследования (таблица 1).
Таблица 1
Клинико-инструментальные и лабораторные характеристики больных СНсФВ
|
Показатель |
СНсФВ (острая декомпенсация) (n=60) |
СНсФВ (компенсированная) (n=20) |
|
Общая характеристика |
||
|
Возраст, лет; Me [ Q25-Q75] |
72 [ 63,0-74,0] |
67 [ 64,0-68,0] |
|
Мужчины, n (%) |
20 (33,3) |
12 (60,0) |
|
Женщины, n (%) |
40 (66,7) |
8 (40,0) |
|
ИМТ, кг/м²; Me [ Q25-Q75] |
30,3 [ 26,5-33,9] |
29,9 [ 26,7-32,6] |
|
Нормальная масса тела — ИМТ 18-25 кг/м², n (%) |
9 (15,0) |
3 (15,0) |
|
Избыточная масса тела — ИМТ 25-30 кг/м², n (%) |
19 (31,7) |
8 (40,0) |
|
Ожирение — ИМТ >30 кг/м², n (%) |
32 (53,3) |
9 (45,0) |
|
ИБС, n (%) |
37 (61,7) |
0 (0,0) |
|
ФП, n (%) |
30 (50,0) |
11 (55,0) |
|
Лабораторные показатели |
||
|
NT-proBNP, пг/мл; Me [ Q25-Q75]* |
1958 [ 947-6084] |
145 [ 130-300] |
|
АЛТ, Ед/л; Me [ Q25-Q75] |
20,6 [ 15,2-32,3] |
21,5 [ 12,0-26,0] |
|
АСТ, Ед/л; Me [ Q25-Q75] |
21,5 [ 17,6-31,5] |
22,0 [ 16,5-24,5] |
|
Креатинин, мкмоль/л; Me [ Q25-Q75]** |
101 [ 78,2-137] |
83,0 [ 68,5-90,0] |
|
CКФ по CKD-EPI; Me [ Q25-Q75]*** |
65 [ 39,5-80,0] |
81,5 [ 70,0-87,0] |
|
Показатели ЭхоКГ |
||
|
ФВ ЛЖ (по Симпсону), %; Me [ Q25-Q75]# |
58,0 [ 55,0-60,5] |
62,0 [ 58,5-64,5] |
|
иММЛЖ, г/м²; Me [ Q25-Q75] |
111 [ 98,0-130] |
115 [ 105-122] |
|
ОТС ЛЖ, мм; Me [ Q25-Q75]## |
0,53 [ 0,49-0,57] |
0,46 [ 0,45-0,50] |
|
E/A; Me [ Q25-Q75] |
0,86 [ 0,72-1,06] |
0,90 [ 0,82-1,24] |
|
E/e’; Me [ Q25-Q75] |
13,8 [ 11,7-15,5] |
13,0 [ 13,0-13,4] |
|
Индекс объема ЛП, мм/м²; Me [ Q25-Q75] |
41,0 [ 38,0-46,0] |
37,0 [ 34,0-42,5] |
Примечание: * — p=0,001; ** — p=0,005; *** — p=0,002; # — p=0,001; ## — p=0,001. АЛТ — аланинаминотрансфераза, АСТ — аспартатаминотрансфераза, ИБС — ишемическая болезнь сердца, иММЛЖ — индекс массы миокарда левого желудочка, ИМТ — индекс массы тела, ЛП — левое предсердие, ОТС ЛЖ — относительная толщина стенок левого желудочка, СКФ по CKD-EPI — скорость клубочковой фильтрации по формуле Chronic Kidney Disease Epidemiology Collaboration, СНсФВ — сердечная недостаточность с сохраненной фракцией выброса, ФВ ЛЖ — фракция выброса левого желудочка, ФП — фибрилляция предсердий, ЭхоКГ — эхокардиография. E/A — отношение максимальных скоростей раннего и позднего наполнения трансмитрального кровотока, E/e’ — отношение максимальных скоростей раннего наполнения трансмитрального кровотока и движения фиброзного кольца митрального клапана в раннюю диастолу, Me [ Q25-Q75]) — медиана и интерквартильный размах, NT-proBNP — N-концевой промозговой натрийуретический пептид.
Наряду с этим всем пациентам проводилось УЗИ легких с оценкой В-линий. В норме в каждом межреберном промежутке определяется <3 В-линий. Наличие ≥3 В-линий означает присутствие внесосудистой жидкости в легочной ткани.
С целью оценки выраженности периферического венозного застоя проводилось УЗИ по протоколу VExUS [5]. Первым шагом данного протокола является оценка диаметра НПВ. При НПВ ≥20 мм проводится оценка формы допплеровских кривых в печеночных венах, затем в портальной и в междолевых венах почек. В норме в печеночных венах систолическая фаза кровотока преобладает над диастолической, изменение соотношения фаз является умеренным отклонением, полный реверс систолической фазы считается выраженным отклонением. В портальной вене рассчитывается индекс пульсации, значения 30-50% считаются умеренным отклонением, >50% — выраженным. В почечных венах в норме кровоток непрерывный, двухфазный кровоток является умеренным отклонением, однофазный — выраженным. В зависимости от диаметра НПВ, количества и степени выявленных отклонений устанавливается степень выраженности венозного застоя: VExUS Grade 0 (застоя нет), VExUS Grade 1 (незначительный застой), VExUS Grade 2 (умеренный застой) и VExUS Grade 3 (выраженный застой).
Взятие крови для исследования БТШ проводилось натощак из кубитальной вены, непосредственно перед началом каких-либо лечебных мероприятий в вакуумную систему Monovette Serum S (Sarstedt, Германия). После центрифугирования при 3000 об./мин при комнатной температуре полученная сыворотка находилась на надежном ответственном хранении при температуре от -70 до -80° С в "Банке биологического материала" ФГБУ "НМИЦ ТПМ" Минздрава России. Количественное определение БТШ проводилось твердофазным иммуноферментным методом с использованием наборов реактивов Human Heat Shock Protein 27 AssayMax ELISA Kit (Assay Pro, США), ELISA Kit for Heat Shock Protein 70 (Cloud-Clone, КНР/США) и ELISA Kit for Heat Shock Protein Beta 7 (Cloud-Clone, КНР/США) с детекцией на микропланшетном фотометре Multiskan FC (Thermo Fisher Scientific, США).
Статистический анализ полученных результатов проводился в программе Statistica 10 (Statsoft, США) и SPSS (IBM, Россия). Количественные переменные описывались медианами (Ме) и интерквартильным размахом [Q25-Q75], для сравнения групп использовался непараметрический критерий Манна-Уитни. Корреляционный анализ проводился методом ранговой корреляции по Спирмену. Для анализа диагностической эффективности биомаркеров применялся ROC-анализ (Receiver operating characteristic analysis) с расчетом площади под кривой (AUC — area under curve), для расчета пороговых уровней применялся коэффициент Юдена (J). Различия и корреляционные связи считались статистически значимыми при p<0,05.
Результаты
Ме концентрации БТШ27 у больных с острой декомпенсацией СНсФВ была в 2,2 раза выше (p=0,019), чем у больных с компенсированной СНсФВ, при этом максимальное значение данного показателя (66,2 нг/мл) было характерно для группы с острой декомпенсацией (таблица 2). Ме уровня БТШ70 в сыворотке крови больных с декомпенсацией также была статистически значимо выше (p=0,002) относительно группы со стабильной СНсФВ, при этом максимальные концентрации белка достигали 36,8 нг/мл. Проведенный анализ уровней квБТШ показал статистически значимые различия (p=0,001) между группами с острой декомпенсацией и компенсированной СНсФВ, при этом Me в группе пациентов с декомпенсацией была выше в >2,7 раз, однако таких выраженных вариаций, как для других проанализированных нами БТШ выявлено не было и максимальное значение в данной группе составило 2505 пг/мл.
Таблица 2
Сравнительный анализ концентраций БТШ в сыворотке крови больных СНсФВ
|
Показатель |
СНсФВ (острая декомпенсация) (n=60) |
СНсФВ (компенсированная) (n=20) |
p |
|
|
БТШ 27 (нг/мл) |
Me [ Q25-Q75] |
0,99 [ 0,34-2,89] |
0,45 [ 0,21-1,16] |
0,019 |
|
Min-max |
0,0-66,2 |
0,0-9,09 |
||
|
БТШ70 (нг/мл) |
Me [ Q25-Q75] |
3,47 [ 2,24-4,84] |
2,19 [ 1,64-3,05] |
0,002 |
|
Min-max |
0,0-36,8 |
0,0-4,36 |
||
|
квБТШ (пг/мл) |
Me [ Q25-Q75] |
967 [ 839-1182] |
350 [ 233-522] |
0,001 |
|
Min-max |
426-2505 |
0,0-1339 |
||
Примечание: БТШ — белки теплового шока, СНсФВ — сердечная недостаточность с сохраненной фракцией выброса, Me [ Q25-Q75]) — медиана и интерквартильный размах.
Анализ концентраций БТШ показал отсутствие статистически значимой зависимости данных биомаркеров от возраста пациентов (БТШ 27: R=0,08, p=0,52; БТШ70: R=-0,10; p=0,43; квБТШ: R=0,08, p=0,55), индекса массы тела (БТШ 27: R=0,12, p=0,37; БТШ70: R=-0,17; p=0,19; квБТШ: R=0,012, p=0,92), а также не выявил различий в зависимости от пола больных СНсФВ и других клинико-анамнестических характеристик, тогда как для БТШ 27 и квБТШ были получены статистически значимые ассоциации с результатами УЗИ, характеризующими застойные явления. Более того, в группе острой декомпенсации СНсФВ не было выявлено статистически значимых различий концентраций анализируемых БТШ в зависимости от наличия острого почечного повреждения (БТШ27: p=0,06; БТШ70: p=0,08; квБТШ: p=0,3).
У больных с декомпенсированной СНсФВ с незначительным венозным застоем (VExUS Grade =1; n=25) уровни БТШ27 и квБТШ отличались от концентраций у больных с умеренным или выраженным венозным застоем (VExUS Grade =2 или 3; n=35). На рисунке 1 видно, что Ме уровня БТШ27 в группе с VExUS Grade 2-3 была почти в 3 раза выше? чем у больных с VExUS Grade 1, при этом различия носили статистически значимый характер (p=0,038). Различия для квБТШ были также статистически значимы, однако разница в уровнях была не столь выраженной, тогда как для БТШ70 различий в зависимости от выраженности застойных явлений выявлено не было.
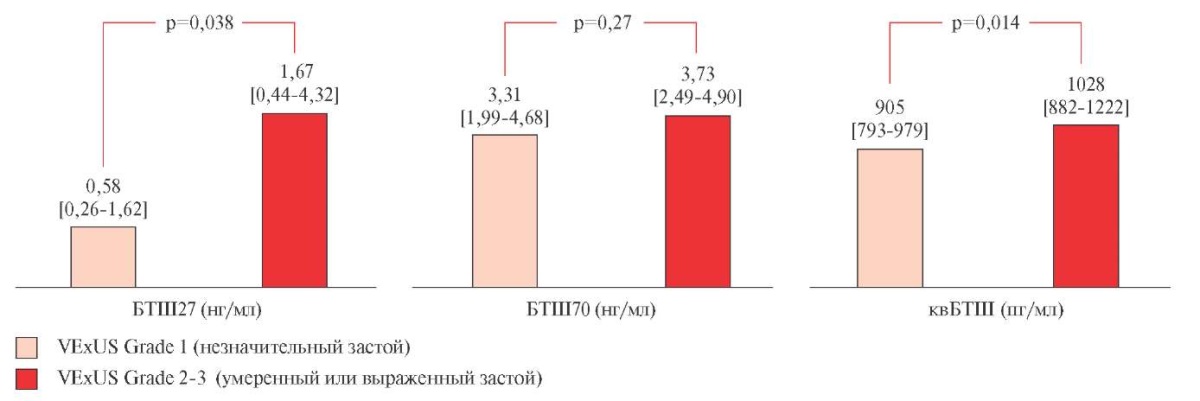
Рис. 1 БТШ и выраженность венозного застоя по VExUS.
Примечание: БТШ — белок теплового шока, квБТШ — кардиоваскулярный БТШ, ИЛ — интерлейкин, VExUS Grade — выраженность периферического венозного застоя по данным ультразвуковового исследования по протоколу VExUS (Venous Excess UltraSound). Данные представлены в виде медиан с интерквантильным интервалом.
При анализе B-линий у больных с острой декомпенсацией СНсФВ пациенты разделялись согласно количеству В-линий в одном сегменте на две подгруппы — больные с количеством B-линий <3 и больные с количеством В-линий ≥3 (рисунок 2). Проведенный анализ концентраций БТШ в зависимости от данного показателя выявил зависимости, схожие с результатами анализа по VExUS Grade. Так, Me концентрации БТШ27 у больных с количеством B-линий в одном сегменте ≥3 была статистически значимо (p=0,014) выше Ме данного маркера у больных с количеством B-линий в одном сегменте <3 более чем в 3,6 раз. Для концентраций БТШ70 статистически значимых различий по данному признаку получено не было, тогда как для квБТШ были выявлены различия (p=0,015) Ме в зависимости от количества В-линий, однако Ме квБТШ в группе пациентов с количеством B-линий в одном сегменте ≥3 только в 1,2 раза превышала Ме концентрации данного белка в сыворотке крови больных с количеством B-линий в одном сегменте <3.
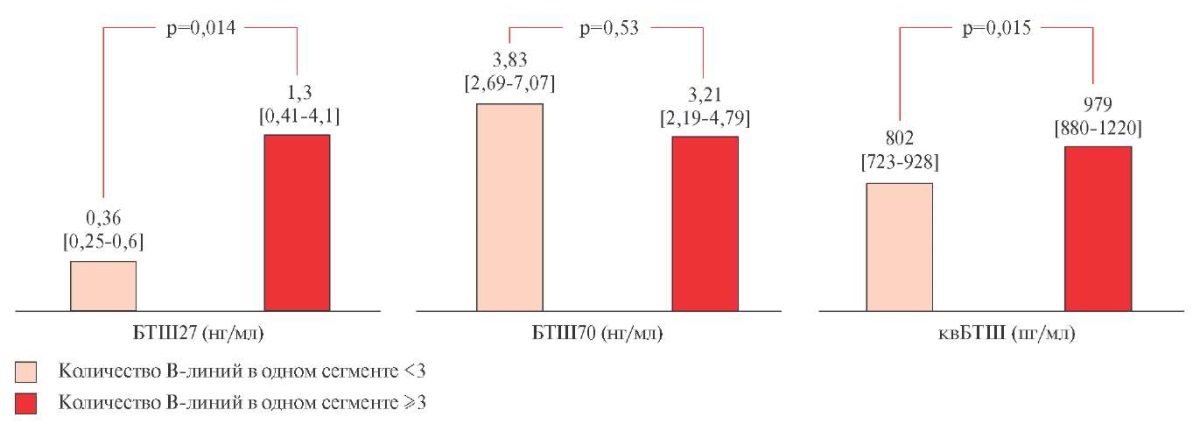
Рис. 2 БТШ и количество B-линий в сегменте.
Примечание: БТШ — белок теплового шока, квБТШ — кардиоваскулярный БТШ, ИЛ — интерлейкин. Данные представлены в виде медиан с интерквантильным интервалом.
С целью оценки потенциальной возможности применения БТШ27 и квБТШ в качестве биомаркеров, отражающих венозный застой при острой декомпенсации СНсФВ, характеризуемый по VExUS и B-линиям, был проведен ROC-анализ (рисунок 3).
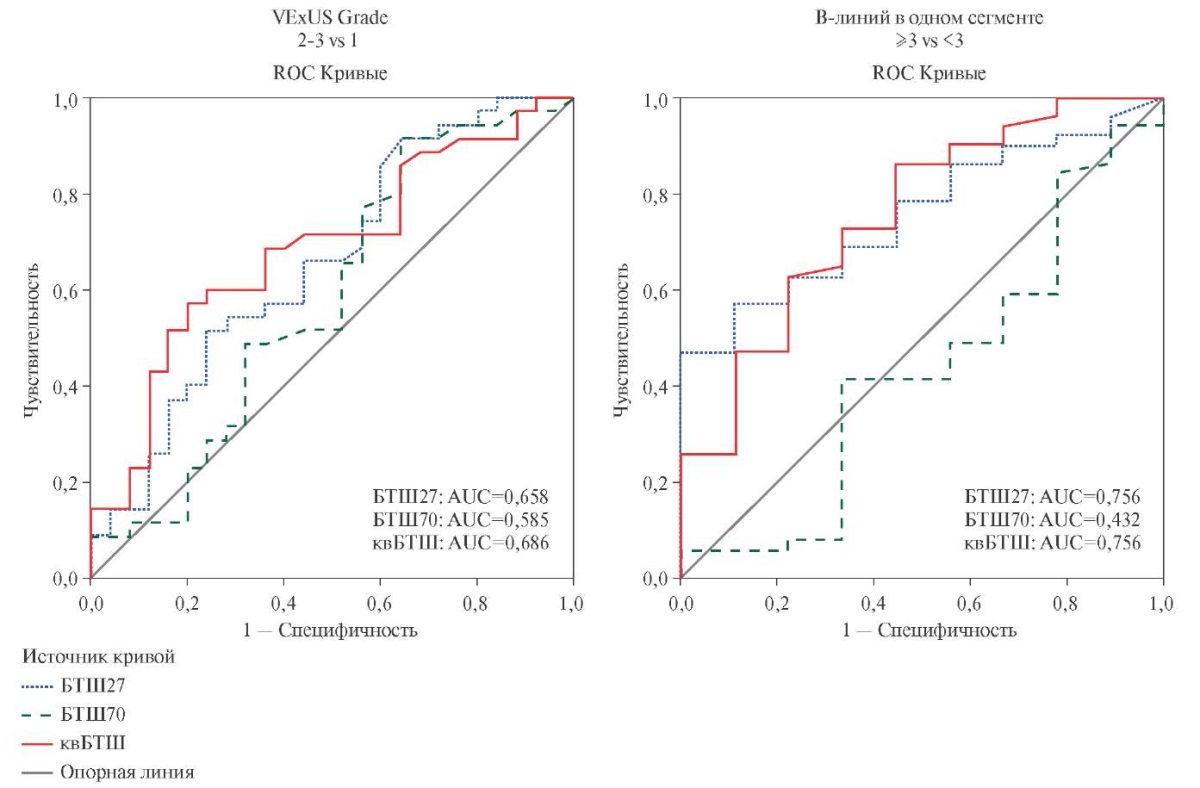
Рис. 3 Результаты ROC-анализа эффективности БТШ как биомаркеров венозного застоя при острой декомпенсации СНсФВ.
Примечание: БТШ — белок теплового шока, квБТШ — кардиоваскулярный БТШ, ИЛ — интерлейкин, СНсФВ — сердечная недостаточность с сохраненной фракцией выброса, VExUS Grade — выраженность периферического венозного застоя по данным ультразвукового исследования по протоколу VExUS (Venous Excess UltraSound), AUC — площадь под кривой (area under curve).
При анализе диагностической эффективности БТШ в качестве биомаркеров, позволяющих дифференцировать незначительный венозный застой от умеренного и выраженного (1 vs 2 и 3 по VExUS Grade) для БТШ27 площадь под кривой (AUC) составила 0,658, для квБТШ AUC=0,686, для БТШ70 AUC=0,585; таким образом наибольшая диагностическая эффективность была характерна для квБТШ и БТШ27. Рассчитанный согласно максимальному индексу Юдена (J) пороговый уровень для БТШ27 составил 1,6 нг/мл (J=0,274, диагностическая чувствительность 51,4%, при диагностической специфичности 76,0%), для квБТШ — 1003 пг/мл (J=0,371, чувствительность 57,1%, специфичность 80,0%).
ROC-анализ также показал потенциальную диагностическую эффективность ряда БТШ для дифференцировки больных с количеством B-линий <3 и больных с количеством В-линий ≥3. Так, AUC для БТШ27 и квБТШ достигала 0,756, тогда как для БТШ70 была низкой (AUC=0,432). Были рассчитаны пороговые уровни для БТШ27 — 1,0 нг/мл (J=0,46, диагностическая чувствительность — 56,9%, при диагностической специфичности 88,9%) и для квБТШ — 931 пг/мл (J=0,405 чувствительность 62,7%, при специфичности 77,8%).
Обсуждение
В настоящей работе впервые в Российской Федерации нами были проанализированы уровни БТШ в группах пациентов с компенсированной СНсФВ и острой декомпенсацией СНсФВ. У пациентов с декомпенсацией СНсФВ также были изучены ассоциации между выраженностью застойных явлений и уровнями БТШ. Оценка тяжести венозного застоя проводилась при помощи ультразвукового определения В-линий и протокола VExUS. Оба метода находят широкое применение в диагностике и оценке тяжести острой декомпенсации СНсФВ, однако требуют четкого соблюдения протокола и являются зависимыми от квалификации оператора [4-7]. Более того, УЗИ легких в сочетании с полным VExUS протоколом занимает существенное количество дополнительного времени на обследование одного пациента, что может явиться ограничением в условиях отделения реанимации и интенсивной терапии. В связи с вышеописанными причинами крайне актуален поиск простых для определения биохимических маркеров, характеризующих тяжесть течения декомпенсированной СНсФВ.
Проанализированный в настоящем исследовании комплекс БТШ, характеризующих как системный биохимический ответ на клеточный стресс — БТШ27 и БТШ70, так и квБТШ, для которого описана кардиоспецифичность, ранее у больных с СНсФВ не исследовался.
В литературе имеется ряд работ, посвящённых изучению БТШ27 у больных СН, результаты которых достаточно неоднозначны; например, в одной из работ низкие уровни БТШ27 соответствовали более низкой ФВ ЛЖ у больных СН [21]. В другом исследовании были получены результаты, согласно которым средние уровни БТШ27 в сыворотке крови больных СНсФВ были выше, чем в контрольной группе, однако связь с декомпенсацией заболевания не исследовалась [22]. В исследовании Traxler D, et al., изучали только уровни БТШ27 у больных с СН с различной ФВ. В работе не было выявлено различий между пациентами с сохраненной, сниженной и низкой ФВ ЛЖ, однако была показана связь повышенных уровней БТШ27 с риском сердечно-сосудистой смерти и незапланированной госпитализации [17]. Несмотря на различный дизайн исследований, можно найти точки пересечения с нашими результатами, согласно которым гиперсекреция БТШ27 была ассоциирована с декомпенсацией и выраженностью застойных явлений, которые являются неблагоприятными факторами прогноза. В работе Traxler D, как и в нашей работе, не было выявлено связи БТШ27 с возрастом и полом больных, что подтверждает независимость концентраций биомаркера от этих факторов [17].
Большинство исследований, посвященных анализу БТШ70 в периферической крови больных с СН, демонстрирует связь гиперсекреции данного биомаркера с наличием структурного поражения сердца, более тяжелым течением СН и более высоким функциональным классом по NYHA (New York Heart Association) [23][24]. Полученные нами данные не выявили связи БТШ70 с выраженностью венозного застоя, однако при декомпенсации СНсФВ концентрации данного белка были значительно выше, что согласуется с литературными данными о связи циркулирующих уровней БТШ70 с более тяжелым течением СН.
Исследования квБТШ при СН проводилось ранее только в экспериментальных работах на мышах. При этом, если в кардиомиоцитах квБТШ играл, скорее, протективную роль, а его недостаток приводил к неблагоприятным исходам [16], то его повышенное содержание в сыворотке крови экспериментальных животных было ассоциировано с развитием СН, причем уже на ранних стадиях [25]. В настоящем исследовании были впервые измерены концентрации квБТШ у пациентов с СНсФВ, при этом концентрации маркера оказались более высокими при декомпенсации заболевания, а также при выраженном венозном застое.
Ограничения исследования. Одним из основных ограничений исследования является относительно небольшой объем выборки, что не позволило провести комплексный многофакторный анализ. Другим ограничением, связанным с особенностями маршрутизации пациентов, является использование двух различных клинических баз, однако важно отметить, что все пациенты с декомпенсацией СНсФВ исследовались на одной базе, что повышает значимость результатов внутри данной группы больных.
Заключение
В ходе настоящего исследования выявлена связь сывороточных концентраций БТШ27, БТШ70 и квБТШ с острой декомпенсацией СНсФВ. Помимо этого, для БТШ27 и квБТШ была показана взаимосвязь с выраженностью застойных явлений оцениваемых по VExUS и B-линиям. Таким образом, циркулирующие БТШ можно рассматривать как потенциальные биомаркеры, связанные c клиническими особенностями СНсФВ, дальнейшее изучение которых позволит оценить их возможности в диагностике и прогнозировании, а также лучше понять роль клеточного стресса в патогенезе данного заболевания.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Поляков Д. С., Фомин И. В., Беленков Ю. Н. и др. Хроническая СН в Российской Федерации: что изменилось за 20 лет наблюдения? Результаты исследования ЭПОХА-ХСН. Кардиология. 2021;61(4):4-14. doi:10.18087/cardio.2021.4.n1628.
2. Драпкина О. М., Бойцов С. А., Омельяновский В. В. и др. Социально-экономический ущерб, обусловленный хронической СН, в Российской Федерации. Российский кардиологический журнал. 2021;26(6):4490. doi:10.15829/1560-4071-2021-4490.
3. Хроническая сердечная недостаточность. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11): 4083. doi:10.15829/1560-4071-2020-4083.
4. Demi L, Wolfram F, Klersy C, et al. New International Guidelines and Consensus on the Use of Lung Ultrasound. J Ultrasound Med. 2023;42(2):309-44. doi:10.1002/jum.16088.
5. Beaubien-Souligny W, Rola P, Haycock K, et al. Quantifying systemic congestion with Point-Of-Care ultrasound: development of the venous excess ultrasound grading system. Ultrasound J. 2020;12(1):16. doi:10.1186/s13089-020-00163-w.
6. Кобалава Ж. Д., Асланова Р. Ш., Сафарова А. Ф., Вацик-Городецкая М. В. Прикроватная ультразвуковая оценка венозного застоя по протоколу VExUS при хронической сердечной недостаточности: клинические ассоциации и прогностическое значение. Рациональная Фармакотерапия в Кардиологии. 2023;19(4):341-9. doi:10.20996/1819-6446-2023-2921.
7. Torres-Arrese M, Mata-Martínez A, Luordo-Tedesco D, et al. Usefulness of Systemic Venous Ultrasound Protocols in the Prognosis of Heart Failure Patients: Results from a Prospective Multicentric Study. J Clin Med. 2023;12(4):1281. doi:10.3390/jcm12041281.
8. Zhou B, Tian R. Mitochondrial dysfunction in pathophysiology of heart failure. J Clin Invest. 2018;128(9):3716-26. doi:10.1172/JCI120849.
9. Drapkina OM. The specific features of synthesis of heat shock proteins in patients with postinfarct cardiosclerosis. Klin Med (Mosk). 2004;82(9):25-8.
10. Ганковская Л. В., Понасенко О. А., Свитич О. А. Роль белка теплового шока 70 в патогенезе сердечно-сосудистой патологии. Медицинская иммунология. 2019;21(2):201-8. doi:10.15789/1563-0625-2019-2-201-208.
11. Shan Q, Ma F, Wei J, et al. Physiological Functions of Heat Shock Proteins. Curr Protein Pept Sci. 2020;21(8):751-60. doi:10.2174/1389203720666191111113726.
12. Dubrez L, Causse S, Borges Bonan N, et al. Heat-shock proteins: chaperoning DNA repair. Oncogene. 2020;39(3):516-29. doi:10.1038/s41388-019-1016-y.
13. Kovács D, Kovács M, Ahmed S, et al. Functional diversification of heat shock factors. Biol Futur. 2022;73(4):427-39. doi:10.1007/s42977-022-00138-z.
14. Kurop MK, Huyen CM, Kelly JH, et al. The heat shock response and small molecule regulators. Eur J Med Chem. 2021;226: 113846. doi:10.1016/j.ejmech.2021.113846.
15. Muranova LK, Shatov VM, Gusev NB. Role of Small Heat Shock Proteins in the Remodeling of Actin Microfilaments. Biochemistry (Mosc). 2022;87(8):800-11. doi:10.1134/S0006297922080119.
16. Wu T, Mu Y, Bogomolovas J, et al. HSPB7 is indispensable for heart development by modulating actin filament assembly. Proc Natl Acad Sci USA. 2017;114(45):11956-61. doi:10.1073/pnas.1713763114.
17. Traxler D, Lainscak M, Simader E, et al. Heat shock protein 27 acts as a predictor of prognosis in chronic heart failure patients. Clin Chim Acta. 2017;473:127-32. doi:10.1016/j.cca.2017.08.028.
18. Duan Y, Tang H, Mitchell-Silbaugh K, et al. Heat Shock Protein 60 in Cardiovascular Physiology and Diseases. Front Mol Biosci. 2020;7:73. doi:10.3389/fmolb.2020.00073.
19. Котова Ю. А., Зуйкова А. А. Изучение маркеров повреждения эндотелия, окислительного и клеточного стресса у больных ИБС и сопутствующим ожирением. Вестник новых медицинских технологий. 2021;28(2):25-8. doi:10.24412/1609-2163-2021-2-25-28.
20. McDonagh T, Metra M. 2021 Рекомендации ESC по диагностике и лечению острой и хронической сердечной недостаточности. Российский кардиологический журнал. 2023;28(1):5168. doi:10.10.15829/1560-4071-2023-5168.
21. Jaroszyński A, Jaroszyńska A, Zaborowski T, et al. Serum heat shock protein 27 levels predict cardiac mortality in hemodialysis patients. BMC Nephrol. 2018;19(1):359. doi:10.1186/s12882-018-1157-1.
22. Liu S, Iskandar R, Chen W, et al. Soluble Glycoprotein 130 and Heat Shock Protein 27 as Novel Candidate Biomarkers of Chronic Heart Failure with Preserved Ejection Fraction. Heart Lung Circ. 2016;25(10):1000-6. doi:10.1016/j.hlc.2016.02.011.
23. Li Z, Song Y, Xing R, at al. Heat shock protein 70 acts as a potential biomarker for early diagnosis of heart failure. PLoS One. 2013;8(7):e67964. doi:10.1371/journal.pone.0067964.
24. Gombos T, Förhécz Z, Pozsonyi Z, et al. Interaction of serum 70-kDa heat shock protein levels and HspA1B (+1267) gene polymorphism with disease severity in patients with chronic heart failure. Cell Stress Chaperones. 2008;13(2):199-206. doi:10.1007/s12192-007-0001-5.
25. Rüdebusch J, Benkner A, Poesch A, at al. Dynamic adaptation of myocardial proteome during heart failure development. PLoS One. 2017;12(10):e0185915. doi:10.1371/journal.pone.0185915.
Об авторах
Ю. С. ТимофеевРоссия
Тимофеев Юрий Сергеевич — к.м.н., с.н.с. отдела фундаментальных и прикладных аспектов ожирения, руководитель лаборатории изучения биохимических маркеров риска хронических неинфекционных заболеваний им. Н.В. Перовой.
Москва
А. Р. Афаунова
Россия
Афаунова Алина Руслановна — врач-терапевт, аспирант.
Москва
А. А. Иванова
Россия
Иванова Анна Александровна — м.н.с. отдела фундаментальных и прикладных аспектов ожирения.
Москва
Т. Ю. Веденикин
Россия
Веденикин Тимофей Юрьевич - зав. отделением анестезиологии-реанимации для больных кардиологического профиля.
Москва
О. Н. Джиоева
Россия
Джиоева Ольга Николаевна — д.м.н., в.н.с. отдела фундаментальных и прикладных аспектов ожирения, директор Института профессионального образования, руководитель лаборатории кардиовизуализации, вегетативной регуляции и сомнологии.
Москва
В. А. Метельская
Россия
Метельская Виктория Алексеевна — д.б.н., профессор, г.н.с. лаборатории изучения биохимических маркеров риска хронических неинфекционных заболеваний им. Н.В. Перовой.
Москва
М. С. Покровская
Россия
Покровская Мария Сергеевна — к.б.н., в.н.с., руководитель лаборатории "Банк биологического материала".
Москва
О. М. Драпкина
Россия
Драпкина Оксана Михайловна — д.м.н., профессор, академик РАН, директор.
Москва
Дополнительные файлы
Что известно о предмете исследования?
- Белки теплового шока (БТШ) — биохимические маркеры клеточного стресса, гиперэкспрессия которых происходит в ответ на воспалительные, метаболические, окислительные и прочие стрессогенные факторы при хронических неинфекционных заболеваниях.
- БТШ рассматриваются как потенциальные биохимические маркеры для диагностики и прогнозирования сердечной недостаточности (СН), однако при СН с сохраненной фракцией выброса (СНсФВ) диагностическое значение этих биомаркеров практически не изучено.
Что добавляют результаты исследования?
- Впервые иммуноферментными методами исследован комплекс БТШ: БТШ27, БТШ70 и кардиоваскулярный БТШ (квБТШ) в сыворотке крови больных с декомпенсированной и компенсированной СНсФВ, при этом квБТШ исследуется в человеческой сыворотке при СН впервые.
- Концентрации БТШ27, БТШ70 и квБТШ при декомпенсированной СНсФВ статистически значимо выше, чем при компенсированной; показана прямая взаимосвязь выраженности венозного застоя с уровнями БТШ27 и квБТШ, которые могут рассматриваться как достаточно чувствительные биохимические маркеры данного состояния.
Рецензия
Для цитирования:
Тимофеев Ю.С., Афаунова А.Р., Иванова А.А., Веденикин Т.Ю., Джиоева О.Н., Метельская В.А., Покровская М.С., Драпкина О.М. Связь сывороточных уровней белков теплового шока с выраженностью венозного застоя у пациентов с острой декомпенсацией сердечной недостаточности с сохраненной фракцией выброса. Кардиоваскулярная терапия и профилактика. 2024;23(6):4037. https://doi.org/10.15829/1728-8800-2024-4037. EDN: HXKJTD
For citation:
Timofeev Yu.S., Afaunova A.R., Ivanova A.A., Vedenikin T.Yu., Dzhioeva O.N., Metelskaya V.A., Pokrovskaya M.S., Drapkina O.M. Interaction of serum heat shock proteins’ levels with the severity of venous congestion in patients with acute decompensated heart failure with preserved ejection fraction. Cardiovascular Therapy and Prevention. 2024;23(6):4037. (In Russ.) https://doi.org/10.15829/1728-8800-2024-4037. EDN: HXKJTD
JATS XML

























































