Перейти к:
Возможности внутрисосудистого ультразвукового исследования коронарных артерий при выборе тактики и оценке результатов эндоваскулярного лечения у пациентов пожилого и старческого возраста
https://doi.org/10.15829/1728-8800-2025-4125
EDN: FWRIEK
Аннотация
Цель. Оценка результатов применения внутрисосудистого ультразвукового исследования (ВСУЗИ) коронарных артерий у пациентов пожилого и старческого возраста в различных клинических ситуациях.
Материал и методы. Исследование проведено на 155 пациентах >60 лет, 118 из которых были выполнены чрескожные коронарные вмешательства (ЧКВ) в плановом порядке, а 37 пациентов были госпитализированы в экстренном порядке по поводу инфаркта миокарда без подъема сегмента ST (ИМбпST). Группа плановых пациентов была разделена на 2 подгруппы: исследуемая — 58 больных, которым выполнено коронарное стентирование под контролем ВСУЗИ, и контрольная — 60 пациентов, подвергшихся ЧКВ под ангиографическим контролем. Стентирование проводили по результатам ранее выполненной диагностической коронароангиографии (КАГ). Оценивались отдаленные результаты лечения в течение 5 лет. В группе пациентов с ИМбпST после диагностической КАГ всем выполнено предоперационное ВСУЗИ: оценивались причины принятия решения о необходимости ВСУЗИ, частота изменения тактики лечения по данным ВСУЗИ, а также непосредственные результаты после эндоваскулярного лечения.
Результаты. Наиболее частым нежелательным событием после плановых ЧКВ у пациентов старших возрастных групп была повторная реваскуляризация в бассейне целевого сосуда, риск которой был максимальным к 3-м годам наблюдения и снижался к 5-ти годам (OR (odds ratio, отношение шансов) 5,09 через 1 год, OR 9,32 через 3 года и OR 5,62 через 5 лет). Аналогичная динамика выявлена для общего количества сердечно-сосудистых событий (OR 1,9 через 1 год, OR 3,1 через 3 года и OR 2,4 через 5 лет), рисков развития острого инфаркта миокарда (OR 2,0 через 1 год, OR 4,07 через 3 года и OR 2,1 через 5 лет) и рестеноза стентов (OR 3,0 через 1 год, OR 7,12 через 3 года и OR 5,62 через 5 лет). Различий по общей летальности в исследуемой и контрольной подгруппах плановых вмешательств не выявлено (OR 0,98 через 1 год, OR 1,47 через 3 года и OR 1,27 через 5 лет, р>0,05). У пациентов старших возрастных групп с ИМбпST выполнение ВСУЗИ повлияло на изменение тактики лечения в 81% случаев, при этом в 5,4% случаев следствием его использования стал отказ от ЧКВ, а в 70,3% по данным ВСУЗИ было подтверждено инфаркт-связанное поражение. Кроме того, использование ВСУЗИ при лечении пациентов с ИМбпST продемонстрировало существенные различия в ангиографических и ВСУЗИ-характеристиках диаметров сосудов (2,95±0,53 vs 3,6±0,56 мм, р=0,034) и в частоте неполного раскрытия стента (11,1 vs 88,9%, р=0,002).
Заключение. Использование ВСУЗИ при реваскуляризации миокарда у пациентов пожилого и старческого возраста в различных клинических ситуациях существенно снижает частоту отдаленных повторных сердечно-сосудистых событий, а также оказывает влияние на изменение тактики эндоваскулярного лечения и непосредственные результаты стентирования.
Ключевые слова
Для цитирования:
Воробьёвский Д.А., Козлов К.Л., Власенко С.В., Щербак С.Г., Вильданов Т.Р. Возможности внутрисосудистого ультразвукового исследования коронарных артерий при выборе тактики и оценке результатов эндоваскулярного лечения у пациентов пожилого и старческого возраста. Кардиоваскулярная терапия и профилактика. 2025;24(2):4125. https://doi.org/10.15829/1728-8800-2025-4125. EDN: FWRIEK
For citation:
Vorobevskii D.A., Kozlov K.L., Vlasenko S.V., Scherbak S.G., Vildanov T.R. The possibilities of intravascular ultrasound of coronary arteries in the choice of tactics and evaluation of the results of endovascular treatment in elderly and senile patients. Cardiovascular Therapy and Prevention. 2025;24(2):4125. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4125. EDN: FWRIEK
Введение
В настоящее время самым распространенным методом диагностики коронарного атеросклероза при ишемической болезни сердца по-прежнему остается инвазивная коронароангиография (КАГ). Однако данный метод имеет ряд недостатков, т.к. является по своей сути 2-мерным изображением 3-мерного сосуда и не позволяет оценить состояние сосудистой стенки. Нивелировать эти недостатки возможно, если дополнять КАГ результатами внутрисосудистого ультразвукового исследования (ВСУЗИ) коронарных артерий (КА). Становится доступным изучение не только просвета артерии, но и исследование структуры сосудистой стенки и состава атеросклеротической бляшки [1-5].
Потребность в определении причин повторных сердечно-сосудистых событий (ССС) после чрескожных коронарных вмешательств (ЧКВ) предопределила бурное развитие методов внутрисосудистой визуализации за последние 20 лет. Многочисленные клинические исследования в этой области выявили ряд неоспоримых преимуществ эндоваскулярных вмешательств, дополненных ВСУЗИ-ассистированием во время плановых ЧКВ, в сравнении со стентированием под ангиографическим контролем. Так, в крупном многоцентровом исследовании STLLR (Impact of Stent Deployment Procedural Factors on Long-Term Effectiveness and Safety of Sirolimus-Eluting Stents) (n=1557) было показано, что >66% стентов было имплантировано неправильно [6][7]. В дальнейших исследованиях дискутабельным оставалось влияние использования ВСУЗИ на уменьшение летальности, однако факт снижения частоты повторных ССС был неоспорим [8-10]. Большинство авторов утверждают, что ВСУЗИ-ассистирование при ЧКВ существенно снижает летальность, что подтверждается данными метаанализов [11]. Кроме того, в исследовании ADAPT-DES (Assessment of dual antiplatelet therapy with drug-eluting stents) показаны существенные преимущества использования ВСУЗИ у пациентов с острым коронарным синдромом (ОКС), а также частая смена стратегии реваскуляризации под влиянием ВСУЗИ [7][12]. Это обусловило значительный рост числа ВСУЗИ-ассистирований при ОКС. Так, Park DY, et al. в своем исследовании показали, что в период 2008-2019гг использование ВСУЗИ у пациентов с острым инфарктом миокарда (ОИМ) увеличилось с 6180 до 25330 случаев, т.е. на 309,9% [13]. Однако четкие критерии, обосновывающие необходимость прибегнуть к помощи внутрисосудистой визуализации при ОКС, до сих пор в полной мере не выработаны.
Пациенты пожилого и старческого возраста являются наиболее частой и наиболее сложной группой больных, подвергающихся эндоваскулярным вмешательствам. Преклонный возраст и наличие множества тяжелых сопутствующих заболеваний зачастую не позволяют выполнять кардиохирургические вмешательства таким пациентам. Во многих случаях безальтернативным вариантом лечения коронарного атеросклероза у таких пациентов остается ЧКВ, а наличие выраженного кальциноза, извитости, многососудистого поражения коронарного русла существенно ухудшают прогноз [14-16].
В современной литературе имеются единичные публикации, посвященные исследованиям внутрисосудистой визуализации и физиологии КА у пациентов пожилого и старческого возраста [14][16-22]. Так, в исследовании FAME (Fractional Flow Reserve versus Angiography for Multivessel Evaluation) продемонстрировано, что наличие фракционного резерва кровотока ≤0,80 (что свидетельствует о гемодинамической значимости) при выявлении стенозов от 71 до 90% было существенно ниже у пожилых пациентов, чем у более молодых (75,3 vs 84,1%, р=0,013) [19]. Многофакторный анализ показал, что возраст и наличие кальцификатов остались независимыми предикторами позитивного ремоделирования КА по данным ВСУЗИ [20]. Пациенты более старшего возраста имеют более обширный и тяжелый атеросклероз, демонстрируя наиболее выраженные некротические ядра и меньшую выраженность фиброзной ткани [21]. Однако публикаций, посвященных влиянию ВСУЗИ на результаты реваскуляризации миокарда у гериатрических больных, не выявлено ни в отечественной, ни в зарубежной литературе.
Цель настоящего исследования — оценка результатов применения ВСУЗИ КА у пациентов пожилого и старческого возраста в различных клинических ситуациях. В дополнение к уже проведенному анализу годичных и 3-летних результатов плановой реваскуляризации миокарда [17], была проведена оценка отдаленных результатов плановых ЧКВ через 5 лет, а также непосредственных результатов стентирования у пациентов с инфарктом миокарда без подъема сегмента ST (ИМбпST).
Материал и методы
В основу настоящего проспективного исследования положен анализ результатов эндоваскулярного лечения 155 пациентов >60 лет, подвергшихся ЧКВ в период с 2015 по 2019гг. Пациенты получали лечение в Санкт-Петербургском городском бюджетном учреждении здравоохранения "Городская больница № 40 Курортного района". 118 пациентам вмешательства были выполнены в плановом порядке по поводу стабильной стенокардии напряжения, 37 пациентам была проведена КАГ в экстренном порядке по поводу ИМбпST с дальнейшим принятием решения о тактике лечения. Группа пациентов со стабильной стенокардией напряжения была разделена на 2 подгруппы: 1-я (исследуемая) — 58 больных, которым выполнено коронарное стентирование под контролем ВСУЗИ, и 2-я (контрольная) — 60 пациентов, подвергшихся ЧКВ под ангиографическим контролем. Оценивались непосредственные и отдаленные результаты лечения в течение 5 лет. В группе пациентов с ИМбпST все стентирования выполнены под контролем ВСУЗИ; оценивались причины принятия решения о необходимости ВСУЗИ, частота изменения стратегии и тактики лечения по данным ВСУЗИ, а также непосредственные результаты эндоваскулярного лечения. Плановым пациентам стентирование выполнялось по результатам ранее выполненной КАГ, пациентам с ИМбпST КАГ выполнялась в экстренном порядке сразу после установления диагноза. Диагноз ИМбпST выставлялся согласно критериям Четвертого универсального определения инфаркта миокарда [23].
КАГ и стентирование выполнялись по стандартной методике при помощи лучевого либо бедренного доступа и с использованием общепринятого инструментария для ЧКВ. Оценка коронарного русла у всех пациентов осуществлялась при помощи количественного ангиографического обсчета диаметра сосуда, степени и протяженности поражения (рисунок 1).
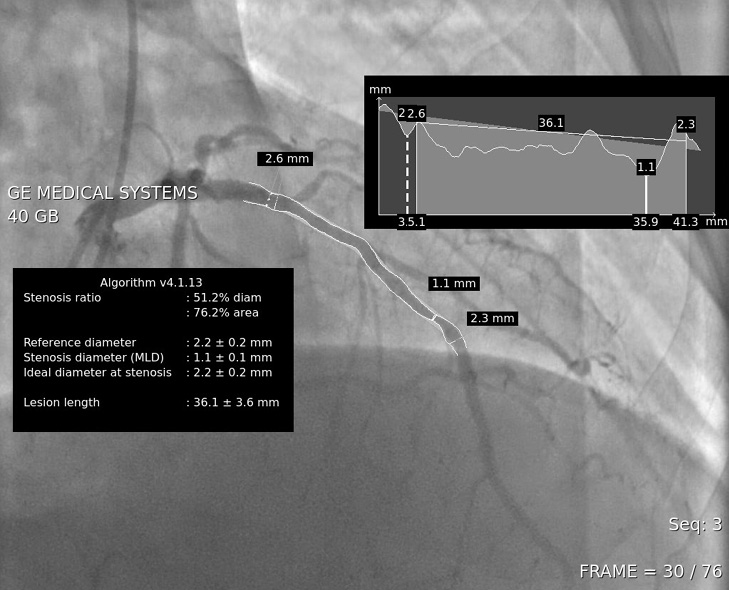
Рис. 1 КАГ с количественной оценкой калибра и степени поражения ПМЖА.
Примечание: КАГ — коронароангиография, ПМЖА — передняя межжелудочковая артерия.
В исследуемой подгруппе плановых стентирований и в группе пациентов с ИМбпST дополнительно проводилось предоперационное ВСУЗИ. В исследуемой подгруппе оценивались диаметр сосуда и остаточного просвета, степень и протяженность стеноза, а также качественный состав бляшки при помощи виртуальной гистологии и наличие дефектов просвета при помощи режима ChromaFlo (рисунки 2, 3). Уделялось особое внимание степени кальциноза и наличию т.н. морфологических бляшек высокого риска. В группе экстренных вмешательств первоначально оценивалось, может ли исследуемый сегмент являться симптом-связанным поражением, после чего выполнялся ВСУЗИ-обсчет вышеописанных показателей. Решение о стратегии и тактике лечения в контрольной подгруппе плановых вмешательств принималось на основании ангиографической картины, а у остальных пациентов — по результатам ВСУЗИ.
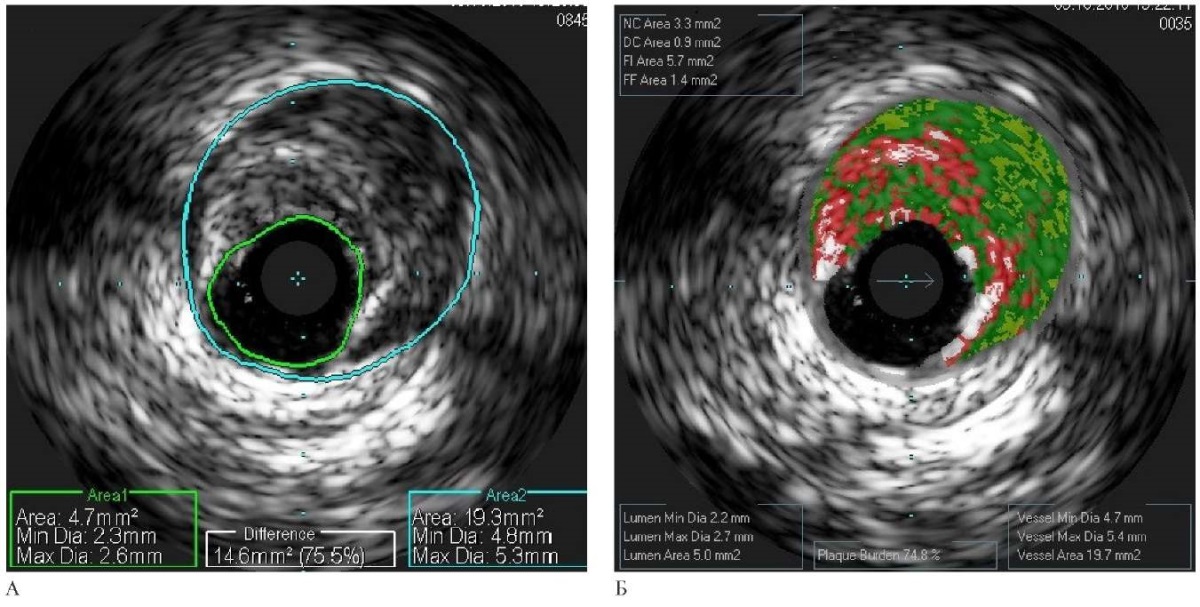
Рис. 2 Результаты ВСУЗИ (А) и данные ВГ (Б) пациента со стенозирующим поражением проксимального сегмента ПМЖА.
Примечание: ВГ — виртуальная гистология, ВСУЗИ — внутрисосудистое ультразвуковое исследование, ПМЖА — передняя межжелудочковая артерия. Цветное изображение доступно в электронной версии журнала.
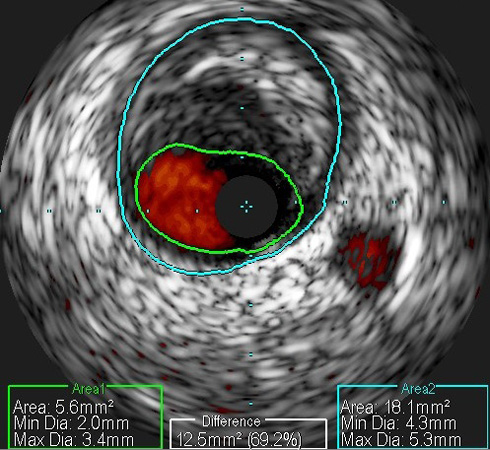
Рис. 3 Исследование просвета сосуда при помощи ВСУЗИ в режиме ChromaFlo у пациента со стенозирующим поражением среднего сегмента ПКА.
Примечание: ВСУЗИ — внутрисосудистое ультразвуковое исследование, ПКА — правая коронарная артерия. Цветное изображение доступно в электронной версии журнала.
После принятия решения о необходимости ЧКВ в группах со ВСУЗИ-контролем размер стента определялся по минимальному диаметру референсного сегмента, который считался приемлемым в случае наличия стеноза <40%. В контрольной подгруппе размер стента определялся по данным количественной ангиографии. Всем пациентам были имплантированы сиролимус- либо зотаролимус-покрытые стенты.
Пациентам, которым вмешательство проводилось со ВСУЗИ-ассистированием, после стентирования ультразвуковой датчик повторно вводился в просвет сосуда и выполнялось контрольное исследование. Обращалось внимание на полноту прилежания и раскрытия стента, наличие краевых диссекций и внутрипросветных образований (тромботические массы, протрузия компонентов атеросклеротической бляшки). Результат ЧКВ признавался удовлетворительным при наличии ряда изначально принятых нами критериев: полное раскрытие стента, степень остаточного стеноза по диаметру <50%, отсутствие краевых диссекций и внутристентовой протрузии бляшки, минимальная площадь просвета >7 мм² для проксимального сегмента передней межжелудочковой артерией (ПМЖА) и >9 мм² для ствола левой коронарной артерии. Описанные критерии были приняты на основании опыта нашей работы и анализа данных современной литературы, касающихся косвенной связи показателей ВСУЗИ и гемодинамической значимости стеноза. В случае неудовлетворительного результата решение о калибре необходимого баллона для постдилатации принималось также на основе ВСУЗИ. В контрольной подгруппе вмешательство заканчивалось после получения удовлетворительного ангиографического результата (оптимальный кровоток, полное раскрытие стента, отсутствие значимых диссекций и внутрипросветных образований).
Клиническое наблюдение за плановыми пациентами осуществлялось в течение 5 лет с контрольными точками в 12, 36 и 60 мес. с использованием телефонного опроса и, в случае необходимости, дополнительных методов обследования (стресс-эхокардиография, КАГ). Повторная КАГ выполнялась только в случае возврата симптомов стенокардии или её эквивалентов. У пациентов группы ИМбпST оценивались только непосредственные результаты ЧКВ и проводилось наблюдение в течение текущей госпитализации.
Полученные в процессе выполнения работы клинические результаты обрабатывались c использованием программной системы Statistica 10. Для наглядного представления исходных данных и полученных статистических результатов были использованы графические возможности программ Statistica 10 и Microsoft Excel 2010.
Для распределения пациентов по величинам показателей использовался критерий Шапиро-Уилка: при p<0,05 нулевая гипотеза о нормальности распределения отклонялась. Количественные показатели рассчитывались при помощи традиционного спектра характеристик описательной статистики: среднее значение, разброс данных, минимум, максимум, медиана и интерквартильный размах. Качественные параметры характеризовались абсолютными значениями и процентными долями в группах и подгруппах. Для сравнения частотных характеристик качественных показателей использовались непараметрические методы χ², χ² с поправкой Йетса (для малых групп), критерий Фишера.
Сопоставление количественных параметров в исследуемых группах выполнялось с помощью критериев Манна-Уитни, медианного χ² и модуля ANOVA. Доверительные интервалы принципиально важных показателей рассчитывались с помощью углового преобразования Фишера. Для количественного описания тесноты связи использования ВСУЗИ с развитием отдаленных сердечно-сосудистых событий рассчитывали отношения шансов (OR — odds ratio).
В качестве критерия статистической достоверности различий принимали величину p<0,05, которая используется повсеместно и является общепринятой в медицине. Когда имели место одинаковые результаты по всем применявшимся критериям, формулировали заключение о наличии или отсутствии достоверных различий.
Результаты
Группа пациентов со стабильной стенокардией напряжения
Исследуемая и контрольная подгруппы были статистически гомогенны и сопоставимы по полу, возрасту, сопутствующей соматической патологии, операционному доступу, локализации поражения, количеству и типу имплантированных стентов (таблицы 1, 2). Лучевым доступом выполнено вмешательство 104 (88,1%) больным, бедренным — 14 (11,9%) пациентам. Имплантировано 66 стентов пациентам исследуемой подгруппы и 69 — контрольной подгруппы. Целевой стентированный сосуд отличался преобладанием ПМЖА в исследуемой подгруппе (37 (56,1%) vs 27 (39,1%), р=0,09). В контрольной подгруппе преобладало поражение правой КА (ПКА) — 7 (10,6%) vs 17 (24,6%), р=007. Ангиографическая характеристика поражений КА в обеих подгруппах представлена в таблице 3. Во всех случаях бифуркационных поражений использовалась одностентовая методика лечения основного сосуда с баллонной ангиопластикой устья боковой ветви через ячейки стента. Удовлетворительный результат в подгруппе ЧКВ со ВСУЗИ был достигнут в 64 (97%) случаях имплантации стента из 66.
Таблица 1
Характеристики подгрупп по возрасту, полу и сопутствующей патологии
|
Показатель |
Все пациенты (n=118) |
1 подгруппа (n=58) |
2 подгруппа (n=60) |
р |
|
Возраст, лет, Ме [Q25; Q75] |
70 [ 66; 78] |
69 [ 65; 78] |
74 [ 68; 78] |
– |
|
Мужчины, n (%) |
61 (51,7) |
31 (53,4) |
30 (50,0) |
0,831 |
|
Женщины, n (%) |
57 (48,3) |
27 (46,6) |
30 (50,0) |
0,825 |
|
СД 2 типа, n (%) |
34 (28,8) |
19 (32,8) |
15 (25,0) |
0,356 |
|
ПИКС, n (%) |
27 (22,9) |
12 (20,7) |
15 (25,0) |
0,582 |
|
ЧКВ в анамнезе, n (%) |
24 (20,3) |
13 (22,4) |
11 (18,3) |
0,586 |
|
АКШ в анамнезе, n (%) |
9 (7,6) |
5 (8,6) |
4 (6,7) |
0,695 |
|
ФВ <30%, n (%) |
7 (5,9) |
3 (5,2) |
4 (6,7) |
0,737 |
|
Курение, n (%) |
29 (24,6) |
16 (27,8) |
13 (21,7) |
0,459 |
|
ИМТ >40 кг/м², n (%) |
14 (11,9) |
6 (10,3) |
8 (13,3) |
0,620 |
|
СКФ <40 мл/мин/1,73 м², n (%) |
8 (6,8) |
3 (5,2) |
5 (8,3) |
0,500 |
Примечание: АКШ — аортокоронарное шунтирование, ИМТ — индекс массы тела, Ме — медиана, ПИКС — постинфарктный кардиосклероз, СД — сахарный диабет, СКФ — скорость клубочковой фильтрации, ФВ — фракция выброса, ЧКВ — чрескожное коронарное вмешательство.
Таблица 2
Имплантированные стенты в исследуемой и контрольной подгруппах
|
Стент |
Все стенты (n=135) |
1 подгруппа (n=66) |
2 подгруппа (n=69) |
р |
|
Сиролимус-покрытый стент, n (%) |
82 (60,7) |
42 (63,6) |
40 (58,0) |
0,5 |
|
Зотаролимус-покрытый стент, n (%) |
53 (39,3) |
24 (36,4) |
29 (42,0) |
Таблица 3
Характеристика поражения КА в исследуемой и контрольной подгруппах
|
Локализация, n (%) |
Всего (n=135) |
1 подгруппа (n=66) |
2 подгруппа (n=69) |
р |
|
СЛКА |
22 (16,3) |
11 (16,7) |
11 (15,9) |
0,94 |
|
ПМЖА |
64 (47,4) |
37 (56,1) |
27 (39,1) |
0,09 |
|
ОА |
25 (18,5) |
11 (16,7) |
14 (20,3) |
0,56 |
|
ПКА |
24 (17,8) |
7 (10,6) |
17 (24,6) |
0,07 |
|
Бифуркационные поражения |
13 (9,6) |
7 (10,6) |
6 (8,7) |
0,91 |
Примечание: ВСУЗИ — внутрисосудистое ультразвуковое исследование, ОА — огибающая артерия, ПКА — правая коронарная артерия, ПМЖА — передняя межжелудочковая артерия, СЛКА — ствол левой коронарной артерии.
Отдаленные результаты ЧКВ в обеих подгруппах оценивались через 12, 36 и 60 мес. Показателем проявления неблагоприятных исходов было принято повторное ССС, которое включало в себя: смерть, ОИМ, инсульт, повторную реваскуляризацию в бассейне целевого сосуда (РЦС), нестабильную стенокардию, реваскуляризацию в бассейне нецелевого сосуда, аортокоронарное шунтирование и рестеноз стента. За весь период наблюдения повторная КАГ выполнена 12 (20,7%) пациентам исследуемой подгруппы и 27 (45,0%) пациентам контрольной подгруппы. Полученные данные были интерпретированы при помощи показателя OR. Итоги 5-летнего наблюдения отдаленных результатов представлены в таблице 4.
Таблица 4
Результаты ЧКВ через 12, 36 и 60 мес.
|
Показатель |
OR (ДИ 95%), p |
||
|
0-12 мес. |
12-36 мес. |
36-60 мес. |
|
|
Сердечно-сосудистое событие |
1,90 (0,587-5,960), р=0,134 |
3,11 (1,601-16,093), р=0,035 |
2,4 (1,129-5,151), р=0,041 |
|
Смерть |
0,98 (0,187-4,988), р=0,451 |
1,47 (0,237-9,158), р=0,374 |
1,27 (0,539-3,029), р=0,402 |
|
Нестабильная стенокардия |
4,14 (1,441-37,568) р=0,031 |
2,95 (1,164-20,234), р=0,044 |
3,67 (1,954-14,086), р=0,039 |
|
Инфаркт миокарда |
2,0 (0,398-23,175), р=0,191 |
4,07 (1,441-37,568), р=0,036 |
2,1 (1,090-7,316), р=0,05 |
|
Инсульт |
2,0 (0,173-22,285), р=0,413 |
0 |
2,56 (0,474-13,679), р=0,288 |
|
Повторная реваскуляризация в бассейне целевого сосуда |
5,09 (1,103-29,708), р=0,041 |
9,32 (1,896-63,251), р=0,032 |
5,62 (1,270-26,793), р=0,037 |
|
Реваскуляризация в бассейне нецелевого сосуда |
0,98 (0,187-4,988), р=0,551 |
0 |
1,78 (0,493-6,449), р=0,437 |
|
АКШ |
2,0 (0,398-23,175), р=0,156 |
1,95 (0,173-22,285), р=0,122 |
0 |
|
Рестеноз стента |
3,0 (1,173-22,285), р=0,039 |
7,12 (1,441-37,567), р=0,035 |
5,62 (1,270-26,793), р=0,037 |
Примечание: АКШ — аортокоронарное шунтирование.
Пятилетние результаты наблюдения оказались в целом сопоставимыми с годичными и трехлетними, опубликованными ранее [17], однако некоторые изменения имели место. Риски повторных ССС в контрольной подгруппе были максимальны в период от года до 3 лет и постепенно снижались к 5-му году наблюдения (превышение в 2,4 раза через 60 мес. по сравнению с 3,11 раз через 36 мес.). Несмотря на это, риск смерти от всех причин оставался одинаковым в обеих подгруппах на протяжении всего периода наблюдения. В контрольной подгруппе увеличение рисков ССС через 5 лет отмечено в основном за счет РЦС вследствие рестеноза стента (превышение в 5,62 раза) и нестабильной стенокардии (в 3,7 раз), в то время как через 3 года — за счет повторной РЦС (превышение в 9,32 раза) и ОИМ (в 4,07 раза). Через 5 лет наблюдения вновь отмечалась тенденция к нарастанию риска развития нестабильной стенокардии, чего не было в первые 36 мес. Стабильно высоким оставался риск развития рестеноза стента в группе ЧКВ без ВСУЗИ (в 3 раза в течение 12 мес., в 7,12 раз в течение 36 мес. и в 5,62 раза в течение 60 мес.).
На рисунке 4 представлен анализ 5-летней летальности в обеих подгруппах. Из представленной гистограммы следует, что около половины всех причин летальных исходов обусловлено новой коронавирусной инфекцией (НКИ), вызванной вирусом SARS-CoV-2 (Severe Acute Respiratory Syndrome CoronaVirus 2), либо изолированно, либо в сочетании с ССС. В связи с этим в настоящем исследовании мы приняли решение не рассматривать отдельно риски летальных исходов от ССС, оценивались только риски смерти от всех причин.
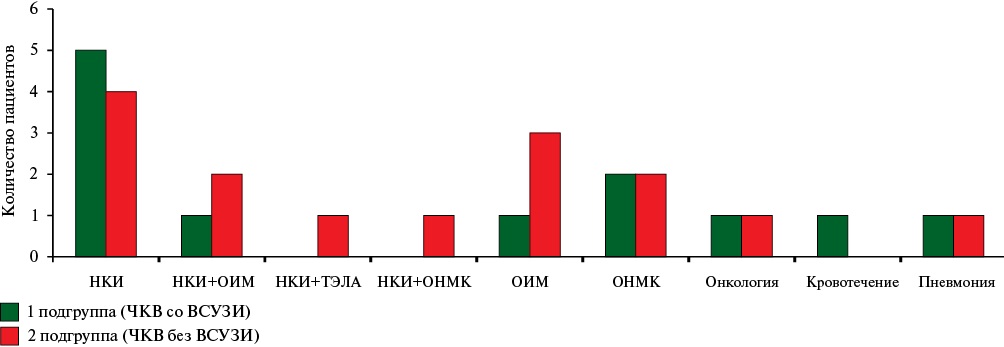
Рис. 4 Анализ 5-летней летальности в обеих подгруппах.
Примечание: ВСУЗИ — внутрисосудистое ультразвуковое исследование, НКИ — новая коронавирусная инфекция, ОИМ — острый инфаркт миокарда, ОНМК — острое нарушение мозгового кровообращения, ТЭЛА — тромбоэмболия легочной артерии, ЧКВ — чрескожное коронарное вмешательство.
Помимо увеличения рисков ССС, были выявлены взаимосвязи возникновения через 36 мес. ССС с реваскуляризацией в бассейне ПКА (28,6% (95% доверительный интервал (ДИ): 20,84-37,06) от всех стентирований ПКА имели свершившееся ССС, р=0,05) и с наличием ангиографически неполного раскрытия стента после имплантации (5,56% (95% ДИ: 1,49-11,99) vs 0% (95% ДИ; 0-2,15), р=0,05). Однако через 60 мес. подобных корреляций отмечено не было. Также не было выявлено взаимосвязи летальных исходов со степенью кальциноза атеросклеротической бляшки по данным виртуальной гистологии, наблюдавшейся в первые 12 мес. (19,2 [ 18,1; 21,3]% (от 17,2 до 22,1) у умерших vs 9,1 [ 2,6; 14,0]% (от 0 до 33,6) у выживших, р=0,039) [17].
Последним этапом была проведена комплексная суммарная оценка всех ССС в обеих подгруппах и их взаимосвязь с основными ангиографическими и ВСУЗИ-показателями. Так, основным предиктором развития ССС через 5 лет, по нашим данным, является степень ангиографического стеноза (82,9±6,23% в группе со свершившимся ССС vs 76,1±6,3% у пациентов без ССС, р<0,05). ОИМ также выявлялся существенно чаще в группе больных с исходным ангиографическим стенозом >80% (13,1%, р<0,05). Взаимосвязи внутрисосудистых показателей калибра, степени поражения и структуры бляшек с развитием ССС через 5 лет выявлено не было. Кроме того, в течение всего периода наблюдения не было выявлено взаимосвязи между развитием ССС и типом имплантированных стентов.
Группа пациентов с ИМбпST
Средний возраст пациентов составил 73 года, мужчин — 21 (56,8%), женщин — 16 (43,2%). Основным доступом для проведения ЧКВ была лучевая артерия — 34 (91,9%) пациента, из которых у 1 пациента была смена доступа на бедренный, у 3 (8,1%) пациентов был использован исходно бедренный доступ. Всего имплантировано 45 стентов у 35 пациентов, наиболее частой инфаркт-связанной артерией была ПМЖА — 17 (45,9%).
В 23 (62,2%) случаях причинами, потребовавшими прибегнуть к ВСУЗИ-ассистированию, были подтверждение, либо исключение инфаркт-связанного поражения, у 6 (16,2%) пациентов поводом для исследования стали поражения ствола левой КА. Далее следовали: длинные (>20 мм) поражения — 1 (2,7%), устьевые поражения — 3 (8,1%), бифуркационные поражения — 2 (5,4%), рестеноз в стенте — 2 (5,4%). Данные предварительной ангиографической оценки диаметра сосуда, степени стеноза и длины поражения инфаркт-связанной артерии достоверно отличались от полученных данных по результату ВСУЗИ (таблица 5).
Таблица 5
Сравнение предоперационных ангиографических и ВСУЗИ данных в группе пациентов с ИМбпST
|
Показатель |
Ангиографически (n=37) |
ВСУЗИ контроль (n=37) |
p |
|
|
Диаметр сосуда, мм |
M±SD |
2,95±0,53 |
3,6±0,56 |
0,034 |
|
min-max |
2,2-4,1 |
2,9-5,2 |
||
|
Ме [Q25; Q75] |
2,8 [ 2,6; 3,5] |
3,7 [ 3,2; 4,5] |
||
|
Процент стеноза, % |
M±SD |
56,5±6,1 |
78,6±7,2 |
0,029 |
|
min-max |
45-70 |
65,6-85,9 |
||
|
Ме [Q25; Q75] |
56 [ 50; 65] |
78,1 [ 68,2; 80,6] |
||
|
Длина поражения >20 мм |
n (%) |
24 (64,9%) |
33 (89,2%) |
0,015 |
Примечание: ВСУЗИ — внутрисосудистое ультразвуковое исследование, Ме — медиана, ПКА — правая коронарная артерия, ИМбпST — инфаркт миокарда без подъема сегмента ST.
После принятия решения о необходимости стентирования сначала проводилась ангиографическая оценка калибра необходимого стента, а затем выполнялось сравнение с данными ВСУЗИ. Решение принималось на основании показателей ВСУЗИ. Аналогичным образом после проведенного стентирования сравнивались ангиографические и ВСУЗИ-результаты (таблица 6). Для достижения достаточного раскрытия стента выполнялась дополнительная постдилятация соответствующим баллоном высокого давления. В 5,7% (n=2) случаях постдилятация приводила к развитию синдромов "no-reflow" либо "slow-reflow", успешно купированных применением блокаторов гликопротеиновых IIb/IIIa рецепторов тромбоцитов.
Таблица 6
Сравнение послеоперационных предполагаемых ангиографических и ВСУЗИ данных в группе пациентов с ИМбпST
|
Показатель |
Ангиографически (n=45) |
ВСУЗИ (n=45) |
р |
|
|
Диаметр стента, мм |
M±SD |
2,75±0,47 |
3,1±0,54 |
0,037 |
|
min-max |
2,25-3,5 |
2,5-4,0 |
||
|
Ме [Q25; Q75] |
2,6 [ 2,5; 3,0] |
3,0 [ 2,9; 3,8] |
||
|
Длина стента, мм |
M±SD |
24,3±6,3 |
31,1±8,52 |
0,039 |
|
min-max |
18-33 |
26-38 |
||
|
Ме [Q25; Q75] |
20 [ 19; 28] |
28 [ 26; 36] |
||
|
Неполное раскрытие стента |
n (%) |
5 (11,1%) |
40 (88,9%) |
0,002 |
|
Потребность в постдилятации |
n (%) |
5 (11,1%) |
40 (88,9%) |
0,002 |
|
Диаметр баллона для постдилятации, мм |
M±SD |
3,0±0,3 |
3,5±0,54 |
0,035 |
|
min-max |
2,5-4,0 |
3,0-5,0 |
||
|
Ме [Q25; Q75] |
2,8 [ 2,5; 3,5] |
3,5 [ 2,9; 4,5] |
||
Примечание: ВСУЗИ — внутрисосудистое ультразвуковое исследование, ИМбпST — инфаркт миокарда без подъема сегмента ST, Ме — медиана.
В 81% случаев применение методов внутрисосудистой визуализации повлияло на тактику и/или стратегию лечения. У 2 (5,4%) пациентов — следствием их использования был отказ от операции, причинами развития ИМбпST у этих пациентов были признаны экстракардиальные причины (инфаркт миокарда 2 типа) (рисунок 5). У 26 (70,3%) пациентов, наоборот, их результат стал основанием для выполнения стентирования, тогда как при стандартной ангиографической оценке эти пациенты могли бы быть не прооперированы (рисунок 6) [24]. У 12 (34,3%) стентированных пациентов использование ВСУЗИ повлияло на исходно иной выбор инструмента, среди которых у 9 (75%) пациентов был выбран более длинный стент для покрытия всего измененного сегмента, у 5 (41,7%) пациентов был выбран коронарный стент с бо́льшим диаметром, у 6 (50%) пациентов был выбран баллонный катетер высокого давления для модификации атеросклеротической бляшки с кальцинированным компонентом. У 25 (71,4%) пациентов после выполнения стентирования потребовалось дополнительное воздействие в связи с неудовлетворительным результатом (рисунок 7).
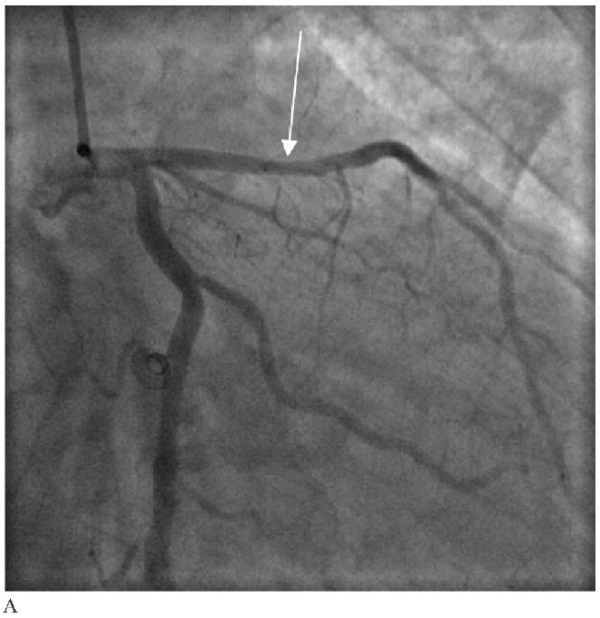
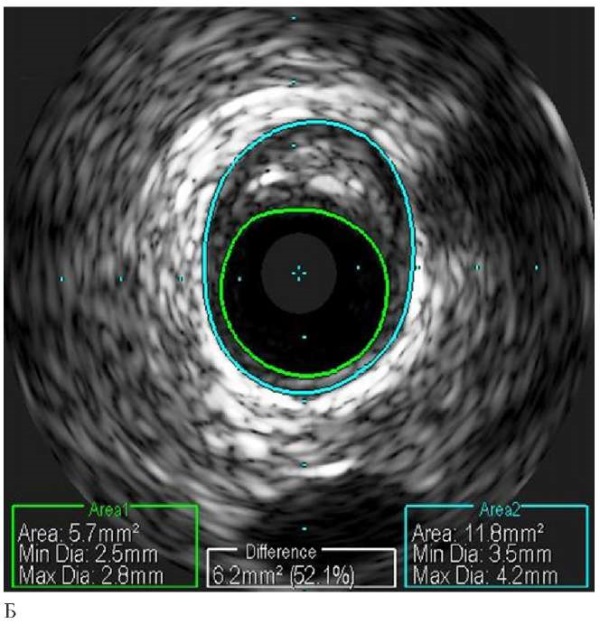
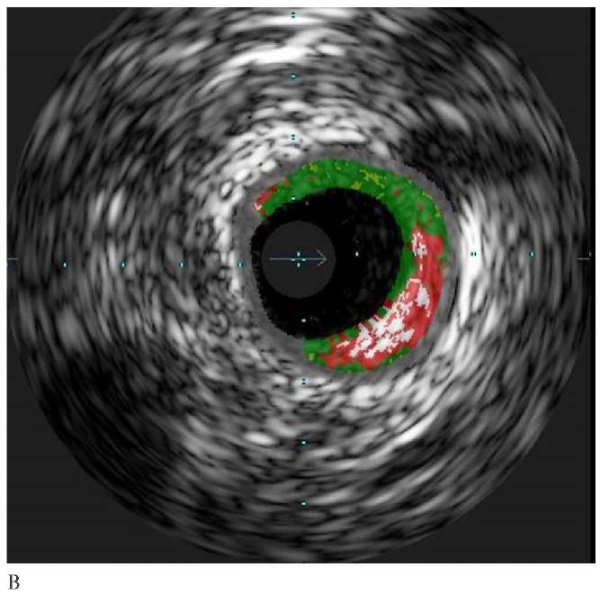
Рис. 5 Клинический пример пациента с ИМбпST, вызванным экстракардиальными причинами (инфаркт миокарда 2 типа): А — ангиография с подозрением на необструктивное поражение проксимального сегмента ПМЖА (отмечено стрелкой); Б — ВСУЗИ в "серой шкале"; В — ВСУЗИ с ВГ. Доказано отсутствие инфаркт-связанного поражения, следствием чего стал отказ от стентирования.
Примечание: ВГ — виртуальная гистология, ВСУЗИ — внутрисосудистое ультразвуковое исследование, ИМбпST — инфаркт миокарда без подъема сегмента ST, ПМЖА — передняя межжелудочковая артерия. Цветное изображение доступно в электронной версии журнала.
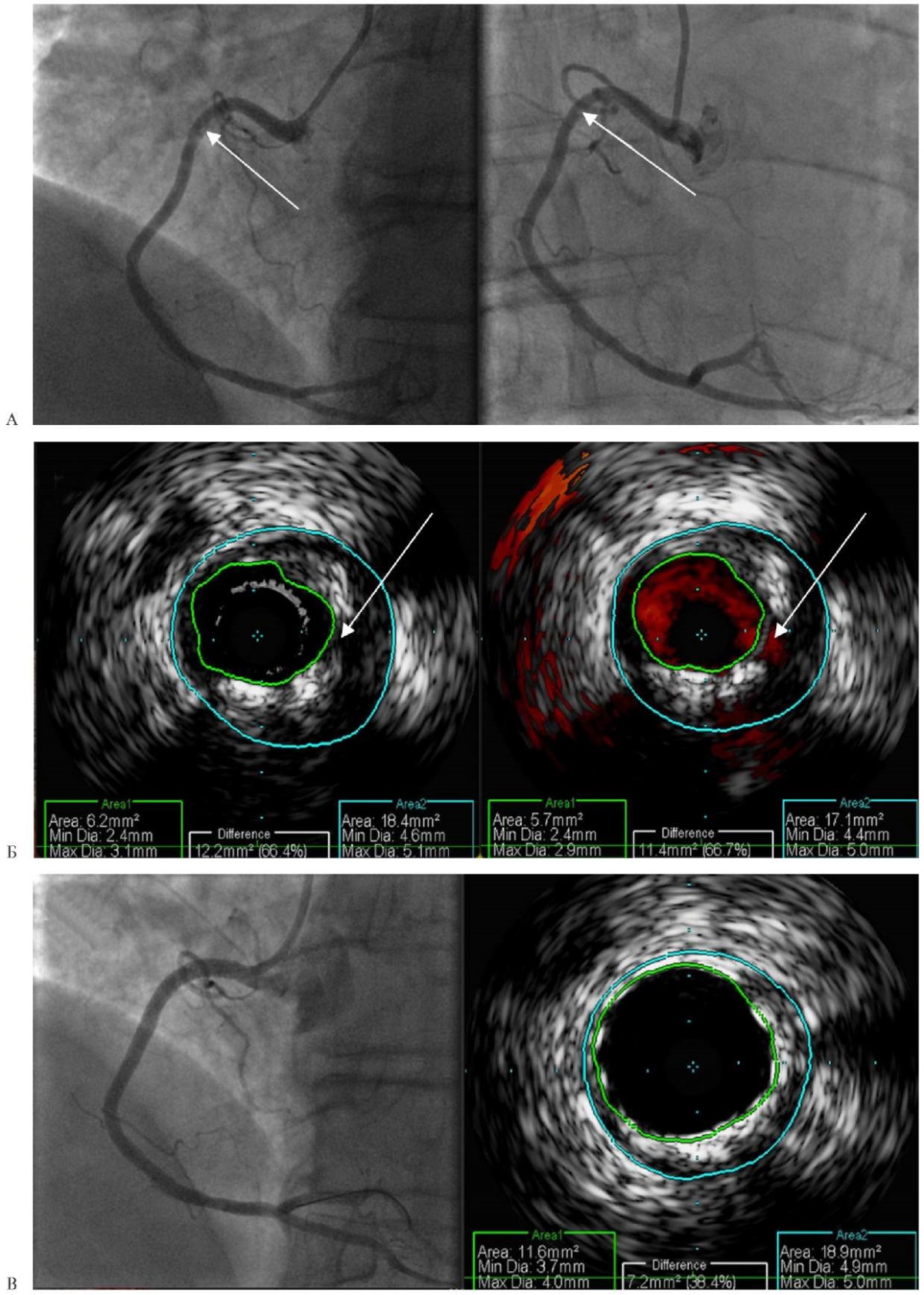
Рис. 6 Клинический пример пациента с ИМбпST: А — Ангиограмма ПКА в проекциях "LAO 30, CRA 5" и "LAO 10, CRA 25" (стрелками указан участок предполагаемого стенозирования ПКА); Б — результаты ВСУЗИ в "серой шкале" и в режиме ChromaFlo проксимальной трети ПКА (стрелками отмечены признаки дефекта интимы); В — контрольная ангиография и ВСУЗИ ПКА после стентирования [24].
Примечание: ВСУЗИ — внутрисосудистое ультразвуковое исследование, ИМбпST — инфаркт миокарда без подъема сегмента ST, ПКА — правая коронарная артерия. Цветное изображение доступно в электронной версии журнала.
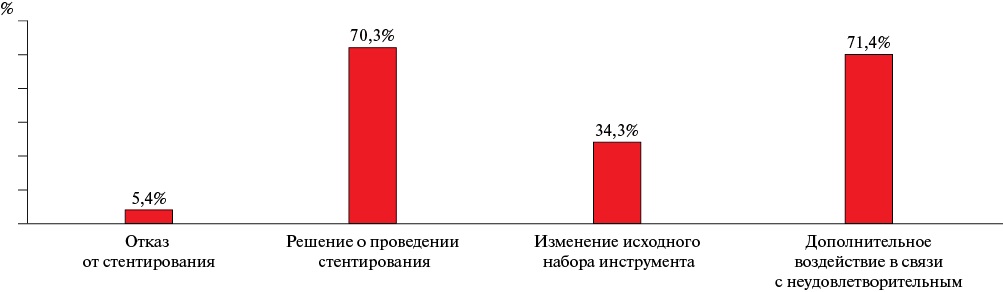
Рис. 7 Влияние ВСУЗИ на тактику лечения пациентов с ИМбпST.
Примечание: ВСУЗИ — внутрисосудистое ультразвуковое исследование, ИМбпST — инфаркт миокарда без подъема сегмента ST.
По итогам стентирования успех ВСУЗИ, критерии которого были идентичны критериям при плановых вмешательствах, в группе ИМбпST был достигнут у 33 (94,3%) пациентов. У 2 (5,7%) пациентов результат обозначен как субоптимальный несмотря на оптимизацию. Эти результаты фиксировались после промежуточных и конечных интраоперационных исследований. Летальных исходов в группе пациентов с ИМбпST в период госпитализации не наблюдалось.
Обсуждение
Данные современных исследований, посвященных использованию ВСУЗИ при ЧКВ, продемонстрировали существенное улучшение отдаленных результатов. Так, в рандомизированном исследовании IVUS-XPL (Effect of Intravascular Ultrasound-Guided vs Angiography Guided Everolimus-Eluting Stent Implantation), включавшем 1400 пациентов, доказано существенное снижение в группе ВСУЗИ по сравнению с группой ангиографического контроля количества крупных нежелательных событий (2,9 vs 5,8%, р=0,007) и частоты РЦС (2,5 vs 5,0%, р=0,02) [8]. В исследовании ULTIMATE (Intravascular Ultrasound Versus Angiography-Guided Drug-Eluting Stent Implantation), проведенном на 1448 пациентах, подтверждено существенное снижение РЦС (2,9 vs 5,4%, р=0,019) и уменьшение рисков повторных реваскуляризаций (OR 0,4) в группе ВСУЗИ [9]. В обоих исследованиях контрольные точки оценивались через 12 мес. Однако все современные клинические исследования включали гетерогенную по возрасту когорту пациентов, без учета описанных выше особенностей пожилых больных. По нашим данным, наиболее частым нежелательным событием после плановых ЧКВ у пациентов старших возрастных групп является РЦС, риск которой был максимальным к 3-м годам наблюдения и снижался к 5-ти годам (OR 5,09 через 1 год, OR 9,32 через 3 года и OR 5,62 через 5 лет). Аналогичная динамика выявлена нами в отношении общего количества ССС (OR 1,9 через 1 год, OR 3,1 через 3 года и OR 2,4 через 5 лет), рисков развития ОИМ (OR 2,0 через 1 год, OR 4,07 через 3 года и OR 2,1 через 5 лет) и рестеноза стентов (OR 3,0 через 1 год, OR 7,12 через 3 года и OR 5,62 через 5 лет). Общая картина наших результатов согласуется с большинством публикаций, в т.ч. с данными крупного исследования de la Torre Hernandez JM, et al., проведенного на 1670 пациентах, наблюдавшихся в течение 3 лет [25].
В более ранних публикациях не было продемонстрировано существенное влияние ВСУЗИ-асcистирования при ЧКВ на изменение летальности [26]. Но по результатам последующих метаанализов доказано, что в группах ЧКВ со ВСУЗИ количество летальных исходов в течение 12 мес. существенно ниже, чем в контрольных группах ЧКВ под ангиографическим контролем [10][11]. Полученные нами данные идут вразрез с данной тенденцией. Однако следует учитывать тот факт, что на наши результаты существенное влияние оказала пандемия НКИ, ставшая причиной смерти почти у половины пациентов. В связи с тем, что механизмы ССС у пациентов с НКИ зачастую отличаются от традиционного патогенеза, была проведена оценка только рисков смерти от всех причин, которая не показала различий в исследуемой и контрольной подгруппах (OR 0,98 через 1 год, OR 1,47 через 3 года и OR 1,27 через 5 лет, р>0,05). Кроме того, немаловажное значение имеет тот факт, что пациенты контрольной подгруппы находились под нашим наблюдением и в случае необходимости им проводились дообследования и коррекция терапии.
На сегодняшний день не существует четких критериев для принятия решения о необходимости ВСУЗИ при ЧКВ у пациентов с ОКС. На одной чаше весов — неоспоримая польза от детального анализа пораженного сегмента и результатов стентирования, на другой — существенное удлинение времени вмешательства, повышенные риски диссекции, экономическая составляющая и противоречивые данные о влиянии на риски летальных исходов. Так, в упоминавшемся уже многоцентровом исследовании ADAPT-DES использование ВСУЗИ приводит к уменьшению частоты тромбоза стентов (0,52 vs 1,04%, р=0,01) и инфаркта миокарда (2,5 vs 3,7%, p=0,002), но не снижает риск смерти (1,0 vs 1,4%, p=0,14) [12]. В этом же исследовании выявлено, что под влиянием ВСУЗИ операторы меняли стратегию ЧКВ в 74% случаев. Внутрисосудистые методы визуализации в группе пациентов с ИМбпST и с отсутствием обструктивного поражения КА имеют ключевое значение для исключения спонтанной диссекции, спазма КА, определения степени атеросклеротического поражения, выявления инфаркт-связанной артерии и выработки дальнейшей стратегии и тактики лечения, что порой невозможно при выполнении только лишь стандартной ангиографии. Balbi MM, et al. в своем исследовании показали, что ВСУЗИ помогло выявить инфаркт-связанную артерию в 96,4% случаях, где стандартная ангиография не помогла дать достоверного ответа, но не было достоверной разницы по летальности (21,4 vs 25,8%, p=0,24) и ССС (39,2 vs 47,6%, p=0,07) между группами ВСУЗИ и ангиографии [27].
По нашим данным, наиболее частым поводом прибегнуть к ВСУЗИ-ассистированию при ИМбпST у пациентов старших возрастных групп является решение вопроса о стратегии и тактике реваскуляризации, когда при наличии клинических признаков инфаркта миокарда отсутствует обструктивное поражение КА либо имеются сомнения в необходимости эндоваскулярного лечения. При этом в 81% случаев использование ВСУЗИ привело к изменению стратегии и тактики лечения: в 5,4% от выполнения ЧКВ было решено отказаться, в 70,3% было избрано инвазивное лечение. Кроме того, подтверждаются существенные различия в ангиографических и ВСУЗИ-характеристиках диаметров сосудов (2,95±0,53 vs 3,6±0,56 мм, р=0,034) и предполагаемых стентов (2,75±0,47 vs 3,1±0,54 мм, р=0,037), а также в частоте неполного раскрытия стента (11,1 vs 88,9%, р=0,002), что оказывает существенное влияние на отдаленные результаты лечения.
Заключение
Проведенное исследование продемонстрировало, что риски повторных ССС после плановых ЧКВ без ВСУЗИ в сравнении с ЧКВ со ВСУЗИ у пациентов пожилого и старческого возраста максимальны в первые 3 года с последующим снижением к 5-му году наблюдения. Увеличение рисков ССС через 5 лет в подгруппе ЧКВ без ВСУЗИ проявляется в основном за счет РЦС вследствие рестеноза стента. Нами не получено достоверных различий в 5-летней летальности между подгруппами плановых вмешательств со ВСУЗИ-ассистированием и без него. В группе пациентов с ИМбпST ВСУЗИ имеет ключевое значение в принятии решения о дальнейшей стратегии и тактике лечения, а также обеспечивает наиболее оптимальные непосредственные результаты.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Демин В. В. Клиническое руководство по внутрисосудистому ультразвуковому сканированию. Оренбург: Южный Урал, 2005. 400 с. ISBN: 5-94162-039-X.
2. Тагиева Н. Р., Шахнович Р. М., Миронов В. М. и др. Сравнение атеросклеротических поражений коронарных артерий у больных острым инфарктом миокарда и стабильной стенокардией по данным внутрисосудистого ультразвукового исследования. Кардиология. 2015;55(7):5-13. doi:10.18565/cardio.2015.7.5-13.
3. Мовсесянц М. Ю., Иванов В. А., Трунин И. В. Внутрисосудистое ультразвуковое исследование с функцией виртуальной гистологии при поражении коронарных артерий. Кардиология. 2009;49(12):58-61.
4. Миронов В. М., Меркулов Е. В., Терещенко А. С. и др. Клиническое применение внутрисосудистого ультразвукового исследования коронарных артерий. Вестник рентгенологии и радиологии. 2013;5:038-049.
5. Демин В. В., Мурзайкина М. М., Галин П. Ю. и др. Сравнение стратегий имплантации стентов с лекарственным покрытием под контролем внутрисосудистого ультразвукового исследования или ангиографии: рандомизированное исследование "ОРЕНБУРГ", часть 2. Данные ангиографии и внутрисосудистых методов визуализации. Диагностическая и интервенционная радиология. 2016;10(2):31-47. doi:10.25512/DIR.2016.10.2.04.
6. Costa MA, Angiolillo DJ, Tannenbaum M, et al. Impact of stent deployment procedural factors on long-term effectiveness and safety of sirolimus-eluting stents (final results of the multicenter prospective STLLR trial). Am J Cardiol. 2008;101(12):1704-11. doi:10.1016/j.amjcard.2008.02.053.
7. Бабунашвили А. М., Азаров А. В., Ардеев В. Н. и др. Согласительный документ экспертной группы Российского научного общества интервенционных кардиоангиологов. Международный журнал интервенционной кардиоангиологии. 2023;74(3):9-51. doi:10.24835/1727-818X-74-9.
8. Hong SJ, Kim BK, Shin DH, et al. Effect of Intravascular Ultrasound-Guided vs Angiography Guided Everolimus-Eluting Stent Implantation: The IVUS-XPL Randomized Clinical Trial. JAMA. 2015;314(20):2155-63. doi:10.1001/jama.2015.15454.
9. Zhang J, Gao X, Kan J, et al. Intravascular Ultrasound Versus Angiography-Guided Drug-Eluting Stent Implantation: The ULTIMATE Trial. J Am Coll Cardiol. 2018;72(24):3126-37. doi:10.1016/j.jacc.2018.09.013.
10. Mintz G, Bourantas C, Chamie D. Intravascular Imaging for Percutaneous Coronary Intervention Guidance and Optimization: The Evidence for Improved Patient Outcomes. J Soc Cardiovasc Angiogr Interv. 2022;1(6):413-29. doi:10.1016/j.jscai.2022.100413.
11. Darmoch F, Alraies M, Al-Khadra Y, et al. Intravascular ultrasound imaging–guided versus coronary angiography–guided percutaneous coronary intervention: A systematic review and meta-analysis. J Am Heart Assoc. 2020;9(5):e013678. doi:10.1161/JAHA.119.013678.
12. Witzenbichler B, Maehara A, Weisz G, et al. Relationship between intravascular ultrasound guidance and clinical outcomes after drug-eluting stents: the assessment of dual antiplatelet therapy with drug-eluting stents (ADAPT-DES) study. Circulation. 2014;129(4):463-70. doi:10.1161/CIRCULATIONAHA.113.003942.
13. Park D, Vemmou E, An S, et al. Trends and impact of intravascular ultrasound and optical coherence tomography on percutaneous coronary intervention for myocardial infarction. Int J Cardiol Heart Vasc. 2023;45:101-86. doi:10.1016/j.ijcha.2023.101186.
14. Воробьёвский Д. А. Перспективы использования внутрисосудистого ультразвукового исследования при реваскуляризации миокарда у пациентов пожилого и старческого возраста. Успехи геронтологии. 2017;30(4):47-57.
15. Козлов К. Л., Титков Ю. С., Титков А. Ю. и др. Роль частичной реваскуляризации миокарда в лечении ишемической болезни сердца у пациентов пожилого и старческого возраста. Успехи геронтологии. 2004;14:92-5.
16. Козлов К. Л., Хубулава Г. Г., Белевитин А. Б. и др. Хирургическое лечение ишемической болезни сердца у пациентов пожилого и старческого возраста. Москва: Издательство РАМН, 2007. 348 с. ISBN: 5-7901-0085-6.
17. Воробьёвский Д. А., Козлов К. Л., Власенко С. В. и др. Роль внутрисосудистого ультразвукового исследования при выборе тактики реваскуляризации миокарда у пациентов пожилого и старческого возраста. Клиническая геронтология. 2022;28(7):46-54. doi:10.26347/1607-2499202207-08046-054.
18. Сумин А. Н., Гайфулин Р. А., Сумин Д. А. Пожилой возраст: влияние на диагностические и лечебные стратегии при мультифокальном атеросклерозе. Сердце. Журнал для практикующих врачей. 2015;14(6):350-61.
19. Lim H, Tonino P, De Bruyne B, et al. The impact of age on fractional flow reserve-guided percutaneous coronary intervention: A FAME (Fractional Flow Reserve versus Angiography for Multivessel Evaluation) trial substudy. Int J Cardiol. 2014;177(1):66-70. doi:10.1016/j.ijcard.2014.09.010.
20. Hasegawa T, Ehara S, Kobayashi Y, et al. Acute myocardial infarction: Clinical characteristics and plaque morphology between expansive remodeling and constrictive remodeling by intravascular ultrasound. Am Heart J. 2006;151(2):332-7. doi:10.1016/j.ahj. 2005.03.041.
21. Baber U, Stone G, Weisz G, et al. Coronary Plaque Composition, Morphology, and Outcomes in Patients With and Without Chronic Kidney Disease Presenting With Acute Coronary Syndromes. JACC Cardiovasc. Imaging. 2012;5(3):53-61. doi:10.1016/J.JCMG.2011.12.008.
22. Захаров А. С., Мичурова М. С., Терехин С. А. и др. Применение внутрисосудистого ультразвукового исследования с "виртуальной гистологией" в оценке структуры атеросклеротической бляшки у больных ишемической болезнью сердца и сахарным диабетом 2-го типа. Терапевтический архив. 2019;91(12):41-6. doi:10.26442/00403660.2019.12.000367.
23. Thygesen K, Alpert J, Jaffe A, et al. Fourth universal definition of myocardial infarction (2018). Eur Heart J. 2019;40(3):237-69. doi:10.1093/eurheartj/ehy462.
24. Воробьевский Д. А., Козлов К. Л., Щербак С. Г. и др. Роль внутрисосудистой визуализации в определении тактики лечения пациента с ИМбпST и отсутствием обструктивного поражения коронарных артерий. Кардиологический вестник. 2024;19(2):67-71. doi:10.17116/Cardiobulletin20241902167.
25. de la Torre Hernandez JM, Alonso JA, Gómez JA, et al. Clinical impact of intravascular ultrasound guidance in drug-eluting stent implantation for unprotected left main coronary disease: pooled analysis at the patient-level of 4 registries. JACC Cardiovasc Interv. 2014;7(3):244-54. doi:10.1016/j.jcin.2013.09.014.
26. Kim JS, Kang TS, Mintz G, et al. Randomized comparison of clinical outcomes between intravascular ultrasound and angiography-guided drug-eluting stent implantation for long coronary artery stenoses. JACC Cardiovasc Interv. 2013;6(4): 369-76. doi:10.1016/j.jcin.2012.11.009.
27. Balbi MM, Scarparo P, Tovar MN, et al. Culprit Lesion Detection in Patients Presenting With Non-ST Elevation Acute Coronary Syndrome and Multivessel Disease. Cardiovasc Revasc Med. 2022;35:110-18. doi:10.1016/j.carrev.2021.03.019.
Об авторах
Д. А. ВоробьёвскийРоссия
Врач по рентгенэндоваскулярным диагностике и лечению; научный сотрудник лаборатории возрастной патологии сердечно-сосудистой системы
Санкт-Петербург
К. Л. Козлов
Россия
Д.м.н., профессор, зав. отделом клинической геронтологии и гериатрии
Санкт-Петербург
С. В. Власенко
Россия
К.м.н., преподаватель кафедры последипломного образования Медицинского факультета; заведующий отделением рентгенохирургических методов диагностики и лечения
Санкт-Петербург
С. Г. Щербак
Россия
Д.м.н., профессор, зав. кафедрой последипломного образования Медицинского факультета; главный врач СПб ГБУЗ «Городская больница №40»
Санкт-Петербург
Т. Р. Вильданов
Россия
Врач по рентгенэндоваскулярным диагностике и лечению
Санкт-Петербург
Дополнительные файлы
Что известно о предмете исследования?
- Внутрисосудистое ультразвуковое исследование (ВСУЗИ) — один из наиболее точных методов оценки состояния сосудистого русла и результатов чрескожных коронарных вмешательств в арсенале рентгенэндоваскулярного хирурга.
Что добавляют результаты исследования?
- Использование ВСУЗИ во время плановых реваскуляризаций миокарда у пациентов пожилого и старческого возраста существенно улучшает отдаленные результаты в течение 5 лет за счет снижения рисков сердечно-сосудистых событий.
- Определение тактики лечения — наиболее частый повод прибегнуть к ВСУЗИ у пациентов старших возрастных групп с инфарктом миокарда без подъема сегмента ST.
Рецензия
Для цитирования:
Воробьёвский Д.А., Козлов К.Л., Власенко С.В., Щербак С.Г., Вильданов Т.Р. Возможности внутрисосудистого ультразвукового исследования коронарных артерий при выборе тактики и оценке результатов эндоваскулярного лечения у пациентов пожилого и старческого возраста. Кардиоваскулярная терапия и профилактика. 2025;24(2):4125. https://doi.org/10.15829/1728-8800-2025-4125. EDN: FWRIEK
For citation:
Vorobevskii D.A., Kozlov K.L., Vlasenko S.V., Scherbak S.G., Vildanov T.R. The possibilities of intravascular ultrasound of coronary arteries in the choice of tactics and evaluation of the results of endovascular treatment in elderly and senile patients. Cardiovascular Therapy and Prevention. 2025;24(2):4125. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4125. EDN: FWRIEK
JATS XML

























































