Перейти к:
Влияние многоцикличного замораживания-оттаивания плазмы крови на результаты проведения неинвазивного пренатального тестирования
https://doi.org/10.15829/1728-8800-2024-4172
EDN: GQSUNI
Аннотация
Цель. Оценить допустимость факта прохождения неинвазивного пренатального тестирования (НИПТ) в роли информативного критерия для определения качества плазмы крови (ПК) и внеклеточной дезоксирибонуклеиновой кислоты (ДНК) (вкДНК) в случае, когда на преаналитическом этапе используются пробирки со стабилизирующим составом, на примере образцов ПК, подвергнутых продолжительному хранению при комнатной температуре (+18о С) и многоцикличному замораживанию-оттаиванию.
Материал и методы. Образцы ПК подвергали 20 циклам замораживания-оттаивания (-80о С/+18о С), 20-дневному хранению при температуре +18о С с промежуточной оценкой состояния вкДНК. Количественный выход оценивали флуорометрически, степень фрагментации — с помощью полимеразной цепной реакции (ПЦР) в реальном времени, результаты НИПТ — через высокопроизводительное секвенирование.
Результаты. После многоцикличного замораживания-оттаивания и длительного хранения ПК при комнатной температуре (+18о С) наблюдается снижение целостности вкДНК, уменьшение концентрации вкДНК к 20 циклу оттаивания и тенденция к увеличению концентрации к 20 сут. хранения ПК; несмотря на это, результаты НИПТ исследованных образцов показали высокую степень совпадения с результатами НИПТ референсных образцов.
Заключение. Показано, что один только факт успешного проведения НИПТ не может рассматриваться в качестве надежного и достаточного критерия оценки качества исходной ПК и правильной преаналитики. Это подчеркивает особую важность контроля условий транспортировки и хранения образцов ПК и цельной крови.
Ключевые слова
Для цитирования:
Уланова П.В., Антоненко А.Н., Доморацкая Е.А., Белов Р.О., Золотопуп А.А., Леонова В.С., Криницына А.А., Беленикин М.С. Влияние многоцикличного замораживания-оттаивания плазмы крови на результаты проведения неинвазивного пренатального тестирования. Кардиоваскулярная терапия и профилактика. 2024;23(11):4172. https://doi.org/10.15829/1728-8800-2024-4172. EDN: GQSUNI
For citation:
Ulanova P.V., Antonenko A.N., Domoratskaya E.A., Belov R.O., Zolotopup A.A., Leonova V.S., Krinitsina A.A., Belenikin M.S. Effect of multiple plasma freeze-thaw cycles on non-invasive prenatal testing. Cardiovascular Therapy and Prevention. 2024;23(11):4172. (In Russ.) https://doi.org/10.15829/1728-8800-2024-4172. EDN: GQSUNI
Введение
Внеклеточные дезоксирибонуклеиновые кислоты (ДНК) (вкДНК, циркулирующие ДНК), циркулирующие в плазме крови (ПК) человека и других биологических жидкостях организма, появляются в результате таких процессов как апоптоз, некроз, активная секреция, кроме того, обнаруживаемые в ПК вкДНК могут относиться к ДНК патогенов (бактерий, вирусов). Присутствие вкДНК в ПК у здоровых людей обусловлено процессом апоптоза гемопоэтических клеток [1, 2]. В кровотоке беременных присутствуют фетальные вкДНК, основными механизмами возникновения которых являются апоптоз гемопоэтических клеток плода, перенос вкДНК плода через плаценту и разрушение трофобласта [3]. Количество циркулирующей ДНК плода зависит, помимо срока гестации и течения беременности, от других факторов, таких как наличие заболеваний у матери, масса тела, анеуплоидии, многоплодная беременность [4]. Функциональная роль вкДНК активно изучается, в частности они могут образовывать нуклео-протеиновые комплексы [5].
Из всех преаналитических переменных при обработке образцов цельной крови и ПК условия их хранения оказывают существенно влияют на качество вкДНК [6-12], однако информация по влиянию особенностей хранения ПК на качество вкДНК значительно варьирует. Общие положения сводятся к тому, что ПК, полученную после центрифугирования образца цельной крови с дальнейшим отбором супернатанта, отделенного от фракции клеток крови, рекомендуют краткосрочно хранить при -20о C или долгосрочно при -80о C. Считается, что данные температурные режимы позволяют подавить процесс ферментативного расщепления ядерной и вкДНК дезоксирибонуклеазами (ДНКазами) [13]. По данным [11] хранение ПК при -80о C без влияния на количественные характеристики вкДНК при последующей экстракции должно продолжаться не >9 мес. При более длительном хранении ПК выход вкДНК может приводить к снижению количества экстрагируемой вкДНК на ~30% в год [14]. В то же время по другим данным [15], даже после 12 лет хранения ПК при сходных условиях, количество выделенной вкДНК из ПК онкобольных мало изменилось, а ее качество позволило провести анализ специфических последовательностей.
Важным аспектом практической работы для исследований вкДНК, в частности для неинвазивного пренатального тестирования (НИПТ), является понимание стабильности вкДНК в ПК, отделенной от форменных элементов крови, в условиях без замораживания — при хранении при комнатной температуре перед экстракцией вкДНК. Данных по этому вопросу немного, поэтому любые количественные данные о влиянии превышения сроков хранения ПК при комнатной температуре предоставят полезную информацию для преаналитической работы с вкДНК для проведения НИПТ.
Помимо сроков и условий хранения ПК очень важным параметром является количество циклов замораживания-оттаивания образцов ПК. Литературные данные разнятся, в одних работах существенных изменений концентраций вкДНК не выявляли [8], тогда как в других авторы отмечали небольшое снижение целостности и качества вкДНК уже после трех циклов замораживания-оттаивания с -80о C до комнатной температуры [13, 16], при этом даже однократное замораживание-оттаивание образцов ПК может привести к снижению процента обнаружения патологии плода при проведении НИПТ [17]. Несмотря на некоторые расхождения, большинство авторов сообщают об однозначно негативном влиянии фактора множественного замораживания-оттаивания и приводят рекомендации предпочтительного хранения вкДНК в виде элюата, а также разделения образцов ПК на несколько аликвот на этапе обработки цельной крови для предполагаемого сокращения влияния числа замораживаний-оттаиваний [13].
Вопрос о точном количестве циклов, вызывающих явную деградацию вкДНК и являющимся критичным для дальнейшего исследования вкДНК, остается открытым. Особенно это касается области практического применения вкДНК, в частности, проведение НИПТ, при котором значимым этапом является работа с ПК и вкДНК. В практическом аспекте важно тестирование границ стабильности и оптимальной подготовки образцов ПК к замораживанию для удобства дальнейшей работы и обеспечения максимально возможного качества, а также для обеспечения воспроизводимости результатов с течением времени и поиска ответа на вопрос: какое количество циклов замораживания-оттаивания ПК все же возможно без существенного влияния на качество. Еще одним из прикладных результатов ответа на этот вопрос является оптимизация хранения образцов ПК в биобанках. Если ориентироваться на хранение биоматериала каждого образца в минимально возможном числе криопробирок (пробирок, предназначенных для хранения при низких температурах), то в случае образцов, представляющих интерес (например, содержащих анеуплоидии), при дальнейших и валидационных исследованиях может требоваться чрезмерное многократное замораживание-оттаивание образца. В то же время, проведение предварительного аликвотирования всех поступающих образцов ПК на большое количество аликвот малого объема может привести к излишнему расходу материалов и емкостей хранения. И хотя, как правило, вопрос экономики хранения образцов при проведении научных исследований не рассматривается, он может вносить значительный вклад экономическую составляющую проводимых работ.
Цель настоящей работы − оценить допустимость факта прохождения НИПТ в роли информативного критерия для определения качества ПК и вкДНК, в случае, когда на преаналитическом этапе используются пробирки со стабилизирующим составом, на примере образцов ПК, подвергнутых продолжительному хранению при комнатной температуре (+18о C) и многоцикличному замораживанию-оттаиванию.
Материал и методы
Образцы. Для проведения исследования использовали образцы ПК пациенток, находящихся на 10-14 нед. гестации после проведения традиционного пренатального скрининга. Все женщины подписали информированное согласие на проведение исследований и обработку персональных данных, включая данные анамнеза.
Для исследования факторов многоцикличного замораживания-оттаивания было проанализировано 5 отдельных кейсов (4 — с наличием повышенного риска хромосомной патологии плода, 1 — без), для длительного хранения ПК — 10 (5 — с наличием повышенного риска хромосомной патологии плода, 5 — без).
Сбор и подготовка образцов для секвенирования. Исходным биоматериалом служила периферическая венозная кровь, собранная в одну пробирку с консервантами, стабилизирующими вкДНК (Streck Cell Free DNA BCT, США). Обработку первичного материала после взятия осуществляли согласно разработанным стандартным операционным процедурам. Кратко, полученные образцы подвергали 2-этапному центрифугированию, после чего ПК, за исключением нижней части объемом ~200 мкл, по 1 мл помещали в криопробирки. Всего для каждого образца было подготовлено 4 аликвоты ПК (каждая в двух повторах) — 1 контрольная проба (после однократного замораживания при -20о C, не подвергавшаяся длительному хранению) и 3 экспериментальных пробы (для 5, 10 и 20 циклов и 5, 10 и 20 сут. хранения). Подготовленные образцы ПК подвергали 20-кратному замораживанию-оттаиванию в режиме -80о C/+18о C с промежуточной оценкой степени деградации и количественного выхода вкДНК на 5, 10 и 20 циклах, а также хранению в течение 20 сут. при температуре +18о C (комнатная температура) с оценкой через 5, 10 и 20 сут.
ВкДНК выделяли с использованием станции пробоподготовки MGISP-960 (MGI, Китай) и набора реагентов для выделения вкДНК Nucleic Acid Extraction Kit (BGI, Китай) по стандартному протоколу производителя. Подготовку библиотек ДНК для проведения НИПТ проводили с использованием той же станции пробоподготовки MGISP-960 (MGI, Китай) и набора реактивов MGIEasy Cell-free DNA Library Prep Set (BGI, Китай) с использованием стандартных протоколов производителя. Секвенирование проводили на BGISEQ-500 (BGI, Китай). Результаты высокопроизводительного секвенирования обрабатывали с использованием проприетарного программного обеспечения.
Оценка количественного выхода и деградации образцов вкДНК. Оценку количественного выхода и оценку деградации вкДНК проводили флуорометрическим способом с набором для измерения концентраций DeNovix dsDNA High Sensitivity Kit (DeNovix Inc., США) и с помощью полимеразной цепной реакции (ПЦР) в реальном времени с применением коммерческого набора для количественной и качественной оценки ДНК человека "QuantumDNA-Set" (Евроген, Россия) и амплификатора CFX96 Touch™ Real-Time PCR Detection System (Bio-Rad, США) согласно инструкции производителя.
Различия оценивались с помощью непараметрического критерия Манна-Уитни путем сравнения вычисленного эмпирического и критического значений (уровень значимости p=0,05) с использованием пакета Microsoft Excel 2018 (Майкрософт, США).
Результаты
Влияние многократных циклов замораживания-оттаивания ПК на качество вкДНК. Вначале была проведена флуорометрическая количественная оценка образцов вкДНК, полученных из ПК, подвергшейся многократным циклам замораживания-оттаивания -80о C/+18о C. Диапазон концентраций вкДНК для контрольных аликвот и экспериментальных образцов составил 0,195-0,249 нг/мкл. После 5 и 10 циклов замораживания-оттаивания проб статистически достоверных различий выявлено не было, тогда как к 20 циклу показано статистически значимое уменьшение концентрации вкДНК (рисунок 1 А).
При этом анализ оценки целостности тех же образцов, проводимый методом ПЦР в реальном времени через подсчет соотношений концентраций амплифицированных фрагментов разных длин, показал отсутствие четкой корреляции между количеством циклов замораживания-оттаивания и степенью фрагментации вкДНК. В отдельных пробах степень деградации резко увеличивается уже на 5 цикле, тогда как у других даже после 10 циклов замораживания-оттаивания вкДНК оставалась слабо деградированной. К 20 циклу наблюдалось увеличение степени фрагментации вкДНК во всех образцах.
При анализе расчетной концентрации фрагментов вкДНК размером 50 и 150 пар нуклеотидов (п.н.) было выявлено, что в контрольных образцах их концентрации примерно равны между собой (0,077 и 0,075 нг/мкл, соответственно), а далее, по мере того, как увеличивалось число циклов замораживания-оттаивания (5 и 10 циклов), концентрация более длинных фрагментов снижалась, тогда как концентрация коротких фрагментов оставалась практически на том же уровне (рисунок 1 Б). К 20 циклу концентрация более коротких фрагментов снижалась, тогда как концентрация более длинных фрагментов опять возрастала. Это может быть связано с тем, что при большом количестве циклов замораживания-оттаивания более длинные фрагменты вкДНК, которые также есть в образце, деградируют и начинают давать свой вклад.
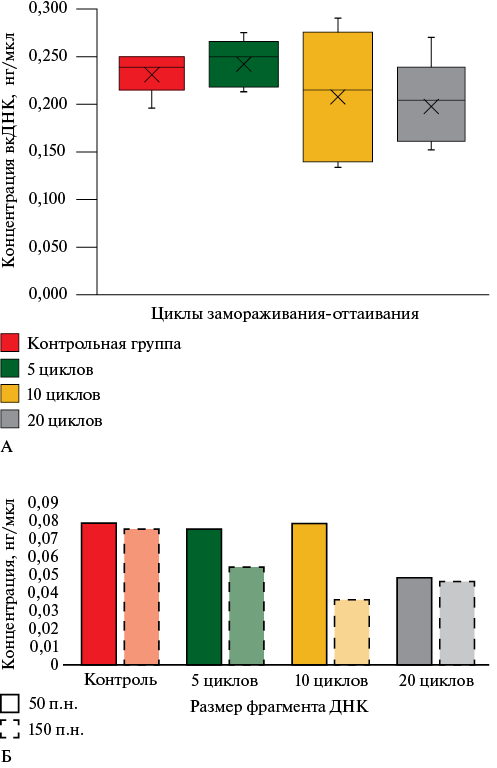
Рис. 1 Изменение концентрации вкДНК (А) и соотношений концентраций фрагментов 50 и 150 п.н. (Б), в препаратах ДНК, полученных из образцов ПК после разного количества циклов замораживания-оттаивания -80о C/+18о C.
Примечание: вкДНК — внеклеточная дезоксирибонуклеиновая кислота (ДНК), ПК — плазма крови, п.н. — пар нуклеотидов.
Влияние многократных циклов замораживания-оттаивания ПК на результаты НИПТ. Далее, для одного из двух повторов тестовых образцов проводили выборочное секвенирование для определения сходимости результатов НИПТ внутри одного образца (таблица 1).
Для одного из пяти исследуемых образцов (№ 2) был выявлен повышенный риск трисомии по 13 хромосоме после 5 циклов замораживания-оттаивания, тогда как в контроле и в образцах, подвергшихся 10 и 20 циклам, трисомии не детектировалось. Кроме этого, в образцах, которые подвергали 5 и 10 циклам замораживания-оттаивания были выявлены делеции в 4, 7 и 3 и 4 хромосомах, соответственно, тогда как в контрольном образце и в образце, который прошел 20 циклов замораживания-оттаивания, таких вариантов не выявлено. Повышенный риск трисомии (Z(chr13)=2,03) в данном случае означает, что образец попадает в "серую" зону и может оцениваться как образец с наличием риска по хромосомным аномалиям, т.е., ложноположительный результат НИПТ, или как образец с отсутствием риска по хромосомным аномалиям — ложноотрицательный образец.
Контрольная проба образца № 4 секвенировалась в двух повторах. Секвенирование одного повтора контрольного образца № 4 детектировало высокий риск наличия дополнительной половой Х хромосомы и аналогично кейсу образца номер № 2 — данный результат попадает в "серую" зону (Q20 (%)=93,44, Effective data (M)=5,04 при [5,+∞]), фетальная фракция ≈4) и требуется повторное проведение анализа. Результаты НИПТ, проводимые для второго повтора, показали улучшение параметров качества секвенирования ((Q20 (%)=98,95, Effective data (M)=7,39 при [5,+∞]), фетальная фракция ≈5) и отсутствие повышенных рисков хромосомных аномалий. В экспериментальных образцах после 5, 10 и 20 циклов результаты НИПТ также соответствовали контролю.
В остальных проанализированных образцах различий в результатах НИПТ в контроле и после многократных циклов замораживания-оттаивания не обнаружено.
Влияние длительного хранения ПК на качество вкДНК. Количественная оценка содержания вкДНК в образцах ПК, хранившихся продолжительное время при комнатной температуре (+18о C), выявила значительный разброс концентраций внутри диапазона 0,18-1,18 нг/мкл. При этом выход вкДНК через 10 сут. после хранения довольно резко падал по сравнению с хранением в течение 5 сут. Через 20 сут. хранения ПК при комнатной температуре (+18о C) количество выделяемой вкДНК практически не менялось (рисунок 2 А).
При оценке индексов деградации было выявлено, что вкДНК в половине исследованных образцов, не подвергавшихся длительному воздействию комнатной температуры, имеет индекс деградации от 1,5 до 1,8, что трактуется как легкая степень деградации. Через 5 суток хранения индекс деградации незначительно увеличивался (максимальный индекс деградации в этой группе образцов составил 2,18), через 10 сут. хранения в единичных образцах наблюдается довольно сильная степень деградации вкДНК по сравнению с контрольными образцами, хранившимися по температуре -20о C. После 20 сут. хранения при +18о C по соотношениям концентраций фрагментов разной длины наблюдается средняя степень деградации образцов. При этом в образцах снижается расчетная концентрация коротких фрагментов вкДНК (50 п.н.) при практически неизменной расчетной концентрации фрагментов размером 150 п.н. (рисунок 2 Б).
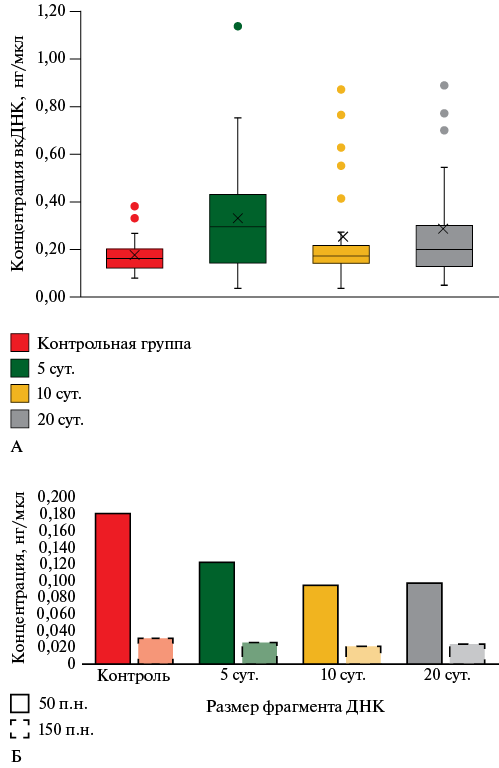
Рис. 2 Изменение концентрации вкДНК (А) и соотношений концентраций фрагментов 50 и 150 п.н. (Б), в препаратах ДНК, полученных из образцов ПК после разных сроков хранения при +18о C.
Примечание: вкДНК — внеклеточная дезоксирибонуклеиновая кислота (ДНК), ПК — плазма крови.
Влияние длительного хранения ПК на результаты НИПТ. Выборочное проведение НИПТ с использованием образцов ПК после 5, 10 и 20 сут. хранения при температуре +18о C (таблица 2) не выявило появления ложноположительных и ложноотрицательных данных по хромосомным отклонениям. Однако в образце № 3 (rt) в варианте хранения 20 сут. при температуре +18о C анализ полученных результатов показал наличие делеций и дупликаций в 1, 6, 10, 12 и 22 хромосомах. При этом в образце ПК, хранившемся в замороженном состоянии, никаких инделей выявлено не было.
Таблица 1
Результаты выборочного секвенирования вкДНК, полученной из образцов ПК, подвергшихся разному количеству циклов замораживания-оттаивания
Образец | ДНК плода (%) [3.50,50] | Z(chr13) | Z(chr18) | Z(chr21) | Тест (половые хромосомы) | Заболевание | Тест (Del/Dup) | Q20 (%) [93,100] | ГЦ (%) [38,42] | Пол плода |
1-0 | 22,35 | 0,094 | 13,073 | -0,034 | Отрицательный | Chromosome 18q deletion Syndrome | del(18q22.1-q23,11.97M) | 98,06 | 39,197 | муж |
1-5 | 25,362 | 0,814 | 13,979 | 0,717 | Отрицательный | Chromosome 18q deletion Syndrome | del(18q22.1-q23,12.10M) | 97,93 | 39,764 | муж |
1-10 | 18,48 | -0,605 | 10,683 | 0,519 | Отрицательный | Chromosome 18q deletion Syndrome | del(18q22.1-q23,10.24M) | 99,13 | 38,304 | муж |
1-20 | 19,96 | 0,891 | 11,977 | 0,072 | Отрицательный | Chromosome 18q deletion Syndrome | del(18q22.1-q23,11.91M) | 98,19 | 39,398 | муж |
2-0 | 3,796 | -0,125 | -2,242 | -1,104 | XXX высокий риск (+++) | – | – | 98,88 | 38 | жен |
2-5 | 3,785 | 2,027* | -0,867 | 0,709 | XXX высокий риск (+++) | – | del(4p16.3-p11,48.65M)* del(7p15.2-p11.2,29.53M)* | 98,72 | 39,13 | жен |
2-10 | 3,895 | 0,436 | -1,247 | 0,709 | XXX высокий риск (+++) | – | del(3p26.3-p11.1,89.44M)* del(4p16.3-p15.32,16.34M)* del(4p15.32-p11,31.21M)* | 99,16 | 38,301 | жен |
2-20 | 3,854 | 0,092 | -2,842 | -0,757 | XXX высокий риск (+++) | – | 98,08 | 39,363 | жен | |
3-0 | 14,192 | -0,899 | -2,818 | 16,424 | Отрицательный | – | 97,05 | 39,143 | муж | |
3-5 | 12,595 | -2,553 | -1,27 | 18,947 | Отрицательный | – | 98,85 | 40,853 | муж | |
3-10 | 11,294 | -2,514 | -2,339 | 12,437 | Отрицательный | – | 98,8 | 39,325 | муж | |
3-20 | 12,252 | -1,356 | -0,62 | 14,078 | Отрицательный | – | 97,92 | 39,914 | муж | |
4-0 | 4,019 | -2,11 | -1,342 | -1,019 | XXX высокий риск (+++)* | – | 93,44 | 40,031 | жен | |
4-0 | 5,191 | -1,048 | -1,607 | -0,938 | Отрицательный | – | 98,95 | 39,841 | жен | |
4-5 | 5,951 | 0,23 | -0,254 | 0,405 | Отрицательный | – | 99,12 | 40,299 | жен | |
4-10 | 4,293 | -0,609 | -1,663 | -1,565 | Отрицательный | – | 98,46 | 40,237 | жен | |
4-20 | 5,439 | 1,013 | -1,102 | -0,685 | Отрицательный | – | 99,03 | 39,832 | жен | |
5-0 | 23,178 | 0,631 | -0,411 | 0,555 | XXX высокий риск (+++) | – | 98,4 | 39,838 | жен | |
5-5 | 21,961 | -0,66 | 1,354 | -0,005 | XXX высокий риск (+++) | – | 98,62 | 40,059 | жен | |
5-10 | 21,439 | -0,647 | 0,145 | -1,008 | XXX высокий риск (+++) | – | 99,04 | 39,786 | жен | |
5-20 | 19,486 | -1,035 | -1,14 | 0,419 | XXX высокий риск (+++) | – | 98,59 | 40,15 | жен |
Примечание: цифра после номера образца — количество циклов замораживания-оттаивания, жирным шрифтом выделены значения, указывающие на наличие трисомии по 18-й (образец 1), 21-й (образец 4) хромосомам или по половым (образец 2) хромосомам; курсивом и * обозначены различающиеся показатели; вкДНК — внеклеточная дезоксирибонуклеиновая кислота (ДНК), ПК — плазма крови, ГЦ — гуанин-цитозиновый состав.
Таблица 2
Пример выборочных результатов секвенирования вкДНК, полученной из образцов ПК, подвергшихся разному сроку хранения при +18о С
Образец | ДНК плода (%) [3.50,50] | Z(chr13) | Z(chr18) | Z(chr21) | Тест (половые хромосомы) | Заболевание | Тест (Del/Dup) | Q20 (%) [93,100] | ГЦ (%) [38,42] | Пол плода |
1(rt)-0 | 19,873 | -0,707 | 1,092 | -1,673 | Отрицательный | – | 98,51 | 39,828 | муж | |
1(rt)-5 | 19,082 | -0,469 | 0,516 | -0,823 | Отрицательный | – | 97,28 | 40,672 | муж | |
1(rt)-10 | 21,963 | -0,125 | -1,646 | 0,442 | Отрицательный | – | 98,41 | 39,484 | муж | |
1(rt)-20 | 18,413 | -0,119 | -1,831 | -1,1 | Отрицательный | – | 97,39 | 39,073 | муж | |
2(rt)-0 | 6,904 | 1,285 | 14,586 | 0,202 | Отрицательный | – | 95,87 | 39,989 | жен | |
2(rt)-5 | 8,354 | -2,679 | 12,08 | -2,086 | Отрицательный | – | 95,62 | 40,086 | жен | |
2(rt)-10 | 7,287 | -1,181 | 16,403 | -0,327 | Отрицательный | – | 98,13 | 40,972 | жен | |
2(rt)-20 | 7,541 | 0,231 | 13,575 | -1,824 | Отрицательный | – | 97,83 | 38,83 | жен | |
3(rt)-0 | 12,082 | -0,124 | 1,492 | -1,343 | Отрицательный | – | 98,73 | 38,829 | жен | |
3(rt)-20 | 13,908 | -1,326 | -1,931 | -1,311 | Отрицательный | Chromosome 10q deletion Syndrome* | dup(1q12-q23.3,19.23M)* dup(6p22.2-p21.2,12.70M)* del(10q25.2-q26.3,22.73M)* dup(12q13.11-q14.1,10.14M)* del(22q13.1-q13.33,9.02M)* | 98,99 | 40,53 | жен |
4(rt)-0 | 11,151 | -0,409 | -0,859 | -0,281 | Отрицательный | – | 99,04 | 40,444 | муж | |
4(rt)-10 | 11,878 | -0,429 | 0,153 | -1,317 | Отрицательный | – | 98,8 | 41,202 | муж |
Примечание: цифра после номера образца — количество суток хранения, выделены жирным курсивом и * обозначены различающиеся показатели; Rt — комнатная температура хранения (+18о С), вкДНК — внеклеточная дезоксирибонуклеиновая кислота (ДНК), ПК — плазма крови, ГЦ — гуанин-цитозиновый состав.
Обсуждение
Качественные и количественные характеристики образцов вкДНК, а также расчётные показатели концентраций фрагментов разного размера и доли фракции ДНК плода, полученных из ПК, подвергшейся влиянию неблагоприятных преаналитических факторов (длительное хранение при комнатной температуре, многократные циклы замораживания-оттаивания), оказались сопоставимыми с характеристиками, которые приводили другие исследователи в своих работах. Средняя доля вкДНК плода на 11-й нед. гестации составляет ~10% от общей вкДНК в материнском кровотоке [18].
Полученные нами данные показывают, что многоцикличное замораживание-оттаивание ПК: (1) негативно влияет на количественный выход вкДНК: наблюдалось снижение уровня вкДНК к 20 циклу замораживания-оттаивания, однако после 5 и 10 циклов статически достоверных изменений концентраций вкДНК не обнаружено (что согласуется с данными [8]); (2) к 20 циклу замораживания-оттаивания приводит к увеличению степени фрагментации вкДНК во всех исследуемых образцах. По мере увеличения количества циклов меняется профиль распределения фрагментов по размеру: длинные фрагменты, вероятно, деградируют на более короткие, что согласуется с информацией авторов в работе [16].
При изучении фактора длительного хранения ПК при комнатной температуре (+18о C) было обнаружено, что при длительном воздействии положительной температуры наблюдается общая закономерность к увеличению концентраций вкДНК к 20 сут. хранения ПК при наблюдаемом увеличении через 5 сут. и уменьшении через 10 сут. по сравнению с 5-ю сут., однако с бóльшим количеством выбивающихся данных по сравнению с контрольной группой. В работе [19] показано, что ~90% вкДНК в ПК находятся в составе экзосом, которые со временем могут распадаться и приводить к дальнейшему высвобождению вкДНК в ПК. Разброс данных, вероятно, может быть вызван нарушением стабилизации этих комплексов и полным высвобождением вкДНК к 20 сут. хранения. При оценке степени фрагментации образцов четкой связи между количеством циклов замораживания-оттаивания и степенью деградации не обнаруживается, однако после 10 и 20 циклов прослеживаются сильная и средняя степень деградации и изменения концентрации фрагментов вкДНК в отдельных образцах.
При снижении в образцах содержания фетальной фракции увеличивается вероятность появления ложноотрицательных результатов [20], а снижение на ~5% доли выявленных трисомий по 21, 13 и 18 хромосомам описано даже после однократного замораживания ПК при -80о C [17]. Это связывают не только со снижением уровня фетальной фракции вкДНК, но и с повышением гуанин-цитозинового состава ДНК исследуемых образцов. По нашим оценкам результаты долговременного хранения при комнатной температуре, а также циклы замораживания-оттаивания приводят к увеличению ложноположительных результатов НИПТ. К ложноположительным результатам ("появление" в результатах НИПТ малых структурных перестроек) приводит хранение образцов с нормальным уровнем фетальной фракции вкДНК в ПК в течение 20 сут. при комнатной температуре. Перечисленные выше отклонения результатов НИПТ свидетельствуют о необходимости четкого соблюдения преаналитических условий работы с ПК, поскольку их несоблюдение не приводит к явному выпадению результата НИПТ, и тем самым направлению биоматериала образца на повторный забор биоматериала.
Заключение
Таким образом, контроль за соблюдением корректных условий транспортировки и хранения ПК особенно важен при проведении НИПТ при использовании пробирок с консервантами, поскольку несоблюдение преаналитических условий не всегда может привести к явному и однозначному неудовлетворительному результату при проведении НИПТ, что могло бы служить явным сигналом необходимости повторного проведения исследования; в случаях таких отклонений на преаналитическом этапе один только факт успешного проведения НИПТ не может рассматриваться в качестве надежного и достаточного критерия оценки качества ПК и вкДНК, и может привести к некорректным результатам.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Список литературы
1. Fleischhacker M, Schmidt B. Circulating nucleic acids (CNAs) and cancer–a survey. Biochim Biophys Acta. 2007;1775(1):181-232. doi:10.1016/j.bbcan.2006.10.001.
2. Moss J, Magenheim J, Neiman D, et al. Comprehensive human cell-type methylation atlas reveals origins of circulating cellfree DNA in health and disease. Nat Commun. 2018;9:5068. doi:10.1038/s41467-018-07466-6.
3. Sekizawa A, Yokokawa K, Sugito Y, et al. Evaluation of bidirectional transfer of plasma DNA through placenta. Hum Genet. 2003;113:307-10. doi:10.1007/s00439-003-0987-4.
4. Zhou Y, Zhu Z, Gao Y, et al. Effects of maternal and fetal characteristics on cell-free fetal DNA fraction in maternal plasma. Reprod Sci. 2015;22(11):1429-35. doi:10.1177/1933719115584445.
5. Tamkovich SN, Tutanov OS, Serdukov DS, et al. Protein Content of Circulating Nucleoprotein Complexes. Adv Exp Med Biol. 2016;924:133-6. doi:10.1007/978-3-319-42044-8_26.
6. Мальцева А. Р., Илларионов Р. А., Вашукова Е. С. и др. Инвентаризация и контроль качества "Коллекции биообразцов от беременных женщин на разных сроках гестации для поиска ранних биомаркеров осложнений беременности". Кардиоваскулярная терапия и профилактика. 2023;22(11):3740. doi:10.15829/1728-8800-2023-3740.
7. Morshneva A, Kozyulina P, Vashukova E, et al. Pilot screening of cellfree mtDNA in NIPT: Quality control, variant calling, and haplogroup determination. Genes. 2021;12(5). doi:10.3390/genes12050743.
8. Кондрацкая В. А., Покровская М. С., Долудин Ю. В. и др. Влияние преаналитических переменных на качество внеклеточной ДНК. Биобанкирование материала для выделения внеклеточной ДНК. Кардиоваскулярная терапия и профилактика. 2021;20(8):3114. doi:10.15829/1728-8800-2021-3114.
9. Вашукова Е. С., Тарасенко О. А., 15. Талантова О. Е. и др. Создание биоресурсной коллекции компонентов крови беременных женщин для выявления генетических особенностей плода, а также для поиска генетических 16. маркеров гестационных осложнений. Кардиоваскулярная терапия и профилактика. 2023;22(11):3742. doi:10.15829/1728-8800-2023-3742.
10. Bronkhorst AJ, Aucamp J, Pretorius PJ. Cell-free DNA: Preanalytical variables. Clin Chim Acta. 2015;450:243-53. doi:10.1016/j.cca.2015.08.028.
11. Meddeb R, Pisareva E, Thierry AR. Guidelines for the Preanalytical Conditions for Analyzing Circulating Cell-Free DNA. Clin Chem. 2019;65(5):623-33. doi:10.1373/clinchem.2018.298323.
12. Trigg RM, Martinson LJ, Parpart-Li, et al. Factors that influence quality and yield of circulating-free DNA: A systematic review of the methodology literature. Heliyon. 2018;4(7):e00699. doi:10.1016/j.heliyon.2018.e00699.
13. El Messaoudi S, Rolet F, Mouliere F, et al. Circulating cell free DNA: Preanalytical considerations. Clin Chim Acta. 2013;424:222-30. doi:10.1590/s2175-97902018000117368.
14. Sozzi G, Roz L, Conte D, et al. Effects of prolonged storage of whole plasma or isolated plasma DNA on the results of circulating DNA quantification assays. J Natl Cancer Inst. 2005;97(24):1848-50. doi:10.1093/jnci/dji432.
15. Shaw JA, Page K, Blighe K, et al. Genomic analysis of circulating cell-free DNA infers breast cancer dormancy. Genome Res. 2012;22(2):220-31. doi:10.1101/gr.123497.111.
16. Chan KC, Yeung SW, Lui WB, et al. Effects of preanalytical factors on the molecular size of cell-free DNA in blood. Clin Chem. 2005;51:781-4. doi:10.1373/clinchem.2004.046219.
17. Xie X, Li F, Tan W, et al. The Effect of Freezing on Non-invasive Prenatal Testing. Sci Rep. 2019;9(1):6962. doi:10.1038/s41598-019-42980-7.
18. Wang E, Batey A, Struble C, et al. Gestational age and maternal weight effects on fetal cell-free DNA in maternal plasma. Prenat Diagn. 2013;33(7):662-6. doi:10.1002/pd.4119.
19. Fernando MR, Jiang C, Krzyzanowski GD, et al. New evidence that a large proportion of human blood plasma cell-free DNA is localized in exosomes. PLOS ONE. 2017;12(8):e0183915. doi:10.1371/journal.pone.0183915.
20. Johansson LF, de Boer EN, de Weerd HA, et al. Novel Algorithms for Improved Sensitivity in Non-Invasive Prenatal Testing. Sci Rep. 2017;7:1838. doi:10.1038/s41598-017-02031.
Об авторах
П. В. УлановаРоссия
Биолог.
Москва
А. Н. Антоненко
Россия
специалист по высокопроизводительному секвенированию.
Москва
Е. А. Доморацкая
Россия
биолог.
Москва
Р. О. Белов
Россия
Специалист по высокопроизводительному секвенированию.
Москва
А. А. Золотопуп
Россия
Специалист по высокопроизводительному секвенированию.
Москва
В. С. Леонова
Россия
Врач-лабораторный генетик.
Москва
А. А. Криницына
Россия
к.б.н., зам. зав. Лаборатории.
Москва
М. С. Беленикин
Россия
к.х.н., зав. лаборатории, директор по научно-исследовательской работе.
Москва
Дополнительные файлы
Что известно о предмете исследования?
- Преаналитические факторы обработки и хранения плазмы крови (ПК) имеют непосредственное влияние на проведение исследований внеклеточной дезоксирибонуклеиновой кислоты (вкДНК).
- Не определены четкие границы максимально допустимого превышения циклов замораживания-оттаивания и времени хранения ПК при использовании стабилизирующих пробирок с консервантом в сравнении с пробирками с ЭДТА для целей неинвазивного пренатального тестирования (НИПТ).
Что добавляют результаты исследования?
- НИПТ с использованием пробирок со стабилизирующим составом для сбора образцов при несоблюдении преаналитических факторов хранения ПК (продолжительное хранение и многоцикличное замораживание-оттаивание) не может рассматриваться достаточным критерием оценки хорошего качества преаналитической обработки ПК.
- В большинстве работ, описывающих манипуляции с вкДНК, рекомендуется однократное замораживание-оттаивание ПК (что связано с использованием пробирок с ЭДТА); однако проведенные исследования с ПК, стабилизированной в пробирках с консервантом, позволяют сделать предположение о корректировке этих параметров (продолжительное хранение и многоцикличное замораживание-оттаивание) в сторону увеличения.
Рецензия
Для цитирования:
Уланова П.В., Антоненко А.Н., Доморацкая Е.А., Белов Р.О., Золотопуп А.А., Леонова В.С., Криницына А.А., Беленикин М.С. Влияние многоцикличного замораживания-оттаивания плазмы крови на результаты проведения неинвазивного пренатального тестирования. Кардиоваскулярная терапия и профилактика. 2024;23(11):4172. https://doi.org/10.15829/1728-8800-2024-4172. EDN: GQSUNI
For citation:
Ulanova P.V., Antonenko A.N., Domoratskaya E.A., Belov R.O., Zolotopup A.A., Leonova V.S., Krinitsina A.A., Belenikin M.S. Effect of multiple plasma freeze-thaw cycles on non-invasive prenatal testing. Cardiovascular Therapy and Prevention. 2024;23(11):4172. (In Russ.) https://doi.org/10.15829/1728-8800-2024-4172. EDN: GQSUNI

























































