Перейти к:
Комплексная модель многофакторного прогнозирования жизнеугрожающих желудочковых нарушений ритма у больных инфарктом миокарда
https://doi.org/10.15829/1728-8800-2025-4215
EDN: OODLYB
Аннотация
Цель. Выявление маркеров развития пробежек желудочковой тахикардии (ЖТ), создание многофакторной модели прогнозирования аритмических событий у больных инфарктом миокарда (ИМ) на госпитальном этапе.
Материал и методы. Объектом исследования стали 80 больных ИМ в возрасте 55,6±8,7 лет. Обследование проводили на 7-9 сут. ИМ: эхокардиография, оценка глобальной продольной деформаци (GLS), магнитно-резонансная томография (МРТ) сердца с применением внутривенного контрастного вещества, определение концентрации N-концевого промозгового натрийуретического пептида (NT-proBNP). При многосуточном мониторировании электрокардиограммы (ММ ЭКГ) в течение 72 ч выявляли пробежки ЖТ, выполнялся анализ микровольтной альтернации зубца Т (МАТ), турбулентности сердечного ритма, поздних потенциалов желудочка, вариабельности сердечного ритма, хронотропной нагрузки сердца, дисперсии QT. Конечной точкой считали наличие ≥1 эпизода ЖТ (≥3 комплекса QRS) по данным ММ ЭКГ.
Результаты. У 10 (12,5%) больных, которые составили группу "ЖТ", были зарегистрированы неустойчивые пробежки ЖТ. Остальные 70 (87,5%) человек, не имевших эпизодов ЖТ, вошли в группу сравнения — "С". По данным МРТ установлено, что масса рубцовой ткани — 36,8±23,7 г и её процентное содержание — 28,5±19,8% в группе "ЖТ" было выше, чем в группе "С" — 16,9 (6,5; 27,9) г (р=0,025) и 13,3 (5,8; 22,2)% (р=0,045), соответственно.
По данным однофакторного регрессионного анализа установлены факторы, ассоциированные с риском ЖТ: ишемическая болезнь сердца в анамнезе, высокие значения NT-proBNP, турбулентности сердечного ритма, МАТ, конечный диастолический размер, GLS, масса рубцовой ткани, рубцовая зона от общей массы миокарда (%), параметры вариабельности сердечного ритма в ночные часы — ULfP, TINN, SDANN.
Заключение. Предложена многофакторная модель прогнозирования неустойчивой ЖТ у больных ИМ, включающая следующие параметры: конечный диастолический размер, МАТ, NT-proBNP, GLS, массу рубцовой ткани и наличие ишемической болезни сердца в анамнезе.
Ключевые слова
Для цитирования:
Аверьянова Е.В., Тонкоглаз А.А., Чернова А.А., Донецкая Н.А., Олейников В.Э. Комплексная модель многофакторного прогнозирования жизнеугрожающих желудочковых нарушений ритма у больных инфарктом миокарда. Кардиоваскулярная терапия и профилактика. 2025;24(1):4215. https://doi.org/10.15829/1728-8800-2025-4215. EDN: OODLYB
For citation:
Averyanova E.V., Tonkoglaz A.A., Chernova A.A., Donetskaya N.A., Oleynikov V.E. Complex multifactorial prediction model for life-threatening ventricular arrhythmias in patients with myocardial infarction. Cardiovascular Therapy and Prevention. 2025;24(1):4215. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4215. EDN: OODLYB
Введение
Начало ХХI века ознаменовалось значительными достижениями в лечении инфаркта миокарда (ИМ), во многом обусловленными широким распространением первичного чрескожного коронарного вмешательства (ЧКВ) и внедрением стратегии ранней реваскуляризации. Это в свою очередь позволило значительно снизить показатели летальности. По данным Росстата смертность от ИМ на территории РФ постепенно уменьшилась с 44,6 случаев/100 тыс. населения в 2005г до 34,2 случаев/100 тыс. населения в 2022г [1][2].
Пациенты, перенесшие ИМ, по-прежнему, подвержены высокому риску развития внезапной сердечной смерти (ВСС), субстратом которой являются структурные изменения миокарда, способствующие развитию жизнеугрожающих желудочковых нарушений ритма (ЖНР) [3][4]. Согласно данным крупного исследования VALIANT (Valsartan in Acute Myocardial Infarction Trial) риск развития ВСС, несмотря на оптимальную медикаментозную терапию, остается наиболее высоким в течение первых 90 сут. после ИМ [5]. В ряде исследований было продемонстрировано, что частота ВСС в течение месяца после перенесенного ИМ колеблется в пределах 1,2-3,6% [6][7].
В связи с этим своевременная идентификация больных ИМ с высоким риском развития ВСС, позволяющая индивидуализировать тактику лечения еще на стационарном этапе лечения, является важной задачей [8]. Вопрос осложняется тем, что ЖНР имеют преходящий характер, поэтому далеко не всегда удается их зарегистрировать при стандартном холтеровском мониторировании электрокардиограммы (ЭКГ). Безусловно, увеличение продолжительности регистрации ЭКГ в условиях многосуточного мониторирования (ММ) ЭКГ существенно повышает вероятность регистрации ЖНР, однако данный метод, как правило, малодоступен для больных ввиду разных причин, в т.ч. неудобства в ношении аппарата в течение нескольких дней, отсутствия и нехватки аппаратуры для проведения мониторинга [9].
Представляет интерес разработка комплексного способа многофакторного прогнозирования ЖНР у больных ИМ, который учитывал бы анамнестические данные, результаты лабораторных и инструментальных методов обследования, в т.ч. оценку морфологии и функции сердца (магнитно-резонансная томография — МРТ, эхокардиография — ЭхоКГ), электрическую нестабильность миокарда. Это позволило бы своевременно и точно стратифицировать риски больных и персонализировать профилактические мероприятия, что в свою очередь способствовало бы снижению риска ВСС и улучшению качества жизни больных, перенесших ИМ.
Цель настоящего исследования заключается в идентификации маркеров развития желудочковой тахикардии (ЖТ), полученных при комплексной оценке состояния миокарда, и создании на их основе многофакторной модели риска аритмических событий на госпитальном этапе у больных, перенесших ИМ.
Материал и методы
Открытое одноцентровое проспективное исследование было одобрено локальным этическим комитетом (протокол заседания №5 от 28.01.2022г) и проводилось в кардиологическом отделении с палатой реанимации и интенсивной терапии. Использовали следующие критерии включения: возраст 30-70 лет; первичный ИМ с подъемом и без подъема сегмента ST, подтвержденный 12-канальной ЭКГ, наличием инфаркт-связанной артерии по данным коронароангиографии и диагностически значимым повышением уровня тропонина I. Основные критерии невключения: повторный/рецидивирующий ИМ, стеноз ствола левой коронарной артерии >30%, хроническая сердечная недостаточность III-IV функциональных классов по NYHA (New York Heart Association) в анамнезе; врожденные и приобретенные пороки сердца, индекс массы тела (ИМТ) ≥35 кг/м2, инсулинопотребный сахарный диабет, тяжелые сопутствующие заболевания в стадии декомпенсации. Все пациенты подписали информированное согласие и включены в исследование на 4-7 сут. ИМ.
В исследование включено 80 больных ИМ. Средний возраст больных составил 55,6±8,7 лет, среди них преобладали мужчины — 91,3%. Процедуре первичного ЧКВ были подвергнуты 52 (65%) человека, фармакоинвазивная стратегия проводилась у 26 (32,5%) пациентов, у 2 больных реваскуляризация не осуществлялась из-за задержки с обращением за медицинской помощью. Все пациенты получали лекарственную терапию согласно действующим клиническим рекомендациям [10][11].
При поступлении определяли уровень тропонина I высокочувствительным методом на анализаторе Architect i2000 (Abbott Laboratories, США). На 7-9 сут. на анализаторе BECKMAN COULTER AU680 (Olympus, Япония) исследовали значения N-концевого промозгового натрийуретического пептида (NT-proBNP), креатинина, рассчитывали скорость клубочковой фильтрации (СКФ) по CKD-EPI.
Инструментальные обследования проводили на 7-9 сут. ИМ. ЭхоКГ выполняли на ультразвуковом сканере Vivid GE 95 Healthcare c анализом изображений при помощи программного обеспечения EchoPAC версии 202 (GE Healthcare). Определяли общепринятые объемные параметры: конечный диастолический размер (КДР), конечный систолический размер (КСР), конечный диастолический объём (КДО), конечный систолический объём (КСО), рассчитывали фракцию выброса (ФВ) по методу Симпсона и индекс массы миокарда левого желудочка (ИММЛЖ). С применением методики спекл-трекинг ЭхоКГ оценивали глобальную продольную деформацию (GLS, %).
МРТ сердца проводили на томографе GE SIGNA Voyager (GE HealthCare, США) с применением внутривенного контрастного вещества Кларискан (гадотеровая кислота, GE Healthcare) c напряженностью поля 1,5 Тл. Для оценки функциональных и морфологических характеристик миокарда использовали кино-режим МРТ в стандартных проекциях, методики Т1-, Т2- и Т2*-картирования. Отсроченное контрастирование оценивали при помощи программы 2D MDE на 7 и 10 мин. Анализ МР-изображений проводили с использованием программного обеспечения CVI42 (Circle Cardiovascular Imaging Inc.). Изучали следующие показатели: общую массу ишемического повреждения с идентификацией рубцовой ткани и периинфарктной гетерогенной зоны, а также их размеры относительно массы миокарда ЛЖ.
ММ ЭКГ в течение 72 ч осуществляли при помощи комплекса телеметрической регистрации ЭКГ "АСТРОКАРД® — ТЕЛЕМЕТРИЯ" (ЗАО "Медитек", Россия). При анализе записей проводилась оценка нарушений ритма и проводимости, эпизодов депрессии и элевации сегмента ST, микровольтной альтернации зубца Т (МАТ), турбулентности сердечного ритма (ТСР), поздних потенциалов желудочка (ППЖ), вариабельности сердечного ритма (ВСР), хронотропной нагрузки сердца, дисперсии QT [9].
Конечной точкой считали регистрацию пробежек ЖТ (≥3 комплекса QRS за 72-часовой период по данным ММ ЭКГ.
Статистическая обработка данных проводилась с использованием программы Statistica 13.0 (StatSoftInc., США). Данные, соответствующие критериям нормального распределения, представлены как среднее и стандартное отклонение (M±SD). Параметры, отличные от симметричного распределения, описаны в виде медианы (Me) и интерквартильного размаха (Q25; Q75). При сравнении количественных значений показателей, соответствующих нормальному распределению, использовали критерий Стьюдента, для показателей с распределением, отличным от нормального, — критерий Манна-Уитни. Для сопоставления качественных величин применяли χ2 для несвязанных выборок. За порог статистической значимости принимали р<0,05. Для выявления параметров, влияющих на развитие конечной точки, применяли метод однофакторного регрессионного анализа с определением относительного риска (RR — relative risk) и его 95% доверительного интервала (ДИ). Включение показателей в многофакторную модель при помощи метода множественной логистической регрессии по Коксу осуществлялось в случае отсутствия корреляционной взаимосвязи. Оценка качества предложенного алгоритма проверялась ROC-анализом, расчетом площади под ROC-кривой (AUC — Area Under the ROC Curve), определением чувствительности (Sen), специфичности (Sp), диагностической точности (De).
Исследование выполнено за счет гранта Российского научного фонда "Ранние предикторы осложненного течения ближайшего и отдаленного постинфарктного периода" № 24-25-20088, https://rscf.ru/project/24-25-20088.
Результаты
По результатам ММ ЭКГ за 72 ч неустойчивые пробежки ЖТ были зарегистрированы у 10 (12,5%) из 80 больных, которые составили группу "ЖТ". Пробежки устойчивых ЖТ у больных зафиксированы не были. Остальные 70 (87,5%) человек, не имевших эпизодов ЖТ вошли в группу сравнения — "С". Стоит отметить, что у 90% больных ЖТ зафиксирована на 2 и 3 сут. ММ ЭКГ. Так, у 5 (50%) аритмия выявлена на 3 сут. мониторирования, у 4 (40%) — на 2 сут., только у 1 (10%) пациента пароксизм зарегистрирован в первые 24 ч.
Группы "С" и "ЖТ" не различались по отдельным антропометрическим, клинико-анамнестическим и лабораторным параметрам. Также не было выявлено межгрупповых различий в используемой тактике реваскуляризации и ее временных интервалах. В группе "ЖТ" зафиксированы более высокие значения NT-proBNP (таблица 1).
Сравнительная характеристика проводимого медикаментозного лечения в обеих группах представлена в таблице 2.
При анализе показателей ЭхоКГ в группе "ЖТ" были выявлены более высокие значения КДР и ИММ ЛЖ по сравнению с группой "С" (таблица 3). В группе "С" сохраненная ФВ (≥50%) была зарегистрирована у 46 (65,7%) пациентов, умеренно сниженная ФВ (41-49%) — у 16 (22,9%) человек, низкая ФВ — у 8 (11,4%) больных. В то время как в группе "ЖТ" 9 (90%) человек имели ФВ ≥50% и только 1 (10%) больной — умеренно сниженную ФВ.
Результаты МРТ сердца с внутривенным контрастированием продемонстрировали, что масса рубцовой ткани и её процентное содержание от общей массы миокарда в группе "ЖТ" значительно превышало таковые в группе сравнения (таблица 4).
При сравнительном анализе данных ММ ЭКГ в группе "ЖТ" были зафиксированы более высокие показатели МАТ, чем в группе "С", значения которой составили 49,5 (38,4; 68,1) и 35,4 (28,6; 40,6) мкВ соответственно (р=0,002). Патологическая ТСР была выявлена у 14 человек группы "С" (20%) и у 3 пациентов группы "ЖТ" (30%), при этом различия не достигли статистической значимости (р=0,757). ППЖ были зафиксированы у 2 (2,9%) больных в группе "С" и у 2 (20%) пациентов группы "ЖТ". И хотя частота ППЖ во второй группе была выше, статистически значимых различий также не было выявлено (р=0,121). Оценка временных и спектральных параметров ВСР, показателей хронотропной нагрузки и дисперсии интервала QT не продемонстрировала межгрупповых различий.
Все вышеописанные параметры были включены в однофакторный регрессионный анализ, в результате которого были выявлены следующие детерминанты, характеризующие риск развития ЖТ: ишемическая болезнь сердца (ИБС) в анамнезе, высокие значения NT-proBNP, ULfP (ультранизкочастотный компонент) (ночь), SDANN (средний показатель стандартной погрешности для всех синусовых RR-интервалов за каждые 5 мин в течение сут.) (ночь), ТСР, МАТ, КДР, GLS, масса рубцовой ткани, рубцовая зона от общей массы миокарда (%) (таблица 5).
На основании полученных данных с учетом корреляционных взаимосвязей при помощи метода пошагового включения переменных была создана многофакторная регрессионная модель риска развития ЖТ у больных с ИМ, в которую вошли: ИБС в анамнезе, высокие значения NT-proBNP, МАТ, КДР, GLS, масса рубцовой ткани (таблица 6) (F=7,6859, p=0,0000036). Математическая модель, построенная для прогнозирования неустойчивых ЖТ у больных ИМ на госпитальном этапе, имеет вид:
в которой z=-1,359+0,214×Х1+0,237×Х2-0,233×Х3+ 0,397×Х4-0,268×Х5+0,261×Х6,
где: Х1 — ИБС в анамнезе (качественно — 1/0); Х2 — NT-proBNP, пг/мл; Х3 — МАТ, мкВ; Х4 — КДР, мм; Х5 — GLS, %; Х6 — масса рубцовой ткани, г.
С помощью ROC-анализа проведена оценка качества данной многофакторной модели: AUC =0,960±0,025 c 95% ДИ: 0,911-1,0 (рисунок 1), чувствительность способа составила 70%, специфичность 100%, диагностическая точность 95,71%.
С помощью ROC-анализа проведена оценка качества данной многофакторной модели: AUC= 0,960±0,025 c 95% ДИ: 0,911-1,0 (рисунок 1), Sen способа составила 70%, Sp — 100%, De — 95,71%.
Таблица 1
Сравнительная характеристика групп "С" и "ЖТ"
Показатель | Группа "С" (n=70) | Группа "ЖТ" (n=10) | р |
Возраст, лет, Me (Q25; Q75) | 57,5 (51; 61) | 59 (57; 62) | 0,387 |
Мужчины/женщины, n (%) | 63 (90)/7 (10) | 10 (100)/0 (0) | 0,654 |
ИМТ, кг/м2, M±SD | 27,5±3,7 | 28,3±4,6 | 0,536 |
ИБС в анамнезе, n (%) | 21 (30) | 5 (50) | 0,367 |
АГ в анамнезе, n (%) | 51 (72,9) | 8 (80) | 0,924 |
Длительность АГ, лет, Me (Q25; Q75)/M±SD | 4 (2; 8) | 7,2±3,7 | 0,122 |
Отягощенная наследственность, n (%) | 22 (31,4) | 4 (40) | 0,857 |
Курение, n (%) | 55 (78,6) | 7 (70) | 0,840 |
СД 2 типа неинсулинопотребный, n (%) | 4 (5,7) | 0 (0) | 1,000 |
Первичное ЧКВ, n (%) | 46 (65,7) | 6 (60) | 1,000 |
Фармакоинвазивная стратегия, n (%) | 22 (31,4) | 4 (40) | 0,857 |
Без реваскуляризации, n (%) | 2 (2,9) | 0 (0) | 0,589 |
Время "боль-ТЛТ", мин, Me (Q25; Q75)/M±SD | 120 (60; 240) | 73,8±44,9 | 0,292 |
Время "боль-ЧКВ", мин, Me (Q25; Q75) | 285 (170; 620) | 228,5 (150; 380) | 0,368 |
ИМ передней/задней стенки ЛЖ, n (%) | 37 (52,9)/33 (47,1) | 7 (70)/3 (30) | 0,497 |
вчТнI, пг/мл, Me (Q25; Q75) | 25673,8 (9526; 57216,6) | 22504,6 (9200; 27017) | 0,766 |
NT-proBNP, пг/мл, Me (Q25; Q75) | 152 (51,2; 341,1) | 322,9 (222,8; 364,2) | 0,03 |
Креатинин, мкмоль/мл, Me (Q25; Q75) | 87,7 (74,8; 99,4) | 93,03±22,67 | 0,218 |
рСКФ (CKD-EPI), мл/мин/1,73 м2, M±SD | 83,02±15,78 | 79,68±20,16 | 0,548 |
Сердечная недостаточность по Killip ≥2 класс, n (%) | 7 (10) | 2 (20) | 0,264 |
Примечание: АГ — артериальная гипертензия, вчТнI — тропонин I, определенный высокочувствительным методом, "ЖТ" — группа с желудочковой тахикардией, ИБС — ишемическая болезнь сердца, ИМТ — индекс массы тела, ЛЖ — левый желудочек, рСКФ (CKD-EPI) — скорость клубочковой фильтрации по формуле CKD-EPI, "С" — группа сравнения, СД — сахарный диабет, ТЛТ — тромболитическая терапия, ЧКВ — чрескожное коронарное вмешательство, M±SD — среднее±стандартное отклонение, Me (Q25; Q75) — медиана (интерквартильный размах), NT-proBNP — N-концевой промозговой натрийуретический пептид.
Таблица 2
Медикаментозная терапия в группах сравнения
Показатель, n (%) | Группа "С" (n=70) | Группа "ЖТ" (n=10) | р |
Статины | 70 (100) | 10 (100) | 1,000 |
Двойная антиагрегантная терапия | 70 (100) | 10 (100) | 1,000 |
β-адреноблокаторы | 63 (90) | 10 (100) | 0,654 |
Ингибиторы ангиотензинпревращающего фермента/сартаны | 67 (95,7) | 10 (100) | 0,824 |
Антагонисты кальция | 10 (14,29) | 2 (20) | 1,000 |
Диуретики | 13 (18,57) | 3 (30) | 0,673 |
Примечание: "ЖТ" — группа с желудочковой тахикардией, "С" — группа сравнения.
Таблица 3
Сравнительная характеристика ЭхоКГ параметров в группах "С" и "ЖТ"
Показатель | Группа "С" (n=70) | Группа "ЖТ" (n=10) | р |
КДР, мм, M±SD | 49,7±6,4 | 54,3±6,3 | 0,036 |
КСР, мм, Me (Q25; Q75)/M±SD | 34 (30; 38) | 37,0±7,7 | 0,247 |
КДО, мл, M±SD | 115,1±33,6 | 121,4±35,9 | 0,584 |
КСО, мл, Me (Q25; Q75)/M±SD | 49,5 (36; 68) | 54,1±18,5 | 0,936 |
иКДО, мл/м2, M±SD | 58,8±16,1 | 60,1±19,3 | 0,817 |
иКСО, мл/м2, Me (Q25; Q75)/M±SD | 25,1 (19,2; 34,3) | 26,8±9,7 | 0,890 |
ФВ ЛЖ, %, Me (Q25; Q75)/M±SD | 55 (47; 62) | 54,9±10,7 | 0,621 |
ИММЛЖ, г/м2, Me (Q25; Q75)/M±SD | 105 (90,9; 120,1) | 131,7±31,9 | 0,034 |
GLS, %, M±SD | -15,1±5,5 | -17,1±5,9 | 0,293 |
Примечание: "ЖТ" — группа с желудочковой тахикардией, иКДО — индекс конечно-диастолического объема, иКСО — индекс конечно-систолического объема, ИММЛЖ — индекс массы миокарда левого желудочка (ЛЖ), КДО — конечный диастолический объём, КДР — конечный диастолический размер, КСО — конечный систолический объём, КСР — конечный систолический размер, "С" — группа сравнения, ФВ — фракция выброса, GLS — глобальная продольная деформация, M±SD — среднее±стандартное отклонение, Me (Q25; Q75) — медиана (интерквартильный размах).
Таблица 4
Сравнительная характеристика морфологических параметров по данным МРТ в группах "С" и "ЖТ"
Показатель | Группа "С" (n=70) | Группа "ЖТ" (n=10) | р |
Масса ишемического повреждения, г, | 29,4 (10,8; 47,6) | 41,7±18,2 | 0,163 |
Масса рубцовой ткани, г, Me (Q25; Q75)/M±SD | 16,9 (6,5; 27,9) | 36,8±23,7 | 0,025 |
Масса периинфарктной зоны, г, Me (Q25; Q75)/M±SD | 11,0 (6,1; 17,5) | 15,9±6,9 | 0,116 |
Рубцовая зона от общей массы миокарда, %, | 13,3 (5,8; 22,2) | 28,5±19,8 | 0,045 |
Периинфарктная зона от общей массы миокарда, %, | 8,3 (4,4;13,9) | 12,5±6,4 | 0,165 |
Рубцовая зона от общей массы ишемического | 55,6±18,4 | 61,2±17,1 | 0,418 |
Примечание: "ЖТ" — группа с желудочковой тахикардией, МРТ — магнитно-резонансная томография, "С" — группа сравнения, M±SD — среднее±стандартное отклонение, Me (Q25; Q75) — медиана (интерквартильный размах).
Таблица 5
Факторы, ассоциированные с риском развития желудочковой тахикардии у больных ИМ
Показатель | χ2 | RR (95% ДИ) | р |
ИБС в анамнезе | 1,866 | 2,373 (1,687-8,204) | 0,016 |
NT-proBNP | 3,861 | 1,001 (1-1,001) | 0,049 |
TINN, ночь | 7,493 | 0,975 (0,957-0,993) | 0,006 |
ULfP, ночь | 5,638 | 1,001 (1-1,002) | 0,018 |
SDANN, ночь | 4,902 | 0,851 (0,738-0,982) | 0,027 |
Патологическая ТСР | 0,466 | 1,412 (1,032-5,264) | 0,049 |
МАТ | 6,934 | 0,947 (0,904-0,985) | 0,008 |
КДР | 3,811 | 1,093 (1,002-1,195) | 0,041 |
GLS | 0,981 | 0,939 (0,831-0,996) | 0,032 |
Mасса рубцовой ткани, г | 3,536 | 1,019 (1,002-1,039) | 0,04 |
Примечание: ДИ — доверительный интервал, ИБС — ишемическая болезнь сердца, ИМ — инфаркт миокарда, КДР — конечный диастолический размер, МАТ — микровольтная альтернация зубца Т, ТСР — турбулентность сердечного ритма, GLS — глобальная продольная деформация, NT-proBNP — N-концевой промозговой натрийуретический пептид, RR — relative risk (относительный риск), SDANN — средний показатель стандартной погрешности для всех синусовых RR-интервалов за каждые 5 мин в течение сут., TINN — индекс триангулярной интерполяции гистограммы RR-интервалов, ULfP — ультранизкочастотный компонент.
Таблица 6
Многофакторная модель прогнозирования ЖТ у больных ИМ
Переменная | RR (95% ДИ) | р |
ИБС в анамнезе | 1,173 (1,033-4,475) | 0,039 |
NT-proBNP | 0,971 (0,908-1,000) | 0,045 |
МАТ | 0,957 (0,902-0,995) | 0,028 |
КДР | 0,903 (0,880-0,958) | 0,0003 |
GLS | 0,944 (0,859-0,999) | 0,014 |
Масса рубцовой ткани | 1,012 (1,002-1,057) | 0,041 |
Примечание: ДИ — доверительный интервал, ЖТ — желудочковая тахикардия, ИБС — ишемическая болезнь сердца, ИМ — инфаркт миокарда, КДР — конечный диастолический размер, МАТ — микровольтная альтернация зубца Т, GLS — глобальная продольная деформация, NT-proBNP — N-концевой промозговой натрийуретический пептид, RR — relative risk (относительный риск).
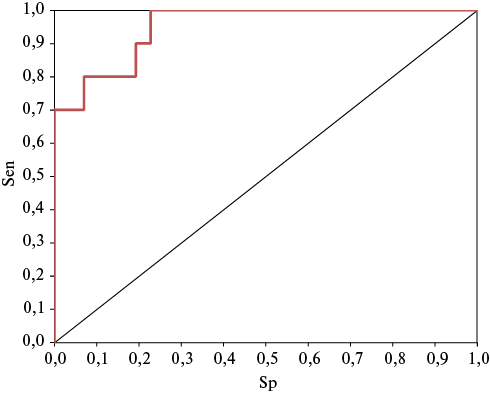
Рис. 1 ROC-кривая, построенная для многофакторной модели прогнозирования неустойчивых ЖТ у больных ИМ на госпитальном этапе.
Примечание: ЖТ — желудочковая тахикардия, ИМ — инфаркт миокарда, Sen — чувствительность, Sp — специфичность.
Обсуждение
ЖНР — наиболее частая причина смерти больных ИМ [12]. По данным Глобального регистра острых коронарных событий (GRACE — Global Registry of Acute Coronary Events) ЖНР выявляются у 4,9-11,7% пациентов с ИМ [12]. Своевременное выявление лиц высокого риска ВСС является важной задачей, осложняющейся преходящим характером аритмий. Зафиксировать ЖНР на стандартной ЭКГ и суточном холтеровском мониторировании удается нечасто, поэтому увеличение времени регистрации существенно увеличивает вероятность детекции аритмии. По данным настоящего исследования ММ ЭКГ позволяет выявить ЖНР у 12,5% больных ИМ, в то время как суточное мониторирование только у 1,25% лиц.
Методы неинвазивной оценки электрофизиологической гетерогенности сердечной мышцы у больных ИМ стали доступны при совершенствовании обработки ЭКГ-сигнала. Различными исследовательскими группами проводился анализ ценности ТСР, ВСР, ППЖ, дисперсии QT, МАТ в прогнозировании аритмических событий, в т.ч. у лиц, перенесших ИМ [13]. В проспективном исследовании Hoshida К, et al. была выявлена взаимосвязь между МАТ, ТСР и аритмическими событиями у пациентов после ИМ [14]. По нашим данным, факторами, ассоциированными с ЖНР у пациентов в острый период ИМ стали параметры ВСР TINN (индекс триангулярной интерполяции гистограммы RR-интервалов), SDANN, ULfP (ультранизкочастотный компонент) в ночные часы, патологическая ТСР, МАТ.
Морфология и электрофизиология сердца тесно связаны, что особенно актуально у больных ИМ, поскольку острая сердечно-сосудистая катастрофа ведет к быстрой значительной трансформации структуры миокарда и формированию субстрата электрической нестабильности. ЭхоКГ и МРТ являются взаимодополняющими инструментами визуализации миокарда, позволяющими оценить его морфофункциональное состояние после ИМ.
Одним из часто используемых в клинической практике маркеров высокого аритмического риска является низкая ФВ ЛЖ [15]. Nikoo МН, et al. исследовали возможность применения GLS, как альтернативы ФВ, в качестве предиктора развития желудочковых нарушений ритма. Авторы продемонстрировали, что значения GLS >-7,2 см/с способны прогнозировать риск развития ЖТ/фибрилляции желудочков с Sen и Sp, превосходящими ФВ ЛЖ. Однако в данное исследование не были включены пациенты, перенесшие ИМ в ближайшие 3 мес. Изучив прогностическое значение GLS в оценке вероятности развития ЖНР в остром периоде ИМ, авторы сообщили о независимой роли GLS в стратификации риска ВСС у данной когорты больных [16]. По результатам наших данных GLS, наряду со стандартно определяемым параметром КДР, также являлись предикторами ЖНР.
Уникальным методом исследования, позволяющим подробно оценить особенности структурного состояния сердечной мышцы после ИМ, является МРТ сердца с контрастным усилением гадолиния. Группа Weissler-Snir A, et al. выявила, что большее накопление гадолиния ассоциируется с частыми пробежками неустойчивых ЖТ [17]. Alexandre J, et al., проведя одноцентровое ретроспективное исследование, сообщили, что масса рубцовой ткани, её процентное содержание от общей массы миокарда, а также трансмуральность рубца могут быть независимыми факторами в выявлении подгруппы пациентов с ИБС с повышенным риском развития ЖНР [18]. Guo D, et al. установили, что у больных ИМ с ЖНР регистрировалась бóльшая масса рубцовой зоны, чем у пациентов без данных аритмий [19]. В настоящем исследовании выявлено, что масса рубцовой зоны является маркером развития желудочковых нарушений, в то время как периинфарктная зона и область ишемического повреждения не продемонстрировали прогностической ценности.
Таким образом, по результатам настоящего исследования, основу построения многофакторной модели риска ЖНР у больных в острый период ИМ составили параметры, характеризующие морфологические и электрофизиологические особенности миокарда, в совокупности с данными анамнеза и лабораторного обследования. На наш взгляд, данная комплексная модель перспективна для индивидуализации лечебной тактики и способствует проведению своевременных профилактических мер, что позитивно влияет на прогноз.
Ограничения исследования. В исследование были включены пациенты с первичным ИМ, гемодинамически значимым стенозом только инфаркт-связанной коронарной артерии, без хронической сердечно недостаточности в анамнезе. Критерии включения и эффективная реваскуляризация, возможно, оказали влияние на частоту появления ЖТ.
Заключение
Таким образом, полученные результаты продемонстрировали, что ММ ЭКГ у больных ИМ в 10 раз увеличивает шансы фиксации неустойчивых пробежек ЖТ.
На основании широкого спектра полученных данных лабораторно-инструментальных исследований и клинико-анамнестических характеристик построена многофакторная модель риска неустойчивой ЖТ, включающая следующие параметры: КДР, МАТ, NT-proBNP, GLS, массу рубцовой ткани по данным МРТ и наличие ИБС в анамнезе.
Применение данной модели в клинической практике, по мнению авторов, позволит существенно улучшить стратификацию риска и значительно улучшить идентификацию пациентов высокого риска развития неустойчивых ЖТ, что особенно важно при отсутствии возможности длительного мониторирования ЭКГ в первые сут. после ИМ.
Отношения и деятельность. Исследование выполнено за счет гранта Российского научного фонда № 24-25-20088, https://rscf.ru/project/24-25-20088.
Список литературы
1. Агеева Л. И., Александрова Г. А., Голубев Н. А. и др. Здравоохранение в России. 2021: Стат.сб./Росстат. М., 2021. 171 с. https://rosstat.gov.ru.
2. Александрова Г. А., Ахметзянова Р. Р., Голубев Н. А. и др. Здравоохранение в России. 2023: Стат.сб./Росстат. М., 2023. 179 с. https://rosstat.gov.ru.
3. Haqqani HM, Marchlinski FE. Electrophysiologic substrate underlying postinfarction ventricular tachycardia: characterization and role in catheter ablation. Heart rhythm. 2009;6(8 Suppl):70-6. doi:10.1016/j.hrthm.2009.04.023.
4. Donahue JK, Chrispin J, Ajijola OA. Mechanism of Ventricular Tachycardia Occurring in Chronic Myocardial Infarction Scar. Circ Res. 2024;134(3):328-42. doi:10.1161/CIRCRESAHA.123.321553.
5. Solomon SD, Zelenkofske S, McMurray JJ, et al. Sudden death in patients with myocardial infarction and left ventricular dysfunction, heart failure, or both. New Engl J Med. 2005;352(25):2581-8. doi:10.1056/NEJMoa043938.
6. Adabag AS, Therneau TM, Gersh BJ. Sudden death after myocardial infarction. JAMA. 2008;300(17):2022-9. doi:10.1001/jama.2008.553.
7. Mäkikallio TH, Barthel P, Schneider R, et al. Frequency of sudden cardiac death among acute myocardial infarction survivors with optimized medical and revascularization therapy. Am J Cardiol. 2006;97(4):480-4. doi:10.1016/j.amjcard.2005.09.077.
8. Лебедева Н. Б., Талибуллин И. В., Темникова Т. Б. и др. Клинико-анамнестические характеристики пациентов с имплантированным кардиовертером-дефибриллятором в реальной клинической практике (данные Кузбасского регистра). Кардиология. 2021;61(8):40-7. doi:10.18087/cardio.2021.8.n1651.
9. Олейников В. Э., Рогоза А. Н., Аверьянова Е. В. и др. Преимущества многосуточного телеметрического мониторирования электрокардиограммы у пациентов, перенесших инфаркт миокарда. Кардиологический вестник. 2024;19(2):39-46. doi:10.17116/Cardiobulletin20241902139.
10. Барбараш О. Л., Дупляков Д. В., Затейщиков Д. А. и др. Острый коронарный синдром без подъема сегмента ST электрокардиограммы. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(4):4449. doi:10.15829/1560-4071-2021-4449.
11. Российское кардиологическое общество (РКО). Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4103. doi:10.15829/29/1560-4071-2020-4103.
12. Tang EW, Wong CK, Herbison P. Global Registry of Acute Coronary Events (GRACE) hospital discharge risk score accurately predicts long-term mortality post acute coronary syndrome. Am Heart J. 2007;153(1):29-35. doi:10.1016/j.ahj.2006.10.004.
13. Steinberg JS, Varma N, Cygankiewicz I, et al. 2017 ISHNE-HRS expert consensus statement on ambulatory ECG and external cardiacmonitoring/telemetry. Heart Rhythm. 2017;14(7):55-96. doi:10.1016/j.hrthm.2017.03.038.
14. Hoshida K, Miwa Y, Miyakoshi M, et al. Simultaneous assessment of T-wave alternans and heart rate turbulence on holter electrocardiograms as predictors for serious cardiac events in patients after myocardial infarction. Circ J. 2013;7(2):432-8. doi:10.1253/circj.cj-12-0789.
15. Лебедев Д. С., Михайлов Е. Н., Неминущий Н. М. и др. Желудочковые нарушения ритма. Желудочковые тахикардии и внезапная сердечная смерть. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(7):4600. doi:10.15829/1560-4071-2021-4600.
16. Nikoo MH, Naeemi R, Moarefl A, et al. Global longitudinal strain for prediction of ventricular arrhythmia in patients with heart failure. ESC Heart Fail. 2020;7(5):2956-61. doi:10.1002/ehf2.12910.
17. Weissler-Snir A, Hindieh W, Spears DA, et al. The relationship between the quantitative extent of late gadolinium enhancement and burden of nonsustained ventricular tachycardia in hypertrophic cardiomyopathy: A delayed contrast-enhanced magnetic resonance study. J Cardiovasc Electrophysiol. 2019;30(5):651-7. doi:10.1111/jce.13855.
18. Alexandre J, Saloux E, Dugué AE, et al. Scar extent evaluated by late gadolinium enhancement CMR: a powerful predictor of long-term appropriate ICD therapy in patients with coronary artery disease. J Cardiovasc Magn Reson. 2013;15(1):12. doi:10.1186/1532-429X-15-12.
19. Guo D, Hu H, Zhao Z, et al. [Value of myocardial scar in predicting malignant ventricular arrhythmia in patients with chronic myocardial infarction]. Zhejiang Da Xue Xue Bao Yi Xue Ban. 2019;48(5):511-6. Chinese. doi:10.3785/j.issn.1008-9292.2019.10.08.
Об авторах
Е. В. АверьяноваРоссия
Аверьянова Елена Владимировна — к.м.н., доцент кафедры "Терапия"
Пенза
А. А. Тонкоглаз
Россия
Тонкоглаз Анастасия Александровна — инженер-исследователь научной лаборатории "Комплексные методы изучения биомеханики и электрофизиологии сердечно-сосудистой системы"
Пенза
1.png)
А. А. Чернова
Россия
Чернова Ангелина Андреевна — аспирант очной формы обучения кафедры "Терапия"
Пенза
1.png)
Н. А. Донецкая
Россия
Донецкая Наталия Александровна — зав. отделением лучевой диагностики, врач-рентгенолог, по совмещению ассистент кафедры "Терапия"
Пенза
1.png)
В. Э. Олейников
Россия
Олейников Валентин Эливич — д.м.н., профессор, зав. кафедрой "Терапия"
Пенза
Дополнительные файлы
Что известно о предмете исследования?
- Основным механизмом танатогенеза внезапной сердечной смерти являются жизнеугрожающие желудочковые нарушения ритма.
- Желудочковые тахикардии (ЖТ) у больных инфарктом миокарда (ИМ) имеют преходящий характер, поэтому их не всегда удается зафиксировать.
Что добавляют результаты исследования?
- Определены основные факторы, ассоциированные с риском развития неустойчивых ЖТ у больных ИМ.
- Предложена комплексная многофакторная модель прогнозирования риска неустойчивой ЖТ у больных ИМ на госпитальном этапе.
Рецензия
Для цитирования:
Аверьянова Е.В., Тонкоглаз А.А., Чернова А.А., Донецкая Н.А., Олейников В.Э. Комплексная модель многофакторного прогнозирования жизнеугрожающих желудочковых нарушений ритма у больных инфарктом миокарда. Кардиоваскулярная терапия и профилактика. 2025;24(1):4215. https://doi.org/10.15829/1728-8800-2025-4215. EDN: OODLYB
For citation:
Averyanova E.V., Tonkoglaz A.A., Chernova A.A., Donetskaya N.A., Oleynikov V.E. Complex multifactorial prediction model for life-threatening ventricular arrhythmias in patients with myocardial infarction. Cardiovascular Therapy and Prevention. 2025;24(1):4215. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4215. EDN: OODLYB

























































