Перейти к:
Оценка сердечных вызванных потенциалов у пациентов с артериальной гипертензией
https://doi.org/10.15829/1728-8800-20244229
EDN: CZISDZ
Аннотация
В последние годы активно изучается интероцепция, описываемая как способность восприятия сигналов внутренних органов. Однако взаимосвязь между сердечно-сосудистыми заболеваниями и нейрофизиологическими показателями интероцепции остается мало изученной.
Цель. В настоящей работе проведено изучение нейрофизиологических маркеров интероцепции в группе пациентов с АГ. В качестве нейрофизиологических маркеров были использованы сердечные вызванные потенциалы (СВП).
Материал и методы. В исследование были включены 41 пациент с АГ (22-50 лет, 80,5% принимали гипотензивную терапию) и 41 человек из группы контроля (26-50 лет), сопоставимые по полу и возрасту. Интероцепцию исследовали на поведенческом уровне с помощью оценки точности ощущений сердцебиений (ТОС) в тесте с нажатием и на нейрональном уровне с применением метода электроэнцефалографии для регистрации СВП. Участники заполняли опросник "Торонтская шкала алекситимии".
Результаты. Не было обнаружено значимых различий в ТОС и амплитудах СВП между пациентами с АГ и контрольной группой, а также значимых взаимосвязей между ТОС и амплитудами СВП в обеих группах. Были обнаружены значимые положительные корреляции между амплитудами СВП и показателями алекситимии в обеих группах.
Заключение. Различия в амплитудах СВП между пациентами с АГ и контрольной группой не были выявлены. Однако впервые была продемонстрирована связь между трудностями в распознавании эмоций и амплитудами СВП у пациентов с АГ, подтверждающая гипотезу о взаимодействии данных процессов на уровне островковой коры.
Ключевые слова
Для цитирования:
Сукманова А.А., Миненко И.А., Лимонова А.С., Гусейнова К.А., Башанкаева З.Б., Моисеева В.В., Ершова А.И., Драпкина О.М. Оценка сердечных вызванных потенциалов у пациентов с артериальной гипертензией. Кардиоваскулярная терапия и профилактика. 2024;23(12):4229. https://doi.org/10.15829/1728-8800-20244229. EDN: CZISDZ
For citation:
Sukmanova A.A., Minenko I.A., Limonova A.S., Guseynova K.A., Bashankaeva Z.B., Moiseeva V.V., Ershova A.I., Drapkina O.M. Assessment of heart-evoked potentials in hypertensive patients. Cardiovascular Therapy and Prevention. 2024;23(12):4229. (In Russ.) https://doi.org/10.15829/1728-8800-20244229. EDN: CZISDZ
Введение
Артериальная гипертензия (АГ) — одно из самых распространенных сердечно-сосудистых заболеваний, которое представляет серьёзную проблему для общественного здравоохранения, поскольку оно способствует повышению сердечно-сосудистой заболеваемости и смертности во всём мире [1]. Профилактика и лечение АГ остаются актуальными задачами современной медицины.
Одним из потенциальных механизмов, влияющих на развитие АГ, является интероцепция, описываемая как способность воспринимать сигналы внутренних органов [2]. Изучение интероцепции сердечного ритма ("кардиоцепции") привлекает все большее внимание исследователей из-за связи данного феномена с широким спектром неврологических, психических [2] и кардиологических патологий [3].
Существуют убедительные доказательства наличия связи между повышенной частотой сердечных сокращений (ЧСС) и риском развития АГ. По данным метаанализа увеличение ЧСС в покое на 10 уд./мин повышает риск развития АГ на 11% [4], что указывает на возможную связь между сниженной интероцепцей и развитием АГ. Также предполагается, что интероцепция влияет на переживание эмоций [5], поскольку исследования нейровизуализации демонстрируют, что островковая кора регулирует механизмы как интероцептивной, так и эмоциональной обработки [6]. Взаимосвязь между интероцепцией и эмоциями особенно актуальна в контексте АГ, поскольку существуют убедительные доказательства влияния стресса на повышение артериального давления (АД) [7]. Понимание взаимосвязи между интероцепцией и эмоциональной обработкой у пациентов с АГ имеет важное значение для терапевтической практики. Развитие интероцепции с помощью целенаправленных тренингов потенциально может улучшить эмоциональную регуляцию и общее состояние сердечно-сосудистой системы и помочь пациентам эффективнее справляться со стрессом и контролировать АД.
Интероцепция часто оценивается с помощью поведенческих тестов, направленных на отслеживание и подсчет сердцебиения в заданные интервалы времени [8]. Однако поведенческие меры являются ненадежными, поскольку на них могут влиять изменение физиологических параметров (вариабельность ЧСС и дыхание) [9], эмоциональное состояние [2] и внимание участников [10]. Чтобы обойти потенциальные ограничения поведенческих методов, исследователи изучают нейрофизиологические показатели, позволяющие объективно оценить интероцепцию. Одним из потенциальных нейрофизиологических маркеров интероцепции является сердечный вызванный потенциал (СВП), регистрируемый с использованием метода электроэнцефалографии (ЭЭГ). Предполагается, что СВП, возникающий во временнóм окне 200-600 мс после R-пика, отражает кортикальную обработку сердечной активности [11]. Однако взаимосвязь между СВП и точностью ощущения сердцебиений (ТОС), измеряемой с помощью поведенческих тестов, остается предметом дискуссии. В недавнем метаанализе была обнаружена лишь умеренная взаимосвязь между амплитудами СВП и поведенческими показателями интероцепции [10]. Однако группа Yoris A, et al. [12] обнаружила снижение амплитуд СВП в группе пациентов с АГ по сравнению с контрольной группой. Таким образом, дальнейшие исследования позволят проверить применимость СВП в качестве нейрофизиологического маркера для оценки интероцептивной точности в группе пациентов с АГ.
Цель исследования — изучение нейрофизиологических маркеров интероцепции в группе пациентов с АГ. В задачи исследования входило сравнение амплитуд СВП в группе пациентов и контрольной группе, а также изучение связи между амплитудами СВП, оценками ТОС и эмоциональной обработкой для многомерной характеристики феномена интероцепции в группе АГ.
Материал и методы
Выборка исследования
В исследование было включено 82 человека (52 мужчины), медиана возраста (Me) [ интерквартильный размах Q25; Q75] =40 [ 33; 45] лет). Участники были разделены на две группы, сопоставимые по полу и возрасту: лица с диагнозом АГ (41 человек) и контрольная группа (КГ; 41 человек). В группе АГ диагноз был установлен на основании действующих клинических рекомендаций [13]. В КГ были включены лица, не имеющие АГ и клинически значимой сердечно-сосудистой, эндокринной, неврологической, психической и любой острой патологии. Наличие бессимптомной АГ, нарушений ритма и проводимости сердца были исключены на основании суточного мониторирования АД и холтеровского мониторирования.
Критерии невключения: наличие клинически значимых нарушений ритма и проводимости сердца; органическая патология сердца (перенесенный инфаркт миокарда, кардиомиопатии различной этиологии, рубцовые изменения неустановленной этиологии, врожденные пороки сердца, гипертрофия миокарда ≥15 мм и пр.); значимый атеросклероз центральных или периферических артерий (стеноз артерий ≥50%); ранее диагностированный синдром обструктивного апноэ сна; острое заболевание любой этиологии; психические заболевания; патология центральной нервной системы; прием лекарственных препаратов, проходящих через гематоэнцефалический барьер; нарушение функции щитовидной железы (или отсутствие её медикаментозной гормональной компенсации); системные и аутоиммунные заболевания; клинически значимое эндокринное заболевание, в т.ч. сахарный диабет любой этиологии; индекс массы тела (ИМТ) ≥35 кг/м²; клинически значимая патология печени, почек, легких.
Исследование было одобрено этическим комитетом ФГБУ "Национальный медицинский исследовательский центр терапии и профилактической медицины" Минздрава России. Все экспериментальные процедуры были проведены в соответствии с этическими стандартами Хельсинкской декларации. Участники дали письменное информированное согласие на участие в исследовании.
Клинические данные
Перед исследованием измеряли рост и вес участников и рассчитывали ИМТ по формуле: ИМТ=вес (кг)/рост (м)².
После проведения поведенческих тестов для оценки интероцепции у участников измеряли систолическое (САД) и диастолическое (ДАД) АД. В рамках исследования была собрана информация о факте наличия у пациента гипотензивной терапии и статусе курения.
Оценка алекситимии
Перед началом исследования участники заполняли психологический опросник, направленный на оценку алекситимии (Торонтская шкала алекситимии, Toronto Alexithymia Scale; TAS-20-R) [14].
Поведенческий тест для оценки интероцепции сердца
Инструкции для выполнения интероцептивного теста были продемонстрированы на компьютере, ответы участников были зарегистрированы с помощью клавиатуры и мыши. В качестве задания для оценки кардиоцепции участники выполняли тест с нажатием на клавишу [15]. Участникам было предложено отслеживать свое сердцебиение в течение 2,5 мин и нажимать на кнопку клавиатуры указательным пальцем ведущей руки после каждого ощущаемого сердечного сокращения (СС). Для расчета ТОС был использован показатель средней разницы (mean distance, md) между частотой нажатий и частотой СС в перекрывающихся временных окнах. ТОС участников, не совершивших ни одного нажатия, была оценена как 0.
Подробная информация о процедуре проведения теста с нажатием и методе расчета ТОС содержится в публикации нашей рабочей группы [16].
Электрофизиологические данные
В покое (перед выполнением теста для оценки интероцепции сердца) и во время теста с нажатием была проведена регистрация ЭЭГ, электромиография (ЭМГ) и электрокардиограмма (ЭКГ) с помощью усилителя NVX-52 (Medical Computer Systems, Ltd) при частоте дискретизации 500 Гц.
Для записи ЭКГ были использованы три пары электродов с биполярным монтажом, установленных на левой и правой сторонах тела: первая пара была установлена на переднюю поверхность предплечья, вторая — на 2 см ниже ключиц в подключичной ямке, третья — на шею [17]. На первом этапе обработки для каждой пары ЭКГ электродов была вычислена разница между активностью, зарегистрированной на левой и правой сторонах тела участников. Затем данные ЭКГ были отфильтрованы в диапазоне 0,5-45 Гц. Для расчета R-пиков были использованы отведения, установленные на предплечьях. Они продемонстрировали наибольшие амплитуды R-пиков и были наименее подвержены влиянию двигательной активности. Определение R-пиков и экстрасистолических сокращений было выполнено полуавтоматически с помощью пакета MNE-Python при последующей визуальной проверке врачами-кардиологами. В расчете ТОС были учтены пики синусового ритма и экстрасистолы.
Для записи ЭМГ был использован биполярный монтаж с установкой активных Ag/AgCl электродов на первую дорсальную межкостную мышцу и сустав указательного пальца ведущей руки участника. Данные ЭМГ были использованы для корректировки времени нажатия на клавишу в тесте с нажатием. Для определения начала мышечного сокращения применялся пакет neurokit2, использующий для расчета оператор энергии Тигера-Кайзера и определяющий пороговое значение начала нажатия по методу biosppy. На первом этапе данный алгоритм определял начало мышечного сокращения в интервале 0,25 с до маркера нажатия клавиши и рассчитывал среднее время задержки между началом сокращения мышцы и маркером нажатия на клавишу. На втором этапе проводилась коррекция расположения маркера на записи путем вычитания средней задержки, рассчитанной на предыдущем шаге, если мышечное сокращение не регистрировалось вблизи маркера нажатия.
Запись ЭЭГ осуществлялась с использованием 36 Ag/AgCl электродов, установленных согласно международной системе 10-20. Каналы T3 и T4 были использованы в качестве ипсилатеральных онлайн-референсов: для левосторонних электродов — канал Т3, для правосторонних — Т4, а для электродов, расположенных вдоль центральной сагиттальной линии — среднее значение (Т3+Т4)/2. Импеданс для всех каналов во время записи не превышал 20 кОм. Два электрода для проведения электроокулографии (исследования глазных мышц) были размещены на латеральных сторонах глаз. Данные ЭЭГ были очищены от артефактов, вызванных движением глаз и сердечным полем (cardiac field artefact, CFA). Для этого использовался анализ независимых компонент (алгоритм fastica), который объяснял 99% дисперсии. Для коррекции артефактов были выбраны не >3-х компонентов, связанных с движением глаз, и не >2-х компонентов CFA. Данные ЭЭГ были отфильтрованы в диапазоне 0,5-20 Гц. Каналы, загрязненные двигательными и техническими артефактами, были подвергнуты интерполяции. Затем в записи ЭЭГ были выделены участки (эпохи) от 0,2 до 0,6 с после появления R-пиков в ЭКГ, из которых была вычтена средняя амплитуда в интервале от 0,2 до 0,1 с до R-пика. Эпохи были усреднены отдельно для каждого канала. Мы исключали эпохи, привязанные по времени к экстрасистолам, две эпохи до и одну после них, а также эпохи с интервалами между R-пиками <0,6 с. Алгоритм AutoReject был применен для удаления или интерполяции зашумленных эпох. После процедуры автоматического удаления артефактов была проведена дополнительная визуальная оценка эпох. Записи, в которых было удалено >20% эпох, были исключены из анализа.
Статистический анализ. Анализ проводился с помощью среды R 4.3.1 с открытым исходным кодом. Перед началом анализа данные были проверены на соответствие требованиям нормального распределения с помощью критерия Шапиро-Уилка.
Для сравнения ТОС и показателей алекситимии между группами использовался непараметрический критерий Вилкоксона для независимых выборок с поправкой Бонферрони на множественные сравнения (в количестве пяти). Сравнение амплитуд СВП между группами в состоянии покоя и во время выполнения теста было проведено с использованием непараметрического пространственно-временнóго пермутационного теста, в основе которого лежит метод Монте-Карло. Тест устранял проблему множественных сравнений амплитуд СВП в каждый момент времени между группами. Тест проводился в среде Python с использованием библиотеки MNE и включал несколько этапов, которые последовательно были выполнены для оценки значимости наблюдаемых эффектов между группами. Во-первых, амплитуды СВП случайным образом были распределены между участниками групп с сохранением пространственной принадлежности к каналам, после чего данные новых групп сравнивались в каждый момент времени по каналам с помощью t-теста для независимых выборок. Во-вторых, из точек, где t-значения превышали порог, выбирался кластер с наибольшей суммой t-значений. Шаги один и два повторялись 1000 раз для формирования распределения t-значений кластеров и проверки нулевой гипотезы. После этого в t-статистике, вычисленной на основе первоначальных данных, были выделены области, где статистика превышала пороговые значения >5% экстремальных значений распределения. Эти области были объединены в кластеры — группы каналов и временных отсчетов, учитывающие пространственную коннективность каналов ЭЭГ. Наконец, для каждого выявленного кластера была вычислена вероятность его случайного возникновения (Монте-Карло p кластера). Вероятность представляла собой отношение числа случаев, когда суммарная статистика кластеров, полученных в ходе пермутаций, превышала суммарную статистику наблюдаемых кластеров, к общему числу пермутаций. Вероятности были использованы для определения значимости кластеров, что позволяло выделить каналы и временные отсчеты с существенными эффектами на уровне заданного значимости.
Для исследования взаимосвязей между амплитудами СВП, оценками ТОС и баллами психологического опросника использовалась модификация вышеописанного пермутационного теста. Во-первых, между участниками были перераспределены оценки ТОС и баллы опросника, а не амплитуды СВП. Во-вторых, t-статистика рассчитывалась поэтапно. Сначала в случайных данных, полученных в ходе каждой пермутации, и в наблюдаемых данных вычислялся двусторонний коэффициент ранговой корреляции Спирмена между амплитудой СВП, оценками ТОС и баллами психологического опросника. Полученный коэффициент преобразовывался в t-статистику. Тест проводился в среде MATLAB с использованием библиотеки Fieldtrip. Уровень значимости для всех проверяемых гипотез соответствовал 0,05.
Результаты
Клиническая характеристика участников, входящих в группы АГ и КГ, представлена в таблице 1. На момент исследования 80,5% пациентов в группе АГ регулярно принимали антигипертензивные препараты. По доле курящих людей исследуемые выборки не различались, однако ИМТ в группе АГ был значимо выше.
Таблица 1
Клиническая характеристика участников исследования
|
Показатель |
Группа АГ |
КГ |
p |
|
n=41 |
n=41 |
||
|
Возраст, Me [ Q25; Q75] (лет) |
40 [ 35; 45] |
41 [ 33; 45] |
0,84а |
|
Мужской пол, n (%) |
30 (73,2) |
22 (53,7) |
0,11б |
|
ИМТ, Me [ Q25; Q75] (кг/м²) |
27,8 [ 25,1; 29,6] |
25,1 [ 22,5; 27,2] |
0,009а |
|
Курение, n (%) |
8 (19,5) |
6 (14,6) |
0,77б |
|
Прием гипотензивных препаратов, n (%) |
33 (80,5) |
0 |
<0,001б |
|
САД, Me [ Q25; Q75] (мм рт.ст.) |
122 [ 114; 132] |
112 [ 105; 120] |
0,001а |
|
ДАД, Me [ Q25; Q75] (мм рт.ст.) |
89 [ 80; 95] |
80 [ 71; 84] |
<0,001а |
Примечание: группа АГ — группа пациентов с артериальной гипертензией; Me [ Q25; Q75] — медиана [ интерквартильный размах]. Значимые p-значения выделены цветом. Статистические критерии, использованные для сравнения клинических характеристик между группами: а — непараметрический критерий Вилкоксона для независимых выборок; б — критерий согласия χ², p — уровень значимости. КГ — контрольная группа, ИМТ — индекс массы тела, ДАД — диастолическое артериальное давление, САД — систолическое артериальное давление.
Рисунок 1 представляет амплитуды СВП в различных топографических областях. Мы не обнаружили значимых различий между амплитудами СВП в группах КГ и АГ, как в состоянии покоя, так и во время выполнения кардиоцептивного теста. Также мы не наблюдали значимых корреляций между амплитудами СВП (во время выполнения теста и в покое) и ТОС в обеих группах по результатам пермутационного пространственно-временнóго кластерного теста.
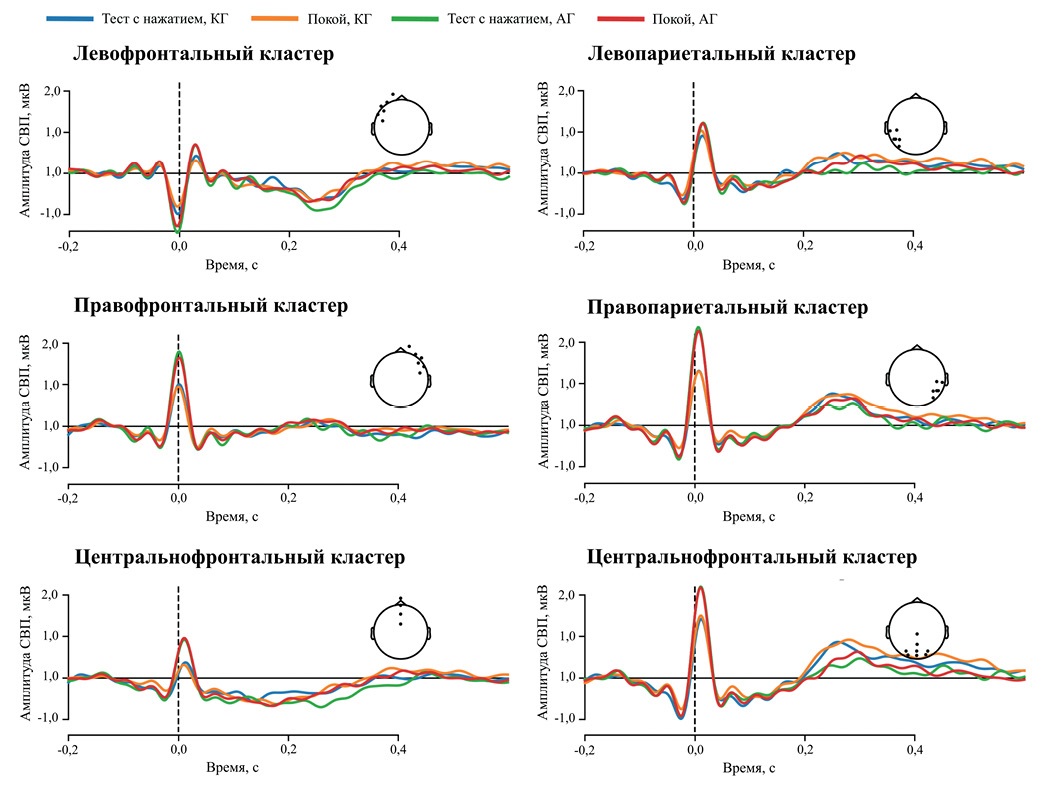
Рис. 1 Амплитуды СВП, усредненные в шести группах каналов (кластеров) и зарегистрированные во время выполнения теста с нажатием (синий цвет, сплошная линия — группа КГ; зеленый цвет, штриховая линия — группа АГ) и в состоянии покоя (оранжевый цвет, линия из точек — группа КГ; красный цвет, штрихпунктирная линия — группа АГ). Позиции каналов, входящих в кластер, отмечены точками на топографической схеме головы человека.
Примечание: СВП — сердечный вызванный потенциал, АГ — группа пациентов с артериальной гипертензией, КГ — контрольная группа, TAS-20-R — Toronto Alexithymia Scale (Торонтская шкала алекситимии). Цветное изображение доступно в электронной версии журнала.
Баллы психологического опросника TAS-20-R (Toronto Alexithymia Scale) и оценки ТОС для обеих групп представлены в таблице 2. Значимых различий между группами по оценкам ТОС и показателям алекситимии выявлено не было. При исследовании взаимосвязей между амплитудами СВП и показателями алекситимии в КГ был обнаружен кластер (Монте-Карло p кластера =0,014), охватывающий каналы F7, F3, Fz, FT7, FC3, C3, TP7, CP3, T5, P3, T6, P5, PO3, POz, P6, PO7, O1, Oz, PO8 и период времени от 248 до 600 мс (рисунок 2 А, слева). Амплитуды СВП в состоянии покоя, усредненные внутри каналов и временнóго периода, обнаруженных с помощью пермутационного кластерного теста, значимо коррелировали (r=0,43, p=0,005) с баллами шкалы "Трудности в описании чувств" опросника TAS-20-R (рисунок 2 А, справа). Также был обнаружен кластер (Монте-Карло p кластера =0,039), охватывающий каналы F3, FC3, C3, TP7, CP3, T5, P3, Pz, P4, T6, P5, PO3, POz, PO4, P6, PO7, O1 и период времени от 302 до 600 мс (рисунок 2 Б, слева). Амплитуды СВП в состоянии покоя, усредненные внутри каналов и временнóго периода, обнаруженных с помощью пермутационного кластерного теста, значимо коррелировали (r=0,37, p=0,017) с баллами шкалы "Общий индекс алекситимии" опросника TAS-20-R в КГ (рисунок 2 Б, справа).
Таблица 2
Результаты оценки интероцепции и психологического статуса участников
|
Тест |
Группа АГ |
КГ |
p |
p-корр. |
|
ТОС |
||||
|
Тест с нажатием (индекс md) |
0,4 [ 0; 0,69] |
0,3 [ 0; 0,74] |
0,9 |
1 |
|
Торонтская шкала алекситимии (баллы) |
||||
|
TAS-20-R (трудности в описании чувств) |
13 [ 8; 18] |
10 [ 9; 14] |
0,15 |
0,75 |
|
TAS-20-R (трудности с идентификацией чувств) |
9 [ 6; 15] |
8 [ 5; 11] |
0,09 |
0,45 |
|
TAS-20-R (внешне-ориентированное мышление) |
11 [ 9; 15] |
9 [ 8; 12] |
0,21 |
1 |
|
TAS-20-R (общий индекс алекситимии) |
38 [ 26; 43] |
30 [ 24; 34] |
0,03 |
0,15 |
Примечание: АГ — группа пациентов с артериальной гипертензией, КГ — контрольная группа, p — уровень значимости, p-корр. — скорректированный уровень значимости после применение поправки на множественные сравнения, md — mean distance, Me [ Q25; Q75] — медиана [ интерквартильный размах], TAS-20-R — Toronto Alexithymia Scale (Торонтская шкала алекситимии). Значимые результаты выделены цветом.
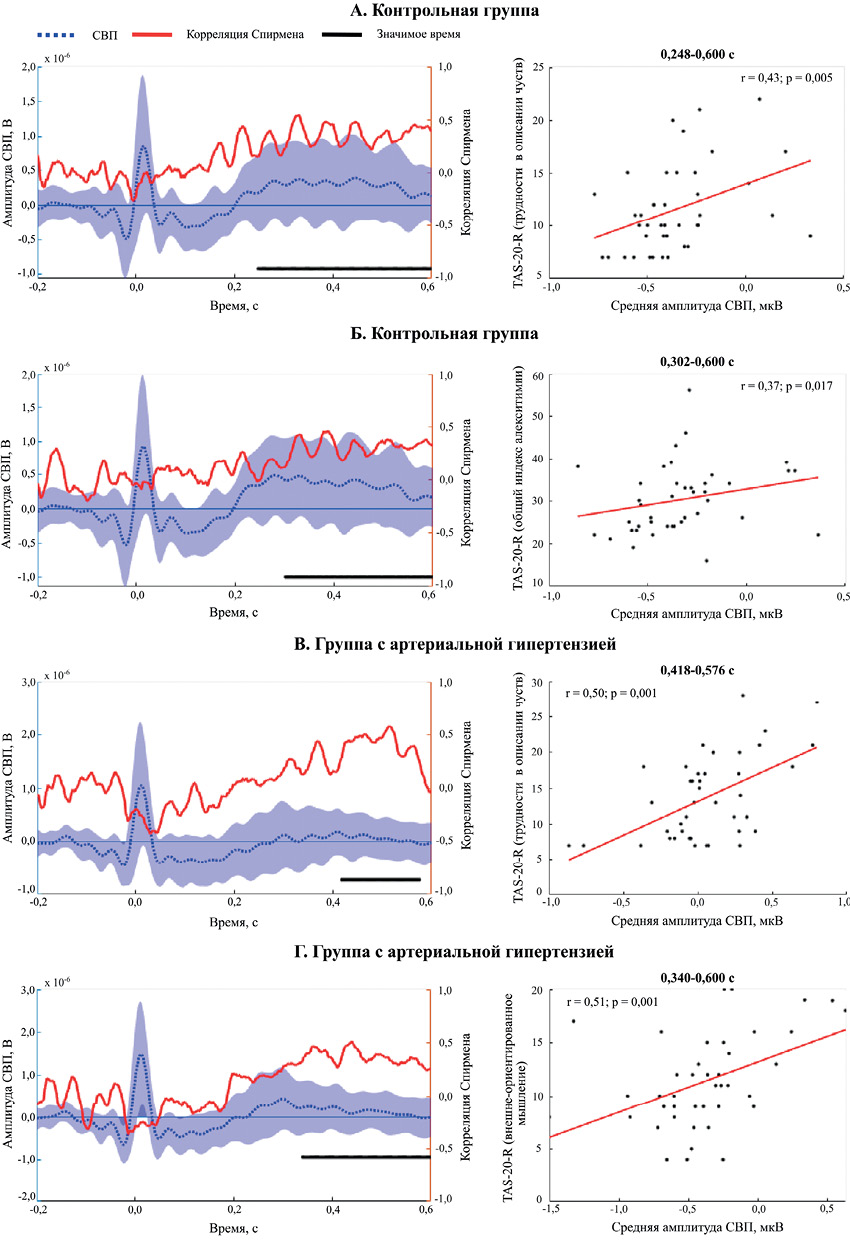
Рис. 2 Результаты теста ранговой корреляции Спирмена между амплитудами СВП в состоянии покоя и баллами психологического опросника TAS-20-R для КГ (А, Б) и АГ (В, Г).
Примечание: на рисунках слева представлены усредненные амплитуды СВП во временнóм окне от 200 мс до 600 мс после R-пика. Красная линия соответствует величине коэффициента ранговой корреляции Спирмена в каждой временнóй точке. Синяя линия отражает среднее значение амплитуды СВП внутри значимых каналов кластера, синяя закрашенная область — величину стандартного отклонения. Черная линия указывает на временнóй период, в котором была выявлена значимая корреляция с использованием кластерного пермутационного теста. Диаграммы рассеяния, представленные справа, отражают взаимосвязь между амплитудами СВП в состоянии покоя, усредненными в рамках временнóго периода, обнаруженного с помощью кластерного пермутационного теста, и баллами психологического опросника TAS-20-R. СВП — сердечный вызванный потенциал, TAS-20-R — Toronto Alexithymia Scale. Цветное изображение доступно в электронной версии журнала.
В группе АГ был обнаружен кластер (Монте-Карло p кластера = 0,049), охватывающий каналы Fp1, Fpz, Fp2, F3, Fz, F4, FC3, FCz, FC4, C3, Cz, C4, CP3, CPz, CP4, TP8, T6, P6 и период времени от 418 до 576 мс (рисунок 2 В, слева). Амплитуды СВП в состоянии покоя, усредненные внутри каналов и временнóго периода, обнаруженных с помощью пермутационного кластерного теста, значимо коррелировали (r=0,5, p=8,0069E-04) с баллами шкалы "Трудности в описании чувств" опросника TAS-20-R (рисунок 2 В, справа). Также был обнаружен кластер (Монте-Карло p кластера = 0,015), охватывающий каналы FC3, FCz, C3, Cz, C4, TP7, CP3, CPz, CP4, T5, P3, Pz, P4, T6, P5, PO3, POz, PO4, P6, PO7, O1, PO8 и период времени от 340 до 600 мс рисунок 2 Г, слева). Амплитуды СВП в состоянии покоя, усредненные внутри каналов и временнóго периода, обнаруженных с помощью пермутационного кластерного теста, значимо коррелировали (r=0,51, p=7,2314E-04) с баллами шкалы "Внешне-ориентированное мышление" опросника TAS-20-R в группе АГ (рисунок 2 Г, справа).
Обсуждение
В ходе исследования не было обнаружено значимых результатов, указывающих на различия в амплитудах СВП и оценках ТОС между пациентами с АГ и КГ. В группе пациентов с АГ не было обнаружено значимых ассоциаций между амплитудами СВП и ТОС. Была обнаружена значимая положительная зависимость между амплитудами СВП и показателями алекситимии в группе пациентов с АГ и КГ.
Настоящее исследование демонстрирует, что выраженный интероцептивный дефицит у пациентов с АГ в возрасте от 22 до 50 лет не наблюдается ни на поведенческом, ни на нейрональном уровне. Полученные результаты позволяют предположить, что у пациентов с АГ в средней возрастной группе повышение интероцепции [18], связанное с высоким уровнем АД, компенсируется началом формирования интероцептивного дефицита, характерного для пациентов с АГ в возрасте от 50 лет [12]. Однако полученный результат, демонстрирующий отсутствие корреляции между амплитудами СВП и оценками ТОС в обеих группах, согласуется с литературными данными, свидетельствующими о том, что параметры СВП могут отражать не только уровень навыка интероцептивной точности, а также комплекс процессов, связанных с кардиорецепцией, вниманием, дыханием и т.д. [19] Таким образом, СВП в данный момент нельзя назвать достоверным нейрофизиологическим маркером ТОС.
Полученные результаты, демонстрирующие взаимосвязь между эмоциональной обработкой и амплитудами СВП, дополняют данные предыдущих исследований нейровизуализации, в которых островковая кора выступает в качестве центра обработки как эмоциональной, так и интероцептивной информации [6]. В работе Yoris, et al. [20] зависимость между ТОС и навыком распознавания эмоций была представлена в КГ, но не среди пациентов с АГ, которые тем не менее демонстрировали более выраженный дефицит эмоциональной обработки.
Ограничения исследования. Ограничениями настоящего исследования является размер выборки и прием антигипертензивной терапии большинством пациентов с АГ на момент проведения исследования. Однако предыдущие исследования продемонстрировали воспроизводимые результаты на аналогичных или меньших выборках [12][18].
Заключение
Настоящее исследование представляет собой первую работу, посвященную изучению амплитуд СВП у пациентов с АГ в возрасте от 22 до 50 лет, в которой была обнаружена связь между трудностями в распознавании эмоций и амплитудами СВП. Результаты исследования не выявили различий в интероцепции между пациентами с АГ и КГ. Эти данные могут указывать на то, что у пациентов среднего возраста с АГ, получающих антигипертензивную терапию, формирование интероцептивного дефицита, характерного для АГ, компенсируется усилением интероцепции, связанным с повышенным АД. Обнаруженная взаимосвязь между эмоциональной обработкой и амплитудами СВП подкрепляет представления о связи данных феноменов на уровне островковой коры и подчеркивает важность дальнейшего изучения интероцепции в группе пациентов с АГ, характеризующейся трудностями в распознавании эмоций. Дальнейшие исследования в этой области помогут лучше понять механизмы нейровисцеральных взаимодействий в рамках оси мозг-сердце и диагностировать их нарушения, которые могут проявляться в изменении интероцепции сердца.
Отношения и деятельность. Работа выполнена за счет гранта Российского научного фонда № 22-15-00507, https://rscf.ru/project/22-15-00507.
Список литературы
1. Stanaway JD, Afshin A, Gakidou E, et al. Global, regional, and national comparative risk assessment of 84 behavioural, environmental and occupational, and metabolic risks or clusters of risks for 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 2018;392(10159):1923-94. doi:10.1016/s0140-6736(18)32225-6.
2. Bonaz B, Lane RD, Oshinsky ML, et al. Diseases, Disorders, and comorbidities of interoception. Trends Neurosci. 2021;44(1): 39-51. doi:10.1016/j.tins.2020.09.009.
3. Shivkumar K, Ajijola OA, Anand I, et al. Clinical neurocardiology defining the value of neuroscience-based cardiovascular therapeutics. J Physiol. 2016;594(14):3911-54. doi:10.1113/jp271870.
4. Shi Y, Zhou W, Liu X, et al. Resting heart rate and the risk of hypertension and heart failure: a dose-response meta-analysis of prospective studies. J Hypertens. 2018;36(5):995-1004. doi:10.1097/HJH.0000000000001627.
5. Barrett LF. How emotions are made: The secret life of the brain. 2017. 448 p. ISBN 978-1-5098-3751-9. Great Britain: Pan Macmillan.
6. Meza-Concha N, Arancibia M, Salas F, et al. Towards a neurobiological understanding of alexithymia. Medwave. 2017;17(04): e6960. doi:10.5867/medwave.2017.04.6960.
7. Rutledge T. A quantitative review of prospective evidence linking psychological factors with hypertension development. Psychosom Med. 2002;64(5):758-66. doi:10.1097/01.psy.0000031578.42041.1c.
8. Körmendi J, Ferentzi E. Heart activity perception: narrative review on the measures of the cardiac perceptual ability. Biol Futura. 2024;75(1):3-15. doi:10.1007/s42977-023-00181-4.
9. Candia-Rivera D, Sappia MS, Horschig JM, et al. Confounding effects of heart rate, breathing rate, and frontal fNIRS on interoception. Sci Rep. 2022;12(1):20701. doi:10.1038/s41598022-25119-z.
10. Coll MP, Hobson H, Bird G, et al. Systematic review and meta-analysis of the relationship between the heartbeatevoked potential and interoception. Neurosci Biobehav Rev. 2021;122:190-200. doi:10.1016/j.neubiorev.2020.12.012.
11. Pollatos O, Schandry R. Accuracy of heartbeat perception is reflected in the amplitude of the heartbeat‐evoked brain potential. Psychophysiology. 2004;41(3):476-82. doi:10.1111/1469-8986.2004.00170.x.
12. Yoris A, Abrevaya S, Esteves S, et al. Multilevel convergence of interoceptive impairments in hypertension: New evidence of disrupted body–brain interactions. Hum Brain Mapp. 2018;39(4):1563-81. doi:10.1002/hbm.23933.
13. Кобалава Ж. Д., Конради А. О., Недогода С. В. и др. Артериальная гипертензия у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(3):3786. doi:10.15829/1560-4071-2020-3-3786.
14. Старостина Е. Г., Тейлор Г. Д., Квилти Л. К. и др. Торонтская шкала алекситимии (20 пунктов): валидизация русскоязычной версии на выборке терапевтических больных. Социальная и клиническая психиатрия. 2010;20(4):31-8.
15. Körmendi J, Ferentzi E, Köteles F. A heartbeat away from a valid tracking task. An empirical comparison of the mental and the motor tracking task. Biol Psychol. 2022;171:108328. doi:10.1016/j.biopsycho.2022.108328.
16. Миненко И. А., Германова К. Н., Лимонова А. С. и др. Сравнение методов субъективной оценки интероцепции сердца. Кардиоваскулярная терапия и профилактика. 2023; 22(10):3797. doi:10.15829/1728-8800-2023-3797.
17. Gray MA, Taggart P, Sutton PM, et al. A cortical potential reflecting cardiac function. PNAS. 2007;104(16):6818-23. doi:10.1073/pnas.0609509104.
18. Koroboki E, Zakopoulos N, Manios E, et al. Interoceptive awareness in essential hypertension. Int J Psychophysiol. 2010;78(2):158-62. doi:10.1016/j.ijpsycho.2010.07.003.
19. Zamariola G, Maurage P, Luminet O, et al. Interoceptive accuracy scores from the heartbeat counting task are problematic: Evidence from simple bivariate correlations. Biol Psychol. 2018;137:12-7. doi:10.1016/j.biopsycho.2018.06.006.
20. Yoris A, Legaz A, Abrevaya S, et al. Multicentric evidence of emotional impairments in hypertensive heart disease. Sci Rep. 2020;10(1):14131. doi:10.1038/s41598-020-70451-x.
Об авторах
А. А. СукмановаРоссия
Анастасия Александровна Сукманова — аспирант, лаборант-исследователь лаборатории нейромодуляции и нейровисцеральных исследований.
Москва
И. А. Миненко
Россия
Ирина Алексеевна Миненко — лаборант-исследователь лаборатории нейромодуляции и нейровисцеральных исследований.
Москва
А. С. Лимонова
Россия
Алёна Сергеевна Лимонова — н.с. лаборатории клиномики.
Москва
К. А. Гусейнова
Россия
Гусейнова Карина Алиевна — лаборант-исследователь лаборатории нейромодуляции и нейровисцеральных исследований.
Москва
З. Б. Башанкаева
Россия
Башанкаева Зуляна Бадмаевна — студент, факультет фундаментальной медицины.
Москва
В. В. Моисеева
Россия
Моисеева Виктория Владимировна — к.б.н., зам. директора, в.н.с..
Москва
А. И. Ершова
Россия
Ершова Александра Игоревна — д.м.н., руководитель лаборатории клиномики, зам. директора по фундаментальной науке.
Москва
О. М. Драпкина
Россия
Оксана Михайловна Драпкина — д.м.н., профессор, академик РАН, директор.
Москва
Дополнительные файлы
Что известно о предмете исследования?
- Сердечный вызванный потенциал (СВП) — это один из нейрофизиологических маркеров интероцепции. Однако его связь с точностью ощущения сердцебиения, которая является наиболее популярным поведенческим методом оценки интероцепции, не до конца изучена.
Что добавляют результаты исследования?
- Настоящая работа представляет собой первое исследование, посвященное изучению СВП у пациентов с артериальной гипертензией в возрасте от 22 до 50 лет.
- В рамках этого исследования впервые проанализирована связь между эмоциональной обработкой и СВП у пациентов с артериальной гипертензией.
Рецензия
Для цитирования:
Сукманова А.А., Миненко И.А., Лимонова А.С., Гусейнова К.А., Башанкаева З.Б., Моисеева В.В., Ершова А.И., Драпкина О.М. Оценка сердечных вызванных потенциалов у пациентов с артериальной гипертензией. Кардиоваскулярная терапия и профилактика. 2024;23(12):4229. https://doi.org/10.15829/1728-8800-20244229. EDN: CZISDZ
For citation:
Sukmanova A.A., Minenko I.A., Limonova A.S., Guseynova K.A., Bashankaeva Z.B., Moiseeva V.V., Ershova A.I., Drapkina O.M. Assessment of heart-evoked potentials in hypertensive patients. Cardiovascular Therapy and Prevention. 2024;23(12):4229. (In Russ.) https://doi.org/10.15829/1728-8800-20244229. EDN: CZISDZ
JATS XML

























































