Перейти к:
Алгоритм прогнозирования сердечно-сосудистых осложнений у больных низкого/умеренного риска с использованием “классических” и “новых” факторов (по данным десятилетнего наблюдения)
https://doi.org/10.15829/1728-8800-2021-2799
Аннотация
Цель. Создание усовершенствованного алгоритма оценки вероятности развития сердечно-сосудистых осложнений (ССО) у больных низкого/умеренного риска с использованием комплекса “классических” и “новых” факторов.
Материал и методы. В работу включено 700 больных с риском по SCORE (Systematic Coronary Risk Evaluation) <5%, обследованных в 2009-2010гг. Помимо стандартного обследования проводились биохимический анализ крови с определением высокочувствительного С-реактивного белка (вчСРБ), сфигмография. В 2019г проведен телефонный обзвон участников для выявления ССО за прошедшее время: смерть от сердечно-сосудистых заболеваний, инфаркты миокарда, нестабильная стенокардия, нарушения мозгового кровообращения, реваскуляризация. Отклик — 79,6% (557 человек: 100 мужчин и 457 женщин).
Результаты. ССО были у 48 (8,6%) пациентов. Риск ССО повышает уровень систолического артериального давления (САД) >130 мм рт.ст. — отношение шансов (ОШ) 1,9 (95% доверительный интервал (ДИ) 1,0-3,6), вчСРБ >2,3 мг/л — ОШ 2,2 (95% ДИ: 1,5-4,1), мочевины >8 ммоль/л — ОШ 5,1 (95% ДИ: 1,2-21,0), кардио-лодыжечный сосудистый индекс (CAVI) >8,05 — ОШ 1,25 (95% ДИ: 1,0-1,6). У пациентов с сочетанием нарушения ≥2 параметров липидного спектра, САД >130 мм рт.ст., вчСРБ >2,3 мг/л и скорость пульсовой волны >13 м/с вероятность развития ССО (включая смерть по сердечно-сосудистым причинам) увеличивается в 3,55 раз (95% ДИ: 1,32-7,67).
Заключение. Скорость пульсовой волны, CAVI, уровни мочевины, вчСРБ могут рассматриваться как дополнительные факторы риска развития ССО у больных низкого/умеренного риска, рассчитанного по стандартным шкалам. Сочетания “классических” и “новых” факторов риска демонстрирует кумулятивный эффект.
Ключевые слова
Для цитирования:
Смирнова М.Д., Свирида О.Н., Фофанова Т.В., Бланкова З.Н., Яровая Е.Б., Агеев Ф.Т. Алгоритм прогнозирования сердечно-сосудистых осложнений у больных низкого/умеренного риска с использованием “классических” и “новых” факторов (по данным десятилетнего наблюдения). Кардиоваскулярная терапия и профилактика. 2021;20(6):2799. https://doi.org/10.15829/1728-8800-2021-2799
For citation:
Smirnova M.D., Svirida O.N., Fofanova T.V., Blankova Z.N., Yarovaya E.B., Ageev F.T. Algorithm for predicting cardiovascular events in low/moderate risk patients using traditional and new factors: data from 10-year follow-up study. Cardiovascular Therapy and Prevention. 2021;20(6):2799. (In Russ.) https://doi.org/10.15829/1728-8800-2021-2799
Прогностическая ценность таких “классических” факторов риска (ФР) развития сердечно-сосудистых осложнений (ССО) как мужской пол, возраст, наследственная предрасположенность, курение, дислипидемия, артериальная гипертония (АГ), сахарный диабет (СД), неоднократно доказана и не вызывает сомнений [1]. Однако нередко ССО впервые возникают у лиц с низким или умеренным риском их развития, рассчитанным на основании стандартных шкал, в т.ч. SCORE (Systematic Coronary Risk Evaluation) — основного, на сегодняшний день, инструмента стратификации риска в странах Европы и Российской Федерации. Это определяет необходимость поиска дополнительных критериев прогнозирования заболеваемости ишемической болезнью сердца (ИБС) и других сердечно-сосудистых заболеваний (ССЗ), связанных с атеросклерозом, и определения показаний к их активной первичной профилактике у этой категории больных.
Целью исследования было создание усовершенствованного алгоритма оценки вероятности развития ССО у больных низкого и умеренного риска с использованием дополненного комплекса “классических” и “новых” факторов.
Материал и методы
В исследование включено 700 больных (136 мужчин и 564 женщины, средний возраст 51,6±7,5 лет) с риском ССО по SCORE <5%, проходивших обследование в НИИ клинической кардиологии им. А.Л. Мясникова в 2009- 2010гг в рамках “Программы разработки новых методов и технологий профилактики, диагностики и лечения ССЗ, связанных с атеросклерозом, в лечебных учреждениях Западного административного округа г. Москвы”. В эту программу были включены пациенты 12 поликлиник Западного административного округа г. Москвы, обратившиеся к участковому терапевту по любому поводу и подписавшие информированное согласие. Критериями невключения были сердечная, дыхательная и печеночная недостаточности, хроническая болезнь почек (ХБП) 4-5 стадий, коллагенозы, онкологические, психические, острые инфекционные и воспалительные заболевания, а также ССЗ, связанные с атеросклерозом — ИБС, клинически значимый атеросклероз брахиоцефальных артерий и артерий нижних конечностей, цереброваскулярная болезнь, острые нарушения мозгового кровообращения в анамнезе. Всем больным перед включением в программу проводили стратификацию риска по шкале SCORE. Для исследования были отобраны из общей базы данных больные с низким и умеренным риском. Пациентам проводили стандартное клиническое обследование, включавшее осмотр, сбор анамнеза, измерение веса и роста с определением индекса массы тела, окружности талии, офисного артериального давления (АД) и частоты сердечных сокращений (ЧСС), биохимический анализ крови с определением липидного профиля, концентрации в крови креатинина, мочевины, уровня С-реактивного белка, определенного высокочувствительным методом (вчСРБ). Проводился тредмил-тест с целью исключения ИБС.
Жесткость магистральных артерий (аорты и крупных ветвей) измерялась с помощью автоматизированной методики — объемной сфигмографии на приборе VaseraVS-1000 (Fukuda Denshi, Япония). Скорость распространения пульсовой волны (СПВ) определялась “плече-лодыжечным” способом. Кардио-лодыжечный сосудистый индекс — CAVI (cardio-ankle vascular index) вычислялся автоматически по формуле:
CAVI=1/k2(lnСАД/ДАД)×СПВ2.
В 2019-2020гг обзвонили больных для проведения анкетирования с внесением данных о ССО за 2009-2019гг: смерть от любых причин, смерть от ССЗ (ССС), фатальные и нефатальные инфаркты миокарда (ОИМ), острые нарушения мозгового кровообращения (ОНМК), случаи реваскуляризации миокарда. Данные вносились со слов пациентов или их родственников. Также рассчитывалась комбинированная конечная точка: ССО=ССС+ОИМ+ ОНМК+нестабильная стенокардия+реваскуляризация.
Статистический анализ проводился с помощью пакетов статистических программ Statistica 10 и SPSS 20. Непрерывные переменные, распределение которых было близко к нормальному, представлялись как среднее (M) ± стандартное отклонение (SD), при отличии распределения переменной от нормального приводились медиана (Me) и 95% доверительный интервал (ДИ). Для проверки гипотез о средних в двух группах применялся t-критерий Стьюдента или его непараметрический аналог — критерий Манна-Уитни. Зависимость признаков в таблице сопряженности 2×2 исследовалась с помощью двустороннего точного критерия Фишера. Для непрерывных переменных зависимость оценивалась с помощью коэффициента корреляции Пирсона или Спирмена (при переходе от абсолютных значений переменных к их рангам). Для нахождения отрезной точки по исследуемым показателям применялся ROC-анализ. Отрезная точка соответствовала значению, для которого сумма чувствительности и специфичности составляла единицу. Вычислялась площадь под ROC-кривой — AUC (Area Under the Curve), стандартная ошибка (Serr) и 95% ДИ для AUC, на основе которого оценивалась статистическая значимость модели. Сравнение кривых выживаемости проводилось с помощью лог-рангового критерия. Отношение шансов (ОШ) и соответствующий 95% ДИ вычислялись с помощью модели бинарной логистической регрессии. Если ДИ не включал единицу, то ОШ считалось статистически значимым. Уровень значимости для проверки гипотез принимался равным 0,05.
Результаты
ССО у больных низкого/умеренного риска за 10 лет наблюдения
Отклик составил 79,6% (557 человек: 100 мужчин и 457 женщин). На момент включения в исследование возраст больных составлял 51,9±7,6 лет. АГ страдали 333 (59,8%) человека. Курили 6% обследованных. Не получали терапию на момент включения в исследование 42,1% пациентов, получали ингибиторы ангиотензинпревращающего фермента — 44,3%, бета-адреноблокаторы — 23,0%, антагонисты кальциевых каналов — 6,4%, диуретики — 24,6%.
Доля больных, перенесших за 10 лет те или иные ССО — смерть, острый коронарный синдром, ОНМК, реваскуляризацию миокарда, составила 8,6% (n=48) (рисунок 1). Структура осложнений представлена на рисунке 2. Умерли от сердечно-сосудистых причин 9 человек. В изучаемой группе за годы наблюдения произошло 10 ОИМ, 11 случаев нестабильной стенокардии, 21 ОНМК, выполнено 27 транслюминальных баллонных ангиопластик коронарных артерий, 1 аортокоронарное шунтирование. За истекшие 10 лет в изучаемой группе было 154 госпитализации по сердечно-сосудистым причинам. Доля умерших от несердечных причин 1,6%, госпитализировались по несердечным причинам 11,6% участников исследования. Основные клинико-демографические характеристики больных, перенесших (ССО+) и не перенесших (ССО-) те или иные ССО, представлены в таблице 1.
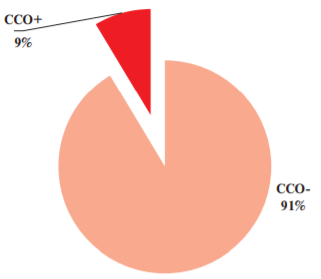
Рис. 1. Больные, перенесшие (ССО+) и не перенесшие (ССО-) ССО по данным 10-летнего наблюдения.
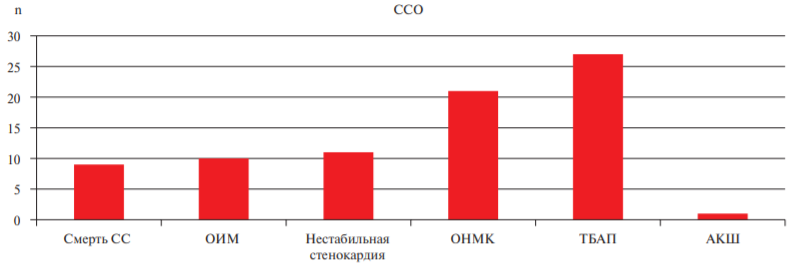
Рис. 2. ССО за 10 лет наблюдения.
Примечание: АКШ — аортокоронарное шунтирование, ОИМ — острый инфаркт миокарда, ОНМК — острое нарушение мозгового кровообращения, ССО — сердечно-сосудистые осложнения, Смерть СС — смерть по сердечно сосудистым причинам, ТБАП — транслюминальная баллонная ангиопластика.
Таблица 1
Исходные клинико-демографические характеристики больных низкого/умеренного риска, перенесших (ССО+) и не перенесших (ССО-) ССО в ходе 10-летнего наблюдения
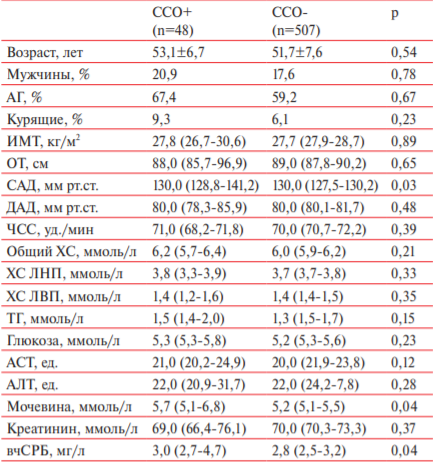
Примечание: ИМТ — индекс массы тела, ОТ — окружность талии, АСТ — аспартатаминотрансфераза, АЛТ — аланинаминотрансфераза.
Влияние САД на прогноз больных низкого/умеренного риска ССО
В группе ССО+ были статистически значимо выше уровень систолического артериального давления (САД) (таблица 1). Проведен ROC-анализ (рисунок 3), в ходе которого была определена “отрезная точка” уровня САД, соответствующая 130 мм рт.ст. (AUC=0,596, SD=0,029, 95% ДИ: 0,513-0,679), что свидетельствует об удовлетворительном качестве исследуемой модели. У больных низкого/умеренного риска по SCORE повышение САД >130 мм рт.ст. увеличивает вероятность осложнений на 90% — ОШ 1,9 (95% ДИ: 1,0-3,6).
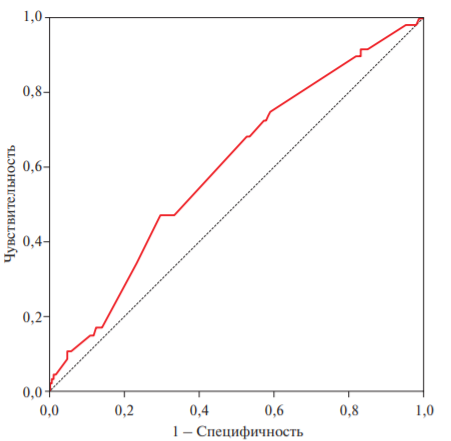
Рис. 3. Rос-кривая модели “САД — ССО”.
Влияние уровня вчСРБ и мочевины на прогноз больных низкого/умеренного риска ССО
В группе ССО+ уровень вчСРБ исходно был выше (таблица 1). По результатам ROC-анализа была определена отрезная точка, составившая 2,3 мг/л. У больных низкого/умеренного риска по SCORE уровень вчСРБ >2,3 мг/л, по нашим данным, увеличивает вероятность осложнений в 2,2 раза: ОШ 2,2 (95% ДИ: 1,5-4,1). Этот показатель сохранял свое прогностическое значение в логистической модели, включающей пол и наличие/отсутствие АГ.
В группе ССО+ также был достоверно выше уровень мочевины: 5,7 vs 5,2 ммоль/л (р=0,04) (таблица 1). Уровень мочевины выше референсных значений (8,0 ммоль/л) был определен у 11 (2%) человек. Доля ССО+ среди них в 5 раз выше — 15,0 vs 3,4% (p<0,05). По данным логистического анализа, исходный уровень мочевины >8 ммоль/л увеличивал риск ССО в 5,1 раз: ОШ 5,1 (95% ДИ: 1,2-21,0).
Влияние сосудистой жесткости на прогноз больных низкого/умеренного риска ССО
В группе ССО+ были выше показатели сосудистой жесткости: как СПВ — 13,7 (13,0-14,0) vs 12,7 (12,6-13,1) м/с (p=0,03), так и CAVI — 8,6 (7,8-12,2) vs 7,5 (7,5-8,2) м/с (p=0,04) — показателя, независимого от уровня АД и характеризующего “истинную” артериальную жесткость. По данным ROCанализа были определены “отрезные точки”: 13,15 м/с для СПВ и 8,05 для CAVI. Однако СПВ не показала себя независимым предиктором ССО, в отличие от CAVI, повышающего вероятность ССО у больных низкого/умеренного риска на 25%: ОШ 1,25 (95% ДИ: 1,0-1,6) для непрерывной переменной. Кроме того, CAVI показал себя независимым предиктором числа ССО в регрессионной модели, включающей возраст, пол, САД, ХС, вчСРБ — β=0,44 (95% ДИ: 0,02-0,13).
Алгоритмы оценки вероятности развития ССО у больных низкого/умеренного риска (<5% по SCORE)
С целью разработки алгоритма оценки вероятности развития ССО у больных низкого/умеренного риска мы провели многофакторный анализ предикторов развития ССО у больных с риском по SCORE <5%. Результаты анализа представлены на рисунке 4. Нарушение у таких пациентов ≥2 параметров липидного спектра (ХС ЛНП >3,0 ммоль/л и/или ХС ЛВП <0,9 ммоль/л и/или ТГ >1,5 ммоль/л) увеличивало 10-летний риск ССО на 36%, однако было статистически незначимо. При выявлении у пациента с дислипидемией офисного САД, соответствующего критериям “высоконормального” или повышенного (САД >130 мм рт.ст.), риск ССО увеличивается уже достоверно, на 89%: ОШ 1,89 (95% ДИ: 1,01-3,55). Если у этого пациента дополнительно выявляется вчСРБ >2,3 мг/л, его риск становится выше уже в 2,12 раз. У пациентов с сочетанием нарушения ≥2 параметров липидного спектра, САД >130 мм рт.ст., вчСРБ >2,3 мг/л и СПВ >13 м/с вероятность развития ССО, включая смерть от сердечно-сосудистых причин (ССС) увеличивается в 3,55 (95% ДИ: 1,32- 7,67) раза.
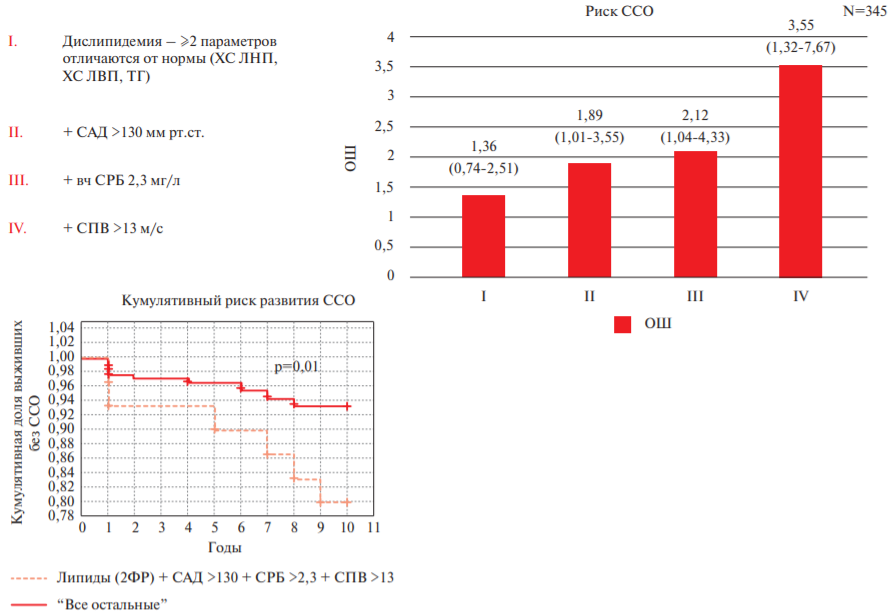
Рис. 4. Алгоритм стратификации риска развития ССО у больных с риском по SCORE <5.
Примечание: вчСРБ — высокочувствительный С-реактивный белок, ОШ — отношение шансов, ХС ЛВП — холестерин липопротеидов высокой плотности, ХС ЛНП — холестерин липопротеидов низкой плотности, САД — систолическое артериальное давление, СПВ — скорость пульсовой волны, ССО — сердечно-сосудистые осложнения, ТГ — триглицериды, ФР — факторы риска.
Обсуждение
Как и предполагалось, число ССО за 10 лет у лиц исходно низкого или умеренного риска было невелико. Однако у ~9% из них все же развились те или иные осложнения. Причем фатальные осложнения произошли у 9 (1,6%) человек. Что же отличало этих больных? Небольшое количество событий не позволяет вычленить предикторы развития каждой из конечных точек. Поэтому для повышения статистической мощности было принято решение провести анализ по комбинированной конечной точке (ССО). В малой выборке с ожидаемо небольшим числом конечных точек именно введение комбинации ФР позволяет учесть их совместный вклад в прогноз осложнений ССЗ.
Когорта больных, включенных в исследование, была достаточно однородна по возрасту и показателям липидного профиля. Это объясняет незначительное влияние этих “классических” ФР на прогноз и позволяет сконцентрировать внимание на так называемых “новых” или “дополнительных” ФР. Первичный анализ показал, что развитие ССО ассоциировалось с более высоким уровнем АД на момент включения (“классическим ФР), а также уровнем мочевины и вчСРБ в плазме крови.
Исходный уровень мочевины >8,0 ммоль/л повышал 10-летний риск ССО более чем в 5 раз. Следует подчеркнуть, что почечная недостаточность (ХБП 4-5 стадий) была критерием невключения больных в исследование. Повышение уровня мочевины у лиц без ХБП в литературе объясняется целым рядом причин: гиповолемией, диетой с избыточным содержанием белка, другими метаболическими нарушениями [2]. Описано повышение уровня мочевины, ассоциированное с возрастом, связанное, помимо прочих причин, с активацией ренин-ангиотензин-альдостероновой и симпатоадреналовой систем у пожилых людей [3]. Ряд исследователей рассматривают мочевину как интегральный маркер метаболического статуса. Например, при неалкогольной жировой болезни печени уровень мочевины повышается, что объясняют активацией ренин-ангиотензин-альдостероновой системы и развитием инсулинорезистентности при этой патологии. Описана корреляция между уровнем общего ХС, ТГ, аспартатаминотрансферазы, аланинаминотрансферазы и мочевины у больных неалкогольной жировой болезнью печени без АГ и СД 2 типа [4]. В настоящее время уровень мочевины все чаще расценивается как дополнительный ФР ССО, однако подавляющее число работ, подтверждающих этот тезис, было проведено на больных с тяжелой почечной патологией. Например, метаанализ Ostfeld R, et al. (2016) показал, что прирост уровня мочевины на каждый 1 мг/дл сопряжен с увеличением риска реваскуляризации у больных ИБС, причем ассоциации с риском ОИМ и ССС выявлено не было [5]. Работ, изучающих влияние уровня мочевины на риски ССО у больных с нормальной или немного сниженной скоростью клубочковой фильтрации, немного. Так Kirtane AJ, et al. (2005) [6] показали роль мочевины как неблагоприятного прогностического фактора при ОИМ у таких больных. В работе Xie Y, et al. (2018) показано повышение риска развития СД 2 типа при увеличении уровня мочевины (ОШ =1,15 на каждые 10 мг/дл) независимо от скорости клубочковой фильтрации [7]. Описана ассоциация уровня мочевины с состоянием сосудистой стенки у лиц без ХБП и клинических проявлений атеросклероза (мужчин >45 лет и женщин >55 лет) [8]. Уровень мочевины >5,3 ммоль/л повышал шанс утолщения комплекса интима-медиа брахиоцефальных артерий в 2,16 раз [8]. Воздействие мочевины на сосудистую стенку может быть опосредовано таким механизмом, как окислительный стресс, что ведет к снижению синтеза оксида азота (NO) и развитию эндотелиальной дисфункции [9]. Также рассматривается прямое повреждающее действие мочевины на эндотелий даже при ее относительно невысокой концентрации в сыворотке крови [10].
Вторым значимым отличием группы ССО+ был более высокий уровень СРБ. Причем, “отрезная точка”, равная 2,3 мг/л, укладывалась в референсные значения (0-5 мг/л), что соответствует представлению об очень небольшом повышении уровня СРБ в ответ на сосудистое воспаление. вчСРБ, как наиболее доступный в рутинной практике маркер хронического воспаления, показал себя как интегральный ФР ССО в ряде крупных клинических исследований, прогностическая ценность которого приближается к таковой для “классических” ФР. В то же время, ряд авторов считает использование этого параметра для стратификации риска нецелесообразным, а вклад его незначительным [11]. Связано это с тем, что уровень вчСРБ в плазме крови очень чутко реагирует на множество разнообразных факторов, включая возраст, курение, ожирение, АГ, СД, заболевания соединительной ткани, травмы, инфекции и многое другое, включая межлабораторную вариабельность показателей [1]. Тем не менее, в представленном исследовании этот фактор влиял на прогноз независимо от пола и АГ. В настоящее время большинство экспертов склоняются к мнению, что биомаркеры воспаления, в т.ч. вчСРБ, целесообразно определять именно у пациентов с умеренным риском ССО [12]. Системное вялотекущее воспаление, по современным представлениям, является общим патогенетическим механизмом большинства связанных с возрастом состояний: метаболических нарушений, СД 2 типа, атеросклероза, ХБП и др.
Больные, впоследствии перенесшие ССО, исходно отличались большей сосудистой жесткостью. Увеличение жесткости сосудистой стенки свидетельствует о ее ремоделировании, свойственном, в первую очередь, больным АГ. Метаанализ подтвердил, что СПВ обладает прогностической ценностью в отношении риска развития ССО, а значит, может использоваться как “дополнительный” ФР [13], особенно у больных порогового риска по стандартным шкалам [1]. В консенсусном документе 2012г по оценке артериальной жесткости в повседневной практике рассмотрен новой метод расчета СПВ (путем умножения 12 м/с на 0,8 с последующим округлением полученной величины). Была рекомендована новая пороговая величина 10 м/с [14]. В 2009г,когда выполнялось настоящее исследование, такой пересчет не проводился. Поэтому “отрезная точка” несколько выше — 13,1 м/с, что в пересчете составляет 10,4 м/с и соответствует современным рекомендациям. СПВ тесно связана с уровнем АД во время исследования и, возможно, поэтому не показала себя независимым предиктором ССО, в отличие от CAVI, характеризующего истинную жесткость артериальной сосудистой стенки, а не степень ее растяжения. Именно CAVI показал себя независимым предиктором ССО в настоящем исследовании.
Для стандартизации стратификации риска ССО у пациентов с риском по SCORE <5% был разработан оригинальный алгоритм, включающий “классические” и “новые” ФР, который позволяет вычленить группу больных с более высоким реальным риском, а значит, требующих внимания кардиолога и, возможно, раннего начала медикаментозной профилактики атеросклероза.
Ограничения исследования. Исследование имеет несколько ограничений: прежде всего, это небольшое количество включенных больных; второе ограничение — относительно большие “потери” участников из-за невозможности с ними связаться (замена или отключение телефонных номеров (n=122), переезд без сообщения контактных данных (n=13), отказ от телефонного контакта (n=9), а также расформирование и перепрофилирование части поликлиник. Третьей проблемой было получение данных о ССО в ходе телефонного контакта, т.е. со слов пациентов или их родственников. В частности, все сведения о причинах смерти были получены исключительно по данным опроса родственников при телефонном контакте, не было возможности получить ни копии справок о смерти, ни тем более протокола патологоанатомического исследования. Предоставили впоследствии медицинскую документацию, подтверждающую ССО, при очном визите или дистанционно, только 31 человек из 48, перенесших ССО. Четвертое, в рамках исследования невозможно было оценить наличие и характер терапии, получаемой пациентами. Все эти ограничения снижают ценность полученных данных и позволяют рассматривать исследование как пилотное, позволяющее разработать протокол для будущих крупных проспективных исследований.
Таким образом, такие показатели как уровень мочевины, вчСРБ, СПВ и CAVI могут рассматриваться как потенциальные ФР развития ССО у больных низкого/умеренного риска, рассчитанного по стандартным шкалам. Сочетание “классических” и “новых” ФР демонстрирует кумулятивный эффект в плане повышения вероятности ССО у больных с риском ССО по SCORE 0-4%. Так, сочетание дислипидемии + САД >130 мм рт.ст. + СПВ >13,1 м/с + вчСРБ >2,3 мг/л увеличивало в выборке 10-летний риск ССО в 3,6 раз. Вклад этих факторов и возможность их использования для стратификации риска в реальной клинической практике требует дальнейшего изучения в ходе масштабных эпидемиологических исследований.
Отношения и деятельность. Работа выполнена без задействования грантов и финансовой поддержки от общественных, некоммерческих и коммерческих организаций. Источник финансирования — федеральный бюджет (госзадание НИРАААА-А18-118022290081-0).
Список литературы
1. Cardiovascular prevention 2017. National guidelines. Russian Journal of Cardiology. 2018;(6):7-122. (In Russ.) doi:10.15829/1560-4071-2018-6-7-122.
2. Dossetor JB. Creatininemia versus uremia. The relative significance of blood urea nitrogen and serum creatinine concentrations in azotemia. Ann Intern Med. 1966;65:1287-99. doi:10.7326/0003-4819-65-6-1287.
3. Kazory A. Emergence of blood urea nitrogen as a biomarker of neurohormonal activation in heart failure. Am J Cardiol. 2010;106:694-700. doi:10.1016/j.amjcard.2010.04.024.
4. Ercin CN, Dogru T, Bagci S, et al. The relationship between blood urea nitrogen levels and metabolic, biochemical, and histopathologic findings of nondiabetic, nonhypertensive patients with nonalcoholic fatty liver disease. Turk J Med Sci. 2016;46(4):985-91. doi:10.3906/sag-1502-144.
5. Ostfeld R, Spinelli M, Mookherjee D, et al. The association of blood urea nitrogen levels and coronary artery disease. Einstein J Biol Med. 2016;25:3. doi:10.23861/EJBM20102573.
6. Kirtane AJ, Leder DM, Waikar SS. Serum blood urea nitrogen as an independent marker of subsequent mortality among patients with acute coronary syndromes and normal to mildly reduced glomerular filtration rates. J Am Coll Cardiol. 2005;45:1781-6. doi:10.1016/j.jacc.2005.02.068.
7. Xie Y, Bowe B, Li T. Higher blood urea nitrogen is associated with increased risk of incident diabetes mellitus. Kidney Int. 2018;93(3):741-52. doi:10.1016/j.kint.2017.08.033.
8. Pykhtina VS, Strazhesko ID, Boytsov SА, et al. The relationship of kidney function with arterial wall condition in individuals without chronic kidney disease and cardiovascular diseases. Klinicheskaya praktika. 2017;30(2):14-21. (In Russ.) doi:10.17816/clinpract8214-21.
9. Zieman SJ, Melenovsky V, Kass DA. Mechanisms, pathophysiology, and therapy of arterial stiffness. Arterioscler Thromb Vasc Biol. 2005;25:932-43. doi:10.1161/01.ATV.0000160548.78317.29.
10. Muller-Delp JM, Spier SA, Ramsey MW, et al. Aging impairs endothelium-dependent vasodilation in rat skeletal muscle arterioles. Am J Physiol Heart Circ Physiol. 2002;283:H1662-72. doi:10.1152/ajpheart.00004.2002.
11. Emerging Risk Factors Collaboration, Kaptoge S, Di Angelantonio E, Pennells L, et al. C-reactive protein, fibrinogen, and cardiovascular disease prediction. N Engl J Med. 2012;367:1310-20. doi:10.1056/NEJMoa11074777.
12. Greenland P, Alpert JS, Beller GA, et al. 2010 ACCF/AHA guideline for assessment of cardiovascular risk in asymptomatic adults: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol. 2010;56:e50-103. doi:10.1016/j.jacc.2010.09.001.
13. Vlachopoulos C, Aznaouridis K, Stefanadis C. Prediction of cardiovascular events and all-cause mortality with arterial stiffness: a systematic review and meta-analysis. J Am Coll Cardiol. 2010;55:1318-27. doi:10.1161/HYPERTENSIONAHA.112.194779.
14. Van Bortel LM, Laurent S, Boutouyrie P, et al. Expert consensus document on the measurement of aortic stiffness in daily practice using carotid-femoral pulse wave velocity. J Hypertens. 2012;30(3):445-8. doi:10.1097/HJH.0b013e32834fa8b0.
Об авторах
М. Д. СмирноваРоссия
Мария Дмитриевна Смирнова — доктор медицинских наук, старший научный сотрудник отдела амбулаторных лечебно-диагностических технологий.
Москва Тел.: +7 (926) 165-11-39
О. Н. Свирида
Россия
Ольга Николаевна Свирида — кандидат медицинских наук, младший научный сотрудник отдела амбулаторных лечебно-диагностических технологий.
Москва
Т. В. Фофанова
Россия
Татьяна Вениаминовна Фофанова — доктор медицинских наук, старший научный сотрудник отдела амбулаторных лечебно-диагностических технологий.
Москва
З. Н. Бланкова
Россия
Зоя Николаевна Бланкова — кандидат медицинских наук, научный сотрудник отдела амбулаторных лечебно-диагностических технологий.
Москва
Е. Б. Яровая
Россия
Елена Борисовна Яровая — доктор медицинских наук, профессор кафедры теории вероятностей механико-математического факультета, отделение математики.
Москва
Ф. Т. Агеев
Россия
Фаиль Таипович Агеев — доктор медицинских наук, профессор, руководитель отдела амбулаторных лечебно-диагностических технологий.
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Смирнова М.Д., Свирида О.Н., Фофанова Т.В., Бланкова З.Н., Яровая Е.Б., Агеев Ф.Т. Алгоритм прогнозирования сердечно-сосудистых осложнений у больных низкого/умеренного риска с использованием “классических” и “новых” факторов (по данным десятилетнего наблюдения). Кардиоваскулярная терапия и профилактика. 2021;20(6):2799. https://doi.org/10.15829/1728-8800-2021-2799
For citation:
Smirnova M.D., Svirida O.N., Fofanova T.V., Blankova Z.N., Yarovaya E.B., Ageev F.T. Algorithm for predicting cardiovascular events in low/moderate risk patients using traditional and new factors: data from 10-year follow-up study. Cardiovascular Therapy and Prevention. 2021;20(6):2799. (In Russ.) https://doi.org/10.15829/1728-8800-2021-2799
JATS XML

























































