Перейти к:
Факторы развития ранних послеоперационных когнитивных нарушений у пациентов после коронарного шунтирования и каротидной эндартерэктомии
https://doi.org/10.15829/1728-8800-2022-3166
Аннотация
Цель. Определение связи между факторами периоперационного периода и показателями когнитивных функций у пациентов после операции коронарного шунтирования (КШ) в сочетании с односторонней каротидной эндартерэктомией (КЭЭ).
Материал и методы. Обследованы 56 мужчин в периоперационном периоде КШ в сочетании с односторонней КЭЭ, среднего возраста 64,0±7,1 лет. Оценка когнитивных функций выполнялась до и на 5-7 сут. после операции при помощи “Status PF”. Расширенное психометрическое исследование включало оценку произвольного внимания (корректурная проба Бурдона — КП Бурдона), кратковременной памяти (тесты “Запоминание 10 чисел”, “Запоминание 10 слов”, и “Запоминание 10 слогов”), нейродинамику (время сложной зрительно-моторной реакции, уровень функциональной подвижности нервных процессов, работоспособность головного мозга, а также количество ошибок (КО) в этих заданиях и пропущенных положительных сигналов). Концентрацию нейрон-специфической енолазы (НСЕ) и белка S100β в сыворотке крови пациентов до операции, через 24 ч и на 5-7 сут. после операции КШ определяли с помощью иммуноферментного анализа.
Результаты. В раннем послеоперационном периоде увеличение времени реакции (р=0,031) сопровождалось увеличением КО в данном тесте (р=0,042), уменьшением количества запоминаемых чисел (р=0,022). Через 24 ч и на 5-7 сут. после операции различий между периоперационным уровнем НСЕ не было (p1-2-3>0,05). Через 24 ч после операции КШ уровень белка S100β повышался на 9,0% (р=0,001), регрессия белка S100β к дооперационному уровню наблюдалась к 5-7 сут. после операции.
Заключение. Выявлена связь между фактором КШ и объемом внимания (r=-0,518; p=0,031), временем реакции уровня функциональной подвижности (УФП) (r=0,476; p=0,041), КО, совершенных при выполнении УФП (r=0,449; p=0,032). Выявлена корреляционная связь между фактором нейрохимических маркеров количеством переработанных знаков на 1-й мин КП Бурдона (r=-0,642; p=0,014), общим количеством переработанных знаков в КП Бурдона (r= -0,617; p=0,017). Комбинированный фактор периоперационного периода ассоциировался с временем реакции УФП (r=0,609; p=0,041), количеством переработанных знаков на 4-й мин (r= -0,490; p=0,017) и общим количеством переработанных знаков в КП Бурдона (r=-0,334; p=0,006).
Ключевые слова
Для цитирования:
Малева О.В., Соснина А.С., Учасова Е.Г., Иванов С.В., Трубникова О.А., Барбараш О.Л. Факторы развития ранних послеоперационных когнитивных нарушений у пациентов после коронарного шунтирования и каротидной эндартерэктомии. Кардиоваскулярная терапия и профилактика. 2022;21(5):3166. https://doi.org/10.15829/1728-8800-2022-3166
For citation:
Maleva O.V., Sosnina A.S., Uchasova E.G., Ivanov S.V., Trubnikova O.A., Barbarash O.L. Factors for early postoperative cognitive impairment in patients after coronary bypass surgery and carotid endarterectomy. Cardiovascular Therapy and Prevention. 2022;21(5):3166. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3166
Введение
Известно, что коронарное шунтирование (КШ) ассоциируется с развитием послеоперационной когнитивной дисфункции. Это состояние плохо выявляется, характеризуется прогрессирующим, необратимым течением. При этом показано, что изолированная каротидная эндартерэктомия (КЭЭ) положительно влияет на когнитивные функции [1][2]. Медико-социальная значимость послеоперационной когнитивной дисфункции определяет необходимость поиска способов ее диагностики и профилактики. Влияние сочетанной операции в объеме КШ и КЭЭ на когнитивные функции в послеоперационном периоде изучено недостаточно.
Одним из перспективных направлений диагностики повреждения головного мозга является оценка нейрохимических маркеров его субклинического повреждения [3]. Известно, что белок S100β преимущественно продуцируется астроцитами, а повышенный его уровень в периферической крови свидетельствует об активации астроцитов при гипоксии, хронической и острой. В некоторых исследованиях при выполнении изолированной КЭЭ и КШ в условиях искусственного кровообращения (ИК) была показана высокая прогностическая значимость повышенного уровня белка S100β в отношении неврологических осложнений первого и второго типов [4][5]. Другой маркер повреждения головного мозга — нейрон-специфическая енолаза (НСЕ), для которой ранее была показана связь со степенью повреждения нейронов и гематоэнцефалического барьера при кардиохирургических операциях [6][7].
Известно, что в некоторых клинических ситуациях, например, при симптомном течении ишемической болезни сердца и атеросклероза прецеребральных артерий, проведение сочетанной операции КЭЭ и КШ является единственным подходом, направленным на снижение риска периоперационных сердечно-сосудистых событий. Однако не все кардиохирурги поддерживают одновременное проведение этих двух операций, т.к. считают его агрессивным, прежде всего, для головного мозга. Исследование когнитивных функций и определение нейрохимических маркеров повреждения головного мозга могло бы способствовать выявлению клинически важных факторов агрессии периоперационного периода.
С учетом этого, целью исследования стало определение связи между факторами периоперационного периода и показателями когнитивных функций у пациентов после операции КШ в сочетании с односторонней КЭЭ.
Материал и методы
Дизайн исследования одобрен Локальным этическим комитетом НИИ КПССЗ. Критерии включения в исследование: планируемая симультанная операция, включающая прямую реваскуляризацию миокарда и одностороннюю (симптом зависимую, при наличии в анамнезе острого нарушения мозгового кровообращения, или гемодинамически значимую, при асимптомном течении прецеребрального атеросклероза) КЭЭ, подписанное информированное согласие на исследование. Критериями невключения были: сочетание КШ с коррекцией патологии клапанов сердца, гемодинамически значимый или симптомный стеноз прецеребральных артерий с контралатеральной стороны вмешательства. Критерием исключения на любом из этапов исследования служил отказ пациента от продолжения участия.
В исследование включено 56 пациентов-мужчин с мультифокальным атеросклерозом прецеребральных и коронарных артерий из стационарных отделений НИИ КПССЗ, среднего возраста 64,0±7,1 лет, подписавшие
добровольное информированное согласие на участие в исследовании. Среди пациентов 13 (23,2%) имели симптомное проявление прецеребрального атеросклероза. Асимптомный стеноз прецеребральных артерий имели 43 (76,8%) пациента. Пациенты принимали базовую медикаментозную терапию согласно действующим клиническим рекомендациям по ведению пациентов с ишемической болезнью сердца, артериальной гипертензий, хронической сердечной недостаточностью и периферическим атеросклерозом.
Для исключения деменции пациентам проводили оценку по шкале Mini-Mental State Examination (MMSE) и Frontal Assеssment Battery (FAB). Расширенное психометрическое тестирование состояло из оценки произвольного внимания (корректурная проба Бурдона — КП Бурбона), а именно, врабатываемость и истощаемость внимания, оцениваемые по количеству просмотренных знаков на 1-й и 4-й мин теста. Кратковременная память оценивалась по тестам “Запоминание 10 чисел”, “Запоминание 10 слов”, и “Запоминание 10 слогов”. Показатели нейродинамики включали: время сложной зрительно-моторной реакции (СЗМР), уровень функциональной подвижности нервных процессов (УФП), работоспособность головного мозга (РГМ), а также количество ошибок (КО) в этих заданиях и пропущенных положительных сигналов (ППС) при выполнении теста УФП и РГМ. Оценка когнитивных функций выполнялась за 24 48 ч до операции и спустя 5-7 сут. после операции при помощи “Status PF”.
Клинико-анамнестическая характеристика пациентов представлена в таблице 1.
Таблица 1
Клинический “портрет” пациентов (n=56)

Примечание: ВСА — внутренняя сонная артерия, NASCET — North American Symptomatic Carotid Endarterectomy Trial, MMSE — MiniMental State Examination, FAB — Frontal Assеssment Battery.
Оперативное вмешательство в виде изолированного КШ и симультанной операции в объеме односторонней КЭЭ было определено мультидисциплинарной командой с учетом клинических рекомендаций для пациентов с гемодинамически значимым сочетанным атеросклерозом прецеребральных и коронарных артерий.
Симультанная операция выполнялась следующей методикой: первым этапом проводилась КЭЭ, вторым этапом выполнялось КШ в условиях ИК.
Интраоперационные параметры соответствовали средним показателям учреждения, которые в последующем были включены в факторный анализ (таблица 2).
Таблица 2
Интраоперационные клинические показатели (n=56)

Примечание: EuroSCORE − European System for Cardiac Operative Risk Evaluation.
В раннем послеоперационном периоде выявлялись ожидаемые клинические осложнения после кардиохирургической операции в условиях ИК, структура которых представлена в таблице 3. У двух пациентов зарегистрировано избыточное поступление отделяемого из операционной области по дренажам в 1-е сут. послеоперационного периода, что потребовало ревизии. Послеоперационная пневмония застойного характера развилась у 4 пациентов, пароксизм фибрилляции предсердий — у 10 человек, с медикаментозной кардиоверсией, гидроторакс или гидроперикард, не требующие инвазивного вмешательства — у 32 пациентов. У большинства пациентов выявлялась послеоперационная анемия легкой и средней степени тяжести, которая не требовала кровевосполнения.
Таблица 3
Структура клинических осложнений раннего послеоперационного периода (n=56)

Концентрацию НСЕ (референсное значение 0-16,3 нг/мл) и белка S100β (референсное значение 54,0±15,6 нг/л) в сыворотке крови пациентов до операции, через 24 ч и на 7 сут. после операции определяли с помощью иммуноферментного анализа с использованием наборов фирмы “Fujirebio” (Бельгия). Образцы крови из периферической вены забиралась в пробирки с активатором свертывания, подвергалась центрифугированию 15 мин при 3000 об./мин. Сыворотка аликвотировалась и замораживалась при температуре -700С до анализа.
Оценивались интраоперационные факторы, доказавшие свое влияние на когнитивные функции в послеоперационном периоде: время ИК и пережатия аорты, средняя температура перфузии и артериальное давление, длительность пережатия сонных артерий, количество шунтов, а также процент возможного риска периоперационных осложнений (European System for Cardiac Operative Risk Evaluation — EuroSCORE). Оценка нейронспецифических белков обусловлена возможностью выявления скрытого, субклинического повреждения головного мозга.
Статистическую обработку результатов исследования проводили с использованием статистического пакета “Statistica 10.0”, “IBM SPSS 26”. Для показателей с нормальным распределением данные представлены в виде среднего (Mean) ± стандартного отклонения (SD); нейропсихологические показатели, распределение которых отклонялось от нормального (одновыборочный критерий Колмогорова-Смирнова), представлены в виде медианы (Мe) и интерквартильного размаха (Q25; Q75). Учитывая значения, отклоняющиеся от нормального распределения нейропсихологических и нейрохимических показателей, для установления различий между пред- и послеоперационными показателями в исследуемой группе использовали непараметрический критерий знаковых рангов Уилкоксона (критерий Вилкоксона), для сравнения зависимых групп по количественному признаку применяли критерий Фридмана. При попарном сравнении использовали критерий Тьюки. Корреляционный анализ выполняли с использованием непараметрического критерия Спирмена. Различия считались статистически значимыми при p<0,05. Факторный анализ включал анализ главных компонент в программе “IBM SPSS 26”. Методом анализа главных компонент отобраны ведущие факторы периоперационного периода. Вклад каждого фактора и общий накопленный вклад факторов в суммарную дисперсию соответствовал существенной доле периоперационных показателей, объясняемых значениями отобранных компонент. Для дальнейшего анализа использовались факторы, чьи собственные значения превышают единицу (формальные критерии). С целью получения структуры, которой соответствует большое значение нагрузки каждой переменной только по одному фактору и малое по всем остальным факторам, использовался вариант вращения факторов “Варимакс”. Степень применимости факторного анализа к данной выборке рассчитан с помощью критерия адекватности выборки Кайзера-Мейера-Олкина.
Результаты
Проведена сравнительная оценка исходных показателей когнитивных функций с ранним послеоперационным периодом (таблица 4). Выявлено увеличение скорости СЗМР (р=0,031), что сопровождалось увеличением КО в данном тесте (р=0,042). Кроме того, выявлено снижение количества запоминаемых чисел (р=0,022).
Таблица 4
Динамика показателей когнитивных функций в периоперационном периоде сочетанной операции КШ и КЭЭ (n=56)

Примечание: ВСО — всего совершено ошибок, КВ — коэффициент внимания, ВВЗ — время выполнения задания.
Проведено сравнение нейрохимических показателей в дооперационном и в раннем послеоперационном периоде. Выявлено, что исходный уровень НСЕ соответствовал диапазону референсных значений 6,2±2,3 нг/мл. Через 24 ч и через 5-7 сут. после операции различий в уровне НСЕ не было (p1-2-3>0,05) (рисунок 1).
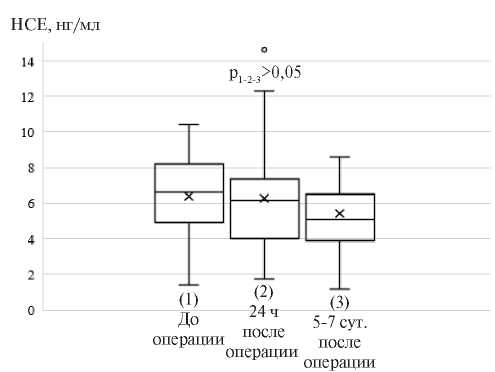
Рис. 1 Динамика НСE (нг/мл) в периоперационном периоде сочетанной операции КШ и КЭЭ (n=56).
Выявлено, что исходный уровень белка S100β в сыворотке крови был выше референсных показателей — 86,3±22,3 нг/мл. Через 24 ч после операции отмечалось повышение концентрации белка S100β на 9,0% (р=0,001), возвращение его уровня к дооперационным значениям наблюдалась к 5-7 сут. послеоперационного периода (рисунок 2).
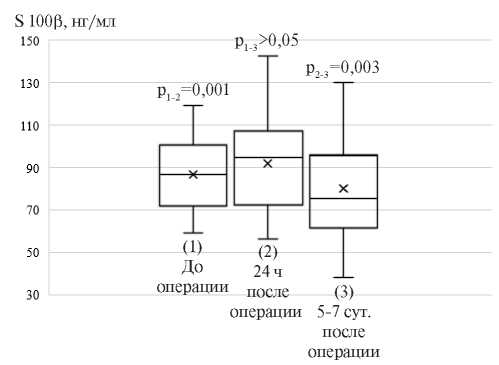
Рис. 2 Динамика белка S100β (нг/мл) в периоперационном периоде сочетанной операции КШ и КЭЭ (n=56).
Таким образом, в раннем послеоперационном периоде, через 24 ч после операции, повышалась концентрация нейрохимического маркера повреждения головного мозга — белка S100β. На 5-7 сут. после операции ухудшались показатели кратковременной памяти, согласно тесту “Запоминание 10 чисел” и СЗМР.
С учетом того, что наиболее значимыми факторами являются периоперационные показатели, описанные ранее, а также нейрохимические маркеры, методом анализа главных компонент отобраны три ведущих фактора периоперационного периода. Вклад каждого фактора в суммарную дисперсию показателей периоперационных показателей составил 21,7, 15,0 и 13,9%, соответственно. Общий накопленный вклад факторов в суммарную дисперсию составил 50,7%. Исходя из этого, можно сделать вывод о существенной доле периоперационных показателей, объясняемых значениями отобранных факторов (таблица 5).
Таблица 5
Характеристики отобранных факторов периоперационного периода при сочетанной операции КШ и КЭЭ (n=56)

Факторная нагрузка для каждой из исследуемых переменных (учитывались величины изменений показателей), позволяющая оценить корреляцию с отобранными факторами, представлена в виде матрицы (наибольшие значения факторной нагрузки выделены курсивом) (таблица 6).
Таблица 6
Матрица факторных нагрузок для периоперационных показателей (n=56)
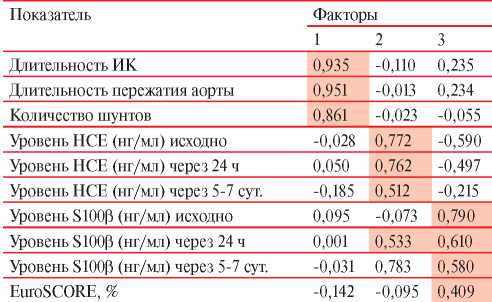
Первый фактор условно обозначен, как фактор “Коронарного шунтирования”, т.к. состоял из числа дистальных анастомозов (шунтов), длительности ИК и пережатия аорты. Второй фактор состоял из нейрохимических показателей — НСЕ и белка S100β, обозначенный как “Нейрохимический фактор”. Третий компонент включал такой параметр, как риск периоперационных осложнений и уровни белка S100β в периоперационном периоде, в связи с чем получил название “Комбинированный фактор”. Исходя из значения меры выборочной адекватности КайзераМейера-Олкина, составляющей 0,618, была установлена удовлетворительная адекватность применения факторного анализа к исследуемой выборке. При оценке распределения переменных с помощью критерия сферичности Бартлетта уровень значимости составил p<0,001, что свидетельствовало о приемлемости проведения факторного анализа.
Результаты корреляционного анализа связи вы - явленных факторов с показателями когнитивных функций в послеоперационном периоде представлены в таблице 7. Установлена статистически значимая обратная корреляционная связь между фактором КШ и объемом внимания (ОВ) (r=-0,518; p=0,031). Кроме того, фактор КШ ассоциировался с временем реакции УФП (r=0,476; p=0,041), КО, совершенных при выполнении этого задания (r=0,449; p=0,030).
Таблица 7
Корреляционный анализ показателей взаимосвязи факторов периоперационного периода и когнитивных функций в раннем послеоперационном периоде (n=56)
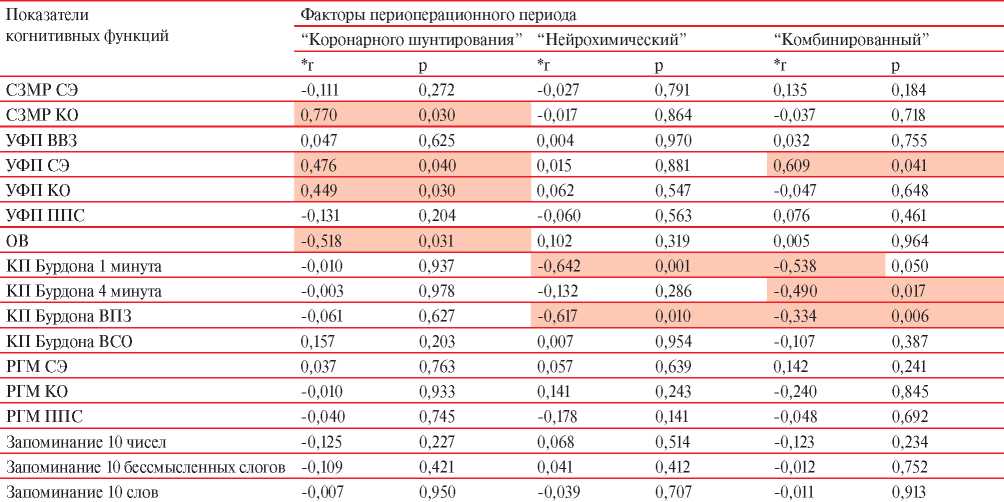
Примечание: *r — коэффициент корреляции Спирмена; ВСО — всего совершено ошибок, ВВЗ — время выполнения задания.
Выявлена корреляционная связь между фактором нейрохимических маркеров и количеством переработанных знаков на 1 мин КП Бурдона (r= -0,642; p=0,010), общим количеством (всего) переработанных знаков (ВПЗ) в КП Бурдона (r=-0,617; p=0,010). Комбинированный фактор периоперационного периода ассоциировался с временем реакции УФП (r=0,609; p=0,041), количеством переработанных знаков на 4-ой мин КП Бурдона (r= -0,490; p=0,017), общим количеством ВПЗ в КП Бурдона (r=-0,334; p=0,006).
Таким образом, периоперационные факторы КШ ассоциируются с ухудшением внимания и нейродинамики в раннем послеоперационном периоде.
Обсуждение
Отсутствие значимой динамики во всех доменах когнитивных функций раннего послеоперационного периода объясняется исходными показателями когнитивных функций, соответствующими умеренным когнитивным расстройствам, согласно среднему баллу MMSE, а также гетерогенностью исследуемой группы пациентов. Однако даже ухудшение в двух доменах когнитивного статуса свидетельствует об ухудшении когнитивных функций после сочетанной операции.
Основным источником белка S100β являются астроциты. В некоторых исследованиях отмечена связь повышенного уровня белка S100β, НСЕ и ранней послеоперационной когнитивной дисфункцией у пациентов после кардиохирургических операций [8][9] и при выполнении изолированной КЭЭ [3][4]. Повышение уровня белка S100β в раннем послеоперационном периоде, вероятнее всего, также обусловлено синдромом церебральной реперфузии, который имел сочетанный генез на фоне ИК и восстановление церебрального кровотока после КЭЭ.
Иные данные получены по НСЕ. НСЕ представляет собой гликолитический нейронспецифический изофермент енолазы. Повышенный уровень НСЕ является признаком ишемического повреждения нейронов головного мозга. В настоящем исследовании повышения уровня данного маркера в раннем послеоперационном периоде не выявлено, следовательно, можно предположить, что интраоперационное воздействие на гематоэнцефалический барьер − обратимое явление и нейроны не испытывали значимой ишемии при выполнении двух операций. В пользу этой теории свидетельствуют и другие исследования, где не подтвержден факт повышения этого маркера после КЭЭ. В исследовании при сравнении изолированной КЭЭ и стентирования сонных артерий повышение НСЕ не наблюдалось в течение 24 ч после КЭЭ, тогда как значимое нарастание отмечено через 48 ч после операции, что сами авторы объясняют феноменом реперфузии [7][10].
Белок S100β оказался более информативным нейрохимическим маркером повреждения головного мозга по сравнению с НСЕ, благодаря более высокой чувствительности глии к гипоксии, генерализованному высвобождению, тогда как НСЕ в данном исследовании не оказался диагностически значимым.
Наиболее значимые факторы периоперационного периода и маркеры повреждения головного мозга связаны с когнитивными функциями в раннем послеоперационном периоде. Выявлено, что выраженность факторов КШ и комбинированного фактора ассоциировалось с худшими показателями внимания и памяти, тогда как фактор нейрохимии ассоциировался только с ухудшением внимания в раннем послеоперационном периоде. С другой стороны, не подтвердивший в факторном анализе свою значимость компонент КЭЭ — длительность пережатия сонных артерий, не исключает усиление эффекта реперфузии и, как следствие, снижение когнитивных функций, что требует продолжения исследований в этом направлении.
Заключение
Таким образом, периоперационные факторы при сочетанной операции в объеме КШ и КЭЭ связаны с показателями когнитивных функций в раннем послеоперационном периоде, что необходимо учитывать при выполнении такой операции с целью обеспечения профилактики вторичных сердечно-сосудистых осложнений; это, в свою очередь, позволит снизить степень когнитивной дисфункции в раннем послеоперационном периоде.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Wente MN, Veit JA, Bassi C, et al. Postpancreatectomy hemorrhage (PPH): an International Study Group of Pancreatic Surgery (ISGPS) definition. Surgery. 2007;142:20-5. doi:10.1016/j.surg.2007.02.001.
2. Wolk S, Radosa CG, Distler M, et al. Risk Factors for In-hospital Mortality After Transarterial Intervention After Postpancreatectomy Hemorrhage. CardioVascular and Interventional Radiology 2020;43:1342-52. doi:10.1007/s00270-020-02509-2.
3. Ревишвили А. Ш., Кригер А. Г., Горин Д. С. и др. Эндоваскулярные вмешательства в хирургии поджелудочной железы. Хирургия. Журнал им. Н. И. Пирогова. 2018;(4):4-16. doi:10.17116/hirurgia201844-16.
4. Гоев А. А., Берелавичус С. В., Карчаков С. С. и др. Аррозионные кровотечения после резекционных вмешательств на поджелудочной железе. Хирургия. Журнал им. Н. И. Пирогова. 2021;(1):77-82. doi:10.17116/hirurgia202101177.
5. Roulin D, Cerantola Y, Demartines N, et al. Systematic Review of Delayed Postoperative Hemorrhage after Pancreatic Resection. J Gastrointest Surg. 2011;15:1055-62. doi:10.1007/s11605-011-1427-8.
6. Guan Y, Zhang JL, Li XH, et al. Postpancreatectomy hemorrhage with negative angiographic findings: outcomes of empiric embolization compared to conservative management. Clin Imaging 2021;73:119-23. doi:10.1016/j.clinimag.2020.12.009.
7. Hassold N, Wolfschmidt F, Dierks A, et al. Effectiveness and outcome of endovascular therapy for late-onset postpancreatectomy hemorrhage using covered stents and embolization. J Vasc Surg. 2016;64:1373-83. doi:10.1016/j.jvs.2016.05.071.
8. Алекян Б. Г., Варава А. Б., Лусников В. П. и др. Результаты рентгенэндоваскулярного лечения позднего артериального кровотечения после операций на поджелудочной железе. Опыт одного центра. Хирургия. Журнал им. Н. И. Пирогова. 2022;(3):5-15. doi:10.17116/hirurgia20220315.
9. Kleive D, Sahakyan M, Søreide K, et al. Risk for hemorrhage after pancreatoduodenectomy with venous resection. Langenbecks Arch Surg. 2018;403:949-57. doi:10.1007/s00423-018-1721-y.
Об авторах
О. В. МалеваРоссия
Ольга Валерьевна Малева — кандидат медицинских наук, старший научный сотрудник лаборатории нейрососудистой патологии.
Кемерово, Тел.: +7 (905) 900-18-56
А. С. Соснина
Россия
Анастасия Сергеевна Соснина — кандидат медицинских наук, научный сотрудниклаборатории нейрососудистой патологии.
Кемерово
Е. Г. Учасова
Россия
Евгения Геннадьевна Учасова — кандидат медицинских наук, научный сотрудниклаборатории исследований гомеостаза.
Кемерово
С. В. Иванов
Россия
Сергей Васильевич Иванов — доктор медицинских наук, ведущий научный сотрудник лаборатории рентгенэндоваскулярной и реконструктивной хирургии сердца и сосудов.
Кемерово
О. А. Трубникова
Россия
Ольга Александровна Трубникова — доктор медицинских наук, зав. лаборатории нейрососудистой патологии.
Кемерово
О. Л. Барбараш
Россия
Ольга Леонидовна Барбараш — доктор медицинских наук, профессор, член-корр. РАН, директор.
Кемерово
Дополнительные файлы
Рецензия
Для цитирования:
Малева О.В., Соснина А.С., Учасова Е.Г., Иванов С.В., Трубникова О.А., Барбараш О.Л. Факторы развития ранних послеоперационных когнитивных нарушений у пациентов после коронарного шунтирования и каротидной эндартерэктомии. Кардиоваскулярная терапия и профилактика. 2022;21(5):3166. https://doi.org/10.15829/1728-8800-2022-3166
For citation:
Maleva O.V., Sosnina A.S., Uchasova E.G., Ivanov S.V., Trubnikova O.A., Barbarash O.L. Factors for early postoperative cognitive impairment in patients after coronary bypass surgery and carotid endarterectomy. Cardiovascular Therapy and Prevention. 2022;21(5):3166. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3166
JATS XML

























































