Перейти к:
Современные аспекты диагностики и лечения пациентов со спонтанной диссекцией коронарных артерий
https://doi.org/10.15829/1728-8800-2022-3193
Аннотация
Спонтанная диссекция коронарных артерий (СДКА) является одной из наиболее редких причин острого коронарного синдрома. СДКА чаще всего встречается у женщин <60 лет (≥90% случаев) в сравнении с мужчинами (10-12%). Бурное развитие технологий, применяемых в интервенционной кардиологии, позволило улучшить диагностику и понять механизм развития данного патологического состояния. Тактика ведения пациентов с СДКА дискутабельна и значительно отличается от подходов к лечению атеросклеротического поражения коронарных артерий. В обзоре представлены результаты проведенных в последние годы исследований. Также описана ангиографическая классификация СДКА, алгоритм диагностики и выбор оптимальной тактики лечения в зависимости от клинических проявлений.
Ключевые слова
Для цитирования:
Зайнобидинов Ш.Ш., Хелимский Д.А., Баранов А.А., Бадоян А.Г., Крестьянинов О.В. Современные аспекты диагностики и лечения пациентов со спонтанной диссекцией коронарных артерий. Кардиоваскулярная терапия и профилактика. 2022;21(8):3193. https://doi.org/10.15829/1728-8800-2022-3193
For citation:
Zainobidinov Sh.Sh., Khelimsky D.A., Baranov A.A., Badoyan A.G., Krestyaninov O.V. Modern aspects of diagnosis and treatment of patients with spontaneous coronary artery dissection. Cardiovascular Therapy and Prevention. 2022;21(8):3193. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3193
Введение
Спонтанная диссекция коронарных артерий (СДКА) является одной из наиболее редких причин острого коронарного синдрома (ОКС). При этом данное состояние чаще всего встречается у женщин <60 лет (≥90% случаев) в сравнении с мужчинами (10-12%) [1][2]. Пациенты с ОКС, обусловленным СДКА, имеют более высокие показатели внутригоспитальной летальности в сравнении с пациентами с ОКС без СДКА (6,8 vs 3,4%) [3]. Первое упоминание о СДКА было сделано Pretty в 1931г у 42-летней женщины по данным аутопсии [4]. Спустя 40 лет Claudon DG, et al. (1972) сообщили, что СДКА ассоциируется с беременностью. Авторы в своем исследовании наблюдали СДКА у 40% молодых женщин в послеродовом периоде [5].
В последние годы частота выявления СДКА у пациентов с ОКС стала значительно выше. Данная тенденция, в первую очередь, обусловлена развитием эндоваскулярных технологий и более широким применением современных устройств для внутрисосудистой визуализации, таких как оптическая когерентная томография (ОКТ) и внутрисосудистое ультразвуковое исследование (ВСУЗИ).
Эпидемиология
Частота распространенности СДКА точно не установлена. Данный факт, вероятно, связан с трудностями диагностики СДКА. По данным проведенных раннее ретроспективных исследований частота выявления СДКА в общей популяции варьируется от 0,07 до 0,2% случаев [6]. При этом частота данной патологии при ОКС значительно выше и составляет 1-4% случаев, а среди женщин с ОКС <60 лет может встречаться до 35% случаев [7-10]. Аналогичные данные представили Clare R, et al. (2019): в своем исследовании авторы сообщили, что распространенность СДКА у пациентов с ОКС <50 лет составляла 44,7% случаев, а среди пациентов более старшего возраста (50-65 лет) — 37,5% [11]. Кроме того, по данным аутопсии было установлено, что СДКА стала причиной внезапной сердечной смерти (ВСС) в 0,5% случаев (n=1647), преимущественно у лиц молодого возраста [9].
Патогенез
СДКА — это надрыв стенки коронарных артерий (КА), не связанный с атеросклерозом, травмой или ятрогенным воздействием и приводящий к образованию ложного просвета с проникновением крови между ее оболочками (tunica intima, tunica media и tunica externa) с формированием интрамуральной гематомы (ИМГ), что приводит к обструкции (тромбозу) КА с последующим развитием инфаркта миокарда (ИМ) и/или ВСС.
На сегодняшний день выделяют два основных механизма развития СДКА: 1) разрыв интимы КА с формированием ИМГ и обструкции истинного русла; 2) спонтанный разрыв vasa vasorum, с последующим развитием ИМГ (данный механизм изучен недостаточно и требует дальнейших исследований) (рисунки 1, 2) [6][12].
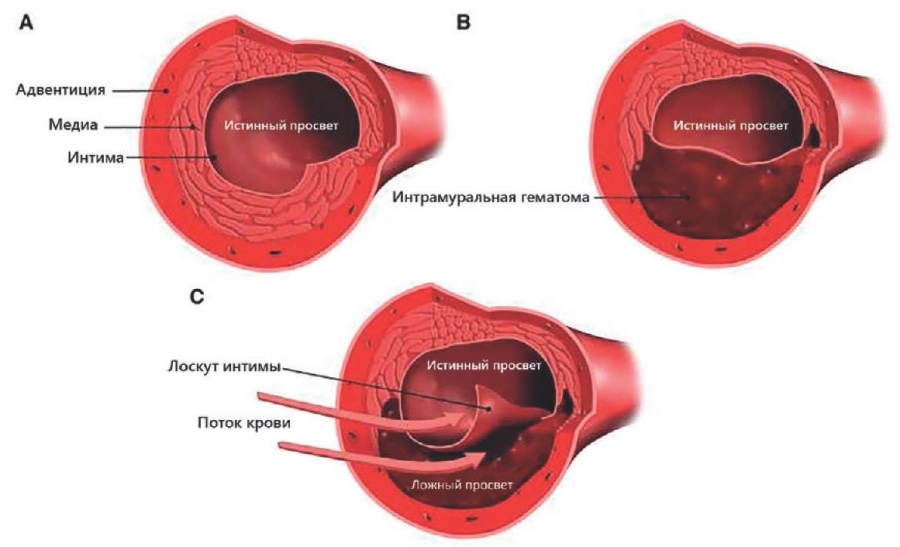
Риc. 1 Механизмы развития СДКА. (А) КА в норме; (В) ИМГ со сдавлением истинного русла; (С) Разрыв/расслоение интимы с формированием ложного просвета [12].

Рис. 2 Патоморфология СДКА. (А) Макроскопическая картина СДКА. (В) Гистологическая картина. На срезах видно сдавление истинного русла ИМГ, расположенная в ложном канале КА [6].
Примечание: TL — истинный просвет, FL — ложный просвет.
Основными предрасполагающими факторами развития СДКА чаще всего являются фибромускулярная дисплазия (ФМД), системные воспалительные заболевания (системная красная волчанка, болезнь Крона, полиартрит и саркоидоз), системные заболевание соединительной ткани (синдромы Марфана, Элерса-Данло и др.), артериопатии, вовлекающие КА и др.
Распространенность ФМД среди пациентов со СДКА варьируется от 34 до 72% случаев [1][13]. Помимо этого, в развитии СДКА немаловажную роль играют и другие факторы, которые могут увеличить риск развития СДКА. В некоторых исследованиях было показано, что длительная заместительная гормональная терапия в отдаленном периоде может привести к изменению архитектоники стенок КА и за счет этого к увеличению риска развития СДКА [13]. Частота встречаемости основных предрасполагающих факторов представлена в таблице 1. Как правило, распространённость классических факторов риска сердечно-сосудистых заболеваний у данной группы пациентов ниже, чем у пациентов с ОКС вследствие разрыва атеросклеротической бляшки (АСБ) [4][5][14].
Таблица 1
Частота встречаемости основных факторов риска развития СДКА [1][2][13]

СДКА и беременность
В ряде исследований было показано, что СДКА чаще всего встречается в послеродовом периоде и редко — в антенатальном периоде (преимущественно в третьем триместре) [15][16]. Elkayam U, et al. (2014) проанализировали данные коронарографий 129 женщин с ОКС (средний возраст 34±6 год), обусловленным СДКА. У 56 (43%) пациентов была выявлена СДКА, у 34 (27%) — атеросклероз КА, у 22 (17%) — тромбоз КА без признаков атеросклеротического поражения и у 14 (11%) — нормальные КА. В данном ретроспективном исследовании СДКА в 73% случаев встречалась в послеродовом периоде и только в 21% случаев — в третьем триместре беременности [17]. Патогенез СДКА в послеродовом периоде до сих пор остается неясным. Данное патологическое состояние, вероятно, связано с гормональными изменениями во время беременности, которые приводят к изменению архитектоники стенок КА и, тем самым, увеличивают риск развития СДКА. Высокий уровень прогестерона в крови вызывает нарушение синтеза коллагена и снижает содержание мукополисахаридов, приводя к истончению стенки КА. Кроме этого, высокий уровень эстрогена, который наблюдается во время беременности, вызывает состояние гиперкоагуляции, что впоследствии приводит к тромбообразованию [18].
Данные факторы могут привести к расслоению интимы и формированию ложного просвета с развитием его тромбоза. Некоторые авторы отметили, что гемодинамические изменения (увеличение объёма циркулирующей крови и сердечного выброса во время беременности также могут увеличивать риск развития СДКА [19].
Клиническая картина
Клинические проявления СДКА могут варьировать от классической картины ИМ с подъемом сегмента ST (ИМпST) до бессимптомного течения. По данным некоторых авторов клиника ОКС — ИМ без подъема сегмента ST (ИМбпST) с повышением уровня кардиоспецифических ферментов среди пациентов со СДКА встречается от 13 до 77,6% случаев, а ИМпST от 29,7 до 52,7%, соответственно [20-23]. Кардиогенный шок при СДКА встречается в 1,2-10,9% случаев, желудочковая тахикардия (ЖТ) или фибрилляция желудочков (ФЖ) в 3,68,1% случаев, а остановка сердца может развиваться в 1,6-2,8% случаев [1][13][20]. По данным ретроспективного исследования среди 196 пациентов со СДКА самым частым симптомом был загрудинная боль 96,4% [21]. Частота таких менее встречающихся симптомов, как тошнота и/или рвота, диспноэ и боль в спине и др. представлены в рисунке 3 [21].
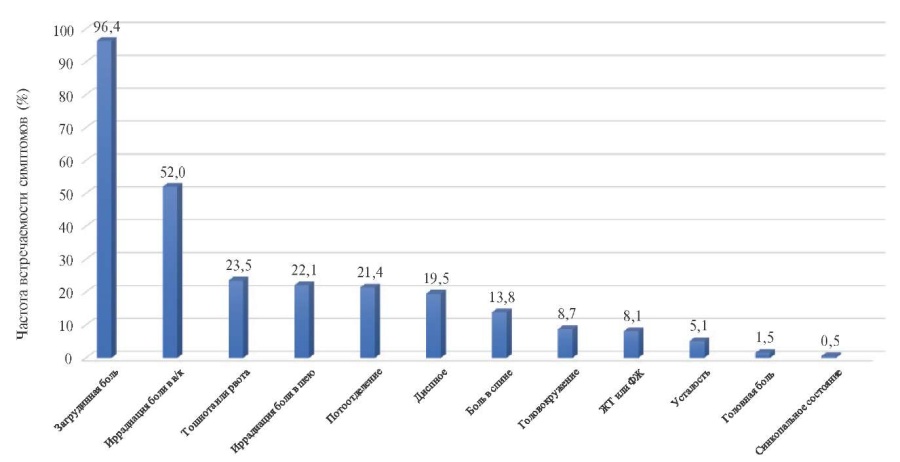
Рис. 3 Частота встречаемости основных клинических симптомов при СДКА [21].
Примечание: в/к — верхняя конечность, ЖТ — желудочковая тахикардия, ФЖ — фибрилляция желудочков.
Диагностика
Качественная и ранняя диагностика играет ключевую роль в определении тактики ведения пациентов со СДКА. Селективная коронарография с внутрисосудистой визуализацией остается “золотым стандартом” в диагностике СДКА. Селективная коронарография является широкодоступным и основным методом в диагностике ОКС, однако она имеет значительные ограничения в диагностике СДКА. Это в первую очередь связано с низкой разрешающей способностью двухмерного изображения (рисунок 4) [24].
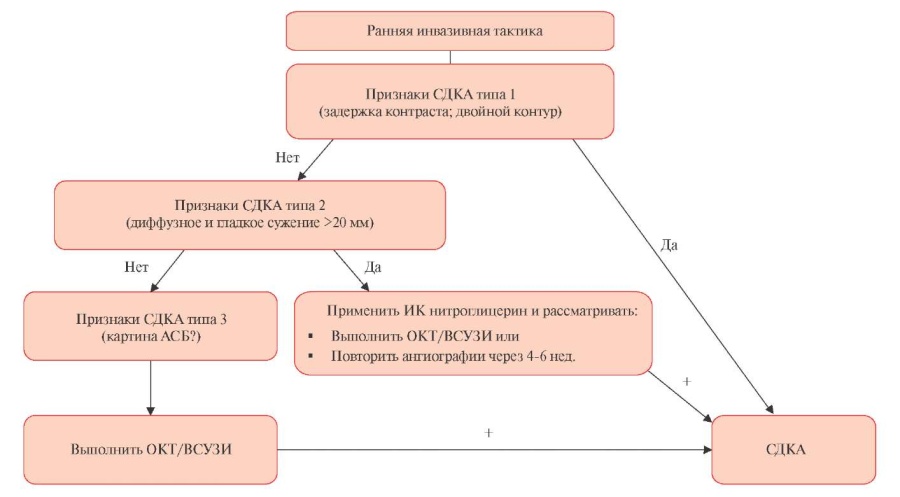
Рис. 4 Алгоритм диагностики СДКА [24].
Примечание: АСБ — атеросклеротическая бляшка, ВСУЗИ — внутрисосудистое ультразвуковое исследование, ИК — интракоронарно, ОКТ — оптическая когерентная томография, СДКА — спонтанная диссекция коронарных артерий.
Применение устройств для внутрисосудистой визуализации, таких как ВСУЗИ и ОКТ, существенно упрощает диагностику СДКА. Однако эти методы во многих клинических центрах в большинстве случаев недоступны для рутинного применения. Кроме того, эти методы ассоциированы с дополнительными рисками и увеличивают стоимость процедуры. В настоящее время отсутствуют специфические биомаркеры, которые могли бы упростить диагностику СДКА. Дифференциальная диагностика СДКА включает в себя: атеросклероз КА, спазм КА, кардиомиопатия такоцубо, эмболия КА и ИМ без обструкции КА [6]. Классическим ангиографическим признаком СДКА является наличие интимального лоскута с образованием двойного контура с задержкой контрастного вещества в просвете КА. Однако по некоторым данным этот признак отсутствует в >70% случаев [25]. Saw J (2014) ранее представил ангиографическую классификацию СДКА [24].
Классификация СДКА
Тип 1. Представляет собой ангиографическую картину наличия интимального лоскута с образованием двойного контура контрастирования и задержкой контраста в просвете КА. Патогномоничный признак СДКА (рисунок 5) [6].
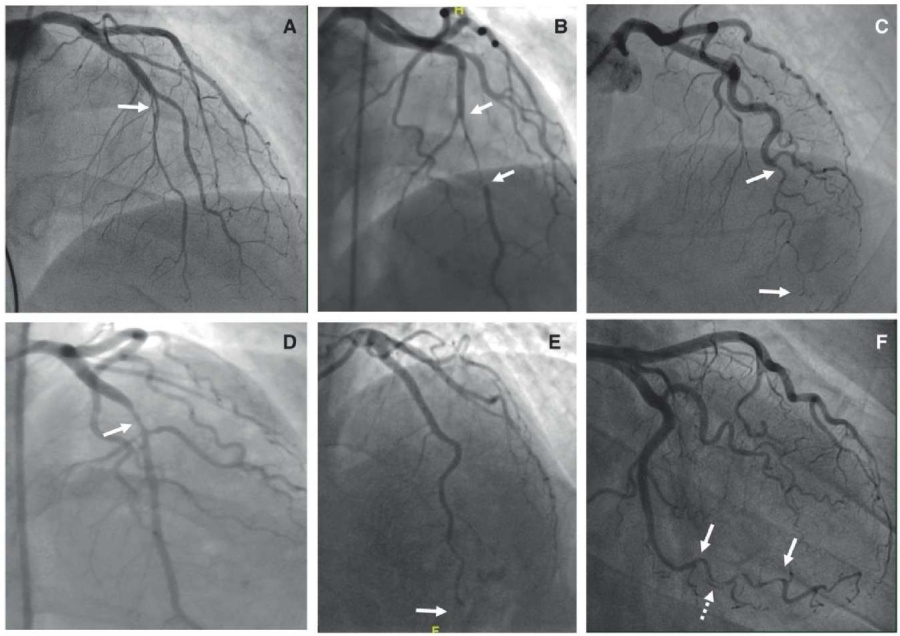
Рис. 5 Ангиографическая картина СДКА. (А) Тип 1; (В) Тип 2А; (С) Тип 2В; (D) Тип 3; (Е) Тип 4 [6].
Тип 2. Характеризуется диффузным сужением различной степени выраженности и длины (обычно >20 мм), преимущественно располагающимсясти от ангиографических признаков выделяют следующие подтипы:
Тип 2А. Характеризуется ограничением поражения между двумя здоровыми участками артерии (рисунок 6) [20].
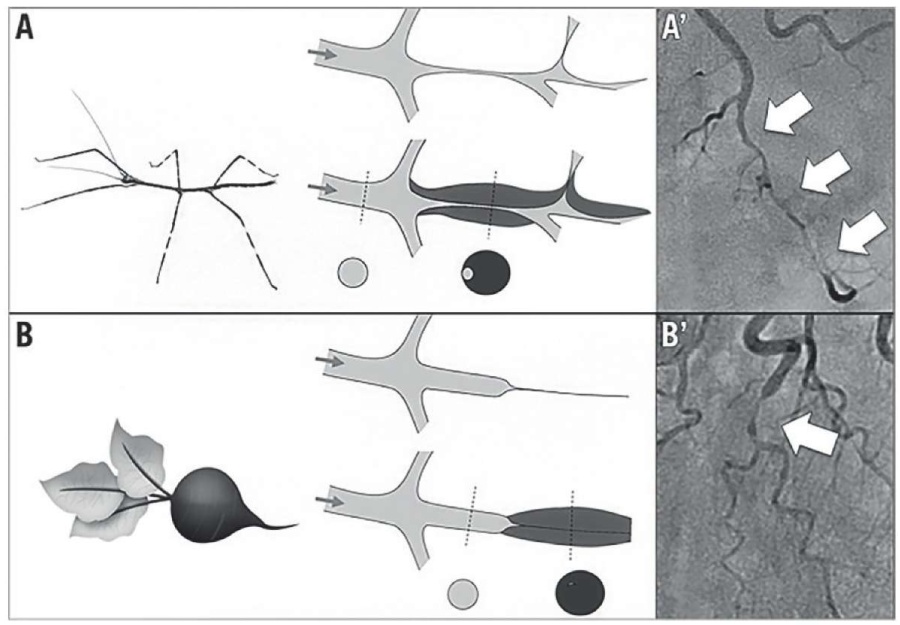
Рис. 6 Патогномоничные признаки 2 типа СДКА; (А) симптом палочника; (В) симптом редиски [20].
Тип 2В. Характеризуется распространением поражения на всем протяжении дистального русла (рисунок 7) [6].
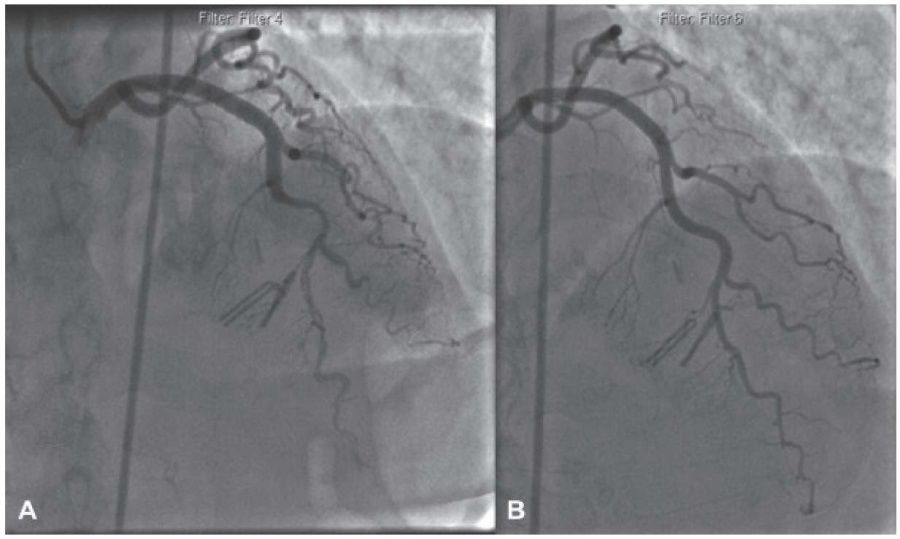
Рис. 7 (А) Диффузное поражение средней трети ПНА, СДКА тип 2В. (В) На контрольной коронарограмме, полученной через несколько мес., можно наблюдать заживление диссекции с восстановлением проходимости КА [6].
Тип 3. Ангиографически напоминает картину АСБ с локальным сужением просвета КА (обычно <20 мм). Для дифференциальной диагностики данного типа СДКА требуется применение ОКТ или ВСУЗИ, что позволяет с высокой точностью определить истинный диаметр КА и наличие ИМГ.
Тип 4. Характеризуется поражением дистальных сегментов КА с развитием тотальной окклюзии КА.
В клинической практике чаще всего встречается 2 тип СДКА (в 60,2%), на следующем месте 1 тип (в 29,0%), и в 10,8% случаев — 3 тип СДКА. В большинстве случаев СДКА наблюдается в бассейне одной КА (86,9%). По данным многоцентрового исследования СДКА чаще всего (52,1%) наблюдалась в бассейне передней нисходящей артерии (ПНА) [1]. Частота поражения остальных артериальных бассейнов представлена в таблице 2 [1].
Таблица 2
Частота поражения КА при СДКА

Примечание: ОА — огибающая артерия, ПКА — правая коронарная артерия, ПНА — передняя нисходящая артерия, п/с — проксимальный сегмент, стЛКА — ствол левой коронарной артерии.
Роль мультиспиральной компьютерной томографии коронарных артерий (МСКТКА) в диагностике СДКА
В настоящее время данные о применении МСКТКА при СДКА ограничены. Преимуществом МСКТКА перед инвазивной коронарографией при диагностике СДКА является неинвазивность процедуры, благодаря чему можно получить информацию о морфологии коронарного русла без увеличения риска ятрогенной диссекции КА. Однако этот метод характеризуется более низкой пространственной разрешающей способностью, что существенно ограничивает точную диагностику СДКА (особенно средних и дистальных сегментов КА). По некоторым данным специфичность и чувствительность МСКТКА при диагностике ишемической болезни сердца составляет 83 и 94%, соответственно [26][27]. В проведенных ранее исследованиях сообщалось, что МСКТКА не всегда позволяет выявить СДКА, что ограничивает ее рутинное применение в клинической практике [28-31]. С учетом вышеперечисленных данных в настоящее время инвазивная коронарография с применением ВСУЗИ и/или ОКТ остается методом выбора в диагностике СДКА. При этом МСКТКА может быть использована в качестве дополнительного метода для оценки морфологии КА после проведенной консервативной и/или инвазивной терапии.
Клинические и ангиографические признаки, которые увеличивают вероятность выявления СДКА у пациентов с ОКС:
- ОКС у женщин <60 лет,
- отсутствие классических факторов риска развития сердечно-сосудистых заболеваний,
- ОКС в раннем послеродовом периоде,
- отсутствие или незначительное атеросклеротическое поражение КА,
- ФМД в анамнезе,
- выраженная извитость КА [32],
- склонность к поражению дистальных сегментов КА (в сравнении с атеросклеротическим поражением КА) [33],
- начало и/или конец ложного просвета (ИМГ) ограничивается участком отхождения боковой ветви [19],
- взаимосвязь участка диссекции с мышечными мостиками КА [34].
Роль ОКТ и ВСУЗИ в диагностике СДКА
Применение ОКТ или ВСУЗИ позволяет более точно оценить истинный диаметр КА, степень распространения ИМГ, степень ее сужения и протяженность поражения КА, что облегчает диагностику СДКА. При этом ОКТ является более предпочтительным методом ввиду более высокой разрешающей способности (10-20 нм) в сравнении с ВСУЗИ (~150 нм) [35][36], что позволяет с высокой точностью определить: наличие разрыва и/или расслоения интимы, наличие диссекции или тромба в просвете КА, протяженность пораженного участка, распознавать истинный и ложный просвет КА, а также наличие АСБ в КА (рисунок 8) [36]. Однако оба метода имеют потенциальные риски для распространения диссекции КА. Это, в первую очередь, связано с проведением коронарного проводника и катетера для визуализации через пораженный участок КА. Кроме того, введение контраста с высоким давлением при проведении ОКТ, может привести к распространению диссекции КА.
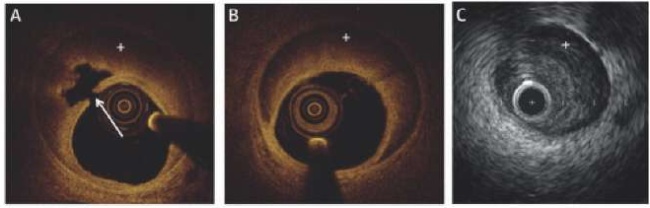
Рис. 8 Внутрисосудистая визуализация при СДКА. (А) ОКТ — картина СДКА. Стрелкой указан разрыв интимы КА и ИМГ (отмечена значком “+”); (В) ОКТ — картинка ИМГ без разрыва интимы КА. (С) ВСУЗИ — картина ИМГ [36].
Необходимо отметить, что выполнение данных процедур более опытными специалистами может привести к снижению частоты осложнений и улучшению прогноза неблагоприятных сердечно-сосудистых событий (ССС). В таблице 3 перечислены преимущества и недостатки проведения внутрисосудистой визуализации при СДКА.
Таблица 3
Преимущества и недостатки применения внутрисосудистой визуализации в диагностике СДКА

Примечание: КА — коронарная артерия, ОКТ — оптическая когерентная томография, СДКА — спонтанная диссекция коронарных артерий, ЧКВ — чрескожное вмешательство.
Лечение
Оптимальная стратегия лечения пациентов со СДКА до сих пор не определена в отличие от пациентов с атеросклерозом КА. Это связано с отсутствием крупных рандомизированных клинических исследований, сравнивающих первичную консервативную стратегию с инвазивной стратегией. Однако в последнее время появилось множество сообщений об эффективности применения первичной консервативной стратегии у гемодинамически стабильных пациентов [8][33][37]. По данным крупного многоцентрового исследования, которое включало 750 пациентов (средний возраст 51,8±10,2; женщины — 88,5%) со СДКА, консервативная терапия проводилась в 86,4% (n=648) случаев. При этом дополнительная реваскуляризация потребовалась в 2,3% случаев — ЧКВ в 2%, а АКШ в 0,3% [1]. Эффективность консервативной стратегии также наблюдали и в серии других проспективных исследований [23][38][39]. Основные характеристики и результаты краткосрочных и долгосрочных наблюдений представлены в таблице 4.
Таблица 4
Основные характеристики и результаты краткосрочных и долгосрочных наблюдений пациентов со СДКА

Примечание: АКШ — аортокоронарное шунтирование, ВЛ — внутригоспитальная летальность, Вн. ИМ — внутригоспитальный ИМ, ГБ — гипертоническая болезнь, Д — дислипидемия, ИМбпST — инфаркт миокарда без подъёма сегмента ST, ИМпST — инфаркт миокарда с подъёмом сегмента ST, Ж. пол — женский пол, КТ — консервативная терапия, н/с — не сообщалось, НС — нестабильная стенокардия, ОКС — острый коронарный синдром, СВ — средний возраст, СПН — средний период наблюдения, ТЛ — тромболизис, ФМД — фибромускулярная дисплазия, ЧКВ — чрескожное вмешательство.
Консервативная стратегия, как правило, была рекомендована гемодинамически стабильным пациентам при отсутствии высокого риска развития неблагоприятных ССС. Признаками высокого риска развития неблагоприятных ССС считались поражение ствола левой КА (стЛКА), продолжающаяся и/или рецидивирующая ангинозная боль, ЖТ/ФЖ, кардиогенный шок и др. (рисунок 9).

Рис. 9 Алгоритм лечения СДКА [36].
Примечание: АКШ — аортокоронарное шунтирование, АПФ — ангиотензинпревращающий фермент, БРА — блокаторы рецепторов ангиотензина, ВАБК — внутриаортальная баллонная контрпульсация, ЖТ — желудочковая тахикардия, ИКД — имплантируемый кардиовертердефибриллятор, КШ — коронарное шунтирование, ЛЖ — левый желудочек, ЛКА — левая коронарная артерия, ОА — огибающая артерия, ПНА — передняя нисходящая артерия, СДКА — спонтанная диссекция коронарных артерий, ФЖ — фибрилляция желудочков, ЧКВ — чрескожное вмешательство, ЭКМО — экстракорпоральная мембранная оксигенация.
Консервативная терапия у данной группы пациентов имеет ряд особенностей. Сообщалось, что применение тромболитиков может привести к распространению диссекции КА и/или прогрессированию ИМГ, тем самым ухудшая прогноз неблагоприятных ССС [40]. В связи с этим следует избегать применения тромболитиков и двойной антитромбоцитарной терапии (ДАТТ) при СДКА.
В международном многоцентровом ретроспективном регистре “DISCO registry” сравнивали эффективность антитромбоцитарной монотерапии (АТМТ) с ДАТТ у 314 пациентов со СДКА. Из 314 пациентов 199 получили первичную консервативную терапию. Пациенты были разделены на две группы. Первая группа (группа АТМТ) из 67 пациентов в 93% случаев получили АТМТ с ацетилсалициловой кислотой (АСК), клопидогрел в 6% случаев и тикагрелор в 1%. Во вторую группу были включены 132 пациента, которые получили ДАТТ. В группе ДАТТ в 62,9% случаев пациенты в составе ДАТТ получили клопидогрел + АСК, а в 36,4% — тикагрелор + АСК.
Длительность ДАТТ у 96,3% пациентов составляла 12 мес. Средний период наблюдения составил 11,8±1,3 мес. По результатам этого исследования было показано, что ДАТТ ассоциирована с высокими показателями неблагоприятных ССС (МАСЕ, Major Adverse Cardiovascular Events) в сравнении с АТМТ (18,9 vs 6,0%; отношение рисков — 2,62; 95% доверительный интервал: 1,22-5,61; p=0,013). Кровотечение (не требующее госпитализации и/ или гемотрансфузии) наблюдалась у 15 (7,5%) пациентов (в группе ДАТТ у 12 (9,1%) vs у 3 (4,5%) пациентов в группе АТМТ; p=0,24). Кроме того, рецидив СДКА также чаще всего наблюдался в группе ДАТТ в сравнении с группой АТМТ –10 (7,6%) vs 2 (3,0%) случаев, соответственно [41].
Помимо этого, применение β-адреноблокаторов, ингибиторов ангиотензинпревращающего фермента и/или блокаторов рецептора ангиотензина при ОКС способствует уменьшению частоты неблагоприятных ССС. Saw J, et al. (2017) в исследовании, которое включало 327 пациентов (средний возраст 52,5±9,6) со СДКА сообщили, что применение β-адреноблокаторов было ассоциировано с значительным снижением частоты рецидива СДКА в отдаленном периоде наблюдения (отношение рисков — 0,36; 95% доверительный интервал: 0,18-0,73; р=0,004) [23].
ЧКВ при СДКА
Несмотря на то, что первичная консервативная стратегия в большинстве случаев считается предпочтительным методом лечения, ЧКВ остается основным методом лечения у гемодинамически нестабильных пациентов с продолжающейся и/или рецидивирующей ангинозной болью или тотальной окклюзией КА, особенно когда в поражение вовлечены стЛКА или ПНА. ЧКВ при СДКА ассоциируется высокой частотой перипроцедурных осложнений и низкими показателями ангиографического успеха. Tweet M, et al. (2014) в исследовании, которое включало 189 пациентов со СДКА, сообщили о безуспешной реваскуляризации (ЧКВ) в 53% (n=95) случаев, а в 13% случаев пациентам потребовалось экстренное АКШ [33]. В Канадском многоцентровом исследовании сообщалось, что из 109 проведенных ЧКВ перипроцедурный успех составлял 29,1% случаев, в 40,8% случаев ЧКВ было частично успешным, а в 30,1% случаев — безуспешным [1]. Кроме того, ЧКВ не уменьшало риск рецидива СДКА или необходимость повторной реваскуляризации целевой артерии в отдаленном периоде наблюдения.
Высокая частота безуспешных ЧКВ у пациентов со СДКА обусловлена тем, что при проведении реваскуляризации КА очень высока вероятность развития ятрогенной диссекции КА, а также развитием мальаппозиции в отдаленном периоде наблюдения. Мальаппозиция стента происходит за счет разрешения ИМГ и восстановления истинного диаметра артерии [42]. Таким образом, эти факторы увеличивают частоту рестеноза и/или тромбоза стентов.
Некоторые эксперты предлагают использовать биорезорбируемые скаффолды вместо стентов с лекарственным покрытием (СЛП) для уменьшения частоты данных осложнений [43-47]. Наряду с этим некоторые авторы также продемонстрировали эффективность и безопасность применения режущих баллонов (РБ) при СДКА [48-50].
РБ применяются для формирования фенестрации между истинным и ложным просветом КА, которая способствует уменьшению объема ИМГ и декомпрессии истинного просвета КА. Таким образом, РБ в большинстве случаев позволяют избежать имплантации стента. Кроме того, в некоторых случаях РБ можно использовать перед имплантацией СЛП для уменьшения риска прогрессирования ИМГ в дистальном или проксимальном направлении и снижения вероятности мальаппозии стента в отдаленном периоде наблюдения, что, в свою очередь, послужит для снижения необходимости повторных реваскуляризаций.
При использовании РБ при СДКА необходимо учитывать ряд важных аспектов. Во-первых, при СДКА стенки КА очень хрупкие и высока вероятность их перфорации РБ. Во избежание этих осложнений Main A, et al. (2019) предлагают использовать РБ небольшого диаметра (на 0,5 мм меньше референсного диаметра пораженной артерии) и избегать применения РБ в артериях небольшого диаметра (≤2 мм). Кроме того, авторы предлагают выполнять баллонную ангиопластику невысоким давлением (в среднем, 2-4 атм.). Во-вторых, КА при СДКА в большинстве случаев очень извитые, что усложняет проведение баллонного катетера до пораженного сегмента КА; в связи с этим для баллонной ангиопластики необходимо рассматривать применение коротких РБ (6-10 мм). В-третьих, при сохранении клиники ангинозных болей можно выполнить повторную баллонную ангиопластику для получения оптимального ангиографического результата с кровотоком в целевой артерии TIMI 3 (Thrombolysis in Myocardial Infarction) и улучшения симптоматики пациента [48]. Возможные осложнения и рекомендации для снижения частоты осложнений при проведении ЧКВ у пациентов со СДКА представлены в таблице 5 [36].
Таблица 5
Возможные осложнения и рекомендации для снижения частоты осложнений при проведении ЧКВ у пациентов со СДКА

Примечание: ВСУЗИ — внутрисосудистое ультразвуковое исследование, ИМГ — интрамуральная гематома, КА — коронарная артерия, ОКТ — оптическая когерентная томография, РБ — режущий баллон, СДКА — спонтанная диссекция коронарных артерий, СЛП — стент с лекарственным покрытием, ЧКВ — чрескожное вмешательство.
Таким образом, очевидно, что ЧКВ является менее предпочтительной тактикой у стабильных пациентов со СДКА по причине высокого риска рестеноза/тромбоза стента в отдаленном периоде наблюдения.
Прогноз
При применении своевременной и оптимальной тактики лечения отдаленный прогноз у пациентов со СДКА, как правило, благоприятный. Отдаленная выживаемость у данной группы пациентов варьируется от 92 до 97,5%. При этом, по данным различных исследований, частота рецидивов СДКА может варьировать от 10,4 до 29,4% [11][19][23].
Заключение
СДКА является редкой патологией КА, которая часто приводит к развитию ОКС и нередко заканчивается ВСС. Применение методов внутрисосудистой визуализации облегчает диагностику СДКА, способствует оптимизации результатов ЧКВ и улучшению отдаленного прогноза. Учитывая сложность проведения ЧКВ и неоднозначные клинические результаты, первичную консервативную терапию следует рассматривать как стратегию по умолчанию у стабильных пациентов со СДКА.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Saw J, Starovoytov A, Humphries K, et al. Canadian spontaneous coronary artery dissection cohort study: in-hospital and 30day outcomes. Eur Heart J. 2019;40(15):1188-97. doi:10.1093/eurheartj/ehz007.
2. Combaret N, Gerbaud E, Dérimay F, et al. National French registry of spontaneous coronary artery dissections: prevalence of fibromuscular dysplasia and genetic analyses. EuroIntervention. 2021;17(6):508-15. doi:10.4244/eij-d-20-01046.
3. Mahmoud AN, Taduru SS, Mentias A, et al. Trends of Incidence, Clinical Presentation, and In-Hospital Mortality Among Women With Acute Myocardial Infarction With or Without Spontaneous Coronary Artery Dissection: A Population-Based Analysis. JACC Cardiovasc Interv. 2018;11(1):80-90. doi:10.1016/j.jcin.2017.08.016.
4. Pretty H. Dissecting aneurysm of coronary artery in a woman aged 42: rupture. BMJ. 1931;1:667.
5. Claudon DG, Claudon DB, Edwards J, et al. Primary dissecting aneurysm of coronary artery. A cause of acute myocardial ischemia. Circulation. 1972;45(2):259-66. doi:10.1161/01.CIR.45.2.259.
6. Adlam D, Alfonso F, Maas A, Vrints C, Writing Committee. European Society of Cardiology, acute cardiovascular care association, SCAD study group: a position paper on spontaneous coronary artery dissection. Eur Heart J. 2018;39(36):3353-68. doi:10.1093/eurheartj/ehy080.
7. Rashid HN, Wong DT, Wijesekera H, et al. Incidence and characterisation of spontaneous coronary artery dissection as a cause of acute coronary syndrome — A single-centre Australian experience. Int J Cardiol. 2016;202:336-8. doi:10.1016/j.ijcard.2015.09.072.
8. Nakashima T, Noguchi T, Haruta S, et al. Prognostic impact of spontaneous coronary artery dissection in young female patients with acute myocardial infarction: A report from the Angina Pectoris-Myocardial Infarction Multicenter Investigators in Japan. Int J Cardiol. 2016;207:341-8. doi:10.1016/j.ijcard.2016.01.188.
9. Hill SF, Sheppard MN. Non-atherosclerotic coronary artery disease associated with sudden cardiac death. Heart 2010;96:1119-25. doi:10.1136/hrt.2009.185157.
10. Vanzetto G, Berger-Coz E, Barone-Rochette G, et al. Prevalence, therapeutic management and medium-term prognosis of spontaneous coronary artery dissection: results from a database of 11,605 patients. Eur J Cardiothorac Surg. 2009;35(2):250-4. doi:10.1016/j.ejcts.2008.10.023.
11. Clare R, Duan L, Phan D, et al. Characteristics and Clinical Outcomes of Patients With Spontaneous Coronary Artery Dissection. J Am Heart Assoc. 2019;8(10):e012570. doi:10.1161/jaha.119.012570.
12. Hayes SN, Kim ESH, Saw J, et al. American Heart Association Council on Peripheral Vascular Disease; Council on Clinical Cardiology; Council on Cardiovascular and Stroke Nursing; Council on Genomic and Precision Medicine; and Stroke Council. Spontaneous Coronary Artery Dissection: Current State of the Science: A Scientific Statement From the American Heart Association. Circulation. 2018;137(19):e523-57. doi:10.1161/CIR.0000000000000564.
13. Saw J, Aymong E, Sedlak T, et al. Spontaneous coronary artery dissection: association with predisposing arteriopathies and precipitating stressors and cardiovascular outcomes. Circ Cardiovasc Interv. 2014;7(5):645-55. doi:10.1161/CIRCINTERVENTIONS.114.001760.
14. Sharma S, Kaadan MI, Duran JM, et al. Risk Factors, Imaging Findings, and Sex Differences in Spontaneous Coronary Artery Dissection. Am J Cardiol. 2019;123(11):1783-7. doi:10.1016/j.amjcard.2019.02.040.
15. Tweet MS, Hayes SN, Codsi E, et al. Spontaneous Coronary Artery Dissection Associated With Pregnancy. J Am Coll Cardiol. 2017;70(4):426-35. doi:10.1016/j.jacc.2017.05.055.
16. Havakuk O, Goland S, Mehra A, et al. Pregnancy and the Risk of Spontaneous Coronary Artery Dissection: An Analysis of 120 Contemporary Cases. Circ Cardiovasc Interv. 2017;10(3):e004941. doi:10.1161/CIRCINTERVENTIONS.117.004941.
17. Elkayam U, Jalnapurkar S, Barakkat MN, et al. Pregnancy-associated acute myocardial infarction: a review of contemporary experience in 150 cases between 2006 and 2011. Circulation. 2014;129(16):1695702. doi:10.1161/CIRCULATIONAHA.113.002054.
18. Farmer RD, Lawrenson RA. Oral contraceptives and venous thromboembolic disease: the findings from database studies in the United Kingdom and Germany. Am J Obstet Gynecol. 1998;179(3 Pt 2):S78-86. doi:10.1053/ob.1998.v179.a92634.
19. Tweet MS, Hayes SN, Pitta SR, et al. Clinical features, management, and prognosis of spontaneous coronary artery dissection. Circulation. 2012;126(5):579-88. doi:10.1161/CIRCULATIONAHA.112.105718.
20. Motreff P, Malcles G, Combaret N, et al. How and when to suspect spontaneous coronary artery dissection: novel insights from a single-centre series on prevalence and angiographic appearance. EuroIntervention. 2017;12(18):e2236-43. doi:10.4244/eij-d-16-00187.
21. Luong C, Starovoytov A, Heydari M, et al. Clinical presentation of patients with spontaneous coronary artery dissection. Catheter Cardiovasc Interv. 2017;89(7):1149-54. doi:10.1002/ccd.26977.
22. Hassan S, Prakash R, Starovoytov A, et al. Natural History of Spontaneous Coronary Artery Dissection With Spontaneous Angiographic Healing. JACC Cardiovasc Interv. 2019;12(6):51827. doi:10.1016/j.jcin.2018.12.011.
23. Saw J, Humphries K, Aymong E, et al. Spontaneous Coronary Artery Dissection: Clinical Outcomes and Risk of Recurrence. J Am Coll Cardiol. 2017;70(9):1148-58. doi:10.1016/j.jacc.2017.06.053.
24. Saw J. Coronary angiogram classification of spontaneous coronary artery dissection. Catheter Cardiovasc Interv. 2014;84(7):1115-22. doi:10.1002/ccd.25293.
25. Saw J, Mancini GB, Humphries K, et al. Angiographic appearance of spontaneous coronary artery dissection with intramural hematoma proven on intracoronary imaging. Catheter Cardiovasc Interv. 2016;87(2):E54-61. doi:10.1002/ccd.26022.
26. Leipsic J, Abbara S, Achenbach S, et al. SCCT guidelines for the interpretation and reporting of coronary CT angiography: a report of the Society of Cardiovascular Computed Tomography Guidelines Committee. J Cardiovasc Comput Tomogr. 2014;8(5):342-58. doi:10.1016/j.jcct.2014.07.003.
27. Budoff MJ, Dowe D, Jollis JG, et al. Diagnostic performance of 64-multidetector row coronary computed tomographic angiography for evaluation of coronary artery stenosis in individuals without known coronary artery disease: results from the prospective multicenter ACCURACY (Assessment by Coronary Computed Tomographic Angiography of Individuals Undergoing Invasive Coronary Angiography) trial. J Am Coll Cardiol. 2008;52(21):1724-32. doi:10.1016/j.jacc.2008.07.031.
28. Eleid MF, Tweet MS, Young PM, et al. Spontaneous coronary artery dissection: challenges of coronary computed tomography angiography. Eur Heart J Acute Cardiovasc Care. 2018;7(7):60913. doi:10.1177/2048872616687098.
29. Torres-Ayala SC, Maldonado J, Bolton JS, et al. Coronary computed tomography angiography of spontaneous coronary artery dissection: a case report and review of the literature. Am J Case Rep. 2015;16:130-5. doi:10.12659/ajcr.892805.
30. Alzand BSN, Vanneste L, Fonck D, et al. Spontaneous coronary artery dissection undissolved using cardiac computed tomography. Int J Cardiol. 2016;222:1040-1. doi:10.1016/j.ijcard.2016.08.058.
31. Tweet MS, Akhtar NJ, Hayes SN, et al. Spontaneous coronary artery dissection: Acute findings on coronary computed tomography angiography. Eur Heart J Acute Cardiovasc Care. 2019;8(5):467-475. doi.org/10.1177/2048872617753799.
32. Rogowski S, Maeder MT, Weilenmann D, et al. Spontaneous Coronary Artery Dissection: Angiographic Follow-Up and LongTerm Clinical Outcome in a Predominantly Medically Treated Population. Catheter Cardiovasc Interv. 2017;89(1):59-68. doi:10.1002/ccd.26383.
33. Tweet MS, Eleid MF, Best PJ, et al. Spontaneous coronary artery dissection: revascularization versus conservative therapy. Circ Cardiovasc Interv. 2014;7(6):777-86. doi:10.1161/circinterventions.114.001659.
34. Macaya F, Salinas P, Gonzalo N, et al. Spontaneous coronary artery dissection: contemporary aspects of diagnosis and patient management. Open Heart. 2018;5(2):e000884. doi:10.1136/openhrt-2018-000884.
35. Alfonso F, Paulo M, Dutary J. Endovascular imaging of angiographically invisible spontaneous coronary artery dissection. JACC Cardiovasc Interv. 2012;5(4):452-3. doi:10.1016/j.jcin.2012.01.016.
36. Saw J, Mancini GBJ, Humphries KH. Contemporary Review on Spontaneous Coronary Artery Dissection. J Am Coll Cardiol. 2016;68(3):297-312. doi:10.1016/j.jacc.2016.05.034.
37. Eleid MF, Guddeti RR, Tweet MS, et al. Coronary artery tortuosity in spontaneous coronary artery dissection: angiographic characteristics and clinical implications. Circ Cardiovasc Interv. 2014;7(5):656-62. doi:10.1161/circinterventions.114.001676.
38. García-Guimaraes M, Bastante T, Macaya F, et al. Spontaneous coronary artery dissection in Spain: clinical and angiographic characteristics, management, and in-hospital events. Rev Esp Cardiol (Engl Ed). 2021;74(1):15-23. English, Spanish. doi:10.1016/j.rec.2020.04.002.
39. Арефьев М.Н., Клыков Л.Л., Крылов В.В. и др. Инфаркт миокарда и проблема индивидуализации лечения. Клинический пример спонтанной диссекции двух коронарных артерий. Кардиоваскулярная терапия и профилактика. 2017;16(4):8892. doi:10.15829/1728-8800-2017-4-88-92.
40. Vrints CJ. Spontaneous coronary artery dissection. Heart. 2010;96(10):801-8. doi:10.1136/hrt.2008.162073.
41. Cerrato E, Giacobbe F, Quadri G, et al. DISCO Collaborators. Antiplatelet therapy in patients with conservatively managed spontaneous coronary artery dissection from the multicentre DISCO registry. Eur Heart J. 2021;42(33):3161-71. doi:10.1093/eurheartj/ehab372.
42. Lempereur M, Fung A, Saw J. Stent mal-apposition with resorption of intramural hematoma with spontaneous coronary artery dissection. Cardiovasc Diagn Ther. 2015;5(4):323-9. doi:10.3978%2Fj.issn.2223-3652.2015.04.05.
43. Watt J, Egred M, Khurana A, et al. 1-Year Follow-Up Optical Frequency Domain Imaging of Multiple Bioresorbable Vascular Scaffolds for the Treatment of Spontaneous Coronary Artery Dissection. JACC Cardiovasc Interv. 2016;9(4):389-91. doi:10.1016/j.jcin.2015.11.030.
44. Panoulas VF, Ielasi A. Bioresorbable scaffolds and drug-eluting balloons for the management of spontaneous coronary artery dissections. J Thorac Dis. 2016;8(10):E1328-30. doi:10.21037/jtd.2016.10.54.
45. Camacho Freire SJ, Gómez Menchero AE, Roa Garrido J, et al. Bioresorbable Scaffolds in Spontaneous Coronary Artery Dissection: Long-Term Follow-Up in 4 Patients. Tex Heart Inst J. 2017;44(6):405-10. doi:10.14503%2FTHIJ-16-6059.
46. Macaya F, Salinas P, Gonzalo N, et al. Long-term followup of spontaneous coronary artery dissection treated with bioresorbable scaffolds. EuroIntervention. 2019;14(13):1403-5. doi:10.4244/eij-d-18-00519.
47. Прохорихин А. А., Фартаков Е. И., Малаев Д. У. и др. Оценка эффективности и безопасности биодеградируемого каркаса Absorb: 6-месячные результаты регистра Gabi R: Russia. Патология кровообращения и кардиохирургия. 2019;23(1S):S26-33. doi:10.21688/1681-3472-2019-1S-S26-S33.
48. Main A, Lombardi WL, Saw J. Cutting balloon angioplasty for treatment of spontaneous coronary artery dissection: case report, literature review, and recommended technical approaches. Cardiovasc Diagn Ther. 2019;9(1):50-4. doi:10.21037/cdt.2018.10.11.
49. Kaya E, Iwata H, Miyazaki S, et al. Successful Coronary Flow Restoration by Stent-Free Strategy Using the Pull-Back Method of Cutting Balloon in Spontaneous Coronary Artery Dissection. CJC Open. 2019;1(4):213-5. doi:10.1016%2Fj.cjco.2019.05.008.
50. Жукова Н. С., Шахнович Р. М., Меркулова И. Н. и др. Спонтанная диссекция коронарных артерий. Кардиология. 2019;59(9):52-63. doi:10.18087/cardio.2019.9.10269.
Об авторах
Ш. Ш. ЗайнобидиновРоссия
Зайнобидинов Шохбозбек Шаробидин угли — врач по рентгенэндоваскулярным диагностике и лечению
Новосибирск
Д. А. Хелимский
Россия
Хелимский Дмитрий Александрович — кандидат медицинских наук, научный сотрудник научно-исследовательского отдела эндоваскулярной хирургии, врач по рентгенэндоваскулярным диагностике и лечению
Новосибирск
А. А. Баранов
Россия
Баранов Алексей Алексеевич — клинический ординатор по рентгенэндоваскулярным диагностике и лечению
Новосибирск
А. Г. Бадоян
Россия
Бадоян Арам Гозоевич — кандидат медицинских наук, врач по рентгенэндоваскулярным диагностике и лечению
Новосибирск
О. В. Крестьянинов
Россия
Крестьянинов Олег Викторович — доктор медицинских наук, зав. научно-исследовательским отделом эндоваскулярной хирургии, врач по рентгенэндоваскулярным диагностике и лечению
Новосибирск
Дополнительные файлы
Рецензия
Для цитирования:
Зайнобидинов Ш.Ш., Хелимский Д.А., Баранов А.А., Бадоян А.Г., Крестьянинов О.В. Современные аспекты диагностики и лечения пациентов со спонтанной диссекцией коронарных артерий. Кардиоваскулярная терапия и профилактика. 2022;21(8):3193. https://doi.org/10.15829/1728-8800-2022-3193
For citation:
Zainobidinov Sh.Sh., Khelimsky D.A., Baranov A.A., Badoyan A.G., Krestyaninov O.V. Modern aspects of diagnosis and treatment of patients with spontaneous coronary artery dissection. Cardiovascular Therapy and Prevention. 2022;21(8):3193. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3193
JATS XML

























































