Перейти к:
Уровни маркеров ангиогенеза у пациентов с различными фенотипами хронической сердечной недостаточности
https://doi.org/10.15829/1728-8800-2022-3230
Аннотация
Цель. Оценить взаимосвязь между уровнями маркеров ангиогенеза и различными фенотипами хронической сердечной недостаточности (ХСН) у пациентов с ХСН ишемического генеза II-IV функционального класса (ФК).
Материал и методы. Проведено одномоментное когортное исследование на базе клинических отделений стационара ФГБУ “НМИЦ ТПМ” Минздрава России. В исследовании приняли участие 180 пациентов в возрасте 30-85 лет с ХСН ишемического генеза II-IV ФК: 90 пациентов с метаболическим синдромом и 90 — без метаболического синдрома. Пациенты были разделены на 3 группы: ХСН с низкой фракцией выброса (ХСНнФВ) — ФВ левого желудочка (ЛЖ) <40%, ХСН с промежуточной ФВ ЛЖ (ХСНпФВ) — ФВ ЛЖ — 40-49%, ХСН с сохраненной ФВ ЛЖ (ХСНсФВ) — ФВ ЛЖ >49%. Помимо стандартного инструментально-лабораторного исследования проведен анализ маркеров ангиогенеза с определением уровней трансформирующего фактора роста β (TGF-β), сосудистого эндотелиального фактора роста А (VEGF-A), пентраксина-3 (PTX-3). Для выполнения статистического анализа использовались программные пакеты Microsoft Office Excel, STATISTICA 10.0 (Statsoft, USA).
Результаты. При проведении трансторакальной эхокардиографии определено, что 74 (41,1%) пациента имели ФВ ЛЖ <50%, у 71 (39,4%) пациента данный показатель оказался <40%. Для группы пациентов с ХСНсФВ отмечена ассоциация с повышением TGF-β ≥7,2 нг/мл (p=0,011). Пороговый уровень РТХ-3 ≥55 нг/мл с высокой степенью достоверности (p=0,001) ассоциирован с развитием ХСНсФВ. Для фенотипа ХСНпФВ определены пороговые значения VEGF-A, TGF-β и PTX-3, которые не достигали уровня статистической значимости, однако отмечена четкая тенденция повышения VEGF-A >200 нг/мл (p=0,052). Для пациентов с низкой ФВ определено статистически значимое пороговое значение VEGF-A >195 нг/мл (p=0,001), ассоциированное с низкой ФВ ЛЖ.
Заключение. Настоящая работа показала актуальность использования PTX-3, VEGF-A и TGF-β в качестве дополнительных маркеров оценки течения ХСН: поскольку среди пациентов с ХСНсФВ отмечено повышение уровней PTX-3 и TGF-β, а у пациентов с ХСНпФВ и ХСНнФВ — повышение уровня VEGF-A, целесообразно для улучшения эффективности диагностики и лечения пациентов с различными фенотипами ХСН ишемического генеза II-IV ФК проводить определение уровня этих маркеров ангиогенеза.
Для цитирования:
Шепель Р.Н., Драпкина О.М. Уровни маркеров ангиогенеза у пациентов с различными фенотипами хронической сердечной недостаточности. Кардиоваскулярная терапия и профилактика. 2022;21(3):3230. https://doi.org/10.15829/1728-8800-2022-3230
For citation:
Shepel R.N., Drapkina O.M. Levels of angiogenesis markers in patients with different heart failure phenotypes. Cardiovascular Therapy and Prevention. 2022;21(3):3230. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3230
ВВЕДЕНИЕ
Хроническая сердечная недостаточность (ХСН) является одним из самых распространенных заболеваний в мире, включая Россию [1][2]. Отмечается прогрессирующий рост числа пациентов, страдающих ХСН, в основном за счет увеличения распространенности факторов риска развития сердечно-сосудистых заболеваний (ССЗ) [3]. В Российской Федерации комбинация артериальной гипертензии (АГ) и ишемической болезни сердца (ИБС) в качестве основных причин ХСН встречается у половины пациентов [4].
Следует отметить, что в западных странах частота ИБС в структуре причин ХСН снижается. Например, в Швеции снижение составило 7-8% с 2006 по 2010гг [5], тогда как в Восточной Европе доля пациентов растет (в первую очередь, за счет инфаркта миокарда) [6]. Важно отметить, что по данным когортного исследования Olmsted County (США) доля пациентов с ишемической ХСН со сниженной фракцией выброса левого желудочка (ФВ ЛЖ) с 2000 по 2010гг снизилась с 39,8 до 29,4%, тогда как доля больных ХСН с сохраненной ФВ (ХСНсФВ) ишемического генеза выросла с 29 до 32,6% [7].
Давней целью многих исследователей было выделение различных фенотипов ХСН, с помощью которых можно определять фенотип-ориентированные подходы к диагностике, позволяющие выбрать конкретные патогенетические точки воздействия, которые, в свою очередь, улучшат вероятность положительного ответа на лечение, будут способствовать оптимизации тактики ведения пациента с обозначенным фенотипом, что приведет к значительному улучшению прогноза у пациентов с ХСН [8].
В настоящее время существует множество лабораторных показателей, которые используются для оценки миокардиальной функции. Результаты экспериментальных и клинических работ свидетельствуют, что маркеры ангиогенеза могут быть одними из перспективных маркеров в диагностике и определении прогноза у пациентов с ХСН [9]. Сосудистый эндотелиальный фактор роста А (VEGF-A) является ключевым регулятором ангиогенеза в миокарде [10]. Трансформирующий фактор роста β (TGF-β) принимает участие практически во всех патологических процессах, ассоциированных с ХСН: в гипертрофии миокарда, фиброзе, апоптозе, воспалении и дифференцировке сердечных клеток-предшественников [11]. Пентраксин-3 (PTX-3) секретируется многими тканями, особенно макрофагами и дендритными клетками и может связываться с P-селектином эндотелиальной поверхности в месте воспаления [12][13].
Отсутствие определенности в понимании роли основных факторов ангиогенеза у пациентов с ХСН не позволяет проводить качественную оценку состояния и прогноза среди пациентов с ХСН. Цель настоящей работы — изучить взаимосвязь между уровнями маркеров ангиогенеза и различными фенотипами ХСН у пациентов с ХСН ишемического генеза II-IV функционального класса (ФК).
МАТЕРИАЛ И МЕТОДЫ
Одномоментное когортное исследование было выполнено на базе клинических отделений стационара ФГБУ “НМИЦ ТПМ” Минздрава России.
В исследовании приняли участие 180 пациентов в возрасте 30-85 лет (медиана — 56 (46;63) лет) с ХСН ишемического генеза II-IV ФК, которые находились на стационарном лечении с февраля 2017 по ноябрь 2019гг: 90 пациентов с метаболическим синдромом (МС) и 90 пациентов без МС. Включение пациентов в обе группы проводилось методом сплошного набора. Протокол исследования, образцы первичной медицинской документации и информированное согласие пациента были одобрены независимым этическим комитетом ФГБУ “НМИЦ ТПМ” Минздрава России.
Критерии включения: мужчины и женщины >18 лет; наличие ХСН ишемического генеза II-IV ФК по классификации Нью-Йоркской ассоциации сердца; подписание информированного добровольного согласия на участие в клиническом исследовании, биобанкирование крови и обработку персональных данных. Ишемический генез ХСН, являющийся критерием включения пациентов в исследование, верицифировался на основании наличия перенесенного инфаркта миокарда в анамнезе давностью >1 мес.
Критерии невключения: женщины в период беременности, раннего послеродового периода, лактации; сведения по данным анамнеза о наркомании, злоупотреблении лекарственными препаратами в течение последних 12 мес.; злоупотребление алкоголем (≥8 баллов по тесту идентификации расстройств, связанных с употреблением алкоголя AUDIT); психические и неврологические заболевания с частичной или полной утратой дееспособности (по данным анамнеза); заболевания соединительной ткани; онкологические и гематологические заболевания; клапанные пороки сердца и некоронарогенные заболевания миокарда, сахарный диабет.
Все пациенты были разделены на три группы: ХСН с низкой ФВ ЛЖ (ХСНнФВ) — ФВ ЛЖ <40%, ХСН с промежуточной ФВ ЛЖ (ХСНпФВ) — ФВ ЛЖ 40-49%, ХСН с сохраненной ФВ ЛЖ (ХСНсФВ) — ФВ ЛЖ >49% [2]. Всем пациентам проводили: оценку жалоб и анамнеза; общий осмотр, оценку баллов по ШОКС (шкале оценки клинического состояния); тест 6-минутной ходьбы; электрокардиографию в 12 отведениях; трансторакальную эхокардиографию (ЭхоКГ); определение в сыворотке крови уровней TGF-β, VEGF-A и PTX-3 — с помощью твердофазного иммуноферментного анализа (ИФА).
Для выполнения статистического анализа использовали программные пакеты Microsoft Office Excel, STATISTICA 10.0 (Statsoft, USA). Соответствие распределения количественных данных нормальному определяли с помощью критерия Шапиро-Уилка. Данные для количественных признаков с нормальным распределением представлены в виде среднего (M) и стандартного отклонения (SD); с распределением, отличным от нормального, — в виде медианы (Me) и интерквартильного размаха (Q25;Q75). Для сравнения двух независимых выборок использовали непараметрический критерий Манна-Уитни. Для сравнения нескольких зависимых выборок использовали непараметрический критерий Фридмана. Для сравнения нескольких независимых выборок использовали непараметрический критерий Крускала-Уоллиса. Для выявления эффективных диагностических точек отсечения исследуемых показателей применяли ROCанализ.
РЕЗУЛЬТАТЫ
Из 180 пациентов 45 (25%) указали факт курения на момент включения в исследование. Отягощенный наследственный анамнез по ССЗ встречался в 42,2% случаев. У одной трети пациентов отмечалось наличие АГ (31,1%), у четверти пациентов (24,4%) — фибрилляция предсердий (ФП).
Среднее значение индекса массы тела (ИМТ) у всех участников составило 27,4 (25;31) кг/м2, что соответствовало, в целом, избыточной массе тела.
Диагностированное выраженное абдоминальное ожирение (окружность талии >88 см у женщин или >102 см у мужчин) выявлялось в 56,1% случаев среди 180 пациентов. Значимо чаще факт ожирения (p=0,001), включая абдоминальное ожирение (p=0,001), встречался у пациентов с МС по сравнению с пациентами без такового. Клиническая характеристика пациентов с ХСН представлена в таблице 1.
Таблица 1. Клиническая характеристика пациентов с ХСН

Примечание: АГ — артериальная гипертония, ИМТ — индекс массы тела,
ССЗ — сердечно-сосудистые заболевания, ХСН — хроническая сердечная недостаточность,
ФП — фибрилляция предсердий.
В рамках исследования было проанализировано количество регулярно принимаемых лекарственных средств на момент включения в исследование. Сравнение проводили путем анализа основных классов лекарственных препаратов: β-блокаторы, ингибиторы ангиотензинпревращающего фермента (иАПФ), блокаторы рецепторов к ангиотензину II, антагонисты кальция, препараты ацетилсалициловой кислоты, клопидогрел, диуретики, статины. В среднем, каждый из участников исследования принимал 2,4±1,7 препаратов из вышеуказанных групп. Наибольшее число участников регулярно принимали статины, иАПФ, β-адреноблокаторы. В меньшей степени отмечалась приверженность к остальным проанализированным классам препаратов.
Трансторакальная ЭхоКГ позволила определить, что 74 (41,1%) пациента имели ФВ ЛЖ <50%, у 71 (39,4%) пациента данный показатель оказался <40%. При сравнении пациентов с наличием и отсутствием МС по параметрам, оцененным в результате проведения ЭхоКГ, статистически значимые различия отмечались по линейным и объемным параметрам ЛЖ (таблица 2). Достоверных различий между показателями линейных и объемных размеров левого предсердия (ЛП) и правых отделов сердца выявлено не было.
Таблица 2. Параметры внутрисердечной гемодинамики у пациентов исследуемых групп

Примечание: КДР — конечно-диастолический размер,
КСР — конечно-систолический размер, КДО — конечно-диастолический объем,
КСО — конечно-систолический объем, ЛП — левое предсердие,
МЖП — межжелудочковая перегородка, МС — метаболический синдром,
ЛЖ — левый желудочек, ФВ ЛЖ — фракция выброса левого желудочка.
Для группы пациентов с ХСНсФВ отмечена ассоциация с повышенным уровнем TGF-β ≥7,2 нг/мл (p=0,011) (таблица 3). Пороговый уровень РТХ-3 ≥55 нг/мл с высокой степенью достоверности (p=0,001) ассоциирован с развитием ХСНсФВ. Для фенотипа ХСНпФВ определены пороговые значения VEGF-A, TGF-β и PTX-3, которые не достигали уровня статистической значимости, однако отмечена четкая тенденция повышения уровня VEGF-A >200 нг/мл (p=0,052). Для пациентов с низкой ФВ определено статистически значимое пороговое значение VEGF-A >195 нг/мл (p=0,001), ассоциированное с низкой ФВ ЛЖ.
Таблица 3. Уровни маркеров ангиогенеза у пациентов с различными фенотипами ХСН
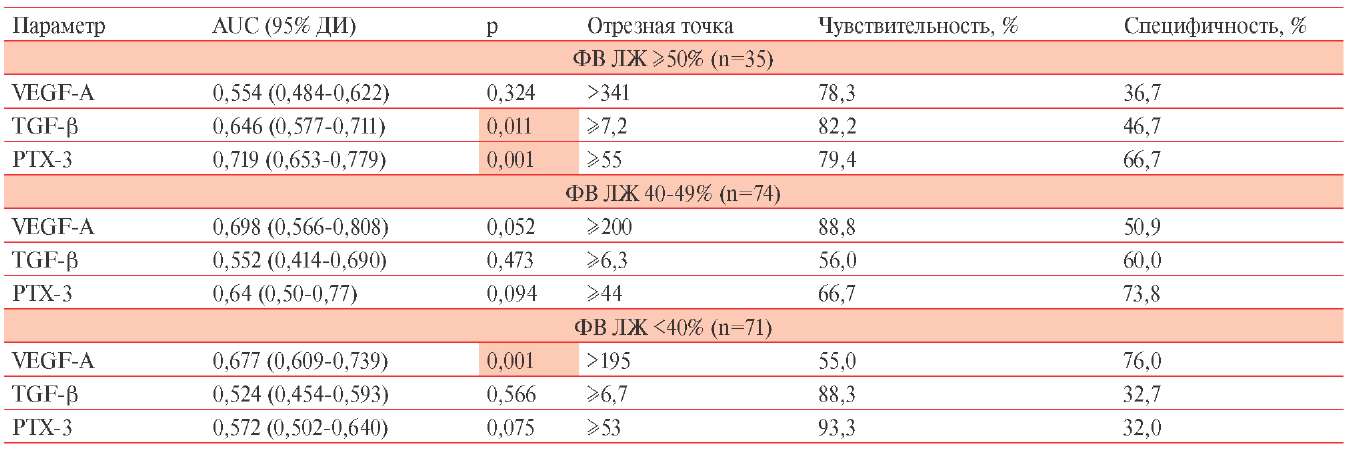
Примечание: AUC — площадь под кривой. ДИ — доверительный интервал,
ФВ — фракция выброса, ФВ ЛЖ — фракция выброса левого желудочка,
PTX-3 — пентраксин-3, TGF-β — трансформирующий фактор роста β,
VEGF-A — сосудистый эндотелиальный фактор роста А.
ОБСУЖДЕНИЕ
Фенотипы ХСН выделяют в соответствии с показателем ФВ ЛЖ, и дифференциация между этими типами важна из-за различий в патогенезе, ассоциированных сопутствующих заболеваниях и терапевтических стратегиях. В патофизиологии ХСН, особенно ХСНнФВ, ведущее значение приобретает ишемическое повреждение миокарда [14].
Наличие сопутствующих заболеваний значительно влияет на прогноз и течение ХСН. МС является клиническим состоянием, которое за счет патофизиологических механизмов оказывает влияние на течение сердечной недостаточности. Ведущим диагностическим критерием МС является абдоминальное ожирение, которое служит предиктором развития сердечной недостаточности с установленной причинно-следственной связью [15]. Абдоминальное ожирение в настоящем исследовании выявлялось более чем у половины пациентов.
При анализе параметров трансторакальной ЭхоКГ среди участников с сопутствующим МС определялось достоверно более выраженное увеличение как конечно-систолического, так и конечно-диастолического объема ЛЖ. У пациентов с ХСН можно наблюдать различные формы ремоделирования ЛЖ. Мы выделили влияние МС на особенности структурных изменений, показав, что дилатация ЛЖ является важным ЭхоКГ-критерием изменений, характерных для ХСН. Эти данные позволяют предположить, что нарушения метаболических процессов, такие как гипергликемия и липотоксичность, характерные для МС, могут вносить больший вклад в формирование структурного миокардиального повреждения [16][17].
Доказано, что индукция ангиогенеза в жировой ткани посредством VEGF активирует термогенез в адипоцитах и оказывает на них протективный эффект [18]. Ранее было показано, что VEGF является мощным индуктором ремоделирования сердечно-сосудистой системы, который защищает сердце от ишемического повреждения [19][20]. Iguchi M, et al. (2018) [21] опубликовали результаты исследования, в котором шла речь о связи VEGF-C со смертностью у больных с ХСН. В проспективное исследование были включены 220 пациентов с ХСН, за которыми наблюдали на протяжении 4 лет. По данным анализа Каплана-Майера, у лиц с изначально низким показателем VEGF-C был выше риск смерти от всех причин. Последующий анализ с учетом возраста, пола, ИМТ, АГ, сахарного диабета, госпитализаций по поводу ХСН, ИБС, анемии, хронической болезни почек, ФП и ФВ ЛЖ <50% продемонстрировал, что уровень VEGF-C обратно ассоциирован с риском смерти от всех причин [21].
Одни исследователи отмечают положительную корреляционную связь уровня PTX-3 со значением мозгового натрийуретического пептида (BNP), при этом PTX-3 превосходил BNP в определении неблагоприятных исходов [22]. В других исследованиях подчеркнуто, что высокий уровень PTX-3 достоверно коррелирует с наличием ХСН вне зависимости от значения ФВ ЛЖ [23].
В настоящей работе продемонстрировано, что сниженные уровни VEGF-A, PTX-3 и TGF-β ассоциированы с более тяжелыми клиническими проявлениями ХСН и сниженной систолической функцией сердца. Таким образом, более высокие уровни маркеров ангиогенеза потенциально могут быть рассмотрены как факторы, ассоциированные с относительно благоприятным течением ХСН, однако полученные результаты указывают на мультифакторность их действия, в частности при дальнейшем изучении их роли при ХСН требуется учитывать влияние МС.
Ограничения исследования: относительно небольшая выборка пациентов, что определяет целесообразность дальнейших исследований в данном направлении.
ЗАКЛЮЧЕНИЕ
Таким образом, настоящая работа показала актуальность количественного определения PTX-3, VEGF-A и TGF-β и их использования в качестве дополнительных маркеров оценки течения ХСН: поскольку среди пациентов с ХСНсФВ отмечено повышение PTX-3 и TGF-β, а у пациентов с ХСНпФВ и ХСНнФВ — повышение уровня VEGF-A, целесообразно для улучшения эффективности диагностики и лечения пациентов с различными фенотипами ХСН ишемического генеза II-IV ФК определение уровня этих маркеров ангиогенеза.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Фомин И.В. Хроническая сердечная недостаточность в Российской Федерации: что сегодня мы знаем и что должны делать. Российский кардиологический журнал. 2016;(8):7-13. doi:10.15829/1560-4071-2016-8-7-13.
2. Ponikowski P, Voors AA, Anker SD, et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail. 2016;18:891-975. doi:10.1002/ejhf.592.
3. Ощепкова Е. В., Лазарева Н.В., Салтыкова Д.Ф., Терещенко С.Н. Первые результаты Российского регистра хронической сердечной недостаточности. Кардиология. 2015;55(5):22-8. doi:10.18565/cardio.2015.5.22-28.
4. Фомин И. В. Эпидемиология хронической сердечной недостаточности в Российской Федерации. Агеев Ф.Т. и др. Хроническая сердечная недостаточность. М.: ГЭОТАР-Медиа, 2010. сс. 7-77. ISBN 978-5-9704-1472-9.
5. Zarrinkoub R, Wettermark B, Wändell P, et al. The epidemiology of heart failure based on data for 2.1 million inhabitants in Sweden. Eur J Heart Fail. 2013;15:995-1002. doi:10.1093/eurjhf/hft064.
6. Moran AE, Forouzanfar MH, Roth GA, et al. The global burden of ischemic heart disease in 1990 and 2010: the global burden of disease 2010 study. Circulation. 2014;129:1493-501. doi:10.1161/CIRCULATIONAHA.113.004046.
7. Gerber Y, Weston SA, Redfield MM, et al. A contemporary appraisal of the heart failure epidemic in Olmsted County, Minnesota, 2000 to 2010. JAMA Intern Med. 2015;175:996-1004. doi:10.1001/jamainternmed.2015.0924.
8. Воронина Л. П., Полунина О. С., Башкина О. А. и др. Фенотипическое деление пациентов с хронической сердечной недостаточностью. Медицинский алфавит. 2020;(36):28-33. doi:10.33667/2078-5631-2020-36-28-33.
9. Ponikowski P, Voors AA, Anker DS, et al. Рекомендации ESC по диагностике и лечению острой и хронической сердечной недостаточности 2016. Российский кардиологический журнал. 2017;(1):7-81. doi:10.15829/1560-4071-2017-1-7-81.
10. Ferrara N. Role of vascular endothelial growth factor in the regulation of angiogenesis. Kidney Int. 1999;56:794-814. doi:10.1046/j.1523-1755.1999.00610.x.
11. Song W, Wang X. The role of TGFβ1 and LRG1 in cardiac remodeling and heart failure. Biophys Rev. 2015;7(1):91-104. doi:10.1007/s12551-014-0158-y.
12. Libby P. Inflammation in atherosclerosis Arterioscler. Thromb Vasc Biol. 2012;32(9):2045-51. doi:10.1161/ATVBAHA.108.179705.
13. Pearson TA, Mensah GA, Alexander RW, et al. Centers for Disease Control and Prevention; American Heart Association. Markers of inflammation and cardiovascular disease: application to clinical and public health practice: A statement for healthcare professionals from the Centers for Disease Control and Prevention and the American Heart Association. Circulation. 2003;107(3):499-511. doi:10.1161/01.cir.0000052939.59093.45.
14. Wright JS, Wall HK, Ritchey MD. Million hearts 2022: small steps are needed for cardiovascular disease prevention. JAMA. 2018;320:1857-8. doi:10.1001/jama.2018.13326.
15. Драпкина О. М., Елиашевич С. О., Шепель Р. Н. Ожирение как фактор риска хронических неинфекционных заболеваний. Российский кардиологический журнал. 2016;(6):73-9. doi:10.15829/1560-4071-2016-6-73-79.
16. Shah AM, Claggett B, Sweitzer NK, et al. Cardiac structure and function and prognosis in heart failure with preserved ejection fraction: findings from the echocardiographic study of the Treatment of Preserved Cardiac Function Heart Failure with an Aldosterone Antagonist (TOPCAT) Trial. Circ Heart Fail. 2014;7:740-51. doi:10.1161/CIRCHEARTFAILURE.114.001583.
17. Beale AL, Meyer P, Marwick TH, et al. Sex Differences in Cardiovascular Pathophysiology: Why Women Are Overrepresented in Heart Failure With Preserved Ejection Fraction. Circulation. 2018;138(2):198-205. doi:10.1161/CIRCULATIONAHA.118.034271.
18. Dryer K, Gajjar M, Narang N, et al. Coronary microvascular dysfunction in patients with heart failure with preserved ejection fraction. Am J Physiol Heart Circ Physiol. 2018;314(5):H1033-42. doi:10.1152/ajpheart.00680.2017.
19. Lopez-de la Mora DA, Sanchez-Roque C, Montoya-Buelna M, et al. Role and New Insights of Pirfenidone in Fibrotic Diseases. Int J Med Sci. 2015;12(11):840-7. doi:10.7150/ijms.11579.
20. Cheng JM, Akkerhuis KM, Battes LC, et al. Biomarkers of heart failure with normal ejection fraction: a systematic review. Eur J Heart Fail. 2013;15(12):1350-62. doi:10.1093/eurjhf/hft106.
21. Iguchi M, Ura S, Masunaga N, et al. Relationship between VEGF-C levels and all-cause mortality in patients with chronic heart failure. Eur Cardiol. 2018;13(2):129. doi:10.15420/ecr.2018.13.2.PO10.
22. Suzuki S, Takeishi Y, Niizeki T, et al. Pentraxin 3, a new marker for vascular inflammation, predicts adverse clinical outcomes in patients with heart failure. Am Heart J. 2008;155:75-81. doi:10.1016/j.ahj.2007.08.013.
23. Matsubara J, Sugiyama S, Nozaki T, et al. Pentraxin 3 is a new inflammatory marker correlated with left ventricular diastolic dysfunction and heart failure with normal ejection fraction. J Am Coll Cardiol. 2011;57:861-9. doi:10.1016/j.jacc.2010.10.018.
Об авторах
Р. Н. ШепельРоссия
Научный сотрудник отдела фундаментальных и прикладных аспектов ожирения, заместительдиректора по перспективному развитию медицинской деятельности
Москва
О. М. Драпкина
Россия
Директор, доктор медицинских наук, профессор, член-корреспондент РАН
Москва
Рецензия
Для цитирования:
Шепель Р.Н., Драпкина О.М. Уровни маркеров ангиогенеза у пациентов с различными фенотипами хронической сердечной недостаточности. Кардиоваскулярная терапия и профилактика. 2022;21(3):3230. https://doi.org/10.15829/1728-8800-2022-3230
For citation:
Shepel R.N., Drapkina O.M. Levels of angiogenesis markers in patients with different heart failure phenotypes. Cardiovascular Therapy and Prevention. 2022;21(3):3230. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3230
JATS XML

























































