Перейти к:
Изучение влияния уровня витамина D на гормональнометаболический статус у больных с метаболическим синдромом на фоне хронической болезни почек
https://doi.org/10.15829/1728-8800-2022-3252
Аннотация
Цель. Оценить связь дефицита витамина D с гормонально-метаболическими нарушениями, в т.ч. инсулинорезистентностью и уровнем лептина, у больных с метаболическим синдромом (МС) на фоне хронической болезни почек (ХБП).
Материал и методы. В исследование включен 81 больной с МС на фоне ХБП в возрасте 45-59 лет (в среднем 51±4 лет); в зависимости от уровня витамина D больные были разделены на две группы: первая (n=49) со сниженным уровнем (23,2±5,1 нг/мл); вторая (n=32) с адекватным уровнем (54,8±12,1 нг/мл). Статистическую обработку проводили с использованием программ STATISTICA 10.0.
Результаты. Установлено, что у больных первой группы окружность талии на 9,0% (р<0,05), окружность талии/окружность бедер на 8,2% (р<0,05), индекс массы тела на 15,1% (р<0,05) больше, чем во второй. По уровню систолического и диастолического артериального давления группы достоверно не различались. В первой группе уровень общего холестерина (ХС) на 18,6% (р<0,01), ХС липопротеинов низкой плотности на 11,9% (р<0,05), триглицеридов на 20,8% (р<0,01), индекса инсулинорезистенстности НОМАIR (Homeostasis Model Assessment Insulin Resistance) на 42,5% (р<0,001), лептина на 30,5% (р<0,01) были выше, чем во второй группе. Определено более выраженное нарушение диастолической функции левого желудочка в первой группе — соотношение скорости раннего и позднего наполнения левого желудочка (Е/А) на 13,2% (р<0,05), время замедления трансмитрального потока в раннюю диастолу (DT) на 13,1% ниже (р<0,05), чем во второй.
Заключение. Полученные результаты свидетельствуют о том, что больные с МС на фоне ХБП и дефицита витамина D чаще имеют общее ожирение, более выраженные нарушения углеводного (индекс НОМА-IR), жирового (уровни общего ХС, ХС липопротеинов низкой плотности, триглицеридов) обмена и высокое содержание в сыворотке крови лептина по сравнению с пациентами с адекватным уровнем этого витамина.
Для цитирования:
Осипова О.А., Гостева Е.В., Жернакова Н.И., Белоусова О.Н., Татаринцева Ю.В., Хачатуров А.Н. Изучение влияния уровня витамина D на гормональнометаболический статус у больных с метаболическим синдромом на фоне хронической болезни почек. Кардиоваскулярная терапия и профилактика. 2022;21(5):3252. https://doi.org/10.15829/1728-8800-2022-3252
For citation:
Osipova O.A., Gosteva E.V., Zhernakova N.I., Belousova O.N., Tatarintseva Yu.V., Khachaturov А.N. Effect of vitamin D levels on the hormonal and metabolic status in patients with metabolic syndrome and chronic kidney disease. Cardiovascular Therapy and Prevention. 2022;21(5):3252. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3252
Введение
Эпидемиологические исследования показали, что распространенность гиповитаминоза D возросла в развитых странах за последние несколько лет в связи с изменением образа жизни и встречается у 30-50% населения [1]. В настоящее время доказана недостаточная обеспеченность витамином D (вит. D) населения РФ, сниженный уровень которого выявляется, в среднем, у 80% лиц в общей популяции; все больше исследований демонстрируют участие вит. D в патогенезе сердечно-сосудистых заболеваний (ССЗ) [2-4]. Увеличение сердечно-сосудистой смертности у пациентов с хронической болезнью почек (ХБП) не всегда полностью объясняется наличием артериальной гипертензии (АГ) и гиперхолестеринемии, определенное влияние оказывают и нетрадиционные факторы риска, в т.ч. неадекватные уровни вит. D [5]. У пациентов с ХБП часто диагностируется метаболический синдром (МС), который характеризуется наличием абдоминального ожирения, гипертриглицеридемии, сниженным уровнем холестерина (ХС) липопротеинов высокой плотности (ЛВП), высоким артериальным давлением (АД) и высоким уровнем глюкозы натощак [6][7]. Среди факторов риска возникновения АГ, МС важную роль играют и генетические факторы [8][9].
Инсулинорезистентность (ИР) играет центральную роль в патогенезе МС, и связана с повышенным риском ХБП у пациентов без сахарного диабета (СД) [10]. МС и его компоненты связаны с развитием ХБП, микроальбуминурии и явной протеинурии [11]. ИР часто встречается у пациентов с ХБП легкой и средней степени тяжести, даже когда скорость клубочковой фильтрации (СКФ) находится в пределах нормы [12].
При ожирении решающую роль в развитии и прогрессировании заболевания почек, ССЗ и МС играет гиперлептинемия [13]. Лептин, обладая свойствами как гормона, так и цитокина, провоцирует атерогенные сдвиги в липидном спектре крови [14]. Лептин представляет собой адипокин, который регулирует аппетит и массу тела, а также обладает рядом плейотропных функций, включая регуляцию функции почек. Все больше данных свидетельствует о том, что ХБП связана с гиперлептинемией, а повышенная концентрация лептина в крови больных ХБП может быть следствием как снижения выведения лептина из кровотока почками (вследствие почечной дисфункции), так и увеличения продукции лептина жировой тканью за счет гиперинсулинемии, хронического воспаления, липидных нарушений у пациентов с ХБП. В исследовании Korczynska J (2021) [15] доказано, что повышенный уровень лептина у пациентов с ХБП приводит к дальнейшему ухудшению функции почек и повышению риска ССЗ.
Цель исследования — оценить связь дефицита вит. D с гормонально-метаболическими нарушениями, в т.ч. ИР и уровнем лептина, у больных с МС на фоне ХБП.
Материал и методы
Проведено наблюдательное одномоментное исследование (сентябрь 2020г — апрель 2020г) с целью изучения связи дефицита вит. D с факторами риска ССЗ у больных с МС на фоне ХБП. В исследование включен 81 пациент, 34 женщины и 47 мужчин, в возрасте 45-59 лет (средний возраст 51±4), впервые обратившихся в лечебно-профилактическое учреждение по поводу АГ. Группу 1 составили 49 (60,5%) пациентов с недостаточным уровнем вит. D (23,2±5,1 нг/мл), группу 2 — 32 (39,5%) пациента с адекватным уровнем (54,8±12,1 нг/ мл). В качестве контрольной группы обследовано 15 человек, сопоставимых по возрасту (49±3 лет) и полу без сопутствующих сердечных или почечных заболеваний, с адекватным уровнем вит. D (>30 нг/мл).
Все больные подписали информированное согласие на включение в исследование.
Критериями включения в исследование были:
1) наличие МС, установленного по критериям: абдоминальный тип ожирения — окружность талии (ОТ) >94 см у мужчин и >80 см у женщин; АГ — АД ≥130/85 мм рт.ст.; повышение уровня триглицеридов (ТГ) ≥1,7 ммоль/л; снижение уровня ХС ЛВП <1,03 ммоль/л у мужчин и <1,29 ммоль/л у женщин; повышение уровня ХС липопротеинов низкой плотности (ЛНП) >3,0 ммоль/л; гипергликемия натощак — глюкоза в плазме крови ≥5,6 ммоль/л; выявленный ранее СД 2 типа или нарушение толерантности к глюкозе;
2) ХБП С2, А2 стадии (СКФ — 60-89 мл/мин/1,73 м2, соотношение в моче альбумин/креатинин 30-300 мг/г);
3) отсутствие систематической медикаментозной антигипертензивной и гиполипидемической терапии;
4) добровольное информированное согласие пациента [12][16].
Критериями невключения являлись: хроническая декомпенсированная сердечная недостаточность, острая и хроническая печеночная недостаточность, острая и тяжелая хроническая почечная недостаточность, онкологические заболевания, СД 1 типа, нарушения функции щитовидной железы, факт приема вит. D и/или стероидной терапии.
Забор крови проводили из локтевой вены утром после ночного голодания ≥12 ч. У всех пациентов стандартными автоматизированными методами определяли уровни глюкозы плазмы натощак, общего ХС, ТГ, ХС ЛВП, ХС ЛНП, креатинина в сыворотке крови, а также креатинина и альбумина в моче.
Уровень вит. D (концентрацию 25-гидроксикальциферола — 25(OH)D) определяли в сыворотке крови с использованием анализатора LIAISON XL (DiaSorin, Италия/Германия). Интерпретацию результатов проводили в соответствии с рекомендациями Российской Ассоциации Эндокринологов [17].
Концентрацию инсулина определяли на автоматическом иммунохемилюминесцентном анализаторе Immulite 2000 (США). Показатель ИР — HOMA-IR (Homeostasis Model Assessment Insulin Resistance), рассчитывали с помощью модели оценки гомеостаза по формуле Matthews D. (1985) [18]: HOMA-IR=глюкоза натощак×инсулин натощак/22,5 (норма <2,77).
Уровень лептина в крови определяли иммуноферментным методом с использованием набора реактивов ЗАО “Вектор Бест” (Россия).
Эхокардиографию проводили на эхо-сканере Logiq P9 (GE) в соответствии с Рекомендациями [19]. Определяли размерные параметры левого желудочка (ЛЖ) (конечный систолический и диастолический размеры, толщину стенок), рассчитывали индекс массы миокарда ЛЖ, фракцию выброса ЛЖ, показатели диастолической функции ЛЖ (Е/А — соотношение скорости раннего и позднего наполнения ЛЖ, DT — время замедления трансмитрального потока в раннюю диастолу).
Статистическую обработку данных проводили с использованием пакета прикладных программ STATISTICA 10.0. Для проверки распределений на нормальность использовали критерий Колмогорова-Смирнова. Количественные показатели представлены в виде медианы и интерквартильного размаха [Ме (Q25; Q75)], непрерывные количественные значения выражали как среднее (М) ± стандартное отклонение (SD). Сравнение проводили с помощью критерия Вилкоксона и критерия Манна-Уитни. Достоверными считали различия при р<0,05.
Результаты
В таблице 1 представлена клиническая характеристика больных с МС на фоне ХБП.
В зависимости от статуса витамина D клиническая характеристика больных с МС на фоне ХБП представлена в таблице 2.
Установлено, что у больных в группе 1 ОТ была на 9,0% (р<0,05), соотношение ОТ/ОБ (окружность бедер) на 8,2% (р<0,05), индекс массы тела (ИМТ) на 15,1% (р<0,05) больше, чем в группе 2. По уровню систолического и диастолического АД (САД и ДАД, соответственно) группы 1 и 2 достоверно не различались.
Таким образом, больные с МС на фоне ХБП со сниженным уровнем вит. D в сыворотке крови достоверно чаще имели общее ожирение (ОТ, ОТ/ ОБ, ИМТ) по сравнению с группой с нормальными значениями вит. D.
С учетом данных литературы, установивших взаимосвязь абдоминального ожирения с развитием лептинорезистентности у больных с МС [13] и, соответственно, с гиперпродукцией лептина, были изучены уровни данного показателя в сравниваемых группах (таблица 3).
Таблица 1
Клиническая характеристика изучаемых групп больных Ме (Q25; Q75)
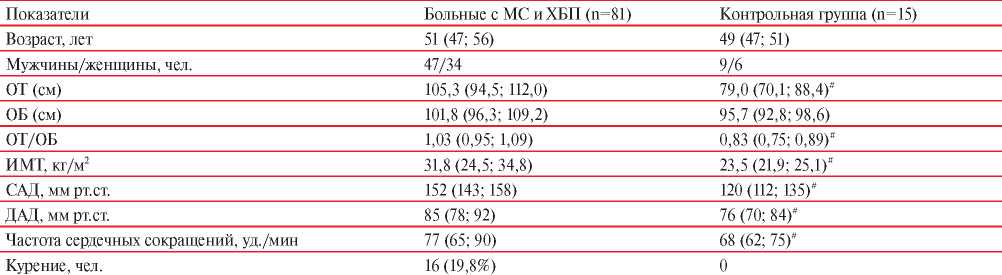
Примечание: # — р<0,05, между группой больных и контрольной группой
Таблица 2
Клиническая характеристика включенных в исследование больных с МС на фоне ХБП в зависимости от статуса вит. D [Ме (Q25; Q75)]

Примечание: # – р<0,05, между 1 и 2 группами.
Таблица 3
Результаты лабораторно-инструментального исследования больных с МС на фоне ХБП в зависимости от статуса вит. D [Ме (Q25; Q75)]

Примечание: # — р<0,05, между группой 1 и контрольной группой; * — р<0,05, между группой 2 и контрольной группой; ФВ — фракция выброса, ИММЛЖ — индекс массы миокарда ЛЖ.
Установлены более выраженные метаболические нарушения у больных 1 группы: уровни общего ХС были на 18,6% (р<0,01), ХС ЛНП на 11,9% (р<0,05), ТГ на 20,8% (р<0,01), индекса НОМА-IR на 42,5% (р<0,001), лептина на 30,5% (р<0,01) выше, чем в группе 2.
У пациентов с МС на фоне ХБП при наличии сниженного уровня вит. D (группа 1) соотношение Е/А было на 13,2% (р<0,05), DT на 13,1% ниже (р<0,05), чем в группе 2, что свидетельствовало о более выраженном нарушении диастолической функции ЛЖ.
Таким образом, в патогенез гормонально-метаболических нарушений вовлечены гиперхолестеринемия, гипертриглицеридемия, гиперлептинемия, ИР, наиболее выраженные у лиц с МС на фоне ХБП при снижении уровня вит. D. У пациентов со сниженным уровнем вит. D установлена более выраженная диастолическая дисфункция ЛЖ.
В связи с полученными данными особый интерес представляло определение зависимости факторов риска ССЗ от уровня вит. D в сыворотке крови. Проведенный анализ выявил прямую корреляционную связь между уровнем вит. D и содержанием ХС ЛВП (r=0,64; p=0,035), а также показателем Е/А, отражающим диастолическую функцию ЛЖ (r=0,58; p=0,041). Определена отрицательная связь вит. D с уровнем ТГ (r=-0,72; p=0,018), индексом НОМА-IR (r=-0,69; p=0,029) и уровнем лептина (r=-0,63; p=0,037). Полученные результаты представлены на рисунках 1 и 2.

Рис. 1 Линейная корреляционная зависимость между уровнем вит. D и индексом НОМА-IR у больных с МС на фоне ХБП.
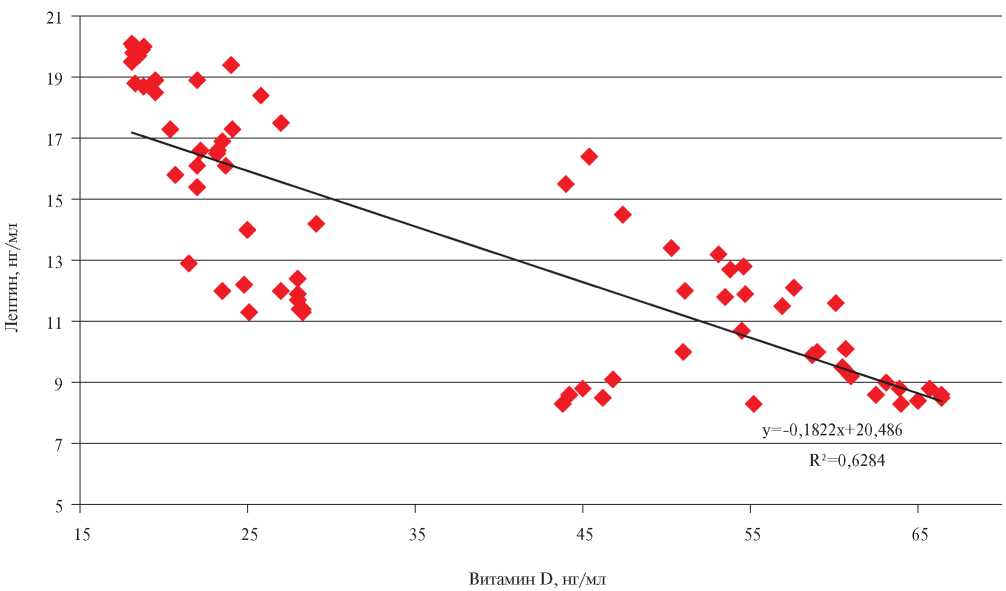
Рис. 2 Линейная корреляционная зависимость между уровнями вит. D и лептина у больных с МС на фоне ХБП.
Обсуждение
Дефицит вит. D связан с различными заболеваниями, включая МС, который клинически определяется комплексом метаболических и сосудистых нарушений.
Настоящее исследование выполнено на больных с МС на фоне ХБП со сниженным уровнем вит. D в сыворотке крови (23,2±5,1 нг/мл, группа 1) и адекватным его уровнем (54,8±12,1 нг/мл, группа 2).
Исследования последних лет демонстрируют связь низкого содержания вит. D в сыворотке с ожирением у лиц среднего возраста [20]. В обзоре Wimalawansa SJ (2018), основанном на фактических данных, описана корреляционная связь вит. D с СД, ИР, ожирением, МС и показано, что вит. D играет непрямую, но важную роль в углеводном и липидном обменах [21]. В исследовании Han YY (2021) показано, что низкий уровень вит. D в сыворотке крови имели лица с АГ и высоким ИМТ [22]. В проведенном нами исследовании установлено, что больные МС на фоне ХБП при дефиците вит. D имеют более высокие показатели ОТ, ОТ/ОБ, ИМТ, чем лица с адекватным его уровнем. В исследовании, Zhang M (2022) показано, что уровень вит. D в сыворотке крови <30 нг/мл, связан с высоким уровнем ТГ и низким ХС ЛВП [23]. В работе Ge H. (2017) выявлена корреляция между дефицитом вит. D и повышенным уровнем общего ХC и ХС ЛНП, а также сниженным уровнем ХС ЛВП в сыворотке крови [24]. В настоящем исследовании у больных с МС на фоне ХБП, имевших низкие уровни вит. D в сыворотке, было выявлено более высокое содержание в крови ТГ и ХС ЛНП, в то время как достоверной разницы по уровню ХС ЛВП не установлено. В настоящее время механизмы, объясняющие связь между вит. D и уровнем сывороточных липидов неизвестны. Предполагается, что вит. D может влиять на липиды сыворотки, изменяя усвоение кальция. В исследовании Cho HJ (2005) [25] показано, что повышенный уровень кальция может уменьшить образование и секрецию печеночных ТГ, снижать уровень ХС за счет стимуляции секреции желчных кислот [26].
Другие исследования показали, что вит. D влияет на функцию β-клеток и чувствительность к инсулину [27], приводя к ИР, в т.ч. и у больных с ХБП. Резистентность к инсулину является ранним метаболическим нарушением у пациентов с ХБП, проявляющимся, когда СКФ все еще находится в пределах нормы и имеет обратную связь с уровнем вит. D [28]. Проведенный нами анализ подтвердил, что между HOMA-IR и уровнем вит. D имеется отрицательная корреляционная зависимость, что согласуется с результатами исследования Schleu MF (2021), в котором с помощью многофакторной регрессии продемонстрированы связи между низкими уровнями вит. D и повышенными значениями HOMA-IR и ИМТ [29]. У больных с МС на фоне ХБП нами установлено наличие ИР, подтвержденное увеличением индекса НОМА-IR на 42,5% у лиц со сниженным уровнем вит. D по сравнению пациентами, имеющими его адекватный уровень.
В развитии и прогрессировании МС и заболевания почек играет гиперлептинемия [13]. В проведенном исследовании установлено, что больные с МС на фоне ХБП имеют более высокие значения лептина в сыворотке крови, чем лица контрольной группы. При этом в группе больных с дефицитом вит. D, уровень лептина был на 30,5% выше, что может свидетельствовать о более выраженных метаболических нарушениях, чем у пациентов, имеющих его адекватный уровень. Дефицит вит. D распространен при сердечной недостаточности, но его значимость при диастолической дисфункции описана в единичных исследованиях [30][31]. Мы изучили связь между статусом вит. D и эхокардиографическими параметрами диастолической функции у пациентов с МС на фоне ХБП. Полученные результаты установили более выраженные нарушения диастолической функции ЛЖ у участников с дефицитом вит. D. Это можно объяснить тем, что вит. D подавляет активацию ренин-ангиотензиновой системы и натрийуретических пептидов, регулирует обновление внеклеточного матрикса, поток кальция и сократительную способность миокарда, влияет на дифференцировку и пролиферацию кардиомиоцитов, что может опосредовать антигипертрофические и антигипертензивные эффекты вит. D и защищать от дисфункции миокарда [32].
В рамках исследования Hoorn Pilz, et al. измерены уровни вит. D и выполнено эхокардиографическое исследование у 614 пациентов. Уровни вит. D в сыворотке крови не были достоверно связаны со структурой и функцией ЛЖ. Тем не менее, была обнаружена незначительная тенденция к увеличению распространенности диастолической дисфункции у участников с дефицитом вит. D [33].
Обнаружение связи между высоким АД и уровнями вит. D фактически стало отправной точкой для рассмотрения участия этого витамина в патогенезе ССЗ. Результаты настоящего исследования свидетельствуют о сопоставимых значениях как САД, так и ДАД в обеих группах больных. По некоторым данным у пациентов с дефицитом вит. D САД было выше по сравнению с пациентами с достаточным содержанием вит. D [34]. Однако, согласно выводам других исследователей, различий по уровню САД и ДАД у людей с дефицитом вит. D нет [31].
Заключение
Полученные в настоящем исследовании результаты свидетельствуют о том, что больные с МС на фоне ХБП и дефицита вит. D чаще имеют общее ожирение, более выраженные нарушения углеводного (индекс НОМА-IR), транспорта липидов в составе липопротеинов (уровни общего ХС, ХС ЛНП, ТГ) и высокое содержание в сыворотке крови лептина по сравнению с пациентами с адекватным уровнем этого витамина. Таким образом, результаты проведенного исследования демонстрируют значимость оценки статуса вит. D у больных с МС на фоне ХБП.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Melguizo-Rodríguez L, Costela-Ruiz VJ, García-Recio E, et al. Role of Vitamin D in the Metabolic Syndrome. Nutrients. 2021;13(3):830. doi:10.3390/nu13030830.
2. Петрушкина А. А., Пигарова Е. А., Рожинская Л. Я. Эпидемиология дефицита витамина D в Российской Федерации. Остеопороз и остеопатии. 2018;21(3):15-20. doi:10.14341/osteo10038.
3. Татаринцева Ю. В., Васильева Л. В., Гостева Е. В. и др. Связь дефицита витамина D с риском метаболического синдрома у лиц пожилого возраста. Терапия. 2021;7(3):115-21. doi:10.18565/therapy.2021.3.115-121.
4. Kheiri B, Abdalla A, Osman M, et al. Vitamin D deficiency and risk of cardiovascular diseases: a narrative review. Clin Hypertens. 2018;24:9. doi:10.1186/s40885-018-0094-4.
5. Агранович Н. В., Пилипович Л. А., Алботова Л. В. и др. К вопросу о дефиците витамина D при хронической болезни почек. Литературный обзор. Нефрология. 2019;23(3):21-8. doi:10.24884/1561-6274-2019-23-3-21-28.
6. Lemieux I, Després JP. Metabolic Syndrome: Past, Present and Future. Nutrients. 2020;12(11):3501. doi:10.3390/nu12113501.
7. Lu MC, Chen IJ, Hsu LT, et al. Metabolic Risk Factors Associated With Chronic Kidney Disease in a Middle-Aged and Elderly Taiwanese Population: A Cross-Sectional Study. Front Med (Lausanne). 2021;8:748037. doi:10.3389/fmed.2021.748037.
8. Moskalenko MI, Milanova SN, Ponomarenko IV, et al. Study of associations of polymorphism of matrix metalloproteinases genes with the development of arterial hypertension in men. Kardiologiia. 2019;59(7с):31-9. doi:10.18087/cardio.2598.
9. Bushueva OYu. Single nucleotide polymorphisms in genes encoding xenobiotic metabolizing enzymes are associated with predisposition to arterial hypertension. Research Results in Biomedicine. 2020;6(4):447-56. doi:10.18413/2658-6533-2020-6-4-0-1.
10. Gluvic Z, Zaric B, Resanovic I, et al. Link between Metabolic Syndrome and Insulin Resistance. Curr Vasc Pharmacol. 2017;15(1):30-9. doi:10.2174/1570161114666161007164510.
11. Huh JH, Yadav D, Kim JS, et al. Metabolism. 2017;67:54-61. doi:10.1016/j.metabol.2016.11.003.
12. Клинические рекомендации. Хроническая болезнь почек (ХБП) — 2021-2022-2023 (24.06.2021) — Утверждены Минздравом РФ. 2021. 162с.
13. Korolczuk A, Dudka J. Increased risk of cardiovascular complications in chronic kidney disease: a possible role of leptin. Curr Pharm Des. 2014;20(4):666-74. doi:10.2174/13816128113199990013.
14. Pereira S, Cline DL, Glavas MM, et al. Tissue-Specific Effects of Leptin on Glucose and Lipid Metabolism. Endocr Rev. 2021;42(1):1-28. doi:10.1210/endrev/bnaa027.
15. Korczynska J, Czumaj A, Chmielewski M, et al. The Causes and Potential Injurious Effects of Elevated Serum Leptin Levels in Chronic Kidney Disease Patients. Int J Mol Sci. 2021;22(9):4685. doi:10.3390/ijms22094685.
16. Беленков Ю. Н., Привалова Е. В., Каплунова В. Ю. и др. Метаболический синдром: история развития, основные критерии диагностики. Рациональная фармакотерапия в кардиологии. 2018;14(5):757-64. doi:10.20996/1819-6446-201814-5-757-764.
17. Клинические рекомендации. Дефицит витамина D у взрослых. 2016. 39с.
18. Matthews DR, Hosker JP, Rudenski AS, et al. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia. 1985;28:412-9.
19. Практическая эхокардиография: Руководство по эхокардиографической диагностике. Под ред. Франка А. Флакскампфа; пер. с нем.; под общ. ред. акад. РАН, проф. В. А. Сандрикова. 2-е изд. Москва: МЕДпресс-информ, 2019. 872с. ISBN: 9785-00030-662-8.
20. Ruiz-Ojeda FJ, Anguita-Ruiz A, Leis R, et al. Genetic Factors and Molecular Mechanisms of Vitamin D and Obesity Relationship. Ann Nutr Metab. 2018;73(2):89-99. doi:10.1159/000490669.
21. Wimalawansa SJ. Associations of vitamin D with insulin resistance, obesity, type 2 diabetes, and metabolic syndrome. J Steroid Biochem Mol Biol. 2018;175:177-89. doi:10.1016/j.jsbmb.2016.09.017.
22. Han YY, Hsu SH, Su TC. Association between Vitamin D Deficiency and High Serum Levels of Small Dense LDL in MiddleAged Adults. Biomedicines. 2021;24;9(5):464. doi:10.3390/biomedicines9050464.
23. Zhang M, Yu F, Xue Y, et al. The Relationship of 25(OH)D3 with Diabetes Mellitus and the Mediation Effect of Lipid Profile in Chinese Rural Population of Henan Province. Medicina (Kaunas). 2022;58(1):85. doi:10.3390/medicina58010085.
24. Ge H, Sun H, Wang T, et al. The association between serum 25-hydroxyvitamin D3 concentration and serum lipids in the rural population of China. Lipids Health Dis. 2017;16(1):215. doi:10.1186/s12944-017-0603-6.
25. Cho HJ, Kang HC, Choi SA, et al. The possible role of Ca2+ on the activation of microsomal triglyceride transfer protein in rat hepatocytes. Biol Pharm Bull. 2005;28(8):1418-23. doi:10.1248/bpb.28.1418.
26. Alomaim H, Griffin P, Swist E, et al. Dietary calcium affects body composition and lipid metabolism in rats. PLoS One. 2019;14(1):e0210760. doi:10.1371/journal.pone.0210760.
27. Pathak K, Soares MJ, Zhao Y, et al. Postprandial changes in glucose oxidation and insulin sensitivity in metabolic syndrome: Influence of fibroblast growth factor 21 and vitamin D status. Nutrition. 2017;37:37-42. doi:10.1016/j.nut.2016.12.007.
28. Spoto B, Pisano A, Zoccali C. Insulin resistance in chronic kidney disease: a systematic review. Am J Physiol Renal Physiol. 2016;311(6):F1087-1108. doi:10.1152/ajprenal.00340.2016.
29. Schleu MF, Barreto-Duarte B, Arriaga MB, et al. Lower Levels of Vitamin D Are Associated with an Increase in Insulin Resistance in Obese Brazilian Women. Nutrients. 2021;13(9):2979. doi:10.3390/nu13092979.
30. Осипова О. А., Гостева Е. В., Татаринцева Ю. В. и др. Дефицит витамина D у пожилых пациентов с артериальной гипертензией и диастолической дисфункцией левого желудочка. Успехи геронтологии. 2021;34(4):566-71. doi:10.34922/AE.2021.34.4.009.
31. Nolte K, Herrmann-Lingen C, Platschek L, et al. Vitamin D deficiency in patients with diastolic dysfunction or heart failure with preserved ejection fraction. ESC Heart Fail. 2019;6(2):26270. doi:10.1002/ehf2.12413.
32. Latic N, Erben RG. Vitamin D and Cardiovascular Disease, with Emphasis on Hypertension, Atherosclerosis, and Heart Failure. Int J Mol Sci. 2020;21(18):6483. doi:10.3390/ijms21186483.
33. Pilz S, Henry RM, Snijder MB, et al. Vitamin D deficiency and myocardial structure and function in older men and women: the Hoorn study. J Endocrinol Invest. 2010;33(9):612-7. doi:10.1007/BF03346658.
34. Alkhatatbeh MJ, Abdul-Razzak KK, Khasawneh LQ, et al. High Prevalence of Vitamin D Deficiency and Correlation of Serum Vitamin D with Cardiovascular Risk in Patients with Metabolic Syndrome. Metab Syndr Relat Disord. 2017;15(5):213-9. doi:10.1089/met.2017.0003.
Об авторах
О. А. ОсиповаРоссия
Ольга Александровна Осипова — доктор медицинских наук, заведующий кафедрой госпитальной терапии Медицинского института.
Воронеж, Тел.: +7 (915) 575-89-69
Е. В. Гостева
Россия
Елена Владимировна Гостева — доктор медицинских наук, доцент кафедры пропедевтики внутренних болезней.
Воронеж
Н. И. Жернакова
Россия
Нина Ивановна Жернакова — доктор медицинских наук, профессор, зам. директора по научной работе Медицинского института.
Воронеж
О. Н. Белоусова
Россия
Оксана Николаевна Белоусова — доктор медицинских наук, профессор кафедры госпитальной терапии Медицинского института.
Воронеж
Ю. В. Татаринцева
Россия
Юлия Владимировна Татаринцева — аспирант кафедры госпитальной терапии Медицинского института.
Воронеж
А. Н. Хачатуров
Россия
Артур Николаевич Хачатуров — ассистент кафедры анестезиологии и реаниматологии.
Воронеж
Рецензия
Для цитирования:
Осипова О.А., Гостева Е.В., Жернакова Н.И., Белоусова О.Н., Татаринцева Ю.В., Хачатуров А.Н. Изучение влияния уровня витамина D на гормональнометаболический статус у больных с метаболическим синдромом на фоне хронической болезни почек. Кардиоваскулярная терапия и профилактика. 2022;21(5):3252. https://doi.org/10.15829/1728-8800-2022-3252
For citation:
Osipova O.A., Gosteva E.V., Zhernakova N.I., Belousova O.N., Tatarintseva Yu.V., Khachaturov А.N. Effect of vitamin D levels on the hormonal and metabolic status in patients with metabolic syndrome and chronic kidney disease. Cardiovascular Therapy and Prevention. 2022;21(5):3252. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3252
JATS XML

























































