Перейти к:
Распространенность неалкогольной жировой болезни печени среди населения трудоспособного возраста: ассоциации с социально-демографическими показателями и поведенческими факторами риска (данные ЭССЕ-РФ-2)
https://doi.org/10.15829/1728-8800-2022-3356
Аннотация
Цель. Оценить распространенность неалкогольной жировой болезни печени (НАЖБП) с использованием индекса ожирения печени — FLI (Fatty Liver Index), и изучить его ассоциации с социально-демографическими показателями и поведенческими факторами риска развития НАЖБП.
Материал и методы. В работе использованы данные многоцентрового исследования ЭССЕ-РФ (Эпидемиология сердечно-сосудистых заболеваний и их факторов риска в регионах Российской Федерации) — выборки из неорганизованного мужского и женского населения в возрасте 25-64 лет. Включено 5161 респондента, из них 2275 (44,1%) мужчин. Для оценки распространенности НАЖБП использовали индекс ожирения печени FLI, рассчитанный по формуле Bedogni G, et al. (2006). Высокий индекс FLI ≥60 считали предиктором стеатоза печени.
Результаты. Высокий FLI ≥60 выявлен у 38,5% мужчин и 26,6% женщин. Многофакторный анализ ассоциаций высокого индекса FLI у мужчин и женщин показал сильную связь: с возрастом: мужчины — отношение шансов (ОШ) 5,01, 95% доверительный интервал (ДИ): 3,82-6,59 (р<0,0001) и женщины — ОШ 8,58, 95% ДИ: 6,39-11,64 (р<0,0001), проживанием в сельской местности: мужчины — ОШ 1,32, 95% ДИ: 1,06-1,63 (р=0,011) и женщины — ОШ 1,4, 95% ДИ: 1,15-1,71 (р=0,001). Индекс FLI ≥60 значимо был связан с низкой физической активностью (р=0,001) у мужчин и курением в настоящее время у женщин (р=0,013).
Заключение. Высокий индекс FLI ≥60 наиболее распространен среди мужчин, значимо ассоциируется с возрастом, проживанием в сельской местности, курением в настоящее время у женщин и низкой физической активностью у мужчин. Высшее образование, по отношению к FLI ≥60, обладало защитным действием у женщин.
Для цитирования:
Евстифеева С.Е., Шальнова С.А., Куценко В.А., Яровая Е.Б., Баланова Ю.А., Имаева А.Э., Капустина А.В., Муромцева Г.А., Максимов С.А., Карамнова Н.С., Сопленкова А.Г., Филичкина Е.М., Викторова И.А., Прищепа Н.Н., Редько А.Н., Якушин С.С., Драпкина О.М. Распространенность неалкогольной жировой болезни печени среди населения трудоспособного возраста: ассоциации с социально-демографическими показателями и поведенческими факторами риска (данные ЭССЕ-РФ-2). Кардиоваскулярная терапия и профилактика. 2022;21(9):3356. https://doi.org/10.15829/1728-8800-2022-3356
For citation:
Evstifeeva S.E., Shalnova S.A., Kutsenko V.A., Yarovaya E.V., Balanova Yu.A., Imaeva A.E., Kapustina A.V., Muromtseva G.A., Maksimov S.A., Karamnova N.S., Soplenkova A.G., Filichkina E.M., Viktorova I.A., Prishchepa N.N., Redko A.N., Yakushin S.S., Drapkina O.M. Prevalence of non-alcoholic fatty liver disease among the working-age population: associations with socio-demographic indicators and behavioral risk factors (ESSE RF-2 data). Cardiovascular Therapy and Prevention. 2022;21(9):3356. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3356
Введение
Неалкогольная жировая болезнь печени (НАЖБП) — хроническое заболевание печени метаболического генеза, распространенность которой растет во всем мире. НАЖБП представляет интерес не только для гастроэнтерологов и гепатологов, но и для широкого круга специалистов ввиду ее синтропии с другими заболеваниями — сахарный диабет 2 типа (СД-2), сердечно-сосудистые заболевания, метаболический синдром и др. [1-3].
Как показывают авторы метаанализа исследований 22 стран (2016) [4], общая распространенность НАЖБП в популяциях значительно варьирует (10-46%), в среднем, она составляет 26,3% (85,3 млн случаев). Изучая 20-летнюю эволюцию распространенности НАЖБП, Younossi ZM, et al. (2011) продемонстрировали ее двукратное увеличение — с 5,5% в 1988-1994гг до 11,0% в 2005-2008гг [5]. Аналогичные данные были представлены в исследовании NHANES (National Health and Nutrition Examination Survey), где стеатоз печени определялся с помощью расчетного индекса Fatty Liver Index (FLI ≥30 (US), а его распространенность составила 18% в 1988-1991гг и 31% в 2011-2012гг [4]. В российском клинико-эпидемиологическом исследовании DIREG (регистр заболевания НАЖБП), которое проводилось в разные годы, авторы также указывают на рост распространенности НАЖБП: с 27,0% в 2007г до 37,3% в 2014г [6].
Построенная Estes C, et al. (2018) математическая модель с использованием данных о распространенности ожирения и СД-2 в 8 государствах (Китай, Франция, Германия, Италия, Испания, Япония, Великобритания, США), свидетельствует об увеличении распространенности НАЖБП (0- 30%) и неалкогольного стеатогепатита (НАСГ) (15- 56%), а также прогнозирует увеличение смертности к 2030г от запущенных случаев НАЖБП [7].
НАЖБП эволюционирует со временем, развиваясь от стеатоза до цирроза печени и гепатоцеллюлярной карциномы. Поражение печени подчас столь велико, что требует ее пересадки. По данным GODT (Global Observatory on Donation and Transplantation) в 2018г трансплантация печени была проведена 34074 (23%) пациентам1. В России с 2012 по 2019гг, по данным национального регистра, число нуждающихся в трансплантации печени увеличилось в 4 раза — с 488 до 2060 человек, соответственно [8-10].
Вокруг диагностики НАЖБП >20 лет продолжаются дебаты, в т.ч. о ее метаболической составляющей. Наконец, в недавно опубликованном (2020) международном экспертном консенсусном заявлении был предложен новый термин — "метаболически ассоциированная жировая болезнь печени" и приведены ее диагностические критерии [11-13].
Для НАЖБП характерно бессимптомное течение заболевания, особенно на ранних стадиях, и зачастую болезнь диагностируется врачами случайно при биохимическом и/или ультразвуковом исследовании (УЗИ). По данным литературы, на стадии НАСГ до 90% случаев повышается активность в крови гамма-глутамилтрансферазы (ГГТ), на стадии НАСГ в 5-7 раз может повыситься активность аланинаминотрансферазы/аспартатаминотрансферазы (АЛТ/АСТ), а уровень общего билирубина повышается, как правило, на стадии цирроза. Биохимические (сыворотка крови) маркеры поражения печени (общий билирубин, АСТ, АЛТ, ГГТ, щелочная фосфатаза (ЩФ)) часто используются как суррогатные маркеры при постановке диагноза, но они имеют низкую диагностическую значимость, т.к. нормальный уровень этих показателей не исключает наличия НАЖБП [14][15].
Несмотря на ограниченность чувствительности УЗИ по сравнению с другими методами лучевой диагностики (магниторезонансная и компьютерная томография) и биопсией, которая по-прежнему остается "золотым стандартом" в диагностике НАЖБП, УЗИ печени рекомендовано в качестве первой линии диагностики НАЖБП в клинической практике [1]. Перечисленные методы лучевой диагностики затратны и не всегда доступны для проведения крупномасштабного скрининга в популяции. Европейскими ассоциациями EASL-EASD-EASO (European Association for the Study of the Liver — European Association for the Study of Diabetes — European Association for the Study of Obesity) при проведении популяционных исследований рекомендовано применение расчетных диагностических индексов и, в частности, индекса ожирения печени FLI (Fatty Liver Iindex) [12][16]. Рекомендованный индекс FLI был разработан Bedogni G, et al. (2006) и основан на 4 показателях, включающих индекс массы тела (ИМТ), окружность талии (ОТ), уровень триглицеридов (ТГ) и ГГТ. Вышеперечисленные показатели были выбраны из 13 переменных (пол, возраст, потребление алкоголя, АСТ, АЛТ, ГГТ, ИМТ, ОТ, сумма 4 кожных складок, глюкоза, инсулин, ТГ и общий холестерин), которые пошагово вводили в различные модели и анализировали с помощью логистической регрессии. Площадь под кривой — ROC-AUC (Receiver Operating Characteristic — Area Under Curve) в этой модели составляла 0,85, 95% доверительный интервал (ДИ): 0,81-0,88. Валидация индекса FLI показала хорошую чувствительность (87%) и специфичность (86%) [17].
Учитывая увеличивающийся рост заболеваемости НАЖБП в России, ее связь с различными заболеваниями и состояниями, рекомендации обществ по изучению печени, ожирения, СД и отсутствие российских эпидемиологических данных о распространенности НАЖБП, проведение исследования с использованием индекса FLI представляется актуальным.
Цель исследования — оценить распространенность НАЖБП с использованием индекса FLI и изучить его ассоциации с социально-демографическими показателями и поведенческими факторами риска развития НАЖБП.
Материал и методы
Объектом одномоментного многоцентрового эпидемиологического исследования ЭССЕ-РФ-2 (Эпидемиология сердечно-сосудистых заболеваний и их факторов риска в регионах Российской Федерации, 2017г) были представительные выборки из неорганизованного мужского и женского населения в возрасте 25-64 лет из 4 регионов РФ — Краснодарский край, Республика Карелия, Омская и Рязанская области. Многоступенчатая стратифицированная выборка была сформирована по методу Киша. Исследование одобрено этическим комитетом ФГБУ "Государственный научно-исследовательский центр профилактической медицины" Министерства здравоохранения Российской Федерации ("ГНИЦПМ") (в настоящее время — ФГБУ "Национальный медицинский исследовательский центр терапии и профилактической медицины" Минздрава России)2. Все обследуемые подписали информированное согласие на обследование и обработку персональных данных. Исследование проводилось в соответствии с этическими положениями Хельсинкской декларации и Национальным стандартом Российской Федерации "Надлежащая клиническая практика GCP (Good Clinical Practice)" ГОСТ Р52379-2005. В целом отклик приглашенных респондентов на исследование составил 80,0%. Дизайн и протокол исследования ЭССЕРФ были опубликованы ранее [18].
Критериями исключения из настоящего анализа являлись: злоупотребление алкоголем (прием этанола — мужчины ≥40 г/сут. и женщины ≥20 г/сут.), гепатит (B, C и др.), онкологические заболевания и прием липидснижающих препаратов (статинов).
В работе рассчитывали индекс FLI по формуле Bedogni G, et al. (2006):
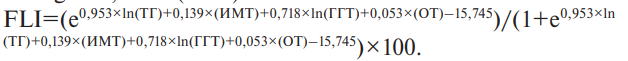
Считали, если индекс FLI <30 — отсутствие стеатоза, ≥30 — <60 — "Серая зона" (сомнительное наличие стеатоза) и ≥60 — предиктор стеатоза печени (высокий индекс) [17].
Наличие заболевания в анамнезе оценивалась при положительном ответе на вопрос: "Говорил ли Вам когда-нибудь врач, что у Вас имеются/имелись следующие заболевания? — гепатит, онкологические заболевания". Прием статинов оценивался при положительном ответе на вопрос: "Принимали ли Вы в последние 2 недели препараты, снижающие холестерин?" Если "Да" — Укажите, какие это препараты.
Курящими считали лиц, выкуривавших хотя бы одну сигарету/папиросу в сутки или бросивших курить <1 года назад. Проводился расчет употребления чистого этанола (г/сут.), при этом принималось во внимание возможность приема всех алкогольных напитков.
Физическая активность (ФА) оценивалась с помощью валидированного международного вопросника GPAQ (Global Physical Activity Questionnaire)3. За низкую ФА (НФА) принимали уровень физической нагрузки, при котором обследуемый затрачивал <150 мин/нед., что соответствует энергозатратам <600 МЕТ (метаболических эквивалентов нагрузки)/мин/нед.
Определение уровня благосостояния проводилась на основании ответов на вопросы (модуль 9), косвенно отражающие уровень доходов: "Какая часть Вашего дохода обычно тратится на еду?" (около 1/3, 1/2, 2/3, почти все); "Выберите высказывание, которое наиболее точно описывает финансовые возможности Вашей семьи?" (не хватает на самое необходимое; можем приобретать все самое необходимое, но не можем покупать дорогие товары длительного пользования и др.); "Как Вы оцениваете обеспеченность Вашей семьи по сравнению с другими?" (она очень обеспечена, относительно обеспечена и др.). Уровень благосостояния оценивали с помощью специальной шкалы, позволяющей выделять 3 уровня благосостояния: высокий (8-12 баллов), средний (5-7 баллов) и низкий (0-4 баллов).
За референсные значения принимали: не курит в настоящее время vs курит в настоящее время, умеренная и интенсивная ФА vs НФА, образование среднее и ниже vs высшее образование, доход низкий и средний vs высокий/ очень высокий доход.
Инструментальные методы исследования. Все антропометрические измерения проводились в соответствии со стандартной процедурой, используемой в большинстве исследований. ИМТ рассчитывался по формуле Кетле: ИМТ=Рост (м)/Вес (кг2). За ожирение принимали значения ИМТ ≥30 кг/кг2. За абдоминальное ожирение принимали ОТ ≥94/80 см для мужчин/женщин [19].
Лабораторные методы исследования. Во всех центрах осуществляли взятие крови из локтевой вены натощак, после 12 ч голодания. Сыворотку крови получали путем низкоскоростного центрифугирования при 900 g в течение 20 мин при температуре +40С. Образцы биологического материала замораживались и хранились при температуре не >-200С до момента отправки в федеральный центр. Транспортировку биоматериалов осуществляли специализированные службы. Показатели липидного спектра, включая уровни ТГ, глюкозы натощак, трансаминаз (АЛТ и АСТ), ГГТ, общий билирубин и ЩФ определяли на автоанализаторе Abbott Architect c8000 с использованием диагностических наборов фирмы "Abbott Diagnostic" (США). Стандартизацию и контроль качества исследований проводили в соответствии с требованиями Федеральной системы внешней оценки качества клинических лабораторных исследований. Референсные интервалы для биохимических показателей крови: ТГ ≤1,7 ммоль/л, глюкоза натощак 3,89-6,1 ммоль/л, общий билирубин 3,4-20,5 мкмоль/л, активность АЛТ 0,0-55,0 Ед/л, АСТ 5,0-34,0 Ед/л, ЩФ 40-150 Ед/л, ГГТ — для женщин 9-36 Ед/л и мужчин — 12-64 Ед/л.
Статистический анализ данных. Статистический анализ проведен с помощью языка статистического программирования и среды R (версия 3.6.1) с открытым исходным кодом.
Количественные переменные описаны медианой и интерквартильным размахом — медиана (Me) [Q25; Q75]. Качественные показатели описаны относительными частотами в процентах. Оценка ассоциации между показателями и FLI в таблице 1 проведена для непрерывных переменных при помощи критерия КраскелаУоллиса, для качественных переменных — при помощи точного теста Фишера. Оценка ассоциации между показателями и FLI ≥60 с поправкой на ковариаты проводилась при помощи модели логистической регрессии. Целевая переменная принимала значение "1" при FLI ≥60 и "0" — иначе. В качестве ковариат использовались: возраст, образование, ФА, курение, доход и регион. Оценивались отношения шансов (ОШ) и 95% ДИ. Уровень статистической значимости принят равным 0,05.
Таблица 1
Характеристика социально-демографических и биохимических показателей в зависимости от уровня индекса FLI
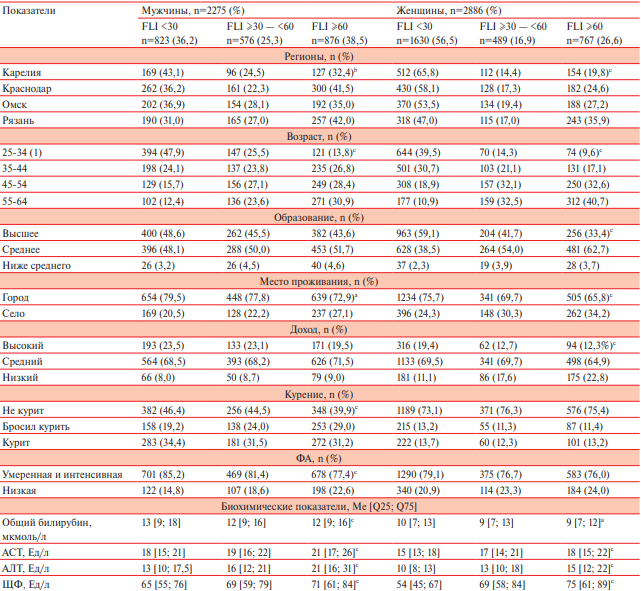
Примечание: a — р<0,005, b — р<0,001, c — р<0,0001; биохимические показатели представлены в виде медианы (Ме) и интерквартильного размаха [Q25; Q75]; FLI: <30 — отсутствие НАЖБП, ≥30 — <60 — "Серая зона" или сомнительное наличие НАЖБП, ≥60 — предиктор НАЖБП (высокий индекс); курит — курение в настоящее время (текущее); АЛТ — аланинаминотрансфераза, АСТ — аспартатаминотрансфераза, НАЖБП — неалкогольная жировая болезнь печени, ФА — физическая активность, ЩФ — щелочная фосфатаза, FLI — Fatty Liver Index (индекс ожирения печени).
Результаты
В таблице 1 представлены характеристики социально-демографических и биохимических показателей в зависимости от уровня индекса FLI.
В анализ включен 5161 респондент, из них — 2275 (44,1%) мужчин и 2886 (55,9%) женщин.
Распространенность различных категорий индекса FLI (<30, ≥30 — <60 и ≥60) в когорте составляла 47,5%, 20,6% и 31,8% соответственно. Высокий уровень FLI ≥60 в когорте выявлен у 38,5% мужчин и у 26,6% женщин.
В регионах наибольшая распространенность высокого индекса FLI (≥60) отмечалась в Рязанской области (мужчины — 42,0% и женщины — 35,9%) и минимального индекса (FLI <30) в Республике Карелия (мужчины — 43,1 и женщины — 65,8%).
Распространенность индекса FLI (≥60) увеличивалась с возрастом у мужчин (25-34 лет — 13,8%; 55-64 лет — 30,9%, р<0,0001) и у женщин (25-34 лет — 9,6%; 55-64 лет — 40,7%, р<0,0001). Высокий индекс регистрировался чаще (р<0,0001) среди мужчин с НФА. Распространенность индекса FLI (≥60) была статистически значимо ниже (р<0,05) среди женщин с высшим образованием, высоким доходом и у некурящих мужчин. Уровень биохимических показателей поражения печени (АСТ, АЛТ, и ЩФ), за исключением общего билирубина,
статистически значимо повышался с увеличением
уровня индекса FLI у мужчин и женщин.
С помощью однофакторной логистической регрессии у мужчин и женщин была подтверждена ассоциация индекса FLI ≥60 с возрастом (р<0,0001) и проживанием в сельской местности — ОШ 1,38, 95% ДИ: 1,13-1,67 (р<0,001) и ОШ 1,5, 95% ДИ: 1,26-1,79 (р<0,0001), соответственно. Выявлена статистически значимая связь FLI ≥60 с НФА у мужчин — ОШ 1,49, 95% ДИ: 1,21-1,84 (р<0,0001). Высокий доход у мужчин и женщин — ОШ 0,8, 95% ДИ: 0,65-0,98 (р<0,0001) и ОШ 0,64, 95% ДИ: 0,5-0,82 (р<0,0001), соответственно, и высшее образование у женщин — ОШ 0,41, 95% ДИ: 0,34-0,49 (р<0,0001) обладали защитным действием (отрицательная связь) по отношению к высокому индексу FLI ≥60. Индекс FLI ≥60 не ассоциировался с курением в настоящее время (текущее) в обеих гендерных группах (рисунки 1, 2).
Многофакторный анализ ассоциаций высокого индекса FLI у мужчин и женщин позволил сформировать набор показателей с наиболее сильной связью: возраст, особенно у женщин после 55 лет (55-64 лет: мужчины — ОШ 5,01, 95% ДИ: 3,82-6,59 (р<0,0001) и женщины — ОШ 8,58, 95% ДИ: 6,39- 11,64 (р<0,0001), проживание в сельской местности: мужчины — ОШ 1,32, 95% ДИ: 1,06-1,63 (р=0,011) и женщины — ОШ 1,4, 95% ДИ: 1,15-1,71 (р=0,001). Индекс FLI ≥60 был значимо связан с НФА — ОШ 1,49, 95% ДИ: 1,18-1,87 (р=0,001) у мужчин и текущим курением у женщин — ОШ 1,41, 95% ДИ: 1,07-1,84 (р=0,013). Высшее образование у женщин сохраняло отрицательную связь с повышенным индексом FLI — ОШ 0,57, 95% ДИ: 0,47-0,69 (р<0,0001) (рисунки 3, 4).
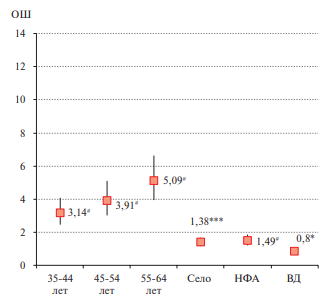
Рис. 1 Однофакторная логистическая регрессия для FLI ≥60 у мужчин.
Примечание: * — р<0,05, *** — р<0,001, # — р<0,0001; ВД — высокий доход, НФА — низкая физическая активность, ОШ — отношение шансов.
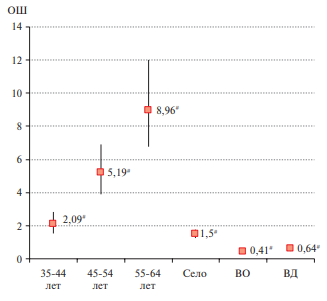
Рис. 2 Однофакторная логистическая регрессия для FLI ≥60 у женщин.
Примечание: # — р<0,0001; ВО — высшее образование, ВД — высокий доход, ОШ — отношение шансов.
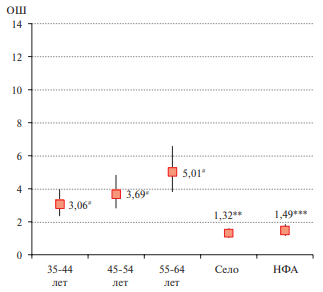
Рис. 3 Многофакторная логистическая регрессия для FLI ≥60 у мужчин с поправкой на регионы и биохимические маркеры поражения печени (АЛТ, АСТ, общий билирубин и ЩФ).
Примечание: ** — р<0,01, *** — р<0,001, # — р<0,0001; НФА — низкая физическая активность, ОШ — отношение шансов.
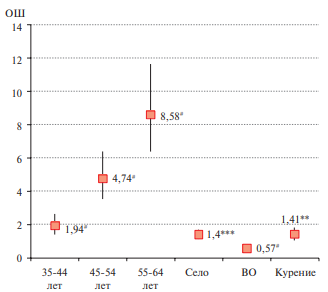
Рис. 4 Многофакторная логистическая регрессия для FLI ≥60 у женщин с поправкой на регионы и биохимические маркеры поражения печени (АЛТ, АСТ, общий билирубин и ЩФ).
Примечание: ** — р<0,01, *** — р<0,001, # — р<0,0001; ВО — высшее образование, ОШ — отношение шансов.
Обсуждение
В эпидемиологическом исследовании ЭССЕРФ-2 распространенность стеатоза печени (FLI ≥60) составила 31,8%, в т.ч. у мужчин — 38,5% и женщин — 26,6% и значимо увеличивалась с возрастом, преобладая среди мужчин и сельских жителей. Кроме того, высокий индекс FLI у мужчин статистически значимо ассоциировался с НФА, а у женщин с курением. Высокий образовательный уровень у женщин обладал защитным действием по отношению к высокому индексу (FLI ≥60). Результаты исследования подтвердили данные, представленные Younossi ZM, et al. (2016), которые показали, что глобальная распространенность НАЖБП составляла 25,2%, с самой высокой распространенностью на Ближнем Востоке — 31,8% и в Южной Америке — 30,4% и самой низкой в Африке — 13,5%. В среднем, распространенность НАЖБП в Европе и Северной Америке составляла 23,7% и 24,1%, соответственно, и в Азии — 27,4% [5].
Исследования по изучению распространенности индекса FLI в зарубежных странах продемонстрировали, что показатель стеатоза печени варьирует от 20% в США и Германии до 33% во Франции [7]. Сравнение данных литературы показывает, что Россия относится к странам с высоким уровнем распространенности стеатоза печени (>30%).
В последние десятилетия наблюдается рост распространенности НАЖБП. Так, по данным Jianghua Zhou, et al. (2020), распространенность этого показателя в Китае выросла с 23,8% в 2000г до 32,9% в 2018г. Ученые прогнозируют, что к 2030г распространенность НАЖБП в китайской популяция составит около 314,58 млн случаев и будет самой большой в мире [20].
Как и в регионах РФ, Xu C, et al. (2013) показали, что НАЖБП чаще регистрировалась у мужчин, и увеличивалась с возрастом [21]. Следует заметить, что в большинстве проведенных исследований указывается, что распространенность НАЖБП среди мужчин выше, чем у женщин, что согласуется с нашими данными. Вместе с тем, исследователи не столь единодушны в оценке связи НАЖБП с полом. В некоторых зарубежных исследованиях сообщалось, что у женщин риск НАЖБП был выше, чем у мужчин [5]. Исследователи указывают, что это может отражать как более высокую заболеваемость среди женщин, так и их высокую обращаемость за медицинской помощью. Однако надо отметить, что эти исследования не были эпидемиологическими. Еще одной из причин в половых различиях упоминается фактор распространенности умеренного потребления алкоголя среди мужчин и женщин, а также гормональный фактор (менопауза) после 45-50 лет у женщин [14][22].
Проведенные когортные исследования в Иране (2009-2010гг и 2016-2017гг) продемонстрировали одинаково хорошую предсказательную способность индекса FLI в прогнозировании НАЖБП, как у мужчин: ОШ — 1,038, 95% ДИ: 1,029-1,047 (p<0,001), так и у женщин: ОШ 1,032, 95% ДИ: 1,023-1,041 (p<0,001) [23].
Большинство исследователей показывают связь НАЖБП с НФА. Так, в общей голландской популяции (Dutch Nutrition, 2011-2013гг) распространенность жировой дистрофии печени (FLI ≥60), составляла 21,5%. Высокий индекс FLI отмечался у мужчин, старшей возрастной категории, курящих и менее физически активных [24].
В Роттердамском исследовании, была выявлена высокая распространенность НАЖБП (35,1%). Основными факторами риска НАЖБП являлись возраст, снижение ФА и курение [25]. Аналогичные данные были получены в исследовании ЭССЕРФ-2, где основными факторами высокого индекса FLI являлись возраст, НФА у мужчин и текущее курение у женщин.
Данные о связи НАЖБП с курением противоречивы. В крупном метаанализе (2018), были проанализированы данные из 20 наблюдательных исследований (9 поперечных, 6 исследований случай-контроль, 4 когортных исследований и 1 ретроспективное когортное исследование), которые показали связь распространенности НАЖБП не только при активном, но и пассивном курении. Однако авторы отмечают, что связь с текущим курением не была выявлена — ОШ 1,034, 95% ДИ 0,899-1,188 (р=0,642) [26].
Популяционные исследования позволяют оценить различные социальные показатели, влияющие на здоровье населения. В 2015г китайские и американский исследователи провели анализ 21 популяционного исследования (7 в Восточной и 5 в Южной Азии, 3 на Ближнем Востоке, 6 в Европе) о связи распространенности НАЖБП с экономическим положением в стране. Проведенный анализ показал, что глобальная распространенность НАЖБП положительно коррелировала с высоким национальным доходом на душу населения (r=0,478, р=0,028). В Европе отмечалась более высокая распространенность НАЖБП (28,0%), чем на Ближнем Востоке (12,9%, р=0,009) и Восточной Азии (19,2%, р=0,0083). Среди мужчин НАЖБП была более распространена, чем среди женщин (р=0,019), особенно в Европе (р=0,013). Кроме того, распространенность НАЖБП среди мужчин и среди респондентов, проживающих в сельской местности, коррелировала с экономическим статусом (r=0,572, р=0,026 и r=0,739, р=0,006, соответственно). Распространенность НАЖБП, в странах с высоким доходом на душу населения (<10 тыс. долларов США), в городах была выше, чем в сельской местности (12,6%, р=0,014) [27][28].
В Китайском исследовании (2020), распространенность НАЖБП была тесно связана с социальноэкономическим уровнем. Интересно, по мнению авторов, если доход увеличивается без повышения уровня образования и осведомленности о здоровье, распространенность НАЖБП будет расти [29].
В Американской работе (NHANES 2017-2018гг) было продемонстрировано, что распространенность НАЖБП была ниже у физически активных респондентов (≥600 МЕТ мин/нед.) (ОШ: 0,71, р=0,043), а более высокое образование (колледж или выше) (0,65, p=0,034), но не доход, снижал риск развития НАЖБП [30]. В исследовании ЭССЕ-РФ-2, высшее образование также обладало защитным действием, а уровень дохода не был связан с высоким индексом FLI.
В геномном и эпидемиологическом исследовании риска атеросклероза в сельских районах среди корейского населения в целом (KoGES-ARIRANG 2008-2011гг), распространенность более высокого FLI (≥60) значительно чаще (р<0,0001) отмечалась у мужчин, среди курящих в настоящее время и не выполняющих регулярную физическую нагрузку [31].
Ограничения исследования. В настоящем исследовании не проводилась лучевая диагностика,
в частности УЗИ печени, которая могла бы подтвердить признаки НАЖБП.
Заключение
Индекс стеатоза печени (FLI ≥60) выявлен у 31,8% населения. Высокий индекс чаще регистрируется у мужчин, статистически значимо ассоциируется с возрастом, проживанием в сельской местности, с текущим курением у женщин и НФА у мужчин. Высшее образование у женщин обладало защитным (отрицательная связь) действием по отношению к высокому индексу FLI ≥60. Отмечены достоверные региональные различия распространенности НАЖБП.
Учитывая увеличивающуюся распространенность НАЖБП, ее связь со многими заболеваниями и состояниями, различные взгляды на причины, диагностику и даже термин (НАЖБП или метаболически ассоциированная жировая болезнь печени) а также отсутствие эпидемиологических знаний о жировой болезни печени в России, исследование в этой области будет продолжено.
Отношения и деятельность. Исследование вы - полнено в рамках государственного задания "Развитие системы динамического наблюдения за эпидемиологической ситуацией, связанной с сердечно-сосудистыми заболеваниями и их факторами риска, в регионах Российской Федерации (ЭССЕ-РФ-2)" (№ госрегистрации AAAA-A17- 117070760036-6).
1. World Health Organization (WHO). Collaborating Centre Donation and Transplantation. https://www.transplant-observatory.org. (19 июня 2022).
2. Выписка из протокола № 03-01/17 от 18.04.2017 Заседания Независимого Этического Комитета ФГБУ "ГНИЦПМ" Министерства здравоохранения России.
3. The WHO STEPwise approach to noncommunicable disease risk factor surveillance (STEPS). Geneva. World Health Organization. https://www.who.int/ncds/surveillance/steps/en. (19 июня 2022).
Список литературы
1. Ивашкин В.Т., Маевская М.В., Павлов Ч.С. и др. Клинические рекомендации по диагностике и лечению неалкогольной жировой болезни печени Российского общества по изучению печени и Российского гастроэнтерологической ассоциации. РЖГГК. 2016;26(2):24-42. doi:10.22416/1382-4376-2016-26-2-24-42.
2. Маевская М.В., Котовская Ю.В., Ивашкин В.Т. и др. Национальный Консенсус для врачей по ведению взрослых пациентов с неалкогольной жировой болезнью печени и ее основными коморбидными состояниями. Терапевтический архив. 2022;94(2):216–53. doi:10.26442/00403660.2022.02.201363.
3. Нелидова А.В., Ливзан М.А., Николаев Н.А. и др. Сердечно-сосудистые заболевания и неалкогольная жировая болезнь печени: связь и патогенетические аспекты фармакотерапии. Рациональная Фармакотерапия в Кардиологии 2021;17(6):880-8. doi:10.20996/1819-6446-2021-12-14.
4. Younossi ZM, Stepanova M, Afendy M et al. Changes in the prevalence of the most common causes of chronic liver diseases in theUnited States from 1988 to 2008. Clin Gastroenterol Hepatology. 2011;9(6):524–30. doi:10.1016/j.cgh.2011.03.020.
5. Younossi ZM, Koenig AB, Abdelatif D et al. Global Epidemiology of Nonalcoholic Fatty Liver Disease—Meta-Analytic Assessment of Prevalence, Incidence, and Outcomes. Hepatology. 2016;64(1):73-84. doi:10.1002/hep.28431/suppinfo.
6. Драпкина О.М., Ивашкин В.Т. Эпидемиологические особенности неалкогольной жировой болезни печени в России. (Результаты открытого многоцентрового проспективного исследования-наблюдения DIREG L 01903). Российский журнал гастроэнтерологии, гепатологии, колопроктиологии. 2014;24(4):32-8. ISSN:1382-4376.
7. Estes C, Anstee QM, Arias-Loste MT et al. Modeling NAFLD disease burden in China, France, Germany, Italy, Japan, Spain, United Kingdom, and United States for the period 2016–2030. Hepatology. 2018;69:896–904. doi:10.1016/j.jhep.2018.05.036.
8. Блинов Д.В. Воронка исходов неалкогольной жировой болезни печени. Фармакоэкономика. Современная фармакоэкономика и фармакоэпидемиология. 2015;8(3):14-9. doi:10.17749/2070-4909.2015.8.3.014-019.
9. Коробка В.Л., Кострыкин М.Ю., Пасечников В.Д. и др. Определение приоритетности в выборе пациентов из листа ожидания для трансплантации печени. Вестник трансплантологии и искусственных органов. 2020;22(3):26-35. doi:10,15825/1995-1191-2020-3-26-35.
10. Готье С.В., Хомяков С.М. Донорство и трансплантация органов в Российской Федерации в 2019 году. XII сообщение регистра Российского трансплантологического общества. Вестник трансплантологии и искусственных органов. 2020;23(2):8-34. doi:10.15825/1995-1191-2010-2-8-34.
11. Eslam M, Sanyal AJ, George J. MAFLD: a consensusdriven proposed nomenclature for metabolic associated fatty liver disease. Gastroenterology. 2020;158(7):1999-2014. doi:10.1053/j.gastro.2019.11.312.
12. НАЖБП у взрослых: клиника, диагностика, лечение. Рекомендации для терапевтов (третья версия). Российское научное медицинское общество терапевтов. Научное общество гастроэнтерологов России. Экспериментальная и клиническая гастроэнтерология. 2021;185(1): 1-47. doi:10.31146/1682-8658-ecg-185-1-4-52.
13. Баланова Ю.А., Имаева А.Э., Куценко В.А. и др. Метаболический синдром и его ассоциации с социально-демографическими и поведенческими факторами риска в Российской популяции 25-64 лет. Кардиоваскулярная терапия и профилактика. 2020;19(4):45-57. doi:10.15829/1728-8800-2020-2600.
14. Ткачев А. В, Тарасова Г. Н., Грошилин В. С. и др. Распространенность неалкогольной жировой болезни печени у пациентов амбулаторно-поликлинической практики в Ростове-на-Дону: региональные результаты исследования DIREG-2. Терапевтический архив. 2016;88(8):59-66. doi:10.17116/terarkh201688859-66.
15. Носов А.Е., Зенина М.Т., Горбушина О.Ю. и др. Значимость клинико-лабораторных индексов в диагностике неалкогольной жировой болезни печени. Терапевтический архив. 2021;93(8):883–889. doi:10.26442/00403660.2021.08.200973.
16. EASL-EASD-EASO. Clinical Practice Guideline for the management of non-alcoholic liver disease. European Association for the Study of the Liver (EASL) and European Association for the Study of Diabetes (EASD) and European Association for the Study of Obesity (EASO). Hepatology. 2016;64:1388–1402. doi:10.1016/j.jhep.2015.11.004.
17. Bedogni G, Bellentani S, Miglioli L et al. The Fatty Liver Index: A simple and accurate predictor of hepatic steatosis in the general population. BMC Gastroenterol. 2006;6:33. doi:10.1186/1471-230X-6-33.
18. Бойцов С.А., Чазов Е.И., Шляхто Е.В. и др. Научно-организационный комитет проекта ЭССЕ-РФ. Эпидемиология сердечно-сосудистых заболеваний в различных регионах России (ЭССЕ-РФ). Обоснование и дизайин исследований. Профилактическая медицина. 2013;16(6):25-34. ISSN:2305-4948.
19. Баланова Ю. А, Имаева А. Э., Концевая А. В. и др. Эпидемиологический мониторинг факторов риска хронических неинфекционных заболеваний в практическом здравоохранении на региональном уровне. Методические рекомендации под редакцией Бойцова С.А. М: Медиа Сфера, 2016. с. 111. doi:10.17116/profmed2016metod01.
20. Zhou J, Zhou F, Wang W et al. Epidemiological Features of NAFLD From 1999 to 2018 in China. Hepatology. 2020;71(5):1851-64. doi:10.1002/hep.31150/suppinfo.
21. Xu C, Yu C, Ma H et al. Prevalence and risk factors for the development of nonalcoholic fatty liver disease in a nonobese Chinese population: the Zhejiang Zhenhai Study. Am J Gastroenterol. 2013;108:1299-304. doi:10.1038/ajg.2013.104.
22. Pan JJ, Fallon MB. Gender and racial differences in nonalcoholic fatty liver disease World Hepatology. 2014;6(5):274-283. doi:10.4254/wjh.v6.i5.
23. Motamed N, Faraji AH, Khonsari MR et al. Fatty liver index (FLI) and prediction of new cases of non-alcoholic fatty liver disease: A population-based study of northern Iran. Clinical Nutrition. 2020;39:468-74. doi:10.1016/j.clnu.2019.02.024.
24. Rietman A, Sluik D, Feskens EJM et al. Associations between dietary factors and markers of NAFLD in a general Dutch adult population. European Journal of Clinical Nutrition. 2018;72:117–23. doi:10.1038/ejcn.2017.148.
25. Ikram MA, Brusselle1 GGO, Murad SD et al. The Rotterdam Study: 2018 update on objectives, design and main results. Eur J Epidemiol. 2017;32:807–50. doi:10.1007/s10654-017-0321-4.
26. Arash Akhavan Rezayat, Malihe Dadgar Moghadam, Mohammad Ghasemi Nour et al. Association between smoking and non-alcoholic fatty liver disease: A systematic review and meta-analysis. SAGE Open Medicine. 2018;6:1–12. doi:10.1177/2050312117745223.
27. Zhu JZ, Dai YN, Wang YM et al. Prevalence of Nonalcoholic Fatty Liver Disease and Economy. Dig Dis Sci. 2015;60(11):3194–202. doi: 10.1007/s10620-015-3728-3.
28. Никонов Е.Л. Аксенов В.А. Современные подходы к диагностике и лечению неалкогольной жировой болезни печени. Профилактическая медицина. 2018;3:62-69. doi.org/10.17116/profmed201831262
29. Hu W, Liu Z, Hao HR et al. Correlation between income and non-alcoholic fatty liver disease in a Chinese population. Ann Endocrinol (Paris). 2020;81(6):561-566. doi:10.1016/j.ando.2020.07.1109.
30. Vilar-Gomez E, Nephew LD, Vuppalanchi R et al. High-quality diet, physical activity, and college education are associated with low risk of NAFLD among the US population. Hepatology. 2021;00:1–16. doi:10.1002/hep.32207.
31. Huh JH, Ahn SV, Koh SB et al. Prospective Study of Fatty Liver Index and Incident Hypertension: The KoGES-ARIRANG Study. PLoS ONE. 2015;10:11:e0143560. doi:10.1371/journal.pone.0143560.
Об авторах
С. Е. ЕвстифееваРоссия
Светлана Евгеньевна Евстифеева — кандидат медицинских наук, старший научный сотрудник отдела эпидемиологии хронических неинфекционных заболеваний
Москва
С. А. Шальнова
Россия
Светлана Анатольевна Шальнова. — доктор медицинских наук, профессор, руководитель отдела
Москва
В. А. Куценко
Россия
Владимир Александрович Куценко — младший научный сотрудник лаборатории биостатистики отдела; аспирант кафедры теории вероятностей механико-математического факультета МГУ им. Ломоносова
Москва
Е. Б. Яровая
Россия
Елена Борисовна Яровая — доктор физико-математических наук, профессор, руководитель лаборатории биостатистики отдела эпидемиологии хронических неинфекционных заболеваний; профессор кафедры теории вероятностей механико-математического факультета МГУ им. Ломоносова
Москва
Ю. А. Баланова
Россия
Юлия Андреевна Баланова — доктор медицинских наук, ведущий научный сотрудник отдела эпидемиологии хронических неинфекционных заболеваний
Москва
А. Э. Имаева
Россия
Асия Эмверовна Имаева — доктор медицинских наук, старший научный сотрудник отдела эпидемиологии хронических неинфекционных заболеваний
Москва
А. В. Капустина
Россия
Анна Владимировна Капустина — старший научный сотрудник отдела эпидемиологии хронических неинфекционных заболеваний
Г. А. Муромцева
Россия
Галина Аркадьевна Муромцева — кандидат биологических наук, ведущий научный сотрудник отдела эпидемиологии хронических неинфекционных заболеваний
Москва
С. А. Максимов
Россия
Сергей Алексеевич Максимов — доктор медицинских наук, ведущий научный сотрудник отдела эпидемиологии хронических неинфекционных заболеваний
Москва
Н. С. Карамнова
Россия
Наталья Станиславовна Карамнова — кандидат медицинских наук, руководитель лаборатории эпидемиологии питания отдела эпидемиологии хронических неинфекционных заболеваний
Москва
А. Г. Сопленкова
Россия
Анна Глебовна Сопленкова. — лаборант лаборатории биостатистики отдела эпидемиологии хронических неинфекционных заболеваний
Москва
Е. М. Филичкина
Россия
Елена Михайловна Филичкина — лаборант лаборатории биостатистики отдела эпидемиологии хронических неинфекционных заболеваний
Москва
И. А. Викторова
Россия
Инна Анатольевна Викторова — доктор медицинских наук, профессор, зав. кафедрой поликлинической терапии и внутренних болезней, главный внештатный специалист по терапии и общей врачебной практике Минздрава Омской области
Омск
Н. Н. Прищепа
Россия
Наталья Николаевна Прищепа — и.о. главного врача
Петрозаводск, Республика Карелия
А. Н. Редько
Андрей Николаевич Редько — доктор медицинских наук, профессор, зав. кафедрой общественного здоровья, здравоохранения и истории медицины
Краснодар
С. С. Якушин
Россия
Сергей Степанович Якушин — доктор медицинских наук, профессор, зав. кафедрой госпитальной терапии с курсом медико-социальной экспертизы
Рязань
О. М. Драпкина
Россия
Оксана Михайловна Драпкина — доктор медицинских наук, профессор, академик РАН, директор
Москва;
Дополнительные файлы
Рецензия
Для цитирования:
Евстифеева С.Е., Шальнова С.А., Куценко В.А., Яровая Е.Б., Баланова Ю.А., Имаева А.Э., Капустина А.В., Муромцева Г.А., Максимов С.А., Карамнова Н.С., Сопленкова А.Г., Филичкина Е.М., Викторова И.А., Прищепа Н.Н., Редько А.Н., Якушин С.С., Драпкина О.М. Распространенность неалкогольной жировой болезни печени среди населения трудоспособного возраста: ассоциации с социально-демографическими показателями и поведенческими факторами риска (данные ЭССЕ-РФ-2). Кардиоваскулярная терапия и профилактика. 2022;21(9):3356. https://doi.org/10.15829/1728-8800-2022-3356
For citation:
Evstifeeva S.E., Shalnova S.A., Kutsenko V.A., Yarovaya E.V., Balanova Yu.A., Imaeva A.E., Kapustina A.V., Muromtseva G.A., Maksimov S.A., Karamnova N.S., Soplenkova A.G., Filichkina E.M., Viktorova I.A., Prishchepa N.N., Redko A.N., Yakushin S.S., Drapkina O.M. Prevalence of non-alcoholic fatty liver disease among the working-age population: associations with socio-demographic indicators and behavioral risk factors (ESSE RF-2 data). Cardiovascular Therapy and Prevention. 2022;21(9):3356. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3356

























































