Перейти к:
Влияние катетерной ренальной денервации на динамику состояния углеводного обмена у пациентов с сахарным диабетом и артериальной гипертензией
https://doi.org/10.15829/1728-8800-2022-3459
Аннотация
Цель. Изучить влияние катетерной симпатической ренальной денервации (РДН) почек методом радиочастотной аблации многополюсным электродом на метаболизм глюкозы у пациентов с сахарным диабетом 2 типа и неконтролируемой артериальной гипертензией.
Материал и методы. 60 пациентов были случайным образом распределены в соотношении 1:1 в группу РДН и контрольную группу. Радиочастотная аблация проводилась через феморальный доступ с использованием катетера Spyral (Medtronic, USA).
Результаты. Технический успех операции составил 100%. Осложнения как системные, так и со стороны места доступа, отсутствовали. У пациентов в группе РДН в течение периода наблюдения было выявлено значимое снижение среднего уровня гликированного гемоглобина — с 7,9 (6,83-8,35) до 6,85 (6,12-7,10)% (p<0,001) и базальной гликемии — с 9,5 (7,17-10,28) до 7,55 (6,43-8,95) ммоль/л (p<0,001) при отсутствии значимых изменений в контрольной группе. Изменения уровня глюкозы и степени инсулинорезистентности коррелировали со снижением офисного систолического артериального давления (r=0,36, р=0,005). Через 6 мес. наблюдения в группе РДН, наряду со значительным снижением индекса инсулинорезистентности (индекс HOMA-IR) на 1,92 (p<0,001), также значимо повысился средний уровень холестерина липопротеинов высокой плотности на 0,17 ммоль/л (p<0,001), а средний уровень триглицеридов снизился на -0,55 ммоль/л (p<0,001).
Заключение. Результаты исследования подтверждают гипотезу о плейотропных эффектах РДН у пациентов с коморбидной патологией, ассоциированной с центральным гипертонусом симпатической нервной системы (сахарный диабет, артериальная гипертензия, дислипидемия).
Ключевые слова
Для цитирования:
Фещенко Д.А., Руденко Б.А., Шукуров Ф.Б., Васильев Д.К., Мамедов М.Н., Драпкина О.М. Влияние катетерной ренальной денервации на динамику состояния углеводного обмена у пациентов с сахарным диабетом и артериальной гипертензией. Кардиоваскулярная терапия и профилактика. 2022;21(12):3459. https://doi.org/10.15829/1728-8800-2022-3459
For citation:
Feshchenko D.A., Rudenko B.A., Shukurov F.B., Vasiliev D.K., Mamedov M.N., Drapkina O.M. Influence of catheter-based renal denervation on carbohydrate metabolism in patients with diabetes and hypertension. Cardiovascular Therapy and Prevention. 2022;21(12):3459. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3459
Введение
Сахарный диабет (СД) представляет собой группу эндокринных заболеваний, возникающих в результате нарушения секреции и действия инсулина, которые характеризуются нарушением метаболизма углеводов, белков и липидов [1]. Пациенты, страдающие СД 2 типа, в большей степени подвержены развитию сопутствующих сердечно-сосудистых заболеваний (ССЗ) — артериальной гипертензии (АГ), сердечной недостаточности, а также высокому риску возникновения сосудистых катастроф: в 2 раза повышается риск развития острого инфаркта миокарда и инсульта [2]. Крайне важно понимать, что с каждым годом наблюдается неуклонный рост числа больных СД и, в отсутствие своевременных профилактических и лечебных мер, к 2030г СД будет страдать 1 из 19 взрослых [3].
Согласно проведенным исследованиям, гиперактивация симпатической нервной системы (СНС) играет ключевую роль в формировании инсулинорезистентности (ИР) и развитии СД 2 типа; в свою очередь сама ИР способствует еще большему повышению общего симпатического тонуса [4][5]. В почечной паренхиме и почечных сосудах сконцентрированы нервные структуры периферического отдела СНС, которые вовлечены в сложные физиологические механизмы регуляции артериального давления (АД), углеводного обмена и экскреторной функции почек.
В последнее десятилетие катетерная ренальная денервация (РДН) — малоинвазивный метод, нацеленный на деструкцию нервных волокон, находящихся в адвентиции почечных артерий, — применялся при лечении резистентной АГ [6]. Однако степень ее эффективности от исследования к исследованию значительно менялась [3-5]. Радость от первых успехов в исследованиях Symplicity HTN-1 (Renal Denervation in Patients with Refractory Hypertension) и Symplicity HTN-2 (Renal Denervation in Patients with Uncontrolled Hypertension), в которых был продемонстрирован стойкий антигипертензивный эффект РДН и впервые выявлено положительное влияние метода на уровень метаболических параметров, сменилась разочарованием от результатов крупного контролируемого исследования Symplicity HTN-3 [7-10]. Проанализировав причины неудач, исследователи пришли к выводу о несовершенстве техники операции и используемого инструментария.
Согласно ранним исследованиям, положительное влияние РДН на уровень АД и параметры углеводного обмена (метаболизм глюкозы, чувствительность к инсулину) реализуется за счет комбинированного нейроэндокринного воздействия на региональную гемодинамику: снижение афферентной импульсации СНС и уменьшения высвобождения норадреналина в кровеносное русло [11-15]. В эксперименте на животных, в которых РДН выполняли хирургическим или химическим путем [16][17], наблюдалось снижение мышечной симпатической активности и улучшение чувствительности к инсулину.
Создание новой конфигурации катетера и усовершенствование техники радиочастотной РДН позволило улучшить клинический результат. Исследования SPYRAL HTN-OFF MED (Catheter-based renal denervation in patients with uncontrolled hypertension in the absence of antihypertensive medications), SPYRAL HTN-ON MED (Effect of renal denervation on blood pressure in the presence of antihypertensive drugs), призванные решить недостатки предыдущих исследований, в полной мере доказали стойкий антигипертензивный эффект нового подхода в лечении неконтролируемой АГ [18][19]. Как ранее отмечалось, нарушения углеводного обмена и повышение тонуса СНС патогенетически взаимосвязаны, и больные с сочетанием СД и АГ имеют максимальную степень симпатической активности [20]; именно этот факт лег в основу гипотезы о возможном положительном влиянии многополюсной РДН на метаболические параметры (липидный и углеводный обмен) для последующих исследований.
Цель настоящего исследования — изучить гипогликемический эффект многополюсной радиочастотной РДН у пациентов с неконтролируемой АГ и СД 2 типа.
Материал и методы
В проспективное рандомизированное открытое исследование включались пациенты с неконтролируемой АГ в сочетании с СД 2 типа. Исследование проводилось в период с 2021 по 2022гг на базе отделения рентгенхирургических методов диагностики и лечения ФГБУ "НМИЦ ТПМ" Минздрава России. Критериями включения являлись наличие эссенциальной АГ с уровнем АД ≥140/90 мм рт.ст. на фоне приема ≥3 препаратов в максимальных дозах, один из которых — диуретик, продолжительностью не <4 нед. до скрининга и СД 2 типа. Из исследования исключались пациенты с вторичным генезом АГ, хронической болезнью почек 4 и 5 стадий (скорость клубочковой фильтрации (СКФ) <30 мл/мин/1,73 м2), аномалией развития и/или атеросклеротическим поражением почечных артерий (стеноз >50%), стентированными почечными артериями, выраженным периферическим атеросклерозом, СД 1 типа, анафилактической реакцией на рентген-контрастные препараты и высоким риском осложнений вмешательства вследствие ранних сроков острых состояний или тяжелых сопутствующих заболеваний. Оценка приверженности к терапии проводилась исходя из результатов опроса.
В общей сложности 100 пациентов с АГ и СД были обследованы на предмет возможности включения в исследование. Из этой группы 40 пациентов не соответствовали заранее определенным критериям включения и были исключены. Оставшиеся 60 пациентов приняли участие в исследовании, подписали информированное согласие и были случайным образом распределены в соотношении 1:1 (параллельное распределение без стратификации) в группу РДН и контрольную группу. Исследование было одобрено этическим комитетом ФГБУ "НМИЦ ТПМ" Минздрава России (протокол № 06-04/21 от 09.09.2021).
Все пациенты подверглись детальному опросу, физикальному осмотру, а также лабораторно-инструментальному обследованию, которое состояло из оценки исходных параметров углеводного обмена (уровень глюкозы натощак, инсулина, гликированного гемоглобина (HbA1c) и степени ИР), липидного профиля (все фракции холестерина (ХС)), азотвыделительной функции почек (уровень креатинина, расчет СКФ по формуле CKD-EPI) и уровня офисного АД. Расчет ИР проводился с использованием индекса HOMA-IR (Homeostasis Model Assessment Insulin Resistance). Пациенты были инструктированы о необходимости соблюдать режим антигипертензивной и сахароснижающей терапии на протяжении всего исследования. Изменения антигипертензивных препаратов после рандомизации допускались только при контрольных визитах у пациентов с АД >180/110 мм рт.ст.
Первичной конечной точкой эффективности считали снижение уровня гликемии в динамике через 6 мес. наблюдения. Дополнительно оценивалась динамика офисного АД, степени ИР, уровня липидов (общего ХС, ХС липопротеинов высокой плотности (ЛВП), ХС липопротеинов очень низкой плотности (ЛОНП), ХС липопротеинов низкой плотности (ЛНП), триглицеридов (ТГ)). Дизайн исследования представлен на рисунке 1.
Операцию РДН методом многополюсной радиочастотной аблации проводили под внутривенной седацией и обезболиванием в условиях рентгеноперационной по стандартной схеме. В качестве артериального доступа у всех пациентов использовалась бедренная артерия. Катетеризация общей бедренной артерии во всех случаях проводилась под ультразвуковой навигацией. С помощью катетера Symplicity Spyral (Medtronic, USA) аблационному воздействию подвергались как основной ствол почечных артерий (<8 мм), так и их дистальные ветви (диаметром >3 мм) (рисунки 2-5). Количество аблаций определялось анатомическими особенностями (длиной и диаметром почечных сосудов). В обязательном порядке выполнялась ангиография почечных артерий до РДН и после последней аппликации с каждой стороны. Выполнение РДН было доверено двум специалистам, имеющим достаточный хирургический опыт (>50 процедур РДН с использованием катетера нового поколения) и являющимися сертифицированными специалистами по данному виду вмешательства.
Для оценки безопасности процедуры всем пациентам через 48-72 ч после РДН, а также спустя 6 мес. определяли уровень креатинина крови и проводили расчет СКФ по формуле CKD-EPI. Кроме того, в течение 6 мес. регистрировали все неблагоприятные события, в т.ч. случаи смерти от всех причин, повторных госпитализаций по поводу гипертонических кризов и осложнений течения СД, повторных интервенций на почечных сосудах.
Статистический анализ проводили с использованием программы StatTech v. 2.8.8 (разработчик — ООО "Статтех", Россия). Количественные показатели, имеющие нормальное распределение, описывали с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95% доверительного интервала. При распределении, отличном от нормального, количественные данные описывали с помощью медианы (Me) и интерквартильного размаха (Q1-Q3). Категориальные переменные отражены количественно и в процентном отношении. Использовали стандартные методы описательной статистики, выявляли различия непрерывных переменных в независимых выборках (t-критерий, U-критерий Манна-Уитни) и парных выборках (t-критерий, W-критерий Вилкоксона). При анализе качественных данных применяли анализ таблиц сопряженности (χ2 Пирсона или точный критерий Фишера с двусторонним уровнем значимости). Критическим уровнем значимости p считали 0,05.

Рис. 1 Дизайн исследования.
Примечание: АГ — артериальная гипертензия, РДН — ренальная денервация, СД — сахарный диабет.

Рис. 2 РЧА дочерней ветви левой артерии.
Рис. 3 РЧА основного ствола левой почечной почечной артерии.
Рис. 4 РЧА дочерней ветви правой почечной артерии.
Результаты
Существенных различий по клинико-демографическим параметрам между двумя группами не выявлено (таблица 1). В группе РДН превалировал женский пол (60%), в контрольной группе — мужчины составили больше половины исследуемых (53,3%). Средний возраст всех пациентов находился в диапазоне 61-66 лет. Среднее значение индекса массы тела (ИМТ) составило >31 кг/м2 (Q25 >30 кг/м2) в обеих группах, что свидетельствует о наличии ожирения разной степени у большинства пациентов. Принимая во внимание сопутствующие АГ, СД, дислипидемию, а также ожирение, мы можем говорить о формировании у пациентов исследуемой когорты метаболического синдрома. У трети исследуемых были зафиксированы сердечно-сосудистые катастрофы (таблица 1). Распространенность периферического атеросклероза была крайне высока, но только в 10% случаев он был клинически значим.
Все пациенты получали антигипертензивную и гипогликемическую терапию (таблица 2). Пациенты обеих групп принимали, в среднем, по 4 препарата из различных классов антигипертензивных средств: у всех больных терапия включала диуретики, блокаторы ренин-ангиотензин-альдостероновой системы (ингибиторы ангиотензинпревращающего фермента (иАПФ)/сартаны), β-блокаторы, при этом антагонисты кальция дополнительно добавлялись к терапии в >60% случаев. Между группами прослеживается значительная разница в назначении иАПФ и сартанов: сартанам отдавали предпочтение в контрольной группе, в группе РДН — иАПФ (p<0,001). У всех пациентов диагноз СД был выставлен за >6 мес. до включения в исследование, в качестве сахароснижающих средств использовался, в основном, метформин (73,3 и 83,3%), инсулины различного действия (26,7 и 20%), а в трети случаев понадобилось назначение комбинированной терапии пероральными сахароснижающими средствами.
Несмотря на проводимую оптимальную гиполипидемическую терапию (аторвастатин или розувастатин в максимальных дозировках, а в 30% случаев дополнительное назначение лекарственных средств, селективно ингибирующих абсорбцию ХС) средний уровень общего ХС оставался высоким (4,25 и 4,30 ммоль/л).
Во время РДН было использовано 91,3±25,2 мл рентгенконтрастного вещества, затрачено 78,5±14,8 мин операционного времени. Всего было выполнено 41,9±6,8 полных аблаций: в основных ветвях — 18,3±6,3, в дочерних ветвях — 23,0 (17,2-28,8) аблаций. Осложнений как системных, так и со стороны места доступа ни в одном случае не наблюдалось.
Исходное значение офисного систолическое АД (САД) составило 162,0±12,5 мм рт.ст. РДН значительно снижало уровень офисного САД на -11±8 мм рт.ст. (p<0,001) и ДАД -4 (-8-0) мм рт.ст. (p<0,001) через 6 мес. наблюдения (таблица 3). У пациентов контрольной группы динамика офисного АД была незначительной, и составила -2/
-1 мм рт.ст. (р =0,055/0,145) (таблица 3). Ответчиками на лечение (т. н. респондеры) считали пациентов, у которых уровень снижения офисного САД составил >10 мм рт.ст. В группе РДН ответчиками были 21 (70%) пациент. Однако после 6-месячного контрольного визита у 4-х пролеченных пациентов дозу антигипертензивных препаратов пришлось уменьшить из-за симптомной гипотензии. У 2-х пациентов из контрольной группы и у 1-го пациента из группы РДН дозу антигипертензивного препарата пришлось увеличить в связи с повышением цифр АД. Для исключения вазоренального механизма постпроцедурального повышения АД (стенозирование почечных артерий) было выполнено дуплексное сканирование сосудов почек, по результатам которого изменений анатомии почечных артерий выявлено не было.
Анализ динамики состояния углеводного обмена у пациентов в группе РДН через 6 мес. наблюдения показал значимое снижение среднего уровня HbA1c — с 7,9 (6,83-8,35) до 6,85 (6,12-7,10)% (p<0,001), и базальной гликемии — с 9,5 (7,17-10,28) до 7,55 (6,43-8,95) ммоль/л (p<0,001) при отсутствии значимых изменений в контрольной группе (таблица 3) (рисунки 6, 7). Положительная динамика гликемического контроля в виде снижения уровня HbA1c имела место у 12 (40%) больных. Изменения уровня глюкозы и степени ИР коррелировали со снижением офисного САД (r=0,36, р=0,005). Не менее важным показателем, отражающим тяжесть нарушения углеводного обмена, является степень ИР. Чувствительность к инсулину, измеренная с помощью индекса HOMA-IR, значительно увеличилась после РДН: HOMA-IR снизился с 6,60 (3,65-12,52) до 4,54 (3,39-8,2) (p<0,001) (таблица 3) (рисунок 8).
Анализ динамики показателей липидного профиля через 6 мес. после РДН выявил значимое повышение среднего уровня ХС ЛВП на 0,18 ммоль/л (p<0,001), в то время как средний уровень ТГ снизился на -0,23 ммоль/л (p<0,001). Остальные показатели липидного обмена остались на исходном уровне (таблица 3).
Контрольные обследования прошли все пациенты, за время наблюдения ни одного крупного сердечно-сосудистого события зафиксировано не было.
Таблица 1
Клинико-инструментальная характеристика пациентов [M±SD или Me (Q25-Q75) или n (%)]
|
Параметр |
Группа РДН (n=30) |
Контрольная группа |
p |
|
Возраст, годы |
61,67±11,84 |
65,93±7,49 |
0,101 |
|
Пол (женский пол) |
18 (60,0) |
14 (46,7) |
0,301 |
|
ИМТ, кг/м2 |
34,20 (30,48-37,93) |
31,40 (30,20-34,77) |
0,147 |
|
ОКС/ИМ |
10 (33,3) |
6 (20,0) |
0,382 |
|
ТИА/ОНМК |
2 (6,7) |
6 (20,0) |
0,254 |
|
Периферический атеросклероз |
26 (86,7) |
28 (93,3) |
0,671 |
|
Креатинин крови, ммоль/л |
87,0 (69,8-98,5) |
78,0 (66,2-93,8) |
0,359 |
|
Расчетная СКФ, мл/мин/1,73 м2 |
73,83±17,89 |
74,97±17,18 |
0,801 |
|
Базальная гликемия, ммоль/л |
9,50 (7,17-10,28) |
10,70 (7,32-13,15) |
0,139 |
|
Инсулин крови, мкМЕ/мл |
18,40 (12,07-33,35) |
20,20 (10,87-64,45) |
0,496 |
|
HbA1c, % |
7,90 (6,83-8,35) |
7,80 (6,03-8,17) |
0,314 |
|
HOMA-IR |
6,60 (3,65-12,52) |
6,93 (5,35-27,73) |
0,225 |
|
Общий ХС, ммоль/л |
4,33 (3,70-5,48) |
4,28 (3,54-5,45) |
0,701 |
|
ХС ЛНП, ммоль/л |
2,04 (1,76-3,26) |
2,05 (1,40-3,41) |
0,534 |
|
ХС ЛОНП, ммоль/л |
0,90 (0,64-1,19) |
0,72 (0,56-1,10) |
0,329 |
|
ХС ЛВП, ммоль/л |
1,21 (0,97-1,38) |
1,23 (1,07-1,46) |
0,399 |
|
ТГ, ммоль/л |
2,04 (1,40-3,00) |
2,01 (1,23-3,26) |
0,796 |
|
оф. САД, мм рт.ст. |
162,0±12,5 |
160,9±11,7 |
0,734 |
|
оф. ДАД, мм рт.ст. |
94,0 (90-100,0) |
98,0 (92,5-100,0) |
0,139 |

Рис. 5 РЧА основной ветви правой почечной артерии.
Таблица 2
Характеристика сахароснижающей и антигипертензивной терапии
|
Параметр |
Группа РДН (n=30) |
Контрольная группа |
p |
|
Антигипертензивная терапия |
|||
|
Количество антигипертензивных препаратов |
4,00 (3,00-4,00) |
4,00 (3,25-4,00) |
0,805 |
|
иАПФ/сартаны, n (%) |
22/8 (100) |
6/24 (100) |
<0,001* |
|
Диуретики, n (%) |
30 (100) |
30 (100) |
|
|
β-блокаторы, n (%) |
30 (100) |
30 (100) |
|
|
Антагонисты кальция, n (%) |
20 (66,7) |
22 (73,3) |
0,779 |
|
Другие, n (%) |
3 (10) |
2 (6,67) |
|
|
Сахароснижающая терапия |
|||
|
Инсулинотерапия + ПСC |
8 (26,7) |
6 (20,0) |
0,761 |
|
Метформин |
22 (73,3) |
25 (83,3) |
0,532 |
|
Комбинированная терапия ПСС |
10 (33,3) |
10 (33,3) |
|
|
Гиполипидемическая терапия |
|||
|
Аторвастатин/розувастатин |
24/6 |
26/4 |
0,731 |
|
Статины + ИАХ |
8 (26,7) |
10 (33,3) |
0,779 |
Таблица 3
Динамика инструментальных и лабораторных показателей в основной и контрольной группах (M±SD или Me (Q25-Q75))
|
Показатель |
Группа РДН |
Контрольная группа |
p |
||
|
До |
Через 6 мес. |
До |
Через 6 мес. |
||
|
оф. САД, мм рт.ст. |
162,0±12,5 |
150,6±11,1* |
160,9±11,7 |
159,2±11,8 |
0,005 |
|
оф. ДАД, мм рт.ст. |
94,0 (90-100,0) |
90 (88-92)* |
98,0 (92,5-100,0) |
97,0 (92-100) |
<0,001 |
|
Уровень глюкозы натощак, ммоль/л |
9,50 (7,17-10,28) |
7,55 (6,43-8,95)* |
10,70 (7,32-13,15) |
10,40 (7,20-13,28) |
0,003 |
|
Уровень HbA1c, % |
7,90 (6,83-8,35) |
6,85 (6,12-7,10)* |
7,80 (6,03-8,17) |
7,50 (6,20-8,20) |
0,044 |
|
HOMA-IR |
6,60 (3,65-12,52) |
4,54 (3,39-8,20)* |
6,93 (5,35-27,73) |
7,24 (5,29-14,81) |
0,014 |
|
Общий ХС, ммоль/л |
4,33 (3,70-5,48) |
4,55 (4,00-5,75)* |
4,28 (3,54-5,45) |
4,29 (3,52-5,27) |
0,255 |
|
ХС ЛНП, ммоль/л |
2,04 (1,76-3,26) |
2,05 (1,73-3,21) |
2,05 (1,40-3,41) |
1,85 (1,48-3,34) |
0,359 |
|
ХС ЛОНП, ммоль/л |
0,90 (0,64-1,19) |
0,90 (0,64-1,26) |
0,72 (0,56-1,10) |
0,68 (0,56-1,22) |
0,248 |
|
ХС ЛВП, ммоль/л |
1,21 (0,97-1,38) |
1,38 (1,25-1,58)* |
1,23 (1,07- 1,46) |
1,22 (1,11-1,41) |
0,047 |
|
ТГ, ммоль/л |
2,04 (1,40-3,00) |
1,49 (1,10-2,25)* |
2,01 (1,23-3,26) |
2,16 (1,41-3,28)* |
0,038 |
Примечание: * — различия показателей статистически значимы (p<0,05), оф. — офисные показатели, SD — стандартное отклонение (вариабельность). ДАД — диастолическое артериальное давление, ЛВП — липопротеины высокой плотности, ЛНП — липопротеины низкой плотности, ЛОНП — липопротеины очень низкой плотности, РДН — ренальная денервация, САД — систолическое артериальное давление, ТГ — триглицериды, ХС — холестерин, HbA1c — гликированный гемоглобин, HOMA-IR — Homeostasis Model Assessment Insulin Resistance.

Рис. 6 Анализ динамики глюкозы натощак в зависимости от метода лечения.
Примечание: РДН — ренальная денервация.
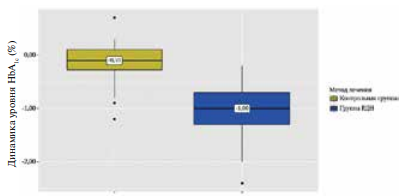
Рис. 7 Анализ динамики HbA1c в зависимости от метода лечения.
Примечание: РДН — ренальная денервация, HbA1c — гликированный гемоглобин.

Рис. 8 Анализ динамики степени ИР в зависимости от метода лечения.
Примечание: РДН — ренальная денервация, HOMA-IR — Homeostasis Model Assessment Insulin Resistance.
Обсуждение
СНС почек является важным регулятором резистентности к инсулину, а деструкции ее периферического звена методом РДН в дополнение к основному антигипертензивному эффекту с высокой долей вероятности позволит улучшить чувствительность к инсулину и метаболизм глюкозы. СНС и чувствительность тканей к инсулину тесто взаимосвязаны: активация СНС повышает ИР и приводит к развитию метаболического синдрома, ожирению и, в конечном итоге, СД [20]. При этом неиспользованный инсулин оказывает симпатоактивирующее действие [20]. РДН, как метод патогенетической борьбы с формирующимся порочным кругом "активация СНС — ИР — активация СНС", позволяет изолированно воздействовать на СНС, не вызывая системных побочных эффектов. Было показано, что ингибирование СНС моксонидином улучшает метаболизм глюкозы за счет снижения секреции глюкагона, увеличения кровотока к скелетным мышцам и уменьшения активности гликогенолиза и глюконеогенеза, что свидетельствует в пользу патофизиологической связи между центральной нервной системой и резистентностью к инсулину [21][22].
Однако неспецифичность механизма действия центральных симпатолитиков и, как следствие, большое количество побочных эффектов, приводит к частому несоблюдению режима лечения [23]. Повышенный уровень глюкозы натощак, нарушение толерантности к глюкозе и СД ассоциированы с повышенным риском ССЗ в результате стимуляции воспалительной реакции, окислительного стресса и тромботической активности, а также ингибирования апоптоза гладкомышечных клеток сосудов [24][25]. Приблизительно 50% пациентов с эссенциальной АГ имеют резистентность к инсулину [26]. РДН может замедлить прогрессирование ИР и предотвратить развитие СД, а в некоторых случаях, способствовать стойкому регрессу СД. Клиническая стратегия значительного снижения центрального тонуса СНС может одновременно повлиять на 2 основных фактора риска у пациентов с ССЗ: уровень АД и гликемический статус.
Однако клинических исследований, анализирующих влияние РДН на показатели углеводного обмена, крайне мало [11][27][28]. Существенными недостатками этих исследований является малая выборка пациентов, включение пациентов с различными видами нарушения углеводного обмена, отсутствие рандомизации и группы фиктивного вмешательства, кроме того, большинство этих исследований проведено с использованием катетеров старого поколения, не обеспечивающих полноценной денервации.
В пилотном исследовании под руководством Mahfoud F, et al. (2011) изучалось влияние РДН на метаболизм глюкозы и резистентность к инсулину у пациентов с резистентной гипертензией [11]. В исследование были включены 50 пациентов с резистентной АГ (37 пациентам была выполнена РДН монополюсным электродом, 13 пациентов вошли в группу контроля), только у 40% больных был диагностирован СД. Помимо выраженного снижения АД (-32/-12 мм рт.ст.; p<0,001) через 3 мес., в группе вмешательства наблюдалось значительное снижение уровней глюкозы натощак (с 118±3,4 до 108±3,8 мг/дл; p=0,039), инсулина (с 20,8±3,0 до 9,3±2,5 мкМЕ/мл; р=0,006), С-пептида (с 5,3±0,6 до 3,0±0,9 нг/мл; р=0,002) и степени ИР HOMA-IR (с 6,0±0,9 до 2,4±0,8; р=0,001).
Однако результаты исследования DREAMS (Denervation of the Renal Arteries in Metabolic Syndrome), в котором изучали влияние РДН на чувствительность к инсулину и уровень АД у пациентов с метаболическим синдромом, полностью опровергли гипотезу о благоприятном влиянии денервации на углеводный обмен [27]. В это исследование были включены 29 пациентов с метаболическим синдромом, из них только 5 (17%) больных имели СД 2 типа. Для оценки симпатической активности проводились измерения активности симпатического мышечного нерва и вариабельности сердечного ритма. Уровень глюкозы натощак изменился с 7,2±1,7 до 7,4±2,6 ммоль/л через 6 мес. наблюдения (p=0,34) и до 7,0±1,3 ммоль/л через 12 мес. наблюдения (p=0,34).
Согласно результатам отечественного исследования, выполненного под руководством Фальковской А. Ю. и др. (2015), через 6 мес. после РДН монополюсным электродом отмечался значимый гипогликемический эффект: уменьшение среднего уровня HbA1c (от 6,9±1,8 до 5,8±1,5%, p=0,04) и тенденция к снижению базальной гликемии (от 8,7±2,8 до 7,7±2,1 ммоль/л, p=0,07) [28].
Единственный доступный в литературе метаанализ, оценивающий значимость влияния катетерной РДН на метаболизм углеводов и липидов, не выявил достоверного эффекта РДН на уровни базовой гликемии, С-пептида, HbA1c, инсулина натощак и степень ИР [29]. Стоит отметить, что большинство включенных в анализ исследований представляли собой наблюдательные когортные исследования без группы контроля, в большинстве из них применялись системы денервации старого поколения, что дает основание считать их результаты менее убедительными.
Преимуществом настоящего исследования является наличие рандомизации, четких критериев включения (пациенты с СД 2 типа) и использование современного многополюсного катетера для РДН (Spyral), доказавшего стойкий антигипертензивный эффект в крупных рандомизированных клинических исследованиях SPYRAL HTN-OFF MED и SPYRAL HTN-ON MED [18][19].
Полученные в ходе настоящего исследования показатели снижения АД соответствуют результатам крупных РКИ. Катетерная РДН привела к значительному снижению офисного САД и диастолического АД (ДАД) на 11/4 мм рт.ст. (p<0,001) через 6 мес. по сравнению с контрольной группой, в то время как в исследовании SPYRAL HTN-ON MED это снижение составило 9,4/5,2 мм рт.ст. (p<0,05).
Ранее упомянутый метаанализ [29] продемонстрировал влияние РДН на показатели липидного обмена (общий ХС и его фракции). Было выявлено статистически значимое, но клинически незначительное снижение уровней ТГ и повышение ХС ЛВП после РДН. Следует понимать, что положительные эффекты наблюдались в исследованиях, не имеющих групп контроля, и соответственно они могут быть нивелированы введением контрольных групп. Большое значение имеет длительность периода наблюдения, как известно, антигипертензивный эффект РДН увеличивается со временем, возможно схожего эффекта стоит ожидать и в отношении липидов.
Предполагается, что основной механизмы воздействия РДН на метаболизм липидов также связан со снижением симпатического тонуса и его эффекта на соответствующие органы и ткани. Жировая ткань посредством изменения уровня циркулирующих липидов сложным образом регулирует системный метаболизм глюкозы [30]. Метаболические нарушения и ожирение сопровождаются изменением микроокружения жировой ткани, дисбалансом липолиза и этерификации, гиперактивацией местных иммунных и воспалительных клеток, сигналы от которых воспринимаются локальными сенсорными афферентными нервными волокнами и передаются в ЦНС, вызывая симпатическую активацию [30]. Симпатическая гиперактивация еще больше усугубляет мобилизацию липидов в жировой ткани, высвобождая в кровоток избыток свободных жирных кислот (СЖК) [30]. Повышенные уровни СЖК способствуют глюконеогенезу в печени и нарушению утилизации глюкозы в скелетных мышцах и других тканях. Аномальное высвобождение СЖК оказывает и липотоксическое действие на периферические органы, что приводит к патологической кумуляции липидов и их нестабильной концентрации в крови. В совокупности сложные перекрестные взаимодействия между микроокружением жировой ткани и центральной нервной системой регулируют системный метаболизм; соответственно, РДН за счет снижения активности СНС может оказывать плейотропное действие и помимо снижения АД влиять на метаболизм и глюкозы, и липидов.
Отдельно стоит остановиться на ограничениях настоящего исследования. По причине крайне малого количества исследований по данной теме уровень клинически значимого ожидаемого эффекта был неизвестен. Поэтому дизайн исследования строился для подтверждения гипотезы вероятного гипогликемического эффекта РДН. Для данного типа исследования была использована выборка небольшого размера, отсутствовало ослепление, что, безусловно, не позволяет судить о клинической эффективности нового лечебного подхода. Однако полученная информация необходима при планировании последующих крупномасштабных рандомизированных клинических исследований.
Одним из существенных недостатков РДН является отсутствие четких интраоперационных критериев эффективности и метода контроля непосредственного послеоперационного успеха процедуры. В экспериментальных и некоторых клинических исследованиях для оценки симпатолитического эффекта РДН проводился анализ динамики уровня активности СНС до и после вмешательства с помощью измерения почечного спилловера адреналина, оценки активности эфферентных симпатических волокон методом микронейрографии, проведения функциональных проб и оценки вариабельности сердечного ритма. В настоящем исследовании эти измерения не проводились, однако снижение уровня АД достоверно коррелировало со снижением уровня глюкозы. В то же время нельзя исключить наличия другого, отличного от симпатолитического, механизма действия РДН — действительно, в ряде исследований корреляции изменений активности СНС и клинических параметров после РДН обнаружено не было [15][27].
Следующее ограничение исследования связано с потенциальным влиянием антигипертензивных препаратов на показатели углеводного обмена. Как известно, изменение дозы антигипертензивных препаратов может влиять на чувствительность к инсулину (например, β-адреноблокаторов, диуретиков, иАПФ) [31]. В некоторых случаях в ходе настоящего исследования была проведена коррекция лекарственной терапии, при этом лабораторный контроль приверженности пациентов к лечению отсутствовал, что могло повлиять на результаты.
Не менее важным в исследовании является правильный выбор метода оценки результатов, в данном исследовании уровень ИР определяли с использованием индекса HOMA-IR. Наиболее точным методом, признанным "золотым стандартом" оценки ИР, является эугликемический гиперинсулинемический клэмп. Результаты, получаемые при выполнении этого теста, достоверны и воспроизводимым как при СД, так и у здоровых людей. К сожалению, этот метод отличается достаточной трудоемкостью в исполнении и высокой стоимостью реализации. В качестве альтернативных методов определения ИР в исследованиях используются непрямые способы с расчетом т.н. математических индексов, основанных на определении уровня глюкозы и инсулина плазмы натощак или в ходе перорального глюкозотолерантного теста. В ранее описанных исследованиях, посвященных изучению влияния РДН на метаболизм глюкозы, как и в настоящем исследовании, был применен индекс HOMA-IR. Ограничения использования данного метода связаны с достаточно большим индивидуальным разбросом данных. На основании его результатов не рекомендуется принимать решение о назначении сахароснижающей терапии, но для динамического наблюдения он крайне удобен и релевантен. В исследовании Grassi G, et al., уровень ИР, определенный с помощью индекса HOMA-IR, коррелировал с результатами эугликемического гиперинсулинемического клэмпа и был связан с повышенной активностью СНС, подтвержденной данными микронейрографии [32].
Заключение
Результаты настоящего исследования показали, что селективная многофокусная радиочастотная аблация почечных симпатических нервов с использованием многополюсного электрода, помимо антигипертензивного эффекта, положительно влияет на метаболизм глюкозы (уменьшается уровень глюкозы натощак, гликированного гемоглобина и степень ИР) у пациентов с неконтролируемой АГ и СД 2 типа. Впервые в рандомизированном исследовании продемонстрировано изменение параметров липидного обмена (повышение уровня ХС ЛВП и снижение уровня ТГ), наблюдаемое после вмешательства. Характер данного исследования не позволяет объяснить причины плейотропных эффектов РДН исключительно ее симпатолитическим действием; существуют предположения, что само снижение АД или любое изменение антигипертензивной терапии, не отраженное в протоколе исследования, может влиять на метаболизм глюкозы и чувствительность к инсулину.
Вместе с тем, полученные данные значительно дополняют концепцию о том, что активация СНС лежит в основе возникновения связанных между собой АГ и СД, и вселяют надежду на то, с помощью РДН возможно, одновременно воздействуя на оба фактора, значительно снизить сердечно-сосудистый риск.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Castro TY, Katholi RE. Novel treatment approaches in hypertensive type 2 diabetic patients. World J Diabetes. 2014;5:53645. doi:10.4239/wjd.v5.i4.536.
2. Buse JB, Ginsberg HN, Bakris GL, et al. Primary prevention of cardiovascular diseases in people with diabetes mellitus: a scientific statement from the American Heart Association and the American Diabetes Association. Circulation. 2007;115:114-26. doi:10.1161/CIRCULATIONAHA.106.179294.
3. Whiting DR, Guariguata L, Weil C, et al. IDF diabetes atlas: global estimates of the prevalence of diabetes for 2011 and 2030. Diabetes Res Clin Pract. 2011;94:311-21. doi:10.1016/j.diabres.2011.10.029.
4. Schlaich MP, Sobotka PA, Krum H, et al. Renal denervation as a therapeutic approach for hypertension: novel implications for an old concept. Hypertension. 2009;54:1195-201. doi:10.1161/HYPERTENSIONAHA.109.138610.
5. DiBona GF, Kopp UC. Neural control of renal function. Physiol Rev. 1997;77:75-197. doi:10.1152/physrev.1997.77.1.75.
6. Roper NA, Bilous RW, Kelly WF, et al. Excess mortality in a population with diabetes and the impact of material deprivation: longitudinal, population based study. BMJ. 2001;322:1389-93. doi:10.1136/bmj.322.7299.1389.
7. Krum H, Schlaich M, Whitbourn R, et al. Catheter-based renal sympathetic denervation for resistant hypertension: a multicentre safety and proof-of-principle cohort study. Lancet. 2009;373(9671):1275-81. doi:10.1016/S0140-6736(09)60566-3.
8. Symplicity HTN-2 Investigators, Esler MD, Krum H, et al. Renal sympathetic denervation in patients with treatment-resistant hypertension (The Symplicity HTN-2 Trial): a randomized controlled trial. Lancet. 2010;376(9756):1903-9. doi:10.1016/S0140-6736(10)62039-9.
9. Esler MD, Krum H, Schlaich M, et al. Renal sympathetic denervation for treatment of drug-resistant hypertension: one-year results from the Symplicity HTN-2 randomized, controlled trial. Circulation. 2012;126(25):2976-82. doi:10.1161/CIRCULATIONAHA.112.130880.
10. Bhatt DL, Kandzari DE, O’Neill WW, et al. A controlled trial of renal denervation for resistant hypertension. N Engl J Med. 2014;370(15):1393-401. doi:10.1056/NEJMoa1402670.
11. Mahfoud F, Schlaich M, Kindermann I, et al. Effect of renal sympathetic denervation on glucose metabolism in patients with resistant hypertension: a pilot study. Circulation. 2011;123:19406. doi:10.1161/CIRCULATIONAHA.110.991869.
12. Witkowski A, Prejbisz A, Florczak E, et al. Effects of renal sympathetic denervation on blood pressure, sleep apnea course, and glycemic control in patients with resistant hypertension and sleep apnea. Hypertension. 2011;58:559-65. doi:10.1161/HYPERTENSIONAHA.111.173799.
13. Schlaich MP, Straznicky N, Grima M, et al. Renal denervation: a potential new treatment modality for polycystic ovary syndrome? J Hypertens. 2011;29:991-6. doi:10.1097/HJH.0b013e328344db3a.
14. Grassi G. Renal denervation in cardiometabolic disease: concepts, achievements and perspectives. Nutr Metab Cardiovasc Dis. 2013;23:77-83. doi:10.1016/j.numecd.2012.09.004.
15. Krum H, Sobotka P, Mahfoud F, et al. Device-based antihypertensive therapy: therapeutic modulation of the autonomic nervous system. Circulation. 2011;123:209-15. doi:10.1161/CIRCULATIONAHA.110.971580.
16. Chen W, Chang Y, He L, et al. Effect of renal sympathetic denervation on hepatic glucose metabolism and blood pressure in a rat model of insulin resistance. J Hypertens. 2016;34:2465-74. doi:10.1097/HJH.0000000000001087.
17. Iyer MS, Bergman RN, Korman JE, et al. Renal denervation reverseshepatic insulin resistance induced by high-fat diet. Diabetes. 2016;65:3453-63. doi:10.2337/db16-0698.
18. Townsend RR, Mahfoud F, Kandzari DE, et al. Catheter-based renal denervation in patients with uncontrolled hypertension in the absence of antihypertensive medications (SPYRAL HTNOFF MED): a randomized, sham-controlled, proof-of-concept trial. Lancet. 2017;390(10108):2160-70. doi:10.1016/S01406736(17)32281-X.
19. Kandzari DE, Böhm M, Mahfoud F, et al. Effect of renal denervation on blood pressure in the presence of antihypertensive drugs: 6-month efficacy and safety results from the SPYRAL HTN-ON MED proof-of-concept randomized trial. Lancet. 2018;391(10137):2346-55. doi:10.1016/S0140-6736(18)30951-6.
20. Huggett RJ, Scott EM, Gilbey SG, et al. Impact of Type 2 Diabetes Mellitus on Sympathetic Neural Mechanisms in Hypertension. Circulation. 2003;108(25):3097-101. doi:10.1161/01.CIR.0000103123.66264.FE.
21. Yakubu-Madus FE, Johnson WT, Zimmerman KM, et al. Metabolic and hemodynamic effects of moxonidine in the Zucker diabetic fatty rat model of type 2 diabetes. Diabetes. 1999;48:1093-100. doi:10.2337/diabetes.48.5.1093.
22. Esler M, Straznicky N, Eikelis N, et al. Mechanisms of sympathetic activation in obesity-related hypertension. Hypertension. 2006;48:787-96. doi:10.1161/01.HYP.0000242642.42177.49.
23. Prichard BN, Jager BA, Luszick JH, et al. Placebo-controlled comparison of the efficacy and tolerability of oncedaily moxonidine and enalapril in mild to moderate essential hypertension. Blood Press. 2002;11:166-72. doi:10.1080/080370502760050403.
24. Emerging Risk Factors Collaboration, Sarwar N, Gao P, Seshasai SR, et al. Diabetes mellitus, fasting blood glucose concentration, and risk of vascular disease: a collaborative metaanalysis of 102 prospective studies. Lancet. 2010;375:221522. doi:10.1016/S0140-6736(10)60484-9.
25. Hall JL, Matter CM, Wang X, Gibbons GH. Hyperglycemia inhibits vascular smooth muscle cell apoptosis through a protein kinase C-dependent pathway. Circ Res. 2000;87:574-80. doi:10.1161/01.res.87.7.574.
26. Gerstein HC. More insights on the dysglycaemia-cardiovascular connection. Lancet. 2010;375:2195-6. doi:10.1016/S0140-6736(10)60973-7.
27. Verloop WL, Spiering W, Vink EE, et al. Denervation of the renal arteries in metabolic syndrome: the DREAMS study. Hypertension. 2015;65:751-7. doi:10.1161/HYPERTENSIONAHA.114.04798.
28. Фальковская А. Ю., Мордовин В. Ф., Пекарский С. Е., и др. Рефрактерная и резистентная артериальная гипертония у больных сахарным диабетом 2-го типа: различия ответа на денервацию почек. Кардиология. 2021;61(2):54-61. doi:10.18087/cardio.2021.2.n1102.
29. Zhang Z, Liu K, Xiao S, et al. Effects of catheter-based renal denervation on glycemic control and lipid levels: a systematic review and meta-analysis. Acta Diabetol. 2021;58(5):603-14. doi:10.1007/s00592-020-01659-6.
30. Guilherme A, Henriques F, Bedard AH, et al. Molecular pathways linking adipose innervation to insulin action in obesity and diabetes mellitus. Nat Rev Endocrinol. 2019;15(4):207-25. doi:10.1038/s41574-019-0165-y.
31. Cooper-DeHoff RM, Pacanowski MA, Pepine CJ. Cardiovascular therapies and associated glucose homeostasis: implications across the dysglycemia continuum. J Am Coll Cardiol. 2009;53:S28-34. doi:10.1016/j.jacc.2008.10.037.
32. Grassi G, Dell’Oro R, Facchini A, et al. Effect of central and peripheral body fat distribution on sympathetic and baroreflex function in obese normotensives. J Hypertens. 2004;22:2363-9. doi:10.1097/00004872-200412000-00019.
Об авторах
Д. А. ФещенкоРоссия
Дарья Анатольевна Фещенко — младший научный сотрудник отдела инновационных эндоваскулярных методов профилактики и лечения сердечно-сосудистых заболеваний, врач рентгенэндоваскулярных методов диагностики и лечения, зав. операционным блоком.
Москва
Б. А. Руденко
Россия
Борис Александрович Руденко — доктор медицинских наук, врач рентгенэндоваскулярных методов диагностики и лечения, руководитель отдела инновационных эндоваскулярных методов профилактики и лечения сердечно-сосудистых заболеваний.
Москва
Ф. Б. Шукуров
Россия
Борис Александрович Руденко — доктор медицинских наук, врач рентгенэндоваскулярных методов диагностики и лечения, руководитель отдела инновационных эндоваскулярных методов профилактики и лечения сердечно-сосудистых заболеваний.
Москва
Д. К. Васильев
Россия
Дмитрий Константинович Васильев — кандтдат медицинских наук, научный сотрудник отдела инновационных эндоваскулярных методов профилактики и лечения сердечно-сосудистых заболеваний, врач рентгенэндоваскулярных методов диагностики и лечения.
Москва
М. Н. Мамедов
Россия
Мехман Ниязиевич Мамедов — доктор медицинских наук, профессор, руководитель отдела вторичной профилактики хронических неинфекционных заболеваний.
Москва
О. М. Драпкина
Россия
Оксана Михайловна Драпкина — доктор медицинских наук, профессор, академик РАН, директор.
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Фещенко Д.А., Руденко Б.А., Шукуров Ф.Б., Васильев Д.К., Мамедов М.Н., Драпкина О.М. Влияние катетерной ренальной денервации на динамику состояния углеводного обмена у пациентов с сахарным диабетом и артериальной гипертензией. Кардиоваскулярная терапия и профилактика. 2022;21(12):3459. https://doi.org/10.15829/1728-8800-2022-3459
For citation:
Feshchenko D.A., Rudenko B.A., Shukurov F.B., Vasiliev D.K., Mamedov M.N., Drapkina O.M. Influence of catheter-based renal denervation on carbohydrate metabolism in patients with diabetes and hypertension. Cardiovascular Therapy and Prevention. 2022;21(12):3459. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3459
JATS XML

























































