Перейти к:
Вариант нуклеотидной последовательности гена RBM20 в семье с дилатационным фенотипом некомпактного миокарда левого желудочка
https://doi.org/10.15829/1728-8800-2022-3470
Аннотация
Цель. Продемонстрировать два поколения семьи с прогрессирующим течением некомпактного миокарда левого желудочка (НМЛЖ) и наличием варианта в гене RBM20.
Материал и методы. На основании многоцентрового регистра пациентов с НМЛЖ в ФГБУ "НМИЦ ТПМ" Минздрава России была выбрана семья с НМЛЖ с дилатационным фенотипом. Секвенирование нового поколения было выполнено на приборе Nextseq 550 (Illumina, США). Для клинической интерпретации были отобраны варианты нуклеотидной последовательности (ВНП) в генах, ассоциированных с развитием НМЛЖ по имеющимся литературным данным, с частотами <0,5% в базе данных gnomAD. Верификацию выявленных ВНП выполняли с помощью секвенирования по Сенгеру на приборе Applied Biosystem 3500 Genetic Analyzer (Thermo Fisher Scientific, США).
Результаты. В статье представлены результаты клинического, инструментального и молекулярно-генетического исследований двух поколений семьи с диагностированным НМЛЖ с дилатационным фенотипом и прогрессированием изолированного НМЛЖ в дилатационный тип. В результате молекулярно-генетического исследования у всех членов семьи с фенотипом НМЛЖ был выявлен вероятно-патогенный ВНП в гене RBM20 NP_001127835.2:p.Pro638Leu (rs267607003). RBM20 является ключевым регулятором сплайсинга, который контролирует процессинг нескольких важных транскриптов, преимущественно экспрессируемых в поперечнополосатых мышцах, особенно в сердечной ткани. ВНП в гене RBM20 могут приводить к нарушению сплайсинга в нескольких точках и, как следствие, к прогрессированию кардиомиопатии. Большинство известных патогенных ВНП RBM20 связано с развитием дилатационной кардиомиопатии, однако в ряде работ были обнаружены ВНП в гене RBM20 у пациентов с НМЛЖ. Сегрегация ВНП с симптомами в двух поколениях семьи свидетельствует в пользу связи выявленного ВНП с развитием НМЛЖ.
Заключение. В настоящее время границы генетики кардиомиопатий расширяются. Патогенные и вероятно-патогенные варианты в гене RBM20 ассоциированы в первую очередь с дилатационным фенотипом и высоким риском внезапной сердечной смерти. В статье представлены результаты обследования двух поколений семьи с НМЛЖ и прогрессирующим ремоделированием миокарда.
Ключевые слова
Для цитирования:
Куликова О.В., Мясников Р.П., Мешков А.Н., Мершина Е.А., Киселева А.В., Сотникова Е.А., Кудрявцева М.М., Харлап М.С., Дивашук М.Г., Жарикова А.А., Ангарский Р.К., Корецкий С.Н., Филатова Д.А., Синицын В.Е., Драпкина О.М. Вариант нуклеотидной последовательности гена RBM20 в семье с дилатационным фенотипом некомпактного миокарда левого желудочка. Кардиоваскулярная терапия и профилактика. 2022;21(12):3470. https://doi.org/10.15829/1728-8800-2022-3470
For citation:
Kulikova O.V., Myasnikov R.P., Meshkov A.N., Mershina E.A., Kiseleva A.V., Sotnikova E.A., Kudryavtseva M.M., Kharlap M.S., Divashuk M.G., Zharikova A.A., Angarsky R.K., Koretsky S.N., Filatova D.А., Sinitsyn V.E., Drapkina O.M. RBM20 nucleotide sequence variant in a family with a dilated phenotype of left ventricular non-compaction. Cardiovascular Therapy and Prevention. 2022;21(12):3470. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3470
Введение
Некомпактный миокард левого желудочка (НМЛЖ) — сложное, клинически и генетически неоднородное заболевание, характеризующееся наличием двухслойной структуры миокарда, основной слой которой представлен компактным миокардом, а другой слой представляет собой губчатую структуру с множественными трабекулами. В связи с развитием методов диагностики и повышением осведомленности о заболевании НМЛЖ стал чаще диагностироваться и у детей, и у взрослых [1]. Тем не менее, разногласия относительно постановки диагноза НМЛЖ сохраняются, поскольку постоянно появляются новые критерии диагностики, учитывающие различные сопутствующие факторы [2]. Из-за многообразия клинических фенотипов заболевания, склонности к развитию жизнеугрожающих аритмий, внезапной сердечной смерти (ВСС), сердечной недостаточности (СН) и недооценки заболевания многими клиницистами, НМЛЖ является заболеванием, которое требует лучшей клинической идентификации, а также понимания патогенеза для своевременного начала терапии. Генетическая природа заболевания выявляется только в половине случаев, однако по мере накопления данных секвенирования эта цифра будет расти [3]. В настоящее время известно >80 генов, ассоциированных с развитием НМЛЖ [4]. В большинстве случаев выявляются варианты в генах саркомерных белков, таких как MYH7, MYBPC3, TTN, а также в генах регуляторных белков, одним из которых является ген RBM20. ВНП в гене RBM20 были обнаружены у ряда пациентов с НМЛЖ [5-8]. Тем не менее, большинство известных патогенных ВНП RBM20 связано с дилатационной кардиомиопатией (ДКМП) [9-10]. В 2019г была опубликована работа Parikh V, et al., в которой идентифицированы 2 области, обогащенные вариантами, ассоциированными с кардиомиопатиями, в экзонах 9 и 11 гена RBM20 [11]. Был создан регистр пациентов RBM20, в котором была продемонстрирована высокая распространенность ВСС и кардиомиопатий с ранним началом, что нашло отражение в европейских рекомендациях 2022г по желудочковым аритмиям и ВСС [12]. Наличие патогенных вариантов в генах RBM20, LMNA, PLN, FLNC стало дополнительным фактором в пользу имплантации кардиовертера-дефибриллятора у пациентов с гипокинетическими кардиомиопатиями [12].
Цель исследования — представить два поколения семьи с прогрессивным течением НМЛЖ с дилатационным фенотипом с наличием вероятно-патогенного варианта в гене RBM20, который кодирует белок с РНК-связывающим мотивом (RNA-binding motif protein 20), отвечающий за сплайсинг как в саркомерных, так и в других генах, важных для нормального функционирования миокарда [9].
Материал и методы
На основании многоцентрового регистра пациентов с НМЛЖ в ФГБУ "НМИЦ ТПМ" Минздрава России [13], была выбрана семья с НМЛЖ с дилатационным фенотипом. Все участники подписали информированное согласие на участие в исследовании и обработку персональных данных. Дизайн исследования был одобрен этическим комитетом ФГБУ "НМИЦ ТПМ" Минздрава России. Всем участникам было проведено клинико-инструментальное обследование по протоколу, описанному ранее [14]. Диагноз НМЛЖ был установлен на основании эхокардиографических (ЭхоКГ) и магнитно-резонансной томографии (МРТ) критериев некомпактного миокарда [1, 15].
Экзомное секвенирование и биоинформатический анализ
Дезоксирибонуклеиновая кислота (ДНК) была выделена из образцов цельной крови с помощью набора QIAamp DNA Blood Mini Kit (Qiagen, Германия). Экзомные библиотеки были приготовлены с использованием набора IDT-Illumina TruSeq DNA Exome (Illumina, США) в соответствии с инструкциями производителя. Секвенирование нового поколения было выполнено на приборе Nextseq 550 (Illumina, США) (75 п.н., парные чтения). Чтения были выровнены на референсный геном (GRCh38). Аннотация проводилась с использованием баз данных ClinVar (2021/01/10) [16], gnomAD (v2.1.1) [17], и dbSNP [18]. Для клинической интерпретации были отобраны варианты нуклеотидной последовательности (ВНП) в генах, ассоциированных с развитием НМЛЖ по имеющимся литературным данным с частотами <0,5% в базе данных gnomAD (v2.1.1) [17]. Патогенность ВНП оценивали в соответствии с критериями, изложенными в Руководстве по интерпретации данных секвенирования нового поколения [19]. Верификацию выявленных ВНП выполняли с помощью секвенирования по Сенгеру на приборе Applied Biosystem 3500 Genetic Analyzer (Thermo Fisher Scientific, США) с использованием набора ABI PRISM BigDye Terminator v3.1 (Thermo Fisher Scientific, США) согласно протоколу производителя.
Результаты
Пробанд (II-2) — женщина 57 лет, наблюдающаяся у кардиолога в ФГБУ "НМИЦ ТПМ" Минздрава России (рисунок 1). Телосложение — нормостеническое. В 44 года стала отмечать появление одышки при физической нагрузке (ФН), появление отеков нижних конечностей, к врачам не обращалась. В 45 лет отметила прогрессивное ухудшение состояния в виде усугубления одышки, появления ортопноэ. При обследовании была выявлена тяжелая митральная недостаточность, выполнено протезирование митрального клапана. После оперативного вмешательства улучшения состояния не отмечала, нарастала одышка, появились отеки нижних конечностей. С явлениями СН была госпитализирована в ФГБУ "НМИЦ ТПМ" Минздрава России. В анализах крови исследуемые показатели были в пределах нормальных значений. При суточном мониторировании электрокардиограммы по Холтеру была выявлена редкая желудочковая экстрасистолия, пробежки неустойчивой желудочковой тахикардии. При ЭхоКГ выявлено: конечный диастолический размер (КДР) — 5,7 см, толщина межжелудочковой перегородки (ТМЖП) — 0,6 см, фракция выброса (ФВ) левого желудочка (ЛЖ) — 22%, признаки НМЛЖ в области верхушки и боковой стенки (критерии Chin, Stollberger, Jenni [1]), систолическое давление в легочной артерии — 48 мм рт.ст., увеличение обоих предсердий, протезированный митральный клапан, митральная регургитация 2 ст., тромбоз полости ЛЖ. При проведении МРТ сердца с контрастированием (рисунки 2, 3) поствоспалительных очагов в миокарде не выявлено. КДР — 6,1 см, ФВ — 20%, картина синдрома некомпактного миокарда в области верхушки и боковой стенки (критерий Petersen, Jacquier, 2 критерия Grothoff [15][20]), соотношение массы некомпактного миокарда к общей массе миокарда (НКМ/ОММ) равно 16,0%, что не удовлетворяет критерию Jacquier [21]. Были назначены β-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента, антагонисты минералкортикоидных рецепторов (аМКР), диуретики, антикоагулянты, амиодарон. Однако состояние пациентки прогрессивно ухудшалось, и в возрасте 47 лет пациентке была выполнена ортотопическая трансплантация сердца. После трансплантации на фоне иммуносупрессивной терапии состояние пациентки стабильное. По данным ЭхоКГ: КДР — 4,1 см, ТМЖП — 0,9 см, ФВ — 66%.
Фенотипический каскадный скрининг
Родословная и клинические данные о родственниках пробанда представлены на рисунке 1.
Сыну пробанда (III-1) в возрасте 21 года было проведено комплексное кардиологическое обследование. В стандартных анализах все показатели в пределах нормальных значений. По данным ЭхоКГ: КДР — 5,3 см, ТМЖП — 0,7 см, ФВ — 53%, признаки некомпактного миокарда в области верхушки, боковой стенки (критерий Stollberger). По данным МРТ сердца (изображения не сохранялись) камеры сердца не расширены, сократимость миокарда ЛЖ — 50%, участков фиброза, рубцового и поствоспалительного поражения миокарда не выявлено, отмечается некомпактный миокард апикальных и латеральных сегментов, соотношение НКМ/ОММ равно 23,0% (критерий Petersen, Jacquier, 4 критерия Grothoff) [15][20][21]. Пациент проходил динамическое обследование на протяжении 7 лет, состояние оставалось стабильным, отмечалось незначительное снижение ФВ ЛЖ до 47%. Была назначена терапия ингибиторами ангиотензинпревращающего фермента и аМКР, которую пациент принимал нерегулярно. В возрасте 31 года стал отмечать снижение толерантности к ФН, появление одышки при ФН. По данным ЭхоКГ: КДР — 5,8 см, систолическое давление в легочной артерии — 34 мм рт.ст., ФВ ЛЖ — 36%. По данным суточного мониторирования электрокардиограммы по Холтеру: одиночная желудочковая экстрасистолия. Выполнено МРТ сердца с контрастированием (рисунки 3, 4). Выявлено увеличение степени некомпактности миокарда (соотношение НКМ/ОММ — 26%, ФВ ЛЖ — 38%). Участков интрамиокардиального фиброза, рубцового и воспалительного поражения миокарда не выявлено. Была скорректирована терапия: продолжена терапия аМКР, назначены β-адреноблокаторы и ангиотензиновых рецепторов и неприлизина ингибитор (АРНИ).
Сыну пробанда (III-2) был проведен кардиологический скрининг, по результатам которого данных за наличие НМЛЖ не получено.
С учетом выявленных изменений у III-1, кардиологический скрининг был проведен мужу пробанда (II-1). По данным ЭхоКГ признаков НМЛЖ не выявлено.
Генетический анализ
Пробанду и всем родственникам первой степени родства был проведен молекулярно-генетический анализ. В результате выявлена ранее описанная однонуклеотидная замена в 9 экзоне гена RBM20 (GRCh38.p12: chr10:110812310, NM_001134363.3:c.1913C>T, NP_001127835.2:p.Pro638Leu, rs267607003). Вариант подтвержден у пробанда и ее сына. На основании актуальных критериев патогенности ВНП может быть классифицирован как вероятно-патогенный вариант (PS3, PM2, PP3, PP5).
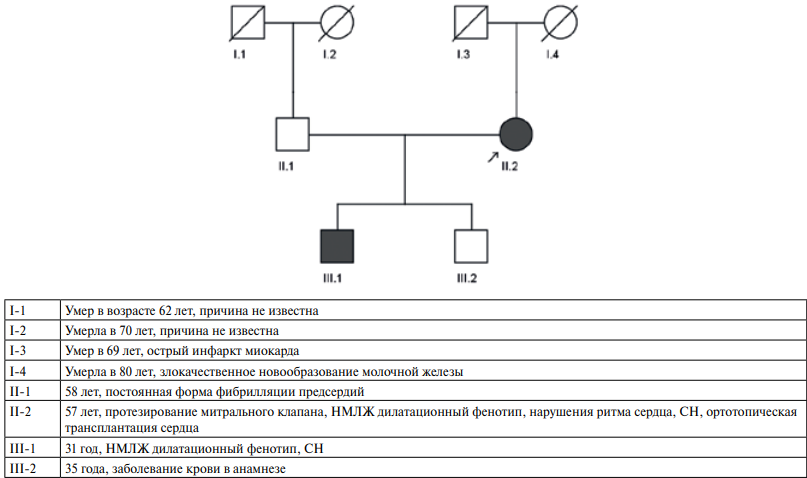
Рис. 1 Родословная.
Примечание: НМЛЖ — некомпактный миокард ЛЖ, СН — сердечная недостаточность.
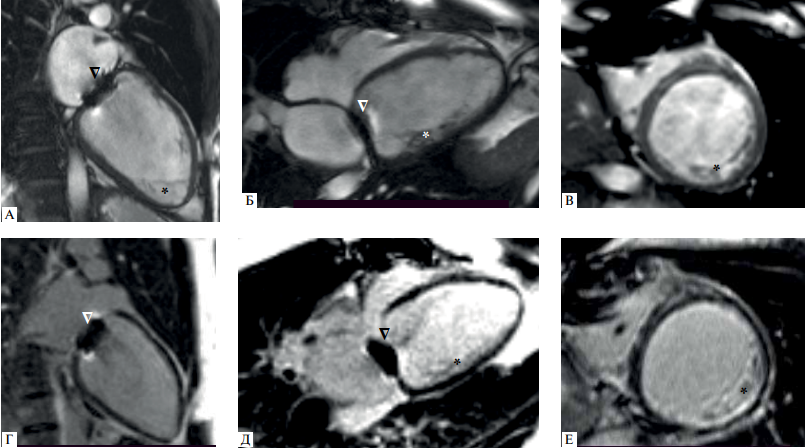
Рис. 2 МРТ сердца (II-2). (А-В) — кино-режим, SSFP-последовательность: А — длинная ось 2-камерная проекция, Б — длинная ось 4-камерная проекция, В — короткая ось на уровне средних сегментов; (Г-Е) — отсроченное контрастирование, IR-последовательность с подавлением сигнала от миокарда.
Примечание: полость ЛЖ расширена, индексированный КДО ЛЖ — 152 мл/м2 (при норме до 92 мл/м2); ФВ ЛЖ 20%. ∆ — артефакт от протеза митрального клапана, * — НМЛЖ. Индексированная масса миокарда ЛЖ не увеличена, составляет 86 г/м2 (при норме до 95 г/м2). Индексированная масса НМЛЖ — 14 г/м2. НКМ/ОММ ЛЖ — 16% (не повышено). Участки отсроченного контрастирования миокарда отсутствуют. Имеется контрастирование в основании трабекул некомпактного миокарда в среднем заднебоковом сегменте.
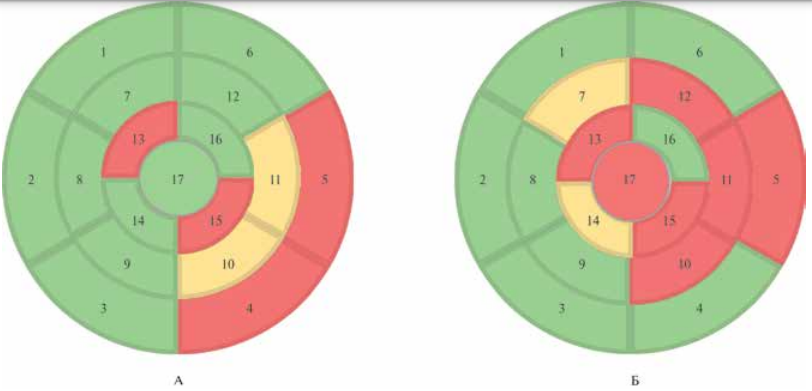
Рис. 3 Участки некомпактного миокарда по сегментам на основании МРТ сердца.
Примечание: А — II-1; Б — III-1. Зеленый цвет — соотношение некомпактного миокарда к компактному <2; желтый цвет — соотношение некомпактного миокарда к компактному >2-2,3; красный цвет — соотношение некомпактного к компактному миокарду ≥2,3. Цветное изображение доступно в электронной версии журнала.
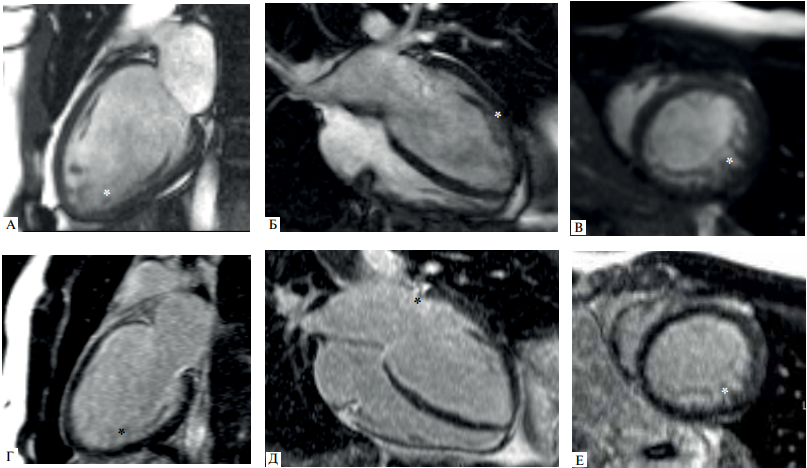
Рис. 4 МРТ сердца (III-1). (А-В) — кино-режим, SSFP -последовательность: А — длинная ось 2-камерная проекция, Б — длинная ось 4-камерная проекция, В — короткая ось на уровне верхушечных сегментов; (Г-Е) — отсроченное контрастирование, IR-последовательность с подавлением сигнала от миокарда.
Примечание: полость ЛЖ умеренно расширена, индексированный конечно-диастолический объем ЛЖ — 92 мл/м2 (при норме до 92 мл/м2); ФВ ЛЖ 38%. * — НМЛЖ. Индексированная масса миокарда ЛЖ не увеличена, составляет 62 г/м2 (при норме до 95 г/м2). Индексированная масса НМЛЖ — 16 г/м2. НКМ/ОММ ЛЖ — 26% (повышено). Участки отсроченного контрастирования миокарда отсутствуют.
Обсуждение
RBM20 регулирует посттранскрипционный сплайсинг в саркомерных и в других генах, важных для поддержания нормальной структуры миокарда [22]. Он экспрессируется во всех поперечнополосатых мышцах, особенно в сердечной ткани [9]. Соответствующий ген, RBM20, расположен на длинном плече хромосомы 10 и содержит 14 экзонов. Он кодирует белок, состоящий из 1227 аминокислотных остатков, содержащий два домена цинкового пальца, область, богатую глутаматом, область, богатую лейцином, РНК-связывающий домен типа мотива распознавания РНК (RRM) и область, богатую аргинином/серином (RS-домен). Наиболее высокая семейная частота ВСС и агрессивное течение ДКМП и НМЛЖ наблюдаются у пациентов с патогенными вариантами в RS-домене [9][11][23]. Функциональный анализ, проведенный с использованием миокардиальной ткани пациентов с ДКМП и культуры клеток, показал, что, в отличие от белка дикого типа, RBM20 с вариантом p.Pro638Leu локализуется не в ядре, а в цитоплазме [24].
Большинство ВНП гена RBM20, обнаруженных у пациентов с ДКМП, являются миссенс-вариантами и локализованы в хот-спот регионе RS-домена (p.634-638) [23]. В работе Sedaghat-Hamedani F, et al. был выявлен новый ВНП p.R634L в хот-спот регионе RS-домена и проведен его функциональный анализ с использованием ткани миокарда ЛЖ двух пациентов с НМЛЖ, который показал, что данный ВНП приводит к неправильному сплайсингу TTN, который кодирует самый большой саркомерный белок титин и является мишенью RBM20 [5].
Важно отметить, что варианты в гене TTN являются частыми причинами НМЛЖ и ДКМП [3][5][25]. Однако данные, полученные недавно Gaertner A, et al. [24], свидетельствуют о том, что кардиомиопатия, вызванная вариантами в гене RBM20, не может быть объяснена исключительно изменениями в сплайсинге TTN, и, вероятно, другие гены-мишени RBM20 могут также вносить вклад в фенотип заболевания.
В исследовании Lennermann D, et al. было показано, что мишенью RBM20 являются >30 генов [26]. Среди них такие важные для функции саркомера гены, как LDВ3 и TNNT2, а также многие гены, имеющие решающее значение для усвоения кальция в кардиомиоцитах. В этой же работе было отмечено, что дефицит RBM20 приводит к перегрузке клеток кальцием, что объясняет наличие различных аритмий и высокий риск ВСС [26].
В настоящей работе представлена семья с различными фенотипами НМЛЖ. Наиболее тяжелое течение заболевания отмечается у пробанда (II-2), у которой диагностирован дилатационный тип НМЛЖ с тяжелым течением СН, с желудочковыми нарушениями ритма сердца, тромбоэмболическими осложнениями, приведший к трансплантации сердца. При этом стоит отметить, что активное прогрессирование ремоделирования миокарда и СН произошло после протезирования митрального клапана механическим протезом. Данная ситуация характерна для пациентов с относительной митральной недостаточностью на фоне дилатации с НМЛЖ [27]. У сына пробанда (III-1) в начале заболевания был выявлен изолированный НМЛЖ с незначительным снижением систолической функции ЛЖ до 47%, нормальными размерами камер сердца, что соответствует современному определению гипокинетической кардиомиопатии. Однако со временем отмечается тенденция к прогрессированию заболевания со снижением ФВ ЛЖ, дилатацией полостей сердца. Выявленный в данной семье ВНП в гене RBM20 находится в RS-домене, что может свидетельствовать о патогенности найденного варианта. Согласно базе OMIM (Online Mendelian Inheritance in Man), данный вариант описан в нескольких случаях ДКМП. Однако в представленной семье, несмотря на присутствие дилатации полостей, нельзя исключить факт наличия НМЛЖ, вероятно усугубляющий клинические проявления заболевания. Учитывая прогрессивное течение заболевания у сына пробанда (III-1), наличие ВНП в гене RBM20 несмотря на отсутствие жизнеугрожающих аритмий в настоящее время, следует проводить более тщательное динамическое наблюдение с целью оценки прогрессирования заболевания и развития фиброза миокарда.
Заключение
В настоящее время границы генетики кардиомиопатий расширяются. Патогенные и вероятно-патогенные варианты в гене RBM20 ассоциированы в первую очередь с дилатационным фенотипом и высоким риском ВСС. В статье представлены результаты обследования двух поколений семьи с НМЛЖ и прогрессирующим ремоделированием миокарда. Данная динамика ремоделирования миокарда указывает на относительную условность разделения по фенотипам у пациентов с НМЛЖ и подчеркивает важность регулярного динамического наблюдения с проведением клинико-инструментального обследования.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Ichida F. Left ventricular noncompaction — Risk stratification and genetic consideration. J Cardiol. 2020;75(1):1-9. doi:10.1016/j.jjcc.2019.09.011.
2. van Waning JI, Caliskan K, Chelu RG, et al. Diagnostic Cardiovascular Magnetic Resonance Imaging Criteria in Noncompaction Cardiomyopathy and the Yield of Genetic Testing. Can J Cardiol. 2021;37(3):433-42. doi:10.1016/j.cjca.2020.05.021.
3. van Waning JI, Caliskan K, Michels M, et al. Cardiac Phenotypes, Genetics, and Risks in Familial Noncompaction Cardiomyopathy. J Am Coll Cardiol. 2019;73(13):1601-11. doi:10.1016/j.jacc.2018.12.085.
4. van Waning JI, Caliskan K, Hoedemaekers YM, et al. Genetics, Clinical Features, and Long-Term Outcome of Noncompaction Cardiomyopathy. J Am Coll Cardiol. 2018;71(7):711-22. doi:10.1016/j.jacc.2017.12.019.
5. Sedaghat-Hamedani F, Haas J, Zhu F, et al. Clinical genetics and outcome of left ventricular non-compaction cardiomyopathy. Eur Heart J. 2017;38(46):3449-60. doi:10.1093/eurheartj/ehx545.
6. Kayvanpour E, Sedaghat-Hamedani F, Gi WT, et al. Clinical and genetic insights into non-compaction: a meta-analysis and systematic review on 7598 individuals. Clin Res Cardiol. 2019;108(11):1297-308. doi:10.1007/s00392-019-01465-3.
7. Piekutowska-Abramczuk D, Paszkowska A, Ciara E, et al. Genetic Profile of Left Ventricular Noncompaction Cardiomyopathy in Children-A Single Reference Center Experience. Genes (Basel). 2022;13(8):1334. doi:10.3390/genes13081334.
8. Вайханская Т. Г., Сивицкая Л. Н., Курушко Т. В. и др. Некомпактная кардиомиопатия. Часть I: клинико-генетическая гетерогенность и предикторы неблагоприятного прогноза. Российский кардиологический журнал. 2020;25(11):3872. doi:10.15829/29/1560-4071-2020-3872.
9. Koelemen J, Gotthardt M, Steinmetz LM, Meder B. RBM20Related Cardiomyopathy: Current Understanding and Future Options. J Clin Med. 2021;10(18):4101. doi:10.3390/jcm10184101.
10. Киселёв А. М., Вершинина Т. Л., Тарновская С. И. и др. Варианты в гене RBM20 у пациентов детского возраста с дилатационной кардиомиопатией. Российский кардиологический журнал. 2019;(10):92-9. doi:10.15829/1560-4071-2019-10-92-99.
11. Parikh VN, Caleshu C, Reuter C, et al. Regional Variation in RBM20 Causes a Highly Penetrant Arrhythmogenic Cardiomyopathy. Circ Heart Fail. 2019;12(3):e005371. doi:10.1161/CIRCHEARTFAILURE.118.005371.
12. Zeppenfeld K, Tfelt-Hansen J, de Riva M, et al. 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Eur Heart J. 2022;43(40):3997-4126. doi:10.1093/eurheartj/ehac262.
13. Куликова О. В., Мясников Р. П., Мершина Е. А. и др. Семейная форма некомпактной кардиомиопатии: типы ремоделирования миокарда, варианты клинического течения. Результаты многоцентрового регистра. Терапевтический архив. 2021;93(4):381-8. doi:10.26442/00403660.2021.04.200677.
14. Мясников Р. П., Щербакова Н. В., Куликова О. В. и др. Мутация гена DES в семье пробанда с миофибриллярной миопатией и развитием некомпактной кардиомиопатии, приведшей к трансплантации сердца. Российский кардиологический журнал. 2017;(10):9-16. doi:10.15829/1560-4071-2017-10-9-16.
15. Petersen SE, Selvanayagam JB, Wiesmann F, et al. Left ventricular non-compaction: insights from cardiovascular magnetic resonance imaging. J Am Coll Cardiol. 2005;46(1):101-5. doi:10.1016/j.jacc.2005.03.045.
16. Landrum MJ, Lee JM, Benson M, et al. ClinVar: public archive of interpretations of clinically relevant variants. Nucleic Acids Res. 2016;44(D1):D862-8. doi:10.1093/nar/gkv1222.
17. Karczewski KJ, Francioli LC, Tiao G, et al. The mutational constraint spectrum quantified from variation in 141,456 humans. Nature. 2020;581(7809):434-43. doi:10.1038/s41586-020-2308-7.
18. Sherry ST, Ward MH, Kholodov M, et al. dbSNP: the NCBI database of genetic variation. Nucleic Acids Res. 2001;29(1):308-11. doi:10.1093/nar/29.1.308.
19. Рыжкова О. П., Кардымон О. Л., Прохорчук Е. Б. и др. Руководство по интерпретации данных последовательности ДНК человека, полученных методами массового параллельного секвенирования (MPS) (редакция 2018, версия 2). Медицинская генетика. 2019;18(2):3-23. doi:10.25557/2073-7998.2019.02.3-23.
20. Grothoff M, Pachowsky M, Hoffmann J, et al. Value of cardiovascular MR in diagnosing left ventricular non-compaction cardiomyopathy and in discriminating between other cardiomyopathies. Eur Radiol. 2012;22(12):2699-709. doi:10.1007/ s00330-012-2554-7.
21. Jacquier A, Thuny F, Jop B, et al. Measurement of trabeculated left ventricular mass using cardiac magnetic resonance imaging in the diagnosis of left ventricular non-compaction. Eur Heart J. 2010;31(9):1098-104. doi:10.1093/eurheartj/ehp595.
22. Maatz H, Jens M, Liss M, et al. RNA-binding protein RBM20 represses splicing to orchestrate cardiac pre-mRNA processing. J Clin Invest. 2014;124(8):3419-30. doi:10.1172/JCI74523.
23. Watanabe T, Kimura A, Kuroyanagi H. Alternative Splicing Regulator RBM20 and Cardiomyopathy. Front Mol Biosci. 2018;5:105. doi:10.3389/fmolb.2018.00105.
24. Gaertner A, Klauke B, Felski E, et al. Cardiomyopathy-associated mutations in the RS domain affect nuclear localization of RBM20. Hum Mutat. 2020;41(11):1931-43. doi:10.1002/humu.24096.
25. Tabish AM, Azzimato V, Alexiadis A, Buyandelger B, et al. Genetic epidemiology of titin-truncating variants in the etiology of dilated cardiomyopathy. Biophys Rev. 2017;9(3):207-23. doi:10.1007/s12551-017-0265-7.
26. Lennermann D, Backs J, van den Hoogenhof MMG. New Insights in RBM20 Cardiomyopathy. Curr Heart Fail Rep. 2020;17(5):234-46. doi:10.1007/s11897-020-00475-x.
27. Куликова О. В., Мясников Р. П., Мешков А. Н. и др. Вариант нуклеотидной последовательности гена FLNC в семье с различными фенотипическими проявлениями некомпактного миокарда левого желудочка. Российский кардиологический журнал. 2021;26(10):4748. doi:10.15829/1560-4071-2021-4748.
Об авторах
О. В. КуликоваРоссия
Ольга Куликова — кандидат медицинских наук, научный сотрудник отдела клинической кардиологии.
Москва
Р. П. Мясников
Россия
Роман Мясников — кандидат медицинских наук, ведущий научный сотрудник отдела клинической кардиологии.
Москва
А. Н. Мешков
Россия
Алексей Мешков — кандидат медицинских наук, руководитель лаборатории молекулярной генетики.
Москва
Е. А. Мершина
Россия
Елена Мершина — кандидат медицинских наук, заведующий отделением рентгенодиагностики.
Москва
А. В. Киселева
Россия
Анна Киселева — кандидат биологических наук, старший научный сотрудник лаборатории молекулярной генетики.
Москва
Е. А. Сотникова
Россия
Евгения Сотникова — старший научный сотрудник лаборатории молекулярной генетики.
Москва
М. М. Кудрявцева
Россия
Мария Кудрявцева — младший научный сотрудник отдела клинической кардиологиию
Москва
М. С. Харлап
Россия
Мария Харлап — кандидат медицинских наук, ведущий научный сотрудник отдела нарушений сердечного ритма и проводимости сердца.
Москва
М. Г. Дивашук
Россия
Михаил Дивашук — кандидат биологических наук, программист лаборатории молекулярной генетики, заведующий лабораторией.
Москва
А. А. Жарикова
Россия
Анастасия Жарикова — кандидат биологических наук, научный сотрудник лаборатории молекулярной генетики, старший преподаватель.
Москва
Р. К. Ангарский
Россия
Руслан Ангарский — младший научный сотрудник лаборатории кардиовизуализации, вегетативной регуляции и сомнологии.
Москва
С. Н. Корецкий
Россия
Сергей Корецкий — кандидат медицинских наук, старший научный сотрудник отдела фундаментальных и прикладных аспектов ожирения.
Москва
Д. А. Филатова
Россия
Дарья Филатова — клинический ординатор кафедры лучевой диагностики и лучевой терапии факультета фундаментальной медицины.
Москва
В. Е. Синицын
Россия
Валентин Синицын — доктор медицинских наук, профессор.
Москва
О. М. Драпкина
Россия
Оксана Драпкина — доктор медицинских наук, профессор, академик РАН, директор.
Москва
Рецензия
Для цитирования:
Куликова О.В., Мясников Р.П., Мешков А.Н., Мершина Е.А., Киселева А.В., Сотникова Е.А., Кудрявцева М.М., Харлап М.С., Дивашук М.Г., Жарикова А.А., Ангарский Р.К., Корецкий С.Н., Филатова Д.А., Синицын В.Е., Драпкина О.М. Вариант нуклеотидной последовательности гена RBM20 в семье с дилатационным фенотипом некомпактного миокарда левого желудочка. Кардиоваскулярная терапия и профилактика. 2022;21(12):3470. https://doi.org/10.15829/1728-8800-2022-3470
For citation:
Kulikova O.V., Myasnikov R.P., Meshkov A.N., Mershina E.A., Kiseleva A.V., Sotnikova E.A., Kudryavtseva M.M., Kharlap M.S., Divashuk M.G., Zharikova A.A., Angarsky R.K., Koretsky S.N., Filatova D.А., Sinitsyn V.E., Drapkina O.M. RBM20 nucleotide sequence variant in a family with a dilated phenotype of left ventricular non-compaction. Cardiovascular Therapy and Prevention. 2022;21(12):3470. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3470
JATS XML

























































