Перейти к:
Сравнительная оценка иммуногенности различных схем ревакцинации против вируса SARS-CoV-2
https://doi.org/10.15829/1728-8800-2022-3483
Аннотация
Крайне важным представляется наряду с эффективностью и безопасностью изучение выраженности гуморального и клеточного иммунитета при проведении не только вакцинации, но и ревакцинации против вируса SARS-CoV-2 (Severe Acute Respiratory Syndrome-related CoronaVirus 2).
Цель. Сравнительная оценка иммуногенности (гуморальный и клеточный иммунитет) различных (гетерологичных и гомологичных) схем ревакцинации против COVID-19 (COronaVIrus Disease 2019) в рамках проспективного наблюдательного исследования.
Материал и методы. У лиц в возрасте ≥18 лет при отсутствии противопоказаний к вакцинации использовались два вида вакцин при первичной вакцинации и ревакцинации: Гам-КОВИДВак и КовиВак. Пациентам I группы выполнялось введение ГамКОВИД-Вак на каждом этапе первичной и повторной вакцинации; пациентам II группы — Гам-КОВИД-Вак на каждом этапе первичной вакцинации, КовиВак на каждом этапе повторной вакцинации; пациентам III группы — КовиВак на каждом этапе первичной вакцинации и Гам-КОВИД-Вак на каждом этапе повторной вакцинации; пациентам IV группы — КовиВак на каждом этапе первичной и повторной вакцинации. Всем участникам в динамике (на каждом этапе вакцинации, ревакцинации и через 12 мес. после первичной вакцинации) определяли уровень IgG к рецептор-связывающему домену поверхностного гликопротеина S (spike) вируса SARSCoV-2 и Т-клеточный иммунитет (Т-СПОТ) к SARS-CoV-2.
Результаты. Максимальный уровень IgG на II этапе ревакцинации отмечается в I и III исследуемых группах вакцинированных лиц. Кроме того, в I, III и IV исследуемых группах отмечен достоверный (p<0,0001) прирост уровня IgG ко II этапу ревакцинации, наиболее выраженный у лиц III группы. Кроме того, отмечен значимо (p<0,05) более высокий уровень IgG на I и II этапе ревакцинации (Визит 3 и 4) среди вакцинированных Гам-КОВИД-Вак — 520 и 540 BAU/мл, соответственно, по сравнению с IV группой вакцинированных КовиВак — 467 и 478 BAU/мл, соответственно. Максимальный и достоверный прирост уровня активных Т-клеток ко II этапу ревакцинации (Визит 4) отмечен в I (p<0,0001) и III (p<0,0022) группах вакцинированных лиц, где он составил 11 и 12, соответственно, что позволяет считать результат положительным (>8). При этом уровень активных Т-клеток, реагирующих на стимуляцию Nucleocapsid Ag SARS-CoV-2 к Визиту 4 (II этап ревакцинации) отмечен во II (14,5) и IV (12) группах вакцинированных.
Заключение. Применение векторной вакцины Гам-КОВИД-Вак в качестве бустерной дозы как в гомологичной, так и гетерологичной схеме вакцинации против вируса SARS-CoV-2 наиболее эффективно для стимуляции и гуморального (IgG к рецептор-связывающему домену поверхностного гликопротеина S (spike) вируса SARS-CoV-2), и Т-клеточного (реагирование на стимуляцию Spike Ag SARS-CoV-2) поствакцинального ответа.
Ключевые слова
Для цитирования:
Драпкина О.М., Бернс С.А., Горшков А.Ю., Рыжакова Л.Н., Жданова О.В., Чащин М.Г., Литинская О.А., Савичева А.А., Покровская М.Г. Сравнительная оценка иммуногенности различных схем ревакцинации против вируса SARS-CoV-2. Кардиоваскулярная терапия и профилактика. 2022;21(12):3483. https://doi.org/10.15829/1728-8800-2022-3483
For citation:
Drapkina O.M., Berns S.A., Gorshkov A.Yu., Ryzhakova L.N., Zhdanova O.V., Chaschin M.G., Litinskaya O.A., Savicheva A.A., Pokrovskaya M.S. Comparative assessment of the immunogenicity of various revaccination regimens against the SARS-CoV-2. Cardiovascular Therapy and Prevention. 2022;21(12):3483. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3483
Введение
В конце 2019г в Китайской народной республике произошла вспышка новой коронавирусной инфекции с эпицентром в городе Ухань (провинция Хубэй), названной Всемирной организацией здравоохранения (ВОЗ) коронавирусной болезнью 2019 COVID-19 (Coronavirus disease 2019). Пандемия коронавирусной инфекции COVID-19, вызванной вирусом SARS-CoV-2 (Severe Acute Respiratory Syndrome-related CoronaVirus 2), продолжается и по настоящее время.
В связи с высокой контагиозностью и частотой тяжелого течения заболевания постановлением Правительства РФ от 31.01.2020г № 66 "О внесении изменения в перечень заболеваний, представляющих опасность для окружающих" новая коронавирусная инфекция (CОVID-19, код по международной классификации болезней 10 пересмотра (МКБ-10) — В 34.2 "Коронавирусная инфекция неуточненная") добавлена в перечень заболеваний, представляющих опасность для окружающих, наряду с особо опасными инфекциями (чума, холера, оспа), утвержденных ранее постановлением Правительства РФ № 715 от 01.12.2004г.
Во всем мире по состоянию на 28.10.2022г было зарегистрировано 626 337 158 подтвержденных случаев заболевания COVID-19, в т.ч. 6 566 610 случаев смерти, согласно данным ВОЗ. В настоящее время основным способом специфической профилактики коронавирусной инфекции служит вакцинация против вируса SARS-CoV-2.
По состоянию на 25.10.2022г было введено 12 830 378 906 доз вакцины. При этом количество полностью вакцинированных лиц на 100 человек населения составило в США 67,63, во Франции и Германии — 77,48 и 78,02, соответственно, в РФ — 52,981.
В настоящее время в РФ зарегистрированы вакцины разного механизма действия против COVID-19: векторные ("Гам-КОВИД-Вак-Лио", "Спутник Лайт", "Гам-КОВИД-Вак-М", "Гам-КОВИД-Вак" — капли назальные, "Салнавак" — капли назальные), вакцины на основе пептидных антигенов ("ЭпиВакКорона", "АВРОРА-КоВ"), вакцина коронавирусная инактивированная цельновирионная ("КовиВак") и вакцина субъединичная рекомбинантная ("Конвасэл")2.
Серьезной проблемой в рамках вакцинации против вируса SARS-CoV-2 является снижение эффективности вакцин, обусловленное рядом причин и в первую очередь — появлением новых штаммов вируса SARS-CoV-2. Полагают, что подобного рода осложнений можно избежать при использовании ревакцинации [1]. Концепция ревакцинации заключается в поддержании протективного иммунитета путем введения бустерных доз вакцин (гомологичных и гетерологичных)3.
Очевидно, что для формирования надежного "коллективного" иммунитета необходимо обеспечить широкую прослойку населения с устойчивым длительным иммунитетом [2, 3]. Более того, с учетом высокой частоты мутаций, свойственной вирусам, обоснованной представляется разработка вакцин, предназначенных для выработки антител (АТ) к иным белкам вируса, среди которых выделяют не только S-белок, но и белок оболочки (envelope protein, E-белок), мембранный белок (membrane protein, M-белок) и нуклеокапсидный белок (nucleocapsid protein, N-белок). Альтернативным и наиболее перспективным кандидатом на успешную вакцину можно считать N-белок, как наиболее иммуногенный в отношении и гуморального, и клеточного иммунитета. Находясь внутри вируса, этот белок не может вызывать антителозависимое усиление инфекции (antibody-dependent enhancement, ADE) и не вызывает выработку нейтрализующих АТ. Однако это не противоречит его потенциальной вакцинной протективности, т.к. он вызывает мощный клеточный ответ, включая локальный легочный, который, по мнению многих ученых, играет ключевую роль в защите от повторных заражений перенесших COVID-19, независимо от уровня АТ4.
Цель настоящего исследования — сравнительная оценка иммуногенности (гуморальный и клеточный иммунитет) различных (гетерологичных и гомологичных) схем ревакцинации против COVID-19 в рамках проспективного наблюдательного исследования.
Материал и методы
Анализ вакцинированных лиц выполнен в рамках исследования САТУРН ("Сравнительная оценкА реактогенносТи и иммУногенности гетеРологичных схем вакциНации против COVID-19", государственное задание № 122013100211-8), которое проводится на базе ФГБУ "Национальный медицинский исследовательский центр терапии и профилактической медицины" Минздрава России. Изучалось применение различных схем ревакцинации против вируса SARS-CoV-2 (гомологичные и гетерологичные схемы) на основе двух вакцин: Гам-КОВИД-Вак и КовиВак. Все участники исследования имели возможность выбрать, какой вакциной прививаться.
КовиВак — вакцина против COVID-19 на основе инактивированного вируса производства ФГБНУ "Федеральный научный центр исследований и разработки иммунобиологических препаратов им. М. П. Чумакова" РАН содержит антиген инактивированного коронавируса SARS-CoV-2 (штамм AYDAR-1, инактивирован β-пропиолактоном).
Гам-КОВИД-Вак состоит из двух компонентов (двух векторов). Компонент 1 содержит рекомбинантные аденовирусные частицы 26 серотипа, в которых содержится ген белка S вируса SARS-CoV-2. Компонент 2 — аденовирусные рекомбинантные частицы 5 серотипа, которые содержат ген белка S вируса SARS-CoV-2.
Критерии включения: возраст ≥18 лет; отсутствие противопоказаний к вакцинации; подписание информированного согласия.
Критерии исключения/невключения: наличие противопоказаний к вакцинации; перенесенная ранее новая коронавирусная инфекция; предшествовавшая вакцинация против вируса SARS-CoV-2; отказ от участия в исследовании.
В настоящем исследовании запланировано проведение пяти визитов: Визит 1 (исходный — I этап первичной вакцинации), Визит 2 (14/21 день — II этап первичной вакцинации), Визит 3 (I этап ревакцинации — через 6 мес. после введения первого компонента при первичной вакцинации), Визит 4 (II этап ревакцинации), Визит 5 — через 12 мес. после I этапа первичной вакцинации.
Исследуемые группы вакцинированных лиц:
Группа I (n=97) — введение Гам-КОВИД-Вак на каждом этапе первичной и повторной вакцинации;
Группа II (n=7) — Гам-КОВИД-Вак на каждом этапе первичной вакцинации, КовиВак на каждом этапе повторной вакцинации;
Группа III (n=42) — КовиВак на каждом этапе первичной вакцинации, Гам-КОВИД-Вак на каждом этапе повторной вакцинации;
Группа IV (n=38) — введение КовиВак на каждом этапе первичной и повторной вакцинации.
На Визите 1 проводилось получение письменного Информированного согласия, сбор анамнеза. Кроме того, у всех участников на всех визитах проводился сбор жалоб и объективный осмотр, забор крови для проведения иммунологического анализа (определение уровня специфических АТ к гликопротеину SARS-CoV-2 IgG; определение уровня специфических АТ к гликопротеину SARS-CoV-2 IgM (качественный); определение уровня IgG к рецептор-связывающему домену поверхностного гликопротеина S (spike) коронавируса SARS-CoV-2); измерение температуры тела. Кроме того, на Визитах 1, 3 и 5 осуществлялся забор крови для определения Т-клеточного иммунитета (Т-СПОТ) к SARS-CoV-2: панель А — количество спотов (специфически сенсибилизированных Т-лимфоцитов) к Spike antigens (поверхностный антиген, Ag), панель B — количество спотов (специфически сенсибилизированных Т-лимфоцитов) к Nucleocapsid antigens (ядерный Ag).
Проводилась оценка параметров безопасности: общая частота всех нежелательных явлений; частота локальных и системных поствакцинальных реакций; частота аллергических и неврологических поствакцинальных осложнений.
Исследование выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice). Протокол исследования одобрен локальным этическим комитетом учреждения. Перед включением в исследование субъекту предоставлялась письменная информация и устное разъяснение о целях, задачах и методах проведения исследования, а также об ожидаемой пользе и возможном риске, связанных с участием в исследовании. Кроме того, субъекты были поставлены в известность о добровольном характере участия в исследовании и о том, что субъект имеет право отказаться от участия в исследовании в любой момент, и что этот отказ не повлияет на качество предоставляемой ему медицинской помощи.
Клинико-анамнестическая характеристика участников исследования, получавших различные вакцины против вируса SARS-CoV-2, представлена на рисунках 1-3. В общей группе вакцинированных отмечено практически одинаковое количество мужчин и женщин — 91 (51%) и 93 (49%), соответственно. Распределение по возрасту показало наибольший процент лиц молодого (48%) и среднего возраста (36%). Пожилые лица составили 12%, лица старческого возраста — 4%. Средний возраст — 45 [37; 54] лет. У 39% вакцинированных лиц отмечена избыточная масса тела и у 23% — ожирение, курили 18% вакцинированных. Патология органов дыхания встречалась у 8%, органов пищеварения у 21%, сердечно-сосудистой системы у 29% вакцинированных лиц.
Статистические методы
Для статистической обработки результатов применяли программы IBM SPSS v. 24 и MedCalc v. 20.104. Переменные представлены в виде медианы (Me) и интерквартильного размаха (Q25; Q75), для долей и частот данные представлены в процентах. Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро-Уилка. Для сравнения количественных переменных в двух группах использовался критерий U-Манна-Уитни, в трех и более группах — критерий Краскела-Уоллиса. Качественные переменные сравнивались с помощью критерия χ2. Для анализа повторных измерений, связанных с одним и тем же индивидуумом, использовался критерий Фридмана. Направление и теснота корреляционной связи между двумя количественными показателями оценивались с помощью коэффициента корреляции Спирмена. Оценка силы связи коэффициентов корреляции проводилась в соответствии со шкалой Чеддока. Оценка зависимости количественных переменных от факторов проводилась с помощью метода линейной регрессии. Уровень значимости различий считался достоверным при p<0,05.
Результаты
С целью оценки выраженности гуморального иммунитета проведен анализ уровня IgG. В таблице 1 представлена динамика уровня IgG (BAU/мл) к рецептор-связывающему домену поверхностного гликопротеина S (spike) коронавируса SARS-CoV-2 на I (Визит 3) и II (Визит 4) этапах ревакцинации против вируса SARS-CoV-2. Продемонстрировано, что максимальный уровень IgG на II этапе ревакцинации отмечается в I (введение Гам-КОВИД-Вак на каждом этапе первичной и повторной вакцинации) и III (КовиВак на каждом этапе первичной вакцинации, Гам-КОВИД-Вак на каждом этапе повторной вакцинации) группах вакцинированных лиц (p>0,05). Кроме того, в I, III и IV группах отмечен достоверный (p<0,0001) прирост уровня IgG ко II этапу ревакцинации, наиболее выраженный у лиц III группы (КовиВак на каждом этапе первичной вакцинации, Гам-КОВИД-Вак на каждом этапе повторной вакцинации).
Кроме того, отмечен значимо (p<0,05) более высокий уровень IgG на I и II этапе ревакцинации (Визит 3 и 4) среди вакцинированных Гам-КОВИД-Вак — 520 и 540 BAU/мл, соответственно, по сравнению с IV группой, вакцинированных КовиВак — 467 и 478 BAU/мл, соответственно.
Анализ напряженности клеточного иммунитета проводился посредством изучения уровня активных Т-клеток, реагирующих на стимуляцию Spike (поверхностный) и Nucleocapsid (ядерный) Ag SARS-CoV-2.
В таблице 2 представлена динамика уровня активных Т-клеток, реагирующих на стимуляцию Spike Ag SARS-CoV-2. Интерпретация исследования: ≥8 — результат положительный; ≤4 — результат отрицательный; 5-7 — результат пограничный.
Показано, что максимальный и достоверный прирост уровня активных Т-клеток ко II этапу ревакцинации (4 Визит) отмечен в I (p<0,0001) и III (p<0,0022) группах вакцинированных лиц, где он составил 11 и 12, соответственно, что позволяет считать результат положительным (>8).
В этих же группах вакцинированных лиц прослежена динамика уровня активных Т-клеток, реагирующих на стимуляцию Nucleocapsid Ag SARS-CoV-2 (таблица 3). К 4 Визиту (II этап ревакцинации) положительный уровень активных Т-клеток (>8) отмечен во II (14,5) и IV (12) группах вакцинированных, причем значимые (p<0,05) различия продемонстрированы между I и IV группами на обоих этапах ревакцинации.
С помощью регрессионного анализа выявлены статистически значимые зависимости умеренной силы (r=0,28; p=0,009) между уровнем IgG и активных Т-клеток, реагирующих на стимуляцию Spike (поверхностный) антиген (Ag) SARS-CoV-2 (рисунок 4), а также между уровнем IgG и активных Т-клеток (r=0,31; p=0,004), реагирующих на стимуляцию Nucleocapsid (ядерный) Ag SARS-CoV-2 (рисунок 5).
Рис. 1 Общая группа вакцинированных с распределением по полу и возрасту.
Рис. 2 Общая группа вакцинированных с распределением по наличию ожирения и курения.

Рис. 3 Общая группа вакцинированных с распределением по наличию патологии органов дыхания, пищеварения и сердечно-сосудистой системы.
Таблица 1
Динамика уровня IgG к рецептор-связывающему домену поверхностного гликопротеина S (spike) коронавируса SARS-CoV-2
|
Группа вакцинированных |
Визит 3 |
Визит 4 |
p |
|
I (n=97) |
520 [ 478; 561]* |
540 [ 540; 561]* |
<0,0001 |
|
II (n=7) |
540 [ 509,5; 550,5] |
499 [ 483,25; 545,5] |
0,0796 |
|
III (n=42) |
478 [ 111,5; 520] |
540 [ 520; 540] |
<0,0001 |
|
IV (n=38) |
467 [ 162; 520]* |
478 [ 248; 540]* |
<0,0001 |
Таблица 2
Динамика уровня активных Т-клеток, реагирующих на стимуляцию Spike (поверхностный) Ag SARS-CoV-2
|
Группа вакцинированных |
Визит 3 |
Визит 4 |
р |
|
I (n=97) |
7 [ 2; 23] |
11 [ 3; 28] |
<0,0001 |
|
II (n=7) |
18 [ 6,5; 55,5] |
17,5 [ 12,75; 34,25] |
0,1763 |
|
III (n=42) |
4 [ 1,5; 6] |
12 [ 5; 24] |
0,0022 |
|
IV (n=38) |
5 [ 1,25; 10,75] |
6 [ 2; 10,5] |
<0,0001 |
Таблица 3
Динамика уровня активных Т-клеток, реагирующих на стимуляцию Nucleocapsid (ядерный) Ag SARS-CoV-2
|
Группа вакцинированных |
3 визит |
4 визит |
р |
|
I (n=97) |
3 [ 0; 8]* |
4 [ 0; 8]* |
>0,05 |
|
II (n=7) |
3 [ 1; 5] |
14,5 [ 9,75; 21,5] |
>0,05 |
|
III (n=42) |
4 [ 1; 8,5] |
6 [ 3; 15] |
>0,05 |
|
IV (n=38) |
10,5 [ 3; 22]* |
12 [ 6,5; 25,75]* |
>0,05 |
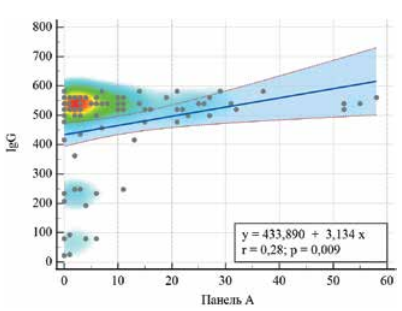
Рис. 4 График регрессионной функции с тепловой картой, характеризующий зависимость титра IgG от значения Панели А (активные Т-клетки, реагирующие на стимуляцию Spike (поверхностный) Ag SARS-CoV-2).
Примечание: цветовым градиентом обозначена плотность точек на диаграмме: от участков с наибольшей плотностью (красный) к более разреженным (голубой). Цветное изображение доступно в электронной версии журнала.
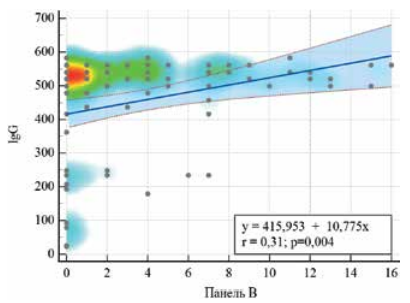
Рис. 5 График регрессионной функции с тепловой картой, характеризующий зависимость титра IgG от значения Панели В (активные Т-клетки, реагирующие на стимуляцию Nucleocapsid (ядерный) Ag SARS-CoV-2).
Примечание: цветовым градиентом обозначена плотность точек на диаграмме: от участков с наибольшей плотностью (красный) к более разреженным (голубой). Цветное изображение доступно в электронной версии журнала.
Обсуждение
Крайне важным представляется наряду с эффективностью и безопасностью изучение выраженности гуморального и клеточного иммунитета при проведении не только вакцинации, но и ревакцинации против вируса SARS-CoV-2. В работе Accors E, et al. было показано, что вакцинация 3 дозами вакцины с мРНК COVID-19, по сравнению с невакцинацией и получением 2 доз, была связана с формированием иммунной защиты как от штамма Омикрон, так и от штамма Дельта SARS-CoV-2, хотя более высокие коэффициенты вероятности ассоциации с инфекцией Омикроном предполагают меньшую защиту от штамма Омикрон, чем от штамма Дельта [4].
В настоящей работе продемонстрирован максимальный уровень IgG на II этапе ревакцинации у лиц, которые первично вакцинировались и ревакцинировались Гам-КОВИД-Вак, а также у тех, кто первично вакцинировался КовиВак, а ревакцинировался Гам-КОВИД-Вак. Результаты изучения иммуногенности (гуморальный иммунитет) отечественных вакцин "Гам-КОВИД-Вак и "КовиВак" были продемонстрированы нами ранее в работах, отражающих данные проспективного исследования "СИРИУС" (Состояние Иммунной системы и исходы у лиц, вакциниРованных протИв вирУСа SARS-CoV-2). Так, было показано, что после введения вышеуказанных вакцин имел место достоверный прирост уровня IgG-АТ к S белку вируса SARS-CoV-2, который был более выражен именно в группе вакцинированных Гам-КОВИД-Вак [5].
Важнейшую роль в формировании иммунного ответа играют клетки памяти, которые способны реагировать на специфические Ag и реактивировать защитные реакции (через эффекторные Т-клетки) иногда по прошествии десятилетий. Известно, что гуморальный иммунитет также поддерживается клетками памяти. Продолжительность клеточной иммунологической памяти к SARS была подтверждена через 11 лет после заражения.4
В настоящей работе также показано, что количество спотов (специфически сенсибилизированных Т-лимфоцитов) к Spike antigens (поверхностный Ag) SARS-CoV-2, которые служат ответом на эффективную вакцинацию, было бóльшим среди лиц, которые ревакцинировались Гам-КОВИД-Вак, а первично вакцинировались — Гам-КОВИД-Вак, либо КовиВак. Таким образом, бустерная вакцинация векторной вакциной как в гомологичной, так и в гетерологичной схеме оказалась более эффективной для стимуляции и гуморального, и Т-клеточного поствакцинального ответа по сравнению с использованием вакцины коронавирусной инактивированной цельновирионной ("КовиВак").
26.08.2022г Pfizer и BioNTech обратились в Европейское агентство по лекарственным средствам с просьбой об одобрении бивалентной вакцины против COVID-19, адаптированной к штамму Омикрон BA.4/BA.5, в качестве бустерной дозы. Вакцина сочетает в себе матричную рибонуклеиновую кислоту, кодирующую спайковый белок уханьского штамма SARS-CoV-2, который является основой оригинальной вакцины Pfizer-BioNTech., и кодирующую шиповидный белок подвариантов Омикрон BA.4 и BA.5. 15.08.2022г была одобрена для использования в качестве бустерной дозы двухвалентная вакцина от Moderna на основе штамма Омикрон BA.1. Предварительные данные показали, что вакцина вызывает выраженный иммунный ответ против подвариантов ВА.4 и ВА.5, которые в настоящее время преобладают в США и Европе [6].
Нами получен интересный факт, свидетельствующий о более выраженном Т-клеточном ответе на стимуляцию Nucleocapsid Ag SARS-CoV-2 среди лиц, которые ревакцинировались КовиВак, а первично вакцинировались КовиВак, либо Гам-КОВИД-Вак.
Нуклеокапсидный белок, наибольший по количеству молекул и общей массе в вирионе SARS-CoV-2, является и самым иммуногенным, как во время, так и после инфекции COVID-194. Это объясняется высоким уровнем клеточного иммунного ответа на этот Ag. Несмотря на то, что белок нуклеокапсида находится под оболочкой вместе с вирусной РНК и не экспонируется на поверхности вирусной частицы, клеточный и гуморальный иммунный ответ к нему формируются на самых ранних стадиях заболевания и опережают ответ к поверхностным белкам, включая S-белок, АТ к которому являются нейтрализующими. Дополнительно с помощью использования адъювантов можно достичь более высоких титров N-специфических АТ и Т-клеточного ответа [7].
Принимая во внимание значимость Т-клеточного иммунного ответа в протективности вакцин против COVID-19, необходимо учесть, что и защитная роль специфических АТ не ограничивается прямой нейтрализацией, тем более в постановке in vitro, которая не включает ни клеточный иммунитет, ни систему комплемента [8-10].
Заключение
Согласно полученным данным, применение векторной вакцины Гам-КОВИД-Вак в качестве бустерной дозы как в гомологичной, так и гетерологичной схеме вакцинации против вируса SARS-CoV-2 наиболее эффективно для стимуляции и гуморального (IgG к рецептор-связывающему домену поверхностного гликопротеина S (spike) коронавируса SARS-CoV-2), и Т-клеточного (реагирование на стимуляцию Spike Ag SARS-CoV-2) поствакцинального ответа.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. WHO Coronavirus (COVID-19) Dashboard With Vaccination Data n.d. WHO. https://covid19.who.int/. (12 October 2022).
2. Министерство здравоохранения РФ "Временные методические рекомендации "Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)". Версия 16. https://static-0.minzdrav.gov.ru/system/attachments/attaches/000/060/193/original/ВМР_COVID-19_V16.pdf. (18.08.2022).
3. WHO. Interim statement on booster doses for COVID-19 vaccination 2021. https://www.who.int/news/item/22-12-2021-interim-statement-on-booster-doses-for-covid-19-vaccination-Update-22-December-2021. (12 April 2022).
4. Регистрационное удостоверение ЛП-006395 от 11.08.2020 Гам-КОВИД-Вак Комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом SARS-CoV-2 (Филиал "Медгамал" ФГБУ "НИЦЭМ им. Н. Ф. Гамалеи" Минздрава России). https://grls.rosminzdrav.ru/InstrImg/0001460267/0000615293/%D0%9B%D0%9F006423[2020]_0.pdf. (16 Marth 2021).
Список литературы
1. Драпкина О. М., Бернс С. А., Горшков А. Ю. и др. Бустерная вакцинация против вируса SARS-CoV-2: основные проблемы и пути их решения. Комплексные проблемы сердечно-сосудистых заболеваний. 2022;11(2):196-203. doi:10.17802/2306-1278-2022-11-2-196-203.
2. Fontanet A, Cauchemez S. COVID-19 herd immunity: where are we? Nat Rev Immunol. 2020;20(10):583. doi:10.1038/s41577020-00451-5.
3. Kemp F, Proverbio D, Aalto A, et al. Modelling COVID-19 dynamics and potential for herd immunity by vaccination in Austria, Luxembourg and Sweden. J Theor Biol. 2021;530:110874. doi:10.1016/j.jtbi.2021.110874.
4. Accors E, Britton A, Fleming-Dutra, et al. Association Between 3 Doses of mRNA COVID-19 Vaccine and Symptomatic Infection Caused by the SARS-CoV-2 Omicron and Delta Variants. JAMA. 2022;327(7):639-51. doi:10.1001/jama.2022.0470.
5. Драпкина О. М., Бернс С. А., Горшков А. Ю. и др. Отдаленная динамика уровня специфических IgG-антител к S-белку коронавируса SARS-CoV-2 у вакцинированных лиц. Кардиоваскулярная терапия и профилактика. 2021;20(8):3124. doi:10.15829/1728-8800-2021-3124.
6. Burki T. COVID vaccine booster doses for omicron variants. Lancet. 2022;10:936. doi:10.1016/S2213-2600(22)00361-7.
7. Le TT, Cramer JP, Chen R, et al. Evolution of the COVID-19 vaccine development landscape. Nat Rev Drug Discov. 2020;19(10):667-8. doi:10.1038/d41573-020-00151-8.
8. Polack FP, Thomas SJ, Kitchin N, et al. C4591001 Clinical Trial Group. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med. 2020;383(27):2603-15. doi:10.1056/NEJMoa2034577.
9. Baden LR, El Sahly HM, Essink B, et al. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. N Engl J Med. 2021;384(5):403-16. doi:10.1056/NEJMoa2035389.
10. Sallam M. COVID-19 Vaccine Hesitancy Worldwide: A Concise Systematic Review of Vaccine Acceptance Rates. Vaccines (Basel). 2021;9(2):160. doi:10.3390/vaccines9020160.
Об авторах
О. М. ДрапкинаРоссия
Доктор медицинских наук, профессор, академик РАН, директор.
Москва
С. А. Бернс
Россия
Доктор медицинских наук, профессор.
Москва
А. Ю. Горшков
Россия
Кандидат медицинских наук, заместитель директора по научной и амбулаторно-поликлинической работе.
Москва
Л. Н. Рыжакова
Россия
Кандидат медицинских наук, главный врач консультативно-диагностического центра.
Москва
О. В. Жданова
Россия
Врач терапевт консультативно-диагностического центра.
Москва
М. Г. Чащин
Россия
Научный сотрудник отдела фундаментальных и прикладных аспектов ожирения.
Москва
О. А. Литинская
Россия
Кандидат медицинских наук, заведующий клинико-диагностической лабораторией.
Москва
А. А. Савичева
Россия
Клинический ординатор.
Москва
М. Г. Покровская
Россия
Кандидат биологических наук, руководитель лаборатории "Банк биологического материала".
Москва
Рецензия
Для цитирования:
Драпкина О.М., Бернс С.А., Горшков А.Ю., Рыжакова Л.Н., Жданова О.В., Чащин М.Г., Литинская О.А., Савичева А.А., Покровская М.Г. Сравнительная оценка иммуногенности различных схем ревакцинации против вируса SARS-CoV-2. Кардиоваскулярная терапия и профилактика. 2022;21(12):3483. https://doi.org/10.15829/1728-8800-2022-3483
For citation:
Drapkina O.M., Berns S.A., Gorshkov A.Yu., Ryzhakova L.N., Zhdanova O.V., Chaschin M.G., Litinskaya O.A., Savicheva A.A., Pokrovskaya M.S. Comparative assessment of the immunogenicity of various revaccination regimens against the SARS-CoV-2. Cardiovascular Therapy and Prevention. 2022;21(12):3483. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3483
JATS XML

























































