Перейти к:
Взаимосвязь эффективного рефрактерного периода левого предсердия и легочных вен и развития раннего рецидива фибрилляции предсердий после радиочастотной изоляции устьев легочных вен. Первые результаты
https://doi.org/10.15829/1728-8800-2023-3503
Аннотация
Цель. Оценить взаимосвязь эффективного рефрактерного периода левого предсердия (ЛП) и легочных вен (ЛВ) и развития раннего рецидива фибрилляции предсердий (ФП) после радиочастотной изоляции легочных вен (ИЛВ).
Материал и методы. В исследование было включено 35 пациентов с персистирующей формой ФП, рефрактерной к антиаритмической терапии (ААТ). Всем пациентам проводилась оценка значений эффективного рефрактерного периода (ЭРП) ЛП и ЛВ с последующей радиочастотной антральной ИЛВ. В зависимости от значений ЭРП пациенты делились на 2 группы. В группу 1 (n=15) были включены пациенты, у которых среднее значение ЭРП ЛП и ЛВ были ≥240 мс, в группу 2 (n=20) — пациенты, у которых среднее значение ЭРП ЛП и ЛВ были <240 мс. Оценка результатов (возникновение ранних рецидивов) ФП, в зависимости от полученных значений ЭРП, проводилась в первые 3 мес.
Результаты. Значения ЭРП, полученные в ходе исследования, группа 1 — ЛП (ушко ЛП) 252±8,9 мс; левая верхняя ЛВ (ЛВЛВ) 252±12,1 мс; левая нижняя ЛВ (ЛНЛВ) 257,3±8,15 мс; правая верхняя ЛВ (ПВЛВ) 254,6±11,3 мс; правая нижняя ЛВ (ПНЛВ) 260±9,05 мс. Группа 2 — ЛП 230±12,1 мс; ЛВЛВ 205±10,5 мс; ЛНЛВ 186,6±22,05 мс; ПВЛВ 212,2±14 мс; ПНЛВ 218,8±11,1 мс. В ходе наблюдения за пациентами в группе 1 в первые 3 мес. после ИЛВ рецидивов не наблюдалось. В группе 2 наблюдались 7 ранних рецидивов ФП. При корреляционном анализе была выявлена статистически значимая обратно пропорциональная зависимость (-0,349; р=0,03) между значениями ЭРП и количеством рецидивов в группах.
Заключение. Первые результаты проведенного исследования демонстрируют наличие обратно пропорциональной зависимости между величиной среднего ЭРП ЛВ и ЛП и развитием раннего рецидива ФП, что позволяет рассматривать значение ЭРП ЛВ и ЛП <240 мс в качестве вероятного предиктора риска раннего рецидива ФП. Однако этот факт требует продолжения исследования с увеличением выборки и проведением соответствующего статистического анализа по предикторной ценности обсуждаемых показателей.
Для цитирования:
Коженов А.Т., Азизов С.Н., Хлынова О.В. Взаимосвязь эффективного рефрактерного периода левого предсердия и легочных вен и развития раннего рецидива фибрилляции предсердий после радиочастотной изоляции устьев легочных вен. Первые результаты. Кардиоваскулярная терапия и профилактика. 2023;22(4):3503. https://doi.org/10.15829/1728-8800-2023-3503
For citation:
Kozhenov A.T., Azizov S.N., Khlynova O.V. Relationship between the left atrial and pulmonary vein effective refractory period and the development of early atrial fibrillation recurrence after radiofrequency pulmonary vein isolation. First results. Cardiovascular Therapy and Prevention. 2023;22(4):3503. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3503
Введение
Фибрилляция предсердий (ФП) остается одним из наиболее распространенных видов нарушений ритма сердца. По данным Kirchhof P, et al. ФП встречается у 1-2% людей в общей популяции и >3% у людей старше >20 лет [1]. ФП не является жизнеугрожающей аритмией, однако она сопровождается увеличением частоты развития различных осложнений (инсульт, сердечная недостаточность), а также ухудшением качества жизни (увеличением частоты госпитализации, снижением толерантности к физической нагрузке).
В последнее десятилетие интервенционные методы являются главным подходом реализации стратегии лечения ФП, направленного на восстановление и поддержание синусового ритма. Haissaguerre M, et al. предположили, что причиной ФП служит триггерная активность участков предсердий, преимущественно расположенных в устьях легочных вен (ЛВ) [2]. Позже Pappone С, et al. с помощью циркулярных воздействий вокруг устьев ЛВ изолировали данные триггеры от левого предсердия (ЛП) [3]. На данный момент изоляция устьев ЛВ (ИЛВ) является основным подходом при катетерном лечении ФП.
По данным некоторых исследований эффективность антиаритмической терапии (ААТ) составляет от 16 до 58% и уступает эффективности катетерной аблации (от 66 до 89%) в лечении пароксизмальной формы ФП [4-6].
Одним из важных вопросов, связанных с интервенционным лечением ФП, является ведение пациентов в раннем послеоперационном, так называемым, "слепом" периоде. Как правило, после катетерной аблации используют 3-месячный слепой период, во время которого не рекомендуется повторная аблация, даже если были рецидивы ФП [7].
Однако в раннем послеоперационном периоде нередко отмечаются симптомные, гемодинамически значимые рецидивы предсердной тахикардии, ФП, что приводит к ухудшению качества жизни пациентов, увеличению частоты госпитализаций. Кроме того, в ряде исследований была обнаружена значимая корреляция между ранними рецидивами ФП (РРФП) в слепом периоде и поздними рецидивами ФП после катетерной аблации [8][9].
Известно, что одним из главных механизмов развития рецидива ФП после радиочастотной аблации (РЧА) является реконнекция изолированной ЛВ, а также отсутствие аблации внелегочных триггеров. "Созревание" аблационных поражений, послеоперационная воспалительная реакция, дисбаланс вегетативной нервной системы также могут оказывать влияние на риск развития РРФП [10].
С целью предотвращения РРФП после аблации по поводу ФП в первую очередь назначаются ААТ и противовоспалительные препараты. В исследовании EAST-AF (The Efficacy of Antiarrhythmic Drugs Short-Term Use After Catheter Ablation for Atrial Fibrillation) была продемонстрирована эффективность ААТ во время "слепого" периода, а именно: ААТ снижает частоту ранних рецидивов ФП, сокращает количество госпитализаций и необходимость кардиоверсии [11].
Известно, что далеко не у всех пациентов один и тот же антиаритмический препарат (ААП) действует одинаково эффективно. Также известно, что прием ААП приводит к увеличению эффективного рефрактерного периода (ЭРП) предсердий, тем самым препятствуя поддержанию кругов микрориентри и блокируя триггерную активность эктопических очагов. Учитывая этот факт, мы решили изучить значения ЭРП, полученные в ходе операции, и понять, возможно ли использовать эти данные для оценки риска РРФП.
Цель исследования — оценить эффективный рефрактерный период ЛП и ЛВ как возможный предиктор раннего рецидива ФП после радиочастотной изоляции устьев ЛВ.
Материал и методы
В данное исследование после получения добровольного информированного согласия (одобрено локальным этическим комитетом ФГБОУ ВО "ПГМУ имени академика Е. А. Вагнера" Минздрава России) было включено 35 пациентов с персистирующей формой ФП, рефрактерной к ААТ. Диагноз ФП был верифицирован на основании критериев согласно рекомендациям ESC (European Society of Cardiology) 2020 по диагностике и лечению пациентов с ФП [12]. Перед оперативным лечением пациентам проводились необходимые клинические, лабораторные и инструментальные исследования, в т.ч. мультиспиральная компьютерная томография. Все пациенты перед операцией принимали ААП, при этом перерывы между приемами ААП не превышали 5 периодов полувыведения. Прием амиодарона составлял не <3 нед. После операции прием ААП не менялся.
Катетерная аблация проводилась на синусовом ритме. За несколько дней до операции пациентам при необходимости проводилась кардиоверсия с целью восстановления синусового ритма; 4-м пациентам ритм восстанавливали на операционном столе непосредственно перед операцией.
После проведения предоперационного обследования пациентов готовили к выполнению РЧА. Под местной анестезией проводилась пункция бедренных вен. После стандартной пункции межпредсердной перегородки электроды позиционировались в ЛП. Если у пациента на данном этапе был пароксизм ФП, выполнялась кардиоверсия.
Если синусовый ритм не восстанавливался, пациент исключался из исследования. Далее проводилось исследование значений ЭРП ЛВ и ЛП. Для этого последовательно из каждой ЛВ и из ушка ЛП выполнялась программируемая стимуляция с базовым циклом 500 мс и начальным экстрастимулом 340 мс. Шаг экстрастимула был выбран — 20 мс. Достижением ЭРП считался первый экстрастимул без соответствующего ответа предсердий. Пример измерения ЭРП показан на рисунке 1.
В работе Бокерия Л. А. и др., где оценивались электрофизиологические особенности предсердий при ФП, было показано, что ЭРП, измеренный в дистальном отделе коронарного синуса (ЛП), был значительно короче в группе больных с персистирующей ФП, чем в группе с пароксизмальной ФП (190,9±25,5 и 228,5±28,2 мс, соответственно) [13]. Учитывая эти данные, мы предположили, что если ЭРП ЛП и муфт устьев ЛВ будет превышать 240 мс (среднее максимальное значение ЭРП в 2 группах, округленное до целого), то механизмы поддержания ФП (микрориентри) будут отсутствовать.
Учитывая результаты данной работы, мы разделили пациентов на 2 группы в зависимости от среднего значения ЭРП, полученного при измерении в ЛП и в ЛВ. В группу 1 (n=15) были включены те, у кого среднее значение ЭРП ЛП и ЛВ были ≥240 мс, в группу 2 (n=20) — лица, у которых значения ЭРП ЛП и ЛВ были <240 мс. К примеру: если значения ЭРП ЛП было =240 мс, ЭРП ЛВЛВ =180 мс, ЭРП ЛНЛВ =180 мс, ЭРП ПВЛВ =260 мс, ЭРП ПНЛВ =220 мс и среднее значение ЭРП в итоге составило 216 мс, то данный пациент относился к группе 2.
Далее выполнялась стандартная радиочастотная антральная изоляция по методике point-by-point согласно CLOSE протоколу с помощью навигационной системы Carto 3 (Biosense Webster, USA). Использовался аблационный электрод Thermocool SmartTouch (Biosense Webster, USA), а также модули Visitag и Ablation Index. Для аблации применяли следующие параметры: температура 45 С, мощность 40 Вт, орошение во время аблации — 30 мл/мин. Параметры модуля Visitag: сила контакта от 3 до 40 г; сила контакта должна быть в нужном диапазоне не <30% времени аблации; минимальное время аблации в одной точке 3 сек; максимальное расстояние между точками 3 мм; стабильность положения электрода не <3 сек. Ablation Index на передней и верхней части антрума составлял 450, на задней и нижней 420 [14].
Изоляция устьев ЛВ считалась успешной при наличии блока входа (отсутствие венозных спайков на всех полюсах катетера Lasso, позиционированного в устьях ЛВ) и блока выхода (отсутствие стимуляционного захвата предсердий при стимуляции по ходу линии аблации), а также отсутствия электрической активности миокарда в области аблационных линий. Пример антральной изоляции на системе навигации Carto представлен на рисунке 2.
Оценка результатов (возникновение ранних рецидивов), в зависимости от достигнутых значений ЭРП, проводилась в первые 3 мес. Рецидивы оценивались по данным жалоб и данным Холтеровского мониторирования электрокардиограммы (ЭКГ). При возникновении частых симптомных рецидивов выполнялась повторная РЧА не ранее, чем через 3 мес. после операции.
Статистическая обработка полученных результатов проводилась с использованием встроенного пакета анализа табличного процессора Excel® 2016 MSO (© Microsoft, 2016), авторского (© В. С. Шелудько, 2001-2016) пакета прикладных электронных таблиц "Stat2015". Результаты представлены в виде абсолютных значений и процентов, а также в виде средних значений и стандартных отклонений. Изучался характер распределения признаков (критерий Шапиро-Уилка). При оценке статистической достоверности различий (р) для количественных признаков использовалось сравнение средних с помощью параметрических критериев: двухвыборочный t-критерий при нормальном распределении и U-критерий Манна-Уитни при распределении, отличном от нормального. Различия считались достоверными при уровне значимости р<0,05.
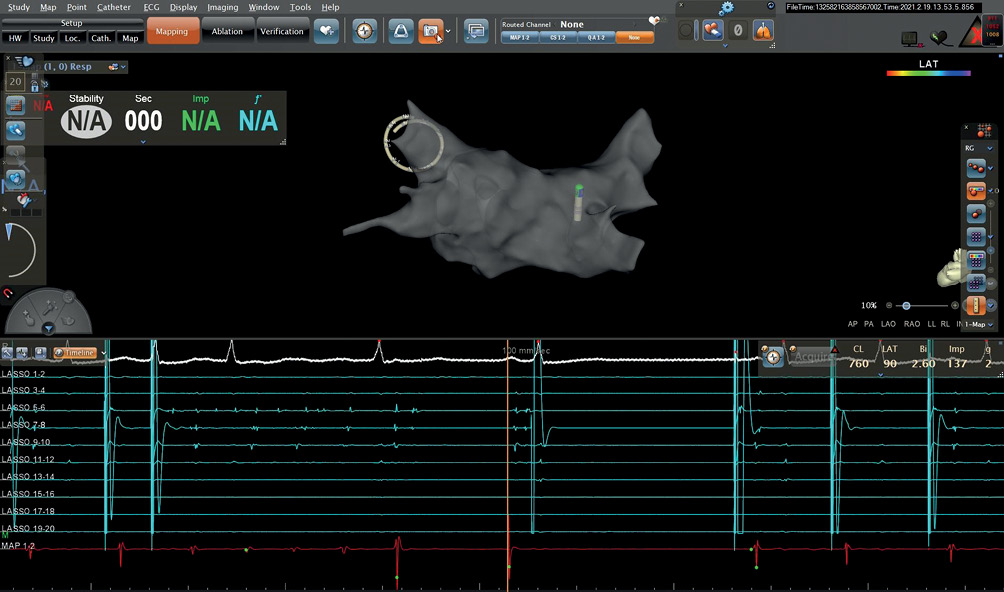
Рис. 1 Анатомическая карта ЛП и ЛВ на системе навигации Carto, катетер Lassо позиционирован в ЛВЛВ, аблационный катетер на передней стенке ЛП. Программируемая стимуляция с полюсов 7-8 Lasso. Индукция неустойчивого пароксизма ФП.
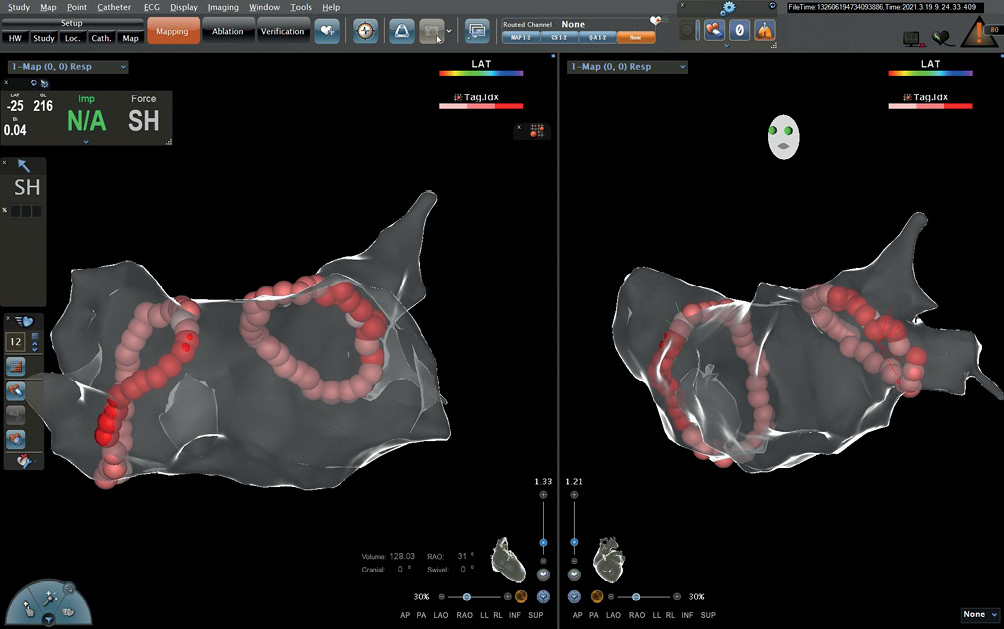
Рис. 2 Анатомическая карта ЛП и ЛВ на системе навигации Carto 3, пример антральной изоляции устьев ЛВ.
Результаты
Пациенты, включенные в исследование, в зависимости от значений ЭРП, полученных во время операции, были разделены на 2 группы. В 1 группу вошли 15 пациентов (11 мужчин и 4 женщины) средний возраст составил 60,9±3,7 лет, во 2 группу 20 пациентов (14 мужчин и 6 женщин) средний возраст 58,6±3,6 лет. Общая характеристика пациентов, данные эхокардиографии и мультиспиральной компьютерной томографии приведены в таблицах 1 и 2. Статистически значимых различий по базовым характеристикам пациентов между группами не было.
В задачи исследования определение эффективности определенного ААП не входило, поэтому исходное назначение ААТ было на усмотрение лечащего врача согласно рекомендациям [12]. Преимущественно назначался соталол (60% в 1 группе; 45% во 2 группе) и амиодарон (27% в 1 группе и 45% в 2 группе), реже пропафенон.
В ходе операции острая ИЛВ была достигнута у всех пациентов. У всех пациентов, включенных в исследование, были определены значения ЭРП. При этом у 4 пациентов во время проведения программируемой стимуляции индуцировался пароксизм ФП. В 2 случаях он купировался при достижении изоляции ЛВ, в 2 случаях синусовый ритм был восстановлен кардиоверсией в конце операции. Интраоперационных и ранних послеоперационных осложнений не наблюдалось. Среднее время операции в группе 1 составило 111±11,2 мин, время рентгеноскопии 3,9±0,4 мин; в группе 2 — 101±10,4 и 4,0±0,46 мин, соответственно (р12=0,271; р12=0,286).
Полученные в ходе исследования данные ЭРП ЛВ и ЛП представлены в таблице 3.
В ходе наблюдения за пациентами в группе 1, где ЭРП ЛВ и ЛП составил ≥240 мс, в первые 3 мес. рецидивов не наблюдалось. В группе 2 наблюдались 7 ранних рецидивов ФП. У одного пациента потребовалась повторная аблация в связи с частыми симптомными пароксизмами ФП. При повторной аблации наблюдалась реконнекция по левым ЛВ. У одного пациента устойчивый пароксизм ФП на фоне гипертиреоза. У остальных пациентов отмечалось самостоятельное восстановление синусового ритма. При корреляционном анализе данных была выявлена статистически значимая обратно пропорциональная зависимость (-0,349; р=0,03) между значениями ЭРП и количеством рецидивов в группах. При этом анализ основных показателей пациентов (демографические, клинические и электрофизиологические) с рецидивами ФП значимых отличий по сравнению с другими пациентами внутри группы не выявил.
Таблица 1
Общая характеристика групп
Группа 1 (n=15) | Группа 2 (n=20) | p | |
Возраст, лет | 60,9±3,7 | 58,6±3,6 | 0,386 |
Пол, муж, n (%) | 11 (73%) | 14 (70%) | 0,868 |
Вес, кг | 88,2±6,3 | 88,4±6,6 | 0,605 |
Длительность последнего приступа ФП, мес. | 4,2±0,72 | 4,8±1,3 | 0,057 |
ИМ, n (%) | 4 (26%) | 1 (5%) | 0,248 |
ТИА, n (%) | 1 (6%) | 1 (5%) | 0,916 |
ГБ, n (%) | 12 (80%) | 18 (90%) | 0,617 |
СД, n (%) | 1 (6%) | 0 (0%) | 0,739 |
Примечание: ИМ — инфаркт миокарда, ТИА — транзиторная ишемическая атака, ГБ — гипертоническая болезнь, СД — сахарный диабет.
Таблица 2
Результаты инструментального исследования в группах сравнения
Группа 1 (≥240 мс) | Группа 2 (<240 мс) | p | |
Мультиспиральная компьютерная томография ЛП | |||
Краниокаудальный размер, мм | 62,9±3,5 | 60,5±3,1 | 0,505 |
Переднезадний размер, мм | 40,4±2,4 | 41,4±2,4 | 0,474 |
Медиолатеральный размер, мм | 62,8±4,8 | 60,5±3,1 | 0,351 |
Объем ЛП, мл | 129,4±9,4 | 122,2±9,5 | 0,576 |
Эхокардиография | |||
КДО, мл | 106,9±14,2 | 96,05±10,1 | 0,549 |
ФВ ЛЖ, ٪ | 48,2±5,2 | 52,6±3,3 | 0,377 |
МЖП, мм | 13,1±0,9 | 12,5±0,8 | 0,629 |
Примечание: КДО — конечно-диастолический объем, ЛП — левое предсердие, ФВ ЛЖ — фракция выброса левого желудочка, МЖП — межжелудочковая перегородка.
Таблица 3
Значения ЭРП ЛВ и ЛП и среднее значения ЭРП в группах сравнения
Показатель, мс | Группа 1 (≥240 мс) | Группа 2 (<240 мс) | p |
ЭРП ПВЛВ | 254,6±11,3 | 212,2±14 | 0,001 |
ЭРП ПНЛВ | 260±9,05 | 218,8±11,1 | 0,001 |
ЭРП ЛВЛВ | 252±12,1 | 205±10,5 | 0,001 |
ЭРП ЛНЛВ | 257,3±8,15 | 186,6±22,05 | 0,001 |
ЭРП ЛП (ушко ЛП) | 252±8,9 | 230±12,1 | 0,001 |
Среднее значение | 255±3,8 | 211±7,8 | 0,001 |
Примечание: ЛВЛВ — левая верхняя ЛВ, ЛНЛВ — левая нижняя ЛВ, ЛП — левое предсердие, ПВЛВ — правая верхняя ЛВ, ПНЛВ — правая нижняя ЛВ, ЭРП — эффективный рефрактерный период.
Обсуждение
Согласно теории множественных волн микрориентри, ФП возникает вследствие короткой длины волны возбуждения круга риентри, чему способствует уменьшение эффективного рефрактерного периода и/или замедление проведения импульса. Благодаря короткой длине волны возбуждения может образовываться большое количество волн микрориентри, что приводит к поддержанию ФП [15]. Триггерная активность чаще всего выявляется в "муфтах" ЛВ [16]. Устранение этой активности в ЛВ может эффективно купировать ФП. Таким образом, можно предположить, что увеличение ЭРП ЛП и "муфт" ЛВ будет снижать риск развития пароксизма ФП.
Кратковременное применение ААТ после катетерной аблации по поводу ФП направлено на уменьшение развития ранних послеоперационных предсердных тахиаритмий. В теории, за счет снижения количества ранних предсердных тахиаритмий прием ААТ может способствовать обратному электрическому ремоделированию ЛП и должен улучшать долгосрочный прогноз. Однако, как показали исследования, в отдаленном периоде кратковременное применение ААТ не влияет на отдаленные результаты [11][17-19]. При этом, в данных исследованиях было показано, что в каждой группе пациентов, находящихся на различных ААП, случались эпизоды раннего рецидива. В связи с этим стало очевидным, что нет оптимального препарата, который бы обладал 100%-ной эффективностью в качестве профилактики РРФП у разных людей.
Определив значения ЭРП ЛВ и ЛП, можно прогнозировать риск раннего рецидива ФП и оценить эффективность ААП у конкретного пациента, а в случае дальнейшей коррекции ААТ можно повысить эффективность профилактики ранних рецидивов ФП.
В настоящей работе не было получено рецидивов в 1 группе. Возможно, это связано с тем, что в этой группе ААП действительно уменьшали число или продолжительность рецидива аритмии. Возможно, что в данной группе увеличилась частота бессимптомных рецидивов ФП за счет снижения частоты сердечных сокращений во время пароксизма. К сожалению, у нас не было возможности имплантировать петлевые регистраторы типа "Reweal" для непрерывного мониторинга ЭКГ, что является основным ограничением исследования. Не было пациентов с электрокардиостимуляторами, где тоже можно было бы отследить количество рецидивов ФП. Вторым ограничением нашего исследования является небольшая выборка пациентов, что также могло повлиять на малое число ранних рецидивов ФП в первой группе. Несмотря на это, на контрольных follow up по данным жалоб и суточного мониторирования ЭКГ пароксизмов ФП зарегистрировано не было. Эти данные, а также наличие обратно пропорциональной зависимости между значениями ЭРП и количеством рецидивов ФП позволяет предположить, что значения ЭРП <240 мс можно рассматривать как маркер риска развития РРФП.
Заключение
Первые результаты проведенного исследования демонстрируют наличие обратно пропорциональной зависимости между величиной среднего ЭРП ЛВ и ЛП и развитием раннего рецидива ФП, что позволяет рассматривать значение ЭРП ЛВ и ЛП <240 мс в качестве вероятного предиктора риска раннего рецидива ФП. Однако этот факт требует продолжения исследования с увеличением выборки и проведением соответствующего статистического анализа по предикторной ценности обсуждаемых показателей.
Согласно результатам настоящей работы также формируется представление о том, что у пациентов с коротким ЭРП ЛП и ЛВ необходимо назначать ААТ уже в раннем послеоперационном периоде, при этом рекомендуется производить смену препарата. Если на фоне приема соталола значения ЭРП низкие, то следует заменить его на кордарон. Если на фоне приема кордарона величина ЭРП низкая, то произвести смену терапии на комбинацию препаратов (соталол + аллапинин).
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Kirchhof P, Benussi S, Kotecha D, et al. 2016 Esc Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. The Task Force for the management of atrial fibrillation of the ESC. Developed with the special contribution of the EHRA of the ESC. Endorsed by the ESO. Eur Heart J. 2016;37(38):2893-962. doi:10.1093/eurheartj/ehw210.2.
2. Haissaguerre M, Jais P, Shah DC, et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med. 1998;339(10):659-66. doi:10.1056/NEJM199809033391003.
3. Pappone C, Rosanio S, Oreto G, et al. Circumferential radiofrequency ablation of pulmonary vein ostia: A new anatomic approach for curing atrial fibrillation. Circulation. 2000; 102(21):2619-28. doi:10.1161/01.cir.102.21.2619.
4. Wilber DJ, Pappone C, Neuzil P, et al. Comparison of antiarrhythmic drug therapy and radiofrequency catheter ablation in patients with paroxysmal atrial fibrillation: a randomized controlled trial. JAMA. 2010;303(4):333-40. doi:10.1001/jama.2009.2029.
5. Julio J, Chierchia G-B, Chierchia C, et al. Regular atrial tachycardias following vein isolation for paroxysmal atrial fibrillation: a comparison between the cryoballoon and radiofrequency techniques. J Interv Card Electrophysiol. 2015;42(2):161-9. doi:10.1007/s10840-014-9961.
6. Котанова Е. С., Рзаев Ф. Г., Сичинава Н. В. и др. Отдаленные результаты изолированной электрической изоляции устьев легочных вен методом радиочастотной аблации у больных с пароксизмальной и персистентной формами фибрилляции предсердий. Анналы аритмологии. 2009;6: 78-86.
7. Calkins H, Hindricks G, Cappato R, et al. 2017 HRS/EHRA/ECAS/APHRS/SOLAECE expert consensus statement on catheter and surgical ablation of atrial fibrillation: Executive summary. Europace. 2018;20(1):157-208. doi:10.1093/europace/eux275.
8. Andrade JG, Khairy P, Verma A, et al. Early recurrence of atrial tachyarrhythmias following radiofrequency catheter ablation of atrial fibrillation. Pacing Clin Electrophysiol. 2012;35(1):106-16. doi:10.1111/j.1540-8159.2011.03256.x.
9. Alipour P, Azizi Z, Pirbaglou M, et al. Defining Blanking Period Post-Pulmonary Vein Antrum Isolation. JACC. Clin Electrophysiol. 2017;3(6):568-76. doi:10.1016/j.jacep.2017.01.006.
10. O’Donnell D, Furniss SS, Dunuwille A, et al. Delayed cure despite early recurrence after pulmonary vein isolation for atrial fibrillation. Am J Cardiol. 2003;91(1):83-5. doi:10.1016/s0002-9149(02)03005-9.
11. Kaitani K, Inoue K, Kobori A, et al. Efficacy of antiarrhythmic drugs short-term use after catheter ablation for atrial fibrillation (EAST-AF) trial. Eur Heart J. 2016;37(7):610-18. doi:10.1093/eurheartj/ehv501.
12. Hindricks G, Potpara T, Dagres N и др. Рекомендации ESC 2020 по диагностике и лечению пациентов с фибрилляцией предсердий, разработанные совместно с европейской ассоциацией кардиоторакальной хирургии (EACTS). Российский кардиологический журнал. 2021;26(9):4701. doi:10.15829/1560-4071-2021-4701.
13. Бокерия Л. А., Базаев В. А., Филатов А. Г. и др. Электрофизиологическое исследование при фибрилляции предсердий. Анналы аритмологии. 2006;6:48-58.
14. Taghji P, El Haddad M, Phlips T, et al. Evaluation of a Strategy Aiming to Enclose the Pulmonary Veins With Contiguous and Optimized Radiofrequency Lesions in Paroxysmal Atrial Fibrillation: A Pilot Study. JACC Clin Electrophysiol. 2018;4(1):99-108. doi:10.1016/j.jacep.2017.06.023.
15. Allessie M, Ausma J, Schotten U. Electrical, contractile and structural remodeling during atrial fibrillation. Cardiovascular research. 2002;54(2):230-46. doi:10.1016/s0008-6363(02)00258-4.
16. Spach MS, Barr RC, Jewett PH. Spread of excitation from the atrium into thoracic veins in human beings and dogs. Am J Cardiol. 1972;30:844-54. doi:10.1016/0002-9149(72)90009-4.
17. Roux JF, Zado E, Callans DJ, et al. Antiarrhythmics After Ablation of Atrial Fibrillation (5A Study). Circulation. 2009;120(12):1036-40. doi:10.1161/CIRCULATIONAHA.108.839639.
18. Darkner S, Chen Xu, Hansen J, et al. Recurrence of arrhythmia following short-term oral AMIOdarone after CATheter ablation for atrial fibrillation: a double-blind, randomized, placebo-controlled study (AMIO-CAT trial). Eur Heart J. 2014;35(47):3356-64. doi:10.1093/eurheartj/ehu354.
19. Тарасов А. В., Давтян К. В., Марцевич С. Ю. Cравнение эффективности антиаритмической терапии в послеоперационном периоде катетерной изоляции устьев легочных вен для профилактики ранних рецидивов предсердных тахиаритмий в рамках исследования ПРУФ. Рациональная фармакотерапия в кардиологии. 2017;13(1):18-24. doi:10.20996/1819-6446-2017-13-1-18-24.
Об авторах
А. Т. КоженовРоссия
Коженов Алимжан Тельжанович — врач сердечно-сосудистый хирург кардиохирургического отделения №3 ФГБУ «ФЦССХ им. С.Г. Суханова» МЗ РФ.
614013, Пермский край, Пермь, ул. Маршала Жукова, 35
С. Н. Азизов
Россия
Азизов Сардор Норматович — кандидат медицинских наук, врач сердечно-сосудистый хирург кардиохирургического отделения №3 ФГБУ «ФЦССХ им. С.Г. Суханова» МЗ РФ.
614013, Пермский край, Пермь, ул. Маршала Жукова, 35
О. В. Хлынова
Россия
Хлынова Ольга Витальевна — доктор медицинских наук., профессор, член-корреспондент РАН, заведующий кафедрой госпитальной терапии и кардиологии.
614990, Пермский край, Пермь Петропавловская ул., 26
Дополнительные файлы
Что известно о предмете исследования?
- Антиаритмические препараты увеличивают эффективный рефрактерный период предсердий, тем самым препятствуют поддержанию механизмов развития фибрилляции предсердий (ФП), в т.ч. и развитию рецидивов после катетерной аблации.
- Нет оптимального препарата, который бы обладал одинаково высокой эффективностью в качестве профилактики ФП у разных людей.
Что добавляют результаты исследования?
- Значение эффективного рефрактерного периода левого предсердия и легочных вен на фоне антиаритмической терапии может стать критерием для последующего выбора антиаритмического препарата с целью профилактики ранних рецидивов ФП после радиочастотной аблации.
Рецензия
Для цитирования:
Коженов А.Т., Азизов С.Н., Хлынова О.В. Взаимосвязь эффективного рефрактерного периода левого предсердия и легочных вен и развития раннего рецидива фибрилляции предсердий после радиочастотной изоляции устьев легочных вен. Первые результаты. Кардиоваскулярная терапия и профилактика. 2023;22(4):3503. https://doi.org/10.15829/1728-8800-2023-3503
For citation:
Kozhenov A.T., Azizov S.N., Khlynova O.V. Relationship between the left atrial and pulmonary vein effective refractory period and the development of early atrial fibrillation recurrence after radiofrequency pulmonary vein isolation. First results. Cardiovascular Therapy and Prevention. 2023;22(4):3503. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3503
JATS XML

























































