Перейти к:
"Primum non nocere (прежде всего — не навреди)". Клинический случай
https://doi.org/10.15829/1728-8800-2023-3625
Аннотация
Диастолическая дисфункция миокарда является важнейшим патогенетическим фактором сердечной недостаточности и вносит существенный вклад в нарушения гемодинамики, что приводит к значительному ухудшению качества жизни и прогноза пациентов. В данной статье представлен клинический случай пациентки, страдающей гипертрофической кардиомиопатией, с пароксизмальной формой фибрилляции предсердий и неоднократным осложнением приступов отеком легких на фоне резкого ухудшения диастолической функции миокарда, значительного нарастания митральной регургитации и легочной гипертензии. Учитывая безуспешность антиаритмической терапии и прогнозируемую неэффективность катетерной аблации аритмогенного очага, пациентке было запланировано проведение атриовентрикулярной деструкции, однако тактика была пересмотрена в направлении оптимизации терапии сердечной недостаточности, на фоне чего в динамике пароксизмы тахисистолии не рецидивировали.
Ключевые слова
Для цитирования:
Нефедова Д.А., Мясников Р.П., Береговская С.А. "Primum non nocere (прежде всего — не навреди)". Клинический случай. Кардиоваскулярная терапия и профилактика. 2023;22(7S):3625. https://doi.org/10.15829/1728-8800-2023-3625
For citation:
Nefedova D.A., Myasnikov R.P., Beregovskaya S.A. "Primum non nocere (First, do no harm)". Case report. Cardiovascular Therapy and Prevention. 2023;22(7S):3625. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3625
Введение
Диастолическая дисфункция миокарда является важнейшим патогенетическим фактором сердечной недостаточности (СН) как с сохраненной, так и со сниженной фракцией выброса левого желудочка и вносит существенный вклад в гемодинамические нарушения: замедление релаксации и повышенная ригидность миокарда способствуют уменьшению сердечного выброса и перегрузке объемом левого предсердия (ЛП) и легочных сосудов с развитием застойных явлений по малому кругу кровообращения [1]. В совокупности это приводит к значительному ухудшению качества жизни и прогноза пациентов с увеличением показателей заболеваемости и смертности [2].
Ниже представлен клинический пример выраженной диастолической дисфункции, являющейся патофизиологическим субстратом симптомной СН, и успешной ее коррекции на фоне максимально возможной оптимизации медикаментозной терапии.
Описание клинического случая
Пациентка В. 35 лет поступила в ФГБУ "НМИЦ терапии и профилактической медицины" в ноябре 2021г с жалобой на приступы сердцебиения при умеренной физической нагрузке, сопровождающиеся одышкой и иногда кашлем с отхождением розовой мокроты.
Из анамнеза пациентки известно, что в подростковом возрасте был верифицирован диагноз гипертрофической кардиомиопатии. С 20 лет отмечала приступы сердцебиения, по поводу чего принимала верапамил с положительным эффектом. В сентябре 2020г в связи с беременностью препарат был отменен, после чего в марте 2021г отметила учащение пароксизмов с ухудшением переносимости. В мае очередной приступ сердцебиения осложнился отеком легких, в связи с чем выполнены экстренное родоразрешение и обследование — по данным эхокардиографии и магнитно-резонансной томографии сердца с контрастированием были выявлены значимая гипертрофия, некомпактность, интрамуральный фиброз, снижение глобальной сократимости миокарда левого желудочка и расширение левых камер сердца. При последующем приеме метопролола и эплеренона пациентка не отмечала улучшения самочувствия, в июне повторно госпитализирована с отеком легких на фоне пароксизма нерегулярной ширококомплексной тахикардии, купированного амиодароном. В июле впервые поступила в клинику центра, где выявлена отрицательная эхокардиографическая динамика. Учитывая неверифицированные нарушения ритма, было проведено электрофизиологическое исследование, по результатам которого укрепилось предположение о фибрилляции предсердий (ФП), и, принимая во внимание умеренный риск внезапной смерти и выраженный фиброз миокарда, выполнена имплантация кардиовертера-дефибриллятора. Также инициирована терапия амиодароном для контроля нарушений ритма, оказавшаяся неэффективной: приступы сердцебиения сопровождались неоднократной дефибрилляцией, в октябре пароксизм вновь осложнился отеком легких, в связи с чем пациентка была повторно госпитализирована для проведения аблации атриовентрикулярного соединения и стабилизации гемодинамики на фоне приступов.
В данной клинической ситуации стояла задача уменьшить частоту и продолжительность пароксизмов, предотвратить их осложнение отеком легких и улучшить качество жизни пациентки. Первая стратегия — терапия амиодароном, не имевшая клинического эффекта. Вторая тактика — аблация очага ФП — малоперспективна из-за значимой дилатации ЛП. Оставалась стратегия атриовентрикулярной деструкции, однако тактика была пересмотрена, учитывая молодой возраст пациентки и ее последующую зависимость от кардиостимуляции. Принимая во внимание значимое нарушение гемодинамики при нагрузке и приступах аритмии в виде рестриктивной диастолической дисфункции, крайне тяжелой митральной регургитации на фоне передне-систолического движения створок митрального клапана и легочной гипертензии с развитием отека легких, была оптимизирована терапия СН: увеличена доза валсартана/сакубитрила до 200 мг/сут. и добавлен дапаглифлозин, на фоне чего при осмотре через полгода пароксизмы тахисистолии не рецидивировали (рисунок 1).
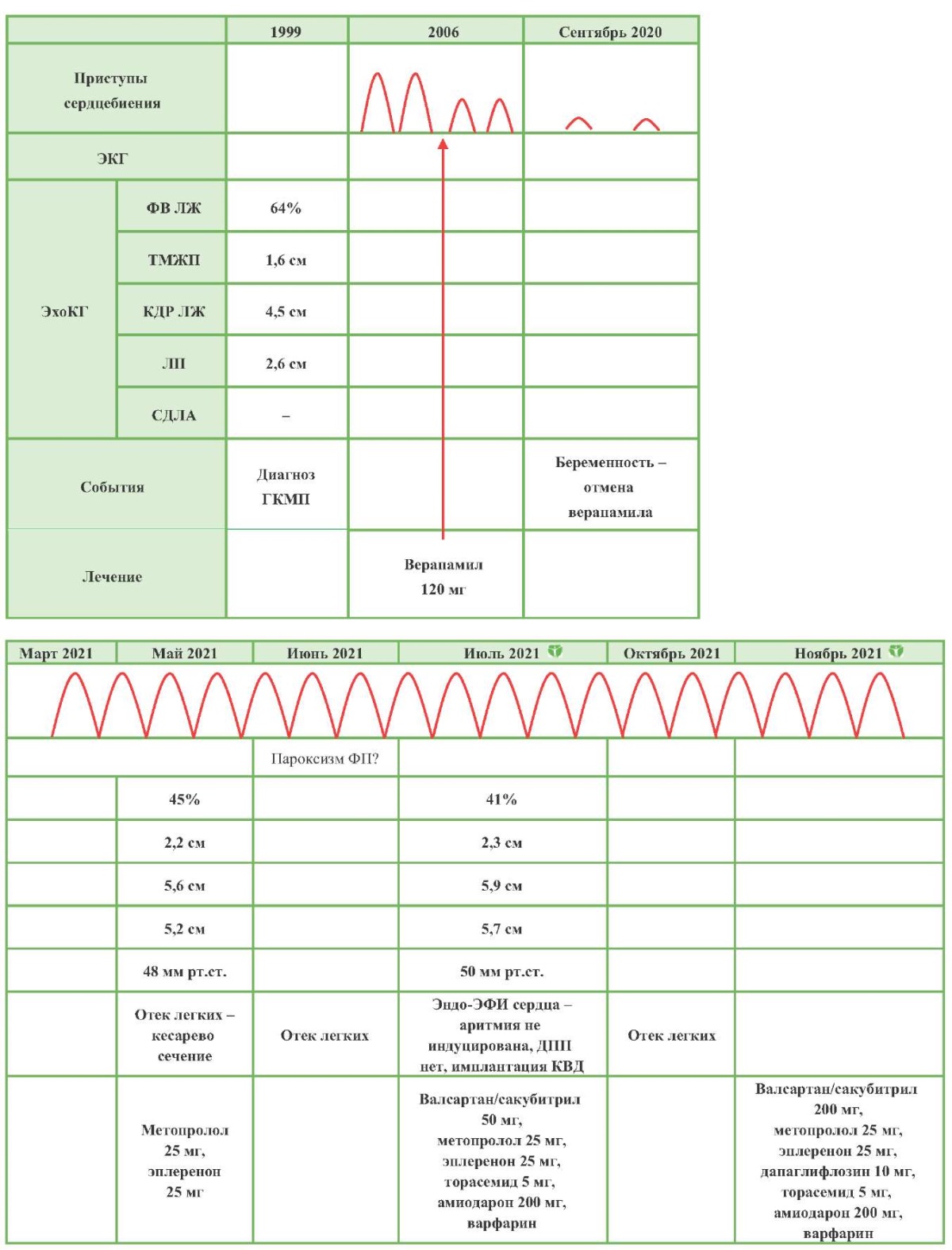
Рис. 1 Временная шкала течения заболевания.
Примечание: ГКМП — гипертрофическая кардиомиопатия, ДПП — дополнительные проводящие пути, КВД — кардиовертер-дефибриллятор, КДР ЛЖ — конечно-диастолический размер левого желудочка, ЛП — левое предсердие, СДЛА — систолическое давление в легочной артерии, ТМЖП — толщина межжелудочковой перегородки, ФВ ЛЖ — фракция выброса левого желудочка, ФП — фибрилляция предсердий, ЭКГ — электрокардиография, эндо-ЭФИ — внутрисердечное электрофизиологическое исследование, ЭхоКГ — эхокардиография.
Обсуждение
Избранная тактика ведения пациентки была нацелена в первую очередь на улучшение диастолической функции миокарда и, следовательно, предупреждение значимой объемной перегрузки ЛП и малого круга кровообращения при нагрузке и пароксизмах ФП, что сопровождалось развитием отека легких. В последние годы были проведены многочисленные исследования и опубликован ряд работ, свидетельствующих о способности как комбинации валсартана/сакубитрила [3][4], так и ингибиторов натрий-глюкозного котранспортера 2 типа [5][6] подавлять синтез провоспалительных цитокинов, угнетать окислительный стресс, восстанавливать эндотелиальную функцию, ионный и энергетический гомеостаз кардиомиоцитов и фосфорилирование саркомерных белков, что нормализует механизм мышечного сокращения и приводит к уменьшению выраженности гипертрофии, интрамурального фиброза и ригидности миокарда с улучшением диастолической функции.
Заключение
Таким образом, данное клиническое наблюдение демонстрирует важность полноценной терапии СН, которая позволяет существенно улучшить качество жизни и отдаленный прогноз пациентов.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Chand V. Understanding diastolic dysfunction. JAAPA. 2006; 19(3):37-42. doi:10.1097/01720610-200603000-00006.
2. Deswal A. Diastolic dysfunction and diastolic heart failure: mechanisms and epidemiology. Curr Cardiol Rep. 2005;7(3):178-83. doi:10.1007/s11886-005-0074-7.
3. Aroor AR, Mummidi S, Lopez-Alvarenga JC, et al. Sacubitril/ valsartan inhibits obesity-associated diastolic dysfunction through suppression of ventricular-vascular stiffness. Cardiovasc Diabetol. 2021;20(1):80. doi:10.1186/s12933-021-01270-1.
4. Sung YL, Lin TT, Syu JY, et al. Reverse electromechanical modelling of diastolic dysfunction in spontaneous hypertensive rat after sacubitril/valsartan therapy. ESC Heart Fail. 2020;7(6):4040-50. doi:10.1002/ehf2.13013.
5. Dyck JRB, Sossalla S, Hamdani N, et al. Cardiac mechanisms of the beneficial effects of SGLT2 inhibitors in heart failure: Evidence for potential off-target effects. J Mol Cell Cardiol. 2022;167:17-31. doi:10.1016/j.yjmcc.2022.03.005.
6. Santos-Gallego CG, Requena-Ibanez JA, San Antonio R, et al. Empagliflozin Ameliorates Diastolic Dysfunction and Left Ventricular Fibrosis/Stiffness in Nondiabetic Heart Failure: A Multimodality Study. JACC Cardiovasc Imaging. 2021;14(2):393-407. doi:10.1016/j.jcmg.2020.07.042.
Об авторах
Д. А. НефедоваРоссия
Ординатор 2 года по специальности "кардиология".
Москва
Р. П. Мясников
Россия
Врач-кардиолог, кандидат медицинских наук, ведущий научный сотрудник отдела клинической кардиологии.
Москва
С. А. Береговская
Россия
Врач-кардиолог, заведующий кардиологическим отделением.
Москва
Рецензия
Для цитирования:
Нефедова Д.А., Мясников Р.П., Береговская С.А. "Primum non nocere (прежде всего — не навреди)". Клинический случай. Кардиоваскулярная терапия и профилактика. 2023;22(7S):3625. https://doi.org/10.15829/1728-8800-2023-3625
For citation:
Nefedova D.A., Myasnikov R.P., Beregovskaya S.A. "Primum non nocere (First, do no harm)". Case report. Cardiovascular Therapy and Prevention. 2023;22(7S):3625. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3625






















































