Перейти к:
Нарушения липидного обмена у больных с артериальной гипертензией и сахарным диабетом: механизмы развития и современные возможности лечения
https://doi.org/10.15829/1728-8800-2023-3656
EDN: PWDBPY
Аннотация
В статье представлены основные механизмы развития нарушений липидного обмена и эндотелиальной дисфункции у больных артериальной гипертензией (АГ) и сахарным диабетом (СД) 2 типа, и их роль в возникновении сердечно-сосудистых осложнений. Рассматриваются современные подходы к лечению АГ и дислипидемии у лиц с СД 2 типа с позиции последних клинических рекомендаций, фокус внимания на фиксированные комбинации лекарственных препаратов, как средства комплексного подхода в управлении факторами риска у коморбидных больных. Приводятся данные об эффективности и безопасности приема фиксированной комбинации лизиноприла, амлодипина и розувастатина у больных АГ и СД 2 типа.
Ключевые слова
Для цитирования:
Подзолков В.И., Тарзиманова А.И., Абрамова А.А., Ветлужская М.В., Медведев И.Д., Лория И.Ж. Нарушения липидного обмена у больных с артериальной гипертензией и сахарным диабетом: механизмы развития и современные возможности лечения. Кардиоваскулярная терапия и профилактика. 2023;22(8):3656. https://doi.org/10.15829/1728-8800-2023-3656. EDN: PWDBPY
For citation:
Podzolkov V.I., Tarzimanova A.I., Abramova A.A., Vetluzhskaya M.V., Medvedev I.D., Loria I.Zh. Lipid metabolism disorders in patients with hypertension and diabetes mellitus: development and current treatment options. Cardiovascular Therapy and Prevention. 2023;22(8):3656. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3656. EDN: PWDBPY
Введение
Сердечно-сосудистые заболевания (ССЗ) остаются ведущей причиной смерти населения во всем мире. Одним из наиболее распространенных ССЗ является артериальная гипертензия (АГ). По результатам крупнейшего исследования, проведенного под эгидой Всемирной организации здравоохранения и Имперского колледжа Лондона, за последние 30 лет отмечается 2-кратное увеличение количества больных АГ в возрасте 30-79 лет: с 650 млн до 1,28 млрд человек [1]. В исследовании ЭССЕ-РФ2 (Эпидемиология сердечно-сосудистых заболеваний и их факторов риска в регионах Российской Федерации. Второе исследование) было показано, что распространенность АГ в России составляет 44,2%, а в ряде регионов достигает 50,2% [2].
Сахарный диабет (СД) является одним из наиболее значимых факторов риска развития сердечно-сосудистых осложнений (ССО). Согласно данным Международной федерации диабета (International Diabetes Federation, IDF) за последние несколько десятилетий распространенность СД среди взрослого населения увеличилась более чем в 3 раза: со 151 до 537 млн человек. К 2030г прогнозируется рост заболеваемости СД до 643 млн, а к 2045г данный показатель достигнет ошеломляющих значений — 783 млн человек. Более 90% больных страдают СД 2 типа1. По данным Федерального регистра СД на январь 2021г численность больных СД в РФ составляет 4799552 человека, из которых СД 1 типа диагностирован у 5,5%, СД 2 типа у 92,5%, другие типы СД — у 2,0% пациентов [3].
Сочетание АГ и СД часто сопровождается развитием дислипидемии (ДЛП), что существенно увеличивает риск развития ССО и смерти от всех причин [4]. По данным исследования ЭССЕ-РФ и национального регистра АГ распространенность СД среди лиц с АГ выше, чем в общей популяции и составляет 13,8 и 8,7%, соответственно [5, 6]. В исследовании Haile K, et al. распространенность ДЛП у лиц с СД 2 типа составила 68,1%, а вероятность развития ДЛП у больных АГ и СД 2 типа была в 2,65 раза выше, чем у лиц без СД [7].
Несмотря на большое количество современных антигипертензивных и гиполипидемических лекарственных препаратов, лишь небольшая часть пациентов с АГ и СД лечится эффективно. Повышение АД тесно связано с наличием инсулинорезистентности (ИР) и многообразными метаболическими нарушениями. В ряде случаев препараты могут не только негативно влиять на метаболизм углеводов, липидов и чувствительность к инсулину, но и вызывать новые случаи СД. Одним из основных требований, предъявляемых к антигипертензивным препаратам для лечения больных АГ и СД, является их метаболическая нейтральность. Учитывая важную роль СД в сердечно-сосудистой заболеваемости и смертности, наличие антигипертензивных препаратов, способных уменьшать ИР и корректировать ДЛП имеет высокую клиническую и прогностическую ценность.
Цель обзора — проанализировать современные данные об эффективности фиксированной комбинации лизиноприла, амлодипина и розувастатина в лечении пациентов с АГ и СД.
Методологические подходы
Поиск литературных источников проводился на русском и английском языках в системах индексирования PubMed, Google Scholar, Web of Science, Cyberleninca. В качестве поисковых запросов использовались следующие ключевые слова и словосочетания: артериальная гипертензия (arterial hypertension), сахарный диабет (diabetes mellitus), дислипидемия (dyslipidemia), эндотелиальная дисфункция (endothelial dysfunction), фиксированная комбинация (fixed-dose combination), лизиноприл (lizinopril), амлодипин (amlodipine), розувастатин (rozuvastatin). Поиск проводили по заголовкам и ключевым словам. Глубина поиска составила 10 лет за исключением более ранних фундаментальных работ, посвященных изучению механизмов лекарственных препаратов, а также крупных рандомизированных исследований. Настоящий обзор описывает обобщенные и систематизированные данные 43 литературных источников.
Результаты
Механизмы развития ДЛП и эндотелиальной дисфункции у пациентов с АГ и СД
ИР у лиц с СД 2 типа сопряжена с нарушениями липидного обмена, в т.ч. с выраженным повышением уровня липидов в крови после приема пищи (постпрандиальная гиперлипидемия) [8]. СД 2 типа характеризуется возникновением "атерогенной триады" [9], которая включает в себя высокий уровень триглицеридов (ТГ), низкий уровень холестерина (ХС) липопротеинов высокой плотности (ЛВП) и наличие мелких плотных частиц липопротеинов низкой плотности (ЛНП).
Нарушения постпрандиальной регуляции обмена липидов у больных СД 2 типа приводят к увеличению богатых ТГ атерогеннных ремнантных липопротеинов — мелких плотных частиц ЛНП, которые легко проникают через эндотелий в сосудистую стенку. Гипергликемия, в свою очередь, способствует большей их проницаемости в сосуды за счет плохого распознавания этих частиц рецепторами печени и медленного выведения из кровотока. Повышенная окисляемость ЛНП усугубляется в условиях окислительного стресса, характерного для СД 2 типа, что ускоряет процессы атерогенеза [10][11].
Следует отметить важную роль почек в регуляции метаболизма липидов и липопротеинов [12]. Развитие диабетической нефропатии приводит к нарушению фильтрационной функции почек и к снижению реабсорбции ЛВП за счет уменьшения экспрессии компонентов эндоцитарного аппарата канальцев [13]. Повышенное выведение ЛВП с мочой у лиц с СД 2 типа способствует снижению их уровня в крови [14].
Гипергликемия является основной причиной развития эндотелиальной дисфункции у лиц СД 2 типа и приводит к возникновению ранних микро- и макрососудистых осложнений. В условиях гипергликемии активируются полиоловый и гексозаминовый пути метаболизма глюкозы. В ходе первого пути расходуется кофермент NADPH (Nicotinamide Adenine Dinucleotide Phosphate), возникающий дефицит которого обуславливает недостаточность системы антиоксидантной защиты, активацию свободнорадикального окисления, снижение продукции оксида азота (NO) [15]. В ходе второго пути меняется активность транскрипционных факторов, что способствует выработке провоспалительных цитокинов [16]. При гипергликемии активируется протеинкиназа С, которая индуцирует множественные внутриклеточные сигнальные механизмы, вызывающие увеличение проницаемости сосудистой стенки, нарушение эндотелий-зависимой релаксации сосудов и активации окислительного стресса. Протеинкиназа С, стимулируя увеличение продукции VEGF (Vascular endothelial growth factor, фактор роста эндотелия сосудов), эпидермального фактора роста и TGF-β (Transforming growth factor beta, трансформирующий фактор роста-β), способствует повышению ангиогенной активности эндотелиоцитов, приводя к структурному ремоделированию микроциркуляторного русла [17].
На сегодняшний день дисфункция эндотелия рассматривается как универсальное неспецифическое звено в патогенезе заболеваний сердечно-сосудистой системы [18]. Воздействие повреждающих факторов, таких как гиперхолестеринемия, ожирение, АГ, ИР, гомоцистеинемия, курение приводят к возникновению эндотелиальной дисфункции [19].
Эндотелий сосудов обладает множеством функций: паракринной, эндокринной и аутокринной, необходимыми для поддержания гомеостаза сосудов в физиологических условиях [20]. Эндотелиоциты осуществляют контроль пролиферации клеток и взаимодействий между клетками крови и стенкой сосуда, регулируют проницаемость сосудов, участвуют в иммунных реакциях. Эндотелий играет ключевую роль в регуляции сосудистого тонуса, воспалительных реакциях, контроле тканевого кровотока, поддержании реологических свойств крови. Регулируя сосудистый гомеостаз, эндотелий поддерживает баланс между вазодилатацией и вазоконстрикцией, ингибированием и стимулированием миграции и пролиферации гладкомышечных клеток, фибринолизом и тромбообразованием, участвует в регуляции адгезии и агрегации тромбоцитов [20-23].
Сочетание АГ, СД 2 типа и ДЛП приводит к генерализованной дисфункции сосудистого эндотелия, адгезии циркулирующих моноцитов и повышенной склонности к тромбообразованию, что требует особого подхода к медикаментозной терапии, направленной на разные звенья патогенеза возникновения ССЗ.
Современные принципы лечения АГ и ДЛП у пациентов с СД
Согласно современным клиническим рекомендациям Российского медицинского общества по артериальной гипертензии (РМОАГ), основной целью лечения больных АГ с СД является снижение риска развития ССО и смерти от них [4]. Для реализации поставленной цели, наряду с проводимой антигипертензивной терапией с достижением целевых значений артериального давления (АД), необходима коррекция имеющихся модифицируемых факторов риска ССЗ.
Многочисленные исследования подтверждают важность контроля АД в профилактике возникновения ССО. В метаанализе Ettehad D, включавшем несколько сотен тысяч пациентов, было показано, что снижение систолического АД (САД) на 10 мм рт.ст. приводит к уменьшению риска "больших" кардиоваскулярных событий на 20%, ишемической болезни сердца на 17%, инсульта на 27%, сердечной недостаточности на 28%, и смерти от всех причин на 13% [24].
Контроль уровня АД у пациентов с СД предотвращает развитие макро- и микрососудистых осложнений, при этом достижение целевых цифр АД имеет бóльшую пользу в отношении снижения сердечно-сосудистого риска и терминальной почечной недостаточности, чем у пациентов без СД [25]. Наличие СД 2 типа у лиц с АГ сразу позволяет отнести их к категории высокого и очень высокого риска развития ССЗ и их осложнений, что требует незамедлительного назначения антигипертензивной терапии [4].
Согласно клиническим рекомендациям Российского кардиологического общества по лечению АГ у взрослых (2020г), целевые цифры АД у больных АГ в сочетании с СД должны составлять 120-129/70-79 мм рт.ст. при условии хорошей переносимости, а для пациентов >65 лет — 130-139/70-79 мм рт.ст. [26]. В качестве препаратов первой линии данной категории лиц рекомендуется комбинированная терапия, включающая блокатор ренин-ангиотензин-альдостероновой системы (РААС) с блокатором кальциевых каналов или тиазидным/тиазидоподобным диуретиком [4][26].
Блокаторы РААС (ингибитор ангиотензинпревращающего фермента (иАПФ) или блокатор рецепторов ангиотензина (АТ) II (БРА)), наряду с антигипертензивным эффектом, являясь метаболически нейтральными, не оказывают негативного воздействия на углеводный и липидный обмен, а также снижают ИР периферических тканей, что крайне важно для больных СД 2 типа. ИАПФ и БРА обладают и нефропротективным действием, которое реализуется вне зависимости от антигипертензивного эффекта [27].
Антагонисты кальция также являются препаратами первого ряда, они не влияют на углеводный, липидный и пуриновый обмен, что позволяет их использовать у пациентов с СД 2 типа. Антагонисты кальция, обладая нефропротективным эффектом, снижают выраженность микроальбуминурии, замедляют прогрессирование диабетической нефропатии [27].
Согласно современным рекомендациям, пациентам с АГ и СД предпочтительна комбинированная терапия блокаторами РААС с блокаторами кальциевых каналов, которые являются метаболически нейтральными и наряду с антигипертензивным действием, обладают нефро- и ангиопротективным эффектами. Старт терапии АГ рекомендовано проводить с допустимой комбинации двух лекарственных препаратов, преимущественно в одной таблетке, с учетом функционального состояния почек [27].
Одним из ключевых механизмов снижения сердечно-сосудистого риска у больных СД является лечение ДЛП. Согласно "Алгоритмам специализированной медицинской помощи больным сахарным диабетом", целевые цифры ХС ЛНП у пациентов с СД высокого риска развития ССО составляют <1,8 ммоль/л, а у лиц с СД очень высокого риска ССО <1,4 ммоль/л. При наличии перенесенного повторного сосудистого события в течение 2-х лет необходимо стремиться к еще более низким цифрам ХС ЛНП <1,0 ммоль/л [27].
Препаратами первого ряда в лечении ДЛП у больных СД являются ингибиторы 3-гидрокси-3-метилглютарил-Коэнзим А (ГМК-КоА) редуктазы (статины), назначение которых ассоциировано со снижением сердечно-сосудистой смертности и снижением количества сердечно-сосудистых катастроф. Наряду с гиполипидемическим эффектом, статины обладают антигипертензивным эффектом, что было показано в метаанализе Briasoulis A, et al., (2013) [28]. Влияние терапии статинами на уровень АД отмечалось в исследованиях с участием пациентов с АГ и в исследованиях с участием пациентов с СД и гиперхолестеринемией. Так, в группе больных СД и гиперхолестеринемией наблюдался более выраженный антигипертензивный эффект статинов: снижение САД на 6,5 мм рт.ст. (95% доверительный интервал: от -10,93 до -2,08; р=0,004) и диастолического АД (ДАД) на 4 мм рт.ст. (95% доверительный интервал: от -6,26 до -1,74; р=0,0005) [28]. Крайне важны плейотропные эффекты статинов: улучшение эндотелий-зависимой вазодилатации, повышение биодоступности NO и снижении уровня эндотелина-1 [29], подавление экспрессии рецепторов АТ 1 типа, снижение экспрессии субъединицы NAD(P)H-оксидазы p22phox, и высвобождение свободных радикалов в сосудистой стенке [30]. Статины ингибируют некоторые активируемые АТ II внутриклеточные сигнальные системы, замедляют индуцированное гипертонией повреждение сосудов [31], уменьшают жесткость крупных артерий и улучшают системную артериальную растяжимость [32]. Положительный эффект статинов на сосудистую систему проявляется сразу после введения, и не зависит от их гиполипидемического действия [33].
При недостижении целевого уровня ХС ЛНП у лиц с СД очень высокого риска ССО на фоне максимально переносимых доз статинов рекомендована комбинированная терапия статинами с эзетимибом [27].
Американская ассоциация сердца (2022 г.) разработала согласительный документ "Комплексное управление кардиоваскулярным риском у взрослых лиц с СД 2 типа", где наряду с общеизвестными модифицированными факторами риска ССЗ, медикаментозной терапией говорилось о важности социальных детерминант здоровья и равных возможностей для поддержания здоровья в континууме лечения СД и ССЗ (рисунок 1). К социальным детерминантам относятся уровень и качество образования, место и среда обитания, качество и доступность медицинской помощи и лекарственного обеспечения, социальный и общественный контент и экономическая стабильность. Социальные детерминанты и физические показатели здоровья влияют на уровень здоровья не только индивидуума, но и популяции в целом, что является актуальной задачей здравоохранения [34].
Наличие у больного нескольких заболеваний приводит к полипрагмазии, т.е. необходимости приема большого количество лекарственных препаратов. Известно, что по мере роста количества препаратов, приверженность к терапии падает. Согласно данным исследования Ghembaza MA, et al., наличие сопутствующей патологии у больных АГ и количество назначенных препаратов являются двумя факторами, связанными с плохой приверженностью к лечению, только 35,5% имели высокую приверженность к терапии [35].
По результатам метаанализа Abegaz TM, et al. (n=12628), в котором изучалась приверженность к антигипертензивной терапии у лиц с АГ с помощью шкалы MMAS-8 (Morisky Medication Adherence Scale-8), 45,2% больных имели низкую приверженность. При сравнении групп с контролируемой и неконтролируемой АГ более низкая приверженность наблюдалась в группе лиц с неконтролируемой АГ — 59,7 vs 83,7%, соответственно [36].
Существует много факторов, влияющих на приверженность больного к проводимой терапии [37], прием фиксированных комбинаций позволяет уменьшить количество принимаемых лекарственных средств, повысить эффективность проводимой терапии и уменьшить финансовые затраты на лечение.
Преимущества фиксированных комбинаций в лечении АГ и увеличение приверженности было продемонстрировано в рандомизированном клиническом исследовании ACCOMPLISH (Аvoiding Сardiovascular Events in Сombination therapy in Patients Living with Systolic Hypertension) у больных АГ (n=11506) c высоким риском развития ССО, который определялся наличием ССЗ или болезнями почек. Сравнивалась эффективность 2-х разных фиксированных комбинаций: иАПФ (беназеприла) с антагонистом кальция (амлодипином) и иАПФ (беназеприла) с гидрохлоротиазидом. На момент включения в исследование 97,2% больных получали антигипертензивную терапию, 74,7% из которых − комбинированную терапию двумя и более препаратами. Контроль АД <140/90 мм рт.ст. наблюдался только у 37,3%. Прием фиксированных комбинаций позволил улучшить контроль АД, который достиг 75,4% в группе беназеприла с амлодипином и 72,4% в группе беназеприла и гидрохлоротиазида. Отмечалась эффективность комбинации иАПФ и антагониста кальция в снижении риска развития событий первичной конечной точки на 20% и скорости прогрессирования хронической болезни почек. В группе беназеприла и амлодипина частота возникновения хронической болезни почек составила 2,0%, а в группе беназеприла и гидрохлоротиазида — 3,7% [38][39].
Больным АГ, СД 2 типа и ДЛП наряду с приемом эффективной комбинации иАПФ с антагонистом кальция, необходимо назначение гиполипидемической терапии, направленной на снижение частоты ССЗ и их ССО. Единственной фиксированной комбинацией иАПФ, антагониста кальция и статина в России является комбинация лизиноприла, амлодипина и розувастатина (препарат Эквамер, "Гедеон Рихтер", Венгрия), которая продемонстрировала свою эффективность в различных исследованиях [40][41]. Существуют несколько фиксированных комбинаций препарата Эквамер: лизиноприл 10 и 20 мг, амлодипин 5 и 10 мг, розувастатин 10 и 20 мг.
Каждая молекула, входящая в состав препарата — лизиноприл, амлодипин, розувастатин, обладая антигипертензивным, ангиопротективным и нефропротективным эффектами, потенцирует влияние друг друга, уменьшает проявления эндотелиальной дисфункции2 (рисунок 2), приводит к уменьшению риска развития ССО. Разные пути метаболизма компонентов комбинации, обуславливают низкую вероятность лекарственных взаимодействий, что служит дополнительным фактором безопасного использования препарата.
Метаболическая нейтральность фиксированной комбинации лизиноприла, амлодипина и розувастатина была продемонстрирована в исследовании ТРИУМВИРАТ (Снижение риска развития сердечно-сосудистых осложнений у больных артериальной гипертонией с помощью трехкомпонентной комбинации антигипертензивных и липидснижающих препаратов). Результаты исследования показали высокую антигипертензивную эффективность фиксированной комбинации — 80% больных достигли целевых значений АД. Прием розувастатина в течение 3 мес. значительно улучшил показатели липидного профиля: терапия в дозе 5 мг привела к снижению уровня ХС ЛНП на 32%, в дозе 10 мг — на 38%, 20 мг — на 50%, 40 мг — на 52%. Фиксированная комбинация продемонстрировала хороший профиль безопасности и отсутствие риска возникновения СД, а также значительное снижение риска ССО за короткий период времени [42].
В исследовании Недогоды С. В. и др. (2018) изучались возможности фиксированной комбинации лизиноприла, амлодипина и розувастатина в достижении дополнительной ангиопротекции у пациентов с АГ в возрасте 18-65 лет, получавших ранее двойную антигипертензивную терапию. Перевод на фиксированную комбинацию позволил снизить среднедневные показатели САД на 16,1% и ДАД на 21,8%, средненочные показатели САД на 14,5% и ДАД на 19,1% (р<0,05), и сопровождался достоверным снижением вариабельности АД. Целевой уровень АД <140/90 мм рт.ст. на фоне приема фиксированной комбинации удалось достичь 73,2% лиц с АГ, 23,2% из которых смогли достичь снижения АД <130/80 мм рт.ст. При оценке показателей состояния сосудистой стенки у лиц с АГ после перехода на фиксированную комбинацию лизиноприла, амлодипина и розувастатина отмечалось достоверное снижение скорости пульсовой волны на 14,7%, индекса аугментации на 14,4% и центрального давления в аорте на 8,1%, что позволило сократить сосудистый возраст на 10,2% (р<0,05).
Терапия препаратом Эквамер сопровождалась улучшением состояния липидного обмена — 71,4% достигли целевых значений ХС ЛНП <2,5 ммоль/л, улучшением состояния углеводного обмена (снижение уровня инсулина на 11,1% и индекса ИР НОМА-IR на 22,9%), а также позитивно влияла на уровень ключевых адипокинов (снижение среднего уровня лептина на 10,7%, повышение уровня адипонектина на 9,9%) и низкоинтенсивное неинфекционное воспаление (снижение уровня высокочувствительного С-реактивного белка на 11,8% (р<0,05) [43].
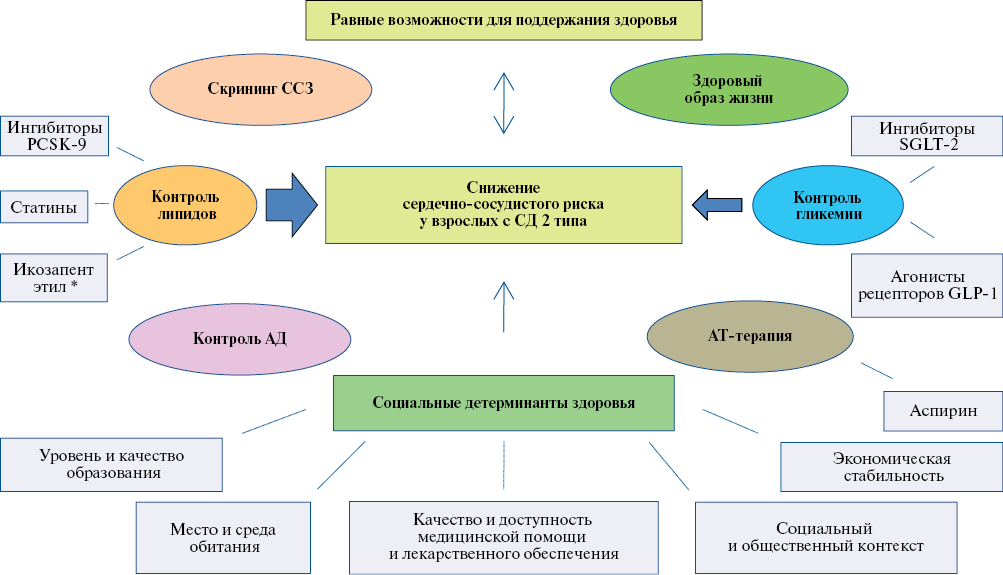
Рис. 1 Комплексное управление факторами риска ССЗ у взрослых с СД 2 типа (адаптировано Joseph JJ, et al, 2022 [34]).
Примечание: PSCK-9 — пропротеиновая конвертаза субтилизин-кексинового типа 9, SGLT-2 — натрий-глюкозный котранспортер 2 типа, GLP-1 — глюкагоноподобный пептид 1, АД — артериальное давление, АТ-терапия — антитромбоцитарная терапия, Икозапент этил — этиловый эфир эйкозапентаеновой кислоты, СД — сахарный диабет, ССЗ — сердечно-сосудистые заболевания, * — не зарегистрирован
в Российской Федерации.
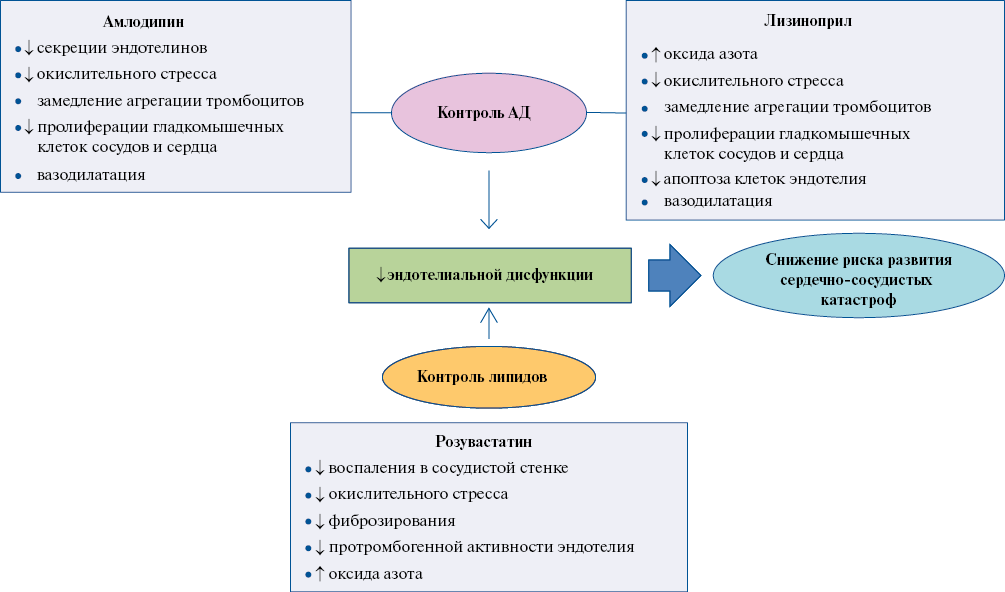
Рис. 2 Механизм ангиопротективного эффекта фиксированной комбинации амлодипин, лизиноприл и розувастатин.
Примечание: АД — артериальное давление.
Заключение
За последние годы стратегия лечения высокого АД претерпела принципиальные изменения. Современные антигипертензивные препараты должны, в первую очередь, снижать риск ССО и смерти от них, эффективно контролировать АД и улучшать состояние органов-мишеней. Применение 3-компонентной фиксированной комбинации лизиноприла, амлодипина и розувастатина у больных АГ и СД в сочетании с ДЛП позволяет эффективно контролировать уровень АД и липидов плазмы крови. Метаболическая нейтральность препарата Эквамер и наличие плейотропной активности обеспечивают органопротекцию на различных этапах сердечно-сосудистого континуума, что позволяет существенно улучшить прогноз пациентов.
Отношения и деятельность. Публикация данной статьи поддержана компанией Гедеон Рихтер, что никоим образом не повлияло на собственное мнение авторов.
1 https://diabetesatlas.org/idfawp/resource-files/2021/07/IDF_Atlas_10th_Edition_2021.pdf.
2 https://www.gedeonrichter.com/ru/-/media/sites/ru/russian-products/files/productinstruction_b5972fde-1429-4635-858a-6a8b1d2b9a06_pdf.pdf?rev=291b9d738514429e809d9c0f0f3615ae&hash=D4A593815868F86FAC9254BEBA2C8E6B.
Список литературы
1. NCD Risk Factor Collaboration (NCD-RisC). Worldwide trends in hypertension prevalence and progress in treatment and control from 1990 to 2019: a pooled analysis of 1201 population-representative studies with 104 million participants. Lancet. 2021;398(10304):957-80. doi:10.1016/S0140-6736(21)01330-1.
2. Баланова Ю. А., Шальнова С. А., Имаева А. Э. и др. от имени участников исследования ЭССЕ-РФ-2. Распространенность артериальной гипертонии, охват лечением и его эффективность в Российской Федерации (данные наблюдательного исследования ЭССЕ-РФ-2). Рациональная Фармакотерапия в Кардиологии 2019;15(4):450-66. doi:10.20996/1819-6446-2019-15-4-450-466.
3. Дедов И. И., Шестакова М. В., Викулова О. К. и др. Эпидемиологические характеристики сахарного диабета в Российской Федерации: клинико-статистический анализ по данным регистра сахарного диабета на 01.01.2021. Сахарный диабет. 2021;24(3):204-21. doi:10.14341/DM12759.
4. РМОАГ. Рекомендации по ведению больных артериальной гипертонией с метаболическими нарушениями и сахарным диабетом 2-го типа. Системные гипертензии. 2020;17(1):7-45. doi:10.26442/2075082X.2020.1.200051.
5. Жернакова Ю. В., Чазова И. Е., Ощепкова Е. В. и др. Распространенность сахарного диабета в популяции больных артериальной гипертонией. По данным исследования ЭССЕ-РФ. Системные гипертензии. 2018;15(1):56-62. doi:10.26442/2075-082X_15.1.56-62.
6. Ощепкова Е. В., Лазарева Н. В., Чазова И. Е. Оценка качества обследования больных артериальной гипертонией в первичном звене здравоохранения (по данным российского Регистра артериальной гипертонии). Системные гипертензии. 2017;14(2):29-34. EDN ZRESKF.
7. Haile K, Timerga A. Dyslipidemia and Its Associated Risk Factors Among Adult Type-2 Diabetic Patients at Jimma University Medical Center, Jimma, Southwest Ethiopia. Diabetes Metab Syndr Obes. 2020;13:4589-97. doi:10.2147/DMSO.S283171.
8. Pastromas S, Terzi AB, Tousoulis D, Koulouris S. Postprandial lipemia: an under-recognized atherogenic factor in patients with diabetes mellitus. Int J Cardiol. 2008;126(1):3-12. doi:10.1016/j.ijcard.2007.04.172.
9. Сергиенко И. В., Аншелес А. А., Халимов Ю. Ш. и др. Кардиологические аспекты сахарного диабета 2 типа. Москва: Издательство "Перо", 2018. 68 с. ISBN: 978-5-00122-645-1.
10. Krentz AJ. Lipoprotein abnormalities and their consequences for patients with type 2 diabetes. Diabetes Obes Metab. 2003;5 Suppl 1:S19-27. doi:10.1046/j.1462-8902.2003.0310.x.
11. Musunuru K. Atherogenic dyslipidemia: cardiovascular risk and dietary intervention. Lipids. 2010;45(10):907-14. doi:10.1007/s11745-010-3408-1.
12. Yang H, Fogo AB, Kon V. Kidneys: key modulators of high-density lipoprotein levels and function. Curr Opin Nephrol Hypertens. 2016;25(3):174-9. doi:10.1097/MNH.0000000000000217.
13. Figueira MF, Castiglione RC, de Lemos Barbosa CM, et al. Diabetic rats present higher urinary loss of proteins and lower renal expression of megalin, cubilin, ClC-5, and CFTR. Physiol Rep. 2017;5(13):e13335. doi:10.14814/phy2.13335.
14. Sniderman AD, Scantlebury T, Cianflone K. Hypertriglyceridemic hyperapob: the unappreciated atherogenic dyslipoproteinemia in type 2 diabetes mellitus. Ann Intern Med. 2001;135(6):447-59. doi:10.7326/0003-4819-135-6-200109180-00014.
15. Dhananjayan R, Koundinya KS, Malati T, et al. Endothelial Dysfunction in Type 2 Diabetes Mellitus. Indian J Clin Biochem. 2016;31(4):372-9. doi:10.1007/s12291-015-0516-y.
16. Goldberg HJ, Whiteside CI, Fantus IG. The hexosamine pathway regulates the plasminogen activator inhibitor-1 gene promoter and sp1 transcriptional activation through protein kinase С-beta I and -delta. J Biol Chem. 2002;277:33833-41. doi:10.1074/jbc.M112331200.
17. Попыхова Э. Б., Степанова Т. В., Лагутина Д. Д. и др. Роль сахарного диабета в возникновении и развитии эндотелиальной дисфункции. Проблемы Эндокринологии. 2020;66(1):47-55. doi:10.14341/probl12212.
18. Rajendran P, Rengarajan T, Thangavel J, et al. The vascular endothelium and human diseases. Int J Biol Sci. 2013;9(10):1057-69. doi:10.7150/ijbs.7502.
19. В. И. Подзолков. Артериальная гипертензия. М.: ООО "Из-дательство "Медицинское информационное агентство", 2016. 424 с. ISBN: 978-5-9986-0264-1.
20. Васина Л. В., Петрищев Н. Н., Власов Т. Д. Эндотелиальная дисфункция и ее основные маркеры. Регионарное кровообращение и микроциркуляция. 2017;16(1):4-15. doi:10.24884/1682-6655-2017-16-1-4-15.
21. Мельникова Ю. С., Макарова Т. П. Эндотелиальная дисфункция как центральное звено патогенеза хронических болезней. Казанский медицинский журнал. 2015;96(4):659-65. doi:10.17750/KMJ2015-659.
22. Власов Т. Д., Нестерович И. И., Шиманьски Д. А. Эндотелиальная дисфункция: от частного к общему. Возврат к "старой парадигме"? Регионарное кровообращение и микроциркуляция. 2019;18(2):19-27. doi:10.24884/1682-6655-2019-18-2-19-27.
23. Степанова Т. В., Иванов А. Н., Терешкина Н. Е., и др. Маркеры эндотелиальной дисфункции: патогенетическая роль и диагностическое значение (обзор литературы). Клиническая лабораторная диагностика. 2019;64(1):34-41. doi:10.18821/0869-2084-2018-63-34-41.
24. Ettehad D, Emdin CA, Kiran A, et al. Blood pressure lowering for prevention of cardiovascular disease and death: a systematic review and meta-analysis. Lancet. 2016;387(10022):957-67. doi:10.1016/S0140-6736(15)01225-8.
25. Thomopoulos C, Parati G, Zanchetti A. Effects of blood-pressure-lowering treatment on outcome incidence in hypertension: 10 - Should blood pressure management differ in hypertensive patients with and without diabetes mellitus? Overview and meta-analyses of randomized trials. J Hypertens. 2017;35(5):922-44. doi:10.1097/HJH.0000000000001276.
26. Кобалава Ж. Д., Конради А. О., Недогода С. В. и др. Артериальная гипертензия у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(3):3786. doi:10.15829/1560-4071-2020-3-3786.
27. Дедов И. И., Шестакова М. В., Майоров А. Ю. и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. Под редакцией И. И. Дедова, М. В. Шестаковой, А. Ю. Майорова. 10-й выпуск. Сахарный диабет. 2021;24(1S):1-148. doi:10.14341/DM12802.
28. Briasoulis A, Agarwal V, Valachis A, et al. Antihypertensive effects of statins: a meta-analysis of prospective controlled studies. J Clin Hypertens (Greenwich). 2013;15(5):310-20. doi:10.1111/jch.12081.
29. Haug C, Schmid-Kotsas A, Zorn U, et al. Endothelin-1 synthesis and endothelin B receptor expression in human coronary artery smooth muscle cells and monocyte-derived macrophages is up-regulated by low density lipoproteins. J Mol Cell Cardiol. 2001;33(9):1701-12. doi:10.1006/jmcc.2001.1421.
30. Wassmann S, Laufs U, Bäumer AT, et al. HMG-CoA reductase inhibitors improve endothelial dysfunction in normocholesterolemic hypertension via reduced production of reactive oxygen species. Hypertension. 2001;37(6):1450-7. doi:10.1161/01.hyp.37.6.1450.
31. Rupérez M, Rodrigues-Díez R, Blanco-Colio LM, et al. HMG-CoA reductase inhibitors decrease angiotensin II-induced vascular fibrosis: role of RhoA/ROCK and MAPK pathways. Hypertension. 2007;50(2):377-83. doi:10.1161/HYPERTENSIONAHA.107.091264.
32. Ferrier KE, Muhlmann MH, Baguet JP, et al. Intensive cholesterol reduction lowers blood pressure and large artery stiffness in isolated systolic hypertension. J Am Coll Cardiol. 2002;39:1020-5. doi:10.1016/s0735-1097(02)01717-5.
33. Antoniades C, Bakogiannis C, Leeson P, et al. Rapid, direct effects of statin treatment on arterial redox state and nitric oxide bioavailability in human atherosclerosis via tetrahydrobiopterin-mediated endothelial nitric oxide synthase coupling. Circulation. 2011;124(3):335-45. doi:10.1161/CIRCULATIO-NAHA.110.985150.
34. Joseph JJ, Deedwania P, Acharya T, et al.; American Heart Association Diabetes Committee of the Council on Lifestyle and Cardiometabolic Health; Council on Arteriosclerosis, Thrombosis and Vascular Biology; Council on Clinical Cardiology; and Council on Hypertension. Comprehensive Management of Cardiovascular Risk Factors for Adults With Type 2 Diabetes: A Scientific Statement From the American Heart Association. Circulation. 2022;145(9):e722-59. doi:10.1161/CIR.0000000000001040.
35. Ghembaza MA, Senoussaoui Y, Tani MK, et al. Impact of patient knowledge of hypertension complications on adherence to antihypertensive therapy. CurrHypertens Rev 2014;10:41-8. doi:10.2174/157340211001141111160653.
36. Abegaz TM, Shehab A, Gebreyohannes EA, et al. Nonadherence to antihypertensive drugs: A systematic review and meta-analysis. Medicine (Baltimore). 2017;96(4):e5641. doi:10.1097/MD.0000000000005641.
37. Подзолков В. И., Брагина А. Е., Медведев И. Д., и др. Приверженность к лечению и ее роль в решении проблемы неконтролируемой артериальной гипертензии. Кардиоваскулярная терапия и профилактика. 2023;22(4):3547. doi:10.15829/1728-8800-2023-3547.
38. Jamerson K, Weber MA, Bakris GL, et al. ACCOMPLISH Trial Investigators. Benazepril plus amlodipine or hydrochlorothiazide for hypertension in high-risk patients. N Engl J Med. 2008;359(23):2417-28. doi:10.1056/NEJMoa0806182.
39. Bakris GL, Sarafidis PA, Weir MR, et al. ACCOMPLISH Trial investigators. Renal outcomes with different fixed-dose combination therapies in patients with hypertension at high risk for cardiovascular events (ACCOMPLISH): a prespecified secondary analysis of a randomised controlled trial. Lancet. 2010;375(9721):1173-81. doi:10.1016/S0140-6736(09)62100-0.
40. Подзолков В. И., Брагина А. Е., Осадчий К. К. Фиксированная комбинация лизиноприл + амлодипин + розувастатин: перспективы применения у пациентов с артериальной гипертонией и сопутствующей дислипидемией. Терапевтический архив. 2017;89(12):133-40. doi:10.17116/terarkh20178912133-140.
41. Подзолков В. И., Тарзиманова А. И. Фиксированные комбинации в лечении артериальной гипертензии: новые возможности. Российский кардиологический журнал. 2018;(5):68-73. doi:10.15829/1560-4071-2018-5-68-73.
42. Карпов Ю. А. Исследование ТРИУМВИРАТ: снижение риска развития сердечно-сосудистых осложнений у больных артериальной гипертонией с помощью трехкомпонентной комбинации антигипертензивных и липидснижающих препаратов. Кардиология. 2015;55(9):10-5. doi:10.18565/cardio.2015.9.10-15.
43. Недогода С. В., Чумачек Е. В., Ледяева А. А. и др. Оптимизация контроля артериального давления, органопротекции и метаболических нарушений с помощью фиксированной комбинации лизино-прил+амлодипин+розувастатин у пациентов с артериальной гипертензией. Российский кардиологический журнал. 2018;(4):49-55. doi:10.15829/1560-4071-2018-4-49-55.
Об авторах
В. И. ПодзолковРоссия
Подзолков Валерий Иванович — доктор медицинских наук, профессор, зав. кафедрой факультетской терапии № 2 ИКМ им. Н. В. Склифосовского, директор клиники факультетской терапии № 2
Москва
А. И. Тарзиманова
Россия
Тарзиманова Аида Ильгизовна — доктор медицинских наук, профессор кафедры кафедры факультетской терапии №2 ИКМ им. Н.В. Склифосовского
Москва
А. А. Абрамова
Россия
Абрамова Антонина Аркадьевна — кандидат медицинских наук, доцент кафедры кафедры факультетской терапии №2 ИКМ им. Н.В. Склифосовского
Москва
М. В. Ветлужская
Россия
Ветлужская Мария Владимировна — кандидат медицинских наук, доцент кафедры кафедры факультетской терапии №2 ИКМ им. Н.В. Склифосовского
Москва
И. Д. Медведев
Россия
Медведев Иван Дмитриевич — кандидат медицинских наук, доцент кафедры кафедры факультетской терапии №2 ИКМ им. Н.В. Склифосовского
Москва
И. Ж. Лория
Россия
Лория Иракли Жанович — кандидат медицинских наук, доцент кафедры кафедры факультетской терапии №2 ИКМ им. Н.В. Склифосовского
Москва
Дополнительные файлы
Что известно о предмете исследования?
- Рост распространенности сердечно-сосудистых заболеваний и сахарного диабета (СД) требует поиска новых подходов к лечению больных артериальной гипертензией и СД.
- Использование фиксированной комбинации лизиноприла, амлодипина и розувастатина способствует повышению приверженности к проводимой терапии, лучшему контролю артериального давления и липидов крови у больных артериальной гипертензией и СД.
Что добавляют результаты исследования?
- Фиксированная комбинация лизиноприла, амлодипина и розувастатина патогенетически оправдана и позволяет комплексно воздействовать на различные факторы риска сердечно-сосудистых заболеваний у коморбидных больных.
Рецензия
Для цитирования:
Подзолков В.И., Тарзиманова А.И., Абрамова А.А., Ветлужская М.В., Медведев И.Д., Лория И.Ж. Нарушения липидного обмена у больных с артериальной гипертензией и сахарным диабетом: механизмы развития и современные возможности лечения. Кардиоваскулярная терапия и профилактика. 2023;22(8):3656. https://doi.org/10.15829/1728-8800-2023-3656. EDN: PWDBPY
For citation:
Podzolkov V.I., Tarzimanova A.I., Abramova A.A., Vetluzhskaya M.V., Medvedev I.D., Loria I.Zh. Lipid metabolism disorders in patients with hypertension and diabetes mellitus: development and current treatment options. Cardiovascular Therapy and Prevention. 2023;22(8):3656. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3656. EDN: PWDBPY
JATS XML

























































