Перейти к:
Эпикардиальный жир и механическая дисперсия левого предсердия у больных артериальной гипертензией с персистирующей фибрилляцией предсердий и без нарушения сердечного ритма
https://doi.org/10.15829/1728-8800-2024-3758
EDN: KGKLOY
Аннотация
Цель. Изучить взаимосвязь между количеством эпикардиального левопредсердного жира (ЛПЖ) и механической дисперсией левого предсердия (МДЛП) у больных артериальной гипертензией (АГ) с персистирующей фибрилляцией предсердий (ФП) и без нарушения сердечного ритма.
Материал и методы. В основную группу были включены 100 больных АГ с персистирующей ФП, которым перед планируемой кардиоверсией была выполнена чреспищеводная эхокардиография (ЧП-ЭхоКГ), а после восстановления синусового ритма и исчезновения станнинга предсердий — трансторакальная эхокардиография (ТТ-ЭхоКГ). В контрольную группу включены 24 пациента с АГ без нарушений сердечного ритма, которым при ЧП-ЭхоКГ было исключено заболевание сердца, заподозренное при ТТ-ЭхоКГ. При ЧП-ЭхоКГ измерялись толщина межпредсердной перегородки и левого бокового гребня. Среднее значение толщины указанных структур обозначалось как толщина ЛПЖ и использовалось для оценки его количества. При ТТ-ЭхоКГ в режиме отслеживания серого пятна (speckle-tracking) определялось время достижения пика продольной деформации миокарда в 6 сегментах левого предсердия. МДЛП рассчитывалась как процентное отношение стандартного отклонения полученных значений к продолжительности сердечного цикла.
Результаты. Медианы толщины ЛПЖ [интерквартильный размах] в основной и контрольной группах равнялись, соответственно, 8,03 [6,78; 8,95] и 5,23 [4,48; 5,80] мм (р<0,001), медианы МДЛП — 2,68 [2,41; 2,83] и 0,95 [0,62; 1,11]% (р<0,001). В основной группе отмечалась положительная корреляционная связь между толщиной ЛПЖ и МДЛП (r=0,556; р<0,001), в контрольной группе такая связь не достигает уровня статистической значимости (r=0,358; р=0,086). Независимой связи между индексом массы тела и толщиной ЛПЖ у обследованных пациентов не выявлено (r=0,027; р=0,765).
Заключение. У больных АГ с персистирующей ФП, по сравнению с больными без нарушения ритма значительно больше средние значения толщины ЛПЖ и МДЛП. У больных АГ с ФП увеличение толщины ЛПЖ ассоциируется с возрастанием МДЛП, у больных АГ без нарушения ритма корреляции между толщиной ЛПЖ и МДЛП не отмечено. Влияния индекса массы тела на толщину ЛПЖ в настоящем исследовании не выявлено.
Ключевые слова
Для цитирования:
Мазур Е.С., Мазур В.В., Баженов Н.Д., Нилова О.В., Николаева Т.О. Эпикардиальный жир и механическая дисперсия левого предсердия у больных артериальной гипертензией с персистирующей фибрилляцией предсердий и без нарушения сердечного ритма. Кардиоваскулярная терапия и профилактика. 2024;23(1):3758. https://doi.org/10.15829/1728-8800-2024-3758. EDN: KGKLOY
For citation:
Mazur E.S., Mazur V.V., Bazhenov N.D., Nilova O.V., Nikolaeva T.O. Epicardial fat and left atrial mechanical dispersion in patients with hypertension with persistent atrial fibrillation and without cardiac arrhythmia. Cardiovascular Therapy and Prevention. 2024;23(1):3758. (In Russ.) https://doi.org/10.15829/1728-8800-2024-3758. EDN: KGKLOY
Введение
Морфологическим субстратом фибрилляции предсердий (ФП) служит фиброз миокарда, в развитии которого важную роль играет эпикардиальное ожирение, в первую очередь, избыточное отложение эпикардиального жира в области левого предсердия (ЛП) [1]. Для измерения объема левопредсердного жира (ЛПЖ) используются томографические методы исследования, однако ориентировочно оценить его количество можно по толщине межпредсердной перегородки (МПП) и левого бокового гребня, измеренных при чреспищеводной эхокардиографии (ЧП-ЭхоКГ) [2][3].
Развитие фиброза сопровождается возрастанием механической дисперсии левого предсердия (МДЛП), т.е. асинхронности растяжения миокарда ЛП при заполнении его кровью [4][5]. По мнению Ciuffo L, et al. [5], МДЛП более точно отражает выраженность фиброза ЛП, чем данные магнитно-резонансной томографии. Учитывая вышеизложенное, можно полагать, что увеличение количества ЛПЖ, оцениваемого по данным ЧП-ЭхоКГ, сопряжено с более выраженной МДЛП.
Цель работы — изучить взаимосвязь между количеством ЛПЖ и МДЛП у больных артериальной гипертензией (АГ) с персистирующей ФП и без нарушения сердечного ритма.
Материал и методы
Одноцентровое одномоментное исследование было одобрено Этическим комитетом ФГБОУ ВО Тверской ГМУ Минздрава России (протокол № 7 от 23.04.2019) и выполнено в соответствии со стандартами надлежащей клинической практики и принципами Хельсинкской Декларации. Все включенные в исследование пациенты подписали добровольное информированное согласие на использование результатов выполненных им исследований в научных целях.
В исследование включались больные АГ, которым в период с 11.11.2019 по 21.12.2022гг в клинике Тверского ГМУ была выполнена ЧП-ЭхоКГ. В исследование не включались больные без гипертрофии левого желудочка (ГЛЖ), с фракцией выброса левого желудочка <50%, с сопутствующей ишемической болезнью сердца, перенесенным мозговым инсультом, врожденными или приобретенными пороками сердца.
В основную группу были включены 100 больных АГ с персистирующей ФП, которым перед планируемой кардиоверсией была выполнена ЧП-ЭхоКГ, а после восстановления синусового ритма и исчезновения станнинга предсердий — трансторакальная эхокардиография (ТТ-ЭхоКГ). В контрольную группу включены 24 пациента с АГ без нарушений сердечного ритма, которым ЧП-ЭхоКГ была выполнена в связи с подозрением на то или иное заболевание сердца. У 4 пациентов по данным ТТ-ЭхоКГ был заподозрен дефект МПП, у 12 — инфекционный эндокардит, у 8 — двустворчатый аортальный клапан. При ЧП-ЭхоКГ ни у кого из этих пациентов предполагаемый диагноз не был подтвержден.
Учитывались пол и возраст пациентов, индекс массы тела (ИМТ), наличие сопутствующего сахарного диабета 2 типа, длительность гипертензивного анамнеза, особенности антигипертензивной терапии и уровень артериального давления на момент обследования.
Эхокардиографические исследования выполнялись на аппарате Vivid S70 (GE, США). Для ЧП-ЭхоКГ использовался матричный мультиплановый фазированный датчик (2D/3D/4D) 6VT-D. Сканирование ЛП осуществляли из среднепищеводного доступа в сечениях от 0 до 180º с пошаговым интервалом 10-30º. Толщину МПП измеряли в бикавальной позиции на 1 см выше овальной ямки. Измерение толщины левого бокового гребня проводилось в 2-камерной позиции со срезанной верхушкой сердца из среднего отдела пищевода. Среднее значение толщины указанных структур обозначалось как толщина ЛПЖ и использовалось для оценки его количества.
ТТ-ЭхоКГ у больных контрольной группы проводили в тот же день, что и ЧП-ЭхоКГ, а у больных основной группы через 5-7 дней после успешного восстановления синусового ритма. Определяли толщину эпикардиального жира в области передней стенки правого желудочка (правожелудочковый жир — ПЖЖ), степень ГЛЖ, индекс объема ЛП (ИОЛП), отношение скорости митрального кровотока к скорости смещения кольца митрального клапана (Е/е’). Больные с персистирующей ФП, у которых на момент проведения ТТ-ЭхоКГ сохранялся станнинг ЛП (Е <50 см/с), были исключены из исследования.
Двухмерная эхокардиография с технологией отслеживания серого пятна (speckle-tracking) и последующий анализ проводили на ультразвуковых изображениях с частотой кадров не <50/сек. Кривые деформации ЛП были созданы путем ручного отслеживания эндокардиальной границы в апикальной 4-камерной проекции в конце диастолы в соответствии с R-R алгоритмом (нулевой уровень деформации установлен на зубце R). Глобальную продольную деформацию ЛП (стрейн резервуара) рассчитывали как среднее значение пиковых значений продольной деформации в фазу резервуара в 6 сегментах ЛП [6][7]. МДЛП рассчитывали как процентное отношение стандартного отклонения времени достижения пикового значения резервуарной фазы продольной деформации миокарда в различных сегментах ЛП к продолжительности сердечного цикла [8][9].
Статистический анализ выполнен в приложении MedCalc® Statistical Software version 20.218 (MedCalc Software Ltd, Ostend, Belgium). Поскольку распределение числовых переменных, за исключением толщины ЛПЖ, отличалось от нормального, для характеристики средних значений использовали медианы и интерквартильные интервалы, а для оценки межгрупповых различий — критерии Манна-Уитни и Краскела-Уоллиса. Разности медиан представлены с 95% доверительными интервалами (ДИ). Для сравнения выборочных долей использовался критерий χ², а при недостаточном для его применения числа значений в ячейках 4-польной таблице — точный двусторонний критерий Фишера. Для изучения взаимосвязи между двумя числовыми переменными использовался корреляционный анализ, между числовой и альтернативной переменной — анализ кривых ошибок (ROC-анализ). Площадь под кривыми ошибок (AUC) и их разности представлены с 95% ДИ. Влияние нескольких переменных на числовую оценивали по результатам множественной линейной регрессии. Коэффициенты при независимых переменных представлены с 95% ДИ. Во всех случаях результаты анализа признавались статистически значимыми при вероятности нулевой гипотезы <5% (р<0,05).
Результаты
Возраст включенных в исследование пациентов варьировал от 40 до 84 лет, анамнез АГ — от 1 до 17 лет (таблица 1). Среди обследованных было 70 (56,5) мужчин, у 49 (39,5%) пациентов отмечалась избыточная масса тела, у 54 (43,5%) — ожирение, у 28 (22,6%) — сахарный диабет 2 типа. Все пациенты получали комбинированную антигипертензивную терапию, которая в подавляющем большинстве случаев включала ингибиторы ангиотензинпревращающего фермента или блокаторы ангиотензина II. Артериальное давление <140/90 мм рт.ст. на момент включения отмечалось у 80 (64,5%) пациентов.
Таблица 1
Характеристика больных АГ с ФП и без нарушения ритма
|
Показатель |
Все больные (n=124) |
ФП |
р |
|
|
Нет (n=24) |
Есть (n=100) |
|||
|
Мужчины, n (%) |
70 (56,5) |
10 (41,7) |
60 (60,0) |
0,105 |
|
Возраст, лет |
63,0 [ 58,0; 69,0] |
59,0 [ 55,0; 64,0] |
63,5 [ 59,5; 69,0] |
0,009 |
|
Анамнез АГ, лет |
7,0 [ 5,0; 8,0] |
5,0 [ 3,0; 7,5] |
8,0 [ 6,0; 9,0] |
0,002 |
|
Прием иАПФ/БРА, n (%) |
123 (99,2) |
24 (100,0) |
99 (99,0) |
1,000 |
|
Прием АК, n (%) |
55 (44,4) |
14 (58,3) |
41 (41,0) |
0,126 |
|
Прием диуретиков, n (%) |
85 (68,5) |
15 (62,5) |
70 (70,0) |
0,479 |
|
Прием БАБ, n (%) |
74 (59,7) |
3 (12,5) |
71 (71,0) |
<0,001 |
|
АД <140/90 мм рт.ст., n (%) |
80 (64,5) |
16 (66,7) |
64 (64,0) |
0,807 |
|
Сахарный диабет 2 типа, n (%) |
28 (22,6) |
6 (25,0) |
22 (22,0) |
0,753 |
|
ИМТ, кг/м² |
29,4 [ 26,4; 33,2] |
26,9 [ 23,3; 29,9] |
29,7 [ 27,2; 33,9] |
0,002 |
|
Толщина ПЖЖ, мм |
8,00 [ 7,00; 9,30] |
6,25 [ 5,45; 6,70] |
8,30 [ 7,70; 9,60] |
<0,001 |
|
Толщина ЛПЖ, мм |
7,23 [ 6,15; 8,90] |
5,23 [ 4,48; 5,80] |
8,03 [ 6,78; 8,95] |
<0,001 |
|
ГЛЖ >1 ст., n (%) |
61 (49,2) |
9 (37,5) |
52 (52,0) |
0,204 |
|
Е/е’ |
10,4 [ 8,25; 12,8] |
8,95 [ 8,10; 10,3] |
10,7 [ 8,80; 13,35] |
0,009 |
|
ИОЛП, мл/м² |
40,0 [ 33,0; 46,5] |
30,0 [ 27,5; 32,5] |
41,0 [ 36,5; 48,0] |
<0,001 |
|
Стрейн резервуара, % |
20,0 [ 17,0; 23,0] |
22,5 [ 20,0; 24,5] |
19,0 [ 17,0; 21,6] |
0,001 |
|
МДЛП, % |
2,32 [ 1,72; 3,09] |
0,95 [ 0,62; 1,11] |
2,68 [ 2,41; 2,83] |
<0,001 |
Примечание: данные представлены в виде медианы
и интерквартильного размаха Ме [ Q25; 75]
или абсолютного и относительного числа носителей признака — n (%).
АГ — артериальная гипертензия, АД — артериальное давление,
АК — антагонисты кальция, БАБ — β-адреноблокаторы,
БРА — блокаторы рецепторов ангиотензина II, ГЛЖ — гипертрофия левого желудочка,
иАПФ — ингибиторы ангиотензинпревращающего фермента,
ИМТ — индекс массы тела, ИОЛП — индекс объема левого предсердия,
ЛПЖ — левопредсердный жир, МДЛП — механическая дисперсия левого предсердия,
ПЖЖ — правожелудочковый жир, ФП — фибрилляция предсердий,
Е/е’ — отношение скорости митрального кровотока
к скорости смещения кольца митрального клапана.
ГЛЖ имела место у всех пациентов, гипертрофия 2-3 ст. выявлена в 61 (49,2%) случае. Отношение Е/е’, отражающее давление наполнения левого желудочка, варьировало от 6,2 до 20,8 ед. и у 82 (66,1%) пациентов превышало 9 ед., т.е. было выше условной границы нормы. ИОЛП варьировал от 23 до 67 мл/м², глобальная продольная деформация миокарда ЛП в фазу резервуара (стрейн резервуара) — от 12 до 35%, МДЛП — от 0,27 до 4,39%, толщина ПЖЖ — от 3,0 до 13,0 мм, ЛПЖ — от 3,90 до 10,85 мм.
Больные основной группы были в среднем на 4,0 (95% ДИ: 1,0-8,0) года старше, на 2,0 (1,0-4,0) года дольше страдали АГ и в 5,7 раза чаще получали β-адреноблокаторы. Эффективность антигипертензивной терапии и выраженность ГЛЖ в сравниваемых группах не различались, однако отношение Е/е’ у больных с ФП было на 1,70 (0,40-2,80) ед. выше, чем в контрольной группе. У больных основной группы на 3,4 (1,3-5,8) кг/м² был > ИМТ, на 2,50 (1,80-3,10) мм > толщина ПЖЖ и на 2,80 (2,20-3,35) мм > толщина ЛПЖ. Существенно различалось и состояние ЛП: ИОЛП в основной группе был > на 12,0 (8,0-15,0) мл/м², стрейн резервуара ЛП < на 3,0 (2,0-5,0)%, а МДЛП > на 1,75 (1,46-2,08)%. Связь ФП с характеристиками ЛП отражают кривые ошибок (рисунок 1 А), а с показателями ожирения — рисунок 1 Б.
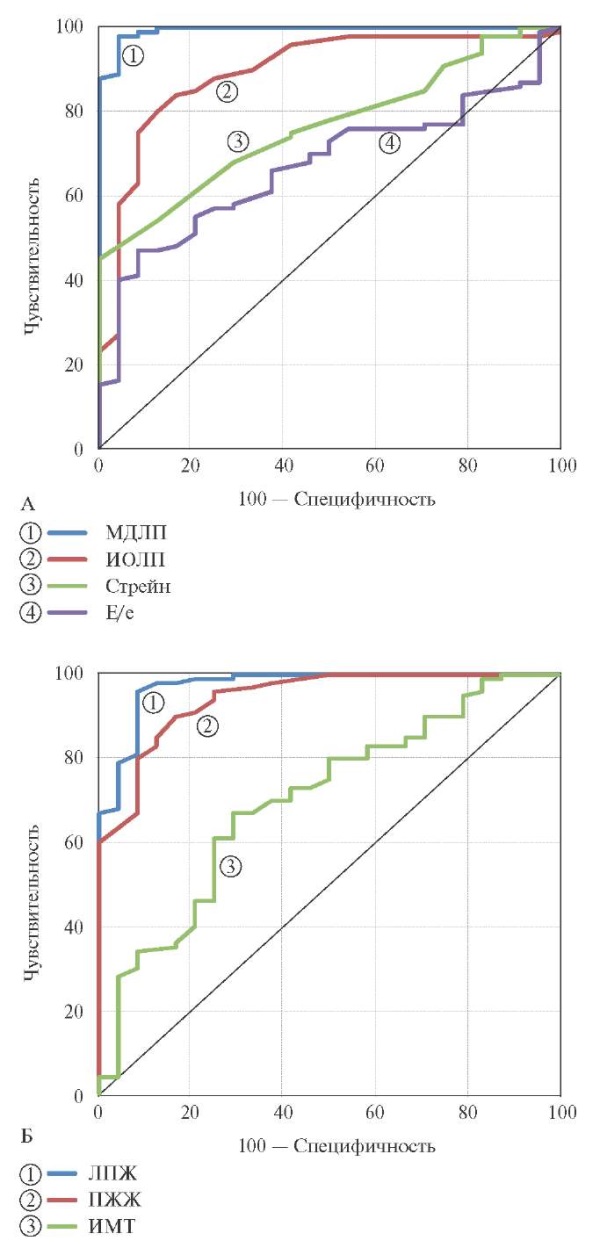
Рис. 1 Кривые ошибок для характеристик ЛП (А)
и показателей ожирения (Б) как маркеров ФП.
Примечание: ИМТ — индекс массы тела, ИОЛП — индекс объема левого предсердия,
ЛП — левое предсердие, ЛПЖ — толщина левопредсердного жира,
МДЛП — механическая дисперсия ЛП, ПЖЖ — толщина правожелудочкового жира,
Стрейн — глобальная продольная деформация ЛП в фазу резервуара,
ФП — фибрилляция предсердий,
Е/е’ — отношение скорости митрального кровотока
к скорости смещения кольца митрального клапана.
Как следует из представленных в таблице 2 данных, наиболее тесную связь с ФП продемонстрировали МДЛП и толщина ЛПЖ. МДЛП >1,38%, как прогностический критерий ФП, продемонстрировал чувствительность 98,0 (93,0-99,8)%, специфичность 95,8 (78,9-99,9)%, отношение правдоподобия для положительного и отрицательного результата 23,52 и 0,021. Соответствующие показатели для толщины ЛПЖ >6,05 мм равны 96,0 (90,1-98,9)%, 91,7 (73,0-99,0)%, 11,52 и 0,044.
Таблица 2
Площадь под кривыми ошибок для характеристик ЛП
и показателей ожирения как предикторов ФП
|
Показатель |
AUC (95% ДИ) |
Разность с AUC для МДЛП (95% ДИ) |
р для разности |
|
МДЛП |
0,994 (0,959-1,000) |
– |
– |
|
Толщина ЛПЖ |
0,975 (0,929-0,994) |
0,019 (-0,014-0,053) |
0,2553 |
|
Толщина ПЖЖ |
0,944 (0,888-0,978) |
0,050 (0,003-0,096) |
0,0359 |
|
ИОЛП |
0,896 (0,828-0,943) |
0,098 (0,025-0,171) |
0,0084 |
|
Стрейн резервуара |
0,765 (0,680-0,836) |
0,229 (0,145-0,313) |
<0,0001 |
|
ИМТ |
0,702 (0,613-0,781) |
0,292 (0,177-0,406) |
<0,0001 |
|
Е/е’ |
0,671 (0,581-0,753) |
0,323 (0,224-0,422) |
<0,0001 |
Примечание: ДИ — доверительный интервал, ЛП — левое предсердие,
МДЛП — механическая дисперсия ЛП, ЛПЖ — левопредсердный жир,
ПЖЖ — правожелудочковый жир, ИОЛП — индекс объема ЛП,
стрейн резервуара — глобальная продольная деформация ЛП в фазу резервуара,
ИМТ — индекс массы тела, ФП — фибрилляция предсердий,
AUC — площадь под кривой,
Е/е’ — отношение скорости митрального кровотока
к скорости смещения кольца митрального клапана.
Между МДЛП и толщиной ЛПЖ выявлена статистически значимая корреляционная связь (r=0,762; р<0,001) (рисунок 2), которая сохраняется у больных с ФП (r=0,556; р<0,001), но утрачивает значимость у лиц без аритмии (r=0,358; р=0,086).
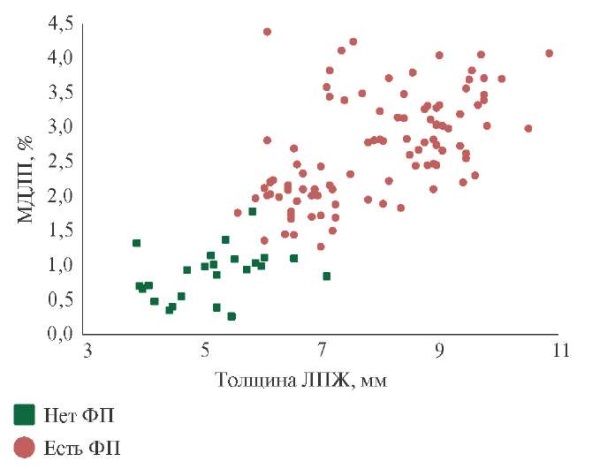
Рис. 2 Точечный график, отражающий связь толщины ЛПЖ и МДЛП
у больных с ФП и без таковой.
Примечание: ЛПЖ — левопредсердный жир,
МДЛП — механическая дисперсия левого предсердия,
ФП — фибрилляция предсердий.
Толщина ПЖЖ также коррелирует с МДЛП (r=0,529; р<0,001), однако эта связь обусловлена наличием тесной связи между ПЖЖ и ЛПЖ (r=0,636; р<0,001). С учетом этой связи корреляция между толщиной ППЖ и ИМТ утрачивает статистическую значимость: rпарциальный=0,089; р=0,330.
Представленный на рисунке 2 график наглядно свидетельствует, что на МДЛП оказывает влияние не только толщина ЛПЖ, но и наличие ФП. По данным множественной линейной регрессии, ФП ассоциируется с возрастанием МДЛП на 0,954 (0,598-1,310)% (р<0,001), а увеличение толщины ЛПЖ на 1 мм с возрастанием МДЛП на 0,308 (0,222-0,395)% (р<0,001).
Толщина ЛПЖ достаточно тесно коррелирует с толщиной ПЖЖ (r=0,636; р<0,001) и слабее с ИМТ (r=0,286; р=0,001). Значительно сильнее с ИМТ коррелирует толщина ПЖЖ: r=0,421 (р<0,001). С учетом этой связи корреляция между толщиной ЛПЖ и ИМТ утрачивает статистическую значимость: rпарциальный=0,027 (р=0,765).
Наглядное представление о связи ИМТ с толщиной ЛПЖ дает сравнение контрольной группы с двумя подгруппами основной группы, выделенными в зависимости от значения ИМТ. В подгруппу А вошли пациенты основной группы, у которых ИМТ не превышал медианное значение (29,65 кг/м²), в подгруппу Б — пациенты основной группы с более высокими значениями ИМТ. Как следует из представленного на рисунке 3 графика, у больных контрольной группы и подгруппы А основной группы ИМТ в среднем не различался — 26,9 [ 23,3; 29,9] и 27,1 [ 24,1; 28,6] кг/м²) и был существенно ниже, чем в подгруппе Б основной группы (34,0 [ 31,6; 36,5] кг/м²).
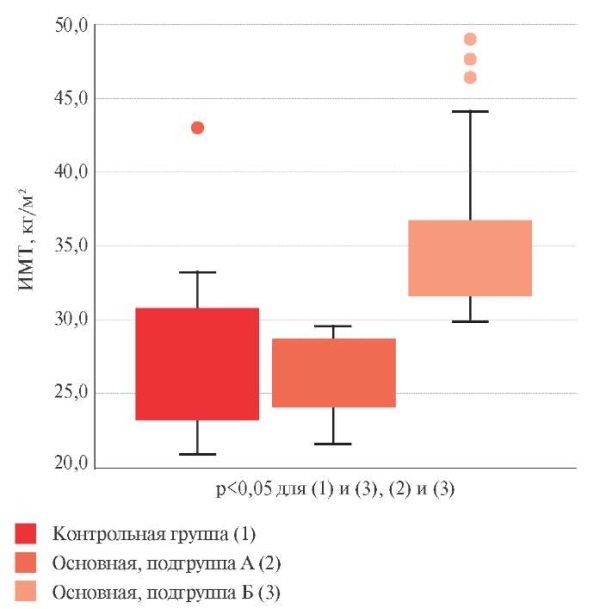
Рис. 3 Средние значения ИМТ в контрольной группе (1)
и в двух подгруппах основной группы:
подгруппа А (2) — ИМТ не превышает медианное значение,
подгруппа Б (3) — ИМТ превышает медианное значение.
Примечание: ИМТ — индекс массы тела.
Несмотря на отсутствие различий по ИМТ между контрольной группой и подгруппой А основной группы, толщина ЛПЖ в подгруппе А в среднем была на 2,55 (1,95-3,20) мм больше, чем в контрольной группе (рисунок 4). Различия в толщине ЛПЖ между подгруппами А и Б основной группы были статистически незначимы — 0,30 (-0,20-0,90) мм (р=0,220).
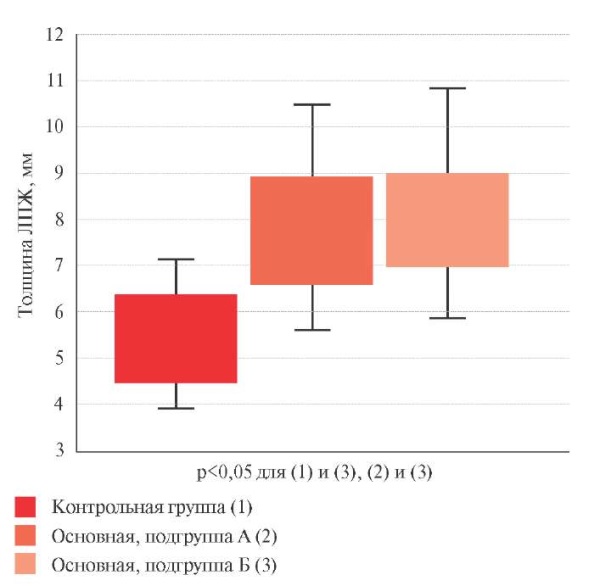
Рис. 4 Средние значения толщины ЛПЖ в контрольной группе (1)
и в двух подгруппах основной группы:
подгруппа А (2) — ИМТ не превышает медианное значение,
подгруппа Б (3) — ИМТ превышает медианное значение.
Примечание: ЛПЖ — левопредсердный жир.
Анализ множественной линейной регрессии показал, что наличие ФП ассоциируется с возрастанием толщины ЛПЖ в среднем на 2,642 (2,085-3,198) мм (р<0,001), а увеличение ИМТ на 1 кг/м² сопровождается возрастанием толщины ЛПЖ на 0,037 (-0,002-0,076) мм (р=0,065). Таким образом, ФП ассоциируется с выраженным увеличением толщины ЛПЖ, в то время как увеличение ИМТ на толщине ЛПЖ не сказывается.
Обсуждение
В настоящей работе среднее значение МДЛП у больных АГ с персистирующей ФП превышало показатель больных без аритмии в ~3 раза: 2,68 vs 0,95%. Еще более выраженные различия были выявлены ранее при сравнении МДЛП у 61 больного с пароксизмальной ФП и 251 больного без нарушения ритма: 2,87 vs 0,72% [9]. Площадь под кривой (AUC) ошибок для МДЛП, как предиктора ФП, в настоящем исследовании составила 0,994, в вышеупомянутом — 0,956. Столь тесную связь между ФП и МДЛП легко объяснить, если считать, что морфологическим субстратом аритмии служит выраженный фиброз миокарда ЛП, а МДЛП дает ему достаточно точную количественную оценку [5]. Представленные результаты позволяют рассматривать МДЛП в качестве весьма перспективного диагностического маркера ФП, позволяющего отбирать пациентов с высоким риском ФП для направления на длительное мониторирование электрокардиограммы.
Второе, резко выраженное, различие между обследованными больными касалось толщины ЛПЖ, которая у больных АГ с ФП в среднем была в 1,5 раза больше, чем в альтернативной группе (8,03 vs 5,23 мм). Практически таким же оказалось соотношение объемов ЛПЖ у 68 больных ФП и 34 здоровых лиц (29,9±12,1 vs 20,2±6,5 см³) в исследовании Tsao HM, et al. [10].
Вопрос о причинах увеличения количества эпикардиального жира вообще и у больных с ФП, в частности, на сегодняшний день остается открытым. В ряде исследований показана зависимость количества эпикардиального жира от ИМТ, иными словами, от выраженности общего ожирения, однако в других исследованиях такой зависимости не выявлено. Так, в работе Mahajan R, et al. [11] у больных с ФП была выявлена статистически значимая корреляция между ИМТ и объемом ЛПЖ (r=0,62; p=0,002), а объем ЛПЖ у больных с ожирением (ИМТ ≥27 кг/м²) был больше, чем в альтернативной группе (31±11 vs 22±11 мл, p=0,05). Однако в работе Tsao HM, et al. [12] не отмечено различий по ИМТ между больными с ФП и здоровыми лицами (25,21±2,95 и 24,97±3,14 кг/м², p=0,404), в то время как объем ЛПЖ у них существенно различался (29,85±10,14 vs 21,46±5,81 см³) (p<0,001).
В настоящем исследовании также не выявлено влияния ИМТ на толщину ЛПЖ, но у больных с ФП отмечена достаточно тесная корреляция между толщиной ЛПЖ и МДЛП (R²=0,581). Поскольку МДЛП является маркером предсердного фиброза [4][5], выявленную корреляционную связь можно считать проявлением взаимосвязи между количеством ЛПЖ и выраженностью фиброза миокарда ЛП. Причем, судя по представленным в литературе данным, возможны два варианта причинно-следственных отношений, стоящих за взаимосвязью между эпикардиальным жиром и фиброзом ЛП.
С одной стороны, отсутствие соединительнотканной границы между миокардом и эпикардиальным жиром создает предпосылки для жировой инфильтрации миокарда и паракринного действия продуцируемых адипоцитами биологически активных веществ, ведущих к развитию фиброза миокарда ЛП [13-17]. С другой стороны, избыточное отложение ЛПЖ при ФП может быть обусловлено тахисистолией [18] и гемодинамической перегрузкой ЛП, ведущей к гиперпродукции предсердного натрийуретического пептида, обладающего выраженным адипогенным действием [19].
Обе гипотезы позволяют объяснить взаимосвязь между толщиной ЛПЖ и МДЛП у больных с ФП, но не дают ответа на вопрос о причинах появления резко выраженных различий в толщине ЛПЖ и МДЛП между больными АГ с ФП и без таковой. Этот вопрос требует отдельного изучения.
Ограничения исследования. Оценивая результаты настоящего исследования, необходимо учитывать две его особенности: во-первых, использование невалидированного метода оценки количества ЛПЖ, во-вторых, способ формирования контрольной группы, не гарантирующий ее репрезентативность по отношению к генеральной совокупности больных АГ без ФП.
Толщина МПП, измеренная при трансторакальном исследовании, ранее уже использовалась для оценки количества ЛПЖ и продемонстрировала тесную связь с функциональным состоянием ЛП у здоровых лиц [20] и с риском рецидива аритмии после катетерной аблации у больных с ФП [21]. Данных об использовании с этой целью толщины левого бокового гребня, который также является депо эпикардиального жира, в литературе не представлено. Использование среднего значения толщины указанных структур позволяет, на наш взгляд, получить более точную оценку количества ЛПЖ. Выявленные в настоящем исследовании взаимосвязи толщины ЛПЖ с ФП и МДЛП, позволяют считать, что это предположение не лишено смысла. Тем не менее, для подтверждения связи между объемом и толщиной ЛПЖ необходимо прямое сравнение результатов ЧП-ЭхоКГ и ТТ-ЭхоКГ исследований.
В контрольную группу включали больных АГ без диагностированной ФП, у которых было заподозрено заболевание, требующее проведения ЧП-ЭхоКГ. Несмотря на то, что подозреваемое заболевание не было выявлено, само подозрение на него уже не позволяет считать таких больных "типичными" представителями больных АГ без ФП. Однако по основным характеристикам контрольная группа оказалась вполне сопоставима с группой ранее обследованных больных АГ (n=251), у которых при суточном мониторировании электрокардиограммы не было выявлено ФП [9]. Так, средний возраст обследованных равнялся, соответственно, 59,0 и 60,0 годам, доля мужчин — 41,7 и 35,5%, толщина ПЖЖ — 6,25 и 6,70 мм, а МДЛП — 0,95 и 0,72%. Таким образом, несмотря на неслучайный метод отбора больных, контрольная группа может считаться репрезентативной к популяции больных АГ без ФП.
Заключение
У больных АГ с персистирующей ФП, по сравнению с больными без нарушения ритма, значительно больше средние значения толщины ЛПЖ и МДЛП. У больных АГ с ФП увеличение толщины ЛПЖ ассоциируется с возрастанием МДЛП, у больных АГ без нарушения ритма корреляции между толщиной ЛПЖ и МДЛП не отмечено. Влияния ИМТ на толщину ЛПЖ в настоящем исследовании не выявлено.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Подзолков В. И., Тарзиманова А. И., Брагина А. Е. и др. Роль эпикардиальной жировой ткани в развитии фибрилляции предсердий у больных артериальной гипертензией. Кардиоваскулярная терапия и профилактика. 2020;19(6):2707. doi:10.15829/1728-8800-2020-2707.
2. Leo LA, Paiocchi VL, Schlossbauer SA, et al. The intrusive nature of epicardial adipose tissue as revealed by cardiac magnetic resonance. J Cardiovasc Echogr. 2019;29(2):45-51. doi:10.4103/jcecho.jcecho_22_19.
3. Мазур Е.С., Мазур В.В., Баженов Н. Д. и др. Эпикардиальное ожирение и фибрилляция предсердий: акцент на предсердном жировом депо. Ожирение и метаболизм. 2020;17(3):316-25. doi:10.14341/omet12614.
4. Watanabe Y, Nakano Y, Hidaka T, et al. Mechanical and substrate abnormalities of the left atrium assessed by 3-dimensional speckle-tracking echocardiography and electroanatomic mapping system in patients with paroxysmal atrial fibrillation. Heart Rhythm. 2015;12:490-7. doi:10.1016/j.hrthm.2014.12.007.
5. Ciuffo L, Tao S, Ipek EG, et al. Intra-atrial Dyssynchrony During Sinus Rhythm Predicts Recurrence After the First Catheter Ablation of Atrial Fibrillation. JACC Cardiovasc Imaging. 2019;12(2):310-19. doi:10.1016/j.jcmg.2017.11.028.
6. Badano LP, Kolias Th, Muraru D, et al. Standardization of left atrial, right ventricular and right atrial deformation imaging using two-dimensional speckle tracking echocardiography: a consensus document of the EACVI/ASE/Industry Task Force to standardize deformation imaging. Eur Heart J Cardiovask Imaging. 2018;19:591-600. doi:10.1093/ehjci/jey042.
7. Алёхин М. Н., Калинин А.О. Значение показателей продольной деформации левого предсердия у пациентов с хронической сердечной недостаточностью. Медицинский алфавит. 2020;(32):24-9. doi:10.33667/2078-5631-2020-32-24-29.
8. Kawakami H, Ramkumar S, Nolan M, et al. Left Atrial Mechanical Dispersion Assessed by Strain Echocardiography as an Independent Predictor of New-Onset Atrial Fibrillation: A Case-Control Study. J Am Soc Echocardiogr. 2019;32:1268-76.e3. doi:10.1016/j.echo.2019.06.002.
9. Мазур Е.С., Мазур В.В., Баженов Н.Д. и др. Эпикардиальное ожирение и механическая дисперсия левого предсердия у больных артериальной гипертензией с пароксизмальной и персистирующей фибрилляцией предсердий. Кардиоваскулярная терапия и профилактика. 2023;22(3):3513. doi:10.15829/1728-8800-2024-3513.
10. Tsao HM, Hu WC, Wu MH, et al. Quantitative analysis of quantity and distribution of epicardial adipose tissue surrounding the left atrium in patients with atrial fibrillation and effect of recurrence after ablation. Am J Cardiol. 2011;107:1498-503. doi:10/1016/j.amjcard.2011.01.027.
11. Mahajan R, Nelson A, Pathak RK, et al. Electroanatomical remodeling of the atria in obesity. Impact of adjacent epicardial fat. J Am Coll Cardiol EP. 2018;4:1529-40. doi:10.1016/j.jacep.2018.08.014.
12. Tsao HM, Hu WC, Tsai PH, et al. The abundance of epicardial adipose tissue surrounding left atrium is associated with the occurrence of stroke in patients with atrial fibrillation. Medicine. 2016;95(14):1-8. doi:10.1097/MD.0000000000003260.
13. Голухова Е. З., Громова О. И., Булаева Н.И. и др. Эпикардиальный жир и фибрилляция предсердий: роль профиброгенных медиаторов. Кардиология. 2018;58(7):59-65. doi:10.18087/cardio.2018.7.10145.
14. Заславская Е. Л., Ионин В. А., Нифонтов С. Е. и др. Эпикардиальная жировая ткань и трансформирующий фактор роста бета1 — факторы риска фибрилляции предсердий у пациентов с метаболическим синдромом? Артериальная гипертензия. 2018;24(3):281-92. doi:10.18705/1607-419X-2018-24-3-281-292.
15. Ионин В. А., Барашкова Е. И., Павлова В. А. и др. Какова роль профибротических и провоспалительных факторов в развитии фибрилляции предсердий, ассоциированной с компонентами метаболического синдрома? Российский кардиологический журнал. 2021;26(11):4752. doi:10.15829/1560-4071-2021-4752.
16. Ионин В.А., Заславская Е.Л., Барашкова Е.И. и др. Молекулярные механизмы формирования фиброза миокарда левого предсердия у пациентов с фибрилляцией предсердий и метаболическим синдромом: какие биомаркеры использовать в клинической практике? Российский кардиологический журнал. 2021;26(7):4579. doi:10.15829/1560-4071-2021-4579.
17. Ионин В. А., Барашкова Е. И., Заславская Е. Л. и др. Биомаркеры воспаления, параметры, характеризующие ожирение и ремоделирование сердца, у пациентов с фибрилляцией предсердий и метаболическим синдромом. Российский кардиологический журнал. 2021;26(3):4343. doi:10.15829/1560-4071-2021-4343.
18. Mahajan R, Lau DH, Brooks AG, et al. Electrophysiological, electro-anatomical and structural remodeling of the atria as consequence of sustained obesity. J Am Coll Cardiol. 2015;66:1-11. doi:10.1016/j.jacc.2015.04.058.
19. Suffee N, Moore-Morris T, Farahmand P, et al. Atrial natriuretic peptide regulates adipose tissue accumulation in adult atria. Proc Natl Acad Sci USA. 2017;114:e771-80. doi:10.1073/pnas.1610968114.
20. Lai YH, Yun CH, Su CH, et al. Excessive interatrial adiposity is associated with left atrial remodeling, augmented contractile performance in asymptomatic population. Echo Res Pract. 2016;3:5-16. doi:10.1530/ERP-15-0031.
21. Lim HE, Na NO, Im SI, et al. Interatrial septal thickness as a marker of structural and functional remodeling of the left atrium in patients with atrial fibrillation. Korean J Intern Med. 2015;30:808-20. doi:10.3904/kjim.2015.30.6.808.
Об авторах
Е. С. МазурРоссия
Мазур Евгений Станиславович — доктор медицинских наук, профессор, заведующий кафедрой госпитальной терапии и профессиональных болезней.
Тверь
В. В. Мазур
Россия
Мазур Вера Вячеславовна — доктор медицинских наук, доцент, профессор кафедры госпитальной терапии и профессиональных болезней.
Тверь
Н. Д. Баженов
Россия
Баженов Николай Дмитриевич — кандидат медицинских наук, доцент, заведующий кафедрой скорой медицинской помощи.
Тверь
О. В. Нилова
Россия
Нилова Оксана Владимировна — кандидат медицинских наук, доцент кафедры поликлинической терапии и семейной медицины.
Тверь
Т. О. Николаева
Россия
Николаева Татьяна Олеговна — кандидат медицинских наук, доцент, заведующая кафедрой пропедевтики внутренних болезней.
Тверь
Дополнительные файлы
Что известно о предмете исследования?
- Морфологическим субстратом фибрилляции предсердий (ФП) служит фиброз миокарда, в развитии которого важную роль играет избыточное отложение эпикардиального жира в области левого предсердия.
- Чреспищеводная эхокардиография позволяет измерить толщину межпредсердной перегородки и левого бокового гребня, представляющих собой депо левопредсердного эпикардиального жира.
Что добавляют результаты исследования?
- У больных артериальной гипертензией с персистирующей ФП средние значения толщины левопредсердного эпикардиального жира и механической дисперсии левого предсердия больше, чем у больных без нарушения ритма, что позволяет рассматривать эти параметры в качестве возможных маркеров ФП.
Рецензия
Для цитирования:
Мазур Е.С., Мазур В.В., Баженов Н.Д., Нилова О.В., Николаева Т.О. Эпикардиальный жир и механическая дисперсия левого предсердия у больных артериальной гипертензией с персистирующей фибрилляцией предсердий и без нарушения сердечного ритма. Кардиоваскулярная терапия и профилактика. 2024;23(1):3758. https://doi.org/10.15829/1728-8800-2024-3758. EDN: KGKLOY
For citation:
Mazur E.S., Mazur V.V., Bazhenov N.D., Nilova O.V., Nikolaeva T.O. Epicardial fat and left atrial mechanical dispersion in patients with hypertension with persistent atrial fibrillation and without cardiac arrhythmia. Cardiovascular Therapy and Prevention. 2024;23(1):3758. (In Russ.) https://doi.org/10.15829/1728-8800-2024-3758. EDN: KGKLOY
JATS XML

























































