Перейти к:
Валидация шкал генетического риска развития артериальной гипертензии на популяции региона Центральной России
https://doi.org/10.15829/1728-8800-2023-3801
EDN: HHXAPO
Аннотация
Цель. Провести валидацию и оценить точность 4 шкал генетического риска (ШГР) артериальной гипертензии (АГ), созданных ранее на европейских выборках, на популяционной выборке населения Ивановской области.
Материал и методы. Для генетического анализа было использовано секвенирование следующего поколения с использованием таргетной панели на выборке региона Центральной России (n=1682) на основе коллекции биобанка. Для валидации отобрано четыре ШГР, ассоциированных с АГ, ранее разработанных для европейской популяции. В качестве метрик качества для моделей регрессии использованы коэффициент детерминации и площадь под ROC-кривой. Проведена дополнительная валидация с включением всех вариантов нуклеотидной последовательности, независимо от уровня их неравновесного сцепления. Составлена объединенная ШГР на основе коэффициентов из отдельных ШГР методом C+T (clumping + thresholding).
Результаты. В рамках исследования было продемонстрировано, что предсказательная способность ранее разработанных ШГР при использовании для популяции региона Центральной России ниже, чем в оригинальных исследованиях, доля объясненной дисперсии составила 0,5-0,8%. Наилучшую предсказательную способность (доля объясненной дисперсии — 2,5%) продемонстрировало применение ранее разработанной ШГР (Evangelou E, et al., 2018), включающей наибольшее количество вариантов нуклеотидной последовательности (n=852).
Заключение. ШГР АГ, разработанные на европейских выборках, не рекомендуется использовать у представителей российской популяции без предварительной валидации. Для создания собственных ШГР не рекомендуется объединять статистические параметры (β -коэффициенты и p-value) из различных ШГР с целю создания собственных ШГР.
Ключевые слова
Для цитирования:
Лимонова А.С., Ершова А.И., Киселева А.В., Куценко В.А., Раменский В.Е., Вяткин Ю.В., Сотникова Е.А., Жарикова А.А., Зайченока М., Покровская М.С., Шальнова С.А., Мешков А.Н., Драпкина О.М. Валидация шкал генетического риска развития артериальной гипертензии на популяции региона Центральной России. Кардиоваскулярная терапия и профилактика. 2023;22(12):3801. https://doi.org/10.15829/1728-8800-2023-3801. EDN: HHXAPO
For citation:
Limonova A.S., Ershova A.I., Kiseleva A.V., Kutsenko V.A., Ramensky V.E., Vyatkin Yu.V., Sotnikova E.A., Zharikova A.A., Zaichenoka M., Pokrovskaya M.S., Shalnova S.А., Meshkov A.N., Drapkina O.M. Validation of genetic risk scores for hypertension in the Central Russian population. Cardiovascular Therapy and Prevention. 2023;22(12):3801. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3801. EDN: HHXAPO
Введение
Артериальной гипертонией (АГ) страдают 1,28 млрд человек во всем мире1. Она является одним из ведущих, но при этом модифицируемым, факторов риска развития сердечно-сосудистых заболеваний (включая ишемическую болезнь сердца, инфаркт миокарда, инсульт, сердечную недостаточность, заболевания периферических артерий и фибрилляцию предсердий), а также поражения почек, глаз и когнитивных нарушений [1]. АГ имеет комплексную этиологию, включающую генетическую предрасположенность и факторы окружающей среды [2]. С помощью исследований полногеномного поиска ассоциаций GWAS (genome-wide association studies) выявлено множество локусов и вариантов, как частых, так и редких, связанных с уровнем артериального давления (АД) [3, 4]. Понимание генетической предрасположенности к гипертонии могло бы стать полезным инструментом для выявления среди молодых лиц группы повышенного риска развития АГ с целью реализации для нее особых профилактических мероприятий и наблюдений для своевременной установки диагноза. Согласно данным Всемирной организации здравоохранения, лишь 42% случаев заболевания АГ оказываются диагностированы1, что подчеркивает важность обсуждаемой стратегии для своевременного выявления заболевания.
Однако каждый в отдельности генетический вариант имеет слабое влияние на развитие многофакторных заболеваний, объясняет очень малую долю наследственности в развитии заболевания и, таким образом, имеет ограниченную предсказательную ценность. Одним из решений повышения предсказательной способности генетического тестирования является объединение информации о нескольких вариантах нуклеотидной последовательности (ВНП) в единую систему оценки риска, часто называемую шкалой генетического риска (ШГР) [5]. С помощью ШГР, включавшей >1 млн ВНП, Vaura F, et al. (2021) продемонстрировали увеличение риска развития не только АГ, но и сердечно-сосудистых заболеваний [6]. Более того, было показано увеличение предсказательной способности модели для оценки риска развития АГ при добавлении к клинической информации данных ШГР. Тем не менее стоит отметить, что интерпретация результатов ШГР по сравнению с генетической диагностикой моногенной патологии не является однозначной и позволяет определить лишь вероятность развития заболевания, а не его точный прогноз. На данный момент клинические рекомендации по применению данного подхода отсутствуют. Как заключают авторы недавно опубликованного рекомендательного документа Американского колледжа медицинской генетики и геномики (American College of Medical Genetics and Genomics), для внедрения ШГР в клиническую практику необходимы дальнейшие проспективные исследования [7].
Применение ШГР на этнической группе, отличной от группы, на которой разработана ШГР, может приводить к неверным оценкам [8], что отчасти обусловлено различиями в неравновесном сцеплении ВНП (linkage disequilibrium) и частотами аллелей [9][10]. Целью настоящего исследования было оценить воспроизводимость ШГР АГ, ранее разработанных на европейских популяциях, у лиц, проживающих на территории Центральной России.
Материал и методы
Выборка. В настоящее исследование была включена репрезентативная выборка населения Ивановской области из исследования ЭССЕ-РФ (Иваново) (Эпидемиология сердечно-сосудистых заболеваний и их факторов риска в регионах Российской Федерации) [11]. После исключения из анализа родственников в исследование включено 1682 человека (медиана возраста и интерквартильный размах составили, соответственно, 49 [ 39; 56] лет). Из них 629 мужчин 44 [ 33; 53] лет и 1053 женщин 52 [ 43; 57] лет.
В рамках исследования ЭССЕ-РФ диагноз АГ устанавливали при положительном ответе на вопрос "Принимали ли Вы препараты, снижающие АД в течение последних 2 нед.?" и/или при уровне систолического АД (САД) ≥140 мм рт.ст. и/или диастолического АД ≥90 мм рт.ст.
Секвенирование. Геномную дезоксирибонуклеиновую кислоту (ДНК) выделяли из образцов цельной крови с использованием набора QIAamp DNA Blood Mini Kit (Qiagen, Германия). Для измерения концентрации ДНК использовали флуориметр Qubit 4.0 (Thermo Fisher Scientific, США). Молекулярно-генетический анализ проводили с помощью диагностической панели для прогнозирования хронических неинфекционных заболеваний (ишемической болезни сердца, АГ, острого нарушения мозгового кровообращения), разработанной в ФГБУ "НМИЦ ТПМ" Минздрава России для анализа с помощью секвенирования следующего поколения на приборе NextSeq 550 (Illumina, США). Все этапы были выполнены в соответствии с протоколами производителей.
Выбор ШГР. На основании анализа литературных данных были отобраны 4 ШГР АГ [4][12-14], разработанные на европейской популяции и опубликованные до начала проведения исследования (в 2019г). Критериями выбора ШГР являлись: количество включенных ВНП (не >1 тыс.), размер выборки в деривационном исследовании не <100 тыс. человек. Обобщенная информация по данным ШГР представлена в таблице 1.
Биоинформатический анализ. Чтения с парными концами в формате fastq были выровнены на референсный геном GRCh37/hg19. Обработка данных и оценка контроля качества выполнялись с помощью специально разработанного пайплайна [15] на базе GATK v.3.8 [16]. ШГР вычислены для каждого образца посредством суммирования эффектов каждого ВНП с применением β-коэффициентов и значений p-value из оригинальных исследований.
Статистический анализ. Для статистического анализа были использованы инструменты языка R v. 4.1. Анализ ассоциаций ШГР с АГ проведен при помощи логистической регрессии с поправкой на пол, возраст и прием антигипертензивной терапии. В качестве метрик качества для моделей регрессии использованы частичный коэффициент детерминации (R2) и площадь под ROC-кривой (area under curve — AUC). Уровень значимости принят равным 0,05.
На следующем этапе анализа была составлена объединенная ШГР на основе коэффициентов из отдельных ШГР методом C+T (clumping + thresholding) [5]. На этапе "clumping" были оставлены только ВНП, имевшие максимальную парную корреляцию с остальными ВНП не >0,1. Оставшиеся ВНП на этапе "thresholding" были подвергнуты пошаговому включению в ШГР на основе медиан р-значений из рассмотренных ШГР. В качестве β-коэффициента использовался медианный β-коэффициент из рассматриваемых ВНП (в том случае, когда один и тот же ВНП использован в нескольких ШГР). Ассоциация ШГР и АГ оценивалась на каждом шаге.
На заключительном этапе проведена дополнительная валидация ШГР Evangelou E, et al. (2018) [4]. Были ослаблены предположения на корреляционную структуру данных, наложенные ранее: включены все ВНП независимо от уровня их неравновесного сцепления. Кроме того, в ШГР включены ВНП, которые ассоциированы с диастолическим и пульсовым давлением.
Результаты
Распространенность АГ в выборке составила 53,8% (902 чел.), из них 64,2% (572 чел.) принимали гипотензивную терапию. Средние показатели САД составили 136±19 мм рт.ст., диастолического АД — 84±10 мм рт.ст.
Первым этапом был проведен анализ силы ассоциации между исследуемыми ШГР и АГ c применением AUC (рисунок 1, таблица 2), AUC варьировала от 52,61% до 54,63%. При этом статистически значимая распространенность АГ для нижнего и верхнего децилей ШГР была установлена только для ШГР из исследования Evangelou E, et al. (2018) [4]. Результаты регрессионного анализа, представленные в виде коэффициента детерминации R2 с поправкой на пол, возраст и прием антигипертензивной терапии, представлены на рисунке 2. Значение R2 для всех 4-х ШГР представлено в таблице 1.
Вторым этапом анализа методом C+T была составлена объединенная ШГР, включавшая 404 ВНП, что позволило достичь увеличения R2 до 1,5% (рисунок 3). Шанс иметь АГ достоверно увеличивался в среднем в 1,020 раза (95% доверительный интервал (ДИ): 1,012-1,028, p<0,001) на каждый балл ШГР. Разница в распространенности АГ между нижним и верхним децилем составила 17,8% (95% ДИ: 6,7-28,8, p=0,004) (рисунок 4). AUC составила 56,01% (95% ДИ: 53,27-58,76%).
На заключительном этапе проведена дополнительная валидация ШГР Evangelou E, et al. (2018). Всего было включено 852 ВНП (для 49 ВНП отсутствовали данные секвенирования). Полученная ШГР была значимо (p<0,001) ассоциирована с увеличением САД. Полученная ШГР объясняет 2,5% дисперсии САД (рисунок 5), AUC составила 56,01% (95% ДИ: 53,27-56,01%). Одно стандартное отклонение ШГР соответствовало увеличению САД на 1,3 мм рт.ст. Распространенность АГ для нижнего дециля составила 46,75% (95% ДИ: 39,04-54,56%), для верхнего — 64,50 % (95% ДИ: 56,78-71,69%).
Таблица 1
Параметры отобранных для данного исследования ШГР АГ
Источник (автор публикации, год) | Размер выборки, чел. | Количество ВНП, включенных в ШГР в оригинальном исследовании | Количество ВНП в настоящем исследовании | Метрики предсказательной способности ШГР, представленные в статье | R2 в настоящем исследовании, % |
Ehret GB, et al. (2011) [12] | 200000 | 29 | 28 | R2 =0,9% | 0,7 |
Ehret GB, et al. (2016) [13] | 201529 | 66 | 54 | R2 =3,4 | 0,5 |
Warren HR, et al. (2017) [14] | 140668 | 152 | 148 | для верхнего квинтиля шанс наличия АГ повышен в >2 раза, по сравнению с нижним (ОШ 2,32, 95% ДИ: 1,76-3,06) | 0,8 |
Evangelou E, et al. (2018) [4] | 757601 | 901 | 255 | R2 =11,2% | 0,8 |
Примечание: АГ — артериальная гипертензия, ДИ — доверительный интервал, ВНП — вариант нуклеотидной последовательности, ОШ — отношение шансов, ШГР — шкала генетического риска.
Таблица 2
Анализ площади под кривой (AUC) для наличия АГ и распространенность АГ для нижнего и верхнего децилей ШГР
Источник (автор публикации, год) | Значение AUC, % p значение | Распространенность АГ для нижнего дециля | Распространенность АГ для десятого дециля | p-значение для распространенности АГ в нижнем и верхнем децилях |
Ehret GB, et al. (2011) [12] | 53,15; (50,38-53,15) 0,026 | 50,89 (43,10-58,65) | 58,58 (50,76-66,09) | 0,190 |
Ehret GB, et al. (2016) [13] | 52,61; (49,84-52,61), 0,046 | 47,93 (40,20-55,73) | 56,21 (48,38-63,82) | 0,157 |
Warren HR, et al. (2017) [14] | 52,89; (50,12-52,89) 0,041 | 51,48 (43,68-59,23) | 60,95 (53,16-68,35) | 0,100 |
Evangelou E, et al. (2018) [4] | 54,63; (51,88-54,63) 0,001 | 44,97 (37,32-52,80) | 65,68 (58,00-72,80) | <0,001 |
Примечание: АГ — артериальная гипертония, ШГР — шкала генетического риска, AUC — аrea under the curve (площадь под ROC-кривой).
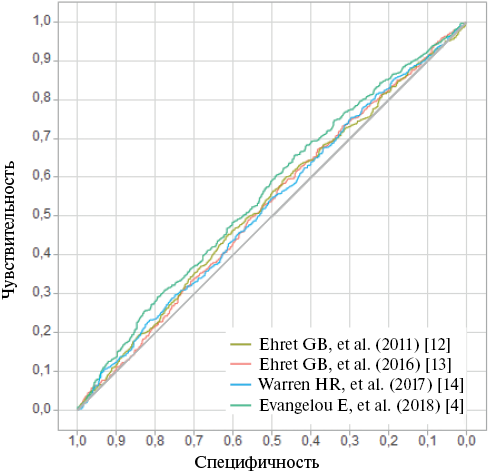
Рис. 1 ROC-кривая для четырех ШГР.
Примечание: ШГР — шкала генетического риска, AUC — аrea under the curve (площадь под ROC-кривой). Цветное изображение доступно в электронной версии журнала.
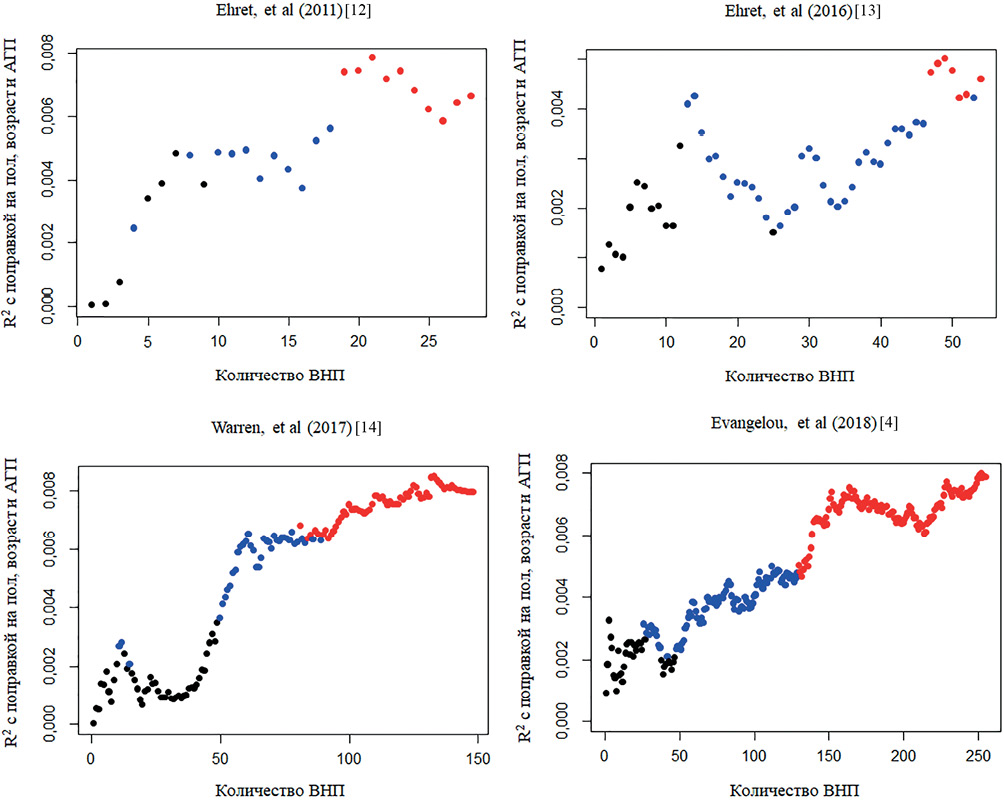
Рис. 2 Результаты линейной регрессии для ассоциации уровня САД со значениями ШГР.
Примечание: для корреляции Пирсона между САД и значением ШГР (из исследований [4][12-14]: черный — p>0,05, синий — p<0,05, красный — p<0,005. АГП — прием антигипертензивных препаратов, ВНП — вариант нуклеотидной последовательности, САД — систолическое артериальное давление, ШГР — шкала генетического риска, R2 — коэффициент детерминации. Цветное изображение доступно в электронной версии журнала.
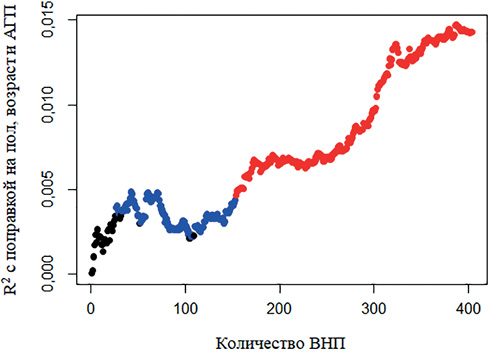
Рис. 3 Результаты линейной регрессии для ассоциации уровня САД со значением объединенной ШГР на основе 404 ВНП.
Примечание: для корреляции Пирсона между САД и значением ШГР: черный — p>0,05, синий — p<0,05, красный — p<0,005. АГП — прием антигипертензивных препаратов, ВНП — вариант нуклеотидной последовательности, САД — систолическое артериальное давление, ШГР — шкала генетического риска, R2 — коэффициент детерминации. Цветное изображение доступно в электронной версии журнала.
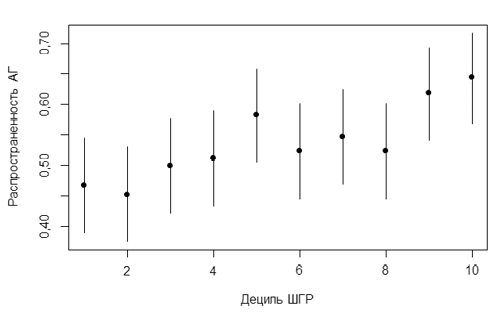
Рис. 4 Распространенность АГ для объединенной ШГР на основе 404 ВНП.
Примечание: АГ — артериальная гипертензия, ВНП — вариант нуклеотидной последовательности, ШГР — шкала генетического риска.
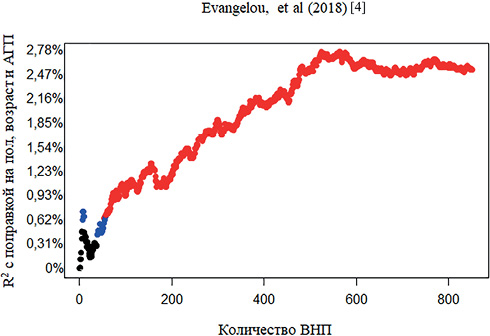
Рис. 5 Результаты линейной регрессии для ассоциации уровня САД со значениями ШГР (Evangelou E, et al, 2018) [4] после включения большего количества ВНП.
Примечание: для корреляции Пирсона между САД и значением ШГР: черный — p>0,05, синий — p<0,05, красный — p<0,005. АГП — прием антигипертензивных препаратов, ВНП — вариант нуклеотидной последовательности, САД — систолическое артериальное давление, ШГР — шкала генетического риска, R2 — коэффициент детерминации. Цветное изображение доступно в электронной версии журнала.
Обсуждение
В настоящей работе впервые проведена валидация ШГР АГ, разработанных на европейских выборках, у представителей российской популяции. Доля объясненной дисперсии для ШГР, включавшей наименьшее количество ВНП [12], сопоставима с результатами оригинальной статьи. Однако полученные нами результаты валидации ШГР на основе большего количества ВНП [4] продемонстрировали более чем в десять раз меньшую долю объясненной дисперсии. Эти результаты согласуются с данными о том, что применение ШГР для этнических групп, отличных от той, для которой разработана ШГР, могут приводить к другим результатам. Есть данные, что экстраполяция результатов GWAS, полученных на одной этнической группе, при разработке ШГР для других этнических групп, может приводить к неверным оценкам [8]. Так, в исследовании Ehret GB, et al. (2016) продемонстрировано, что ассоциации ВНП с АГ различны для представителей выборок европейского и неевропейского (южноазиатского, восточноазиатского и африканского) происхождения [13]. Показано, что точность генетических предсказаний для разных популяций снижается практически линейно по мере увеличения различий между выборками [17].
Для исследований, посвященных разработке ШГР, отсутствует стандартизированный набор оцениваемых на основании ШГР параметров, что может затруднять сравнение результатов разных исследований между собой. Только в одном из 4-х исследований (ШГР которых были выбраны для валидации в рамках нашего исследования) авторы оценивают распространенность АГ между нижним и верхним децилями [12]. При этом авторы получают значимые различия, однако интерпретация затруднительна в силу существенных различий размеров выборки [5]. Отсутствует единообразие в оценке метрик качества/предсказательной способности ШГР, с этой целью часто оценивают доли объясненной дисперсии. Ее увеличение при создании объединенной ШГР в рамках данного исследования согласуется с фактом, что предсказательная способность ШГР возрастает при увеличении количества ВНП, включенных в ШГР. Так, для одной и той же когорты было продемонстрировано, что увеличение количества ВНП с 29 [18] до 858 [19] позволяло увеличить предсказательную ценность ШГР. В настоящем исследовании R2 увеличился с 0,9 до 2,5% при увеличении количества включенных ВНП с 28 до 852. Однако стоит отметить, что подобное конструирование ШГР имеет ограничения [5]: р-значения исходных ШГР зависели от размеров выборок, использованных для построения этих ШГР; коэффициенты исходных ШГР могли быть поправлены на структуру сцепленности ВНП.
На основании проведенной валидации ШГР с созданием собственной ШГР, наибольшую предсказательную способность имела ранее разработанная ШГР, включающая наибольшее количество ВНП. Это можно объяснить тем, что объединение необходимых статистических параметров (β-коэффициенты и p-value) из нескольких ШГР с целью создания собственных ШГР не является оптимальным подходом. Более результативным является применение готовых ШГР (после их валидации), включающих наибольшее количество ВНП, либо создание ШГР на основе данных GWAS, в т.ч. на представителях российской популяции.
Заключение
ШГР АГ, разработанные на европейских выборках, не рекомендуется использовать у представителей российской популяции без предварительной валидации. Прогностическая ценность ШГР может быть улучшена за счет увеличения количества ВНП, включенных в ШГР. Для создания собственных ШГР не рекомендуется объединять статистические параметры (β-коэффициенты и p-value) из различных ШГР.
Отношения и деятельность. Научно-исследовательская работа "Разработка интегрированных систем прогнозирования в персонализированной медицине". Рег. № 121021700364-1.
1 World Health Organization. Hypertension. https://www.who.int/news-room/fact-sheets/detail/hypertension (17 September 2023).
Список литературы
1. Williams B, Mancia G, Spiering W, et al. 2018 Practice Guidelines for the Management of Arterial Hypertension of the European Society of Hypertension and the European Society of Cardiology: ESH/ESC Task Force for the Management of Arterial Hypertension. J Hypertens. 2018; 36(12):2284-309. doi:10.1097/HJH.0000000000001961.
2. Oparil S, Acelajado MC, Bakris GL, et al. Hypertension. Nat Rev Dis Primers. 2018;4:18014. doi:10.1038/nrdp.2018.14.
3. Giri A, Hellwege JN, Keaton JM, et al. Trans-ethnic association study of blood pressure determinants in over 750,000 individuals. Nat Genet. 2019;51(1):51-62. doi:10.1038/s41588-018-0303-9.
4. Evangelou E, Warren HR, Mosen-Ansorena D, et al. Genetic analysis of over 1 million people identifies 535 new loci associated with blood pressure traits. Nat Genet. 2018;50(10):1412-25. doi:10.1038/s41588-018-0205-x.
5. Choi SW, Mak TSH, O’Reilly PF. Tutorial: a guide to performing polygenic risk score analyses. Nat Protoc. 2020;15(9):2759-72. doi:10.1038/s41596-020-0353-1.
6. Vaura F, Kauko A, Suvila K, et al. Polygenic risk scores predict hypertension onset and cardiovascular risk. Hypertension. 2021; 77(4):1119-27. doi:10.1161/HYPERTENSIONAHA.120.16471.
7. Abu-El-Haija A, Reddi HV, Wand H, et al. The clinical application of polygenic risk scores: A points to consider statement of the American College of Medical Genetics and Genomics (ACMG). Genet Med. 2023;25(5):100803. doi:10.1016/j.gim.2023.100803.
8. Martin AR, Gignoux CR, Walters RK, et al. Human Demographic History Impacts Genetic Risk Prediction across Diverse Populations. Am J Hum Genet. 2017;100(4):635-49. doi:10.1016/j.ajhg.2017.03.004.
9. Morales J, Welter D, Bowler EH, et al. A standardized framework for representation of ancestry data in genomics studies, with application to the NHGRI-EBI GWAS Catalog. Genome Biol. 2018; 19(1):21. doi:10.1186/s13059-018-1396-2.
10. Sakaue S, Hirata J, Kanai M, et al. Dimensionality reduction reveals fine-scale structure in the Japanese population with consequences for polygenic risk prediction. Nat Commun. 2020;11(1):1569. doi:10.1038/s41467-020-15194-z.
11. Научноорганизационный комитет проекта ЭССЕ-РФ. Эпидемиология сердечно-сосудистых заболеваний в различных регионах России (ЭССЕ-РФ). Обоснование и дизайн исследования. Профилактическая медицина. 2013;16(6):25-34.
12. Ehret GB, Munroe PB, Rice KM, et al. Genetic variants in novel pathways influence blood pressure and cardiovascular disease risk. Nature. 2011;478(7367):103-9. doi:10.1038/nature10405.
13. Ehret GB, Ferreira T, Chasman DI, et al. The genetics of blood pressure regulation and its target organs from association studies in 342,415 individuals. Nat Genet. 2016;48(10):1171-84. doi:10.1038/ng.3667.
14. Warren HR, Evangelou E, Cabrera CP, et al. Genome-wide association analysis identifies novel blood pressure loci and offers biological insights into cardiovascular risk. Nat Genet. 2017;49(3):403-15. doi:10.1038/ng.3768.
15. Ramensky VE, Ershova AI, Zaicenoka M, et al. Targeted Sequencing of 242 Clinically Important Genes in the Russian Population From the Ivanovo Region. Front Genet. 2021;12. doi:10.3389/FGENE.2021.709419/FULL.
16. van der Auwera G, O'Connor BD. Genomics in the Cloud: Using Docker, GATK, and WDL in Terra. O’Reilly Media, Inc. 2020. ISBN: 9781491975190.
17. Scutari M, Mackay I, Balding D. Using Genetic Distance to Infer the Accuracy of Genomic Prediction. PLoS Genet. 2016;12(9): e1006288. doi:10.1371/journal.pgen.1006288.
18. Fava C, Sjögren M, Montagnana M, et al. Prediction of blood pressure changes over time and incidence of hypertension by a genetic risk score in swedes. Hypertension. 2013;61(2):319-26. doi:10.1161/HYPERTENSIONAHA.112.202655.
19. Giontella A, Sjögren M, Lotta LA, et al. Clinical Evaluation of the Polygenetic Background of Blood Pressure in the PopulationBased Setting. Hypertension. 2021;77:169-77. doi:10.1161/hypertensionaha.120.15449.
Об авторах
А. С. ЛимоноваРоссия
н.с. лаборатории клиномики.
Москва
А. И. Ершова
Россия
д.м.н., лаборатория клиномики, руководитель, зам. директора по фундаментальной науке.
Москва
А. В. Киселева
Россия
к.б.н., в.н.с., Институт персонализированной терапии и профилактики, лаборатория молекулярной генетики, руководитель.
Москва
В. А. Куценко
Россия
с.н.с., лаборатория биостатистики отдела эпидемиологии хронических неинфекционных заболеваний, аспирант механико-математического факультета.
Москва
В. Е. Раменский
Россия
в.н.с., руководитель лаборатории геномной и медицинской биоинформатики, Институт персонализированной терапии и профилактики, доцент факультета биоинженерии и биоинформатики.
Москва
Ю. В. Вяткин
Россия
Программист, Институт персонализированной терапии и профилактики, лаборатория геномной и медицинской биоинформатики, старший преподаватель факультета естественных наук, кафедра молекулярной биологии и биотехнологии.
Москва, Новосибирск
Е. А. Сотникова
Россия
с.н.с. лаборатории молекулярной генетики, Институт персонализированной терапии и профилактики.
Москва
А. А. Жарикова
Россия
к.б.н., лаборатория молекулярной генетики, Институт персонализированной терапии и профилактики, в.н.с., старший преподаватель факультета биоинженерии и биоинформатики.
Москва
М. Зайченока
Россия
Аспирант, Физтех-школа биологической и медицинской физики.
Московская область, Долгопрудный
М. С. Покровская
Россия
к.б.н., в.н.с., руководитель Лаборатории "Банк биологического материала", Институт персонализированной терапии и профилактики.
Москва
С. А. Шальнова
Россия
д.м.н., профессор, руководитель отдела эпидемиологии хронических неинфекционных заболеваний.
Москва
А. Н. Мешков
Россия
д.м.н., руководитель Института персонализированной терапии и профилактики.
Москва
О. М. Драпкина
Россия
д.м.н., профессор, академик РАН, директор.
Москва
Дополнительные файлы
Что известно о предмете исследования?
- Применение шкал генетического риска (ШГР) требует предварительной валидации.
Что добавляют результаты исследования?
- Предсказательная способность ранее разработанных на европейской популяции ШГР артериальной гипертензии при использовании на представителях популяции региона Центральной России ниже, чем в оригинальных исследованиях.
- При разработке собственных ШГР рекомендуется включение большего количества вариантов нуклеотидной последовательности и применение данных полногеномного поиска ассоциаций, в т.ч. на представителях российской популяции.
Рецензия
Для цитирования:
Лимонова А.С., Ершова А.И., Киселева А.В., Куценко В.А., Раменский В.Е., Вяткин Ю.В., Сотникова Е.А., Жарикова А.А., Зайченока М., Покровская М.С., Шальнова С.А., Мешков А.Н., Драпкина О.М. Валидация шкал генетического риска развития артериальной гипертензии на популяции региона Центральной России. Кардиоваскулярная терапия и профилактика. 2023;22(12):3801. https://doi.org/10.15829/1728-8800-2023-3801. EDN: HHXAPO
For citation:
Limonova A.S., Ershova A.I., Kiseleva A.V., Kutsenko V.A., Ramensky V.E., Vyatkin Yu.V., Sotnikova E.A., Zharikova A.A., Zaichenoka M., Pokrovskaya M.S., Shalnova S.А., Meshkov A.N., Drapkina O.M. Validation of genetic risk scores for hypertension in the Central Russian population. Cardiovascular Therapy and Prevention. 2023;22(12):3801. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3801. EDN: HHXAPO
JATS XML

























































