Перейти к:
Мультидисциплинарный подход в дифференциальной диагностике синдрома гипертрофии левого желудочка на примере клинического случая
https://doi.org/10.15829/1728-8800-2024-3837
EDN: TVCCIX
Аннотация
Гипертрофия миокарда левого желудочка (ЛЖ) подразумевает под собой структурные изменения сердечной стенки и, как следствие, увеличение массы миокарда. На текущий момент выделяют множество причин данного состояния: гипертоническую болезнь, аортальный стеноз, гипертрофическую кардиомиопатию, спортивные тренировки, болезни накопления (AL, ATTR-амилоидоз, болезнь Данона, болезнь Андерсона-Фабри и др.), нарушение метаболизма. Несмотря на существующие в настоящее время алгоритмы диагностики при гипертрофии ЛЖ, установление верного диагноза может занимать длительное время, а спорные результаты исследований — приводить к ложным выводам. В настоящей статье представлен клинический случай пациентки с гипертрофией миокарда ЛЖ, нетипичной клинической картиной и неоднозначными результатами инструментальных исследований, что привело к определенным трудностям диагностического поиска.
Ключевые слова
Для цитирования:
Кудрявцева М.М., Рыжкова Е.В., Куликова О.В., Мершина Е.А., Синицын В.Е., Драпкина О.М., Мясников Р.П. Мультидисциплинарный подход в дифференциальной диагностике синдрома гипертрофии левого желудочка на примере клинического случая. Кардиоваскулярная терапия и профилактика. 2024;23(2):3837. https://doi.org/10.15829/1728-8800-2024-3837. EDN: TVCCIX
For citation:
Kudryavtseva M.M., Ryzhkova E.V., Kulikova O.V., Mershina E.A., Sinitsyn V.E., Drapkina O.M., Myasnikov R.P. Multidisciplinary approach in the differential diagnosis of left ventricular hypertrophy: a case report. Cardiovascular Therapy and Prevention. 2024;23(2):3837. (In Russ.) https://doi.org/10.15829/1728-8800-2024-3837. EDN: TVCCIX
Введение
Гипертрофия миокарда левого желудочка (ЛЖ) — наиболее часто выявляемое состояние при проведении визуализирующих методик. Под гипертрофией миокарда ЛЖ принимают утолщение его стенок и/или расширение полости, и, как следствие, увеличение массы миокарда, развивающееся как при физиологических состояниях, так и при артериальной гипертензии, аортальных пороках, недостаточности митрального клапана, первичных кардиомиопатиях (гипертрофическая кардиомиопатия (ГКМП)), болезнях накопления (AL — amyloid light chain (амилоидоз легких цепей), ATTR — Transthyretin amyloidosis (транстиретиновый амилоидоз), болезнь Данона, болезнь Андерсона-Фабри и др.), нарушениях метаболизма и других заболеваниях [1]. В настоящее время гипертрофия ЛЖ рассматривается как предиктор развития жизнеугрожающих нарушений ритма вплоть до внезапной сердечной смерти [1]. Таким образом, своевременная диагностика и лечение данного состояния позволит предотвратить смерть пациента. Существенную роль в первичной диагностике и стратификации риска при гипертрофии миокарда ЛЖ играют методы визуализации, такие как трансторакальная эхокардиография (ЭхоКГ) и магнитно-резонансная томография (МРТ) сердца в отсроченную фазу. Несмотря на существующие в настоящее время алгоритмы диагностики при гипертрофии ЛЖ, установление верного диагноза может занимать длительное время, а спорные результаты исследований — приводить к ложным выводам. В настоящей статье представлен клинический случай пациентки с нетипичной клинической картиной и неоднозначными результатами инструментальных исследований.
Клинический случай
Во всех случаях от пациентов или их законных представителей получено письменное добровольное информированное согласие на публикацию описания клинического случая.
Информация о пациенте
Пациентка 57 лет поступила в кардиологическое отделение в июле 2023г в связи с жалобами на снижение толерантности к физическим нагрузкам, одышку, головокружение, наличие эпизодов учащенного аритмичного сердцебиения. Впервые жалобы на неритмичное сердцебиение и синкопальные состояния пациентка предъявляла во время первой беременности в 26 лет. По данным ЭхоКГ было выявлено незначительное утолщение стенок ЛЖ, однако дальнейшее обследование не проводилось. После второй беременности в 28 лет пациентка стала отмечать частые приступы неритмичного сердцебиения. По данным холтеровского мониторирования электрокардиограммы (ЭКГ) была верифицирована фибрилляция предсердий (ФП). Назначенная антиаритмическая терапия (соталол, пропафенон, аллапинин) не давала результата, в связи с чем в 2013г, в 47 лет, пациентке была проведена радиочастотная аблация, модификация операции "Лабиринт", в условиях искусственного кровообращения с положительным эффектом в виде уменьшения пароксизмов ФП.
В 2016г жалобы возобновились. Пациентка обратилась к кардиологу, было начато обследование. По данным ЭхоКГ отмечалось увеличение толщины межжелудочковой перегородки (МЖП) до 12 мм, дилатация левого предсердия (переднезадний размер 52 мм), незначительное снижение глобальной сократимости ЛЖ (фракция выброса (ФВ) ЛЖ 51% по методу Симпсона). По данным холтеровского мониторирования ЭКГ были зарегистрированы 13 тыс. одиночных желудочковых экстрасистол, пароксизмы неустойчивой желудочковой тахикардии. Для более детальной оценки структуры сердца и исключения воспалительных/рубцовых изменений миокарда пациентке была дважды (в 2016 и 2017гг) выполнена МРТ сердца (Siemens Magnetom Avanto) с контрастированием в отсроченную фазу. В обоих случаях было выявлено распространенное субэндокардиальное контрастирование в отсроченную фазу МЖП на всем протяжении, как со стороны ЛЖ, так и со стороны правого желудочка (ПЖ), с распространением на верхушечные сегменты ЛЖ и ПЖ (рисунок 1). На основании характера контрастирования в отсроченную фазу был заподозрен амилоидоз сердца. Выполнена биопсия подкожно-жировой клетчатки — амилоида не выявлено.
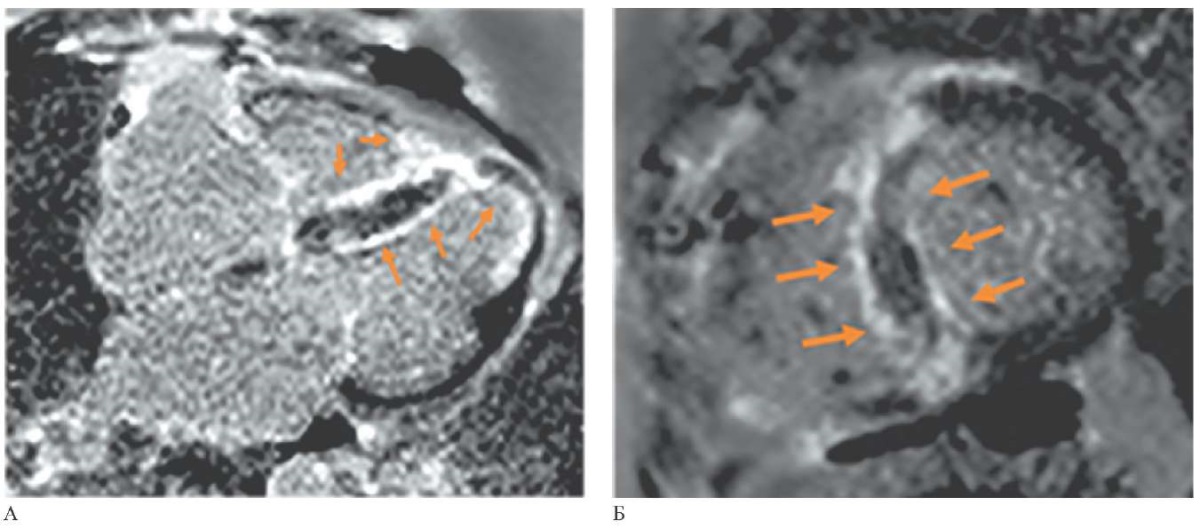
Рис. 1 МРТ сердца (2017г), отсроченное контрастирование,
IR-последовательность с подавлением сигнала от миокарда:
А — 4-камерная проекция, длинная ось,
Б — короткая ось на уровне средних сегментов ЛЖ.
Стрелками указаны зоны субэндокардиального контрастирования миокарда.
Несмотря на противоречивые результаты клинико-инструментальных исследований, диагноз амилоидоза снят не был, планировалось дообследование (проведение иммунохимического исследования сыворотки крови и мочи, сцинтиграфия миокарда, коронароангиография), от которого пациентка воздержалась ввиду удовлетворительного самочувствия на тот момент. Была назначена терапия: апиксабан 10 мг/сут., бисопролол 2,5 мг/сут., эналаприл 5 мг мг/сут., пропафенон 150 мг/сут., индапамид ретард 1,5 мг/сут.
На фоне принимаемых препаратов в течение последующих лет пациентка отмечала снижение толерантности к физической нагрузке, усугубление одышки, учащение приступов неритмичного сердцебиения. В 2023г пациентка обратилась к кардиологу центра и была госпитализирована в стационар ФГБУ "НМИЦ ТПМ" Минздрава России в связи с явлениями прогрессирования сердечной недостаточности.
Временнáя шкала (рисунок 2)

Рис. 2 Временнáя шкала.
Примечание: ЖТ — желудочковая тахикардия,
ЖЭС — желудочковая экстрасистолия МЖП — межжелудочковая перегородка,
МРТ — магнитно-резонансная томография, ФП — фибрилляция предсердий,
ХМ-ЭКГ — холтеровское мониторирование электрокардиограммы.
Результаты физикального осмотра
При осмотре — состояние средней степени тяжести, по органам и системам без особенностей. Рост: 165 см, вес: 74 кг, индекс массы тела: 27,2 кг/м². Артериальное давление на левой и правой руках одинаковое: 100/70 мм рт.ст. Частота сердечных сокращений 75 уд./мин. Пульс ритмичный на обеих руках. Частота дыхательных движений 18/мин. Периферические отеки — отечность голеней и стоп.
Результаты сбора семейного анамнеза (рисунок 3)
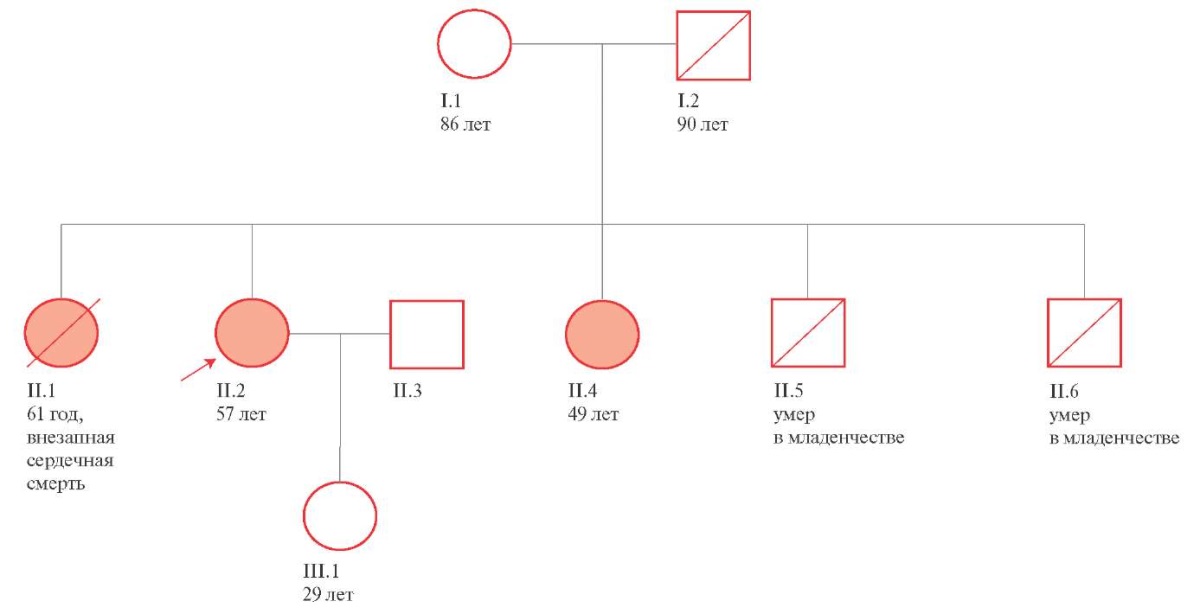
Рис. 3 Генетическое древо.
В ходе сбора семейного анамнеза при поступлении были установлено, что два родных младших брата пациентки умерли в младенческом возрасте внезапно, причина смерти установлена не была. При этом у двух родных сестер была диагностирована ГКМП.
ЭКГ при поступлении (рисунок 4)
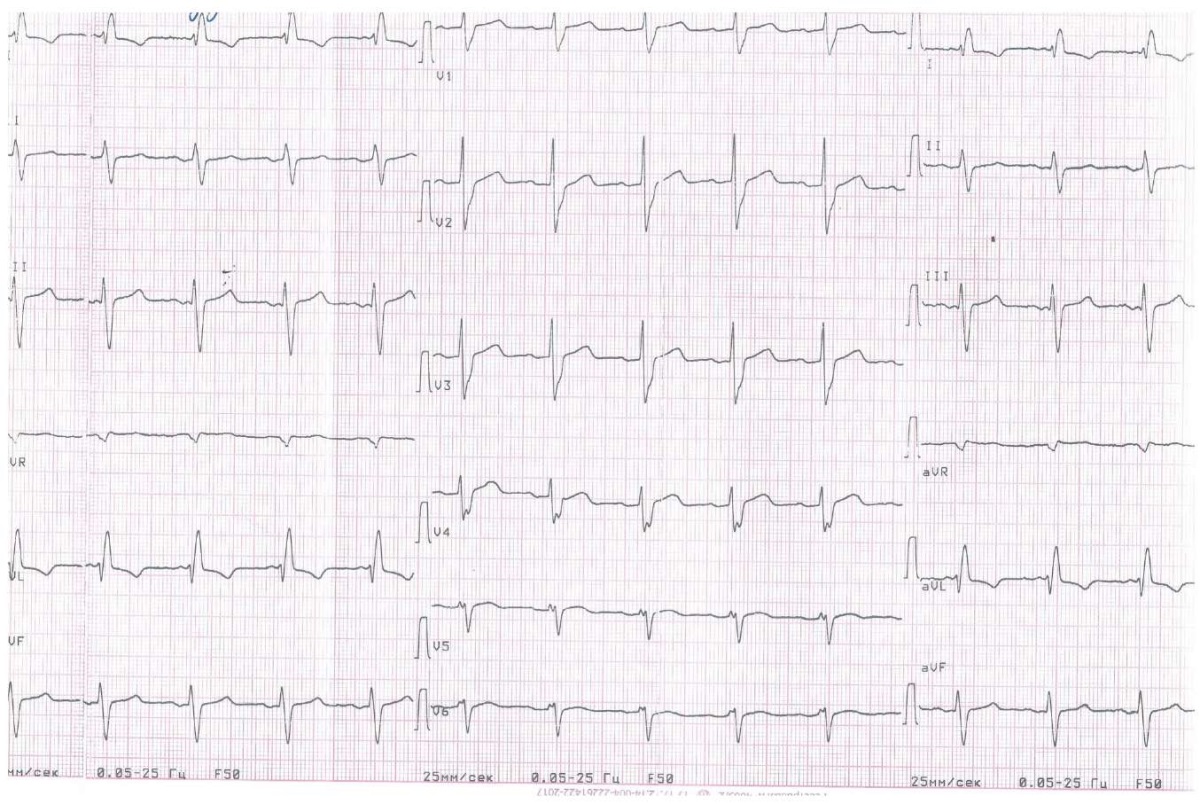
Рис. 4 ЭКГ.
Синусовый ритм с частотой сердечных сокращений 67 уд./мин, отклонение электрической оси сердца резко влево, блокада передней ветви левой ножки пучка Гиса, атриовентрикулярная блокада I ст., нарушение внутрижелудочковой проводимости.
Диагностическая оценка
При поступлении в стационар пациентке была выполнена трансторакальная ЭхоКГ (Mindray Resona 7), в ходе которой выявлены умеренная асимметричная гипертрофия миокарда ЛЖ с максимальной толщины МЖП до 15-16 мм (толщина задней стенки ЛЖ составила 7 мм) (рисунок 5), гипокинез МЖП при нормальных значениях глобальной сократимости ЛЖ (ФВ ЛЖ 63% по методу Симпсона), дилатация полости левого предсердия (переднезадний размер 51 мм, индексированный объем 49 мл/м²) и признаки диастолической дисфункция ЛЖ 2 типа. Признаков обструкции выносящего тракта ЛЖ не отмечалось.

Рис. 5 Трансторакальная ЭхоКГ, парастернальная проекция, длинная ось ЛЖ.
Стрелками отмечена гипертрофированная стенка МЖП (толщина стенки 15-16 мм).
По данным тканевой допплерографии в раннюю диастолу обращало на себя внимание более выраженное снижение скорости смещения фиброзного кольца митрального клапана в медиальной части (E’(s) =2,3 см/с) по сравнению с латеральной частью (E’(l) =11 см/с) (рисунок 6).
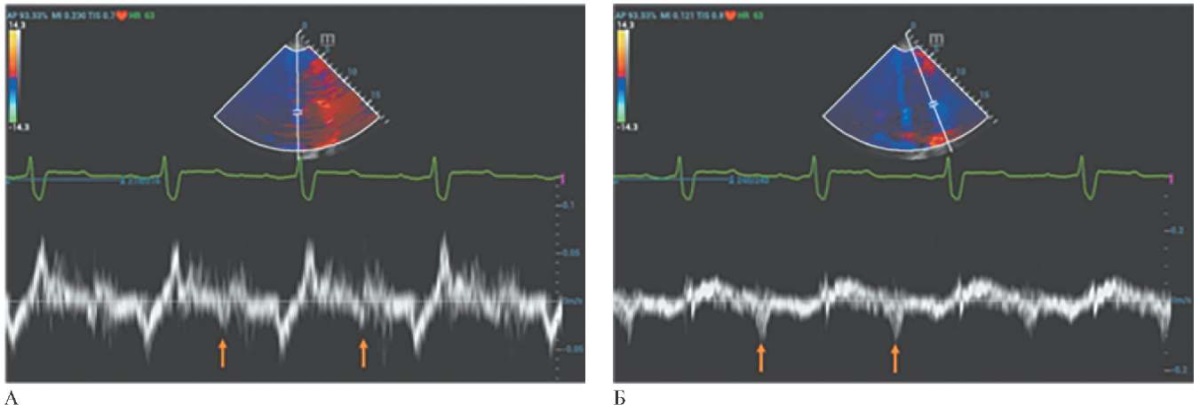
Рис. 6 Трансторакальная ЭхоКГ, апикальная 4-камерная проекция ЛЖ.
Тканевая допплерография:
А — пик миокардиальной скорости раннего диастолического наполнения
медиальной части фиброзного митрального кольца (E’(s) =2,3 см/с);
Б — пик миокардиальной скорости раннего диастолического наполнения
латеральной части фиброзного митрального кольца (E’(l) =11 см/с).
Примечание: цветное изображение доступно в электронной версии журнала.
При анализе продольной деформации ЛЖ отмечалось значительное снижение глобальной продольной деформации до (-)7%. При анализе продольной деформации по сегментам ЛЖ наиболее низкие показатели соответствовали перегородочным и апикальным сегментам (рисунок 7). Однако паттерна, характерного для амилоидоза сердца с относительным сохранением деформации верхушки ЛЖ, выявлено не было.
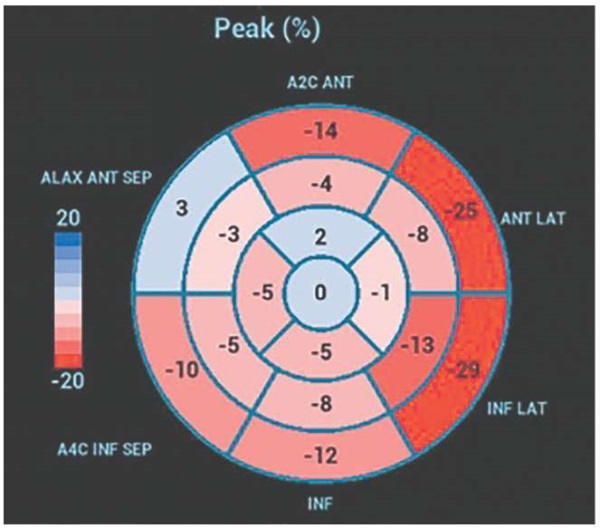
Рис. 7 Схема "бычий глаз" ЛЖ значений продольной деформации
по данным трансторакальной ЭхоКГ.
Пиковая глобальная продольная деформация ЛЖ составила (-) 7%.
В ходе повторного анализа данных МРТ сердца (Siemens Espree), выполненного накануне поступления в стационар, сохранялся прежний субэндокардиальный паттерн контрастирования МЖП в отсроченную фазу, как и на МРТ 6-летней давнос-
ти (рисунок 8).
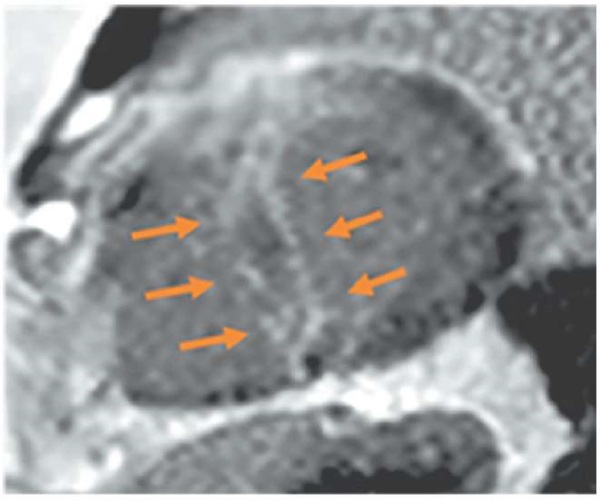
Рис. 8 МРТ сердца (2023г), отсроченное контрастирование,
IR-последовательность с подавлением сигнала от миокарда:
короткая ось на уровне средних сегментов ЛЖ.
Стрелками указаны зоны субэндокардиального контрастирования миокарда.
Была проведена сцинтиграфия миокарда, по результатам которой признаков накопления радиофармпрепарата не обнаружено. При иммунохимическом исследовании белков сыворотки крови и мочи моноклональной секреции также не выявлено. Пациентка была консультирована гематологом. Учитывая полученные результаты клинико-инструментальных исследований, диагноз ATTR- или AL-амилоидоз представлялся крайне сомнительным.
Принимая во внимание отягощенный семейный анамнез пациентки, было принято решение о проведении генетического исследования, в ходе которого выявлен вариант нуклеотидной последовательности (ВНП) в гене MYH7. В гене TTR мутации отсутствовали.
Таким образом, было принято решение о дальнейшем ведении и лечении, как пациентки с генетически детерминированной необструктивной ГКМП.
Клинический диагноз
Основное заболевание: Асимметричная ГКМП без обструкции выносящего тракта ЛЖ. Риск внезапной сердечной смерти по шкале HCM Risk-SCD — 12,57%.
Осложнения основного заболевания: Хроническая сердечная недостаточность IIА стадии с сохранной ФВ, II функциональный класс по NYHA (New-York Heart Association).
Нарушения ритма и проводимости сердца: пароксизмальная форма ФП (CHA2DS2-VASc (шкала для оценки риска тромбоэмболических осложнений) 2 балла, HAS-BLED (шкала для оценки риска кровотечения) 1 балл). Радиочастотная аблация, модификация операции "Лабиринт" от 2013г. Частая желудочковая экстрасистолия. Неустойчивая желудочковая тахикардия. Атриовентрикулярная блокада I ст. Блокада передней ветви левой ножки пучка Гиса.
Обсуждение
Кардиомиопатии представляют собой группу заболеваний, вызванных нарушением функции и структуры сердечной мышцы при отсутствии у пациента данных за ишемическую болезнь сердца, артериальную гипертонию, заболевание клапанного аппарата и наличие врожденных пороков. Согласно современным представлениям, кардиомиопатии классифицируют по их фенотипическим проявлениям. Таким образом, на текущий момент выделяют ГКМП, дилатационную, гипокинетическую недилатационную, рестриктивную, аритмогенную кардиомиопатии, а также неклассифицируемые состояния (синдром такоцубо, синдром некомпактного миокарда) [2].
Одной из самых распространенных форм кардиомиопатий является ГКМП, с частотой выявления среди взрослого населения 0,2% [2]. Это заболевание характеризуется утолщением миокарда ЛЖ и/или ПЖ >15 мм в любом сегменте у пробанда и 13-14 мм у родственников, которое невозможно объяснить перегрузкой желудочка объемом, и возникающее при отсутствии другого сердечного или системного заболевания, метаболического или полиорганного синдрома, связанного с гипертрофией ЛЖ [3]. Причиной развития данного состояния у пациента является наличие около 1500 ВНП в генах, ответственных за синтез структурных белков кардиомиоцитов, что приводит к утолщению и нарушению функции сердечной мышцы [4].
Для клинической картины ГКМП характерны снижение толерантности к физическим нагрузкам, одышка, боли ангинозного характера, ритмичное/неритмичное сердцебиение, синкопальные состояния. Следует отметить, что пациенты с ГКМП могут длительное время не предъявлять жалоб, в связи с чем диагноз чаще всего является находкой при проведении ЭКГ и ЭхоК Г.
ЭхоКГ относится к наиболее доступным способам визуализации на амбулаторном этапе и позволяет оценить выраженность гипертрофии миокарда, состояние митрального клапана, наличие признаков обструкции, анализируется систолическая и диастолическая функции желудочков. Кроме того, в современной рутинной практике ЭхоКГ часто применяется метод оценки пиковой продольной деформации ЛЖ [5]. Было показано, что снижение показателей деформации может быть обусловлено фиброзными изменениями миокарда при гипертрофии ЛЖ и является неблагоприятным прогностическим фактором [6].
Главным преимуществом МРТ сердца, помимо более точной оценки выраженности гипертрофии, является неинвазивная тканевая характеристика состояния миокарда. Проведение контрастирования гадолиний-содержащим препаратом при МРТ сердца в отсроченную фазу является обязательным при диагностике ГКМП. Выявление признаков контрастирования при ГКМП обусловлено развитием фиброзных изменений в миокарде и определяется в 65% случаев [7]. Как правило, при ГКМП контрастирование имеет очаговый интрамиокардиальный характер и ассоциировано с наиболее гипертрофированными сегментами миокарда. Субэндокардиальный и трансмуральный паттерны контрастирования миокарда встречаются значительно реже и, как правило, отмечаются при апикальной форме ГКМП и наличии мидвентрикулярной обструкции с формированием аневризмы верхушки ЛЖ [8-10].
Помимо метода контрастирования миокарда гадолиний-содержащим препаратами для тканевой характеристики миокарда в рутинную практику МРТ сердца сегодня внедряются методы Т1- и Т2-картирования миокарда, которые основываются на измерении времен Т1- и Т2-релаксации и могут помочь в диагностике ряда заболеваний миокарда и стратификации риска осложнений. Так, например, Т1-картирование помогает в дифференциальной диагностике ГКМП и сердца атлета, гипертонического сердца, при поражении сердца в случае болезни Андерсона-Фабри и амилоидоза. Повышение же показателя Т2-времени релаксации при ГКМП отмечалось у пациентов с высоким риском развития жизнеугрожающих нарушений ритма сердца. В представленном нами клиническом случае Т1- и Т2-картирование по техническим причинам не проводилось [11][12].
Однако для постановки окончательного диагноза в большинстве случаев методов визуализации миокарда бывает недостаточно ввиду наличия фенокопий ГКМП (AL, ATTR-амилоидоз, болезнь Данона, атаксия Фридрейха, болезнь Андерсона-Фабри и т.д.). В связи с этим был предложен мультидисциплинарный подход к дифференциальной диагностике пациентов с выявленной гипертрофией миокарда ЛЖ [13-15].
В описанном случае на основании результатов МРТ (а именно: наличия субэндокардиального контрастирования МЖП при умеренно выраженной гипертрофии миокарда ЛЖ) пациентка длительно наблюдалась с диагнозом амилоидоз сердца. Несмотря на отрицательные результаты биопсии и отягощенный семейный анамнез пациентки, возможность наличия генетически детерминированной кардиомиопатии не рассматривалась. Кроме того, всестороннего обследования для подтверждения/исключения амилоидоза в течение долгого времени не проводилось, что могло быть обусловлено недостаточной информированностью пациентки о потенциальных рисках ее состояния, таких как внезапная сердечная смерть.
Как известно, амилоидоз сердца представляет собой жизнеугрожающее заболевание, обусловленное внеклеточным отложением в миокарде амилоидных фибрилл. Амилоидоз может быть как наследственным, так и приобретенным заболеванием [16].
В настоящее время известно >30 белков, способных приводить к образованию амилоида, однако только 9 из них могут откладываться в миокарде, вызывая нарушение функции сердца. Согласно современным данным, >98% диагностированных случаев амилоидоза сердца обусловлено отложением фибрилл легких цепей моноклональных иммуноглобулинов (AL-амилоидоз) или транстиретина (ATTR-амилоидоз). Стоит также отметить, что ATTR-амилоидоз может быть как наследственным (ATTRv), так и приобретенным (ATTRwt, дикий тип) заболеванием [17].
К сожалению, данные ЭхоКГ и МРТ сердца при амилоидозе и при ГКМП могут быть во многом сходными. Так, для этих заболеваний характерными находками при визуализации являются увеличение толщины миокарда ЛЖ, развитие и прогрессирование диастолической дисфункции ЛЖ, дилатация предсердий. Однако при амилоидозе по данным ЭхоКГ отмечается, как правило, более выраженное снижение показателей тканевой допплерографии (Е’), диастолическая дисфункция ЛЖ 3 типа (рестриктивный тип), а также снижение глобальной продольной деформации ЛЖ с признаками относительного сохранения деформации верхушки ЛЖ. По данным МРТ для амилоидоза наиболее характерно субэндокардиальное или трансмуральное контраcтирование миокарда в отсроченную фазу [18].
В описанном нами случае по данным ЭхоКГ с течением времени отмечалось увеличение гипертрофии миокарда ЛЖ, что, принимая во внимание наличие распространенного фиброза миокарда по результатам МРТ, способствовало прогрессированию диастолической дисфункции ЛЖ при сохраненной систолической функции ЛЖ с развитием явлений сердечной недостаточности.
Согласно современным клиническим рекомендациям, диагноз амилоидоза сердца может быть подтвержден при биопсии миокарда. Однако проведение такого инвазивного исследования с повышенным риском осложнений обычно не требуется. Критериями постановки диагноза в этом случае являются обнаружение отложений амилоида при биопсии другого органа (например, почки или слизистой оболочки прямой или двенадцатиперстной кишки, жировой ткани) и наличие характерных изменений по данным ЭхоКГ и/или МРТ сердца.
При диагностике ATTR-амилоидоза применяется сцинтиграфия миокарда с радиофармпрепаратом (пирофосфатом технеция). Интенсивное накопление радиоактивного препарата в миокарде (2+/3+) в сочетании с изменениями по данным ЭхоКГ и/или МРТ при отсутствии моноклональной секреции при иммунохимическом исследовании белков сыворотки крови и мочи позволяют подтвердить ATTR-амилоидоз сердца [13][14].
ГКМП — это заболевание, преимущественно обусловленное мутациями в генах, кодирующих белки саркомера, и, согласно сегодняшним клиническим рекомендациям, обязательным при генетическом тестировании является анализ следующих 8 генов: MYH7, MYBPC3, TNNI3, TNNT2, TPM1, MYL2, MYL3 и ACTC1. ГКМП-ассоциированный вариант генов выявляется в 30% спорадических случаев и в 60% семейных случаев ГКМП [3].
Среди пациентов с ГКМП и патогенным вариантом мутаций в генах, кодирующих белки саркомера, наиболее часто встречаются мутации в 2 генах: MYH7 (ген, кодирующий тяжелую цепь β-миозина 7) и MYBPC3 (ген, кодирующий миозин-связывающий белок С3). Мутации в этих генах встречаются в 70% саркомер-позитивных случаев ГКМП, в то время как на мутации в каждом другом гене (TNNI3, TNNT2, TPM1, MYL2, MYL3, ACTC1) приходится совсем малое количество пациентов (1-5%). Кроме того, каждый из генов может иметь >1400 вариантов, бóльшая часть которых является уникальным для каждой отдельной семьи с историей ГКМП. Хотя у родственников пациентов с ГКМП вероятность развития заболевания высока, возраст дебюта заболевания является индивидуальным. Около 40% пациентов не имеют семейного анамнеза ГКМП, а также в ходе генетического тестирования патогенные варианты саркомерных мутаций у них не обнаруживаются [19].
Принимая во внимание неоднозначные данные ЭхоКГ/МРТ сердца, отрицательные результаты сцинтиграфии миокарда, биопсии подкожно-жировой клетчатки и иммунохимического исследования белков сыворотки и мочи, диагноз амилоидоза был исключен.
Пациентке было выполнено генетическое тестирование для выявления ВНП в генах, ответственных за развитие истинной ГКМП (FLNC, MYBPC3, MYH7, MYL2, MYL3, PLN, PRKAG2, TNNC1, TNNI3, TNNT2, TPM1), а также ВНП в генах, ответственных за развитие болезней накопления: ATTR — амилоидоз (TTR), болезнь Данона (LAMP2), болезнь Андерсона-Фабри (GLA), синдром Нунана (PTPN11).
При генетическом тестировании была выявлена мутация только в гене MYH7. Данных за наличие болезней накопления получено не было. Наследственный вариант ATTR-амилоидоза также был исключен (мутации в гене TTR обнаружено не было).
Таким образом, на основании семейного анамнеза, данных методов визуализации и лабораторно-генетического анализа пациентке была диагностирована истинная ГКМП, ассоциированная с ВНП в гене MYH7.
Представленный случай представляет собой интерес, т.к. у пациентки с истинной генетически-детерминированной ГКМП, несмотря на умеренно выраженную гипертрофию миокарда ЛЖ, по данным МРТ сердца отмечалось распространенное субэндокардиальное контрастирование миокарда ЛЖ в отсроченную фазу, более характерное для случаев амилоидоза сердца. Неоднозначные результаты визуализации в отсутствии проведения необходимых дополнительных лабораторных и инструментальных исследований удлинили путь к окончательному диагнозу.
Заключение
Описан случай генетически-детерминированной ГКМП с умеренно выраженной гипертрофией миокарда и нетипичным субэндокардиальным паттерном контрастирования миокарда в отсроченную фазу при МРТ. На основании представленного клинического случая следует еще раз отметить важность мультидисциплинарного подхода в диагностике гипертрофии миокарда ЛЖ. В ходе диагностического поиска при гипертрофии необходимо опираться не только на данные методов визуализации, которые могут давать схожие результаты при различных нозологиях, но и проводить своевременное генетическое тестирование для оптимизации лечения и улучшения прогноза течения заболевания.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Grajewski KG, Stojanovska J, Ibrahim EH, et al. Left Ventricular Hypertrophy: Evaluation With Cardiac MRI. Curr Probl Diagn Radiol. 2020;49(6):460-75. doi:10.1067/j.cpradiol.2019.09.005.
2. Arbelo E, Protonotarios A, Gimeno JR, et al. 2023 ESC Guidelines for the management of cardiomyopathies. Eur Heart J. 2023;44(37):3503-626. doi:10.1093/eurheartj/ehad194. PMID: 37622657.
3. Габрусенко С. А., Гудкова А. Я., Козиолова Н. А. и др. Гипертрофическая кардиомиопатия. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(5):4541. doi:10.15829/1560-4071-2021-4541.
4. Алиева А. М., Алмазова И. И., Резник Е. В. и др. Гипертрофическая кардиомиопатия: современный взгляд на проблему. CardioСоматика. 2020;11(1):39-45. doi:10.26442/22217185.2020.1.200116.
5. Лысенко А. В., Леднев П. В., Салагаев Г. И. и др. Современный взгляд на диагностику и лечение гипертрофической кардиомиопатии. Кардиология и сердечно-сосудистая хирургия. 2019;12(1):38-44. doi:10.17116/kardio20191201138.
6. Hu X, Bao Y, Zhu Y, et al. Predicting Left Ventricular Myocardial Fibrosis in Patients with Hypertrophic Cardiomyopathy by Speckle Tracking Automated Functional Imaging. Ultrasound Med Biol. 2023;49(5):1309-17. doi:10.1016/j.ultrasmedbio.2023.01.020.
7. Rudolph A, Abdel-Aty H, Bohl S, et al. Noninvasive detection of fibrosis applying contrast-enhanced cardiac magnetic resonance in different forms of left ventricular hypertrophy relation to remodeling. J Am Coll Cardiol. 2009;53(3):284-91. doi:10.1016/j.jacc.2008.08.064.
8. Moon JC, Reed E, Sheppard MN, et al. The histologic basis of late gadolinium enhancement cardiovascular magnetic resonance in hypertrophic cardiomyopathy. J Am Coll Cardiol. 2004;43(12):2260-4. doi:10.1016/j.jacc.2004.03.035.
9. Brenes JC, Doltra A, Prat S. Cardiac magnetic resonance imaging in the evaluation of patients with hypertrophic cardiomyopathy. Glob Cardiol Sci Prac. 2018;3:22. doi:10.21542/gcsp.2018.22.
10. Sultan FAT, Saadia S. Patterns of Left Ventricular Hypertrophy and Late Gadolinium Enhancement on Cardiac MRI in Patients with Hypertrophic Cardiomyopathy and their Prognostic Significance — An Experience from a South Asian Country. J Clin Imaging Sci. 2021;11:14. doi:10.25259/JCIS_235_2020.
11. Hinojar R, Varma N, Child N, et al. T1 Mapping in Discrimination of Hypertrophic Phenotypes: Hypertensive Heart Disease and Hypertrophic Cardiomyopathy: Findings From the International T1 Multicenter Cardiovascular Magnetic Resonance Study. Circ Cardiovasc Imaging. 2015;8(12):e003285. doi:10.1161/CIRCIMAGING.115.003285.
12. Мершина Е. А., Рыжкова Е. В., Лисицкая М. В. и др. Нативное Т1- и Т2-картирование времен релаксации миокарда при магнитно-резонансной томографии сердца: области применения. Сибирский журнал клинической и экспериментальной медицины. 2023;38(3):49-57. doi:10.29001/2073-8552-2023-39-3-49-57.
13. Galluzzo A, Fiorelli F, Rossi VA, et al. Multimodality Imaging in Sarcomeric Hypertrophic Cardiomyopathy: Get It Right…on Time. Life. 2023;13(1):171. doi:10.3390/life13010171.
14. Шаяхметова С. В., Синицын В. Е., Афанасьев А. В. Магнитно-резонансная томография сердца при гипертрофической кардиомиопатии: диагностические возможности, применение в клинической практике, прогностическая значимость. Российский кардиологический журнал. 2019;(12):131-36. doi:10.15829/1560-4071-2019-12-131-136.
15. Аншелес А. А., Насонова С. Н., Жиров И. В. и др. Сцинтиграфия миокарда с 99mTc-пирофосфатом в диагностике амилоидоза сердца: место в диагностическом алгоритме, особенности выполнения и интерпретации исследования. Терапевтический архив. 2022;94(4):530-7. doi:10.26442/00403660.2022.04.201461.
16. Терещенко С. Н., Жиров И. В., Моисеева О. М. и др. Практические рекомендации по диагностике транстиретиновой амилоидной кардиомиопатии (ATTR-КМП или транстиретинового амилоидоза сердца). Терапевтический архив. 2022;94(4):584-95. doi:10.26442/00403660.2022.04.201465.
17. Лысенко (Козловская) Л.В., Рамеев В. В., Моисеев С. В. и др. Клинические рекомендации по диагностике и лечению системного амилоидоза. Клиническая фармакология и терапия. 2020;29(1):13-24. doi:10.32756/0869-5490-2020-1-13-24.
18. Nagueh SF, Phelan D, Abraham T, et al. Recommendations for Multimodality Cardiovascular Imaging of Patients with Hypertrophic Cardiomyopathy: An Update from the American Society of Echocardiography, in Collaboration with the American Socie ty of Nuclear Cardiology, the Society for Cardiovascular Magnetic Resonance, and the Society of Cardiovascular Computed Tomography. J Am Soc Echocardiogr. 2022;35(6):533-69. doi:10.1016/j.echo.2022.03.012.
19. Ingles J, Burns C, Bagnall RD, et al. Nonfamilial Hypertrophic Cardiomyopathy: Prevalence, Natural History, and Clinical Implications. Circ Cardiovasc Genet. 2017;10(2):e001620. doi:10.1161/CIRCGENETICS.116.001620.
Об авторах
М. М. КудрявцеваРоссия
Кудрявцева Мария Максимовна — м.н.с. отдела клинической кардиологии.
Москва
Е. В. Рыжкова
Россия
Рыжкова Евгения Викторовна — м.н.с. отдела клинической кардиологии, м.н.с. медицинского научно-образовательного центра МГУ.
Москва
О. В. Куликова
Россия
Куликова Ольга Викторовна — к.м.н., с.н.с. отдела клинической кардиологии.
Москва
Е. А. Мершина
Россия
Мершина Елена Александровна — к.м.н., заведующая отделением рентгенодиагностики медицинского научно-образовательного центра МГУ.
Москва
В. Е. Синицын
Россия
Синицын Валентин Евгеньевич — д.м.н., профессор, медицинский научно-образовательный центр МГУ.
Москва
О. М. Драпкина
Россия
Драпкина Оксана Михайловна — д.м.н., профессор, академик РАН, директор.
Москва
Р. П. Мясников
Россия
Мясников Роман Петрович — к.м.н., в.н.с. отдела клинической кардиологии.
Москва
Дополнительные файлы
- Пациентке с гипертрофией левого желудочка была выполнена магнитно-резонансная томография сердца с контрастированием гадолиний содержащим препаратом в отсроченную фазу для уточнения генеза заболевания.
- По данным магнитно-резонансной томографии выявлен нетипичный для гипертрофической кардиомиопатии субэндокардиальный паттерн контрастирования миокарда, затруднивший дальнейший дифференциально диагностический поиск.
Рецензия
Для цитирования:
Кудрявцева М.М., Рыжкова Е.В., Куликова О.В., Мершина Е.А., Синицын В.Е., Драпкина О.М., Мясников Р.П. Мультидисциплинарный подход в дифференциальной диагностике синдрома гипертрофии левого желудочка на примере клинического случая. Кардиоваскулярная терапия и профилактика. 2024;23(2):3837. https://doi.org/10.15829/1728-8800-2024-3837. EDN: TVCCIX
For citation:
Kudryavtseva M.M., Ryzhkova E.V., Kulikova O.V., Mershina E.A., Sinitsyn V.E., Drapkina O.M., Myasnikov R.P. Multidisciplinary approach in the differential diagnosis of left ventricular hypertrophy: a case report. Cardiovascular Therapy and Prevention. 2024;23(2):3837. (In Russ.) https://doi.org/10.15829/1728-8800-2024-3837. EDN: TVCCIX

























































