Перейти к:
Клинический случай эндоваскулярного лечения электрод-ассоциированного синдрома верхней полой вены после имплантации электрокардиостимулятора
https://doi.org/10.15829/1728-8800-2023-3850
EDN: DUFDAW
Аннотация
В основе развития синдрома верхней полой вены (СВПВ) лежит нарушение венозного оттока от головы, шеи, конечностей и верхней половины туловища в правое предсердие вследствие стенозирования или полной обструкции верхней полой вены (ВПВ). Повышение венозного давления в ВПВ и отсутствие своевременного лечения приводит не только к серьезным осложнениям, но и к летальному исходу. За последние годы этиология СВПВ резко изменилась, главным образом из-за увеличения количества имплантируемых внутрисосудистых устройств (центральные венозные катетеры, электрокардиостимуляторы, дефибрилляторы и др. устройства). Эндоваскулярные методы получили широкие применение в лечении пациентов с СВПВ. В первую очередь этому способствовали малоинвазивность вмешательства, высокий технический успех операции (восстановление просвета вены) и быстрое наступление клинического улучшения. Пациенты, у которых СВПВ развился после имплантации устройств, преимущественно молодого возраста и имеют более высокую продолжительность жизни. При выборе метода лечения крайне важно учитывать эти факторы и отдавать предпочтение тем методам, которые позволяют обеспечить долгосрочный эффект с наименьшим количеством возможных осложнений. В статье представлен клинический случай эндоваскулярного лечения пациентки с окклюзией ВПВ, развившейся спустя 9 лет после имплантации электрокардиостимулятора, с применением методов внутрисосудистой визуализации.
Ключевые слова
Для цитирования:
Фещенко Д.А., Капериз К.А., Руденко Б.А., Шукуров Ф.Б., Васильев Д.К., Давтян К.В., Тарасов А.В., Труфанова Е.А., Талиуридзе М.Т. Клинический случай эндоваскулярного лечения электрод-ассоциированного синдрома верхней полой вены после имплантации электрокардиостимулятора. Кардиоваскулярная терапия и профилактика. 2023;22(12):3850. https://doi.org/10.15829/1728-8800-2023-3850. EDN: DUFDAW
For citation:
Feshchenko D.A., Kaperiz K.V., Rudenko B.A., Shukurov F.B., Vasiliev D.K., Davtyan K.V., Tarasov A.V., Trufanova Е.A., Taliouridze M.T. Endovascular treatment of lead-related superior vena cava syndrome after pacemaker implantation. Cardiovascular Therapy and Prevention. 2023;22(12):3850. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3850. EDN: DUFDAW
Введение
Частота развития синдрома (СВПВ) верхней полой вены (ВПВ) составляет 0,005% от общей популяции населения и в большинстве случаев (до 70%) является осложнением прогрессирования злокачественного новообразования [1]. Однако увеличения количества имплантаций внутрисосудистых устройств различного применения привело к увеличению случаев развития доброкачественных форм СВПВ [2].
К традиционным методам лечения СВПВ относятся лучевая терапия, химиотерапия и хирургическое открытое вмешательство [3]. Большую популярность в последние два десятилетия приобрело использование эндоваскулярных методов (ангиопластика, стентирование), которые к настоящему моменту стали основным вариантом лечения [3-5].
Внедрение в клиническую практику эндоваскулярных технологий позволило при малой инвазивности операции достигать быстрого клинического эффекта: купирования симптомов венозной гипертензии и улучшения качества жизни пациентов непосредственно после операции. Спектр чрескожных вмешательств, применяемых при СВПВ, расширяется и на сегодняшний день включает в себя баллонную ангиопластику и стентирование с возможностью использования внутрисосудистой визуализации, направленный катетерный тромболизис, механическую тромбэкстракцию и др.
Клинический случай
Информация о пациенте
Пациентка, 23 лет, русская, проживает в поселке Красное-на-Волге, поступила в отделение хирургического лечения сложных нарушений ритма и электрокардиостимуляции ФГБУ "НМИЦ ТПМ" Минздрава России в плановом порядке в сентябре 2022г с клиникой СВПВ.
Пациентка предъявляла жалобы на выраженное ощущение сдавления в лобной и височной областях головы в положении лежа на спине и при наклонах туловища вперед, что сопровождалось набуханием вен в области лба и висков. Девушку также беспокоили колющие боли в левой половине грудной клетки, иррадиирущие в правую половину грудной клетки и нижнюю треть грудины, возникающие в покое, длительные, проходящие самостоятельно.
Из анамнеза известно, что в 2013г в возрасте 14 лет впервые была выявлена синусовая брадикардия, по поводу чего проходила обследование по месту жительства. При электрокардиографии (ЭКГ) диагностирована полная атриовентрикулярная блокада. Синкопальных состояний не отмечала, периодически жаловалась на выраженную слабость, головокружения, развивающиеся на фоне ортостаза или без каких-либо провоцирующих факторов. Было проведено холтеровское мониторирование ЭКГ, на котором в течение суток регистрировалась полная атриовентрикулярная блокада, средняя дневная частота сердечных сокращений (ЧСС) составляла 44 уд./мин. Средняя ночная ЧСС 31 уд./мин. В соответствии с актуальными на тот момент рекомендациями в октябре 2013г пациентке была проведена имплантация постоянного электрокардиостимулятора (ЭКС). После имплантации в течение 8 лет чувствовала себя удовлетворительно.
Весной 2021г девушка заболевает новой коронавирусной инфекцией SARS-CoV-2 (Severe Acute Respiratory Syndrome COronaVirus 2) (вирус идентифицирован). Вышеописанные симптомы стали появляться осенью 2021г, что ухудшало качество жизни пациентки. В июне 2022г в связи с прогрессированием тяжести симптомов была направлена в наш центр для обследования и выбора дальнейшей тактики лечения. По данным эхокардиографии отмечается ускорение кровотока в ВПВ в месте впадения в правое предсердие. В связи с начинающимся истощением источника питания ЭКС была рекомендована смена ЭКС в плановом порядке (рисунок 1).
Результат физикального осмотра
При физикальном осмотре кожные покровы обычной окраски и влажности. Лимфатические узлы не увеличены. При осмотре в утренние часы обращает на себя внимание выраженная отечность лица, уменьшающаяся во второй половине дня, контурирование вен лица и верхней половины туловища при горизонтальном положении тела.
Предварительный диагноз
Пациентке, исходя из имеющихся данных и выписок из истории болезни, выставлен следующий клинический диагноз:
Основное заболевание: Нарушения проводимости сердца: Полная атриовентрикулярная блокада III ст. Имплантация двухкамерного ЭКС Adapta ADDR01 от 24.10.2013.
Конкурирующее заболевание: СВПВ. Стеноз левой подключичной вены — 70%. Окклюзия ВПВ в области впадения в правое предсердие.
Сопутствующее заболевание: Сколиоз поясничного отдела позвоночника.
Диагностическая оценка
ЭКГ: Р-синхронизированная желудочковая стимуляция с ЧСС 70 уд./мин.
Мультиспиральная компьютерная томография (МСКТ) органов грудной клетки: ВПВ имеет умеренно неравномерный просвет — наибольший на уровне дуги аорты 16×17,5 мм, наименьший на уровне бифуркации легочного ствола 11×10 мм, на уровне впадения в правое предсердие 19×12 мм, контрастируется без наличия дефектов, проходимость на уровне сужения сохранена. Выше участка сужения в ВПВ впадает расширенная до 16 мм непарная вена. Непарная и полунепарная вены расширены на всем протяжении до 15 и 6,5 мм, соответственно, контрастируются равномерно, отмечается активный сброс контрастного вещества в данные вены из ВПВ в начале внутривенного введения. В брюшной полости непарная вена дренируется в нижнюю полую вену (рисунок 2 А, Б).
Флебография: слева отмечается сужение левой подключичной вены до 70%, также визуализируются 2 электрода в просвете подключичной вены и ВПВ. При выполнении контрастирования ВПВ отмечается окклюзия в области впадения в правое предсердие с просветом 1 мм (рисунок 3).
Дуплексное сканирование нижней полой вены, вен таза и нижних конечностей: признаков сужения тромбоза не выявлено. Вены подкожной венозной системы без явных признаков варикозной трансформации. Клапанной и перфорантной несостоятельности не обнаружено.
Клинический диагноз
Основное заболевание: СВПВ. Стеноз левой подключичной вены — 70%. Окклюзия ВПВ в области впадения в правое предсердие. Ангиопластика кавально-предсердного соустья (КПС) от 28.09.2022.
Нарушение проводимости сердца: Полная атриовентрикулярная блокада III ст. Имплантация двухкамерного ЭКС Adapta ADDR01 от 24.1012013г.
Сопутствующее заболевание: Сколиоз поясничного отдела позвоночника.
Дифференциальная диагностика
Клиническая картина пациентов с СВПВ столь специфична, что дифференциальная диагностика ограничена. Первоначальная жалоба пациентки была на выраженные головные боли при поворотах и наклонах головы, в связи с чем девушка обратилась за медицинской помощью к неврологу. Детальный осмотр невролога с проведением дополнительных проб определил церебральный характер болевого синдрома как проявление осложнения основного заболевания, после чего пациентка была направлена к кардиологу. На основании четкой связи болей и набухания вен головы и шеи в зависимости от положения тела был заподозрен СВПВ.
Медицинское вмешательство
Пациентка была консультирована рентгенэндоваскулярным хирургом для решения дальнейшей тактики лечения. Было принято решение провести ангиопластику КПС с использованием интраоперационного внутрисосудистого ультразвукового исследования (ВСУЗИ).
При полной обструкции предпочтительнее иметь несколько доступов для контрастирования как проксимального участка, так и дистального [3]. Поэтому было принято решение под местной анестезией провести пункцию правой бедренной вены с установлением интродьюсера 8F и левой кубитальной вены с установлением интродьюсера 6F. Катетер-гид установлен в нижней трети ВПВ. На контрольной флебограмме подтверждается окклюзия КПС (рисунок 3).
Периферический проводник из кубитального доступа проведен через зону окклюзии в правый желудочек и легочный ствол. Выполнена баллонная ангиопластика пораженного участка сначала коронарными баллонными катетерами с максимальным диаметром до 4 мм, затем периферическими баллонными катетерами с максимальным диаметром до 12 мм (рисунок 4).
Для уточнения остаточного стеноза было принято решение провести ВСУЗИ через бедренный доступ, по данным которого остаточный стеноз КПС составил <30% (рисунок 5).
Учитывая хорошее восстановление сброса из правой полой вены в правое предсердие, уменьшение давления в ВПВ с 24 до 10 мм рт.ст. и отсутствие интраоперационных осложнений, было решено закончить операцию (рисунок 6).
Динамика и исходы
После проведения ангиопластики КПС отмечалась регрессия симптомов. Ранний послеоперационный период протекал без особенностей. В результате лечения отмечается положительная динамика в виде отсутствия цефалгии при движении головой и пастозности лица. Даны рекомендации о модификации образа жизни, назначена антитромботическая терапия (новый оральные антикоагулянт + ацетилсалициловая кислота) на 6 мес. с последующим решением вопроса о ее пролонгации.
При контрольном осмотре через 3, 6 и 12 мес. пациентка жалоб не предъявляла, повторных госпитализаций и рецидивов клиники синдрома ВПВ не было. По результатам контрольной МСКТ проходимость КПС сохранена, диаметр непарной и полунепарной вен уменьшился вдвое (рисунок 7).
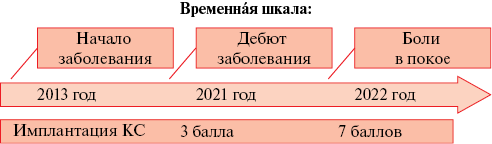
Рис. 1 Хронология течения болезни.
Примечание: оценка тяжести симптомов СВПВ в баллах по шкале Kishi. КС — кардиостимулятор, СВПВ — синдром верхней полой вены.
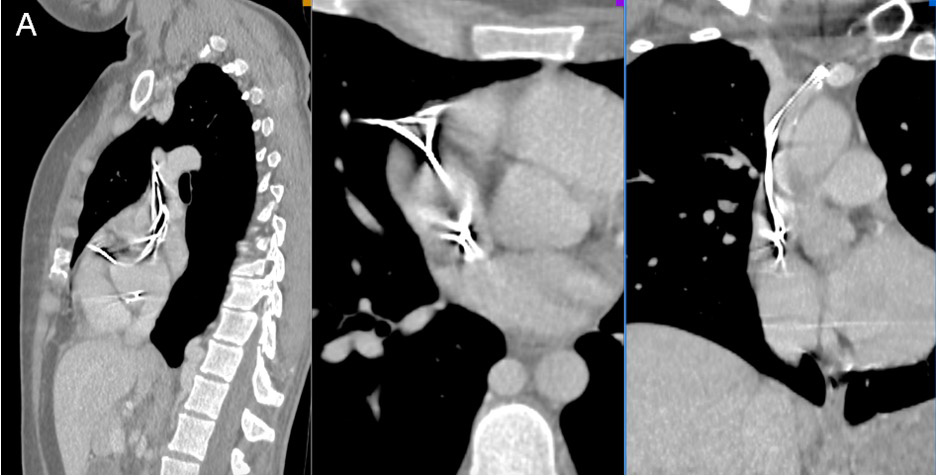
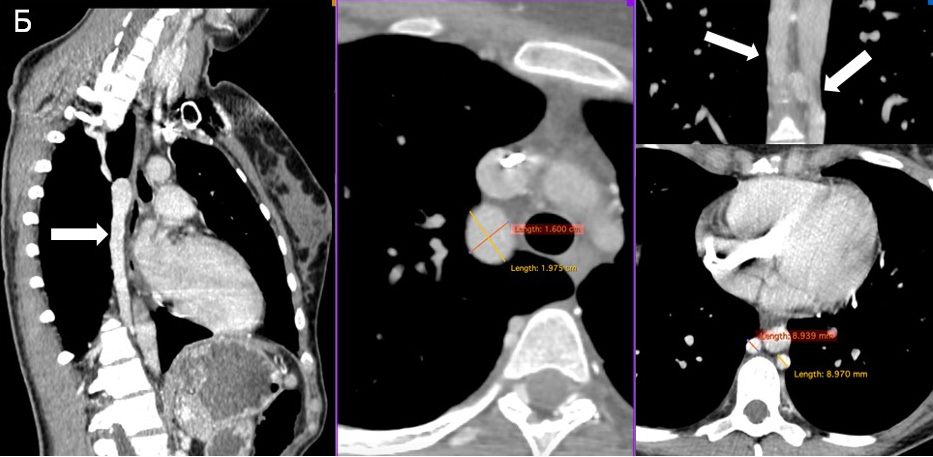
Рис. 2 А. Непарная вена расширена на всем протяжении до 11,5 мм, полунепарная вена — 5 мм (ранее 15 и 6,5 мм, соответственно), контрастируют равномерно, Б.
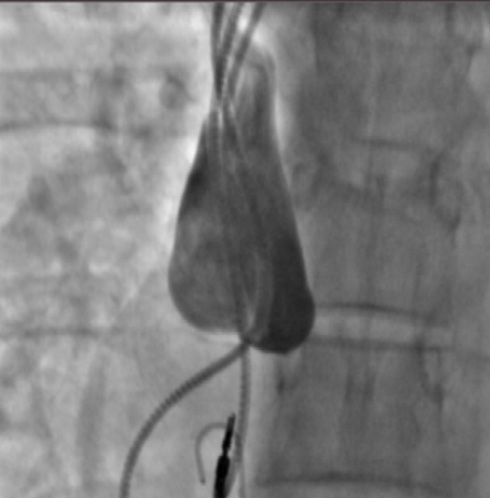
Рис. 3 Окклюзия ВПВ в области впадения в правое предсердие.
Примечание: ВПВ — верхняя полая вена.
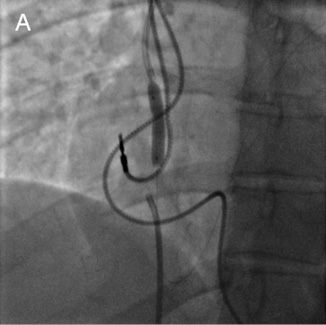
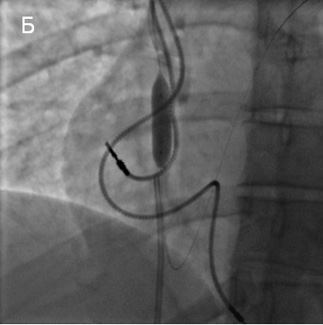
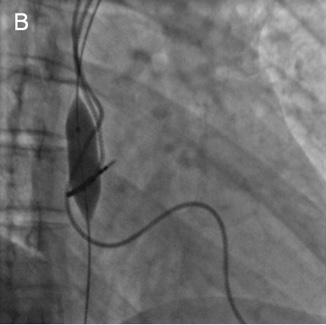
Рис. 4 А — Ангиопластика коронарным баллонным катетером. Б, В — Ангиопластика периферическим баллонным катетером.
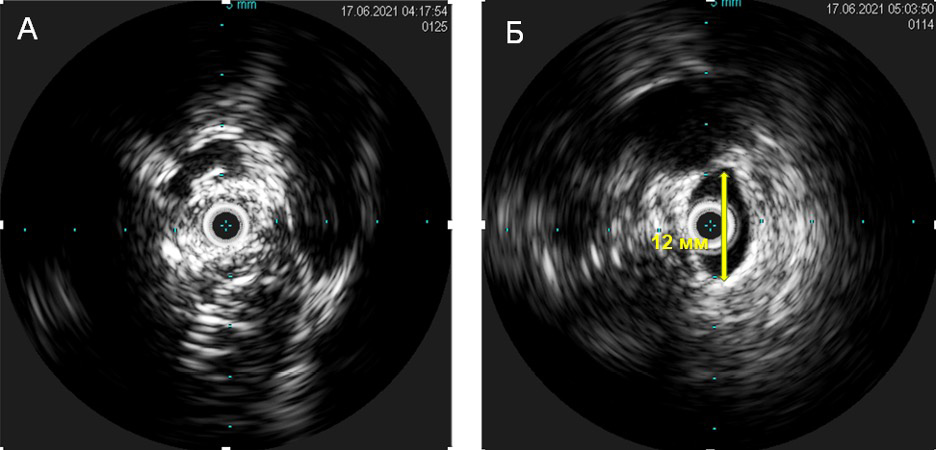
Рис. 5 Внутрисосудистая ультразвуковая визуализация КПС. Слева изображение соустья после предилатации баллонным катетером 2 мм (датчик УЗИ полностью обтурирует просвет соустья). Справа — финальный результат после баллонной ангиопластики.
Примечание: КПС — кавально-предсердное соустье, УЗИ — ультразвуковое исследование.
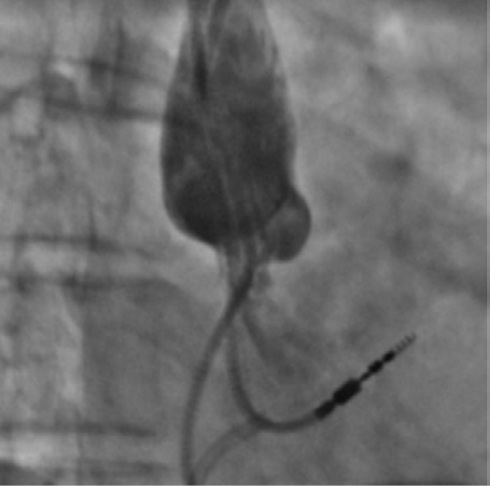
Рис. 6 Флебограмма конечного результата ангиопластики ВПВ.
Примечание: ВПВ — верхняя полая вена.
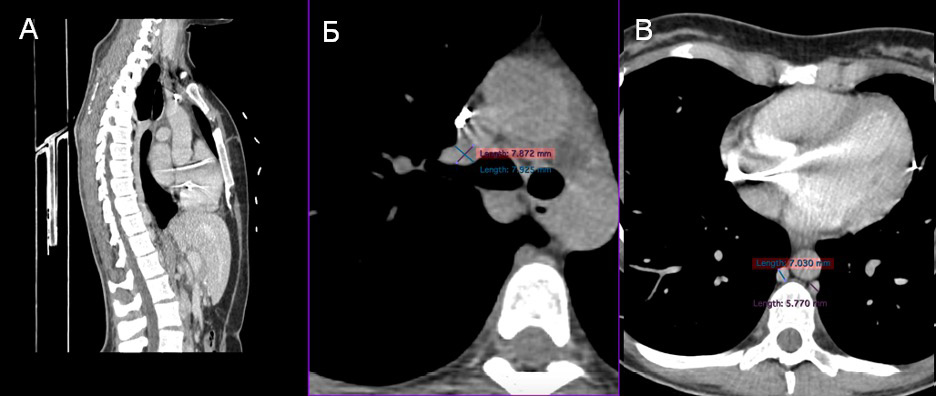
Рис. 7 КТ-диагностика через 12 мес.
Примечание: КТ — компьютерная томография.
Обсуждение
Электрод-ассоциированная венозная обструкция является одним из осложнений имплантации электрокардиостимуляторов или дефибрилляторов (ИКД). В последние десятилетия частота имплантации кардиостимуляторов и ИКД существенно выросла благодаря усовершенствованию технологий и расширению показаний для первичной профилактики внезапной смерти и лечения сердечной недостаточности.
У 30% пациентов после имплантации устройств наблюдается бессимптомный стеноз >50% ВПВ и ее основных притоков, у 10% — полная окклюзия [6]. Окклюзирующее поражение ВПВ развивается в 1% случаев [6]. В структуре этиологических причин развития СВПВ на долю электрод-ассоциированного СВПВ приходится до 30% случаев [3].
Оценка степени обструкции ВПВ и объема поражения проводится на основе классификации, предложенной Stanford W и Doty DB [7]. Исходя из ее типа, определяется объем хирургического лечения.
Показаниями к хирургическому лечению независимо от подходов является тяжесть симптомов заболевания: в случае наличия жизнеугрожающих проявлений (отек гортани, сдавление головного мозга и др.) — это экстренное спасительное оперативное лечение, в случае тяжелой симптоматики — улучшение качества жизни пациентов. Шкала Kishi, основанная на рейтинговой системе, позволяет оценить по имеющимся у пациента клиническим симптомам тяжесть заболевания и выставить показания к проведению хирургического лечения; так, 4 балла являются показанием для стентирования ВПВ [8][9]. (рисунок 8). В представленном клиническом случае тяжесть клинического проявления СВПВ составила 7 баллов по классификации Kishi, что явилось убедительным основанием к проведению хирургического лечения.
Стоит отметить, что общепринятых стандартов лечения электрод-ассоциированных форм СВПВ не существует ввиду отсутствия рандомизированных исследований. При острой тромботической окклюзии ВПВ наиболее эффективна тактика баллонной ангиопластики в сочетании с тромболитической терапией или без нее, а также применение механической тромбэктомии [10]. Однако необходимо понимать, что тромболизис или механическую тромбэктомию можно рассматривать в первые 2-4 нед. после имплантации устройства.
В случае хронической окклюзии ВПВ существует также не уступающий по результатам лечения второй подход, подразумевающий удаление электродов, стентирование пораженных сегментов с последующей имплантацией новых электродов [3]. И именно такой подход является на сегодняшний день основным [3]. В исследовании Rizvi AZ, et al. сравнили 5 методов лечения синдрома ВПВ: антикоагулянтная терапия, тромболизис, венопластика, стентирование и открытая хирургия [11]. Стентирование продемонстрировало хорошие результаты и заявило о себе, как о методе с самой низкой частотой рецидивов [12]. Основными осложнениями стентирования являются миграция и перелом стента, тромбоэмболия легочных вен, отек легких, тампонада перикарда и др. [13].
Существенно суживают возможности широкого применения подхода "экстракция электрода + стентирование + имплантация новых электродов" ограничения, связанные с отсутствием разрешенных к имплантации в данной позиции стентов и трудности экстракции электродов, в особенности у пациентов с длительно стоящими электродами. Для осуществления данного подхода нужна опытная команда с необходимым оснащением (лазерные и др. технологии) и готовностью к конверсии от малоинвазивной тактики к открытой операции. В представленном клиническом случае длительность стояния электродов составила >9 лет.
В то же время стентирование не исключает в будущем рецидивирования рестенозирования после установки стента. По данным Fu HX, et al. при таком подходе реокклюзии развивалась у половины пациентов [14].
Принимая во внимание трудности и риски экстракции электродов, баллонную ангиопластику ранее окклюзированных бассейнов без предварительный экстракции электродов и стентирования также можно рассматривать в качестве альтернативного подхода. Баллонная ангиопластика уступает стентированию по частоте рестенозирования и первичной проходимости пораженного сегмента [3]. Однако это может быть нивелировано использованием баллонных катетеров высокого давления, значительно разрушающих фиброзные структуры, а также активным использованием внутрисосудистых визуализирующих технологий для оценки результатов баллонной ангиопластики и принятия решения о стентировании. В представленном клиническом случае восстановление просвета и диаметр остаточного просвета после баллонной ангиопластики был оценен с помощью ВСУЗИ. На основании полученного хорошего результата было принято решение остановиться только на баллонной ангиопластике без экстракции электродов и стентирования как наименее травматичной тактике.
Особого внимания заслуживает выбор оптимального режима антикоагулянтной и антиагрегантной терапии у пациентов с СВПВ. В случае тромботической окклюзии ВПВ системная антикоагулянтная терапия является стандартом лечения как до, так и после реваскуляризации. Однако эффективность и безопасность длительной антикоагулянтной или антитромботической терапии при отсутствии выраженного тромбоза не установлена. Некоторые исследователи предполагают, что антикоагулянтная терапия может снизить предполагаемый риск тромбоза стента в отдаленном периоде [15], в то время как другие считают, что одна только антиагрегантная терапия является достаточной и целесообразной [16]. В случае баллонной ангиопластики вопрос о назначении антитромботической терапии на длительный срок крайне дискутабелен.
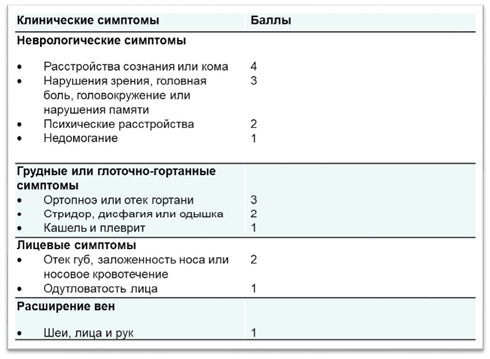
Рис. 8 Шкала Kishi.
Заключение
Представленный клинический случай демонстрирует успешное эндоваскулярное лечение электрод-ассоциированного СВПВ. В качестве эндоваскулярного лечения использовалась баллонная ангиопластика окклюзии ВПВ и КПС с последующей оценкой результатов лечения с помощью внутрисосудистых визуализирующих технологий. Именно использование ВСУЗИ при данной патологии демонстрирует уникальность предлагаемого лечебно-диагностического подхода и его эффективность в долгосрочной перспективе.
Прогноз для пациента. Прогноз электрод-ассоциированного СВПВ благоприятный, однако в долгосрочной перспективе сохраняются риски рестенозирования области вмешательства. При таком развитии событий преимущественной тактикой лечения будет стентирование ВПВ.
Информированное согласие. От пациента получено письменное добровольное информированное согласие на публикацию описания клинического случая (дата подписания 12.12.2022).
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Rice TW, Rodriguez RM, Light RW. The superior vena cava syndrome: clinical characteristics and evolving etiology. Medicine (Baltimore). 2006;85:37-42.
2. Eberhardt F, Bunck AC, Codjambopoulo P, et al. Benign vena cava superior syndrome in patients with cardiac implantable electronic devices: Presentation and management. HeartRhythm Case Rep. 2020;6(9):549-53. doi:10.1016/j.hrcr.2020.06.018.
3. Azizi AH, Shafi I, Shah N, et al. Superior Vena Cava Syndrome. JACC Cardiovasc Interv. 2020;13(24):2896-910. doi:10.1016/j.jcin.2020.08.038.
4. Gabriels J, Chang D, Maytin M, et al. Percutaneous management of superior vena cava syndrome in patients with cardiovascular implantable electronic devices. Heart Rhythm. 2021;18(3):392-8. doi:10.1016/j.hrthm.2020.11.012.
5. Breault S, Doenz F, Jouannic AM, Qanadli SD. Percutaneous endovascular management of chronic superior vena cava syndrome of benign causes: long-term follow-up. Eur Radiol. 2017;27(1):97104. doi:10.1007/s00330-016-4354-y.
6. Cacko A, Kozyra-Pydyś E, Gawałko M, et al. Predictors of venous stenosis or occlusion following first transvenous cardiac device implantation: Prospective observational study. J Vasc Access. 2019;20(5):495-500. doi:10.1177/1129729818815135.
7. Stanford W, Doty DB. The role of venography and surgery in the management of patients with superior vena cava obstruction. Ann Thorac Surg. 1986;2(41):158-63. doi:10.1016/s00034975(10)62659-8.
8. Kishi K, Sonomura T, Mitsuzane K, et al. Self-expandable metallic stent therapy for superior vena cava syndrome: clinical observations. Radiology. 1993;189(2):531-5. doi:10.1148/radiology.189.2.8210386.
9. Lacout A, Marcy PY, Thariat J, et al. Radio-anatomy of the superior vena cava syndrome and therapeutic orientations. Diagn Interv Imaging. 2012;93(7-8):569-77. doi:10.1016/j.diii.2012.03.025.
10. Gebreyes AT, Pant HN, Williams DM, et al. Be aware of wires in the veins: a case of superior vena cava syndrome in a patient with permanent pacemaker. J Community Hosp Intern Med Perspect. 2012;2:3. doi:10.3402/jchimp.v2i3.19159.
11. Rizvi AZ, Kalra M, Bjarnason H, et al. Benign superior vena cava syndrome: stenting is now the first line of treatment. J Vasc Surg. 2008;47(2):372-80. doi:10.1016/j.jvs.2007.09.071.
12. Aung EY, Khan M, Williams N, et al. Endovascular Stenting in Superior Vena Cava Syndrome: A Systematic Review and Metaanalysis. Cardiovasc Intervent Radiol. 2022;45(9):1236-54. doi:10.1007/s00270-022-03178-z.
13. Ganeshan A, Quen Hon L, Warakaulle DR, et al. Superior vena cava stenting for SVC obstruction: current status. Eur J Radiol. 2009;71(2):343-9.
14. Fu HX, Huang XM, Zhong L, et al. Outcome and management of pacemaker-induced superior vena cava syndrome. Pacing Clin Electrophysiol. 2014;37(11):1470-6. doi:10.1111/pace.12455.
15. Nagata T, Makutani S, Uchida H, et al. Follow-up results of 71 patients undergoing metallic stent placement for the treatment of a malignant obstruction of the superior vena cava. Cardiovasc Intervent Radiol. 2007;30(5):959-67. doi:10.1007/s00270-0079088-4.
16. Lanciego C, Pangua C, Chacón JI, et al. Endovascular stenting as the first step in the overall management of malignant superior vena cava syndrome. AJR Am J Roentgenol. 2009;193(2):549-58. doi:10.2214/AJR.08.1904.
Об авторах
Д. А. ФещенкоРоссия
м.н.с. отдела инновационных эндоваскулярных методов профилактики и лечения сердечно-сосудистых заболеваний, врач рентгенэндоваскулярных методов диагностики и лечения, зав. операционным блоком.
Москва
К. А. Капериз
Россия
м.н.с. отдела фундаментальных и клинических проблем тромбоза при неинфекционных заболеваниях, зав. сосудистым отделением.
Москва
Б. А. Руденко
Россия
д.м.н., врач рентгенэндоваскулярных методов диагностики и лечения, руководитель отдела инновационных эндоваскулярных методов профилактики и лечения сердечно-сосудистых заболеваний.
Москва
Ф. Б. Шукуров
Россия
к.м.н., с.н.с. отдела инновационных эндоваскулярных методов профилактики и лечения сердечно-сосудистых заболеваний, врач рентгенэндоваскулярных методов диагностики и лечения, врач рентгенэндоваскулярных методов диагностики и лечения.
Москва
Д. К. Васильев
Россия
к.м.н., н.с. отдела инновационных эндоваскулярных методов профилактики и лечения сердечно-сосудистых заболеваний, врач рентгенэндоваскулярных методов диагностики и лечения.
Москва
К. В. Давтян
Россия
д.м.н., доцент, руководитель отдела нарушений сердечного ритма и проводимости.
Москва
А. В. Тарасов
Россия
д.м.н., зав. отделением хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции.
Москва
Е. А. Труфанова
Россия
Врач-кардиолог отделения хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции.
Москва
М. Т. Талиуридзе
Россия
Клинический ординатор отделения рентгенхирургических методов диагностики и лечения.
Москва
Дополнительные файлы
- Синдром (СВПВ) верхней полой вены (ВПВ) возникает вследствие обструкции кровотока по системе ВПВ; его основной причиной является прогрессирование злокачественного новообразования грудной клетки. Однако стоит помнить, что в 3% случаев СВПВ может развиваться после имплантации внутрисосудистых устройств (электрокардиостимулятора, имплантируемого кардиовертер-дефибриллятора и др.), так называемый электрод-ассоциированный СВПВ.
- При СВПВ встречаются как специфические, так неспецифические проявления: отек верхних конечностей и лица, одышка, кашель, расширение вен грудной клетки и шеи. Своевременная диагностика электрод-ассоциированного СВПВ позволяет определиться с характером и объемом поражения и выбрать наиболее оптимальный вариант лечения.
- Основным методом лечения СВПВ являются эндоваскулярные технологии (ангиопластика и стентирование ВПВ).
Рецензия
Для цитирования:
Фещенко Д.А., Капериз К.А., Руденко Б.А., Шукуров Ф.Б., Васильев Д.К., Давтян К.В., Тарасов А.В., Труфанова Е.А., Талиуридзе М.Т. Клинический случай эндоваскулярного лечения электрод-ассоциированного синдрома верхней полой вены после имплантации электрокардиостимулятора. Кардиоваскулярная терапия и профилактика. 2023;22(12):3850. https://doi.org/10.15829/1728-8800-2023-3850. EDN: DUFDAW
For citation:
Feshchenko D.A., Kaperiz K.V., Rudenko B.A., Shukurov F.B., Vasiliev D.K., Davtyan K.V., Tarasov A.V., Trufanova Е.A., Taliouridze M.T. Endovascular treatment of lead-related superior vena cava syndrome after pacemaker implantation. Cardiovascular Therapy and Prevention. 2023;22(12):3850. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3850. EDN: DUFDAW
JATS XML

























































