Перейти к:
Стентирование интракраниальных артерий с применением внутрисосудистого ультразвукового исследования у пациента с повторным ишемическим инсультом. Клинический случай
https://doi.org/10.15829/1728-8800-2024-3862
EDN: QKXWZB
Аннотация
Введение. В настоящее время активно ведется поиск подходов к лечению больных со стенозом интракраниальных артерий (ИКА) и повторным ишемическим инсультом на фоне проводимой агрессивной медикаментозной терапии (МТ). На сегодняшний день получены подтверждения о пользе стентирования ИКА в комбинации с МТ. Показано, что инвазивное лечение не уступает по эффективности и исходам лечения лекарственной терапии. Внутрисосудистое ультразвуковое исследование (ВСУЗИ) может предоставить ценную информацию относительно морфологии поражения ИКА и улучшить результаты стентирования ИКА.
Описание клинического случая. В настоящей публикации представлен клинический случай: после успешной эндоваскулярной тромбэкстракции у больного с повторным острым ишемическим инсультом выполнено плановое стентирование труднодоступного коммуникантного и кавернозного интракраниальных сегментов внутренней сонной артерии под контролем высокочастотного датчика ВСУЗИ, что позволило оценить детальную морфологию поражения сосуда и подобрать оптимальный размер стента.
Заключение. Клинический пример демонстрирует потенциал использования ВСУЗИ при инвазивной диагностике патологии ИКА для планирования стентирования или баллонной ангиопластики пораженного сегмента. ВСУЗИ ИКА обеспечит необходимой информацией нейроинтервенционистов для выполнения высокоэффективных и оптимальных эндоваскулярных вмешательств на ИКА по аналогии с чрескожным коронарным вмешательством, а также снизит риск неблагоприятных интра- и послеоперационных событий, позволит выделить больных высокого хирургического риска.
Ключевые слова
Для цитирования:
Закарян Н.В., Молохоев Е.Б., Бояринцев В.В., Ардашев В.Н., Белков Д.С., Давтян А.Г., Киракосян В.Р., Панков А.С. Стентирование интракраниальных артерий с применением внутрисосудистого ультразвукового исследования у пациента с повторным ишемическим инсультом. Клинический случай. Кардиоваскулярная терапия и профилактика. 2024;23(6):3862. https://doi.org/10.15829/1728-8800-2024-3862. EDN: QKXWZB
For citation:
Zakaryan N.V., Molokhoev E.B., Boyarintsev V.V., Ardashev V.N., Belkov D.S., Davtyan A.G., Kirakosyan V.R., Pankov A.S. Intravascular ultrasound-guided intracranial artery stenting in a patient with recurrent ischemic stroke: a case report. Cardiovascular Therapy and Prevention. 2024;23(6):3862. (In Russ.) https://doi.org/10.15829/1728-8800-2024-3862. EDN: QKXWZB
Введение
Атеросклероз интракраниальных артерий (ИКА) является одной из основных причин ишемического инсульта (ИИ) во всем мире [1][2]. Несмотря на агрессивную медикаментозную терапию, симптоматические стенозы ИКА с признаками нарушения дистальной перфузии (кровотока) подвергаются более высокому риску рецидива. Частота рецидивов инсульта до 20% случаев в течение 2 лет побудила исследователей искать более эффективные методы лечения, включая интервенционные процедуры [3-5]. В настоящее время получены подтверждения об эффективности стентирования ИКА в комбинации с медикаментозной терапией [6-8]. Современные методы неинвазивной визуализации сосудистой стенки сместили традиционный фокус со степени стеноза ИКА на структуру атеросклеротической бляшки (АСБ), что позволило оценить стадии интракраниального атеросклероза, включая ранние субклинические нестенотические периоды, и улучшить первичную профилактику инсульта [9][10]. В настоящее время прямая селективная субтракционная ангиография является основным методом инвазивной диагностики для оценки технической возможности проведения стентирования ИКА. Прямая ангиография не способна продемонстрировать подробную морфологию поражения сосуда и состав АСБ, что увеличивает риски интра- и послеоперационных осложнений и неудовлетворительных отдалённых результатов. Внутрисосудистое ультразвуковое исследование (ВСУЗИ) может предоставить ценную информацию относительно морфологии поражения ИКА. ВСУЗИ было впервые разработано как вспомогательное средство при чрескожных коронарных вмешательствах (ЧКВ), которое не только улучшило результаты инвазивного лечения больных с ишемической болезнью сердца (ИБС), но и позволило выделить предикторы неблагоприятного исхода ЧКВ [11]. Имеется ряд клинических наблюдений о применении ВСУЗИ при стентировании внутренних сонных артерий (ВСА) [12][13]. ВСУЗИ позволяет получить изображения поперечного сечения артериальной стенки и ее просвета, а также выявлять лоскуты, неровности интимы, состав и протяженность АСБ.
Дальнейшие поиски оптимального подхода к диагностике стенозов ИКА у больных с повторным ИИ должны быть направлены, помимо неинвазивных методов диагностики, на совершенствование инвазивных методов внутрисосудистой визуализации и расширения возможности применения ВСУЗИ в дистальном русле ВСА. Известно, что самой частой локализацией поражения ИКА являются, помимо кавернозной части, супраклиноидный отдел ВСА и проксимальный сегмент средней мозговой артерии (СМА) передней циркуляции головного мозга [14][15]. Ввиду технических особенностей катетеров для ВСУЗИ и анатомических характеристик ИКА по данным научно-практической литературы по настоящее время не удавалось выполнить ВСУЗИ выше кавернозного сегмента ВСА. Также имелись некоторые ограничения детализации изображения ввиду использования датчиков низкой частоты в 30 МГц.
С учётом накопленного опыта выполненных эндоваскулярных вмешательств на ИКА в настоящей публикации впервые представлен один из нескольких клинических случаев, демонстрирующих возможность проведения стентирования дистального интракраниального сегмента ВСА под контролем высокочастотного датчика ВСУЗИ 60 МГц.
Клинический случай
Информация о пациенте
Пациент, мужчина 70 лет, поступил в 2023г в стационар экстренно с диагнозом повторный ИИ, через 6 ч от начала клиники инсульта. Из анамнеза известно: около года назад перенес острый ИИ в бассейне левой СМА без развития грубого неврологического дефицита, страдает ИБС со стенокардией напряжения III функционального класса, перенес инфаркт миокарда два года назад, выполнялись ЧКВ.
Результаты физикального осмотра
При осмотре неврологом отмечен выраженный неврологический дефицит по шкале NIHSS (National Institutes of Health Stroke Scale) 20 баллов — правосторонняя гемиплегия, парез взора влево, дизартрия.
Предварительный диагноз
Основной: Цереброваскулярная болезнь. Повторный ИИ в бассейне левой СМА, атеротромботический подтип по TOAST. Острое нарушение мозгового кровообращения по ишемическому типу от 2022г.
Сопутствующие заболевания: ИБС. Стенокардия напряжения III функционального класса. Постинфарктный кардиосклероз (инфаркт миокарда неизвестной давности). Стенозирующий коронароатеросклероз со стенозом передней межжелудочковой ветви 95% и огибающей ветви 65% левой коронарной артерии. Состояние после стентирования передней межжелудочковой ветви левой коронарной артерии под контролем ВСУЗИ от 2022г.
Временнáя шкала (таблица 1).
Таблица 1
Временнáя шкала
|
День 0 |
|
|
14:00 |
Поступление в стационар через 6 ч от начала клиники инсульта |
|
14:10 |
МСКТ-натив головы, МСКТ-ангиография головы, МСКТ-перфузия: окклюзия левой ВСА от устья, обширная зона "пенумбры" с формированием небольшой зоны "ядра" в левой гемисфере |
|
14:30 |
Прямая ангиография головы в рентгеноперационной |
|
14:40 |
Эндоваскулярная тромбоаспирация и тромбэкстракция с комбинированным использованием аспирационного катетера и стент-ретриевера |
|
15:30 |
Контрольная церебральная ангиография по окончании операции — остаточный стеноз и диссекция интракраниального отдела ВСА |
|
15:40 |
Коллегиальное решение о введении интраоперационно через назогастральный зонд дезагрегантов (тикагрелор 180 мг и ацетилсалициловая кислота 100 мг) для профилактики тромботических осложнений в зоне стеноза с диссекцией интракраниального отдела ВСА |
|
15:50 |
Контрольная церебральная ангиография — отсутствие реокклюзии ВСА в зоне остаточного стеноза и диссекции интракраниального сегмента. Завершение операции. Решение о стентировании интракраниальных сегментов ВСА в плановом порядке |
|
16:15 |
Поступление в отделение реанимации и интенсивной терапии для больных с ОНМК для дальнейшего лечения и наблюдения |
|
День 7. После выполненной тромбэктомии положительная динамика в виде регресса неврологического дефицита до 5 баллов по шкале NIHSS (National Institutes of Health Stroke Scale) |
|
|
1 мес., день 1 |
|
|
09:00 |
Поступление в стационар для планового оперативного вмешательства в объёме стентирования интракраниального сегмента ВСА |
|
14:00 |
Контрольная предоперационная церебральная ангиография — стеноз до 80% коммуникантного и кавернозного сегментов (диссекция) левой ВСА |
|
14:10 |
По результатам расчёта, с помощью программного обеспечения "Stenosys analysis" ангиографа и 3D ангиографической реконструкции, показан диаметр нативного сосуда от 3,0 до 3,6 мм, что затрудняет подбор размера стента |
|
14:20 |
С целью уточнения истинного диаметра коммуникантного отдела левой ВСА, степени и морфологии стеноза решено выполнить ВСУЗИ. С учётом измерений выбраны коронарные стенты с лекарственным покрытием для коммуникантного сегмента ВСА 3,5 мм в диаметре и длиной 8,0 мм, для кавернозного сегмента 4,5 мм в диаметре и длиной 12,0 мм |
|
14:40 |
Выполнена имплантация стентов с раздутием баллона в стенте для коммуникантного отдела диаметром до 3,8 мм, для коммуникантного отдела — 4,5 мм |
|
15:20 |
На контрольном ВСУЗИ визуализируются стентированный коммуникантный и кавернозный сегменты левой ВСА, раскрытие стентов оптимальное, без признаков мальпозиции |
|
15:30 |
Пациент переведен в стабильном состоянии в палату реанимации. В последующие сутки переведен в палату без отрицательной динамики по общему состоянию |
|
День 5 |
Выписка больного в стабильном состоянии. Рекомендовано продолжить приём двойной антиагрегантной терапии в течение 12 мес. с последующей контрольной МСКТ-ангиографией через 6 мес. |
Примечание: ВСА — внутренняя сонная артерия, ВСУЗИ — внутрисосудистое ультразвуковое исследование, МСКТ — мультиспиральная компьютерная томография, ОНМК — острое нарушение мозгового кровообращения.
Клинический диагноз
Основной: Атеросклероз. Стеноз кавернозного и коммуникантного интракраниальных сегментов левой ВСА до 80%. Цереброваскулярная болезнь. ИИ в бассейне левой СМА от 2022г и 2023г, атеротромботический подтип по TOAST.
Сопутствующие заболевания: ИБС. Стенокардия напряжения 3 ФК. Постинфарктный кардиосклероз (инфаркт миокарда неизвестной давности). Стенозирующий коронароатеросклероз со стенозом передней межжелудочковой ветви 95% и огибающей ветви 65% левой коронарной артерии. Состояние после стентирования передней межжелудочковой ветви левой коронарной артерии под контролем ВСУЗИ от 2022г.
Медицинские вмешательства
По результатам мультиспиральной компьютерной томографии (МСКТ) головы определена окклюзия левой ВСА от устья, обширная зона "пенумбры" с формированием небольшой зоны "ядра" в левой гемисфере (рисунок 1). Пациент соответствовал критериям для выполнения экстренного эндоваскулярного вмешательства. Пациент был взят в рентгеноперационную. Под местной анестезией и внутривенной седацией через правый бедренный доступ выполнена катетеризация баллонным гайд-катетером левой общей сонной артерии. На прямой селективной ангиографии подтверждена окклюзия левой ВСА. Далее выполнено раздутие баллона с временной обтурацией общей сонной артерии. Выполнена тромбоаспирация аспирационным катетером, позволившая извлечь тромбы из экстракраниального отдела левой ВСА. Далее визуализируется окклюзия коммуникантного отдела левой ВСА (рисунок 2).
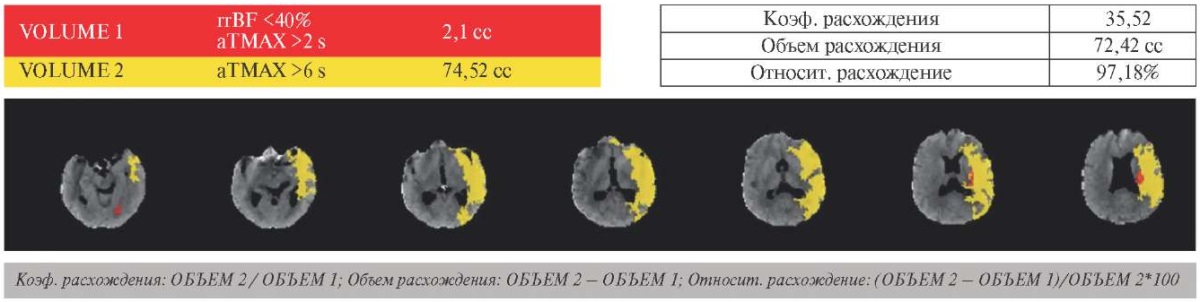
Рис. 1 МСКТ-перфузия головного мозга. Объём "ядра" (rBF) — 2,1 мл, объём "пенумбры" (Tmax) — 74,5 мл, коэффициент расхождения (mismatch) — 35,5.
Примечание: МСКТ — мультиспиральная компьютерная томография. Цветное изображение доступно в электронной версии журнала.
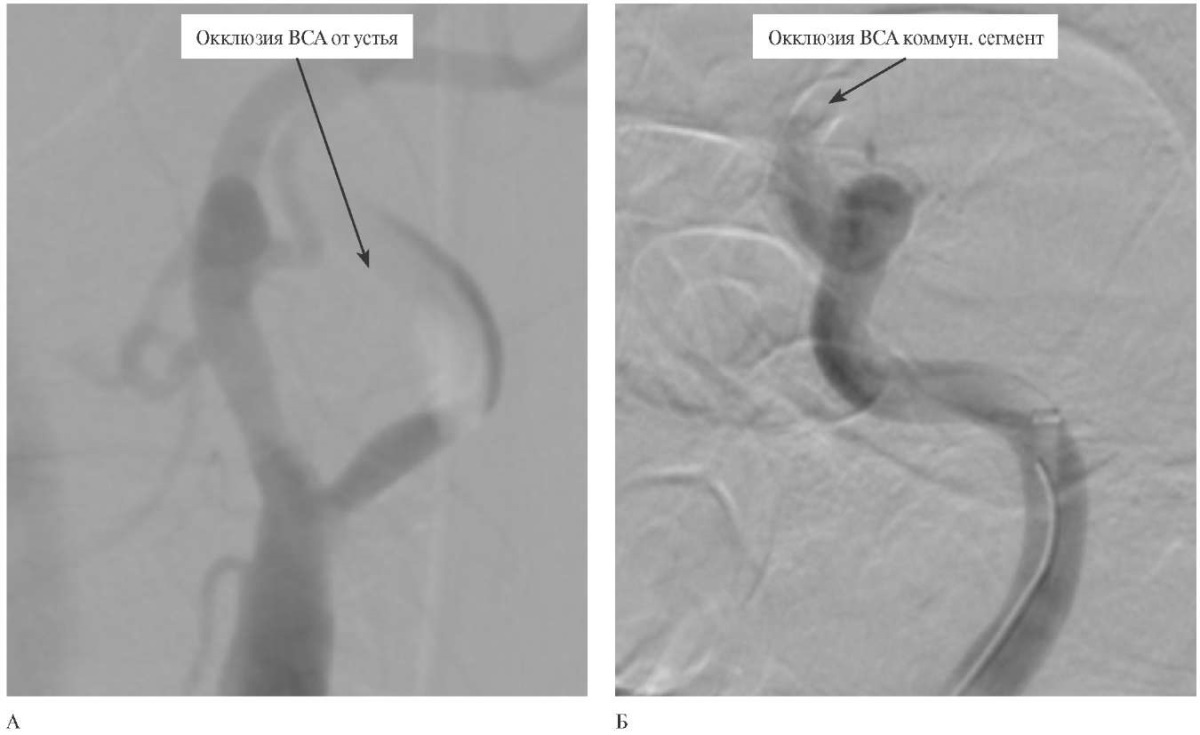
Рис. 2 Прямая ангиография и эндоваскулярное вмешательство: А — окклюзия левой ВСА от устья; Б — после первой тромбоаспирации с реканализацией экстракраниального отдела левой ВСА с диагностированной окклюзией коммуникантного отдела левой ВСА.
Примечание: ВСА — внутренняя сонная артерия.
Далее выполнена одномоментная тромбоаспирация и тромбэкстракция с комбинированным использованием аспирационного катетера и стент-ретриевера, в результате которого реваскуляризирован весь левый каротидный бассейн с восстановлением проходимости по интакраниальным ветвям левой ВСА. Также визуализируются стеноз коммуникантного сегмента левой ВСА до 70-80% с зоной локальной диссекции, и зона диссекции кавернозного сегмента левой ВСА (рисунок 3).
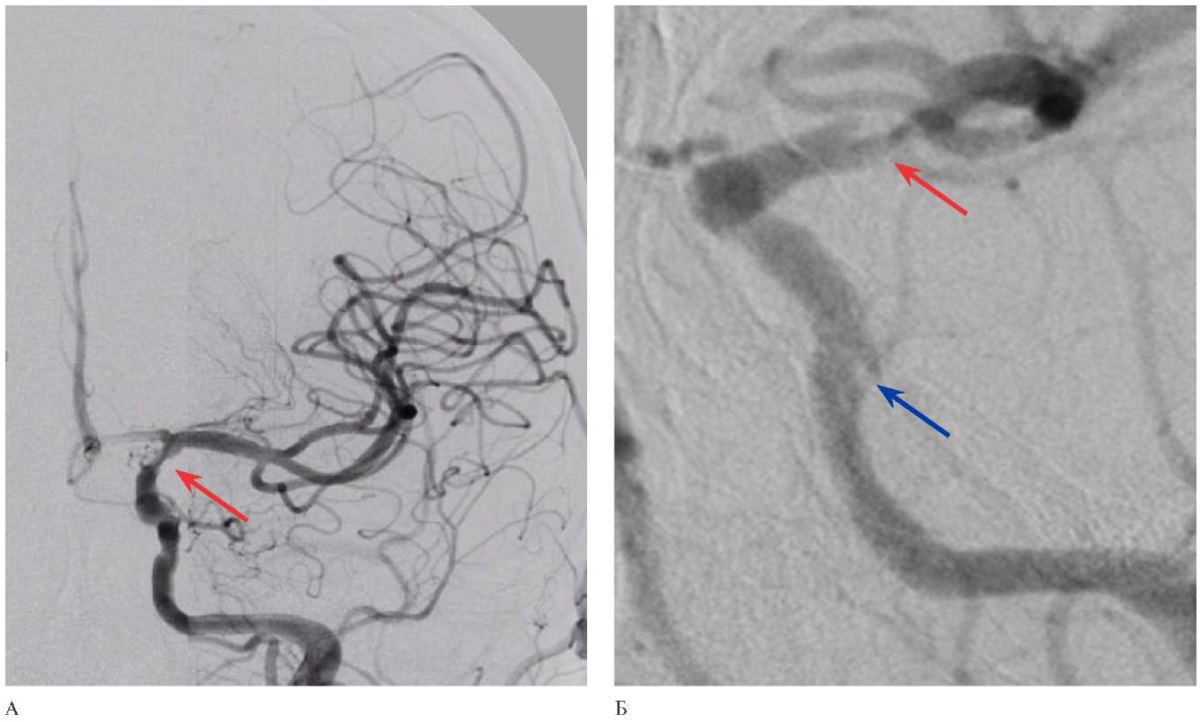
Рис. 3 Прямая ангиография после тромбэкстракции: А — полная проходимость интракраниальных ветвей левой ВСА, "красной" стрелкой отмечен стеноз коммуникантного сегмента левой ВСА; Б — зона стеноза (указано "красной" стрелкой) коммуникантного отдела с локальной диссекцией и зона диссекции (указано "синей" стрелкой) кавернозного сегмента левой ВСА.
Примечание: ВСА — внутренняя сонная артерия.
Интраоперационно даны через назогастральный зонд дезагреганты (тикагрелор 180 мг и ацетилсалициловая кислота 100 мг) для профилактики тромботических осложнений в зоне стеноза с диссекцией ИКА. Дважды через каждые 10 мин выполнены контрольные ангиографии для оценки в динамике состояния церебрального кровотока в зоне стеноза и диссекции левой ВСА. Учитывая положительный эффект от проведенной тромбэкстракции, отсутствие при контрольной ангиографии реокклюзии интракраниальной артерии в зоне стеноза с диссекцией, было решено завершить оперативное вмешательство. Рекомендовано выполнение стентирования интракраниальных ветвей ВСА в плановом порядке.
После выполненной тромбэктомии положительная динамика в виде регресса неврологического дефицита до NIHSS 5 баллов. Через 1 мес. после тромбэктомии пациенту выполнили плановое оперативное вмешательство в стенозированных сегментах левой ВСА.
На контрольной прямой ангиографии имеется стеноз до 80% коммуникантного и кавернозного сегментов левой ВСА (рисунок 4).
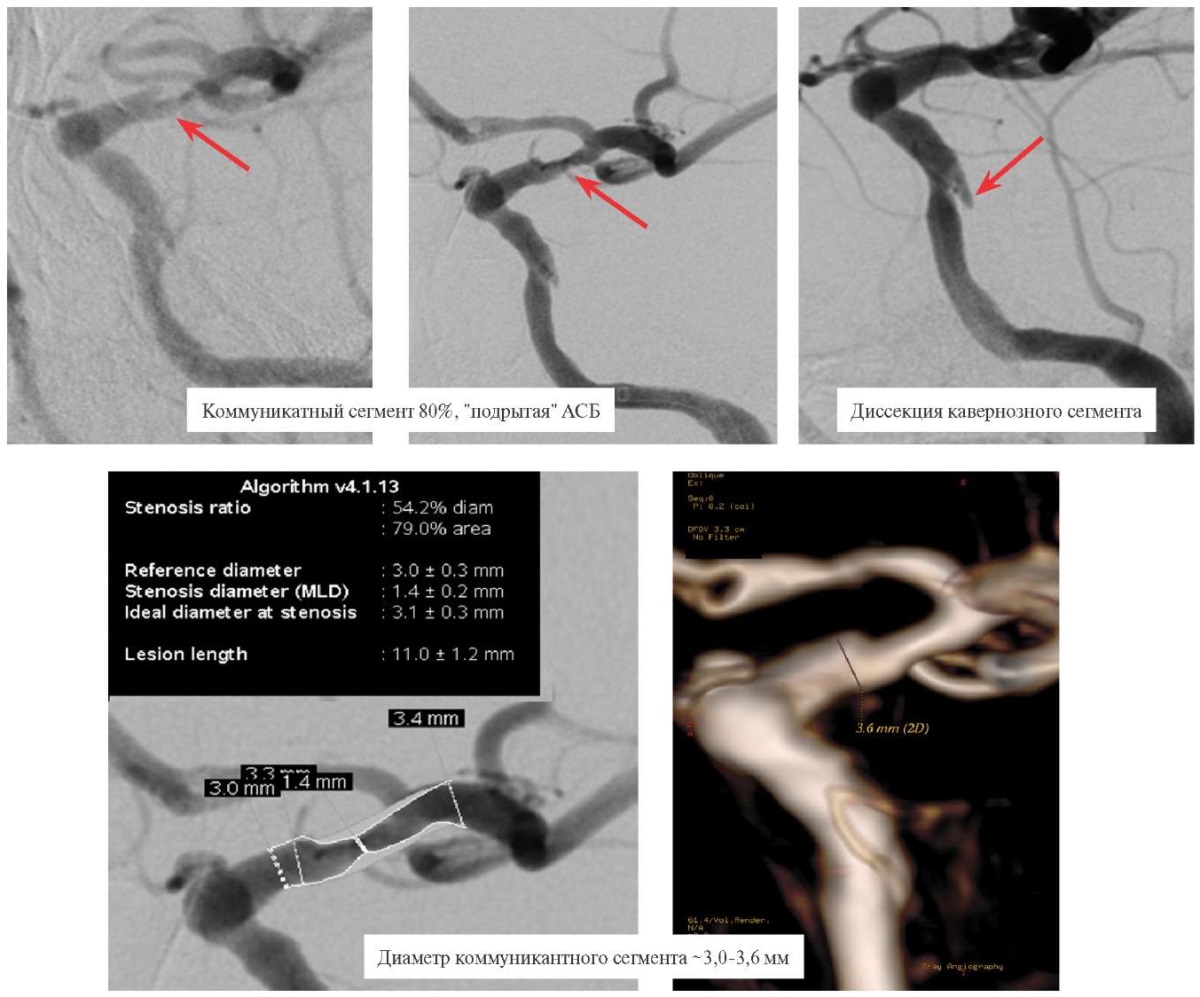
Рис. 4 Верхний ряд ангиограмм: прямая ангиография через 1 мес. — стеноз до 80% коммуникантного сегмента и диссекция (указаны красной стрелкой) кавернозного сегмента левой ВСА; нижний ряд ангиограмм: расчёты диаметра коммуникантного сегмента левой ВСА по данным субтракционной прямой ангиографии и 3D-ангиографии.
Примечание: ВСА — внутренняя сонная артерия.
По результатам расчёта с помощью программного обеспечения "Stenosys analysis" ангиографа и 3D ангиографической реконструкции показан диаметр нативного сосуда от 3,0 до 3,6 мм, что затрудняло подбор размера стента (рисунок 4).
С целью уточнения истинного диаметра коммуникантного отдела левой ВСА, степени и морфологии стеноза решено выполнить ВСУЗИ. По коаксиально установленной системе проводниковых нейрокатетеров по 0,014” проводнику заведен катетер с ультразвуковым датчиком частотой 60 МГц (рисунок 5).
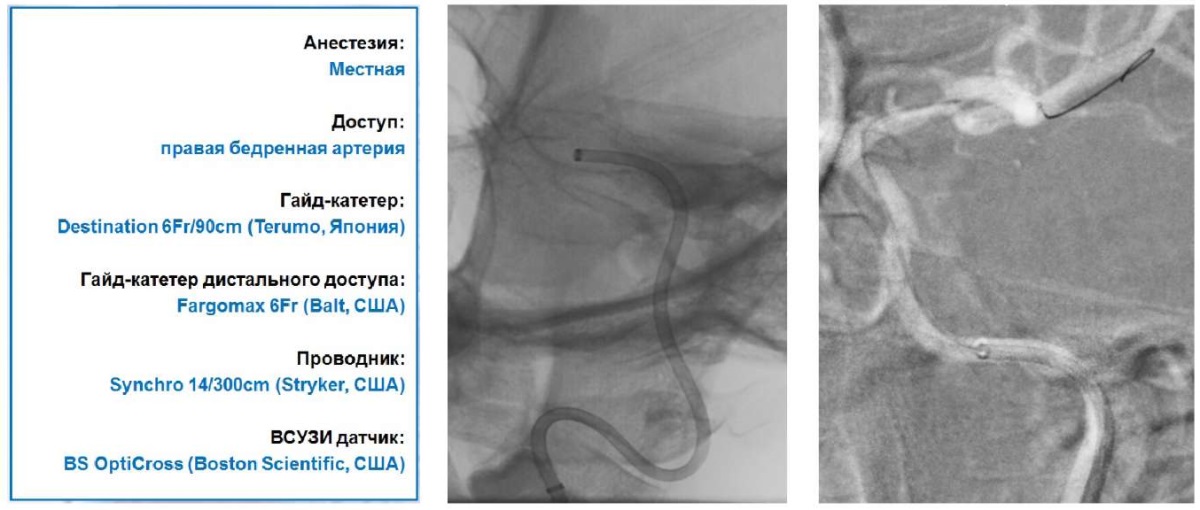
Рис. 5 Рентгенографическая картина установленной коаксиальной системы проводниковых катетеров и датчика ВСУЗИ.
Примечание: ВСУЗИ — внутрисосудистое ультразвуковое исследование.
По результатам выполненного ВСУЗИ по сегментам видим: СМА без изменений, диаметр её составляет 4,0 мм; в коммуникантном сегменте степень стеноза до 76%, АСБ с кальцием и фиброзом, истинный диаметр сосуда 3,8 мм; в офтальмическом сегменте гемодинамически незначимое сужение до 35%; в кавернозном сегменте зона локальной диссекции интимы с сужением просвета сосуда до 44%, имеется кальцификация отслоившейся зоны интимы, диаметр нативного сосуда 4,5 мм (рисунок 6).
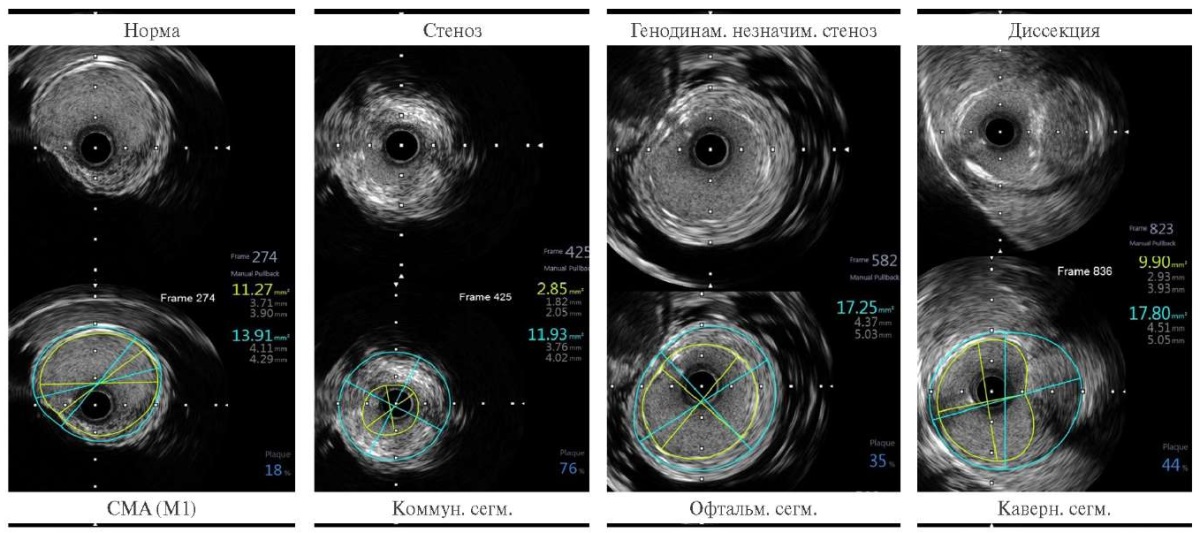
Рис. 6 Снимки ВСУЗИ по сегментам левой ВСА.
Примечание: ВСА — внутренняя сонная артерия, ВСУЗИ — внутрисосудистое ультразвуковое исследование, СМА — средняя мозговая артерия. Цветное изображение доступно в электронной версии журнала.
С учётом измерений выбраны коронарные стенты с лекарственным покрытием для коммуникантного сегмента ВСА 3,5 мм в диаметре и длиной 8,0 мм, для кавернозного сегмента 4,5 мм в диаметре и длиной 12,0 мм. Выполнена имплантация стентов с раздутием баллона в стенте для коммуникантного отдела диаметром до 3,8 мм, для коммуникантного отдела — 4,5 мм (рисунок 7).
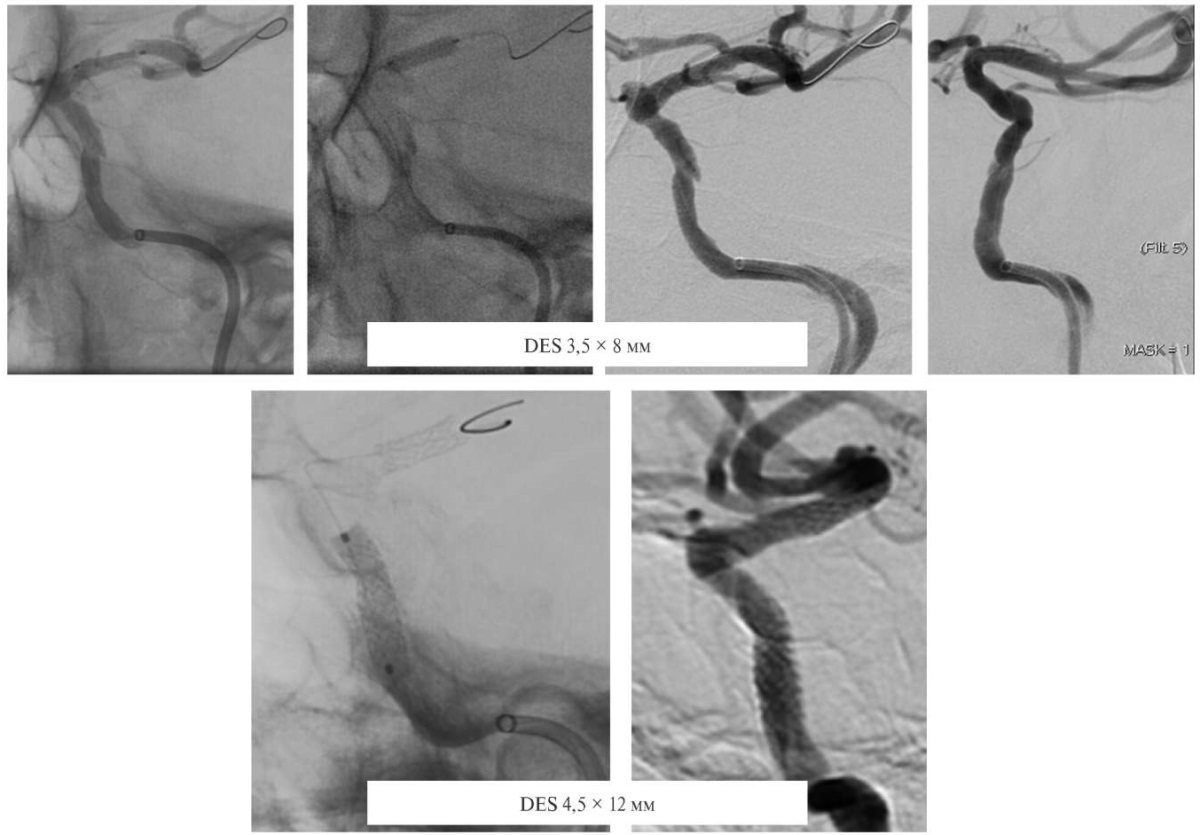
Рис. 7 Верхний ряд ангиограмм: имплантация стента в коммуникантный сегмент левой ВСА с агиографической картиной после имплантации стента. Нижний ряд ангиограмм: имплантация стента в кавернозный сегмент левой ВСА с ангиографической картиной после имплантации стента.
Примечание: ВСА — внутренняя сонная артерия.
На контрольном ВСУЗИ визуализированы стентированные коммуникантный и кавернозный сегменты левой ВСА, раскрытие стентов оптимальное, без признаков мальапозиции (рисунок 8).
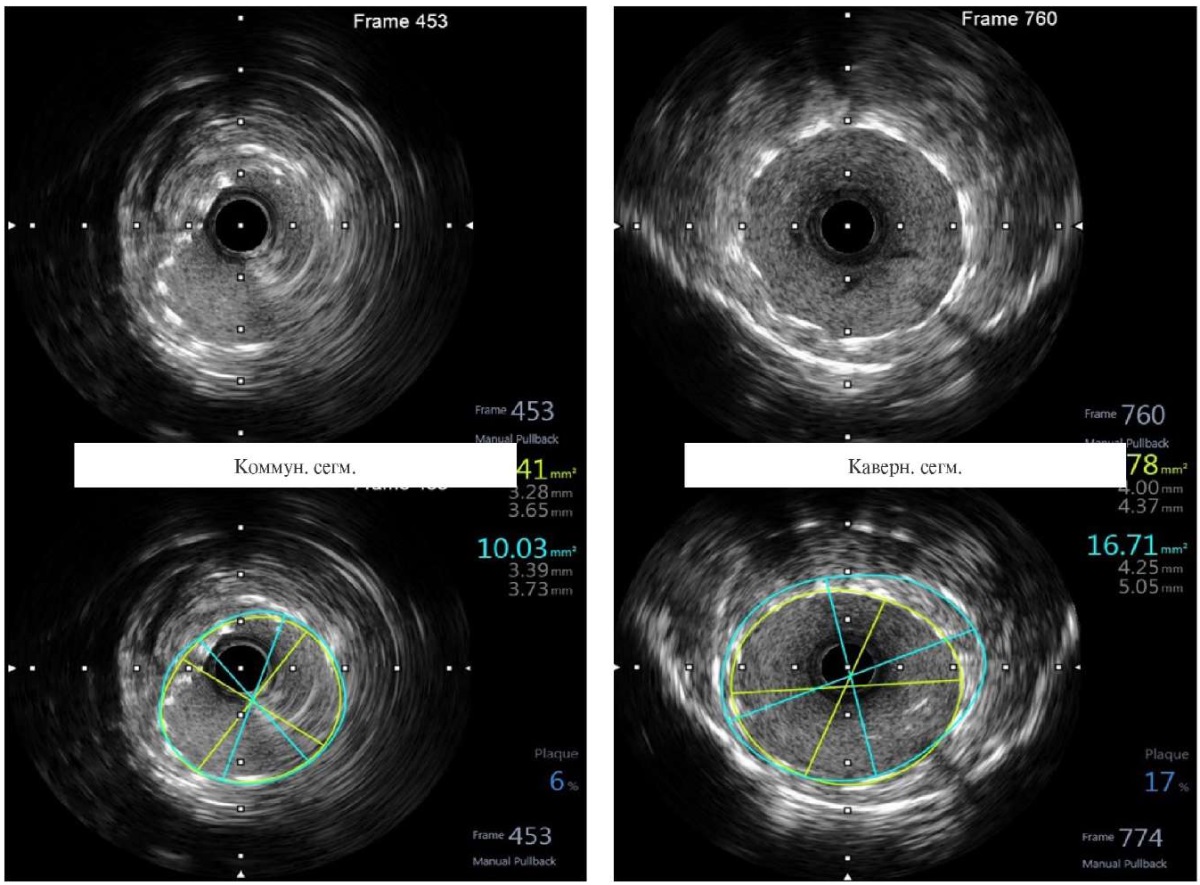
Рис. 8 Контрольная ВСУЗИ стентированных сегментов левой ВСА.
Примечание: ВСА — внутренняя сонная артерия, ВСУЗИ — внутрисосудистое ультразвуковое исследование. Цветное изображение доступно в электронной версии журнала.
Операция проведена под местной анестезией с небольшой внутривенной седацией в момент раскрытия стентов. Пациент переведен в стабильном состоянии в палату реанимации. На следующие сутки переведен в палату, без отрицательной динамики по общему состоянию. Рекомендовано продолжить приём двойной антиагрегантной терапии в течение 12 мес. с последующей контрольной МСКТ-ангиографией через 6 мес.
Динамика и исходы
В послеоперационном периоде общее состояние пациента без отрицательной динамики. На 5 сут. после планового оперативного вмешательства выписан под амбулаторное наблюдение невролога, кардиолога, сосудистого хирурга.
Обсуждение
Приведенный клинический пример показал важность применения ВСУЗИ для уточнения морфологии поражения ИКА, где имелась кальцинированная "нестабильная" с изъязвленными краями АСБ коммуникантного сегмента ВСА, гемодинамически незначимо суженный просвет офтальмического сегмента и диссекция кавернозного сегмента ВСА. Все измерения проводились по аналогии стентирования коронарных артерий. Расчёты ВСУЗИ значимо отличались от данных прямой ангиографии, что позволило подобрать необходимый диаметр и длину стента исходя от истинного диаметра нативного сосуда и длины протяженности АСБ.
ВСУЗИ значительно облегчило понимание процесса коронарного атеросклероза, послужив основой для многих достижений в методах ЧКВ. На основе инвазивных методов визуализации ЧКВ достигли оптимальных технических результатов в условиях сложного поражения коронарных артерий, что позволило снизить риск неблагоприятных сердечных событий. Полученные изображения ВСУЗИ в данном клиническом примере, указывают, как часто простая прямая ангиография недооценивает истинную протяженность, характеристики АСБ, склонных к разрыву и вызывающих острые неблагоприятные события.
По данным зарубежных авторов, визуализация ИКА ограничена из-за сложности навигации по внутричерепным сосудам из-за узкого хода и выраженной извилистости сосудов [15]. В приведённом клиническом примере нам удалось провести ВСУЗИ перед стентированием дистального отдела ВСА и СМА, что демонстрирует возможность проведения датчика ВСУЗИ через сложные анатомические извитости ИКА при поддержке атравматичных проводниковых нейрокатетеров дистального доступа.
Адекватная визуализация стенки сосуда достигается с помощью датчиков с частотой 20-40 МГц [16]. Manninen HI, et al. [17] обнаружили, что оптимальное разрешение в артериях диаметром 3-6 мм достигается с помощью датчика с частотой 30 МГц, что дает максимальный радиус проникновения ~5 мм. Однако иногда поражения на поверхности интимы не могут быть адекватно визуализированы, поскольку они находятся ниже предела разрешения используемой системы ВСУЗИ или скрыты содержимым АСБ. В настоящем клиническом примере применён датчик высокого разрешения в 60 МГц, что позволило получить более четкую детализированную картину состояния сосудистого русла по всем слоям стенки артерии. Несмотря на имеющиеся риски о повреждении или расслоении сосуда и непреднамеренным разрушением АСБ при заведении датчиков через выраженные стенозы ИКА [15], в нашем клиническом примере подобных ситуаций не было.
Можно полагать, что использование ВСУЗИ в ИКА может обеспечить необходимой информацией нейроинтервенционистов для выполнения высокоэффективных и оптимальных эндоваскулярных вмешательств на ИКА, а также позволит снизить риск неблагоприятных интра- и послеоперационных событий.
Заключение
Эндоваскулярные вмешательства на ИКА с применением высокочастотного датчика ВСУЗИ относительно безопасны, эффективны и информативны в определении морфологии поражения сосуда, позволяют оптимизировать процесс стентирования артерии с целью снижения интра- и послеоперационных неблагоприятных событий.
Информированное согласие
От пациента получено письменное добровольное информированное согласие на публикацию описания клинического случая (дата подписания 15.11.2023г).
От пациента получено добровольное письменное информированное согласие на публикацию его изображений в медицинском журнале, включая его электронную версию (дата подписания 15.11.2023г).
Разрешения на перепубликацию, лицензирование
Каждый представленный в рукописи графический объект (рисунок или фотография) и таблицы являются авторскими и не заимствованы из других источников.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Сергеева А. Н., Сергеев Д. В., Пирадов М. А. Интракраниальный атеросклероз: диагностика, клинические проявления, терапия. Эффективная фармакотерапия. 2014;6(52):44-50.
2. Gorelick PB, Wong KS, Bae H-J, Pandey DK. Large artery intracranial occlusive disease: a large worldwide burden but a relatively neglected frontier. Stroke. 2008;39(8):2396-9. doi:10.1161/STROKEAHA.107.505776.
3. Сорокоумов В.А., Савелло А. В. Атеросклероз внутричерепных артерий: причины ишемического инсульта, диагностика и лечение. Неврология, нейропсихиатрия, психосоматика. 2014;6(2S):50-5. doi:10.14412/2074-2711-2014-2S-50-55.
4. Танашян М. М., Лагода О. В., Раскуражев А. А. и др. Экстра-versus интракраниальный атеросклероз: две грани одной проблемы. Российский неврологический журнал. 2022;27(3):11-9. doi:10.30629/2658-7947-2022-27-3-11-19.
5. Gorelick PB, Richardson DJ, Kelly M, et al. Aspirin and ticlopidine for prevention of recurrent stroke in black patients: a randomized trial. JAMA. 2003. 11;289(22):2947-57. doi:10.1001/jama.289.22.2947.
6. Chimowitz MI, Lynn MJ, Derdeyn CP, et al.; SAMMPRIS Trial Investigators. Stenting versus aggressive medical therapy for intracranial arterial stenosis. N Engl J Med. 2011;365(11):993-1003. doi:10.1056/NEJMoa1105335.
7. Miao Zh, Jiang L, Wu H, et al. Randomized Controlled Trial of Symptomatic Middle Cerebral Artery Stenosis. Stroke. 2012;43(12):3284-90. doi:10.1161/STROKEAHA.112.662270.
8. Gao P, Wang T, Wang D, et al. Effect of Stenting Plus Medical Therapy vs Medical Therapy Alone on Risk of Stroke and Death in Patients With Symptomatic Intracranial Stenosis: The CASSISS Randomized Clinical Trial. JAMA. 2022;328(6):534-42. doi:10.1001/jama.2022.12000.
9. Dearborn JL, Zhang Y, Qiao Y, et al. Intracranial atherosclerosis and dementia: the Atherosclerosis Risk in Communities (ARIC) Study. Neurology. 2017;88(16):1556-63. doi:10.1212/WNL.0000000000003837.
10. Танашян М. М., Раскуражев А. А., Шабалина А. А. и др. Биомаркеры церебрального атеросклероза: возможности ранней диагностики и прогнозирования индивидуального риска. Анналы клинической и экспериментальной неврологии. 2015;9(3):20-5.
11. Демин В. В., Зеленин В. В., Желудков А. Н. и др. Внутрисосудистое ультразвуковое сканирование при интервенционных вмешательствах на коронарных артериях: оптимальное применение и критерии оценки. Международный журнал интервенционной кардиоангиологии. 2003;1:66-72.
12. Волков С. В., Мыцык С. А., Наумов С. М. и др. Стентирование внутренних сонных артерий под контролем внутрисосудистого ультразвукового исследования. Ангиология и сосудистая хирургия. 2019;25(4):41-52. doi:10.33529/Angio2019419.
13. Петросян К. В., Юлдашев Ф. Ш. Использование внутрисосудистого ультразвукового исследования при стентировании общей сонной артерии у пациентки с бикаротидным поражением. Грудная и сердечно-сосудистая хирургия. 2022;5(64): 554-9. doi:10.24022/0236-2791-2022-64-5-554-559.
14. Wehman JC, Holmes DRJr, et al. Intravascular ultrasound for intracranial angioplasty and stent placement: technical case report. Neurosurgery. 2006;59(2):481-83. doi:10.1227/01.NEU.0000222825.92929.0C.
15. Жердев Н. Н., Чернова Д. В., Комаха Б. Б. и др. Результаты применения внутрисосудистой визуализации при стентировании внутренней сонной артерии: опыт одного центра. Эндоваскулярная хирургия. 2019;6(2):133-9. doi:10.24183/2409-4080-2019-6-2-133-139.
16. Gupta R, Bhatt A, Kassab M, et al. Intravascular ultrasound to assess extracranial vertebral artery restenosis: case report. J Neuroimaging. 2008;18(3):336-9. doi:10.1111/j.1552-6569.2007.00220.x.
17. Manninen HI, Räsänen H, Vanninen RL, et al. Human carotid arteries: correlation of intravascular US with angiographic and histopathologic findings. Radiology. 1998;206(1):65-74. doi:10.1148/radiology.206.1.9423653.
Об авторах
Н. В. ЗакарянРоссия
Закарян Нарек Варданович — д.м.н., научный руководитель по рентгенэндоваскулярным диагностике и лечению.
Москва
Е. Б. Молохоев
Россия
Молохоев Евгений Борисович — к.м.н. врач по рентгенэндоваскулярной диагностике и лечению отделения рентгенохирургических методов диагностики и лечения, и хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции ФГБУ «КБ №1» Управления делами Президента РФ; доцент кафедры скорой медицинской помощи, неотложной и экстремальной медицины ФГБУ ДПО «ЦГМА» Управления делами Президента РФ.
Москва
В. В. Бояринцев
Россия
Бояринцев Валерий Владимирович — д.м.н., профессор, заведующий кафедрой скорой медицинской помощи, неотложной и экстремальной медицины ФГБУ ДПО «ЦГМА» Управления делами Президента РФ, профессор Российской академии наук, Заслуженный врач РФ, Заместитель начальника Главного медицинского управления Управления делами Президента РФ.
Москва
В. Н. Ардашев
Россия
Ардашев Вячеслав Николаевич — д.м.н., профессор, заслуженный врач РФ, заслуженный деятель науки РФ, научный руководитель по терапии.
Москва
Д. С. Белков
Россия
Белков Дмитрий Сергеевич — к.м.н., доцент кафедры факультетской хирургии 1 лечебного факультета, РНИМУ им. Н.И. Пирогова; врач-хирург отделения абдоминальной хирургии ФГБУ «КБ №1» Управления делами Президента РФ.
Москва
А. Г. Давтян
Россия
Давтян Арман Генрикович — врач по рентгенэндоваскулярной диагностике и лечению, и.о. зав. отделением рентгенохирургических методов диагностики и лечения, и хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции.
Москва
В. Р. Киракосян
Россия
Киракосян Вардан Рафикович — врач по рентгенэндоваскулярной диагностике и лечению отделения рентгенохирургических методов диагностики и лечения, и хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции.
Москва
А. С. Панков
Россия
Панков Алексей Сергеевич — к.м.н., врач по рентгенэндоваскулярной диагностике и лечению отделения рентгенохирургических методов диагностики и лечения, и хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции.
Москва
Дополнительные файлы
- Повторный ишемический инсульт развился у больного, постоянно принимающего антиагрегантную терапию, на фоне стеноза интракраниальных артерий (ИКА).
- Стентирование ИКА не уступает по эффективности и исходам лечения лекарственной терапии.
- Внутрисосудистое ультразвуковое исследование ИКА обеспечит необходимой информацией о морфологии поражения сосуда для выполнения эндоваскулярных вмешательств, что снизит риск неблагоприятных интра- и послеоперационных событий.
Рецензия
Для цитирования:
Закарян Н.В., Молохоев Е.Б., Бояринцев В.В., Ардашев В.Н., Белков Д.С., Давтян А.Г., Киракосян В.Р., Панков А.С. Стентирование интракраниальных артерий с применением внутрисосудистого ультразвукового исследования у пациента с повторным ишемическим инсультом. Клинический случай. Кардиоваскулярная терапия и профилактика. 2024;23(6):3862. https://doi.org/10.15829/1728-8800-2024-3862. EDN: QKXWZB
For citation:
Zakaryan N.V., Molokhoev E.B., Boyarintsev V.V., Ardashev V.N., Belkov D.S., Davtyan A.G., Kirakosyan V.R., Pankov A.S. Intravascular ultrasound-guided intracranial artery stenting in a patient with recurrent ischemic stroke: a case report. Cardiovascular Therapy and Prevention. 2024;23(6):3862. (In Russ.) https://doi.org/10.15829/1728-8800-2024-3862. EDN: QKXWZB
JATS XML

























































