Перейти к:
Изучение провоспалительных маркеров, уровня галектина-3, параметров липидного обмена, сердечно-сосудистого статуса и их взаимосвязей у пациентов с лимфомами до начала противоопухолевой терапии
https://doi.org/10.15829/1728-8800-2025
EDN: SIHVAK
Аннотация
Цель. Изучить значение провоспалительных маркеров, уровня галектина-3, показателей липидного спектра, сердечно-сосудистого статуса и их взаимосвязи у пациентов с лимфомами до начала специфической противоопухолевой терапии, сопоставить значения изученных показателей с результатами данных пациентов со схожим кардиальным статусом без онкологического заболевания.
Материал и методы. В исследование было включено 2 группы пациентов: основная группа (n=30) — пациенты с впервые установленным лимфопролиферативным заболеванием (ЛПЗ), группа сравнения (n=30) — пациенты со схожими факторами риска и/или доказанной кардиоваскулярной патологией, без онкологического заболевания в анамнезе. Всем включенным в исследование проведено определение маркеров воспаления, липидограммы и специальных маркеров (концентрация интерлейкина-6 (ИЛ-6) и галектина-3).
Результаты. Включенные в исследование пациенты обеих групп были сопоставимы по возрасту, полу, факторам риска сердечно-сосудистого заболеваний, кардиальной терапии. Определено, что у пациентов основной группы уровень потенциально проатерогенных липидов в группе пациентов с лимфомами был несколько выше, чем в группе сравнения, хотя различия не достигли статистической значимости (p>0,05); достоверно выше были — уровни белков острой фазы (С-реактивный белок, ферритин, фибриноген), скорость оседания эритроцитов (р<0,05 для всех показателей), ИЛ-6 (p=0,032), маркера фиброза — галектина-3 (p=0,001). Внутригрупповой анализ в группе ЛПЗ в зависимости от международных прогностических индексов для лимфом (IPI/MIPI/FLIPI — International Prognostic Index/Mantle cell Lymphoma International Prognostic Index/Follicular Lymphoma International Prognostic Index) продемонстрировал, что уровни галектина-3 и ИЛ-6 оказались выше у пациентов с худшими показателями прогноза ЛПЗ. В ходе корреляционного анализа выявлена прямая умеренной силы взаимосвязь между галектином-3 и ИЛ-6 (r=0,488; p=0,016).
Заключение. В ходе исследования было показано, что исследуемые группы по уровню потенциально проатерогенных липидов статистически значимо не различались. Результаты сравнительного анализа демонстрируют, что концентрация галектина-3 и ИЛ-6 при ЛПЗ значимо выше относительно данных группы сравнения, их высокий уровень может являться отражением активности опухолевого процесса. Значение данных биомаркеров в развитии кардиоваскулотоксических осложнений у пациентов с ЛПЗ на данный момент не изучено и представляется интересным с точки зрения их возможной предикторной роли в развитии сердечно-сосудистых осложнений химиотерапии.
Ключевые слова
Для цитирования:
Соколова И.Я., Кардовская С.А., Салахеева Е.Ю., Кириченко Ю.Ю., Сидерко Е.А., Бочкарникова О.В., Щендрыгина А.А., Беленков Ю.Н., Ильгисонис И.С. Изучение провоспалительных маркеров, уровня галектина-3, параметров липидного обмена, сердечно-сосудистого статуса и их взаимосвязей у пациентов с лимфомами до начала противоопухолевой терапии. Кардиоваскулярная терапия и профилактика. 2025;24(1):3944. https://doi.org/10.15829/1728-8800-2025. EDN: SIHVAK
For citation:
Sokolova I.Ya., Kardovskaya S.A., Salakheeva E.Yu., Kirichenko Yu.Yu., Siderko E.A., Bochkarnikova O.V., Shchendrygina A.A., Belenkov Yu.N., Ilgisonis I.S. Study of proinflammatory markers, galectin-3 level, lipid metabolism parameters, cardiovascular status and their relationship in patients with lymphomas before antitumor therapy. Cardiovascular Therapy and Prevention. 2025;24(1):3944. (In Russ.) https://doi.org/10.15829/1728-8800-2025. EDN: SIHVAK
Введение
Кардиоонкология (КО) — одна из стремительно развивающихся отраслей медицины, что обусловлено ее большой значимостью в ежедневной рутинной практике врачей-кардиологов. В настоящее время стремительно увеличивается количество пациентов, которые достигли ремиссии в отношении онкопатологии. Как правило, одним из основных методов их лечения является химиотерапия, таким образом, в ежедневной клинической практике кардиологов пациенты, которые имеют в анамнезе злокачественные новообразования и проведенную по их поводу химиотерапию, становятся часто встречающейся когортой больных. Благодаря накопленной в настоящее время информации стало понятно, что наличие онкологического заболевания и проведенного противоопухолевого лечения приводит к развитию осложнений со стороны сердечно-сосудистой системы (ССС), что нередко ограничивает возможность использования высокоэффективных противоопухолевых методов лечения, а также значимо ухудшает качество жизни пациентов, достигших ремиссии в отношении злокачественного заболевания.
Внедрение и активное использование различных высокоэффективных противоопухолевых стратегий ассоциировано с развитием кардиоваскулотоксических (КВТ) осложнений, что подчеркивает для кардиологов/кардиоонкологов значимость оценки исходного КВТ риска, определения характера и объема превентивной кардиальной терапии [1][2].
Стратификация риска КВТ осложнений на современном этапе направлена на комплексную оценку состояния ССС, что является первостепенным, т.к. точное определение исходного КО риска служит предпосылкой для назначения и/или коррекции превентивной кардиальной терапии. Однако, согласно современным литературным данным, целесообразно оценивать и основные показатели, характеризующие активность опухолевого процесса [3]. Особенностью всех злокачественных заболеваний в гематологии является системность патологических процессов на этапах инициации развития, манифестации и прогрессирования новообразований.
Гетерогенная группа лимфопролиферативных заболеваний (ЛПЗ) является наиболее часто встречающейся в практике гематологов онкологической нозологией [4]. Значимость малоинтенсивного системного воспаления в патогенезе кардиоваскулярной патологии давно доказана и подробно изучена; в силу этого роль характерного для лимфом воспалительного ответа в отношении воздействия на систему кровообращения представляет особый интерес. В большинстве используемых для лечения ЛПЗ программных курсов химиотерапии (ХТ) применяются препараты с хорошо известными КВТ свойствами [2]. Например, широко используемый в терапии гемобластозов доксорубицин (антрациклиновый антибиотик) способствует апоптозу и некрозу кардиомиоцитов, приводя к необратимому дозозависимому повреждению миокарда [5]. КВТ эффект алкилирующих агентов (циклофосфамид, мелфалан) обусловлен повреждением дезоксирибонуклеиновой кислоты (ДНК) кардиомиоцитов, эндотелиоцитов их метаболитами, запускающими процессы системного воспаления, дисрегуляции выработки вазодилатирующих молекул, эндотелиальной дисфункции. Дополнительное к цитостатическим препаратам использование высоких доз глюкокортикоидов способствует развитию вторичной артериальной гипертензии (АГ), электролитных нарушений с высоким риском развития фатальных нарушений ритма/проводимости сердца [1][2]. В отдаленном периоде воздействие противоопухолевых препаратов в сочетании с исходными факторами риска (ФР) сердечно-сосудистых заболеваний (ССЗ) и/или доказанной кардиоваскулярной патологии приводит к ремоделированию миокарда и развитию хронической сердечной недостаточности (ХСН). Наличие патологии ССС у данной группы пациентов не только значимо ухудшает качество жизни, но и затрудняет использование эффективных химиопрепаратов при рецидиве/рефрактерности гемобластоза и нередко может стать причиной летальных исходов [6].
Современные клинические исследования в области гематологии и кардиологии продемонстрировали наличие исходных особенностей транспорта липидов в составе липопротеинов плазмы крови у пациентов с высокоагрессивными неходжкинскими лимфомами. Ambrosio MA, et al. доказано, что опухолевые клетки при высокоагрессивных ЛПЗ (лимфома Беркитта, диффузная В-крупноклеточная лимфома) способны изменять экспрессию генов, кодирующих белки, участвующие в регуляции липидного обмена, приводит к накоплению в собственной цитоплазме большого количества обогащенных липидами вакуолей [7]. Имеются также научные данные о повышении уровня проатерогенных липидов после одного курса проведенной противоопухолевой терапии. С учетом этих особенностей анализ исходных липидограмм у пациентов онкогематологического профиля на момент манифестации гемобластоза также можно расценивать как один из ключевых критериев выбора профилактической гиполипидемической терапии [5].
Важной задачей КО является поиск новых, доступных и специфичных биомаркеров, позволяющих с большей точностью определять риски развития побочных эффектов ХТ со стороны ССС, выбор полной и действенной превентивной кардиальной терапии [2][8]. Одними из наиболее перспективных маркеров, отвечающих вышеупомянутым требованиям и отражающих активность патологических процессов, как кардиоваскулярных, так и онкогематологических заболеваний, в настоящее время являются маркеры системного воспалительного ответа и маркеры фиброза.
В концепции патогенеза развития патологии сердца и сосудов интерлейкин (ИЛ)-6 рассматривается в качестве "проатерогенного цитокина", а повышение его концентрации у пациентов с ССЗ является независимым предиктором сердечно-сосудистой смерти [9]. Хорошо изученное участие данной молекулы в патогенезе кардиоваскулярных заболеваний определяет обоснованность изучения ИЛ-6 в качестве маркера-предиктора КВТ ХТ. Роль данного биомаркера в развитии КВТ при использовании различных противоопухолевых методов лечения малоизучена. В 2023г опубликованы данные оригинальной работы о вовлеченности провоспалительных цитокинов в развитие неблагоприятных кардиальных событий у пациентов с В-клеточными опухолями, получавших клеточную терапию (Chimeric Antigen Receptor-T-cell therapy, CAR-T). Показано, что развитие фибрилляции предсердий ассоциированно с высокой концентрацией ИЛ-6 в сыворотке крови на момент возникновения нарушения ритма [10]. Также в 2023г инициировано проспективное исследование ANTEC (Atherosclerosis iN chemoTherapy-rElated Cardiotoxicity), в дизайне которого запланирована оценка ассоциации исходного уровня и динамики изменений ИЛ-6 и риска развития кардиальной дисфункции, связанной с ХТ-лечением [11].
Галектин-3 — белок, секретируемый как клетками иммунной системы, так и неиммунными органами и тканями и участвующий в физиологических процессах репарации. У взрослых наибольшая секреция галектина-3 связана с активностью моноцитов и макрофагов. Здоровый миокард практически не экспрессирует галектин-3, тогда как в условиях патологии доказано его участие в процессах фиброзирования, сопряженного с длительной и высокой экспрессией этого соединения. Основным из преимуществ использования галектина-3 в клинической практике в качестве биомаркера является его "стабильность" (независимость концентрации от пола, возраста, циркадного ритма, физической активности) [12]. Активность биомаркера как в процессах регуляции ЛПЗ, так и в процессах ремоделирования миокарда демонстрирует перспективность его изучения в рамках КО. Экспериментальные работы демонстрируют наличие взаимосвязи уровня галектина-3 и развития острой сердечной недостаточности у мышей, получавших доксорубицин; при этом введение препарата, способствующего снижению продукции галектина-3, связано с низким риском развития фиброза и острой сердечной недостаточности у мышей в период 7 дней [13]. В оригинальном исследовании Dean M, et al. изучена динамика и корреляционные взаимосвязи между основными кардиальными биомаркерами и эхокардиографическими параметрами, в т.ч. в режиме speakle-tracking, у пациентов с раком молочной железы, подлежащих доксорубицин-содержащей ХТ. Выявлена достоверная прямая корреляция умеренной силы между разницей до- и пост-ХТ уровня галектина-3 и значений фракции выброса левого желудочка (ЛЖ) (r=0,407; p=0,011) [14].
На основании вышеизложенных данных целесообразным представилось проведение исследования, направленного на изучение концентрации биомаркеров ИЛ-6 и галектина-3 в сыворотке крови у пациентов с ЛПЗ, определение наличия их различий по сравнению с пациентами, имеющими сходный статус ССС, но не имеющих в анамнезе онкологического процесса.
Цель исследования — изучить значение провоспалительных маркеров, уровня галектина-3, ИЛ-6, показателей липидного спектра, сердечно-сосудистого статуса и их взаимосвязи у пациентов с лимфомами до начала специфической противоопухолевой терапии, сопоставить значения изученных показателей с результатами данных пациентов со схожим кардиальным статусом без онкологического заболевания.
Материал и методы
Проведено одномоментное одноцентровое когортное клиническое исследование (отделение гематологии, отделение кардиологии № 1 Университетской клинической больницы № 1 Сеченовского Университета). Исследование выполнено в соответствии с принципами Хельсинкской декларации, всеми исследуемыми было подписано добровольное информированное согласие, дизайн исследования был одобрен локальным этическим комитетом Сеченовского Университета. Набор пациентов проводился в период с июня 2020г по ноябрь 2022г.
В основную группу (n=30) включены пациенты с доказанным ЛПЗ (лимфома Ходжкина, неходжкинские лимфомы), которым планировалось проведение программной ХТ; диагноз ЛПЗ установлен согласно критериям Российских клинических рекомендаций по диагностике и лечению лимфопролиферативных заболеваний 2018г1. Критериями невключения явились: ишемическая болезнь сердца, ХСН любого гемодинамического фенотипа, острое нарушение мозгового кровообращения в течение 3-х предшествующих мес. от начала исследования, хроническая обструктивная болезнь легких 3-4 стадии, наличие аутоиммунных заболеваний или осложнений основного заболевания, сахарный диабет 1 типа, тяжелые нарушения функции печени и почек (хроническая болезнь почек 3-5 стадии, острое почечное повреждение), хронические заболевания желудочно-кишечного тракта и эндокринной системы в стадии декомпенсации, наличие другого онкологического диагноза и проведенной ХТ в анамнезе. В группу сравнения было включено 30 сопоставимых по полу и возрасту пациентов с соответствующими основной группе ФР ССЗ (курение, дислипидемия, отягощенный семейный анамнез, АГ, сахарный диабет) и/или доказанной кардиоваскулярной патологией. Более детально хараткристика контрольной группы представлена в таблице 1.
Обе группы пациентов были сопоставимы между собой по полу, возрасту и основным ФР ССЗ (таблица 1): медиана (Ме) возраста в группе пациентов с ЛПЗ составила 52 [ 36-64] года, тогда как среди пациентов без онкологического заболевания — 47 [ 39-59] лет, в обеих группах численно несколько превалировали женщины — 60,0 и 63,3% в основной группе и группе сравнения, соответственно.
В зависимости от распространенности лимфопролиферативного процесса по системе стадирования Ann-Arbor, в основную группу было включено 6,7% (n=2) пациентов с I стадией, 20% (n=6) со II стадией, 23,3% (n=7) c III стадией, тогда как у 50% (n=15) включенных пациентов была диагностирована IV стадия ЛПЗ.
Всем включенным в исследование пациентам было проведено стандартное обследование, включая общий анализ крови с подсчетом лейкоцитарной формулы и определение скорости оседания эритроцитов (СОЭ), оценку маркеров системного воспалительного ответа (С-реактивный белок (СРБ), электрофорез белков сыворотки крови, ферритин, фибриноген), а также показателей липидного профиля. В качестве специальных маркеров в обеих группах исследовались концентрация провоспалительного цитокина ИЛ-6 (Human IL-6 ELISA Kit, RayBiotech, ELISA Kit, Китай, и биомаркера фиброза галектина-3 (Human Galektin-3 ELISA Kit, RayBiotech, Китай) методом иммуноферментного анализа при помощи прибора "Adaltis Personal Lab" в автоматическом режиме. Вышеперечисленные показатели в обеих группах оценивались однократно, при этом в основной группе, согласно дизайну, анализ параметров проводился до начала специфической противоопухолевой терапии.
База данных была сформирована при помощи пакета программ Microsoft Office 2017 и подвергнута статистической обработке с помощью SPSS Statistics для MacOS. Результаты представлены в виде категориальных и количественных показателей; для определения типа распределения количественных показателей выборки, с учетом ее размера (<50 исследуемых), использовался критерий Шапиро-Уилка и метод "колокольной кривой" (метод Гаусса). При подтверждении нормального распределения признака результаты описывались посредствам средних арифметических величин (М) и стандартного отклонения (SD), границ 95% доверительного интервала (ДИ). При распределении, отличном от нормального, — в виде Ме и интерквартильного размаха (Q25-Q75). Сравнение средних значений и Ме исследуемых показателей в двух несвязанных выборках проводилось при помощи t-критерия Стьюдента или непараметрического U-критерия Манна-Уитни в зависимости от типа распределения данных. При сравнении Ме в ≥3 несвязанных выборках был использован критерий Краскела-Уоллиса.
Корреляционный анализ был проведен с использованием коэффициентов корреляции Спирмена и Пирсона в зависимости от вида изучаемых переменных (метрические/ранговые/бинарные). Межгрупповые различия и корреляционные связи считались статистически достоверными при значении p<0,05.
Результаты
В ходе статистического анализа не было выявлено межгрупповых различий ни по параметрам системной гемодинамики, которые оказались скомпенсированными, ни по общему сердечно-сосудистому риску, рассчитанному по шкале SCORE (Systematic Coronary Risk Evaluation).
При сравнительной исходной оценке кардиальной и гиполипидемической терапии пациентов в исследуемых группах продемонстрировано, что наиболее часто назначаемыми препаратами явились антигипертензивные агенты (ингибиторы ангиотензинпревращающего фермента (ИАПФ), блокаторы медленных кальциевых каналов (БМКК), тиазидные диуретики) для обеих групп; статистически значимых межгрупповых различий в используемой терапии выявлено не было (таблица 1).
По результатам общеклинического исследования определено, что группы также были сопоставимы по основным показателям клинического анализа крови, уровню гликемии и показателям фильтрационной способности почек: значения Me вышеперечисленных показателей не выходили за рамки референсных значений в обеих группах.
В основной группе у 73,3% (n=22) диагностирован один из вариантов неходжкинских лимфом, тогда как у 26,7% (n=8) был установлен диагноз лимфомы Ходжкина.
Структура распределения пациентов в зависимости от распространенности онкогематологического процесса (по системе Ann Arbor) представлена на рисунке 1.
Согласно современным кардиоонкологическим рекомендациям [2], всем пациентам из основной группы был определен исходный КО-риск: у 50% (n=15) пациентов КО-риск определялся как низкий, у 43,3% (n=13) — как промежуточный и только у 6,7% (n=2) — высокий. Таким образом, исходный сердечно-сосудистый статус онкогематологических пациентов не требовал инициации или смены кардиальной терапии.
При оценке параметров липидного профиля в обеих группах пациентов определено, что все исследуемые показатели не выходили за рамки референсных значений лабораторных данных, а также целевых уровней холестерина (ХС) в зависимости от категории сердечно-сосудистого риска (таблица 2). Исходя из средних значений SCORE в обеих группах, уровень общего ХС соответствовал целевым значениям, тогда как уровень ХС липопротеинов низкой плотности (ЛНП) не превышал целевых значений в группе без онкогематологической патологии, и не отличался от соответствующих показателей пациентов с онкогематологической патологией. Несмотря на сопоставимость включенных в исследование по основным ФР ССЗ, в т.ч. дислипидемии, а также по кардиальной терапии, у пациентов с ЛПЗ были определены более высокие Ме уровней общего ХС, ХС ЛНП и триглицеридов (ТГ) относительно группы сравнения, различие которых при этом не было статистически значимым.
При исследовании белков острой фазы в обеих группах показано, что концентрация СРБ, определенного рутинным методом, ферритина, фибриногена, значения СОЭ была достоверно выше у пациентов с ЛПЗ (таблица 2).
Ме ИЛ-6 у пациентов основной группы оказалась в 7 раз выше Ме концентрации цитокина в группе сравнения (рисунок 1): значения Ме концентрации ИЛ-6 в основной группе составили 10,4 [ 3,25-12,75] vs 1,5 [ 1,5-3,42] пг/мл в группе сравнения (p=0,001).
Результаты оценки маркера фиброза галектина-3 представлены на рисунке 2. Ме концентрации исследуемого маркера у обеих групп не выходили за рамки лабораторных референсых значений, определенных производителями использованного набора для иммуноферментного анализа, однако уровень галектина-3 в группе пациентов с ЛПЗ оказался достоверно выше в 4 раза относительно результатов в группе сравнения: Me галектина-3 в группе пациентов с ЛПЗ составила 33,9 [ 31,21-44,79] нг/мл, тогда как в группе без онкогематологического заболевания — 8,40 [ 7,15-13,67] нг/мл (p=0,001).
В ходе анализа внутригрупповых различий основных маркеров липидного спектра в зависимости от прогностических индексов IPI/MIPI/FLIPI (International Prognostic Index/Mantle cell Lymphoma International Prognostic Index/Follicular Lymphoma International Prognostic Index) оценки выживаемости пациентов с ЛПЗ, было продемонстрировано, что пациенты с худшим прогнозом относительно онкогематологического заболевания имели более высокие значение ТГ в сыворотке крови (таблица 3), что может отражать также более высокий риск развития КВТ осложнений.
При анализе корреляций параметров липидного спектра, исследуемых белков воспаления, уровней ИЛ-6, галектина-3 статистически достоверных взаимосвязей установлено не было; это свидетельствует о том, что более высокий уровень протеарогенных липидов может быть связан с непосредственным наличием ЛПЗ. При этом в группе сравнения была выявлена статистически значимая прямая взаимосвязь уровней ИЛ-6 и ХС ЛНП (r=0,770, p<0,001).
При внутригрупповой оценке распределения исследуемых маркеров выявлено, что концентрации ИЛ-6 и галектина-3 оказались несколько выше у пациентов с худшиим прогнозом по системе IPI/MIPI/FLIPI : так, у пациентов с низким риском неблагоприятного исхода Ме значений галектина-3 составили 33,8 [ 33,9-34,1] и 34,3 [ 32,0-49] нг/мл для пациентов с 0 и 1 баллом, соответственно; для пациентов промежуточного риска (2 балла) Ме соответствовала 34,5 [ 14,00-35,4] нг/мл; при высоком риске неблагоприятного исхода — 38,7 [ 25,9-42,5] нг/мл у пациентов с 3-мя баллами и 44,7 [ 38,0-60,2] нг/мл — с 4-мя баллами по результатам оценки международных прогностических индексов (р=0,796 при сравнении Ме с помощью критерия Краскела-Уоллиса).
Внутригрупповой анализ маркера фиброза галектина-3 основной группы в зависимости от исходного КО риска продемонстрировал, что наименьшая его концентрация определялась у пациентов с высоким КО риском, тогда как наибольшие значения биомаркера были определены у группы пациентов с низким риском развития КВТ осложнений: так, у пациентов с низким КО риском Ме маркера составила 37,4 [ 26,5-49,9] нг/мл, у пациентов с промежуточным риском — 32,9 [ 19,6-34,1] нг/мл, тогда как при высоком КО-риске — 17,7 [ 16,2-19,1] нг/мл (p=0,043).
Другой интересной находкой при проведении корреляционного анализа показателей в группе пациентов с ЛПЗ явилась доставерная прямая взаимосвязь ИЛ-6 и галектина-3 умеренной силы (r=0,488; p=0,016), свидетельствующая о том, что оба показателя являются патогенетически взаимосвязанными с процессами, участвующими в пролиферации опухолевого клона.
Таблица 1
Сравнительная характеристика основных клинико-анамнестических данных и кардиальной терапии в исследуемых группах Ме [Q25-Q75]
Показатель | Основная группа (n=30) | Группа сравнения (n=30) | p |
Возраст (лет), Ме [Q25-Q75] | 52 [ 36-64] | 47 [ 39-59] | 0,367 |
Пол, n (%) | М — 12 (40,0) Ж — 18 (60,0) | М — 11 (36,7) Ж — 19 (63,3) | 0,791 0,789 |
ИМТ, кг/м2 | 24,7 [ 22,1-28,2] | 25,25 [ 23,2-27,5] | 0,734 |
ППТ, м2, М±SD (95% ДИ) | 1,94±0,21 (1,86-2,02) | 1,90±0,19 (1,83-1,97) | 0,373 |
Ожирение, n (%) | 5 (16,7) | 4 (13,3) | 0,925 |
Курение, n (%) | 9 (30,0) | 9 (30,0) | 0,914 |
СД 2 типа, n (%) | 4 (13,3) | 3 (10,0) | 0,935 |
Дислипидемия, n (%) | 5 (16,7) | 4 (13,3) | 0,978 |
АГ, n (%): I ст. II ст. III ст. | 11 (36,7) 6 (20) 3 (10) 2 (6,67) | 9 (30) 4 (13,3) 3 (10) 2 (6,67) | 0,754 |
Семейный анамнез ССЗ, n (%): | 7 (23,3) | 6 (20) | 0,864 |
САД, мм рт.ст., Ме [Q25-Q75] | 127 [ 123-132] | 125 [ 121-129] | 0,964 |
ДАД, мм рт.ст., Ме [Q25-Q75] | 79 [ 72-84] | 77 [ 72-81] | 0,935 |
ЧСС, уд./мин, Ме [Q25-Q75] | 81 [ 72-93] | 78 [ 69-82] | 0,897 |
Шкала SCORE, % | 1,9 | 1,07 | 0,768 |
ИАПФ, n (%) | 6 (20) | 4 (13,3) | 0,754 |
АРА II, n (%) | 2 (6,7) | 3 (10) | 0,984 |
ББ, n (%) | 3 (10) | 2 (6,7) | 0,982 |
Статины, n (%) | 2 (6,7) | 2 (6,7) | 0,997 |
Сахароснижающие препараты, n (%) | 4 (13,3) | 3 (10) | 0,965 |
БМКК, n (%) | 4 (13,3) | 4 (13,3) | 0,997 |
Тиазидные диуретики, n (%) | 6 (20) | 5 (16,7) | 0,875 |
Примечание: АРА — антагонисты рецептора ангиотензина II, ББ — β-блокаторы, БМКК — блокаторы медленных кальциевых каналов, ДАД — диастолическое артериальное давление, ИАПФ — ингибиторы ангиотензинпревращающего фермента, ИМТ — индекс массы тела, СД — сахарный диабет, ППТ — площадь поверхности тела, ССЗ — сердечно-сосудистые заболевания, ЧСС — частота сердечных сокращений, Ме [Q25-Q75] — медиана [интерквартильный размах], М±SD (95% ДИ) — среднее арифметическое±стандартное отклонение (95% доверительный интервал), SCORE — Systematic Coronary Risk Evaluation.
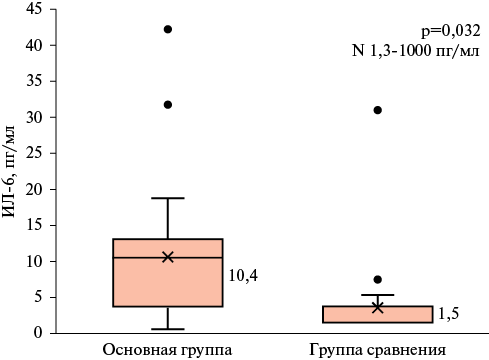
Рис. 1 Концентрация ИЛ-6 в сыворотке крови у пациентов исследуемых групп (Ме [Q25-Q75].
Примечание: ИЛ — интерлейкин, Ме — медиана, Q25-Q75 — интерквартильный размах, N — референсные значения.
Таблица 2
Сравнительный анализ концентрации основных стандартных белков острой фазы и показателей липидного спектра у пациентов исследуемых групп
Показатель | Основная группа (n=30) | Группа сравнения (n=30) | p |
Общий ХС, ммоль/л, М±SD | 4,68±1,19 | 3,9±0,12 | 0,417 |
ХС ЛНП, ммоль/л, М±SD | 3,03±0,98 | 2,0±0,17 | 0,812 |
ХС ЛВП, ммоль/л, Ме [Q25-Q75] | 1,08 [ 0,78-1,40] | 1,2 [ 0,81-1,32] | 0,621 |
ТГ, ммоль/л, Ме [Q25-Q75] | 1,21 [ 0,86-1,35] | 1,06 [ 0,74-1,13] | 0,582 |
СРБ, мг/л, Ме [Q25-Q75] | 7,78 [ 3,0-36,0] | 3,0 [ 2,0-3,0] | <0,001 |
Ферритин, мкг/л, Ме [Q25-Q75] | 57,2 [ 30,48-125,92] | 70,0 [ 60,5-90,0] | 0,05 |
Фибриноген, г/л, Ме [Q25-Q75] | 3,7 [ 2,88-5,98] | 3,3 [ 2,57-3,86] | 0,043 |
СОЭ, мм/ч, Ме [Q25-Q75] | 12 [ 8-23] | 7 [ 4-8] | <0,001 |
Примечание: ЛВП — липопротеины высокой плотности, ЛНП — липопротеины низкой плотности, СРБ — С-реактивный белок, СОЭ — скорость оседания эритроцитов, ТГ — триглицериды, ХС — холестерин, М±SD — среднее арифметическое±стандартное отклонение, Ме [Q25-Q75] — медиана [интерквартильный размах].
Таблица 3
Распределение концентрации ТГ в сыворотке крови у пациентов из группы с ЛПЗ в зависимости от Международных прогностических индексов IPI/MIPI/FLIPI
Система стадирования | Количество баллов | ТГ, ммоль/л | p | |
Ме [ Q25-Q75] | n | |||
IPI/MIPI/FLIPI | 0 | 1,01 [ 0,85-1,17] | 2 | 0,135 |
1 | 1,18 [ 0,88-1,23] | 10 | ||
2 | 1,27 [ 0,81-1,34] | 8 | ||
3 | 1,22 [ 1,08-1,52] | 7 | ||
4 | 1,41 [ 1,04-1,69] | 3 | ||
Примечание: ЛПЗ — лимфопролиферативное заболевание, ТГ — триглицериды, IPI/MIPI/FLIPI — International Prognostic Index/Mantle cell Lymphoma International Prognostic Index/Follicular Lymphoma International Prognostic Index, Ме [Q25-Q75] — медиана [интерквартильный размах].
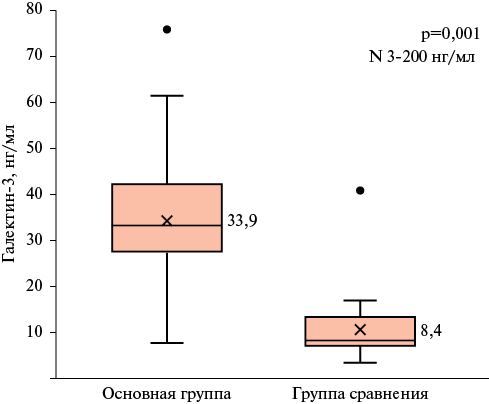
Рис. 2 Концентрация и галектина-3 в сыворотке крови у пациентов исследуемых групп (Ме [Q25-Q75].
Примечание: ИЛ — интерлейкин, Ме — медиана, Q25-Q75 — интерквартильный размах, N — референсные значения.
Обсуждение
В настоящее время количество пациентов онкогематологического профиля неуклонно возрастает, а ЛПЗ являются основной нозологической группой, встречающейся в ежедневной практике врачей-гематологов, оказывающих медицинскую помощь взрослому населению. Появление большого количества высокоэффективных химиотерапевтических препаратов позволяет достичь ремиссии опухолевого процесса и сохранить длительный безрецидивный/беспрогрессивный период. При этом большое количество пациентов зачастую госпитализируются в связи с развитием и/или декомпенсацией сердечно-сосудистой патологии, основной причиной манифестации/прогрессирования которой является КВТ воздействие противоопухолевых препаратов [15]. Учитывая, что лимфомы представляют собой гетерогенную группу нозологий и встречаются у пациентов различных возрастных категорий, на современном этапе основной задачей врачей кардиоонкологов является назначение полноценной кардиальной терапии еще до начала специфического лечения онкогематологического заболевания. Характер и объем назначаемой терапии целесообразно определять с учетом основных патогенетических механизмов ЛПЗ, имеющих воздействие на систему кровообращения.
В настоящее исследование были включены 2 группы пациентов, соответствующие по полу, возрасту, состоянию ССС, основным отличием которых явилось наличие в основной группе ЛПЗ. Отсутствие значимых различий в объеме и характере применяемых групп лекарственных средств на момент исследования позволили исключить влияние используемой кардиальной терапии на полученные результаты, а также обосновать установленные межгрупповые различия, как непосредственную взаимосвязь с наличием ЛПЗ и их патогенетическими особенностями.
Результаты исследования продемонстрировали, что несмотря на сопоставимый объем гиполипидемической терапии в обеих группах и обозначенные как референсные показатели липидного обмена, пациенты с лимфопролиферацией имеют несколько более высокие значения проатерогенных липидов, чем соответствующие им по возрастно-половому составу пациенты без онкопатологии в анамнезе. Предположительно данную особенность можно объяснить избыточным накоплением ХС в вакуолях атипичных лимфоцитов (клеток, принадлежащих опухолевому клону), что индуцирует их апоптоз с последующим высвобождением ХС в кровоток [16]. Этот факт также подтверждается внутригрупповым распределением уровня ТГ в зависимости от количества баллов при оценке Международных прогностических индексов у пациентов с ЛПЗ. В пользу предположения о взаимосвязи исходных результатов липидограммы и наличия ЛПЗ можно представить результаты работы Будановой Д. А. (2021г), в которой показано статистически значимое повышение уровня общего ХС и ХС ЛНП (p<0,01) на фоне одного курса ХТ у "наивных" пациентов с индолентными лимфомами [17] без контроля уровня ХС с помощью гиполипидемической терапии.
В свете современных научных данных, развитие атеросклеротического процессов тесно сопряжено с хроническим малоинтенсивным системным воспалением, что продемонстрировано и доказано в ряде больших клинических исследований. Однако, с учетом того, что активный воспалительный ответ является одним из основных в патогенезе онкогематологических заболеваний, интересным представилось проведение исследования взаимосвязи маркеров острого воспаления и показателей липидного профиля. В исследуемой нами группе, пациенты с ЛПЗ имели статистически более высокие значения СРБ, ферритина, фибриногена и СОЭ, чем пациенты соответствующего пола и возраста с доказанными ССЗ, но без онкогематологического заболевания. Однако поиск взаимосвязей маркеров системного воспаления и липидного профиля в основной группе наличия корреляций не продемонстрировал.
Подобные результаты можно объяснить тем, что от момента инициации опухолевого процесса до факта установки онкологического диагноза, как правило, проходит непродолжительный период времени и воздействие резко возрастающих показателей системного воспалительного ответа не успевает оказать влияние на метаболизм липидов. Полученные данные также могут рассматриваться в качестве подтверждения вышеописанной гипотезы о повышении содержания ХС в составе проатерогенных липопротеинов за счет его высвобождения из подвергающихся апоптозу патологических лимфоцитов.
Еще одним немаловажным результатом проведенного исследования явилась демонстрация статистически значимых различий уровня галектина-3 у пациентов с онкогематологическим заболеванием и лиц без злокачественного новообразования в анамнезе. На современном этапе определено 16 типов галектинов, однако, несмотря на продолжительный период изучения этих молекулярных структур, точная функция их до сих пор не установлена [18]. В кардиологии наиболее изучен галектин-3, который является одним из маркеров фиброза и ремоделирования миокарда. Так, в исследовании Медведевой Е. А. и др. показано, что повышение уровня галектина-3 >21 нг/мл ассоциировано с высоким риском смерти у пациентов с ХСН [19]. В других исследованиях, посвященных оценке влияния галектина-3 на морфофункциональное состояние миокарда ЛЖ у пациентов с АГ, показано наличие прямых корреляционных связей уровня биомаркера с массой миокарда ЛЖ (p<0,001). В современной научной литературе представлено ограниченное количество исследований, демонстрирующих важность биомаркера фиброза, как одного из преддикторов плохого прогноза у пациентов с онкогематологическими заболеваниями. Результаты исследования Gao N, et al. (2016), посвященного изучению уровня галектина-3 в сыворотке крови у пациентов с острыми миелобластными лейкозами, показали, что данный биомаркер являлся независимым фактором неблагоприятного прогноза и был ассоциирован с худшими показателями общей выживаемости (p<0,01) [20].
В работе Samura B (n=82, неходжкинские лимфомы, полная/частичная ремиссии, наблюдение 12 мес.) показано, что пациенты, у которых за период наблюдения развились сердечно-сосудистого события (сердечно-сосудистая смерть, нарушения ритма/проводимости сердца, острый коронарный синдром, развитие/декомпенсация ХСН), исходно имели статистически более высокие уровни галектина-3 (p<0,05) [21].
Основным клиническим исследованием, подчеркивающим важность провоспалительных цитокинов, в т.ч. ИЛ-6, в развитии ССЗ, является исследование CANTOS (Canakinumab Antiinflammatory Thrombosis Outcome Study): снижение риска сердечно-сосудистых событий при введении моноклонального антитела канакинумаба (ингибитора ИЛ-1β). Одним из основных предикторов развития сердечно-сосудистых катастроф у пациентов, включенных в исследование, оказалась высокая концентрация ИЛ-6 [22]. Еще большее количество работ, направленных на демонстрацию значимости ИЛ-6 в развитии ССЗ, стало появляться в связи с пристальным его изучением у пациентов с COVID-19 (COrona VIrus Disease 2019) [23]. В гематологической практике уровень ИЛ-6 достоверно ассоциируется со степенью выраженности В-симптомов (снижение массы тела, ночная потливость, лихорадка) и является одним из основных предикторов выживаемости при классической лимфоме Ходжкина [24]. В отношении неходжкинских лимфом хорошо известно, что гиперэкспрессия цитокина ассоциированна с неблагоприятным прогнозом и лекарственной резистентностью опухолевых клеток [25]. Следует отметить, что в рамках изучения патогенеза ССЗ накоплено значительное количество данных, демонстрирующих роль ИЛ-6 в развитии атеросклероза. В настоящее время показано, что высокие значения этого провоспалительного цитокина ассоциированны с повышенным уровнем ХС ЛНП, а также синтезом липопротеина(а) гепатоцитами [26], что нашло отражение в результатах проведенного исследования в отношении пациентов группы сравнения. Однако с точки зрения КО, ассоциация ИЛ-6 с КВТ осложнениями практически не изучена, даже в отношении препаратов, КВТ-эффекты которых хорошо изучены.
Выявленная в ходе исследования достоверная взаимосвязь уровней галектина-3 и ИЛ-6 у пациентов основной группы подчеркивает обусловленность исходных значений маркеров непосредственной активностью ЛПЗ. Ранее было упомянуто, что ИЛ-6 ассоциирован с неблагоприятным прогнозом, тогда как гиперэкспрессия гена галектина-3 и высокая концентрация галектина-3 в сыворотке крови у пациентов с гемобластозами является причиной неэффективности препаратов-индукторов апоптоза (ингибиторы BCL-2) [27], что может служить доказательством исходной активности опухолевого процесса. В то же время, выявленный в настоящем исследовании достоверно низкий уровень галектина-3 у пациентов с высоким КО риском, вероятнее всего, связан с более интенсивной кардиальной терапией.
Несмотря на ограничения исследования (малая выборка пациентов с ЛПЗ, отсутствие оценки взаимосвязи биомаркеров с исходными результатами эхокардиографии/speakle-traking и современными рекомендованными маркерами кардиотоксичности, отсутствие определения динамики показателей на фоне специфической ХТ) результаты проведенного исследования демонстрируют, что определение уровней галектина-3 и ИЛ-6 у пациентов с ЛПЗ является высокоперспектиным и требуют дальнейшего пристального изучения в проспективных исследованиях.
Заключение
Пациенты онкогематологического профиля являются одними из самых сложных в практике кардиологов/кардиоонкологов. Рациональная превентивная кардиальная терапия — основной краеугольный камень в тактике ведения пациентов с ЛПЗ. Таким образом, полученное в настоящем исследовании статистически значимое различие показателей галектина-3 у пациентов с ЛПЗ в сравнении с пациентами без онкологического заболевания при сопоставимой кардиальной терапии, а также наличие различий в значениях сывороточного биомаркера в зависимости от международных прогностических индексов лимфом открывает перспективы для проведения исследований, направленых на оценку взаимосвязи данного биомаркера с морфофункциональными параметрами миокарда, на определение изменений его концентрации на фоне противоопухолевой терапии.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1 Поддубная И. В., Савченко В. Г. и др. Российские клинические рекомендации по диагностике и лечению лимфопролиферативных заболеваний. Российская медицинская академия непрерывного профессионального образования МЗ РФ, 2018. 356 с. ISBN 978-5-4465-1990-3.
Список литературы
1. Zamorano JL, Lancellotti P, Rodriguez Munoz D, et al. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC). Eur Heart J. 2016;37:2768-801. doi:10.1093/eurheartj/ehw211.
2. Lyon AR, López-Fernández T, Couch LS, et al. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). Eur Heart J. 2022;43(41):4229-361. doi:10.1093/eurheartj/ehac244.
3. Фомина Е.В., Карданова С.А., Бочкарникова О.В. и др. Изучение активности системного воспаления и структурнофункционального состояния миокарда, их взаимосвязь у пациентов с множественной миеломой на фоне бортезомибсодержащей противоопухолевой терапии. Кардиология. 2023; 63(10):29-38. doi:10.18087/cardio.2023.10.n2489.
4. Thandra KC, Barsouk A, Saginala K, et al. Epidemiology of Non-Hodgkin's Lymphoma. Med Sci (Basel). 2021;30;9(1):5. doi:10.3390/medsci9010005.
5. Kong CY, Guo Z, Song P, et al. Underlying the Mechanisms of Doxorubicin-Induced Acute Cardiotoxicity: Oxidative Stress and Cell Death. Int J Biol Sci. 2022;18(2):760-70. doi:10.7150/ijbs.65258.
6. Juul MB, Jelicic J, Anru PL, et al. Cardiovascular diseases in elderly survivors of diffuse large B-cell lymphoma: a Danish populationbased cohort study. Leuk Lymphoma. 2022;63(9):2074-83. doi:10.1080/10428194.2022.2064982.
7. Ambrosio MR, Piccaluga PP, Ponzoni M, et al. The alteration of lipid metabolism in Burkitt lymphoma identifies a novel marker: adipophilin. PLoS One. 2012;7(8):e44315. doi:10.1371/journal.pone.0044315.
8. Васюк Ю.А., Гендлин Г.Е., Емелина Е.И. и др. Согласованное мнение российских экспертов по профилактике, диагностике и лечению сердечно-сосудистой токсичности противоопухолевой терапии. Россий¬ский кардиологический журнал. 2021;26(9):4703. doi:10.15829/1560-4071-2021-4703.
9. Ghamri RA, Alghalayini KW, Baig M, et al. Correlation of Cardiovascular Risk Parameters with Serum IL.6 and C-RP in Myocardial Infarction. Niger J Clin Pract. 2022;25(3):299-303. doi:10.4103/njcp.njcp_1504_21.
10. Lee DH, Chandrasekhar S, Jain MD, et al. Cardiac and inflammatory biomarker differences in adverse cardiac events after chimeric antigen receptor T-Cell therapy: an exploratory study. Cardiooncology. 2023;9(1):18. doi:10.1186/s40959-023-00170-5.
11. Borowiec A, Ozdowska P, Rosinska M, et al. Prognostic value of coronary atherosclerosis and CAC score for the risk of chemotherapy-related cardiac dysfunction (CTRCD): The protocol of ANTEC study. PLoS One. 2023;18(8):e0288146. doi:10.1371/journal.pone.0288146.
12. Meijers WC, López-Andrés N, de Boer RA. Galectin-3, Cardiac Function, and Fibrosis. Am J Pathol. 2016;186(8):2232-4. doi:10.1016/j.ajpath.2016.05.002.
13. Seropian IM, Fontana Estevez FS, Villaverde A, et al. Galectin-3 contributes to acute cardiac dysfunction and toxicity by increasing oxidative stress and fibrosis in doxorubicin-treated mice. Int J Cardiol. 2023;15:393:131386. doi:10.1016/j.ijcard.2023.131386.
14. Dean M, Kim MJ, Dimauro S, et al. Cardiac and noncardiac biomarkers in patients undergoing anthracycline chemotherapy — a prospective analysis. Cardiooncology. 2023;9(1):23. doi:10.1186/s40959-023-00174-1.
15. Bryne A, Lambert J, Yellon D, et al. Cardio-oncology Issues in Lymphoma Patients. Isr Med Assoc J. 2022;24(3):159-64.
16. Yano H, Fujiwara Y, Komohara Y.Cholesterol metabolism and lipid droplet vacuoles; a potential target for the therapy of aggressive lymphoma. J Clin Exp Hematop. 2022;62(4):190-4. doi:10.3960/jslrt.22023.
17. Ogilvie GK, Ford RB, Vail DM, et al. Alterations in lipoprotein profiles in dogs with lymphoma. J Vet Intern Med. 1994;8(1):62-6. doi:10.1111/j.1939-1676.1994.tb03198.x.
18. Dong R, Zhang M, Hu Q, et al. Galectin-3 as a novel biomarker for disease diagnosis and a target for therapy (Review). Int J Mol Med. 2018;41(2):599-614. doi:10.3892/ijmm.2017.3311.
19. Medvedeva EA, Berezin II, Surkova EA, et al. Galectin-3 in patients with chronic heart failure: association with oxidative stress, inflammation, renal dysfunction and prognosis. Minerva Cardioangiol. 2016;64(6):595-602.
20. Gao N, Yu WZ, Guo NJ, et al. Clinical significance of galectin-3 in patients with adult acute myeloid leukemia: a retrospective cohort study with long-term follow-up and formulation of risk scoring system. Leuk Lymphoma. 2017;58(6):1394-402. doi:10.1080/10428194.2016.1243677.
21. Samura B.Galectin-3 as a prognostic biomarker in patients with non-hodgkin lymphoma. Georgian Med News. 2015;(248):7-11.
22. Nicholls M. CANTOS: One year on: When the findings of the CANTOS trial were unveiled at ESC Congress 2017 in Barcelona, there was a sense of hope that a new era in preventive cardiology was set to begin. One year on, CANTOS Principle Investigator and study author Paul M.Ridker discusses whether that optimism is being realized. Eur Heart J. 2018;39(45):3989-90. doi:10.1093/eurheartj/ehy702.
23. Cupido AJ, Asselbergs FW, Natarajan P, et al. Dissecting the IL-6 pathway in cardiometabolic disease: A Mendelian randomization study on both IL6 and IL6R. Br J Clin Pharmacol. 2022;88(6):2875- 84. doi:10.1111/bcp.15191.
24. Marri PR, Hodge LS, Maurer MJ, et al. Prognostic significance of pretreatment serum cytokines in classical Hodgkin lymphoma. Clin Cancer Res. 2013;19:6812-9. doi:10.1158/1078-0432.CCR-13-1879.
25. Bao C, Gu J, Huang X, et al. Cytokine profiles in patients with newly diagnosed diffuse large B-cell lymphoma: IL-6 and IL-10 levels are associated with adverse clinical features and poor outcomes. Cytokine. 2023;169:156289. doi:10.1016/j.cyto.2023.156289.
26. Makris A, Barkas F, Sfikakis PP, et al. Lipoprotein(a), Interleukin-6 inhibitors, and atherosclerotic cardiovascular disease: Is there an association? Atheroscler Plus. 2023. 54:1-6. doi:10.1016/j.athplu.2023.09.001.
27. Harazono Y, Nakajima K, Raz A. Why anti-Bcl-2 clinical trials fail: a solution. Cancer Metastasis Rev. 2014;33(1):285-94. doi:10.1007/s10555-013-9450-8.
Об авторах
И. Я. СоколоваРоссия
Соколова Ирина Яковлевна — врач-гематолог отделения гематологии Университетской клинической больницы № 1
Москва
С. А. Кардовская
Россия
Кардовская Сабина Александровна — аспирант кафедры госпитальной терапии № 1 Института клинической медицины им. Н. В. Склифосовского
Москва
Е. Ю. Салахеева
Россия
Салахеева Екатерина Юрьевна — ассистент кафедры госпитальной терапии № 1 Института клинической медицины им. Н. В. Склифосовского
Москва
Ю. Ю. Кириченко
Россия
Кириченко Юрия Юрьевна — к.м.н., ассистент кафедры госпитальной терапии № 1 Института клинической медицины им. Н. В. Склифосовского
Москва
Е. А. Сидерко
Россия
Сидерко Екатерина Александровна — студент 6 курса Института клинической медицины им. Н. В. Склифосовского
Москва
О. В. Бочкарникова
Россия
Бочкарникова Ольга Валентиновна — врач-гематолог, зав. отделением гематологии Университетской клинической больницы № 1
Москва
А. А. Щендрыгина
Россия
Щендрыгина Анастасия Александровна — к.м.н, доцент кафедры госпитальной терапии № 2 Института клинической медицины им. Н. В. Склифосовского
Москва
Ю. Н. Беленков
Россия
Беленков Юрий Никитич — д.м.н., профессор, академик РАН, зав. кафедрой госпитальной терапии № 1 Института клинической медицины им. Н. В. Склифосовского, директор Клиники госпитальной терапии им. А. А. Остроумова Университетской клинической больницы № 1
Москва
И. С. Ильгисонис
Россия
Ильгисонис Ирина Сергеевна — к.м.н., профессор кафедры госпитальной терапии № 1 Института клинической медицины им. Н. В. Склифосовского
Москва
Дополнительные файлы
Что известно о предмете исследования?
- Использование антрациклиновых антибиотиков для лечения злокачественных новообразований, в т.ч. онкогематологических заболеваний, зачастую является причиной развития кардиоонкологических осложнений, приводящих к летальному исходу как во время химиотерапии, так и в отдаленный период.
- В современных многоцентровых исследованиях показаны более высокие концентрации биомаркеров галектина-3 и интерлейкина (ИЛ)-6 у пациентов с доказанными кардиальными нозологиями, демонстрируя роль процессов ремоделирования и системного воспаления в развитии патологии сердечно-сосудистой системы.
Что добавляют результаты исследования?
- У пациентов с доказанными лимфомами до начала химиотерапии уровни галектина-3 и ИЛ-6 значимо выше, чем у пациентов со схожим сердечно-сосудистым статусом без онкопатологии в анамнезе.
- У пациентов с лимфопролиферативным заболеванием оценить роль галектина-3 и ИЛ-6 в развитии сердечно-сосудистых заболеваний затруднительно, ввиду патогенетических особенностей онкозаболевания.
Рецензия
Для цитирования:
Соколова И.Я., Кардовская С.А., Салахеева Е.Ю., Кириченко Ю.Ю., Сидерко Е.А., Бочкарникова О.В., Щендрыгина А.А., Беленков Ю.Н., Ильгисонис И.С. Изучение провоспалительных маркеров, уровня галектина-3, параметров липидного обмена, сердечно-сосудистого статуса и их взаимосвязей у пациентов с лимфомами до начала противоопухолевой терапии. Кардиоваскулярная терапия и профилактика. 2025;24(1):3944. https://doi.org/10.15829/1728-8800-2025. EDN: SIHVAK
For citation:
Sokolova I.Ya., Kardovskaya S.A., Salakheeva E.Yu., Kirichenko Yu.Yu., Siderko E.A., Bochkarnikova O.V., Shchendrygina A.A., Belenkov Yu.N., Ilgisonis I.S. Study of proinflammatory markers, galectin-3 level, lipid metabolism parameters, cardiovascular status and their relationship in patients with lymphomas before antitumor therapy. Cardiovascular Therapy and Prevention. 2025;24(1):3944. (In Russ.) https://doi.org/10.15829/1728-8800-2025. EDN: SIHVAK
JATS XML

























































