Перейти к:
Кардиальные проявления при миотонической дистрофии 1 типа
https://doi.org/10.15829/1728-8800-2024-3999
Аннотация
Цель. Охарактеризовать поражение сердца при миотонической дистрофии 1 типа (МД1), наиболее распространенной форме наследственной первично-мышечной патологии у взрослых.
Материал и методы. 48 пациентам с МД1 (31 мужчина, 17 женщин, средний возраст 39,2±9,3 лет) проведены клинический осмотр, нейропсихологическое обследование, оценка липидного профиля, электрокардиография (ЭКГ), холтеровское мониторирование ЭКГ (ХМ-ЭКГ) и эхокардиография (ЭхоКГ). Представлено 4 клинических случая, которые демонстрируют яркие кардиологические проявления МД1.
Результаты. Пациенты не предъявляли жалоб на нарушения ритма, боли в области грудной клетки, у 7 (14,6%) были жалобы на одышку при физической нагрузке. Те или иные формы нарушения сердечной проводимости встречались у 18 (37,5%) пациентов, которые были представлены атриовентрикулярной (АВ)-блокадой, нарушениями проведения по ветвям и ножкам пучков Гиса, внутрижелудочковой проводимости. По данных ХМ-ЭКГ частота сердечных сокращений<60 уд./мин регистрировалось у 46 (95,8%) пациентов, из них у 2 (4,2%) <30 уд./мин. У одного (2,1%) пациента выявлен ритм фибрилляций предсердий. По данным ЭхоКГ увеличение желудочков выявлено у 3 (6,3%) пациентов, предсердий — у 8 (16,7%). Ни у одного из пациентов фракция выброса не была <50%.
Заключение. Поражение сердца является частым проявлением МД1. Полученные знания из полноценного кардиологического обследования могут помочь не только улучшить качество жизни пациентов, но и избежать возможных побочных эффектов назначаемого лечения.
Ключевые слова
Для цитирования:
Клементьева А.Г., Ерохина Е.К., Шамтиева К.В., Мельник Е.А., Хробостова А.Н., Филипенко М.Б., Аракелянц А.А., Петерс Т.В., Павликова Е.П. Кардиальные проявления при миотонической дистрофии 1 типа. Кардиоваскулярная терапия и профилактика. 2024;23(8):3999. https://doi.org/10.15829/1728-8800-2024-3999
For citation:
Klementieva A.G., Erokhina E.K., Shamtieva K.V., Melnik E.A., Khrobostova A.N., Filipenko M.B., Arakelyants A.A., Peters T.V., Pavlikova E.P. Cardiac manifestations in myotonic dystrophy type 1. Cardiovascular Therapy and Prevention. 2024;23(8):3999. (In Russ.) https://doi.org/10.15829/1728-8800-2024-3999
Введение
Миотоническая дистрофия 1 типа (МД1) является наследственным заболеванием с аутосомно-доминантным типом наследования, причиной которого является экспансия тринуклеотидных повторов (CTG) в гене DMPK, кодирующем миотонин протеинкиназу. Помимо классических мышечных симптомов у пациентов с МД1 развивается поражение многих органов и систем: центральной и периферической нервной системы, кожи, дыхательной, эндокринной и сердечно-сосудистой систем (ССС) [1]. Заболеваемость МД1 оценивается как 1 случай/8 тыс. новорожденных, а его распространенность во всем мире колеблется от 5 до 20 случаев/100 тыс. жителей, что делает его одним из самых часто встречающихся наследственных нервно-мышечных заболеваний [2]. В настоящее время патогенетической терапии не разработано.
Поражение сердца, нередко предшествующее развитию мышечной слабости, встречается у 80% пациентов с МД1 и является второй по частоте причиной смерти после респираторных нарушений [3]. МД1 может дебютировать с кардиальных проявлений, еще до развития миотонии и мышечной слабости [4]. Проявления со стороны ССС могут возникать у молодых людей и даже детей [5].
Поражение сердца у пациентов с МД1 протекает как дегенеративный процесс с прогрессирующим фиброзом и жировым замещением соединительной ткани, который в первую очередь затрагивает специализированную проводящую систему, а также первоначально непораженные участки миокарда предсердий и желудочков [6]. Нарушения проводящей системы прогрессируют и, хотя изначально могут быть бессимптомными, риск симптоматических аритмий крайне высок [7].
Кардиальные симптомы при МД1 можно разделить на три группы: нарушения сердечной проводимости, тахиаритмии и ишемические проявления [3]. Нарушения проводимости встречаются у ~40% пациентов и могут затронуть любую часть проводящей системы, однако чаще всего это пучок Гиса и волокна Пуркинье [3][8]. Дефекты проводимости обычно выявляются на стандартной электрокардиограмме (ЭКГ) в виде удлинения интервалов PQ, QRS, в т.ч. и у бессимптомных пациентов [3][8]. Среди наджелудочковых тахиаритмий наиболее распространены трепетание или фибрилляция предсердий, которые выявляются в 25% случаев [9]. Диагностика желудочковых аритмий, таких как желудочковая тахикардия и фибрилляция желудочков, крайне важна, т.к. профилактическая имплантация кардиовертера-дефибриллятора пациентам с подобными нарушениями может снизить риск летального исхода [10]. Другие кардиальные проявления включают ишемическую болезнь сердца в виде нестабильной и стабильной стенокардии, инфаркта миокарда в молодом возрасте [3].
Осведомленность кардиологов о том, что данные проявления могут быть частью системного заболевания, способствует своевременной постановке диагноза у данной группы пациентов. В то же время всем пациентам с установленной МД1 необходимо проводить тщательное обследование в динамике для выявления рисков серьезных сердечно-сосудистых событий.
В статье описаны общие закономерности выявляемых изменений при исследовании ССС у данной группы больных и серия клинических случаев пациентов с МД1 с кардиальной патологией. Изложены подходы к обследованию и ведению пациентов с МД1, имеющих различные варианты кардиальных проявлений данной патологии.
Материал и методы
В исследование, проводимое на базе неврологического отделения МНОЦ МГУ им. М. В. Ломоносова, было включено 48 пациентов с МД1 ≥18 лет. Критерием включения было генетическое подтверждение диагноза.
Всем пациентам проведен клинический осмотр, оценка выраженности мышечной слабости с помощью специализированной шкалы оценки мышечных нарушений (Muscular Impairment Rating Scale — MIRS), где 1 — нет мышечной слабости, а 5 — выраженная дистальная и проксимальная слабость в конечностях, нарушения ходьбы.
Все пациенты оценены на наличие когнитивных нарушений с помощью Адденбрукской шкалы III (Addenbrooke’s cognitive examination III — ACE-III), Монреальской шкалы оценки когнитивных функций (Montreal Cognitive Assessmen — МоСА). Эмоциональный статус пациентов оценивался с помощью шкалы депрессии Гамильтона, шкалы тревоги Бека и шкалы апатии.
Для всех пациентов определен индекс массы тела (ИМТ); в соответствии с классификацией ожирения по ИМТ (ВОЗ, 1997г): 18,5-24,9 кг/м2 — нормальная масса тела; 25,0-29,9 кг/м2 — избыточная масса тела; 30,0-34,9 кг/м2 — ожирение I ст.; 35,0-39,9 кг/м2 — ожирение II ст.; ≥40 кг/м2 — ожирение III ст.1
Всем пациентам проведена лабораторная диагностика (оценены липидограмма и уровень гликированного гемоглобина) и исследование ССС, включающее ЭКГ, холтеровское мониторирование ЭКГ (ХМ-ЭКГ) и эхокардиографию (ЭхоКГ), с использованием оборудования, закупленного в рамках программы развития МНОЦ МГУ им. М. В. Ломоносова (рег. № НИОКТР 123032800008-7).
Статистический анализ проводился с помощью программного обеспечения SPSS Statistics 26.0 (IBM). Основной описательной статистикой для категориальных переменных были частота и процентная доля, для количественных переменных — медиана (Me) и интерквартильный размах (Q25-Q75). Для оценки взаимосвязи показателей использовался корреляционный анализ Спирмена. Нулевую гипотезу отвергали при p<0,05.
Результаты обследования пациентов с МД1
Обследовано 48 пациентов с генетически подтвержденным диагнозом МД1.
У пациентов не было жалоб на нарушения ритма, эпизоды потери сознания, боли в области грудной клетки. Только 7 (14,6%) пациентов предъявляли жалобы на одышку при физической нагрузке, которая не всегда была объяснима степенью выраженности мышечной слабости.
Всем пациентам выполнено обследование ССС в объеме ЭКГ, ХМ-ЭКГ и ЭхоКГ, оценка липидного профиля — уровни холестерина (ХС) общего и ХС липопротеинов низкой и высокой плотности (ЛНП и ЛВП, соответственно), триглицеридов. Все данные, полученные в результате сбора анамнеза, физикального обследования и инструментальных методов обследования, суммированы в таблицах 1-4.
Из сосудистых факторов риска наиболее часто встречалось повышение массы тела — у 23 (47,9%) пациентов, из них ожирение I ст. (ИМТ 30,0-34,9 кг/м2) — у 8 (16,7%)1. Сахарный диабет (СД) 2 типа был выявлен у 6 (12,5%) пациентов. Артериальная гипертензия (АГ) 1 ст. отмечалась у 5 (10,4%) пациентов. Курили 9 (18,75%) пациентов. Ни у одного из пациентов не было определено гемодинамически значимых атеросклеротических стенозов брахиоцефальных артерий.
Те или иные формы нарушения сердечной проводимости встречались у 18 (37,5%) пациентов уже при проведении стандартной ЭКГ, которые были представлены атриовентрикулярной (АВ)-блокадой 1 ст., нарушениями проведения по ветвям и ножкам пучка Гиса, нарушениями внутрижелудочковой проводимости. При анализе сердечных интервалов: PQ превышал 20 мсек у 12 (25%) пациентов, но в целом составлял не >24 мсек, QRS превышал 9 мсек у 27 (56,3%) пациентов, но в целом составлял не >18 мсек, QTс не превышал >500 мсек ни у одного из пациентов.
Длительность интервала PQ была связана с возрастом (R=0,465, p=0,001), уровнем общего ХС (R=0,327, p=0,026) и гликированного гемоглобина (R=0,339, p=0,034).
По данным ХМ-ЭКГ у 2 (4,2%) помимо АВ-блокады 1 ст. были зафиксированы эпизоды АВ-блокады 2 ст. Мобитц 1, а также у 1 (2,1%) пациента была выявлена синоаурикулярная блокада 2 ст. Частота сердечных сокращений (ЧСС) <60 уд./мин регистрировалось у 46 (95,8%) пациентов, <50 уд./мин у 37 (77,1%), <40 уд./мин у 13 (27,1%), <30 уд./мин у 2 (4,2%) (клинические случаи 1 и 2). Среднесуточная ЧСС была >80 уд./мин у 4 (8,3%) пациентов, но в подавляющем числе случаев не превышала 90 уд./мин. Среднесуточная ЧСС не показала взаимосвязи с сосудистыми факторами риска.
Только у 1 (2,1%) пациента был выявлен ритм трепетания предсердий правильной формы с частотой проведения 4:1
Количество наджелудочковых и желудочковых экстрасистолий не превышало 2000 за исключением одного пациента (клинический случай 2). Паузы >2000 мсек были зарегистрированы у 7 (14,6%) пациентов и были единичными за исключением трех пациентов (клинические случаи 1, 2, 3).
По данным ЭхоКГ увеличение конечно-диастолических размера и объема (КДР и КДО) левого желудочка (ЛЖ) так же, как и размера правого желудочка (ПЖ), было выявлено только у описанных пациентов в клинических случаях 1, 2, 3), в то время как увеличение предсердий встречалось чаще. Снижение фракции выброса (ФВ) не наблюдалось.
Объем левого предсердия (ЛП) был увеличен у 8 (16,7%) пациентов, из которых у двух составил 90 мл (клинический случай 1) и 109 мл (клинический случай 3). Размер ЛП был положительно связан с возрастом (R=0,325, p=0,027) и индексом массы тела (ИМТ) (R=0,654, p<0,001). Площадь правого предсердия (ПП) была незначимо увеличена только у 4 (8,3%) пациентов и также имела взаимосвязь с возрастом (R=0,308, p=0,042) и ИМТ (R=0,519, p<0,001).
Далее представлены наиболее показательные клинические случаи, которые демонстрируют яркие кардиологические проявления МД1, а также обозначают трудности, с которыми встречаются врачи при ведении таких пациентов.
Клинический случай 1
Информация о пациенте. Пациент Ц., 42 года, во время планового обследования в условиях неврологического отделения с основным диагнозом МД1, взрослая форма, с дебютом заболевания в 36 лет, был направлен на кардиологическое обследование. Пациент не отмечал жалоб со стороны ССС, в т.ч. перебоев в работе сердца, синкопе, ортопноэ.
Наследственный анамнез по заболеваниям ССС не был отягощен.
Результаты физикального осмотра. Рост: 180 см, вес: 95 кг, ИМТ: 29,3 кг/м2 (избыточная масса тела). СД, АГ, курение отрицал.
При проведении неврологического осмотра — 4 балла по MIRS, что соответствовало наличию дистальной и проксимальной слабости, функция ходьбы была нарушена.
Нейропсихологическое тестирование выявило снижение когнитивных функций (25 баллов по MoCA при N>26, 82 балла по ACE-III, где N<88 с чувствительностью 94%, специфичностью 89% свидетельствует о деменции [11]), а также апатию (33 балла по шкале апатии, N<30 [12], при этом клинически значимых депрессии и тревоги выявлено не было. Пациент получил высшее образование, самостоятельно себя обслуживал, на момент обследования не работал.
Диагностическая оценка. Показатели липидограммы (уровни ХС общего, ХС ЛНП, ХС ЛВП, триглицеридов) были в пределах нормы [13].
По данным ЭКГ: увеличение продолжительности комплекса QRS до 16 мсек (N<9), ритм трепетания предсердий правильной формы с частотой проведения 4:1, ЧСС 47 уд./мин, блокада правой ножки и передней ветви левой ножки пучка Гиса. По данным ХМ-ЭКГ в течение исследования регистрировалось трепетание предсердий правильной и неправильной формы. Средняя ЧСС за сут. составила 34 уд./мин, минимальная ЧСС — 14 уд./мин, максимальная ЧСС — 63 уд./мин, нарушение проводимости в течение всего исследования по типу синдрома Фредерика: полная поперечная блокада сердца и длительно персистирующая форма типичного трепетания предсердий (рисунок 1 А). Пауз >3000 мс зарегистрировано 468, из них >4000 мс — 36.
По данным ЭхоКГ незначительное расширение полости ЛЖ: конечно-систолический размер — 5,7 см (N<5,5), конечно-систолический объем (КСО) — 64 мл (N<32), КДО — 161 мл (N<128), ФВ — 59%. Увеличение размера ПЖ до 3,2 см (N<3); объема ЛП до 90 мл (N<60); площади ПП до 20 см2 (N<18).
Заключение. На основании выявленных изменений кардиологом рекомендовано проведение экстренной имплантации электрокардиостимулятора, однако пациент категорически отказался от проведения хирургического лечения, вероятно, вследствие имеющихся когнитивных нарушений и особенностей нейропсихологического профиля.
Помимо явной диссоциации между клинической картиной и данными инструментальной диагностики данный клинический случай демонстрирует влияние нейропсихологических нарушений пациентов с МД1 на принятие ими решений в отношении важных вопросов собственного здоровья и жизни.
Клинический случай 2
Информация о пациенте. Пациент Е., 38 лет, в рамках госпитализации в неврологическом отделении с диагнозом МД1, взрослая форма, с дебютом заболевания в 29 лет, планово проходил кардиологическое обследование. Пациент не отмечал жалоб со стороны ССС, в т.ч. ограничений физической активности за счёт одышки или дискомфортных ощущений в груди. Перебои в работе сердца, синкопе, ортопноэ и отеки голеней отрицал.
Наследственный анамнез: мать умерла в возрасте 54 лет вследствие внезапной сердечной смерти.
Результаты физикального осмотра. Рост: 180 см, вес: 100 кг, ИМТ: 30,9 кг/м2 (ожирение I ст.). СД, АГ, курение отрицал.
При проведении неврологического осмотра — 3 балла по MIRS, что соответствовало наличию дистальной мышечной слабости.
По результатам нейропсихологического тестирования когнитивный статус не был изменен, а среди эмоциональных нарушений отмечалась только тревожность (28 баллов по шкале тревоги Бека при N<21), не наблюдалось депрессии и апатии. Пациент получил высшее образование, на момент обследования работал.
Диагностическая оценка. В липидограмме были обнаружено повышение уровня общего ХС до 5,3 ммоль/л.
Пациенту было выполнено стандартное инструментальное исследование ССС. По данным ЭКГ: увеличение интервалов PQ до 23 мсек (N<20) — АВ-блокада 1 ст., QRS до 18 мсек (N<9), ЧСС 46 уд./мин, блокада правой ножки и передней ветви левой ножки пучка Гиса. По данным ХМ-ЭКГ: синусовый ритм, средняя ЧСС составила за сут. 44 уд./мин, минимальная ЧСС — 27 уд./мин, максимальная ЧСС — 67 уд./мин, выявлено 2965 одиночных наджелудочковых экстрасистол, 7 выскальзывающих желудочковых комплексов, регистрировались паузы >2000 мс на фоне нарушения АВ-проводимости в количестве 2777. АВ-блокада I ст. в течение всего исследования, AB-блокада II ст. Мобитц I преимущественно в вечернее и ночное время, отмечались периоды 2:1 (рисунок 1 Б).
По данным ЭхоКГ было выявлено незначительное расширение полости ЛЖ: КДО — 140 мл (N<128), КСО — 55 мл (N<32), ФВ — 61%. Объем ЛП составил 64 мл (N<40), в остальном без значимых особенностей.
Заключение. Данный клинический случай демонстрирует наличие выраженных нарушений сердечной проводимости и ритма сердца, требующих хирургического лечения, у пациента без каких-либо жалоб со стороны ССС. Пациенту проведено инвазивное электрофизиологическое исследование и установлен 2-камерный электрокардиостимулятор, что в соответствии с рекомендациями по брадиаритмиям Российского кардиологического общества и Европейского общества кардиологов имеет уровень доказательности IB [14][15].
Клинический случай 3
Информация о пациенте. Пациент Р., 48 лет, с МД1, взрослая форма, с дебютом заболевания в 20 лет, при плановом обследовании отмечал наличие одышки при минимальной физической нагрузке, несистемное головокружение. Наследственный анамнез по заболеваниям ССС был отягощен: у отца пациента была неуточненная патология сердца.
Результаты физикального осмотра. Рост: 175 см, вес: 100 кг, ИМТ: 33 кг/м2 (ожирение I ст.). Курильщик, установлен диагноз СД 2 типа. Артериальное давление (АД) было в пределах нормы.
При проведении неврологического осмотра — 5 баллов по MIRS, что соответствует наличию выраженной дистальной и проксимальной слабости, вследствие чего значимо нарушены ходьба и способность к самообслуживанию.
Наблюдались выраженный когнитивный дефицит (20 баллов по MoCA при N>26, 72 балла по ACE-III, где N<82 с чувствительностью 84%, специфичностью 100% свидетельствует о деменции) и такие эмоциональные нарушения, как депрессия (14 баллов по шкале депрессии Гамильтона, N<7), тревога (22 балла по шкале тревоги Бека, N<10) и апатия (52 балла по шкале апатии, N<30).
Диагностическая оценка. По данным липидограммы обращало на себя внимание снижение уровня ХС ЛВП — 0,45 ммоль/л, при этом уровень общего ХС был 2,9 ммоль/л.
По данным ЭКГ: синусовый ритм, ЧСС 70 уд./мин, диффузное нарушение реполяризации. По данным ХМ-ЭКГ: на фоне синусового ритма брадикардия в ночные часы, средняя ЧСС за сут. составила 49 уд./мин, минимальная ЧСС — 32 уд./мин, максимальная ЧСС — 110 уд./мин, зарегистрировано 84 желудочковых экстрасистол, из них 2 парные. Пауз длительностью >2000 мс зарегистрировано 13, из них 2 постэкстрасистолические.
По данным ЭхоКГ выявлено расширение всех камер сердца. ЛЖ: КДО — 178 мл (N<128), КСО — 84 мл (N<32), ФВ — 53%, толщина межжелудочковой перегородки ЛЖ — 1,5 см (N<1), толщина задней стенки ЛЖ — 1,6 см (N<1), Увеличение размеров ПЖ до 3,7 см (N<3); переднезаднего размера ЛП до 5,1 см (N<4), объема ЛП до 109 мл (N<60); площади ПП до 20 см2 (N<18). Гипертрофия миокарда ЛЖ, кардиомегалия, расширение корня аорты (рисунок 1 В).
Заключение. Особенности нейропсихологического профиля в данном случае вносили негативный вклад в состояние пациента, а также в уровень его комплаентности к лечению.
Клинический случай 4
Информация о пациенте. Пациент К., 23 лет, с МД1, детская форма, на момент поступления в неврологическое отделение жалоб со стороны ССС не отмечал. Из анамнеза известно, что в возрасте 6 лет у пациента было выявлено нарушение сердечной проводимости при отсутствии других проявлений заболевания, в т.ч. миотонии и мышечной слабости. МД1 была диагностирована в возрасте 22 лет, т.о., задержка постановки верного диагноза составила 16 лет. Наследственный анамнез был отягощен по отцовской линии — неуточненное поражение сердца.
Результаты физикального осмотра. ИМТ был в пределах нормы. Курение, СД и АГ отрицал.
При проведении неврологического осмотра — 2 балла по MIRS, что соответствует отсутствию клинически значимой мышечной слабости.
Нейропсихологическое тестирование не выявило снижения когнитивных функций, однако присутствовали депрессия (12 баллов по шкале Гамильтона, N<7) и апатия (36 баллов по шкале апатии, N<30). Самостоятельно себя обслуживал, имел среднее профессиональное образование, не работал.
Диагностическая оценка. Показатели липидограммы были в пределах нормы.
По данным ЭКГ: нарушение внутрижелудочкового проведения по правой ножке пучка Гиса, незначительное увеличение продолжительности комплекса QRS до 10 мсек (N<9), ЧСС 62 уд./мин. По данным ХМ-ЭКГ: регистрировалась постоянная АВ-блокада I ст., однократно АВ-блокада II ст. Мобитц II (рисунок 1 Г). Средняя ЧСС за сут. составила 62 уд./мин, минимальная ЧСС — 39 уд./мин, максимальная ЧСС — 117 уд./мин.
По данным ЭхоКГ значимых структурных изменений не выявлено.
Заключение. Особенностью данного клинического случая является дебют МД1 с кардиальной патологии в детском возрасте при отсутствии каких-либо других проявлений заболевания.
Таблица 1
Сосудистые факторы риска и результаты лабораторных исследований у пациентов с МД1
Показатель | n (%) | Me | Q25 | Q75 | min | max |
Возраст, лет | 36 | 27 | 45 | 18 | 68 | |
Пол, мужчин | 29 (60,4) | |||||
ИМТ, кг/м2 | 23,3 | 20,4 | 27,4 | 15,2 | 35,0 | |
Избыточная масса тела (25,0-29,9 кг/м2) | 15 (31,3) | |||||
Ожирение I ст. (30,0-34,9 кг/м2) | 8 (16,7) | |||||
ХC общий, ммоль/л | 4,74 | 4,02 | 5,21 | 2,70 | 6,70 | |
Гиперхолестеринемия (ХС ≥5,0 ммоль/л) | 17 (35,4) | |||||
HbA1c, % | 5,09 | 4,80 | 5,50 | 4,36 | 8,81 | |
СД 2 типа (у всех HbA1c >6,2%) | 6 (12,5) | |||||
АГ 1 ст. | 5 (10,4) | |||||
Курение | 9 (18,75) |
Примечание: АГ — артериальная гипертензия, ИМТ — индекс массы тела, Ме — медиана, МД1 — миотоническая дистрофия 1 типа, СД — сахарный диабет, HbA1c — гликированный гемоглобин.
Таблица 2
Показатели ЭКГ у пациентов с МД1
Показатель | n (%) | Me | Q25 | Q75 | min | max |
ЧСС, уд./мин | 66 | 60 | 73 | 47 | 106 | |
RR, мсек | 890 | 800 | 980 | 565 | 1260 | |
PQ, мсек | 18 | 16 | 21 | 12 | 24 | |
PQ >20 мсек | 12 (25) | |||||
QRS, мсек | 10 | 9 | 11 | 8 | 18 | |
QRS >9 мсек | 27 (56,3) | |||||
QTc, мсек | 400 | 390 | 412 | 373 | 457 |
Примечание: МД1 — миотоническая дистрофия 1 типа, ЧСС — частота сердечных сокращений, ЭКГ — электрокардиограмма.
Таблица 3
Показатели ХМ-ЭКГ у пациентов с МД1
Показатель | n (%) | Me | Q25 | Q75 | min | max |
Ссреднесуточная ЧСС, уд./мин | 69 | 64 | 75 | 44 | 97 | |
max ЧСС за сут., уд./мин | 123 | 112 | 134 | 67 | 168 | |
min ЧСС за сут., уд./мин | 46 | 40 | 53 | 27 | 68 | |
ЧСС <60/50/40/30 уд./мин | 46 (95,8)/37 (77,1)/13 (27,1)/2 (4,2) | |||||
ЧСС >80 уд./мин | 4 (8,3) | |||||
Число экстрасистолий >2000 | 1 (2,1) | |||||
Паузы >2000 мсек | 7 (14,6) | |||||
Примечание: МД1 — миотоническая дистрофия 1 типа, ЧСС — частота сердечных сокращений, ХМ-ЭКГ — холтеровское мониторирование электрокардиограммы.
Таблица 4
Показатели ЭхоКГ у пациентов с МД1
Количество пациентов (n=48) | n (%) | Me | Q25 | Q75 | min | max |
КДР ЛЖ, см | 4,90 | 4,50 | 5,10 | 4,00 | 6,10 | |
КСР ЛЖ, см | 3,20 | 2,90 | 3,40 | 2,50 | 3,90 | |
КДО ЛЖ, мл | 84,5 | 72,0 | 102,0 | 58,0 | 178,0 | |
КСО ЛЖ, мл | 35,5 | 27,0 | 42,0 | 21,0 | 84,0 | |
ФВ ЛЖ, % | 61,5 | 58,0 | 64,3 | 53,0 | 68,0 | |
Размер ПЖ, см | 2,60 | 2,40 | 2,80 | 1,67 | 3,70 | |
Объем ЛП, мл | 45,0 | 39,0 | 53,0 | 23,7 | 109,0 | |
Объем ЛП >60 мл | 8 (16,7) | |||||
Площадь ПП, см2 | 14,0 | 13,0 | 16,0 | 10,0 | 21,0 | |
Площадь ПП >18 см2 | 4 (8,3) |
Примечание: КДР — конечно-диастолический размер, КДО — конечно-диастолический объем, КСР — конечно-систолический размер, КСО — конечно-систолический объем, ЛЖ — левый желудочек, ЛП — левое предсердие, МД1 — миотоническая дистрофия 1 типа, ПЖ — правый желудочек, ПП — правое предсердие, ФВ — фракция выброса, ЭхоКГ — эхокардиография.
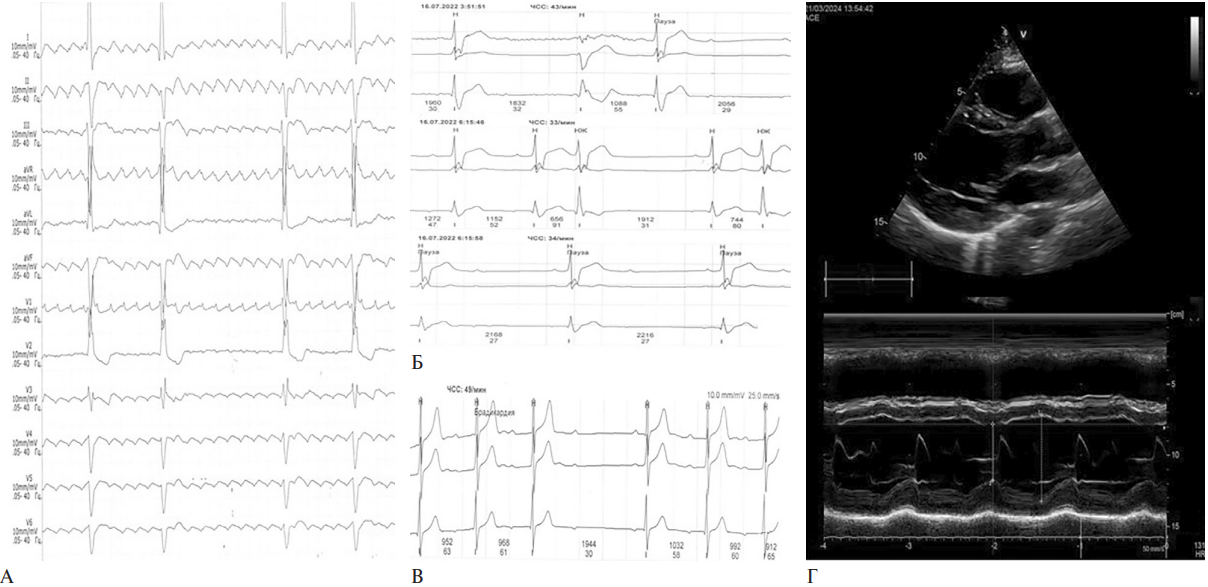
Рис. 1 Демонстрация находок ХМ-ЭКГ и ЭхоКГ у пациентов с МД1: А) синдром Фредерика: полная поперечная блокада сердца и трепетание предсердий; Б) АВ-блокада II ст., 2:1.; В) гипертрофия миокарда ЛЖ, расширение корня аорты; Г) АВ-блокада II ст. Мобитц I.
Примечание: АВ — атриовентрикулярная, ХМ-ЭКГ — холтеровское мониторирование ЭКГ, ЭКГ — электрокардиография.
Обсуждение
Кардиальные проявления у пациентов с МД1 гораздо чаще представлены нарушениями проводимости, в то время как нарушения ритма сердца в представленной выборке были единичными.
Описанные клинические случаи, как и большинство пациентов с МД1 не имели оформленных жалоб ввиду когнитивных нарушений, а также особенностей нейропсихологического профиля, в частности наличия депрессии и апатии, которые могли бы дать врачу возможность заподозрить вовлечение в патологический процесс сердца, что требовало бы проведения обследования ССС.
Важно отметить, что МД1 может дебютировать кардиальными проявлениями еще до развития миотонии и мышечной слабости, в т.ч. у молодых людей, как продемонстрировано в приведенных клинических случаях. Также обязателен тщательный сбор наследственного анамнеза, особенно важно спрашивать пациентов о внезапной сердечной смерти у родственников. Зачастую это может указывает на возможность наличия сердечной патологии у самого пациента.
Стратификация пациентов по уровню сердечно-сосудистого риска должна быть реализована неврологом уже на начальном этапе оценки состояния пациента, чтобы иметь возможность определить уровень сложности кардиологических исследований в соответствии с практическими клиническими путями (таблица 5). Согласно клиническим рекомендациям пациентам с МД1 показаны проведение ЭКГ и осмотр кардиолога 1 раз в год, а при наличии изменений ЭКГ, симптомов со стороны ССС или возраста >40 лет также ХМ-ЭКГ и ЭхоКГ — каждые 3-5 лет [7]. Суточное мониторирование АД и ультразвуковое допплерографическое исследование брахиоцефальных артерий целесообразно проводить пациентам с жалобами на синкопе, а также при выявлении изменений вещества головного мозга сосудистого генеза по данным магнитно-резонансной томографии, которые не укладываются в проявления основного заболевания.
Поскольку знания в отношении применения фармакологической терапии у данной группы пациентов ограничены, целесообразно рассматривать возможность ранней имплантации кардиовертера-дефибриллятора в рамках первичной профилактики внезапной сердечной смерти [6][7][12][16].
В отличие от нарушений ритма сердца, об эпидемиологии дисфункции ЛЖ и сердечной недостаточности (СН) у пациентов с МД1 мало известно [17]. Распространенность симптоматической СН у пациентов с МД1 согласно данным литературы колеблется от 0,1 до 7,1% [7], однако симптомы СН могут быть недооценены из-за ограниченного уровня физической активности данных пациентов. Рекомендовано начинать лечение СН как можно раньше, в частности, ингибиторами ангиотензинпревращающего фермента и антагонистами рецепторов ангиотензина II, которые могут оказывать антифибротический эффект [18].
АГ не характерна для пациентов с МД1 [6], но при необходимости пациентам в качестве гипотензивной терапии назначаются ингибиторы ангиотензинпревращающего фермента и антагонисты рецепторов ангиотензина II, как и в случае СН [18].
Может быть рекомендована оценка липидного профиля, т.к. гиперхолестеринемия является одним из модифицируемых сосудистых факторов риска, которую целесообразно проводить раз в 3 года, а в случае выявления отклонений необходим более частый контроль показателей [7]. Более того, влияние статинов на состояние пациентов с МД1 изучено недостаточно, поэтому врачам необходимо тщательно следить за возможными осложнениями со стороны мышечной ткани при назначении данной группы препаратов. В качестве альтернативы статинам возможно рассмотрение применения ингибиторов PCSK9 (proprotein convertase subtilisin/kexin type 9, пропротеиновая конвертаза субтилизин-кексинового типа 9) [19].
Из корригируемых сосудистых факторов риска у пациентов также отмечено повышение ИМТ, коррелирующего с кардиальными проявлениями. В связи с данным наблюдением данной группе пациентов следует рекомендовать умеренные аэробные нагрузки, поскольку они повышают мышечный тонус [7], эластичность сосудистой стенки [20][21] и могут способствовать снижению веса.
Данные об имеющихся кардиальных проявлениях и причинах их развития важны для предупреждения побочных эффектов лекарственных препаратов, назначаемых по основному заболеванию или сопутствующей патологии, в частности при лечении возникающих инфекционных осложнений, коррекции психоэмоциональных нарушений. Так, в качестве препарата первой линии для облегчения социально ограничивающих симптомов миотонии используют мексилетин, который является антиаритмическим препаратом класса 1В, но его назначение следует согласовывать с кардиологом при наличии нарушений ритма у пациента [7].
Ещё одним препаратом, требующим согласования с кардиологом, является карбамапазепин. Препарат не приведен в основных рекомендациях по лечению пациентов с МД1, но зачастую фигурирует в научных публикациях ввиду большей доступности по сравнению с мексилетином [22][23], однако и его назначение требует оценки рисков со стороны ССС, поскольку он противопоказан при АВ-блокадах и других нарушениях сердечной проводимости [21].
Таким образом, полученные знания из полноценного исследования ССС пациентов с МД1 могут помочь не только улучшить качество жизни, но и избежать возможных побочных эффектов назначаемого лечения.
Таблица 5
Частота проведения инструментальных исследований у пациентов с МД1
Исследование | Частота проведения |
ЭКГ | не <1 раза/год |
Осмотр кардиолога | не <1 раза/год |
Липидный профиль | не <1 раза/3 года |
ХМ-ЭКГ | Первое исследование при установлении диагноза Далее: |
При вновь появившиеся изменениях на ЭКГ — сразу, или при симптомах со стороны ССС и возрасте >40 лет — 1 раз/3-5 лет | |
ЭхоКГ | При изменениях на ЭКГ сразу, или при симптомах со стороны ССС и возрасте >40 лет — 1 раз/3-5 лет |
МРТ сердца | По показаниям после основного блока обследований |
ЭФИ | По показаниям после основного блока обследований |
УЗДГ БЦА | По показаниям (синкопе, изменения вещества головного мозга сосудистого генеза) |
СМАД | По показаниям (синкопе, изменения вещества головного мозга сосудистого генеза) |
Примечание: БЦА — брахиоцефальные артерии, МД1 — миотоническая дистрофия 1 типа, МРТ — магнитно-резонансная томография, СМАД — суточное мониторирование артериального давления, ССС — сердечно-сосудистая система, УЗДГ — ультразвуковая допплерография, ХМ-ЭКГ — холтеровское мониторирование электрокардиограммы, ЭКГ — электрокардиограмма, ЭхоКГ — эхокардиография, ЭФИ — электрофизиологическое исследование.
Заключение
Поражение сердца, нередко предшествующее развитию мышечной слабости, встречается у 80% пациентов с МД1 и является второй по частоте причиной смерти после респираторных нарушений. Ввиду когнитивных нарушений, а также особенностей нейропсихологического профиля, в частности, наличия депрессии и апатии, пациенты зачастую некритичны к своему состоянию и требуют регулярного обследования ССС даже при отсутствии жалоб. Кроме того, важно учитывать побочные эффекты лекарственных препаратов, назначаемых по основному заболеванию, поскольку многие из них напрямую или косвенно влияют на сердечную проводимость.
Информированное согласие. От пациентов получено письменное добровольное информированное согласие на публикацию описания каждого клинического случая (даты подписания пациентом К. 10.08.2022, пациентом Р. 13.09.2021, пациентом Ц. 21.12.2022, пациентом Е. 14.07.2022).
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1 World Health Organization. Obesity: preventing and managing the global epidemic. 1997, Geneva: WHO.
Список литературы
1. Ерохина Е.К., Мельник Е.А., Влодавец Д.В. Клинические особенности течения разных форм миотонической дистрофии 1-го типа. Русский журнал детской неврологии. 2023;18(1):22-37. doi:10.17650/2073-8803-2023-18-1-22-37.
2. Johnson NE, Butterfield RJ, Mayne K, et al. Population-based prevalence of myotonic dystrophy type 1 using genetic analysis of statewide blood screening program. Neurology. 2021;96(7): e1045-53. doi:10.1212/WNL.0000000000011425.
3. Nigro G, Papa AA, Politano L. The heart and cardiac pacing in Steinert disease. Acta Myologica. 2012;31(2):110-6.
4. Миронов Н.Ю., Миронова Н.А., Соколов С. Ф. и др. Желудочковая тахикардия как первое клиническое проявление миотонической дистрофии. Кардиология. 2015;8:86-96.
5. Johnson NE, Butterfield R, Berggren K, et al. Disease burden and functional outcomes in congenital myotonic dystrophy: A crosssectional study. Neurology. 2016;87(2):160-7. doi:10.1212/WNL.0000000000002845.
6. Russo V, Antonini G, Massa R, et al. Comprehensive Cardiovascular Management of Myotonic Dystrophy Type 1 Patients: A Report from the Italian Neuro-Cardiology Network. J Cardiovasc Dev Dis. 2024;11(2):63. doi:10.3390/jcdd11020063.
7. Ashizawa T, Gagnon, Groh WJ, et al. Consensus-based care recommendations for adults with myotonic dystrophy type 1. Neurol Clin Pract. 2018;8(6):507-20. doi:10.1212/CPJ.0000000000000531.
8. Groh WJ, Groh MR, Saha C, et al. Electrocardiographic abnormalities and sudden death in myotonic dystrophy type 1. New Engl J Med. 2008;358:2688-97. doi:10.1056/NEJMoa062800.
9. Oloffson B, Forsberg H, Andersson S, et al. Electrocardiographic findings in myotonic dystrophy. Br Heart J. 1988;59:47-52.
10. Laurent V, Pellieux S, Corcia P, et al. Mortality in myotonic dystrophy patients in the area of prophylactic pacing devices. Int J Cardiol. 2011;150:54-8. doi:10.1016/j.ijcard.2010.02.029.
11. Варако Н.А., Архипова Д.В., Ковязина М.С. и др. Адденбрукская шкала оценки когнитивных функций III (Addenbrooke’s cognitive examination III — ACE-III): лингвокультурная адаптация русскоязычной версии. Анналы клинической и экспериментальной неврологии. 2022;16(1):53- 8. doi:10.54101/ACEN.2022.1.7.
12. Gallais B, Gagnon C, Côté I, et al. Reliability of the Apathy Evaluation Scale in Myotonic Dystrophy Type 1. J Neuromusc Dis. 2018;5(1):39-46. doi:10.3233/JND-170274.
13. Ежов М.В., Сергиенко И.В., Кухарчук В.В. Клинические рекомендации по нарушениям липидного обмена 2023. Что нового? Атеросклероз и Дислипидемии. 2023;3(52):5-9. doi:10.34687/2219-8202.JAD.2023.03.0001.
14. Рекомендации Европейского общества кардиологов (ESC) 2022 года по ведению пациентов с желудочковыми аритмиями и профилактике внезапной сердечной смерти. Атеросклероз. 2023;19(1):57-68.
15. Ревишвили А.Ш., Артюхина Е.А., Глезер М.Г. и др. Брадиаритмии и нарушения проводимости. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(4):4448. doi:10.15829/1560-4071-2021-4448.
16. Priori SG, Blomström-Lundqvist C, Mazzanti A, et al. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC). Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC). Eur Heart J. 2015;36:2793-867. doi:10.1093/eurheartj/ehv316.
17. Russo V, Sperlongano S, Gallinoro E, et al. Prevalence of Left Ventricular Systolic Dysfunction in Myotonic Dystrophy Type 1: A Systematic Review. J Card Fail. 2020;26:849-56. doi:10.1016/j.cardfail.2019.07.548.
18. Russo V, Papa AA, Williams E.A, et al. ACE inhibition to slow progression of myocardial fibrosis in muscular dystrophies. Trends Cardiovasc Med. 2018;(28):330-7. doi:10.1016/j.tcm.2017.12.006.
19. Alishetti S, Bodepudi S, Rosenblatt A.The geneticist with unfortunate genes: coronary artery disease in myotonic dystrophy. J Am Coll Cardiol. 2017;69(11 Suppl.):2230. doi:10.1016/S0735-1097(17)35619-X.
20. Verdicchio C, Freene N, Hollings M, et al. A Clinical Guide for Assessment and Prescription of Exercise and Physical Activity in Cardiac Rehabilitation. A CSANZ Position Statement. Heart Lung Circ. 2023;32(9):1035-48. doi:10.1016/j.hlc.2023.06.854.
21. Kusumoto FM, Schoenfeld MH, Barrett C, et al. 2018 ACC/AHA/HRS Guideline on the evaluation and management of patients with bradycardia and cardiac conduction delay: a report of the american college of cardiology/american heart association task force on clinical practice guidelines and the heart rhythm society. Circulation. 2019;140:e382-482. doi:10.1161/CIR.0000000000000628.
22. Kurihara T. New classification and treatment for myotonic disorders. Intern Med. 2005;44(10):1027-32. doi:10.2169/internalmedicine.44.1027.
23. Sechi GP, Traccis S, Durelli L, et al. Carbamazepine versus diphenylhydantoin in the treatment of myotonia. Eur Neurol. 1983;22(2):113-8. doi:10.1159/000115546.
Об авторах
А. Г. КлементьеваРоссия
Клементьева Анна Григорьевна — врач-терапевт, кардиолог, зав. приемным отделением, н.с. отдела возраст-ассоциированных заболеваний
Москва
Е. К. Ерохина
Россия
Ерохина Елизавета Константиновна — врач-невролог
Москва
К. В. Шамтиева
Россия
Шамтиева Камила Витальевна — врач-невролог консультативно-диагностического отделения, н.с. отдела внутренних болезней
Москва
Е. А. Мельник
Россия
Мельник Евгения Александровна — к.м.н., н.с. Российского детского нервно-мышечного центра при обособленном структурном подразделении, доцент кафедры генетики неврологических болезней ИВДПО
Москва
А. Н. Хробостова
Россия
Хробостова Анастасия Николаевна — студентка факультета фундаментальной медицины
Москва
М. Б. Филипенко
Россия
Филипенко Марина Борисовна — к.м.н., врач-кардиолог, врач функциональной диагностики, зав. отделением функциональной диагностики
Москва
А. А. Аракелянц
Россия
Аракелянц Амалия Ашотовна — к.м.н., доцент кафедры общей врачебной практики
Москва
Т. В. Петерс
Россия
Петерс Татьяна Васильевна — к.м.н., н.с. отдела внутренних болезней
Москва
Е. П. Павликова
Россия
Павликова Елена Петровна — д.м.н., профессор, врач-кардиолог, зав. отделом внутренних болезней, заместитель директора
Москва
Дополнительные файлы
Что известно о предмете исследования?
- Поражение сердца, встречающееся у подавляющего числа пациентов с миотонической дистрофией 1 типа (МД1), является второй по частоте причиной смерти после респираторных нарушений и нередко предшествуют развитию генерализованной мышечной слабости.
- Кардиальные симптомы наиболее часто включают нарушения проводимости, тахиаритмии и ишемические проявления, своевременная диагностика которых важна, чтобы снизить риск летального исхода.
Что добавляют результаты исследования?
- На ведение пациентов оказывают значимое влияние особенности их нейропсихологического профиля, особенно выраженность когнитивных нарушений, что снижает их критическое отношение к своему состоянию и требует регулярного обследования сердечно-сосудистой системы даже при отсутствии жалоб.
Рецензия
Для цитирования:
Клементьева А.Г., Ерохина Е.К., Шамтиева К.В., Мельник Е.А., Хробостова А.Н., Филипенко М.Б., Аракелянц А.А., Петерс Т.В., Павликова Е.П. Кардиальные проявления при миотонической дистрофии 1 типа. Кардиоваскулярная терапия и профилактика. 2024;23(8):3999. https://doi.org/10.15829/1728-8800-2024-3999
For citation:
Klementieva A.G., Erokhina E.K., Shamtieva K.V., Melnik E.A., Khrobostova A.N., Filipenko M.B., Arakelyants A.A., Peters T.V., Pavlikova E.P. Cardiac manifestations in myotonic dystrophy type 1. Cardiovascular Therapy and Prevention. 2024;23(8):3999. (In Russ.) https://doi.org/10.15829/1728-8800-2024-3999
JATS XML

























































