Перейти к:
Изучение роли свободных нуклеотидов при хронической сердечной недостаточности
https://doi.org/10.15829/1728-8800-2025-4056
EDN: KPJTWO
Аннотация
Цель. Оценить возможность исследования уровня свободных нуклеотидов в плазме крови в качестве дополнительных биомаркеров хронической сердечной недостаточности (ХСН) с учетом клинико-инструментальных данных пациента, а также проанализировать его изменение на фоне терапии.
Материал и методы. В исследование включены 67 пациентов с ХСН и 23 здоровых добровольца. Содержание свободных нуклеотидов в плазме крови анализировали хроматографическим методом на автоматизированной системе FPLS® System (Швеция), колонка 10 × 200 мм с Q Sepharose Fast Flow. Повторный анализ выполняли у пациентов со сниженной фракцией выброса через 6±0,2 мес.
Результаты. У пациентов с ХСН по сравнению с контрольной группой выявлены более низкие уровни аденозина — 30,45±2,61 vs 56,68±3,99 мм2 (p=0,001), аденозинмонофосфата — 278,60±18,60 vs 391,68±39,86 мм2 (p=0,022), гуанозиндифосфата — 500,27± 22,83 vs 901,63±51,09 мм2 (p=0,001), аденозинтрифосфата — 49,25±8,89 vs 145,18±18,80 мм2 (p=0,001), гуанозинтрифосфата — 32±8,25 vs 92,40±27,07 мм2 (p=0,041) и более высокие значения аденозиндифосфата — 690,10±57,41 vs 392,09±32,63 мм2 (p=0,002). Данные закономерности сохранялись при анализе с учетом фракции выброса, функционального класса и наличия сахарного диабета. На фоне лечения уровни аденозиндифосфата и гуанозиндифосфата достоверно изменяются (до 307±26,08 мм2 и 650,47±58,1 мм2, соответственно), приближаясь к значениям в контрольной группе.
Заключение. Выявленные особенности нуклеотидного профиля при ХСН позволяют рассматривать уровень свободных нуклеотидов как дополнительный потенциальный биомаркер, отражающий объективные нарушения на клеточном уровне.
Ключевые слова
Для цитирования:
Колесникова Е.В., Мячина О.В., Пашков А.Н., Пашкова А.Н. Изучение роли свободных нуклеотидов при хронической сердечной недостаточности. Кардиоваскулярная терапия и профилактика. 2025;24(1):4056. https://doi.org/10.15829/1728-8800-2025-4056. EDN: KPJTWO
For citation:
Kolesnikova E.V., Myachina O.V., Pashkov A.N., Pashkova A.A. The role of free nucleotides in heart failure. Cardiovascular Therapy and Prevention. 2025;24(1):4056. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4056. EDN: KPJTWO
Введение
Хроническая сердечная недостаточность (ХСН) остается одной из наиболее значимых проблем здравоохранения ввиду выраженного социального и экономического ущерба, причиняемого данной патологией [1]. Высокий уровень инвалидизации и смертности пациентов с ХСН сравним с аналогичными показателями при злокачественных новообразованиях [2], при этом степень выраженности нарушения кровообращения оказывает непосредственное влияние на прогноз больного. Известно, что пациенты с низкой фракцией выброса (ФВ) и/или с тяжелой стадией ХСН, а также с частыми декомпенсациями, относятся к прогностически наиболее неблагоприятным группам [3]. Отдельного внимания заслуживает изучение влияния сопутствующей патологии, т.к. в силу возраста наиболее частыми представителями среди пациентов с ХСН являются коморбидные больные [4][5].
Согласно клиническим рекомендациям, как Российского, так и Европейского обществ кардиологов, основной лабораторный показатель, определяемый с целью верификации ХСН — это уровень N-концевого промозгового натрийуретического пептида (NT-proBNP) [6][7]. В то же время известно, что увеличение концентрации NT-proBNP в крови не является абсолютно специфичным в диагностике ХСН, и существуют иные, как кардиальные, так и некардиальные причины его повышения [8].
С учетом имеющихся сведений о роли иммуновоспалительной теории в патогенезе сердечно-сосудистых заболеваний, перспективным направлением представляется дальнейшее изучение маркеров системного повреждения тканей. Отдельного внимания требует исследование этих маркеров у пациентов с различными фенотипами сердечной недостаточности, что также может расширить имеющиеся сведения о подходах к лечению. Одними из таких биомолекул являются свободные нуклеотиды в плазме крови, являющиеся универсальными показателями стрессовых реакций и имеющие научное обоснование для изучения в качестве перспективных биомаркеров при сердечно-сосудистых заболеваниях [9]. Выполняя структурную, ферментативную, сигнальную, энергетическую функции, нуклеотиды обеспечивают нормальное течение биохимических процессов [10]. Помимо нуклеотидов, входящих в состав нуклеиновых кислот, в организме присутствует немалое количество свободных нуклеотидов. Основной нуклеотидный пул на 90% формируется в результате синтеза, незначительная часть образуется в результате частичного гидролиза нуклеиновых кислот [11]. Влияние стрессового агента (высокая/низкая температура, гипоксия, патология любой системы и др.) приводит к изменению метаболизма пуриновых нуклеотидов, нарушению соотношения компонентов гуаниновой — ГМФ (гуанозинмонофосфат), ГДФ (гуанозиндифосфат), ГТФ (гуанозинтрифосфат) и адениновой — АМФ (аденозинмонофосфат), АДФ (аденозиндифосфат), АТФ (аденозинтрифосфат) систем, что связано с адаптационными потребностями организма и может рассматриваться в качестве индикатора клеточных нарушений [12].
В связи с этим дальнейший поиск и изучение диагностического и терапевтического потенциала свободных нуклеотидов являются актуальными. С целью повышения диагностической и прогностической точности этих показателей, как потенциальных маркеров ХСН, необходимы исследования, основанные на комплексной оценке индивидуальных особенностей пациента.
Цель настоящего исследования — изучить возможность оценки уровня свободных нуклеотидов в плазме крови в качестве потенциальных дополнительных биомаркеров ХСН с учетом ФВ, функционального класса (ФК), наличия сахарного диабета 2 типа (СД), а также проанализировать изменение их концентраций на фоне проводимой терапии у больных со сниженной ФВ.
Материал и методы
В работу были включены: 67 человек с подтвержденным клинико-лабораторными и инструментальными методами диагнозом ХСН, находящихся под диспансерным наблюдением кардиолога амбулаторно-поликлинического звена; 23 здоровых добровольца (Контроль) аналогичного возраста и пола, без установленных хронических заболеваний, которые обратились для проведения профилактических мероприятий.
Критерии включения: пациенты с установленным диагнозом ХСН, возраст 40-85 лет, подписанное информированное добровольное согласие пациента на участие в исследовании. Для лиц контрольной группы — отсутствие документированных сведений о хронических заболеваниях, клиническое благополучие на момент исследования, подписанное информированное добровольное согласие на участие в исследовании. Проведение исследования одобрено Локальным этическим комитетом ФГБОУ ВО ВГМУ (заседание № 5 от 18.10.2022).
Критерии невключения: злокачественное новообразование вне зависимости от стадии и локализации, включая наличие в анамнезе, ХСН IV ФК по Нью-Йоркской классификации (NYHA — New York Heart Association (Functional Classification)), ХСН III стадии по классификации Н. Д. Стражеско и В. Х. Василенко (согласно российским клиническим рекомендациям по ведению пациентов с ХСН 2020 года), ожирение ≥2 ст. (индекс массы тела (ИМТ) >35 кг/м2), дефицит массы тела (ИМТ <18,5 кг/м2), наличие острого нарушения мозгового кровообращения или транзиторной ишемической атаки в анамнезе давностью <6 мес., наличие острого инфаркта миокарда в анамнезе давностью <1 мес., СД 1 типа, хроническая болезнь почек ≥С4 стадии.
Общая характеристика пациентов представлена в таблице 1.
Клинико-лабораторное и инструментальное обследование пациентов с ХСН включало физикальный осмотр, общий анализ крови, биохимический анализ крови с определением показателей липидного профиля, уровней глюкозы, креатинина, NT-proBNP, а также электрокардиографию, эхокардиографию, ультразвуковое исследование органов брюшной полости, рентгенографию органов грудной клетки, тест с 6-мин. ходьбой для определения ФК ХСН. На этапе включения в исследование оценивалась схема ранее получаемой пациентами медикаментозной терапии, и при необходимости проводилась коррекция согласно алгоритмам, представленным в Российских клинических рекомендациях по ведению пациентов с ХСН, 2020. Повторный забор крови проведен через 6±0,2 мес. в группе пациентов со сниженной ФВ (n=18).
Содержание свободных нуклеотидов в плазме крови анализировали хроматографическим методом на автоматизированной системе FPLS® System (Швеция) с использованием колонки размером 10×200 мм с Q Sepharose Fast Flow. К 600 мкл отцентрифугированной плазмы крови добавляли дважды по 200 мкл охлажденной хлорной кислоты, раствор тщательно перемешивали и в течение 5 мин центрифугировали. После осаждения нуклеопротеидного комплекса 600 мкл надосадочной жидкости подщелачивали 1 N раствором охлажденного KOH для нейтрализации pH, центрифугировали 2-3 мин. Далее 100 мкл плазмы крови наносили на колонку. Предварительно удаляли неорганические соли из ионообменника, промывку системы проводили дистиллированной водой, затем 1 N раствором HCl. Уравновешивали буферным раствором, начинали элюирование со скоростью потока 1,5 мл/мин при длине волны 260 нм. В качестве буфера использовали ступенчатый градиент, состоящий из двух компонентов: А — 0,05 N HCl; Б — 0,1 N HCl + 0,5 М NaCl. Время выхода буфера А составляло с 0 по 8 мин, буфера Б — с 9 по 31 мин. Для идентификации нуклеотидного состава плазмы крови использовали хроматографическое разделение известных нуклеотидов, которые сопоставлялись с выделенными нуклеотидными фракциями. Количество выделенных нуклеотидов определяли путем измерения площади элюированных пиков (в мм2).
Статистическая обработка результатов исследования проведена с помощью программ Microsoft Office Excel (2007) и Statistica SPSS SPSS 17. Нормальность распределения вариационных рядов оценивали с помощью критерия Колмогорова-Смирнова. По большинству критериев преобладало нормальное распределение, поэтому проверку статистических гипотез проводили с помощью параметрического t-критерия Стьюдента для несвязанных выборок или парного t-критерия для связанных выборок. Данные представлены как среднеарифметическое значение и ошибка среднего (М±m). Различия считали статистически значимыми при уровне значимости p<0,05.
Результаты
Основные показатели биохимического анализа крови пациентов с ХСН представлены в таблице 2. Средние значения глюкозы, общего холестерина (ХС), ХС липопротеинов низкой плотности находятся выше референтных границ и свидетельствуют о нарушении углеводного и липидного обмена в целом в исследуемой группе. Концентрация NT-proBNP, многократно превосходящая установленное нормальное значение, также указывает на наличие структурных изменений миокарда.
Экскреция свободных (кислоторастворимых) нуклеотидов у практически здоровых лиц происходила в виде 6 пиков: аденозина (А), АМФ, АДФ, ГДФ, АТФ, ГТФ. В то же время у всех больных с ХСН постоянно выделялись только 4 пика: А, АМФ, АДФ и ГДФ. Выделение АТФ наблюдалось только у 50% пациентов, ГТФ — у 3-13% пациентов. Примеры типичных хроматограмм у практически здоровых лиц и пациентов с ХСН представлены на рисунках 1, 2.
Количественный анализ выделяемых нуклеотидов, проведенный у больных с ХСН, и контрольной группы обнаружил более низкие уровни А — 30,45±2,61 vs 56,68±3,99 мм2 (p=0,001), АМФ — 278,60±18,60 vs 391,68±39,86 мм2 (p=0,022), ГДФ — 500,27±22,83 vs 901,63±51,09 мм2 (p=0,001), АТФ — 49,25±8,89 vs 145,18±18,80 мм2 (p=0,001), ГТФ — 32±8,25 vs 92,40±27,07 мм2 (p=0,041). Уровень АДФ (690,10±57,41 мм2) был достоверно выше у пациентов с ХСН по сравнению с контрольной группой (392,09±32,63 мм2) (p=0,002).
Согласно результатам определения содержания свободных нуклеотидов в плазме крови в зависимости от фракции выброса (классификация Российских клинических рекомендаций 2020 — группы с ФВ ≥50%, n=24, ФВ =40-49%, n=25, ФВ <40%, n=18), обнаружено более низкое содержание А, ГДФ и АТФ, более высокие уровни АДФ в каждой из исследуемых групп по сравнению с контрольной группой (tрасч.>tкрит., p<0,05). Кроме того, выявлен более низкий уровень АМФ по сравнению с контролем в группах с ФВ =40-49% (tрасч.>tкрит., p=0,024) и ФВ <40% (tрасч.>tкрит., p=0,001) (таблица 3).
Анализ уровня свободных нуклеотидов в плазме крови больных с ХСН в зависимости от ФК (I, n=16, II, n=30, III, n=21) характеризуется аналогичными результатами, а именно более низким содержанием А, АМФ, ГДФ и АТФ, более высоким уровнем АДФ по сравнению с контрольной группой (tрасч.>tкрит., p<0,05) в группах ФК II, ФК III. В группе пациентов с ФК I присутствуют такие же закономерности, за исключением содержания АМФ (таблица 4).
В работе, проведенной нами ранее, была рассчитана средняя концентрация NT-proBNP у больных с ХСН и различными ФВ и ФК (таблицы 3, 4). Полученные данные свидетельствуют также о наличии достоверной разницы уровня NT-proBNP с контрольной группой (tрасч.>tкрит., p<0,05), а статически значимые межгрупповые отличия наблюдаются между пациентами с ФВ ≥50% и ФВ <40% (p=0,001), ФВ =40-49% и ФВ <40% (p=0,013) и между группами ФК I и ФК III (p=0,001).
Наиболее часто встречающейся сопутствующей патологией в исследуемой группе пациентов был СД 2 типа, поэтому был проведен анализ 28 пациентов с сочетанием ХСН и СД 2 типа (ХСН+СД 2 типа). Свободные нуклеотиды у пациентов ХСН+СД 2 типа в 100% случаев элюируют виде 4 пиков: А, АМФ, АДФ, и ГДФ. Выделение АТФ происходит только у 12 (54,55%) человек, ГТФ — у 2 (9,09%). Статистически значимых различий уровней свободных нуклеотидов между пациентами с ХСН с СД 2 типа и без него выявлено не было. Количественный анализ содержания свободных нуклеотидов у пациентов с ХСН+СД 2 типа и контрольной группы обнаруживает более низкие уровни А — 37,98±5,10 мм2 (p=0,001), АМФ — 280,73±22,00 мм2 (p=0,021), ГДФ — 489,77±32,18 мм2 (p=0,003) и АТФ — 54,5±16,59 мм2 (p=0,000), увеличение уровня АДФ — 705,64±76,16 мм2 (p=0,001).
На этапе включения в исследование был проведен анализ принимаемой пациентами терапии на предмет наличия основных классов препаратов для лечения ХСН (ингибиторы ренин-ангиотензиновой системы/антагонисты ангиотензиновых рецепторов и неприлизина, β-блокаторы, антагонисты минералокортикоидных рецепторов, ингибиторы натрий-глюкозного котранспортера 2-го типа, диуретики) и целевых дозировок, указанных в Российских клинических рекомендациях. Полученные сведения представлены на рисунке 3. Все пациенты получали β-блокаторы, ингибиторы ренин-ангиотензиновой системы, с небольшим преобладанием ингибиторов ангиотензинпревращающего фермента (55%) над блокаторами ангиотензиновых рецепторов (40%), 5% больных принимали препарат валсартан+сакубитрил, 4% получали дапаглифлозин/эмпаглифлозин, а 73% больных получали антагонисты минералокортикоидных рецепторов. При этом достижение пациентами целевых дозировок на старте исследования составляло в среднем ~60%. За период, составивший 2-3 мес., была проведена работа по коррекции схемы терапии: замена препарата, включение ранее неиспользуемой группы, титрация дозы до рекомендованной. Исходя из рисунка 3 основные изменения через 6±0,2 мес. выглядят следующим образом: значимо увеличилась доля пациентов, принимающих валсартан+сакубитрил (18%), дапаглифлозин/эмпаглифлозин (48%), кроме того, на фоне диуретической терапии достигнуто состояние эуволемии, а количество пациентов, находящихся на целевых дозах лекарств, составило ~80%.
Для оценки возможных изменений на фоне проводимой медикаментозной терапии повторно исследован уровень свободных нуклеотидов в группе больных c ХСН со сниженной ФВ (ФВ <40%). Образцы нуклеотидного профиля пациентов данной группы на этапе включения и через 6±0,2 мес. представлены на рисунках 4, 5, соответственно. Полученные результаты отражают значительные изменения содержания свободных нуклеотидов в крови пациентов со сниженной ФВ по сравнению с уровнями на этапе включения: у всех обследованных (в 100%) появляются фракции АТФ и ГТФ, чего не наблюдалось при первоначальном обследовании, содержание АДФ в плазме крови достоверно снижается и составляет 307±26,08 мм2 (р=0,001), фракция ГДФ статистически значимо возрастает (650,47±58,10 мм2, р=0,020), но остается значительно сниженной по сравнению с контролем.
Таблица 1
Общая характеристика пациентов
Показатель | Всего пациентов, n (%) |
Средний возраст, лет, (M±m) | 68±1,2 |
Мужчины | 41 (61,) |
Женщины | 26 (38,) |
ИМТ ≥25 кг/м2 | 36 (53,7) |
Курение (в т.ч. в анамнезе) | 16 (23,9) |
ФВ ≥50% | 24 (35,8) |
ФВ =40-49% | 25 (37,3) |
ФВ <40% | 18 (26,9) |
ФК I | 16 (23,9) |
ФК II | 30 (44,8) |
ФК III | 21 (31,3) |
ХСН, I стадия | 16 (23,9) |
ХСН, IIА стадия | 34 (50,7) |
ХСН, IIВ стадия | 17 (25,4) |
Инфаркт миокарда в анамнезе | 25 (37,3) |
СД 2 типа | 28 (41,8) |
Фибрилляция предсердий | 14 (21) |
ХОБЛ | 16 (23,9) |
ХБП С2-С3Б стадии | 23 (34,3) |
Примечание: ИМТ — индекс массы тела, СД — сахарный диабет, ФВ — фракция выброса, ФК — функциональный класс, ХБП — хроническая болезнь почек, ХОБЛ — хроническая обструктивная болезнь легких, ХСН — хроническая сердечная недостаточность.
Таблица 2
Результаты биохимического анализа
Биохимические показатели крови | Результат (M±m) |
NT-proBNP | 899,65±82,41* |
Глюкоза | 6,53±0,28* |
Мочевая кислота | М: 407,33±34,37 Ж: 328,17±21,82 |
Креатинин | М: 99,46±5,75 Ж: 91,56±6,82 |
Общий ХС | 5,32±0,28* |
ХС липопротеинов низкой плотности | 3,67±0,26* |
Примечание: * — выше референтных значений. Ж — женщины, М — мужчины, NT-proBNP — N-концевой промозговой натрийуретический пептид.
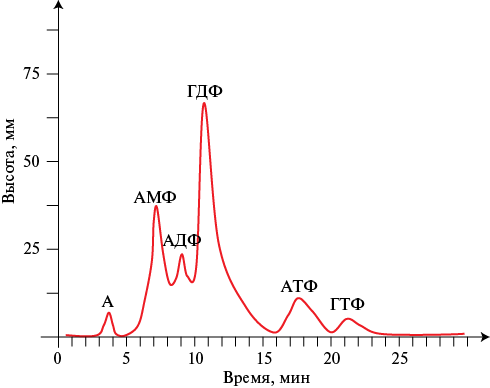
Рис. 1 Хроматограмма нуклеотидного профиля практически здорового добровольца.
Примечание: А — аденозин, АДФ — аденозиндифосфат, АМФ — аденозинмонофосфат, АТФ — аденозинтрифосфат, ГДФ — гуанозиндифосфат, ГТФ — гуанозинтрифосфат.

Рис. 2 Хроматограмма нуклеотидного профиля пациента К., страдающего ХСН.
Примечание: А — аденозин, АДФ — аденозиндифосфат, АМФ — аденозинмонофосфат, ГДФ — гуанозиндифосфат, ХСН — хроническая сердечная недостаточность.
Таблица 3
Свободные нуклеотиды у пациентов с различной ФВ
Фракция | Площадь элюированного пика (мм2), (M±m) | |||
ФВ ≥50% (n=24) | ФВ =40-49% (n=25) | ФВ <40% (n=18) | Контроль (n=23) | |
А | 30,72±4,26* | 32,10±4,22* | 36,96±4,83* | 56,68±3,99 |
АМФ | 296,94±22,97 | 272,53±22,50* | 254,23±30,94* | 391,68±39,86 |
АДФ | 682,64±75,26* | 720,18±65,39* | 660,54±115,57* | 392,09±32,63 |
ГДФ | 514,67±27,98* | 512,65±32,69* | 464,15±40,90* | 901,63±51,09 |
АТФ | 55,67±13,15* | 40,30±13,53* | 63,86±25,39* | 145,18±18,80 |
ГТФ | & | & | & | 92,40±27,07 |
NT-proBNP, пг/мл | 559,1±69,3* | 825,3±115,9* | 1456,9±187,9*#^ | |
Примечание: * — различия статистически значимы по сравнению с группой здоровых лиц; # — различия статистически значимы по сравнению с группой ФВ ≥50; ^ — различия статистически значимы по сравнению с группой ФВ =40-49; & — фракция ГТФ наблюдалась у 1-3 обследуемых; А — аденозин, АДФ — аденозиндифосфат, АМФ — аденозинмонофосфат, АТФ — аденозинтрифосфат, ГДФ — гуанозиндифосфат, ГТФ — гуанозинтрифосфат, ФВ — фракция выброса, NT-proBNP — N-концевой промозговой натрийуретический пептид.
Таблица 4
Свободные нуклеотиды у пациентов с разными ФК ХСН
Фракция | Площадь элюированного пика (мм2), (M±m) | |||
ФК I (n=16) | ФК II (n=30) | ФК III (n=21) | Контроль (n=23) | |
А | 32,92±5,24* | 29,43±3,39* | 37,77±5,17* | 56,68±3,99 |
АМФ | 295,38±23,74 | 288,39±23,22* | 247,53±23,37* | 391,68±39,86 |
АДФ | 623±49,13* | 731,13±76,45* | 676,94±88,47* | 392,09±32,63 |
ГДФ | 518,33±28,88* | 490,78±27,92* | 496,65±39,45* | 901,63±51,09 |
АТФ | 62,67±15,49* | 43,92±10,32* | 50,89±21,05* | 145,18±18,80 |
ГТФ | & | & | & | 92,40±27,07 |
NT-proBNP, пг/мл | 565,5±138,02* | 841,24±103,32* | 1233,34±168,98*# | |
Примечание: * — различия статистически значимы по сравнению с группой здоровых лиц; # — различия статистически значимы по сравнению с группой ФК I; & — фракция ГТФ наблюдалась у 1-3 обследуемых; А — аденозин, АДФ — аденозиндифосфат, АМФ — аденозинмонофосфат, АТФ — аденозинтрифосфат, ГДФ — гуанозиндифосфат, ГТФ — гуанозинтрифосфат, ФК — функциональный класс, NT-proBNP — N-концевой промозговой натрийуретический пептид.

Рис. 3 Медикаментозная терапия пациентов с ХСН.
Примечание: МНН — международное непатентованное наименование, ХСН — хроническая сердечная недостаточность.
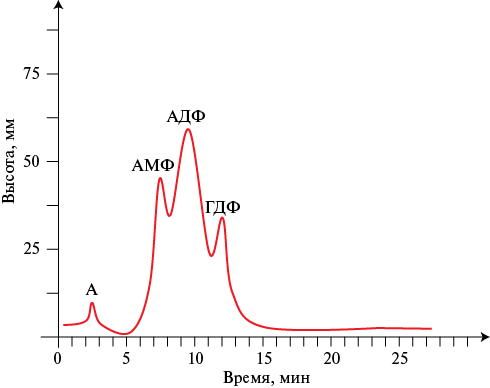
Рис. 4 Хроматограмма нуклеотидного профиля пациента В. с ХСН со сниженной ФВ на этапе включения.
Примечание: А — аденозин, АДФ — аденозиндифосфат, АМФ — аденозинмонофосфат, ГДФ — гуанозиндифосфат, ФВ — фракция выброса, ХСН — хроническая сердечная недостаточность.
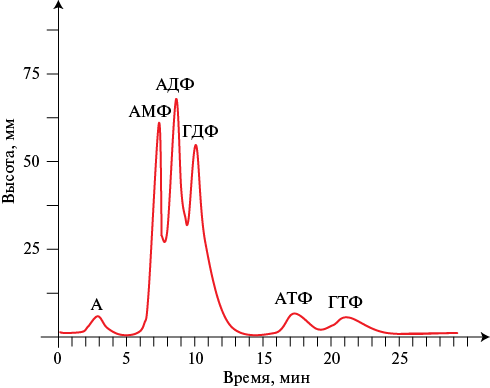
Рис. 5 Хроматограмма нуклеотидного профиля пациента В. с ХСН со сниженной ФВ на фоне коррекции терапии.
Примечание: А — аденозин, АДФ — аденозиндифосфат, АМФ — аденозинмонофосфат, АТФ — аденозинтрифосфат, ГДФ — гуанозиндифосфат, ГТФ — гуанозинтрифосфат, ФВ — фракция выброса, ХСН — хроническая сердечная недостаточность.
Обсуждение
Используемый в настоящей работе хроматографический метод выделения свободных нуклеотидов позволил выявить следующие особенности нуклеотидного профиля у пациентов с ХСН: поскольку последовательность образования нуклеотидов и нуклеозидов — это единый процесс, то нарушение на одном этапе приведет к изменениям последующих звеньев. Более низкий уровень АТФ в крови пациентов с ХСН, а в некоторых случаях и вовсе отсутствие этого свободного нуклеотида в плазме, является отправной точкой дальнейших нарушений биохимических процессов. В условиях длительной гипоксии переключение энергообмена с аэробного на анаэробный приводит к дефициту образования АТФ [13], при этом происходит значительное увеличение концентрации свободного АДФ [14]. Данные отклонения мы и наблюдаем при анализе пациентов с ХСН. Дальнейшие этапы расщепления или дефосфорилирования приведут к образованию меньшего количества АМФ и А, причем данные отличия от контрольной группы также являлись достоверными. А является мощным вазодилататором, поэтому дефицит этого вещества провоцирует повышение тонуса сосудов, приводя к патологическим изменениям [15].
Уменьшение площади пиков ГТФ и ГДФ у пациентов с ХСН также имеет определенную функциональную обоснованность. Трансмембранная передача сигнала между рецепторами и эффекторными белками осуществляется с помощью универсальных посредников — G-белков (ГТФ-связывающих белков). Взаимодействие с α-субъединицей G- белка приводит к образованию активной формы α-ГТФ, дефосфорилирование данной молекулы сопровождается образованием неактивной α-ГДФ-формы [16]. Повторяющиеся этапы активации и дезактивации обеспечивают функционирование сигнально-рецепторной системы. Однако любая патология, вызывая нарушения на клеточном уровне, приводит к сбою в данной системе [17].
Выявленные нарушения сохранялись и при анализе с учетом критериев "фракция выброса" и "функциональный класс". Дополнительно был проанализирован уровень NT-proBNP в этих группах, также выявивший достоверную разницу с группой сравнения, кроме того убедительные межгрупповые отличия были представлены у пациентов с сохраненной и сниженной ФВ, с промежуточной и сниженной ФВ, с ФК I и III. Полученные результаты согласуются с мнением экспертов о взаимосвязи уровня натрийуретического пептида с объективным состоянием пациента, а именно нарушение сократительной способности миокарда или снижение толерантности к физической нагрузке сопровождается увеличением концентрации данного биомаркера в крови пациента [18][19].
По данным статистического анализа с позиции сопутствующей патологии, а именно: наличия СД 2 типа, не было выявлено достоверных отличий нуклеотидного профиля между больными СД 2 типа и без такового. Однако при количественном анализе уровней свободных нуклеотидов, проведенный в группе пациентов с ХСН и СД 2 типа, были обнаружены убедительные отличия содержания этих биохимических показателей по сравнению с контрольной группой. Возможным объяснением данного обстоятельства может быть как ограниченный размер выборки, так и тот факт, что основным и, очевидно, более значимым критерием является наличие ХСН, а не сопутствующая патология.
Повторный анализ свободных нуклеотидов у пациентов со сниженной ФВ свидетельствует о положительных изменениях на фоне проводимой терапии. Нуклеотидный профиль у пациентов данной группы, в динамике претерпевает изменения, демонстрируя тенденцию к нормализации биохимических процессов.
Ограничения исследования. К ограничениям исследования следует отнести малый размер выборки. Увеличение количества случаев вероятно повлияет на результаты и позволит выявить новые закономерности.
Заключение
Таким образом, проведенные клинические и лабораторно-инструментальные исследования выявили достоверные отличия уровней свободных нуклеотидов в плазме крови пациентов с ХСН от контрольной группы, при этом данная разница сохраняется вне зависимости от степени выраженности клинико-инструментальных нарушений и наличия сопутствующей патологии. Кроме того, исходя из результатов повторного анализа в группе пациентов со сниженной ФВ, исследуемый показатель подвержен динамическим изменениям, следовательно, может рассматриваться в качестве потенциального дополнительного биомаркера для оценки эффективности проводимых лечебных мероприятий.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Рейтблат О.М., Айрапетян А.А., Лазарева Н.В. и др. Создание регистров как один из механизмов улучшения медицинской помощи пациентам с хронической сердечной недостаточностью. Состояние проблемы. Терапевтический архив. 2023;95(9):739-45. doi:10.26442/00403660.2023.09.202370.
2. Насонова С.Н., Лаптева А.Е., Жиров И.В. и др. Дистанционный мониторинг пациентов с сердечной недостаточностью в реальной клинической практике. Кардиология. 2021;61(8):76-86. doi:10.18087/cardio.2021.8.n1683.
3. Поляков Д.С., Фомин И.В., Беленков Ю.Н. и др. Хроническая сердечная недостаточность в Российской Федерации: что изменилось за 20 лет наблюдения? Результаты исследования ЭПОХА-ХСН. Кардиология. 2021;61(4):4-14. doi:10.18087/cardio.2021.4.n1628.
4. Газизянова В.М., Булашова О.В., Хазова Е.В. и др. Клинические варианты течения хронической сердечной недостаточности в сочетании с хронической обструктивной болезнью легких. Практическая медицина. 2019;17(2):58-63. doi:10.32000/2072-1757-2019-2-58-63.
5. Лазарева Н.В., Ощепкова Е.В., Орловский А.А. и др. Клиническая характеристика и оценка качества лечения больных с хронической сердечной недостаточностью и сахарным диабетом. Терапевтический архив. 2020;92(4):37-44. doi:10.26442/00403660.2020.04.000474.
6. Хроническая сердечная недостаточность. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4083. doi:10.15829/1560-4071-2020-4083.
7. McDonagh TA, Metra M, Adamo M, et al. ESC Scientific Document Group. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599-726. doi:10.1093/eurheartj/ehab368.
8. Чаулин А.М., Дупляков Д.В. Повышение натрийуретических пептидов, не ассоциированное с сердечной недостаточностью. Российский кардиологический журнал. 2020;25(4S):4140. doi:10.15829/1560-4071-2020-4140.
9. Aboumsallem JP, Shi C, De Wit S, et al. Multi-omics analyses identify molecular signatures with prognostic values in different heart failure aetiologies. J Mol Cell Cardiol. 2023;175:13-28. doi:10.1016/j.yjmcc.2022.12.001.
10. Северин Е.С. Биохимия: учебник. 5-е изд., испр. и доп. М.: ГЭОТАР-Медиа, 2015. 768 с. ISBN: 978-5-9704-3312-6.
11. Каликова Л.Б., Бойко Е.Р. Определение адениновых нуклеотидов модифицированным методом высокоэффективной жидкостной хроматографии. Клиническая лабораторная диагностика. 2021;66(3):172-6. doi:10.51620/0869-2084-2021-66-3-172-176.
12. Berdis A. Nucleobase-modified nucleosides and nucleotides: Applications in biochemistry, synthetic biology, and drug dis covery. Front Chem. 2022;30(10):1051525. doi:10.3389/fchem.2022.1051525.
13. Приходько В.А., Селизарова Н.О., Оковитый С.В. Молекулярные механизмы развития гипоксии и адаптации к ней. Часть I. Архив патологии. 2021; 83(2):52-61. doi:10.17116/patol20218302152.
14. Ochs RS. ATP Redux. Trends Biochem Sci. 2021;46(6):435-7. doi:10.1016/j.tibs.2021.03.001.
15. Чаулин А.М. Аденозин и его роль в физиологии и патологии сердечно-сосудистой системы. Кардиология: новости, мнения, обучение. 2019;7(3):37-45. doi:10.24411/2309-1908-2019-13004.
16. Voss JH, Müller CE. Heterotrimeric G Protein α-Subunits — Structures, Peptide-Derived Inhibitors, and Mechanisms. Curr Med Chem. 2022;29(42):6359-78. doi:10.2174/0929867329666220308112424.
17. Ferré S, Ciruela F, Dessauer CW, et al. G protein-coupled receptoreffector macromolecular membrane assemblies (GEMMAs). Pharmacol Ther. 2022;231:107977. doi:10.1016/j.pharmthera.2021.107977.
18. Cindik N, Gökdemir M, Varan B, et al. Comparison of serum N-terminal pro-brain natriuretic peptide levels, conventional echocardiography, exercise parameters, and dyssynchrony measurements in Fontan patients. Cardiol Young. 2023;33(9):1706- 12. doi:10.1017/S1047951123003256.
19. Miranda WR, Jain CC, Borlaug BA, et al. Exercise Capacity, NTproBNP, and Exercise Hemodynamics in Adults Post-Fontan. J Am Coll Cardiol. 2023;81(16):1590-600. doi:10.1016/j.jacc.2023.02.031.
Об авторах
Е. В. КолесниковаРоссия
Колесникова Елена Викторовна — соискатель кафедры поликлинической терапии, врач-кардиолог
Воронеж
О. В. Мячина
Россия
Мячина Ольга Владимировна — д.м.н., доцент, зав. кафедрой биологии
Воронеж
А. Н. Пашков
Россия
Пашков Александр Николаевич — д.б.н., профессор кафедры биологии
Воронеж
А. Н. Пашкова
Россия
Пашкова Анна Николаевна — д.м.н., профессор, зав. кафедрой поликлинической терапии
Воронеж
Дополнительные файлы
Что известно о предмете исследования?
- Свободные нуклеотиды в плазме крови являются универсальными показателями воздействия стрессового фактора.
- Изменение метаболизма свободных нуклеотидов связано с адаптационными потребностями организма в условиях повреждающего действия стрессовых агентов.
Что добавляют результаты исследования?
- Выявлено достоверное отличие уровней свободных нуклеотидов у пациентов с хронической сердечной недостаточностью в сравнении с контрольной группой, что может быть обусловлено особенностями клеточного метаболизма в условиях гипоксии.
- Уровни свободных нуклеотидов подвержены динамическим изменениям на фоне лечения, что подтверждено на примере группы пациентов со сниженной фракцией выброса.
Рецензия
Для цитирования:
Колесникова Е.В., Мячина О.В., Пашков А.Н., Пашкова А.Н. Изучение роли свободных нуклеотидов при хронической сердечной недостаточности. Кардиоваскулярная терапия и профилактика. 2025;24(1):4056. https://doi.org/10.15829/1728-8800-2025-4056. EDN: KPJTWO
For citation:
Kolesnikova E.V., Myachina O.V., Pashkov A.N., Pashkova A.A. The role of free nucleotides in heart failure. Cardiovascular Therapy and Prevention. 2025;24(1):4056. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4056. EDN: KPJTWO
JATS XML

























































