Перейти к:
Предоперационные факторы риска сердечно-сосудистых осложнений в некардиальной хирургии
https://doi.org/10.15829/1728-8800-2024-4119
EDN: IBQGPV
Аннотация
Цель. Выявление предоперационных факторов, ассоциированных с любыми сердечно-сосудистыми осложнениями (Any Cardio-Vascular Events — AnyCVE), разработка на их основе индекса риска развития AnyCVE.
Материал и методы. Проведено одноцентровое ретроспективное когортное исследование базы данных пациентов, подвергшихся некардиальным хирургическим вмешательствам в 2018 и 2020гг. В зависимости от исходов выделены 2 группы пациентов с развитием AnyCVE и без AnyCVE на госпитальном этапе после внесердечных оперативных вмешательств. Проведен сравнительный анализ >60 предоперационных показателей (ПП), отражающих состояние пациента, и показателей, характеризующих планируемое оперативное вмешательство; анализ ассоциативной связи ПП с вероятностью развития АnyCVE; построена прогностическая модель (ПМ), на основании которой разработан простой индекс риска AnyCVE. Проведено сравнение качества моделей, основанных на индексе риска AnyCVE (ПМ1) и индексе кардиального риска (ПМ2).
Результаты. Сравнительный анализ ПП пациентов с развитием AnyCVE (n=392) и без AnyCVE (n=2545) выявил статистически значимые различия по ряду показателей, которые проанализированы на наличие ассоциативных связей с вероятностью развития AnyCVE. Выявлены факторы, ассоциированные с AnyCVE: возраст ≥62 лет, уровень глюкозы ≥5,59 ммоль/л, уровень С-реактивного белка ≥2,08 г/л, D-димера ≥0,640 мкг/мл, количество хронических неинфекционных заболеваний, область операции, вид анестезиологического пособия, на основании которых разработана ПМ1. Сформирован простой индекс AnyCVE: прогностическая значимость каждого фактора оценена в баллах, сумму баллов ≥4 предложено расценивать как высокий риск развития AnyCVЕ. В стратификации риска AnyCVЕ прогностическая ценность разработанной ПМ1 (площадь под кривой 0,862 с 95% доверительным интервалом 0,721-1,000, чувствительность 69,2%, специфичность 89,5%) превосходит ПМ2, основанную на критериях индекса кардиального риска (площадь под кривой 0,578 с 95% доверительным интервалом 0,546-0,609, p<0,001, чувствительность 25,0%, специфичность 90,4%).
Заключение. Выделены предоперационные факторы, позволяющие улучшить стратификацию риска AnyCVE в некардиальной хирургии. Для практического применения предложен простой индекс риска AnyCVЕ.
Ключевые слова
Для цитирования:
Мурашко С.С., Бернс С.А., Пасечник И.Н. Предоперационные факторы риска сердечно-сосудистых осложнений в некардиальной хирургии. Кардиоваскулярная терапия и профилактика. 2024;23(10):4119. https://doi.org/10.15829/1728-8800-2024-4119. EDN: IBQGPV
For citation:
Murashko S.S., Berns S.A., Pasechnik I.N. Preoperative risk factors for cardiovascular events in non-cardiac surgery. Cardiovascular Therapy and Prevention. 2024;23(10):4119. (In Russ.) https://doi.org/10.15829/1728-8800-2024-4119. EDN: IBQGPV
Введение
Высокая значимость сердечно-сосудистых заболеваний (ССЗ) в структуре заболеваемости, смертности, а также в оценке безопасности при проведении хирургических вмешательств способствовала появлению термина MACE (Major Аdverse Сardiac Events), обозначающего "серьезные неблагоприятные кардиальные события", которые включают сердечно-сосудистую смерть, острый инфаркт миокарда (ИМ) и ишемический инсульт [1]. Исторически термин MACE начали использовать в середине 1990-х гг как комбинированную конечную точку внутрибольничных осложнений после чрескожных коронарных вмешательств. В настоящее время MACE широко используют для оценки сердечно-сосудистых осложнений (ССО) в различных клинических исследованиях, в т.ч. для оценки послеоперационных ССО. Исследования, оценивающие развитие ССО у пациентов, подвергающихся некардиальным хирургическим вмешательствам, свидетельствуют о снижении MACE с 3,9% в начале 2000-х гг [2] до 1,4-0,5% к концу второго десятилетия XXI века [3][4]. Такая тенденция MACE при некардиальных вмешательствах стала возможной благодаря внедрению в практическую врачебную деятельность рекомендаций, разработанных на основании результатов научных исследований с использованием принципов доказательной медицины. Следует отметить, что во многих современных научных исследованиях для определения конечных точек сердечно-сосудистых событий в послеоперационном периоде наряду с ИМ, инсультом, сердечно-сосудистыми смертями, стали использовать и другие события: нестабильную стенокардию, реваскуляризацию миокарда, сердечную недостаточность (СН), нарушения ритма сердца и проводимости, тромбоэмболические события и т.д. [5]. Любые осложнения, развившиеся в послеоперационном периоде, приводят к экономическим затратам, преимущественно за счет увеличения длительности госпитализации. Такое заключение было сделано на основании систематического обзора результатов 38 научных исследований [6]. Анализ течения послеоперационного периода при некардиальных хирургических вмешательствах отечественными исследователями показал, что любые ССО приводят к достоверному увеличению длительности госпитализации и сопровождаются ухудшением клинического состояния пациента. Клиническая и экономическая значимость вышеуказанного факта способствовала появлению нового термина для обозначения совокупности любых ССО в послеоперационном периоде — AnyCVE (Any Cardio-Vascular Events) [7]. Изучение факторов, не только снижающих риск смерти, но влияющих на качество и экономическую эффективность лечения, — это тренд, отражающий основные тенденции научных исследований настоящего времени [8].
Стратификации риска послеоперационных ССО начали уделять серьезное внимание с середины XXв. В 1977г Goldman Lee на основании ретроспективного анализа 1000 пациентов после некардиальных вмешательств предложил индекс кардиального риска, который в последующем был неоднократно модифицирован и в виде пересмотренного индекса сердечного риска (RСRI — Revised Cardiac Risk Index) рекомендован и наиболее часто используется в практической деятельности, несмотря на большие различия прогностической значимости данного индекса в разных медицинских учреждениях [9]. Наряду с RCRI рекомендованы к использованию и другие шкалы и индексы, включающие различный перечень показателей, порой требующих проведения дополнительных дорогостоящих исследований. Ранее предложенные прогностические модели (ПМ) имеют преимущества и ограничения, но принципиальным является то, что они были разработаны и применяются преимущественно с целью стратификации МACE [9][10]. Попытки использования рекомендованных для стратификации кардиального риска в некардиальной хирургии шкал и индексов с целью предсказания вероятности развития AnyCVE не продемонстрировали их высокую прогностическую ценность [11].
Цель исследования — выявление предоперационных факторов, ассоциированных с любыми сердечно-сосудистыми осложнениями (AnyCVE), разработка на их основе индекса риска развития AnyCVE.
Материал и методы
Проведено одноцентровое ретроспективное когортное исследование. Выполнен сравнительный анализ характеристик групп пациентов в зависимости от развития послеоперационных AnyCVE или без AnyCVE, определена ассоциативная связь предоперационных показателей (ПП) с развитием АnyCV E. Разработана ПМ1 вероятности развития АnyCVE, на основании которой предложен простой индекс риска АnyCV E. Прогностическая значимость ПМ1 оценена в сравнении с прогностической значимостью ПМ2, основанной на определении вероятности развития AnyCVЕ с использованием критериев индекса RCRI (рисунок 1).

Рис. 1 Дизайн исследования.
Примечание: ПМ1 — прогностическая модель 1, ПМ2 — прогностическая модель 2, ПП — предоперационные показатели, AnyCVE — Any Cardio-Vascular Events, RCRI — Revised Cardiac Risk Index.
База данных включала стационарные истории болезни пациентов, которым были выполнены внесердечные оперативные вмешательства в 2018 и 2020гг.
Критериями включения пациентов в группу с AnyCVE являлись любые отклонения деятельности сердечно-сосудистой системы (ССС) от нормальных значений в послеоперационном периоде: MACE, динамика сегмента ST-T на электрокардиограмме (ЭКГ), острая или декомпенсация хронической СН, нарушения ритма и проводимости сердца, включающие пароксизмы фибрилляции предсердий, суправентрикулярной тахикардии, частой желудочковой экстрасистолии ≥3 класса по Лауну, впервые зарегистрированные нарушения проводимости или прогрессирование ранее имеющейся степени нарушений проводимости сердца, колебания артериального давления (АД) в виде эпизодов гипотонии (снижение систолического АД (САД) <90 мм рт.ст.) или гипертонии (повышение САД >160 мм рт.ст.), кровотечения >500 мл, тромбоэмболические осложнения (ТЭО), послеоперационный делирий.
Период наблюдения для регистрации развития послеоперационных AnyCVE соответствовал периоду стационарного лечения.
Критериями невключения в исследование были случаи оперативного вмешательства офтальмологического профиля в связи с узким спектром хирургического вмешательства и короткими сроками стационарного наблюдения (1-2 сут.) и эндокринологического профиля в связи с малым количеством оперативных вмешательств данного профиля.
Для сравнительной характеристики групп пациентов с развитием AnyCVE и без AnyCVE и выявления предоперационных предикторов, связанных с развитием послеоперационных осложнений, был проведен анализ >60 ПП:
— половозрастные и антропометрические данные пациентов: возраст, вес (кг), рост (см), индекс массы тела (ИМТ) (кг/м²), пол — женский (Ж), мужской (М);
— сопутствующие заболевания: хронические неинфекционные заболевания (ХНИЗ) — хронические заболевания системы кровообращения — ССЗ, хронические заболевания дыхательной системы (ДЗ), сахарный диабет (СД), новообразования и другие сопутствующие заболевания органов и систем — желудочно-кишечного тракта, урологические, гинекологические, неврологические, психиатрические, опорно-двигательной системы;
— физикальные данные пациентов, характеризующие деятельность ССС перед операцией — уровень САД и диастолического АД (ДАД), частота сердечных сокращений (ЧСС);
— лабораторные данные перед оперативным вмешательством: гемоглобин (Нb) г/л, эритроциты ×10¹²/л, гематокрит (Hct)%, лейкоциты ×10⁹/л, палочкоядерные нейтрофилы%, скорость оседания эритроцитов (СОЭ) мм/ч, тромбоциты ×10⁹/л, активированное частичное тромбопластиновое время (аЧТВ) сек, фибриноген г/л, международное нормализованное отношение (МНО), D-димер мкг/мл, глюкоза ммоль/л, холестерин моль/л, калий ммоль/л, натрий ммоль/л, железо мкмоль/л, мочевина ммоль/л, креатинин мкмоль/л, скорость клубочковой фильтрации (СКФ) мл/мин/1,73 м², общий белок г/л, аспарагинаминотрансфераза (АСТ) Ед/л, аланинаминотрансфераза (АЛТ) Ед/л, С-реактивный белок (СРБ) г/л, микроскопия мочи — белок г/л, глюкоза ммоль/л, лейкоциты в поле зрения, эритроциты в поле зрения;
— любые отклонения от референсных значений результатов инструментальных исследований перед оперативным вмешательством: ЭКГ, холтеровского мониторирования ЭКГ (ХМ-ЭКГ), эхокардиографического исследования (ЭхоКГ), цветового дуплексного сканирования сосудов (ЦДС), функции внешнего дыхания (ФВД), рентгенологического исследования органов грудной клетки (R), мультиспиральной компьютерной томография (МСКТ), ультразвукового исследования (УЗИ), эзофагогастродуоденоскопии (ЭГДС), колонофиброскопии (КФС);
— данные об оперативном вмешательстве: наличие операций в анамнезе, срочность оперативного вмешательства (планово, экстренно), профиль операции по области вмешательства (абдоминальная, гинекология, урология, травматология-ортопедия, нейрохирургия, колопроктология, эндоскопия, кожа и подкожная клетчатка, венозные сосуды), вид анестезиологического пособия (тотальная внутривенная анестезия (ТВА), местная инфильтративная, региональная, комбинированная анестезия (КОА), сочетанная).
Для оценки RCRI использовали 6 предикторов риска серьезных ССО: хирургическое вмешательство высокого риска, наличие в анамнезе ишемической болезни сердца, СН, транзиторной ишемической атаки/инсульта, предоперационная инсулинотерапия, предоперационный уровень креатинина >176,8 мкмоль/л (2 мг/дл) или клиренса креатинина <30 мл/мин [10].
Статистический анализ проводился с использованием программы StatTech v. 4.1.2 (разработчик — ООО "Статтех", Россия). Категориальные данные представлены с указанием абсолютных значений и процентных долей. Сравнение процентных долей при анализе многопольных таблиц сопряженности выполнялось с помощью критерия χ² Пирсона или точного критерия Фишера.
Количественные показатели оценивались на предмет соответствия нормальному распределению. В случае распределения, отличного от нормального, количественные данные описывались с помощью медианы (Me) и интерквартильного размаха (Q25-Q75). Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна-Уитни. Сравнение ≥3 групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью критерия Краскела-Уоллиса, апостериорные сравнения — с помощью критерия Данна с поправкой Холма. Различия считались статистически значимыми при p<0,05.
Применяли одномерную логистическую регрессию для выбора переменных, впервые входящих в регрессионную модель. Для количественных переменных разделяющее значение в точке cut-off определялось по значению индекса Юдена. Построение многофакторной ПМ1 проведено с помощью многомерного логистического регрессионного анализа с применением метода пошагового отбора предикторов AnyCVE.
Каждой переменной ПМ1 с учетом ее значимости присвоена балльная оценка для создания простого индекса риска AnyCVE.
С помощью логистической регрессии создана ПМ2 вероятности развития AnyCVE в зависимости от предикторов риска индекса RCRI.
С использованием ROC-анализа проведено сравнение прогностической значимости ПМ1 (на основании простого индекса риска AnyCVE) и ПМ2 (на основании индекса RCRI) в стратификации риска AnyCVE.
Качество ПМ оценивалось с помощью определения площади под ROC-кривой (AUС): AUС =0,50-0,59 — плохое качество модели, 0,60-0,69 — среднее качество, 0,70-0,79 — удовлетворительная прогностическая ценность модели, 0,80-0,89 — хорошая прогностическая ценность, результат ≥0,9 — отличная прогностическая ценность. Чувствительность определялась как доля истинно положительных результатов среди всех исследуемых случаев с развитием AnyCVE. Специфичность определялась как доля истинно отрицательных результатов среди всех оцениваемых случаев без AnyCVE.
Результаты
После применения критериев невключения были выделены две группы — с развитием AnyCVE (n=392) и без развития AnyCVE (n=2545) в послеоперационном периоде. Сравнительный анализ ПП данных групп выявил статистически значимые различия по следующим переменным:
- возраст, рост;
- ХНИЗ, из них чаще ССЗ, СД, злокачественные новообразования, патология нервной системы (перенесенное ранее нарушение мозгового кровообращения или транзиторная ишемическая атака, дисциркуляторная энцефалопатия 2-3 стадии) и психические неэндогенные расстройства;
- уровень САД, ЧСС при поступлении;
- уровень Нb, эритроцитов, Нct, лейкоцитов, палочкоядерных нейтрофилов, СОЭ, фибриногена, МНО, D-димера, глюкозы, мочевины, СКФ, общего белка, АЛТ, СРБ, белка в моче, глюкозы в моче, лейкоцитов в моче;
- отклонение от нормальных показателей ЭхоКГ, ХМ-ЭКГ, КФС;
- срочность оперативного вмешательства (планово, экстренно), область операции, планируемая анестезия.
ПП, по которым различались исследуемые группы, были проанализированы на наличие статистически значимых ассоциативных связей с AnyCVE (таблица 1).
Таблица 1
Значимость предоперационных показателей в прогнозировании послеоперационных AnyCVE
|
Показатель |
AUC (95% ДИ) |
Точка отсечения |
Чувствительность, %/ специфичность, % |
р |
OR (95% ДИ) |
p |
|
Возраст, лет |
0,633 (0,601-0,664) |
62 |
62,0/58,3 |
<0,001 |
1,034 (1,026-1,043) |
<0,001 |
|
Рост, см |
0,563 (0,534-0,593) |
168 |
49,2/61,9 |
<0,001 |
0,988 (0,979-0,996) |
0,004 |
|
ССЗ |
0,599 (0,567-0,630) |
0,184 |
62,0/57,8 |
<0,001 |
2,230 (1,791-2,776) |
<0,001 |
|
СД |
0,541 (0,510-0,572) |
0,215 |
18,6/89,5 |
<0,001 |
1,961 (1,476-2,606) |
<0,001 |
|
Онкологические заболевания |
0,533 (0,502-0,564) |
0,229 |
13,8/92,8 |
<0,001 |
2,074 (1,499-2,869) |
<0,001 |
|
Неврологические заболевания |
0,556 (0,524-0,587) |
0,262 |
19,6/91,5 |
<0,001 |
2,622 (1,972-3,487) |
<0,001 |
|
Психиатрические заболевания |
0,519 (0,488-0,550) |
0,286 |
6,1/97,6 |
<0,001 |
2,701 (1,662-4,393) |
<0,001 |
|
Количество ХНИЗ, n |
0,612 (0,580-0,643) |
1 |
66,6/51,9 |
<0,001 |
1,565 (1,397-1,754) |
<0,001 |
|
Сопутствующие заболевания, n |
0,580 (0,548-0,611) |
3 |
55,4/60,3 |
<0,001 |
1,271 (1,162-1,391) |
<0,001 |
|
САД, мм рт.ст. |
0,542 (0,511-0,573) |
127 |
48,3/58,9 |
0,006 |
1,009 (1,002-1,015) |
0,007 |
|
ЧСС, уд./мин |
0,559 (0,528-0,591) |
70 |
56,1/53,2 |
<0,001 |
– |
|
|
Нb, г/л |
0,589 (0,557-0,621) |
136 |
57,1/55,8 |
<0,001 |
0,980 (0,973-0,987) |
<0,001 |
|
Эритроциты ×10¹²/л |
0,581 (0,548-0,613) |
4,4 |
51,3/62,6 |
<0,001 |
0,551 (0,438-0,692) |
<0,001 |
|
Hct, % |
0,589 (0,556-0,622) |
36,9 |
34,7/78,6 |
<0,001 |
0,922 (0,898-0,947) |
<0,001 |
|
Лейкоциты ×10⁹/л |
0,590 (0,555-0,625) |
8,0 |
47,7/68,8 |
<0,001 |
1,115 (1,081-1,151) |
<0,001 |
|
Палочкоядерные нейтрофилы, % |
0,594 (0,557-0,630) |
3,0 |
35,6/81,1 |
<0,001 |
1,118 (1,069-1,168) |
<0,001 |
|
СОЭ, мм/ч |
0,590 (0,552-0,628) |
16 |
43,4/70,6 |
<0,001 |
1,018 (1,011-1,024) |
<0,001 |
|
Фибриноген, г/л |
0,561 (0,517-0,605) |
3,67 |
46,0/66,0 |
<0,001 |
1,309 (1,138-1,505) |
<0,001 |
|
МНО |
0,559 (0,520-0,599) |
1,09 |
19,9/89,9 |
0,003 |
2,235 (1,141-4,375) |
0,019 |
|
D-димер, мкг/мл |
0,792 (0,676-0,908) |
0,64 |
68,0/80,0 |
<0,001 |
2,634 (1,411-4,914) |
0,002 |
|
Глюкоза, ммоль/л |
0,608 (0,564-0,652) |
5,59 |
66,0/54,8 |
<0,001 |
1,115 (1,025-1,213) |
0,011 |
|
Мочевина, ммоль/л |
0,591 (0,550-0,632) |
6,2 |
49,8/66,9 |
<0,001 |
1,089 (1,044-1,137) |
<0,001 |
|
СКФ, мл/мин/1,73 м² |
0,580 (0,543-0,617) |
89,75 |
60,8/53,6 |
<0,001 |
0,993 (0,989-0,997) |
<0,001 |
|
Общий белок, г/л |
0,583 (0,545-0,621) |
68,4 |
39,9/74,2 |
<0,001 |
0,938 (0,915-0,963) |
<0,001 |
|
АЛТ, Ед/л |
0,558 (0,564-0,719) |
18,6 |
51,5/61,1 |
0,004 |
– |
|
|
СРБ, г/л |
0,642 (0,564-0,719) |
2,08 |
45,6/81,5 |
<0,001 |
1,077 (1,031-1,125) |
0,001 |
|
Белок в моче, г/л |
0,551 (0,509-0,592) |
0,124 |
24,9/85,5 |
0,005 |
– |
|
|
Глюкоза в моче, ммоль/л |
0,513 (0,471-0,554) |
0,001 |
4,6/97,9 |
0,026 |
– |
|
|
Лейкоциты в моче, в поле зрения |
0,555 (0,513-0,597) |
20 |
26,4/84,0 |
<0,001 |
1,006 (1,004-1,009) |
<0,001 |
|
ХМ-ЭКГ с патологическими отклонениями |
0,604 (0,473-0,735) |
0,391 |
89,3/31,6 |
0,037 |
3,846 (1,026-14,411) |
0,046 |
|
ЭхоКГ с патологическими отклонениями |
0,584 (0,505-0,664) |
0,338 |
63,4/53,4 |
0,016 |
1,986 (1,133-3,480) |
0,017 |
|
КФС с патологическими отклонениями |
0,555 (0,442-0,669) |
0,250 |
17,2/93,8 |
0,032 |
0,317 (0,106-0,949) |
0,040 |
|
Операции в анамнезе |
0,545 (0,514-0,576) |
0,158 |
51,0/58,0 |
<0,001 |
1,438 (1,162-1,781) |
0,001 |
|
Срочность операции |
0,525 (0,494-0,556) |
0,207 |
12,0/92,9 |
<0,001 |
1,790 (1,274-2,517) |
0,001 |
|
Область операции |
0,621 (0,590-0,652) |
0,142 |
71,4/47,9 |
<0,001 |
– |
|
|
Абдоминальный профиль |
0,527 (0,496-0,558) |
0,182 |
17,3/88,0 |
0,003 |
1,536 (1,152-2,047) |
0,003 |
|
Гинекологический профиль |
0,536 (0,505-0,568) |
0,144 |
89,3/18,0 |
<0,001 |
0,568 (0,411-0,784) |
<0,001 |
|
Урологический профиль |
– |
– |
– |
1,094 (0,849-1,409) |
0,489 |
|
|
Травматолого-ортопедический профиль |
0,551 (0,520-0,583) |
0,204 |
25,8/84,5 |
<0,001 |
1,895 (1,475-2,434) |
<0,001 |
|
Нейрохирургический профиль |
0,536 (0,505-0,567) |
0,143 |
91,6/15,6 |
<0,001 |
0,499 (0,344-0,724) |
<0,001 |
|
Колопроктологический профиль |
– |
– |
– |
0,393 (0,142-1,086) |
0,062 |
|
|
Эндоскопический профиль |
0,517 (0,486-0,547) |
0,138 |
92,9/10,5 |
0,042 |
0,659 (0,440-0,988) |
0,042 |
|
Кожа и подкожная клетчатка |
– |
– |
– |
0,954 (0,371-2,455) |
0,922 |
|
|
Сосудистый профиль (вены) |
0,511 (0,480-0,542) |
0,206 |
5,4/96,8 |
0,029 |
1,722 (1,053-2,817) |
0,029 |
|
Вид анестезии |
0,657 (0,626-0,688) |
0,164 |
80,4/45,2 |
<0,001 |
– |
|
|
ТВА |
0,610 (0,579-0,641) |
0,171 |
86,2/35,8 |
<0,001 |
0,287 (0,213-0,387) |
<0,001 |
|
Местная анестезия |
0,518 (0,487-0,549) |
0,138 |
94,1/9,4 |
0,021 |
0,558 (0,359-0,867) |
0,021 |
|
Регионарная анестезия |
0,533 (0,502-0,564) |
0,177 |
23,2/83,4 |
0,001 |
1,517 (1,173-1,960) |
<0,001 |
|
КОА |
0,550 (0,519-0,581) |
0,164 |
46,2/63,8 |
<0,001 |
1,513 (1,221-1,874) |
<0,001 |
|
Сочетанная анестезия |
0,545 (0,514-0,576) |
0,457 |
11,0/98,0 |
<0,001 |
6,025 (3,955-9,179) |
<0,001 |
Примечание: АЛТ — аланинаминотрансфераза, ДИ — доверительный интервал, КОА — комбинированная анестезия, КФС — колонофиброскопия, ИМ — инфаркт миокарда, МНО — международное нормализованное отношение, САД — систолическое артериальное давление, СД — сахарный диабет, СКФ — скорость клубочковой фильтрации, СОЭ — скорость оседания эритроцитов, ССЗ — сердечно-сосудистые заболевания, СРБ — С-реактивный белок, ТВА — тотальная внутривенная анестезия, ХМ-ЭКГ — холтеровское мониторирование электрокардиограммы, ХНИЗ — хронические неинфекционные заболевания, ЧСС — частота сердечных сокращений, ЭхоКГ — эхокардиографическое исследование, AUC — Area Under the ROC Curve (площадь под ROC-кривой), OR — Odds Ratio (отношение шансов), Нb — гемоглобин, Hct — гематокрит.
Шансы развития AnyCVE достоверно увеличивались с возрастом, при наличии ХНИЗ, особенно ССЗ, СД, неврологических, психиатрических заболеваний, при более высоком уровне в крови перед операцией маркеров воспаления, глюкозы, МНО, D-димера, при экстренном оперативном вмешательстве, при абдоминальной, травматологической операции, регионарной, комбинированной или сочетанной анестезии, при наличии в анамнезе указания на ранее перенесенное оперативное вмешательство.
Шансы развития AnyCVE были достоверно ниже у пациентов более высокого роста, с более высоким уровнем Нb, эритроцитов, Hct, CКФ перед операцией, с оперативным вмешательством гинекологического, нейрохирургического, колопроктологического, эндоскопического профиля.
Одномерный логистический регрессионный анализ выявил, что большинство показателей характеризовалось неудовлетворительным качеством в предсказании AnyCVE. Среднее качество моделей выявлено со следующими переменными: возраст, наличие ≥1 ХНИЗ, уровень глюкозы, СРБ, выявление патологических изменений по данным ХМ-ЭКГ, области операции, вида анестезиологического пособия. Хорошее качество показала прогностическая модель вероятности развития AnyCVE с использованием фактора риска D-димер.
В результате многомерного логистического регрессионного анализа с пошаговым отбором из вышеуказанных переменных были отобраны 7 ПП и получена ПМ1 хорошего качества (ROC-анализ): AUC 0,862 с 95% доверительным интервалом (ДИ): 0,721-1,000, p<0,001, чувствительность 69,2%, специфичность 89,5% (рисунок 2).

Рис. 2 ROC-кривая, ПМ1 (AUC 0,862 с 95% ДИ: 0,721-1,000, чувствительность 69,2%, специфичность 89,5%).
Примечание: ДИ — доверительный интервал, ПМ1 — прогностическая модель 1, AUC — Area Under the ROC Curve (площадь под ROC-кривой).
На основании ПМ1 для использования в практической деятельности нами предложен простой индекс риска AnyCVE, в котором каждому фактору присвоена балльная оценка его прогностического веса: ХНИЗ по 1 баллу за каждое заболевание, возраст ≥62 года (1 балл), уровень глюкозы ≥5,59 ммоль/л (1 балл), уровень СРБ ≥2,08 г/л (1 балл), уровень D-димера ≥0,640 мкг/мл (1 балл), область операции абдоминальная (1 балл), травматология-ортопедия (1 балл), вид анестезии: регионарная (1 балл), комбинированная (1 балл), сочетанная (6 баллов). Вероятность развития AnyCVE оценивалась как высокая при индексе риска AnyCVE ≥4 балла.
Построена ПМ2 вероятности развития AnyCVE в зависимости от факторов риска индекса RCRI (AUC 0,578 с 95% ДИ: 0,546-0,609, p<0,001, чувствительность 25,0%, специфичность 90,4%), прогностическая ценность которой уступает ПМ1 (рисунок 3).
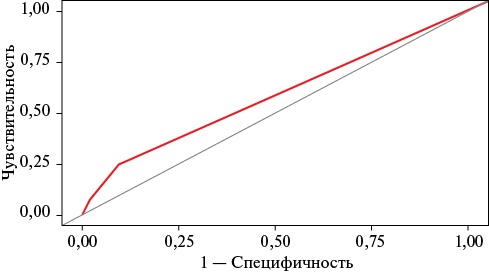
Рис. 3 ROC-кривая, ПМ2 (AUC 0,578 с 95% ДИ: 0,546-0,609, p<0,001, чувствительность 25,0%, специфичность 90,4%).
Примечание: ДИ — доверительный интервал, ПМ2 — прогностическая модель 2, AUC — Area Under the ROC Curve (площадь под ROC-кривой).
Обсуждение
В настоящем исследовании получены новые данные по проблеме послеоперационных ССО в некардиальной хирургии: впервые проанализированы характеристики ПП групп пациентов в зависимости от развития AnyCVE, оценены ассоциативные связи между вероятностью развития AnyCVE и ПП, построена ПМ и предложен к практическому применению простой индекс риска AnyCVE, проанализированы особенности и общие тенденции с результатами работ по оценке рисков MACE.
Действующие рекомендации Российского кардиологического общества и Европейского общества кардиологов демонстрируют поиск новых прогностических инструментов для стратификации риска не только серьезных ССО, но и других периоперационных сердечно-сосудистых состояний [9][12]. Учет любых хирургических послеоперационных осложнений согласно широко используемой классификации Clavien-Dindo показал, что даже развитие осложнений 1-й ст. (по данной классификации) приводит к увеличению стоимости случая лечения в 2 раза [13]. Целью настоящего исследования было определение предоперационных факторов AnyCVE в рамках поиска решения современных задач снижения риска любых послеоперационных ССО.
Среди рекомендованных шкал и индексов наиболее широко в практическом здравоохранении используется индекс RCRI, разработанный Thomas Henry Lee в 1999г на основании исследования данных 2893 пациентов для оценки риска серьезных ССО с использованием 6 простых показателей. Многочисленные исследования свидетельствуют о невысокой прогностической значимости данного индекса и большой вариации ценности других шкал и индексов, направленных преимущественно на стратификацию МACE [10][11]. На когорте исследуемых нами пациентов ПМ с использованием показателей индекса RCRI продемонстрировала неудовлетворительное качество (AUC 0,578).
Настоящее исследование проведено на основании анализа 2937 историй болезни. Выделены ПП, ассоциированные с риском развития AnyCVE: возраст, ХНИЗ, уровень глюкозы, СРБ, D-димера, область операции, вид анестезии.
Возраст >65 лет является одним из первичных признаков при стратификации как абсолютного сердечно-сосудистого риска в популяции, так и при выделении группы высокого риска ССО в некардиальной хирургии, согласно рекомендациям Европейского общества кардиологов и Российского кардиологического общества [9][12]. В представленном исследовании медиана возраста в группе пациентов с развитием AnyCVE составила 65 лет (55,00-73,00), в группе пациентов без AnyCVE — 58 (44-68) лет. При увеличении возраста на 1 год шансы развития AnyCVE увеличивались в 1,034 раза, AUC модели вероятности развития AnyCVE в зависимости от возраста 0,633±0,016 с 95% ДИ: 0,601-0,664, пороговое значение в точке cut-off, которому соответствовало наивысшее значение индекса Юдена, составило 62 года. По данным зарубежного рандомизированного исследования послеоперационных исходов среди >55 млн пациентов >45 лет, риск развития MACE, включая госпитальную смерть, ИМ, ишемический инсульт, в возрасте 45-64 лет имели 1,7% пациентов, 65-74 лет — 2,8%, 75-84 лет — 4,5%, >85 лет — 6,9% пациентов, среди прооперированных пациентов 52,3% составили лица >65 лет [14].
Известно, что пациенты, имеющие заболевания сердца или факторы сердечно-сосудистого риска, имеют значительно более высокий риск периоперационных ССО. Согласно этапным данным национального обсервационного многоцентрового исследования "Роль сопутствующих заболеваний в стратификации риска послеоперационных осложнений в абдоминальной хирургии — STOPRISK" частота послеоперационных осложнений коррелирует с коморбидностью; среди пациентов без сопутствующих заболеваний послеоперационные осложнения не превышали 1,3%, при наличии 1-3 сопутствующих заболеваний составляли 3,4-5,7%, среди пациентов с ≥4 сопутствующими заболеваниями осложнения развились в 12% случаев [15]. В настоящем исследовании прослеживаются аналогичные тенденции — среди 392 пациентов с AnyCVE 261 (66,6%) пациент имел ХНИЗ, среди которых преобладали пациенты с ССЗ (243 человека, 93,1%). В группе с AnyCVE в среднем у пациентов имелось >3 сопутствующих заболеваний, в группе без AnyCVE — не >2 сопутствующих заболеваний. При наличии у пациента нескольких ХНИЗ шансы развития AnyCVE увеличивались в 1,565 раза с каждым заболеванием.
Наряду с важностью предоперационного выявления имеющихся у пациента сопутствующих заболеваний, клинические национальные рекомендации свидетельствуют о целесообразности проведения стандартных лабораторных тестов, таких как определение уровня Нb, креатинина у пациентов, готовящихся к операции среднего и высокого риска, уровня сердечного тропонина (сTn) и N-концевого промозгового натрийуретического пептида (NT-proBNP) у пациентов высокого риска хирургического вмешательства [12]. Повышение уровня сTn и NT-proBNP связано с увеличением риска смерти, что делает периоперационный контроль этих показателей перспективным методом оценки периоперационного риска [16], однако экономические затраты на проведение данных лабораторных тестов не позволяют применять их с необходимой частотой. В настоящем исследовании определение уровней сTn и NT-proBNP проводилось по клиническим показаниям, а не всем пациентам с ССЗ, подвергшимся хирургическим вмешательствам высокого риска, в связи с чем данные показатели не были включены в перечень ПП для сравнения. Среди стандартных лабораторных тестов были получены статистически значимые прогностические влияния предоперационного уровня глюкозы натощак с пороговым значением 5,59 ммоль/л (AUC 0,608, 95% ДИ: 0,564-0,652); СРБ с пороговым значением 2,08 г/л (AUC 0,642, 95% ДИ: 0,564-0,719); D-димера с пороговым значением 0,64 мкг/мл (AUC 0,792, 95% ДИ: 0,676-0,908). В литературе часто выделяют СД как независимый предиктор послеоперационных осложнений, при этом дискутируется влияние уровня глюкозы натощак в периоперационном периоде и предоперационного уровня гликированного гемоглобина на послеоперационные осложнения — различными научными сообществами указываются разные прогностические интервалы уровня гликемии [17]. Большинство исследователей приходят к выводу, что независимо от типа СД чем выше уровень гликемии и вариабельность гликемии в периоперационном периоде, тем более высок риск осложнений и длительность госпитализации [18]. СРБ указывается наряду с NT-proBNP как независимый сильный предиктор MACE и делирия [19][20]. Общепризнанным считается факт, что повышенный уровень D-димера является маркером повышенного риска ТЭО. Предлагается сочетать оценку уровня D-димера до операции с оценкой клинико-анамнестических данных и динамикой уровня D-димера в раннем послеоперационном периоде для стратификации риска послеоперационных осложнений [21].
Анализ нескольких зарубежных популяционных исследований и программ, на основании которых созданы национальные регистры послеоперационных исходов, демонстрирует распределение частоты развития послеоперационных осложнений в зависимости от области хирургии в порядке убывания следующим образом: кардиохирургия (57%), нейрохирургия (38,8%), торакальная хирургия (26,4%), сосудистая хирургия (25,6%), операции на брюшной полости (24,3-24,4%), челюстно-лицевая хирургия (14-64%), ортопедия-травматология (16,5%), печень и желчевыводящие пути (16%), урология (14,8%), операции на молочной железе (8,3%), гинекология (3,7-6,5%), эндокринная хирургия (0,4-22,1%), акушерство (0,4-2,8%) [22]. В настоящем исследовании AnyCVE зарегистрированы после сосудистых операций в 20,6% случаев, травматолого-ортопедических операций в 20,4%, абдоминальных в 18,2%, урологических в 14,2%, операций на коже и подкожной клетчатке в 12,8%, эндоскопических в 9,5%, гинекологических в 8,4%, нейрохирургических в 7,7%, колопроктологических в 5,8% случаев. Состав группы пациентов c AnyCVE в зависимости от проведенного оперативного вмешательства представлен следующими профилями: травматология-ортопедия (25,8%), урология (23,0%), абдоминальная хирургия (17,3%), гинекология (10,7%), нейрохирургия (8,4%), эндоскопия (7,1%), хирургия на венозных сосудах (5,4%), операции на коже и подкожной клетчатке (1,3%).
В зависимости от вида анестезии нами выявлена ассоциативная связь развития AnyCVE с сочетанной анестезией в 45,7% случаях, после регионарной анестезии мы наблюдали AnyCVE в 17,7% случаев, после КОА — 16,4%, после местной анестезии — 8,7%, после ТВА — 5,6% случаев. Среди пациентов с развитием AnyCVE преобладали пациенты после КОА (46,2%), после регионарной анестезии доля пациентов с AnyCVE составила 23,3%, после ТВА — 13,8%, после сочетанной анестезии — 11,0%, после местной анестезии — 5,9%. По литературным данным регионарная анестезия лучше обеспечивает антиноцицептивную защиту, создает предпосылки для снижения частоты ТЭО и кровотечений, уменьшает длительность послеоперационного пребывания в стационаре, однако увеличивает риск развития гипотонии [23]. В другом исследовании достоверных различий в развитии послеоперационных ССО в зависимости от вида анестезии (общая или нейроаксиальная) получено не было [24].
Ограничения исследования. Ретроспективный анализ предоперационных данных в поиске факторов риска развития AnyCVE мог быть сопряжен с ошибками информации в архивных историях болезни; дизайн исследования, включающий одномерный логистический регрессионный анализ >60 ПП, имеет ограничения, связанные с возможными недоучтенными факторами, конфаундерными влияниями; результаты исследования по анализу предоперационных факторов риска развития AnyCVE проблематично сравнивать с другими исследованиями, имеющими конечными точками MACE; требуется проведение валидации разработанного простого индекса риска AnyCVE.
Заключение
Выполненное исследование позволило определить факторы, ассоциированные с риском развития AnyCVE. На основании разработанной ПМ создан простой индекс риска AnyCVE, который базируется на показателях, входящих в стандартное предоперационное обследование пациентов, прост в вычислении и превосходит RСRI в стратификации риска ССО в некардиальной хирургии.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Kip KE, Hollabaugh K, Marroquin OC, Williams DO. The problem with composite end points in cardiovascular studies: the story of major adverse cardiac events and percutaneous coronary intervention. J Am Coll Cardiol. 2008;51(7):701-7. doi:10.1016/j.jacc.2007.10.034.
2. Devereaux PJ, Goldman L, Cook DJ, et al. Perioperative cardiac events in patients undergoing noncardiac surgery: a review of the magnitude of the problem, the pathophysiology of the events and methods to estimate and communicate risk. CMAJ. 2005;173(6):627-34. doi:10.1503/cmaj.050011.
3. Smilowitz NR, Berger JS. Perioperative Cardiovascular Risk Assessment and Management for Noncardiac Surgery: A Review. JAMA. 2020;324(3):279-90. doi:10.1001/jama.2020.7840.
4. Peterson BR, Cotton A, Foy AJ. Reevaluating the Cardiac Risk of Noncardiac Surgery Using the National Surgical Quality Improvement Program. Am J Med. 2021;134(12):1499-505. doi:10.1016/j.amjmed.2021.07.016.
5. Bosco E, Hsueh L, McConeghy KW, et al. Major adverse cardiovascular event definitions used in observational analysis of administrative databases: a systematic review. BMC Med Res Methodol. 2021;21(1):241. doi:10.1186/s12874-021-01440-5.
6. Patel AS, Bergman A, Moore BW, et al. The economic burden of complications occurring in major surgical procedures: a systematic review. Appl Health Econ Health Policy. 2013;11:577-92. doi:10.1007/s40258-013-0060-y.
7. Мурашко С. С., Бернс С. А., Пасечник И. Н. Сердечно-сосудистые осложнения в некардиальной хирургии: что остается вне поля зрения? Кардиоваскулярная терапия и профилактика. 2024;23(1):3748. doi:10.15829/1728-8800-2024-3748.
8. Gal D, Thijs B, Glänzel W, Sipido KR. Hot topics and trends in cardiovascular research. Eur Heart J. 2019;40(28):2363-74. doi:10.1093/eurheartj/ehz282.
9. Сумин А. Н., Дупляков Д. В., Белялов Ф. И. и др. Рекомендации по оценке и коррекции сердечно-сосудистых рисков при несердечных операциях. Российский кардиологический журнал. 2023;28(8):5555. doi:10.15829/1560-4071-2023-5555. EDN MQQWMW.
10. Moraes CMT, Corrêa LM, Procópio RJ, et al. Tools and scores for general and cardiovascular perioperative risk assessment: a narrative review. Rev Col Bras Cir. 2022;49:e20223124. doi:10.1590/0100-6991e-20223124.
11. Мурашко С. С., Бернс С. А., Пасечник И. Н. Стратификация риска хирургических и сердечно-сосудистых осложнений в некардиальной хирургии: прогностическая значимость рекомендуемых шкал. Кардиоваскулярная терапия и профилактика. 2024;23(7):4016. doi:10.15829/1728-8800-2024-4016. EDN: MCKFPK.
12. Halvorsen S, Mehilli J, Cassese S, et al. 2022 ESC Guidelines on cardiovascular assessment and management of patients undergoing non-cardiac surgery [published correction appears in Eur Heart J. 2023;44(42):4421. doi:10.1093/eurheartj/ehad577]. Eur Heart J. 2022;43(39):3826-924. doi:10.1093/eurheartj/ehac270.
13. De la Plaza Llamas R, Ramia JM. Cost of postoperative complications: How to avoid calculation errors. World J Gastroenterol. 2020;26(21):2682-90. doi:10.3748/wjg.v26.i21.2682.
14. Banco D, Dodson JA, Berger JS, Smilowitz NR. Perioperative cardiovascular outcomes among older adults undergoing in-hospital noncardiac surgery. J Am Geriatr Soc. 2021;69(10):2821-30. doi:10.1111/jgs.17320.
15. Заболотских И. Б., Трембач Н. В., Магомедов М. А. и др. Структура и частота сопутствующих заболеваний и связанных с ними послеоперационных осложнений: национальное наблюдательное многоцентровое исследование STOPRISK. Вестник интенсивной терапии имени А. И. Салтанова. 2023; (3):43-57. doi:10.21320/1818-474X-2023-3-43-57.
16. Kuthiah N, Er C. Myocardial injury in non-cardiac surgery: complexities and challenges. Singapore Med J. 2020;61(1):6-8. doi:10.11622/smedj.2020004.
17. Кременчугская Т. А., Кубышкин В. А., Самоходская Л. М. Риск развития послеоперационных осложнений при гипергликемических состояниях. Хирургия. Журнал им. Н. И. Пирогова. 2023;1:67-73. doi:10.17116/hirurgia202301167.
18. Nair BG, Neradilek MB, Newman SF, Horibe M. Association between acute phase perioperative glucose parameters and postoperative outcomes in diabetic and non-diabetic patients undergoing non-cardiac surgery. Am J Surg. 2019;218(2):302-10. doi:10.1016/j.amjsurg.2018.10.024.
19. Ayob F, Lam E, Ho G, et al. Pre-operative biomarkers and imaging tests as predictors of post-operative delirium in non-cardiac surgical patients: a systematic review. BMC Anesthesiol. 2019;19(1):25. doi:10.1186/s12871-019-0693-y.
20. Li P, Lei Y, Li Q, et al. Diagnosing Perioperative Cardiovascular Risks in Noncardiac Surgery Patients. J Anal Methods Chem. 2019;2019:6097375. doi:10.1155/2019/6097375.
21. Бервицкий А. В., Гужин В. Э., Мойсак Г. И. и др. Новый алгоритм стратификации риска венозных тромбоэмболических осложнений в плановой нейрохирургии и его прогностическая значимость. Вопросы нейрохирургии имени Н. Н. Бурденко. 2022;86(6):7-15. doi:10.17116/neiro2022860617.
22. Заболотских И. Б., Белкин А. А., Григорьев Е. В. и др. Национальный регистр послеоперационных исходов — RuSOS: протокол исследования. Вестник интенсивной терапии имени А. И. Салтанова. 2024;(1):158-67. doi:10.21320/1818-474X-2024-1-158-167.
23. Недбайло И. Н. Сравнительный анализ влияния нейроаксиального блока и комбинированной анестезии на основные показатели физикального статуса и "рутинные" лабораторные показатели в раннем послеоперационном периоде. Современные проблемы науки и образования. 2020;5. doi:10.17513/spno.30157.
24. Yeh HW, Yeh LT, Chou YH, et al. Risk of Cardiovascular Disease Due to General Anesthesia and Neuraxial Anesthesia in Lower-Limb Fracture Patients: A Retrospective Population-Based Cohort Study. Int J Environ Res Public Health. 2019;17(1):33. doi:10.3390/ijerph17010033.
Об авторах
С. С. МурашкоРоссия
Мурашко Светлана Степановна — к.м.н., зам. главного врача, доцент кафедры анестезиологии и реаниматологии.
Москва
С. А. Бернс
Россия
Бернс Светлана Александровна — д.м.н., профессор, зав. кафедрой терапии и общей врачебной практики.
Москва
И. Н. Пасечник
Россия
Пасечник Игорь Николаевич — д.м.н., профессор, зав. кафедрой анестезиологии и реаниматологии.
Москва
Дополнительные файлы
Что известно о предмете исследования?
- Используемые в настоящее время прогностические факторы и модели разрабатывались для предсказания вероятности развития MACE (Major Adverse Cardiac Events).
Что добавляют результаты исследования?
- Впервые представлена сравнительная характеристика предоперационных показателей у пациентов, подвергшихся некардиальным оперативным вмешательствам, в зависимости от развития в послеоперационном периоде АnyCVE (Any Cardio-Vascular Events) и без AnyCVE.
- Выделены предоперационные факторы, связанные с увеличением отношения шансов (OR — Odds Ratio) развития AnyCVE, и имеющие прогностическую ценность в предсказании развития AnyCVE.
- Создана модель, включающая 7 предоперационных факторов и обладающая хорошим прогностическим качеством, на основе которой предложен простой индекс риска AnyCVЕ.
Рецензия
Для цитирования:
Мурашко С.С., Бернс С.А., Пасечник И.Н. Предоперационные факторы риска сердечно-сосудистых осложнений в некардиальной хирургии. Кардиоваскулярная терапия и профилактика. 2024;23(10):4119. https://doi.org/10.15829/1728-8800-2024-4119. EDN: IBQGPV
For citation:
Murashko S.S., Berns S.A., Pasechnik I.N. Preoperative risk factors for cardiovascular events in non-cardiac surgery. Cardiovascular Therapy and Prevention. 2024;23(10):4119. (In Russ.) https://doi.org/10.15829/1728-8800-2024-4119. EDN: IBQGPV
JATS XML

























































