Перейти к:
Ассоциации уровней биохимических маркеров хронического и острого воспаления, абдоминального ожирения и постковидного синдрома у реконвалесцентов COVID-19
https://doi.org/10.15829/1728-8800-2024-4131
EDN: KNNMTY
Аннотация
Цель. Изучить ассоциации абдоминального ожирения (АО), уровней биохимических маркеров хронического и острого воспаления и постковидного синдрома (ПКС) у реконвалесцентов COVID-19 (COronaVIrus Disease 2019).
Материал и методы. В одномоментное обсервационное исследование включены 166 человек в возрасте 18-84 (44,6% мужчин), являющихся реконвалесцентами COVID-19. У всех пациентов оценивали данные анамнеза, определяли антропометрические параметры. АО определяли при окружности талии >80 см у женщин и >94 см у мужчин. В сыворотке крови методом иммуноферментного анализа определяли концентрации биохимических маркеров хронического и острого воспаления: интерферона альфа, интерлейкинов (ИЛ) 1бета (ИЛ-1β), ИЛ-6, ИЛ-8, моноцитарного хемотаксического фактора 1 (MCP-1), инсулина, С-пептида, С-реактивного белка, определенного высокочувствительным методом (вчСРБ).
Результаты. Реконвалесценты COVID-19 c ПКС и АО имели значимо более высокие уровни ИЛ-6 (3,13 [2,26;4,98] и 1,74 [1,10;3,04] пг/мл, p<0,0001, соответственно) и вчСРБ (3,83 [2,42;10,16] и 2,34 [0,70;5,79] мг/л, p=0,028, соответственно), чем без АО. Инсулин и С-пептид продемонстрировали значимость различий у реконвалесцентов COVID-19 c АО независимо от ПКС. Результаты многофакторного логистического регрессионного анализа показали, что шанс наличия АО у реконвалесцентов COVID-19 с ПКС увеличивается в 1,6 раза при повышении в крови ИЛ-6 на 1 пг/мл (odds ratio (OR) 1,581, 95% доверительный интервал (ДИ): 1,001-2,416; p=0,047) и в 1,2 раза при повышении в крови инсулина на 1 пг/мл (OR 1,168, 95% ДИ: 1,015-1,343; p=0,030). Наличие АО у мужчин с ПКС ассоциировано с концентрацией в крови ИЛ-6 (OR 1,943, 95% ДИ: 1,018-3,709; p=0,044) и ИЛ-1β (OR 0,591, 95% ДИ: 0,362-0,967; p=0,036). Наличие ПКС у женщин с АО и сердечно-сосудистыми заболеваниями ассоциировано с уровнем MCP-1 (OR 0,991, 95% ДИ: 0,983-0,999; p=0,035).
Заключение. У реконвалесцентов COVID-19 c ПКС шанс наличия АО ассоциирован с повышением в крови ИЛ-6 и инсулина. У мужчин шанс наличия АО ассоциирован с повышением ИЛ-6 и снижением ИЛ-1β. У женщин с АО и с сердечно-сосудистыми заболеваниями в анамнезе наличие ПКС ассоциировано с уровнем MCP-1 в крови.
Ключевые слова
Для цитирования:
Карасева А.А., Афанасьева А.Д., Гарбузова Е.В., Каштанова Е.В., Полонская Я.В., Шрамко В.С., Логвиненко И.И., Рагино Ю.И. Ассоциации уровней биохимических маркеров хронического и острого воспаления, абдоминального ожирения и постковидного синдрома у реконвалесцентов COVID-19. Кардиоваскулярная терапия и профилактика. 2024;23(10):4131. https://doi.org/10.15829/1728-8800-2024-4131. EDN: KNNMTY
For citation:
Karaseva A.A., Afanaseva A.D., Garbuzova E.V., Kashtanova E.V., Polonskaya Ya.V., Shramko V.S., Logvinenko I.I., Ragino Yu.I. Associations of levels of biochemical markers of chronic and acute inflammation, abdominal obesity and post-COVID syndrome in COVID-19 convalescents. Cardiovascular Therapy and Prevention. 2024;23(10):4131. (In Russ.) https://doi.org/10.15829/1728-8800-2024-4131. EDN: KNNMTY
Введение
На сегодняшний день доказано, что жировая ткань, кроме способности накапливать энергию в виде триацилглицеролов, является и самостоятельным эндокринным органом, секретирующим многочисленные соединения с биологической активностью, включая адипоцитокины. Адипоцитокины представляют собой вещества, которые синтезируются вследствие взаимодействия между самими адипоцитами и иммунными клетками и играют важную роль в энергетическом балансе и гомеостазе [1]. К ним относится широкий спектр различных биомолекул, таких как гормоны (адипонектин, резистин, лептин, висфатин), провоспалительные цитокины — интерлейкины (ИЛ) — ИЛ-1β, ИЛ-6, ИЛ-8, моноцитарный хемоаттрактантный белок 1-го типа (MCP-1, Monocyte Chemotactic Protein 1), фактор некроза опухоли-альфа, липокалин-2, оментин-1; молекулы системы комплемента (адипсин) и сосудистого гемостаза (ингибитор активатора плазминогена 1-го типа) и др. [2]. Наличие абдоминального ожирения (АО) вызывает хроническую системную воспалительную реакцию слабой степени выраженности, возникающую в результате сочетания повышенной резистентности к инсулину и повышенной продукции медиаторов воспаления за счет увеличения количества висцеральных/абдоминальных адипоцитов [3][4].
В настоящее время известно, что одним из осложнений новой коронавирусной инфекции (Coronavirus Disease 2019 (COVID-19)) является развитие постковидного синдрома (ПКС), который характеризуется возникновением различных симптомов после перенесенной острой инфекции и которые, по определению Всемирной организации здравоохранения (ВОЗ), не могут быть объяснены другими причинами [5][6]. Патогенетические механизмы развития ПКС в настоящее время все еще остаются предметом научного медицинского познания. Интерес представляет изучение иммунного ответа, возникающего при инфицировании вирусом SARSCoV-2 (Severe Acute Respiratory Syndrome-related CoronaVirus 2), и его участия в развитии постинфекционных состояний. Реакция иммунной системы после COVID-19 отличается от иммунного ответа, наблюдаемого в ее остром периоде [7]. В соответствии с данными проведенных исследований, в основе патофизиологических механизмов развития тяжелых форм COVID-19 в остром периоде, различных осложнений и летального исхода при данном заболевании лежат ассоциированные с ожирением нарушения метаболических процессов и иммунных реакций, состояние хронического системного воспалительного ответа вследствие гиперсекреции провоспалительных цитокинов, изменения дыхательных объемов, скопление вируса SARSCoV-2 в жировой ткани в связи с более высоким уровнем экспрессии адипоцитами рецепторов [8][9]. Vojdani A, et al. в своем исследовании показали, что триггерами развития ПКС являются нарушение иммунной регуляции, активация интерферонов (ИФН), ожирение, нарушение микрососудистой регуляции и др. [10].
Актуальность исследований биохимических маркеров хронического и острого воспаления и их связи с наличием АО, крайне высока, поскольку АО оказывает существенное влияние на развитие сердечно-сосудистых (ССЗ) и многих других неинфекционных заболеваний, что, в свою очередь, может влиять на течение резвившихся состояний и их прогноз в постковидном периоде.
Цель исследования — изучить ассоциации АО, уровней биохимических маркеров хронического и острого воспаления и ПКС у реконвалесцентов COVID-19.
Материал и методы
Дизайн исследования — одномоментное обсервационное исследование. Исследование проводилось на базе НИИТПМ — филиала ИЦГ СО РАН в 2020-2021гг. В исследование было включено 166 человек (44,6% мужчин) в возрасте 18-84 лет (53,17±13,19 года), являющихся реконвалесцентами COVID-19. Критерии включения в исследование: наличие COVID-19, подтвержденное положительным анализом — рибонуклеиновой кислоты (РНК)-коронавируса SARS-CoV-2 методом полимеразной цепной реакции во время заболевания и/или наличие антител IgG к коронавирусу SARS-CoV-2; истечение 2-х мес. после реконвалесценции.
Все пациенты дали свое информированное согласие на участие в исследовании. Исследование выполнено в рамках бюджетной темы, рег. № 122031700115-7 и было одобрено Этическим комитетом НИИТПМ — филиал ИЦиГ СО РАН, г. Новосибирска.
Все пациенты были распределены в 2 группы в соответствии с наличием/отсутствием ПКС, а далее на подгруппы в зависимости от наличия или отсутствия АО (рисунок 1). АО констатировали при окружности талии >80 см у женщин и >94 см у мужчин.
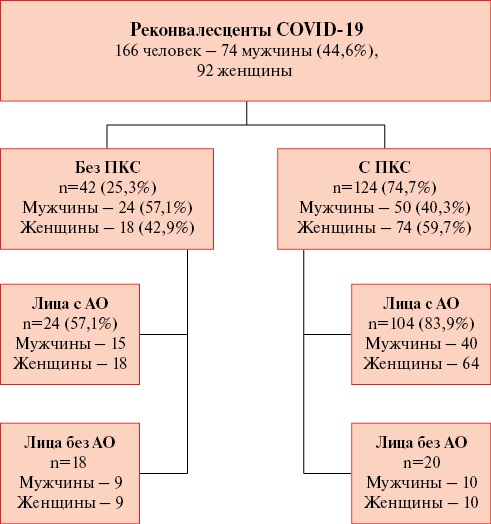
Рис. 1 Блок-схема дизайна исследования.
Примечание: АО — абдоминальное ожирение, ПКС — постковидный синдром, COVID-19 — новая коронавирусная инфекция, COrona VIrus Disease 2019.
В сыворотке крови методом иммуноферментного анализа с использованием наборов АО "Вектор-Бест" (Россия) были определены уровни биохимических маркеров хронического и острого воспаления — ИФН-α, ИЛ-1β, ИЛ-6, ИЛ-8, MCP-1, инсулина, С-пептида, С-реактивного белка, определенного высокочувствительным методом (вчСРБ). Анализ проводился с помощью микропланшетного ридера (Multiscan EX, Thermo, Финляндия), вошера (Thermo, Финляндия) в полуавтоматическом режиме при использовании стандартного программного обеспечения, прилагаемого к анализатору.
Статистическая обработка результатов выполнялась с использованием пакета программ SPSS. Статистические оценки включали дескриптивный анализ числовых характеристик признаков. При распределении количественных показателей, отличном от нормального, данные были представлены как медиана (Ме) и интерквартильный размах [ Q25;Q75]. Использовали стандартные критерии оценки статистических гипотез: критерий Манна-Уитни для сравнения групп, однофакторный и многофакторный логистический регрессионный анализ для оценки отношения шансов (odds ratio — OR). Сравнение групп по частотам выполнялось с помощью таблиц сопряжённости с использованием критерия χ² Пирсона. За критический уровень значимости при проверке статистических гипотез принимали р<0,05.
Результаты
Сравнительный анализ концентрации исследуемых биохимических маркеров хронического и острого воспаления у пациентов с ПКС и без ПКС, в зависимости от наличия АО, представлен в таблице 1. У лиц с ПКС и АО уровни ИЛ-6 были > в 1,8 раза (p<0,001), вчСРБ > в 1,6 раза (p=0,028), чем у лиц без АО. В свою очередь, лица, страдающие АО, независимо от наличия ПКС имели более высокие уровни инсулина и С-пептида, чем без АО.
Таблица 1
Уровень биохимических маркеров хронического и острого воспаления у реконвалесцентов COVID-19 в зависимости от наличия ПКС на фоне АО или без него, Ме [ Q25;Q75]
|
Параметр |
Нет ПКС, |
р |
Есть ПКС, |
р |
||
|
АО, |
Нет АО, |
АО, |
Нет АО, |
|||
|
ИФН-α, пг/мл |
1,82 [ 0,53;4,69] |
3,68 [ 1,31;11,25] |
0,096 |
2,34 [ 0,70;5,79] |
3,00 [ 0,85;4,90] |
0,778 |
|
ИЛ-1β, пг/мл |
2,50 [ 1,97;3,91] |
2,11 [ 1,57;4,56] |
0,980 |
2,42 [ 1,70;3,52] |
2,60 [ 1,75;4,10] |
0,654 |
|
ИЛ-6, пг/мл |
2,81 [ 1,70;4,89] |
2,84 [ 1,46;5,30] |
0,722 |
3,13 [ 2,26;4,98] |
1,74 [ 1,10;3,04] |
<0,001 |
|
ИЛ-8, пг/мл |
8,80 [ 6,54;12,86] |
7,65 [ 4,98;10,64] |
0,297 |
8,98 [ 5,81;12,26] |
8,42 [ 5,08;10,08] |
0,461 |
|
MСР-1, пг/мл |
350,31 [ 258,19;461,94] |
341,52 [ 226,16;426,08] |
0,675 |
339,80 [ 260,96;437,27] |
299,01 [ 195,60;379,91] |
0,071 |
|
Инсулин, мМЕ/л |
7,71 [ 1,90;9,57] |
2,43 [ 0,38;5,75] |
0,005 |
5,29 [ 1,52;11,46] |
1,83 [ 0,26;6,71] |
0,004 |
|
С-пептид, пмоль/л |
221,94 [ 88,97;572,10] |
73,43 [ 50,00;153,76] |
0,003 |
209,62 [ 62,49;561,08] |
86,10 [ 32,40;206,34] |
0,004 |
|
вчСРБ, мг/л |
4,85 [ 2,21;10,27] |
7,71 [ 1,90;9,57] |
0,084 |
3,83 [ 2,42;10,16] |
2,34 [ 0,70;5,79] |
0,028 |
Примечание: вчСРБ — С-реактивный белок, определенный высокочувствительным методом, ИФН-α — интерферон-альфа, ИЛ-1β — интерлейкин 1бета, ИЛ-6 — интерлейкин 6, ИЛ-8 — интерлейкин 8, Ме [ Q25;Q75] — медиана [ интерквартильный размах], ПКС — постковидный синдром, АО — абдоминальное ожирение, MСР-1 — моноцитарный хемотаксический фактор 1, COVID-19 — COrona VIrus Disease 2019.
Среди мужчин с ПКС и АО уровень ИЛ-6 был > в 1,9 раза (p<0,05), уровень С-пептида > в 2,5 раза (p=0,028), а ИЛ-1β < в 1,7 раза (p=0,018) (рисунок 2), чем у лиц без АО. Не было получено различий по уровням ИФН-α, ИЛ-8, MСР-1, инсулина и вчСРБ. Для мужчин без ПКС было показано, что при АО уровень инсулина > в 2,9 раза (8,25 [ 2,43;9,68] vs 2,86 [ 0,81;5,10] мМЕ/л, p=0,012), а уровень С-пептида > в 2,4 раза (299,81 [ 209,62;655,17] vs 123,08 [ 51,06;193,88] пмоль/л, p=0,010), чем у лиц без АО.
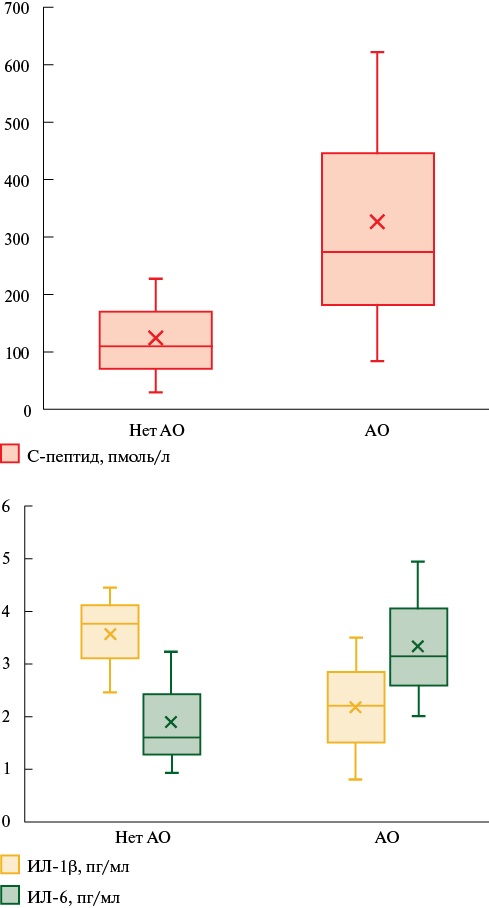
Рис. 2 Уровни биохимических маркеров хронического и острого воспаления у мужчин с ПКС на фоне АО и без него.
Примечание: АО — абдоминальное ожирение, ИЛ-1β — интерлейкин 1бета, ИЛ-6 — интерлейкин 6, ПКС — постковидный синдром.
Среди женщин с ПКС и АО уровень ИЛ-6 был > в 1,8 раза (p=0,012), уровень MCP-1 > в 1,5 раза (p=0,008), уровень С-пептида > в 2,4 раза (p=0,038), уровень инсулина > в 6,5 раза (p=0,002) чем у женщин без АО (рисунок 3). Различий по уровням ИФН-α, ИЛ-1β, ИЛ-8, вчСРБ получено не было. Для женщин без ПКС и АО различий по уровню исследуемых биохимических маркеров хронического и острого воспаления получено не было.
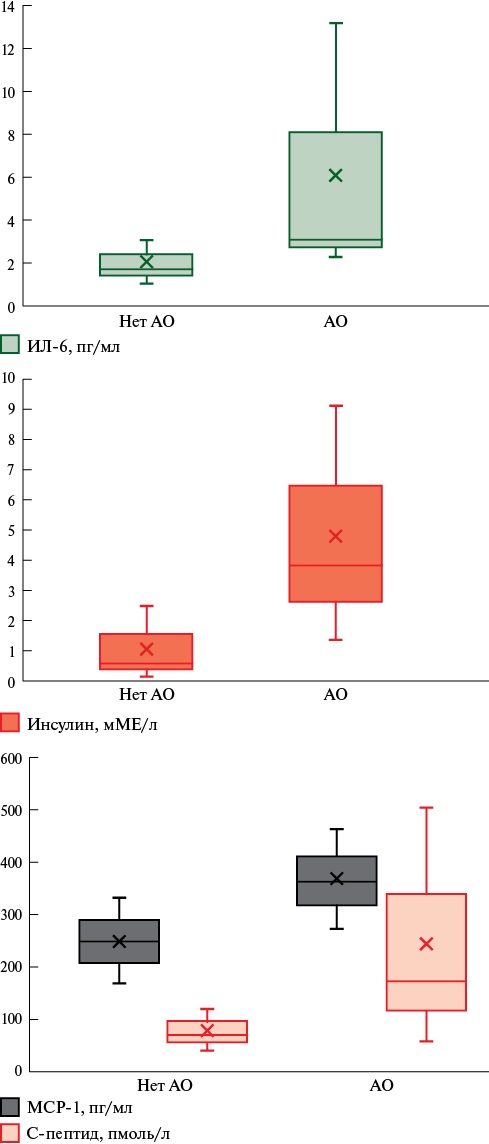
Рис. 3 Уровни биохимических маркеров хронического и острого воспаления у женщин с ПКС на фоне АО и без него.
Примечание: АО — абдоминальное ожирение, ИЛ-6 — интерлейкин 6, ПКС — постковидный синдром, MCP-1 — моноцитарный хемотаксический фактор 1.
Проведенный далее пошаговый многофакторный логистический регрессионный анализ у реконвалесцентов COVID-19 с ПКС продемонстрировал ассоциации исследованных биомолекул с наличием АО (таблица 2). Так, АО у лиц с ПКС ассоциировано с концентрацией в крови ИЛ-6 и инсулина. У мужчин с ПКС шанс наличия АО повышается в ~2 раза с увеличением уровня ИЛ-6 на 1 пг/мл и снижается на 50% при увеличении уровня ИЛ-1β.
Таблица 2
Многофакторный логистический регрессионный анализ ассоциаций АО с биохимическими маркерами хронического и острого воспаления у реконвалесцентов COVID-19 с наличием ПКС (со стандартизацией по полу и возрасту)
|
Показатель |
Все обследованные |
Мужчины |
Женщины |
|||
|
OR (95% ДИ) |
р |
OR (95% ДИ) |
р |
OR (95% ДИ) |
p |
|
|
Возраст, на 1 год |
1,015 (0,969-1,063) |
0,528 |
0,982 (0,920-1,049) |
0,593 |
1,053 (0,973-1,140) |
0,197 |
|
ИЛ-1β, на 1 пг/мл |
0,889 (0,749-1,054) |
0,176 |
0,591 (0,362-0,967) |
0,036 |
1,273 (0,554-2,925) |
0,569 |
|
ИЛ-6, на 1 пг/мл |
1,581 (1,001-2,416) |
0,047 |
1,943 (1,018-3,709) |
0,044 |
1,152 (0,619-2,143) |
0,655 |
|
MСР-1, на 1 пг/мл |
1,004 (0,999-1,009) |
0,130 |
0,998 (0,989-1,007) |
0,634 |
1,006 (0,998-1,014) |
0,127 |
|
Инсулин, на 1 мМЕ/л |
1,168 (1,015-1,343) |
0,030 |
1,151 (0,931-1,424) |
0,194 |
1,210 (0,863-1,698) |
0,269 |
|
вчСРБ, на 1 мг/л |
1,032 (0,944-1,129) |
0,484 |
0,996 (0,883-1,124) |
0,951 |
1,043 (0,917-1,186) |
0,520 |
Примечание: ДИ — доверительный интервал, вчСРБ — С-реактивный белок, определенный высокочувствительным методом, ИЛ-1β — интерлейкин 1бета, ИЛ-6 — интерлейкин 6, ИЛ-8 — интерлейкин 8, MCP-1 — моноцитарный хемотаксический фактор 1, ПКС — постковидный синдром, COVID-19 — COrona VIrus Disease 2019, OR — odds ratio (отношение шансов).
На следующем этапе статистического анализа исследуемые биомолекулы были включены в другую модель логистического регрессионного анализа, где в качестве зависимой переменной использовали наличие ПКС, а в качестве независимых переменных — возраст и все исследуемые в данной работе биохимические маркеры хронического и острого воспаления, показавшие статистически значимую разницу между подгруппами (таблица 3). Целью данного анализа было определение ассоциаций ПКС у лиц с ССЗ на фоне АО и исследуемых биохимических маркеров хронического и острого воспаления. Было выявлено, что у женщин с АО и ССЗ в анамнезе наличие ПКС ассоциировано с уровнем MCP-1 в крови.
Таблица 3
Многофакторный логистический регрессионный анализ ассоциаций ПКС у лиц с ССЗ на фоне АО с биохимическими маркерами хронического и острого воспаления (со стандартизацией по возрасту)
|
Показатель |
Мужчины |
Женщины |
||
|
OR (95% ДИ) |
р |
OR (95% ДИ) |
p |
|
|
Возраст, на 1 год |
1,018 (0,967-1,071) |
0,507 |
1,007 (0,901-1,125) |
0,901 |
|
ИЛ-1β, на 1 пг/мл |
1,090 (0,674-1,762) |
0,725 |
0,806 (0,525-1,239) |
0,806 |
|
ИЛ-6, на 1 пг/мл |
1,047 (0,636-1,724) |
0,857 |
1,204 (0,645-2,247) |
0,560 |
|
MСР-1, на 1 пг/мл |
0,997 (0,990-1,004) |
0,355 |
0,991 (0,983-0,999) |
0,035 |
|
Инсулин, на 1 мМЕ/л |
1,016 (0,913-1,131) |
0,772 |
0,936 (0,843-1,039) |
0,216 |
|
вчСРБ, на 1 мг/л |
1,055 (0,943-1,179) |
0,349 |
0,977 (0,893-1,068) |
0,608 |
Примечание: ДИ — доверительный интервал, вчСРБ — С-реактивный белок, определенный высокочувствительным методом, ИЛ-1β — интерлейкин 1бета, ИЛ-6 — интерлейкин 6, ИЛ-8 — интерлейкин 8, ССЗ — сердечно-сосудистые заболевания, MCP — моноцитарный хемотаксический фактор 1, OR — odds ratio (отношение шансов).
Обсуждение
Согласно данным настоящего исследования, лица с ПКС и наличием/отсутствием АО значительно различаются по содержанию биохимических маркеров хронического и острого воспаления: у лиц с АО и наличием ПКС уровни ИЛ-6 и вчСРБ выше, чем у лиц без АО. Большинство исследований, посвященных анализу провоспалительных цитокинов, демонстрируют связь между продукцией ИЛ-6 висцеральной жировой тканью и секрецией вчСРБ, высокая концентрация которого, в свою очередь, приводит к атеровоспалительным процессам [11]. Известно, что повышенный уровень ИЛ-6 ассоциируется с развитием эндотелиальной дисфункции, усилением агрегации тромбоцитов, увеличением артериального давления, нарушением соотношения атерогенных и антиатерогенных липопротеинов и, как итог, — с неблагоприятными кардиоваскулярными исходами [12][13]. Мы считаем, что эти данные могут вносить свой вклад в развитие и течение постковидных осложнений, в частности ПКС.
Выраженная иммунная дисрегуляция, возникающая во время острого периода COVID-19, продолжается и при ПКС, в частности, в литературе описано персистирующее повышение биомаркеров (ИЛ-6, ИЛ-18 и др.) [14]. В проведенном крупном метаанализе, посвященном изучению биомаркеров воспаления в сыворотке крови у выживших после COVID-19 с ПКС и без него, было выявлено, что более высокие уровни вчСРБ и ИЛ-6 обнаружены у лиц с ПКС, чем у тех, у кого ПКС не было [15], что согласуется с данными, полученными нами.
Однако мы выявили значимое повышение уровня ИЛ-6 и снижение ИЛ-1β только среди лиц мужского пола с ПКС, страдающих АО, что вызывает особый интерес. Известно, что различия в иммунном ответе по признаку пола варьируются на протяжении всего жизненного цикла. Эти эффекты могут быть обусловлены половыми гормонами: эстрадиолом, прогестероном и андрогенами [16]. У мужчин в пожилом возрасте в связи со снижением выработки тестостерона растет продукция воспалительных цитокинов [17]. В ряде исследований выявлено наличие связей между уровнем тестостерона и ИЛ-6. Так, Маggio M, et al. продемонстрировали статистически значимую отрицательную корреляцию между уровнем цитокина и содержанием как общего, так свободного тестостерона [18]. Вероятно, с этим связано повышение уровня ИЛ-6 у мужчин с АО и ПКС, т.к. в настоящем исследовании на долю мужчин >60 лет приходится 30% от всех лиц мужского пола.
Полученные нами данные в отношении ИЛ-1β носят противоречивый характер. Известно, что ИЛ-1β является цитокином с широким спектром действия, который играет важную роль в первичной иммунной ответной реакции организма на воздействие патогенов [19]. Мы выявили, что у мужчин с ПКС концентрация ИЛ-1β в сыворотке крови снижается при АО (3,93 [ 2,61;4,64]) vs 2,37 [ 0,96;3,69] пг/мл, p=0,19). Однако в литературе описано повышение уровня данного цитокина при ожирении [20]. Вероятнее всего, на уровень ИЛ-1β ПКС влияет в большей степени, т.к. у лиц с АО тяжелее протекает острая стадия COVID-19. Данные, представленные Fawzy S, et al., показывают, что тяжелое течение COVID-19 и, как следствие, выраженная иммуносупрессия, ассоциировано со сниженным уровнем данного цитокина в крови [21]. Полученные результаты требуют дополнительного изучения.
MCP-1 является цитокином из семейства хемокинов и вызывает миграцию лейкоцитов в зону воспаления. Он играет важную роль в развитии целого ряда заболеваний, для которых характерна инфильтрация мононуклеарных клеток, включая атеросклероз [22]. Piemonti L, et al. установили, что у лиц с избыточной массой тела и ожирением уровень MCP-1 в крови был независимо ассоциирован с риском смерти от ССЗ [23]. Также показана его роль в развитии инсулинорезистентости [24]. Данные мировой литературы демонстрируют ассоциации уровня MCP-1 в крови с тяжелым течением острого периода COVID-19, и данная молекула рассматривается как потенциальный биомаркер тяжелой стадии заболевания [25]. Полученные нами результаты в отношении MCP-1 не противоречат данным приведенных исследований, однако стоит отметить, что для оценки роли MCP-1 в развитии ПКС требуется большее количество исследований.
Пациенты с АО входят в группу повышенного риска развития сердечно-сосудистых осложнений за счет биологической активности висцеральной жировой ткани [26]. Полученные в ходе исследования данные демонстрируют специфические изменения цитокинового профиля у пациентов с ПКС и АО, что свидетельствует о необходимости разработки персонифицированных профилактических мероприятий у данной категории пациентов.
К ограничениям исследования можно отнести относительно небольшой размер исследуемых подгрупп и использование в качестве метода оценки уровня биохимических маркеров хронического и острого воспаления иммуноферментного анализа.
Заключение
Результаты проведенного исследования показывают, что уровни некоторых биохимических маркеров хронического и острого воспаления значительно различаются в зависимости от наличия АО. Так, у лиц с ПКС и АО были выявлены более высокие уровни ИЛ-6 и вчСРБ. Однако вне зависимости от наличия ПКС у лиц с АО были более высокими уровни инсулина и С-пептида. Примечательно, что у лиц мужского пола с ПКС и АО данная ассоциация сохранялась только в отношении ИЛ-6, а уровень ИЛ-1β был ниже, что, вероятно, может быть объяснено тяжелым течением острого периода COVID-19. У женщин с АО и ССЗ в анамнезе наличие ПКС ассоциировано с уровнем MCP-1 в крови.
Полученные данные демонстрируют сложные патогенетические ассоциации между активностью жировой ткани и развитием осложнений после перенесенной COVID-19. Можно предположить, что сочетание ПКС с кардиометаболическими факторами риска приводит к более тяжелому течению сердечно-сосудистой патологии у реконвалесцентов COVID-19.
Отношения и деятельность. Исследование выполнено в рамках бюджетной темы "Формирование когорт детского, подросткового, молодого населения для изучения механизмов и особенностей жизненного цикла человека в российской популяции", госрегистрация № 122031700115-7, при поддержке стипендии Президента РФ № СП-2974.2022.4 и гранта правительства Новосибирской области ГР-24 от 18.06.2024г.
Список литературы
1. Cao H. Adipocytokines in obesity and metabolic disease. J Endocrinol. 2014;220(2):47-59. doi:10.1530/JOE-13-0339.
2. Рагино Ю. И., Щербакова Л. В., Облаухова В. И. и др. Адипокины крови у молодых людей с ранней ишемической болезнью сердца на фоне абдоминального ожирения. Кардиология. 2021;61(4):32-8. doi:10.18087/cardio.2021.4.n1369.
3. Chait A, den Hartigh LJ. Adipose tissue distribution, inflammation and its metabolic consequences, including diabetes and cardiovascular disease. Front Cardiovasc Med. 2020;7:22. doi:10.3389/fcvm.2020.00022.
4. Kwaifa IK, Bahari H, Yong YK, et al. Endothelial dysfunction in obesity-induced inflammation: molecular mechanisms and clinical implications. Biomolecules. 2020;10(2):291. doi:10.3390/biom10020291.
5. Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020; 15;395(10223):497-506. doi:10.1016/S0140-6736(20)30183-5.
6. Abdallah SJ, Voduc N, Corrales-Medina VF, et al. Symptoms, pulmonary function, and functional capacity four months after COVID-19. Ann Am Thorac Soc. 2021;18(11):1912-7. doi:10.1513/AnnalsATS.202012-1489RL.
7. Bekbossynova M, Tauekelova A, Sailybayeva A, et al. Unraveling acute and post-COVID cytokine patterns to anticipate future challenges. J Clin Med. 2023;12(16):5224. doi:10.3390/jcm12165224.
8. Dalamaga M, Christodoulatos G, Karampela I, et al. Understanding the co-epidemic of obesity and COVID-19: current evidence, comparison with previous epidemics, mechanisms, and preventive and therapeutic perspectives. Curr Obes Rep. 2021; 10(3):214-43. doi:10.1007/s13679-021-00436-y.
9. Gkogkou E, Barnasas G, Vougas K, et al. Expression profiling meta-analysis of ACE2 and TMPRSS2, the putative anti-inflammatory receptor and priming protease of SARS-CoV-2 in human cells, and identification of putative modulators. Redox Biol. 2020;36:101615. doi:10.1016/j.redox.2020.101615.
10. Vojdani A, Vojdani E, Saidara E, et al. Persistent SARS-CoV-2 infection, EBV, HHV-6 and other factors may contribute to inflammation and autoimmunity in long COVID. Viruses. 2023;15(2):400. doi:10.3390/v15020400.
11. Вербовой А. Ф., Вербовая Н. И., Долгих Ю. А. Ожирение — основа метаболического синдрома. Ожирение и метаболизм. 2021;18(2):142-9. doi:10.14341/omet12707.
12. Попкова Т. В., Новиков Д. С., Насонов Е. Л. Интерлейкин-6 и сердечно-сосудистая патология при ревматоидном артрите. Научно-практическая ревматология. 2011;49(4):64-72.
13. Удачкина Е. В., Новикова Д. С., Попкова Т. В. и др. Роль интерлейкина 6 в развитии атеросклероза при ревматоидном артрите. Современная ревматология. 2013;7(3):25-32. doi:10.14412/1996-7012-2013-7.
14. Городин В. Н., Нестерова И. В., Матушкина В. А. и др. Высокие уровни цитокинов IL-17А, IL-18, VEGF-А в периоде реконвалесценции COVID-19 — биомаркеры незавершенности иммунного воспали тельного процесса, сигнализирующие об опасности развития постковидного синдрома. Инфекционные болезни. 2023;21(4):12-20. doi:10.20953/1729-9225-2023-4-12-20.
15. Yong SJ, Halim A, Halim M, et al. Inflammatory and vascular biomarkers in post-COVID-19 syndrome: A systematic review and meta-analysis of over 20 biomarkers. Rev Med Virol. 2023; 33(2):e2424. doi:10.1002/rmv.2424.
16. Лагерева Ю. Г., Беляева С. В., Бейкин Я. Б. и др. Гендер-специфические иммунологические различия у детей и взрослых. Российский иммунологический журнал. 2012; 6(4):363-9.
17. Хрипун И. А., Гусова З. Р., Дзантиева Е. О. и др. Тестостерон как инструмент метаболического контроля мужского здоровья (обзор литературы). Медицинский вестник Юга России. 2014;(4):19-22. doi:10.21886/2219-8075-2014-4-19-22.
18. Maggio M, Lauretani F, Ceda GP, et al. Association between hormones and metabolic syndrome in older Italian men. J Am Geriatr Soc. 2006;54(12):1832-8. doi:10.1111/j.1532-5415.2006.00963.x.
19. Ильина А. Е., Станислав М. Л., Денисов Л. Н. и др. Интерлейкин-1 как медиатор воспаления и терапевтическая мишень. Научно-практическая ревматология. 2011;49(5):62-71.
20. Щербаков В. И., Скосырева Г. А., Рябиченко Т. И. и др. Цитокины и регуляция метаболизма глюкозы и липидов при ожирении. Ожирение и метаболизм. 2022;19(3):317-23. doi:10.14341/omet12863.
21. Fawzy S, Ahmed MM, Alsayed BA, et al. IL-2 and IL-1β patient immune responses are critical factors in SARS-CoV-2 infection outcomes. J Pers Med. 2022;12(10):1729. doi:10.3390/jpm12101729.
22. Никитина В. В., Захарова Н. Б. Значение МСР-1 как предиктора сосудистых нарушений. Саратовский научно-медицинский журнал. 2010;6(4):786-90.
23. Piemonti L, Calori G, Lattuada G, et al. Association between plasma monocyte chemoattractant protein-1 concentration and cardiovascular disease mortality in middle-aged diabetic and nondiabetic individuals. Diabetes Care. 2009;32(11):2105-10. doi:10.2337/dc09-0763.
24. Тимофеев Ю. С., Джиоева О. Н., Драпкина О. М. Биологические маркеры при ожирении: фундаментальные и клинико-лабораторные аспекты. М.: ООО "Силицея-Полиграф", 2024. 108 с. ISBN: 978-5-6050540-9-2. doi:10.15829/ROPNIZ-t1-2024. EDN JZFEJM.
25. Singh S, Anshita D, Ravichandiran V. MCP-1: Function, regulation, and involvement in disease. International Immunopharmacol. 2021;101(Pt B):107598. doi:10.1016/j.intimp.2021.107598.
26. Викторова И. А., Моисеева М. В., Ширлина Н. Г. и др. Абдоминальное ожирение — независимый фактор риска развития фатальных и нефатальных сердечно-сосудистых событий по данным проспективного наблюдательного эпидемиологического исследования ЭССЕ-РФ2. Профилактическая медицина. 2022;25(6):40-6. doi:10.17116/profmed20222506140.
Об авторах
А. А. КарасеваРоссия
Карасева Александра Александровна — м.н.с.
Новосибирск
А. Д. Афанасьева
Россия
Афанасьева Алёна Дмитриевна — к.м.н., зав. лабораторией генетических и средовых детерминант жизненного цикла человека.
Новосибирск
Е. В. Гарбузова
Россия
Гарбузова Евгения Витальевна — к.м.н., н.с. лаборатории генетических и средовых детерминант жизненного цикла человека.
Новосибирск
Е. В. Каштанова
Россия
Каштанова Елена Владимировна — д.б.н., в.н.с. с в.о. зав. лабораторией лаборатории клинических, биохимических, гормональных исследований терапевтических заболеваний.
Новосибирск
Я. В. Полонская
Россия
Полонская Яна Владимировна — д.б.н., с.н.с. лаборатории клинических, биохимических, гормональных исследований терапевтических заболеваний.
Новосибирск
В. С. Шрамко
Россия
Шрамко Виктория Сергеевна — к.м.н., н.с. лаборатории клинических, биохимических, гормональных исследований терапевтических заболеваний.
Новосибирск
И. И. Логвиненко
Россия
Логвиненко Ирина Ивановна — д.м.н., профессор, г.н.с. лаборатории профилактической медицины, зам. руководителя по лечебной работе.
Новосибирск
Ю. И. Рагино
Россия
Рагино Юлия Игоревна — д.м.н., профессор, член-корр. РАН, руководитель.
Новосибирск
Дополнительные файлы
Что известно о предмете исследования?
- Постковидный синдром (ПКС) — наиболее распространенное осложнение перенесенной коронавирусной инфекции.
- Во всем мире отмечается высокая частота абдоминального ожирения (АО), что усугубляет развитие сердечно-сосудистых заболеваний, особенно в постковидный период.
Что добавляют результаты исследования?
- АО и концентрации биохимических маркеров хронического и острого воспаления могут выступать как связующее звено между ПКС и тяжелым течением сердечно-сосудистой патологии у реконвалесцентов COVID-19 (COronaVIrus Disease 2019).
- АО у лиц с ПКС ассоциировано с концентрацией в крови интерлейкина-6 и инсулина. У женщин с АО и сердечно-сосудистыми заболеваниями в анамнезе наличие ПКС ассоциировано с уровнем в крови моноцитарного хемотаксического фактора 1.
Рецензия
Для цитирования:
Карасева А.А., Афанасьева А.Д., Гарбузова Е.В., Каштанова Е.В., Полонская Я.В., Шрамко В.С., Логвиненко И.И., Рагино Ю.И. Ассоциации уровней биохимических маркеров хронического и острого воспаления, абдоминального ожирения и постковидного синдрома у реконвалесцентов COVID-19. Кардиоваскулярная терапия и профилактика. 2024;23(10):4131. https://doi.org/10.15829/1728-8800-2024-4131. EDN: KNNMTY
For citation:
Karaseva A.A., Afanaseva A.D., Garbuzova E.V., Kashtanova E.V., Polonskaya Ya.V., Shramko V.S., Logvinenko I.I., Ragino Yu.I. Associations of levels of biochemical markers of chronic and acute inflammation, abdominal obesity and post-COVID syndrome in COVID-19 convalescents. Cardiovascular Therapy and Prevention. 2024;23(10):4131. (In Russ.) https://doi.org/10.15829/1728-8800-2024-4131. EDN: KNNMTY

























































