Перейти к:
Возможности карбоксиангиографии при лечении критического поражения почечной артерии у пациента с хронической болезнью почек. Клинический случай
https://doi.org/10.15829/1728-8800-2024-4189
EDN: JPVQZG
Аннотация
Сочетание атеросклеротического поражения коронарного и почечного бассейнов встречается в клинической практике довольно часто, при этом риск сердечно-сосудистых осложнений у таких пациентов в десятки раз выше, чем в общей популяции, что связано с резким ускорением процессов сосудистого повреждения. Применение малоинвазивных хирургических методов, в частности эндоваскулярной реваскуляризации почечных артерий, способно улучшить экскреторную почечную функцию и отсрочить необходимость проведения заместительной почечной терапии, однако использование нефротоксичных рентген-контрастных веществ при наличии у пациента хронической болезни почек может стать ключевым ограничивающим фактором для применения эндоваскулярных методов лечения. Выходом из сложившейся ситуации становится применение бесконтрастной рентгенэндоваскулярной хирургии с проведением вмешательства под контролем карбоксиангиографии и внутрисосудистых методов визуализации. В статье представлен клинический случай успешной баллонной ангиопластики и стентирования критического стеноза правой почечной артерии у коморбидного пациента под контролем карбоксиангиографии и внутрисосудистого ультразвукового исследования.
Ключевые слова
Для цитирования:
Васильев Д.К., Араблинский Н.А., Шукуров Ф.Б., Фещенко Д.А., Талиуридзе М.Т., Шаноян А.С., Федотова Н.П. Возможности карбоксиангиографии при лечении критического поражения почечной артерии у пациента с хронической болезнью почек. Клинический случай. Кардиоваскулярная терапия и профилактика. 2024;23(12):4189. https://doi.org/10.15829/1728-8800-2024-4189. EDN: JPVQZG
For citation:
Vasiliev D.K., Arablinsky N.A., Shukurov F.B., Feshchenko D.A., Taliuridze M.T., Shanoyan A.S., Fedotova N.P. Potential of carbon dioxide angiography in the treatment of critical renal artery lesions in a patient with chronic kidney disease: a case report. Cardiovascular Therapy and Prevention. 2024;23(12):4189. (In Russ.) https://doi.org/10.15829/1728-8800-2024-4189. EDN: JPVQZG
Введение
Известно, что прогрессирование атеросклероза в одном сосудистом бассейне увеличивает риск манифестации атеросклеротического поражения в других артериальных бассейнах [1]. В отечественной и европейской клинической практике наиболее часто применяемым термином для обозначения такого системного поражения является "мультифокальный атеросклероз" (МФА). Сочетание у пациента гемодинамически значимого атеросклеротического поражения коронарных и почечных артерий (ПА) в различной степени выраженности относится к МФА и может встречаться вплоть до 30% [2]. Согласно рекомендациям Европейского общества кардиологов, гемодинамически значимым поражением ПА считается стеноз ≥60%, что клинически может проявляться в виде резистентной артериальной гипертензии (АГ), хронической болезни почек (ХБП) неясного генеза, а также острого отека легких [3]. Ведение пациента с диагностированным значимым поражением ПА должно быть направлено на контроль АГ, уменьшение скорости прогрессирования ХБП, замедление прогрессирования атеросклероза и, в целом, на снижение риска возникновения неблагоприятных сердечно-сосудистых осложнений и необходимости проведения заместительной почечной терапии (ЗПТ). Стратегии оптимальной медикаментозной терапии (ОМТ) при атеросклеротическом поражении ПА в значительной степени соответствуют привычным в кардиологической практике комбинациям и включают назначение антиагрегантов и статинов, а также, с определенными ограничениями, антигипертензивных препаратов (ингибиторов ангиотензинпревращающего фермента, блокаторов рецепторов ангиотензина II), β-адреноблокаторов, блокаторов кальциевых каналов) для лучшего контроля артериального давления и замедления прогрессирования ХБП. В большинстве случаев блокаторы ренин-ангиотензин-альдостероновой системы хорошо переносятся пациентами с атеросклерозом ПА, однако безопасность их применения должна тщательно мониторироваться посредством определения уровня креатинина и расчетной скорости клубочковой фильтрации (СКФ).
Инвазивная стратегия ведения пациентов с гемодинамически значимым поражением ПА заключается в проведении рентгенэндоваскулярного вмешательства — баллонной ангиопластики и стентирования. Первые исследования, сравнивавшие преимущества баллонной ангиопластики и стентирования над ОМТ, значимого преимущества не продемонстрировали [4][5]. Более того, эти исследования имели ряд ограничений, которые были в последующем подчеркнуты в других работах [6][7]. В настоящее время проведение эндоваскулярной реваскуляризации в бассейне ПА рассматривается как дополнительный к ОМТ метод лечения у определенных пациентов, что обуславливает тщательный предоперационный скрининг и поиск максимальных респондеров от данной процедуры. К группе таких пациентов можно отнести лиц, имеющих одно из нижеперечисленных состояний или их сочетание [8-10]:
- стеноз ПА >70% при наличии истинно резистентной АГ;
- быстрое прогрессирование ХБП (снижение СКФ >5 мл/мин/1,73 м² в год);
- рецидивирующие симптомы хронической сердечной недостаточности (ХСН) с/без внезапного отека легких;
- наличие фибромускулярной дисплазии с признаками органной ишемии;
- в случае наличия двустороннего стеноза ПА без существенной атрофии почек или стеноз ПА единственной функционирующей почки.
К сожалению, наличие ХБП может стать весомым ограничением для проведения рентгенэндоваскулярного лечения. Использование рентген-контрастных веществ (РКВ) на основе йода может усугубить ХБП и привести к развитию такого ятрогенного осложнения, как контраст-индуцированная нефропатия (КИН). В зависимости от профиля риска пациента при проведении вмешательств с РКВ на основе йода КИН может встречаться с вероятностью 3-31%, что ассоциировано с увеличением длительности госпитализации, повышением вероятности развития неблагоприятных сердечно-сосудистых событий и необходимости проведения ЗПТ [11].
Проведение эндоваскулярного вмешательства под контролем карбоксиангиографии, в т.ч. с применением внутрисосудистого ультразвукового исследования (ВСУЗИ), может стать выходом из сложившейся ситуации [12][13]. Карбоксиангиография не требует введения РКВ на основе йода, а подразумевает дозированное введение углекислого газа в интересующий сосудистый бассейн под фиксированным давлением, что исключает перерастяжение артериальной стенки. Углекислый газ не обладает аллергенностью и нефротоксичностью, поскольку он хорошо растворим в воде и выводится через легкие; при этом использование данной методики в ряде сосудистых бассейнов сопоставимо по информативности со стандартными методами контрастирования [14]. Таким образом, применение карбоксиангиографии имеет ряд критически важных преимуществ при использовании в когорте коморбидных пациентов с ХБП высоких градаций.
В статье представлено описание клинического случая лечения полиморбидного пациента с критическим стенозом правой ПА, ишемической болезнью сердца (ИБС), ХСН с низкой фракцией выброса (ФВ) левого желудочка (ЛЖ) и прогрессирующей ХБП. Представлена методика бесконтрастного рентгенэндоваскулярного стентирования правой ПА под контролем карбоксиангиографии и ВСУЗИ.
Описание клинического случая
Информация о пациенте: Пациент Б., 62 лет, был госпитализирован в отделение рентгенхирургических методов диагностики и лечения ФГБУ "НМИЦ ТПМ" Минздрава России в июне 2024г. Жалоб активно не предъявлял. Из анамнеза заболевания известно: в 2016г пациент перенес инфаркт миокарда нижней локализации, проведена баллонная ангиопластика и стентирование правой коронарной артерии. Тогда же по данным ультразвукового исследования (УЗИ) выявлен стеноз правой ПА — 50%. Длительное время пациент за медицинской помощью не обращался, однако в 2019г вновь обратился к кардиологу по месту жительства в связи с возникновением одышки при физических нагрузках и отеков нижних конечностей. По результатам эхокардиографии (ЭхоКГ) от 2019г впервые выявлена дилатация камер сердца со снижением ФВ ЛЖ до 37%, по результатам коронароангиографии — выявлено многососудистое поражение коронарного русла. В проведении коронарного шунтирования пациенту было отказано, в связи с чем пациент длительное время наблюдался по месту жительства с подбором ОМТ. По данным ЭхоКГ от 2024г — дилатация камер сердца, ФВ ЛЖ 30%, в связи с чем с целью первичной профилактики внезапной сердечной смерти был имплантирован 2-камерный имплантируемый кардиовертер-дефибриллятор (ИКД). В динамике также отмечается повышение уровня креатинина крови со 140 (февраль 2023г) до 274 мкмоль/л (май 2024г) (снижение СКФ с 46 до 21,9 мкмоль/л по формуле CKD-EPI). По результатам УЗИ отмечается прогрессирование стеноза правой ПА до 90%. С учетом известного поражения правой ПА, прогрессирования ХБП у коморбидного пациента с ИБС и ХСН пациент был госпитализирован в НМИЦ ТПМ для дообследования и проведения эндоваскулярной реваскуляризации в бассейне правой ПА (рисунок 1).
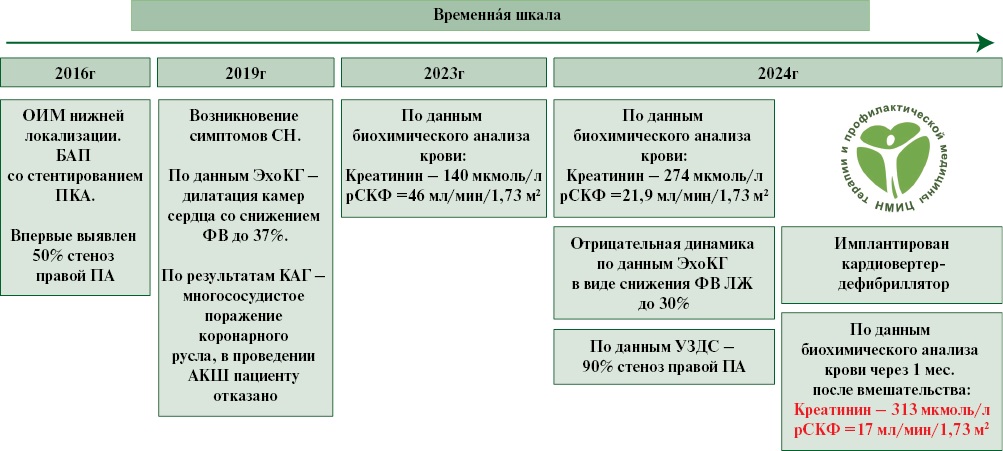
Рис. 1 Временнáя шкала.
Примечание: АКШ — аортокоронарное шунтирование, БАП — баллонная ангиопластика, КАГ — коронароангиография, ЛЖ — левый желудочек, ПА — почечная артерия, ПКА — правая коронарная артерия, рСКФ — расчетная скорость клубочковой фильтрации, УЗДС — ультразвуковое дуплексное сканирование, ФВ — фракция выброса, ЭхоКГ — эхокардиография.
Из анамнеза жизни известно, что до 2016г пациент курил по 1 пачке/сут. на протяжении 20 лет, с 2018г пациенту также выставлен диагноз нарушение толерантности к глюкозе. Семейный анамнез по сердечно-сосудистым заболеваниям не отягощен. Аллергологический анамнез не отягощен. На момент госпитализации регулярно принимал валсартан+сакубитрил 300 мг/сут., карведилол 12,5 мг/сут., дапаглифлозин 10 мг/сут., торасемид 5 мг/сут., розувастатин 20 мг/сут., ацетилсалициловую кислоту 100 мг/сут.
При проведении предоперационного обследования: в общем анализе крови без патологических отклонений; в биохимическом анализе крови: креатинин 355 мкмоль/л, расчетная СКФ по формуле CKD-EPI 15 мл/мин/1,73 м² (поскольку у пациента отсутствуют факторы, способные искажать результат расчета, была выбрана стандартная методика подсчета СКФ), повышение уровня холестерина липопротеинов низкой плотности (ХС ЛНП) до 2,15 ммоль/л (отмечается недостижение целевых значений ХС ЛНП, несмотря на прием розувастатина); в общем анализе мочи — глюкоза 14 ммоль/л (обусловлена приемом дапаглифлозина), белок 1,62 г/л. По данным электрокардиографии: предсердная стимуляция с частотой сердечных сокращений 60 уд./мин, электрическая ось сердца отклонена влево, рубцовые изменения нижней стенки ЛЖ. По данным ЭхоКГ: дилатация всех камер сердца, конечно-диастолический размер ЛЖ 7,9 см, конечно-систолический размер ЛЖ 7,2 см, ФВ ЛЖ 31%, акинез базальных и средних сегментов задней и нижней стенки ЛЖ. Акинез средних и верхушечных сегментов межжелудочковой перегородки и передней стенки ЛЖ. Нормокинез боковой стенки ЛЖ. Гипокинез остальных сегментов ЛЖ. Митральная регургитация 2 ст. По результатам УЗИ почек: размеры почек справа — 8,6×4,7 см, слева — 9,5×4,6 см; кортико-медуллярная дифференцировка сглажена с обеих сторон; толщина паренхимы справа — 1,5 см, слева — 1,6 см. Почечный синус четко визуализируется чашечно-лоханочная система не расширена, конкрементов нет. В правой ПА стеноз >90%, Vs max 230 см/с.
На основании данных жалоб, анамнеза, физикального и инструментального обследований был выставлен предварительный диагноз:
Основное заболевание: ишемическая болезнь почек. Нефропатия смешанного генеза (гипертоническая, атеросклеротическая). ХБП С4 (расчетная СКФ 17 мл/мин/1,73 м²). Стеноз правой ПА — 90%.
Сочетанное заболевание: ИБС. Постинфарктный кардиосклероз (инфаркт миокарда нижней локализации от 2016г). Транслюминальная баллонная ангиопластика со стентированием правой коронарной артерии от 2016г. ХСН со сниженной ФВ ЛЖ, 2А стадии, III функциональный класс по NYHA (New York Heart Association). Имплантация 2-камерного ИКД от 2024г.
Фоновые заболевания: Гипертоническая болезнь III стадии, контролируемая АГ, риск сердечно-сосудистых осложнений — 4. Дислипидемия. МФА.
Медицинские вмешательства:
Проведена комплексная оценка состояния пациента: принимая во внимание гемодинамически значимый стеноз правой ПА (подтвержденный по УЗИ почек морфологически, а также скоростными параметрами кровотока), учитывая жизнеспособность почки (по критериям, соответствующим рекомендациям европейского кардиологического общества)1, прогрессирование ХБП со снижением расчетной СКФ >5 мл/мин/1,73 м² в год и ХСН со сниженной ФВ ЛЖ, которая поддерживала прогрессирование кардио-ренального континуума, — было принято решение о проведении реваскуляризации в бассейне пораженной артерии.
По результатам диагностической карбоксиангиографии, выполненной через правый лучевой доступ с использованием инжектора Angiodroid, правым диагностическим катетером был выявлен 95%-й стеноз проксимального отдела правой ПА (рисунок 2). Наличие программы обработки ангиографических изображений, встроенной в ангиографическую установку Siemens Artis Q, позволило провести стандартную субтракционную ангиографию углекислым газом с обработкой изображения, сходной с обычным ангиографическим исследованием, однако вмешательство было проведено без использования РКВ (углекислый газ указан как один из вариантов контрастного препарата, к которому применяется пакет обработки "карбоксиангиография на ангиографическом комплексе"). Для проведения реваскуляризации осуществлен правый бедренный артериальный доступ. Катетер-гид установлен в устье правой ПА. Коронарный проводник был проведен в дистальное русло правой ПА. Выполнено ВСУЗИ (Volcano Core, Philips), по результатам которого подтверждено критическое поражение ПА, оценена морфология атеросклеротической бляшки, диаметр сосуда и протяженность поражения (рисунок 3). Проведена баллонная ангиопластика стеноза правой ПА баллоном 5×20 мм. В область остаточного стеноза правой ПА позиционирован и имплантирован почечный баллонрасширяемый стент 6×24 мм. Выполнена контрольная карбоксиграфия и ВСУЗИ (рисунки 4, 5). Стент адекватно расправлен, остаточного стеноза и диссекций нет. По данным ВСУЗИ площадь просвета артерии составляет 33 мм², отмечается полная аппозиция стента. Доза введенного углекислого газа составила: 320 мл. Йод-содержащее контрастное вещество не использовалось.
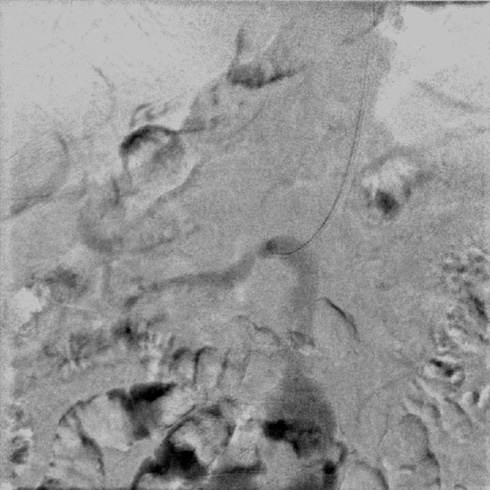
Рис. 2 Критический стеноз правой ПА, подтвержденный данными карбоксиангиографии.
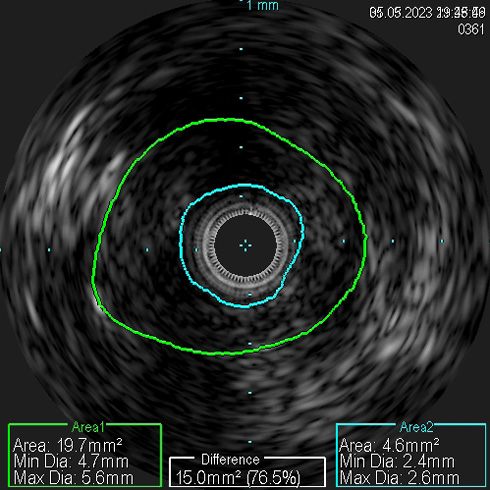
Рис. 3 Гемодинамически значимый стеноз правой ПА подтвержден данными ВСУЗИ.
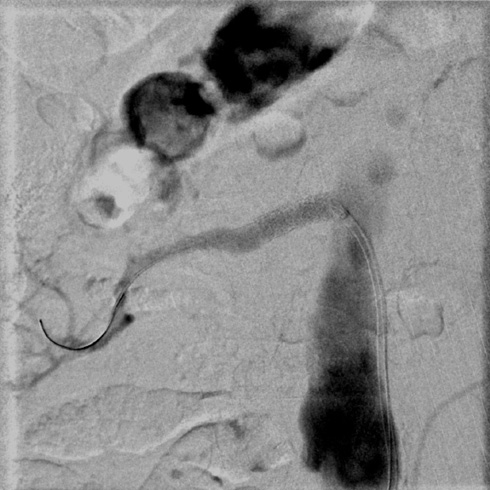
Рис. 4 Контрольная карбоксиангиография после БАП и имплантации стента в правой ПА.
Примечание: БАП — баллонная ангиопластика.
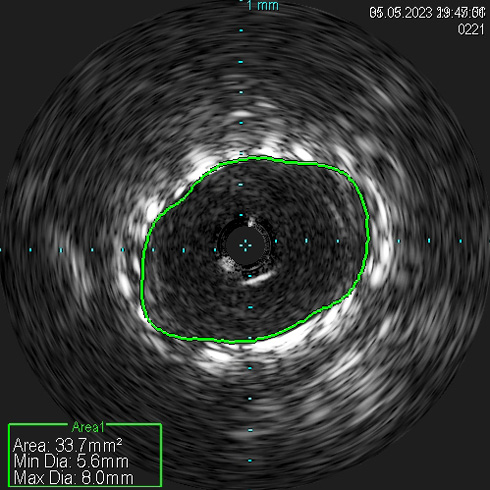
Рис. 5 Контрольное ВСУЗИ после БАП и имплантации стента в правой ПА.
Примечание: БАП — баллонная ангиопластика.
В стабильном состоянии пациент был переведен в отделение реанимации и интенсивной терапии, далее в палату наблюдения для дальнейшего наблюдения.
Динамика и исходы:
Послеоперационный период протекал гладко. Уровень креатинина на 2-е сут. после операции составил 298 мкмоль/л, расчетная СКФ 18 мл/мин/1,73 м². Пациент был выписан на 3-и сут. после операции под наблюдение кардиолога и нефролога по месту жительства. Были даны рекомендации по диете, соблюдению режима труда и отдыха. В качестве оптимальной медикаментозной терапии назначены ацетилсалициловая кислота 75 мг/сут., клопидогрел 75 мг/сут. в течение 6 мес. после стентирования, валсартан+сакубитрил 100 мг/сут., дапаглифлозин 10 мг/сут., карведилол 12,5 мг/сут., торасемид 5 мг/сут., аторвастатин 80 мг/сут., эзетимиб 10 мг/сут., кетостерил по 2 таблетки 3 раза в сут.
В дальнейшем при телефонном контроле состояния пациента через 3 мес.: жалоб не предъявляет, уровень креатинина — 213 мкмоль/л, расчетная СКФ 28 мл/мин/1,73 м².
Обсуждение
Необходимость реваскуляризации в бассейне правой ПА в данной клинической ситуации была продиктована сердечно-сосудистой и почечной коморбидностью в виде тяжелого поражения коронарного бассейна с развитием ХСН с низкой ФВ ЛЖ, а также прогрессирующей ХБП, которая рано или поздно потребовала бы проведения ЗПТ. К сожалению, риск смерти у пациентов с сердечно-сосудистыми заболеваниями на ЗПТ в десятки раз выше, чем в общей популяции, что связано с резким ускорением процессов сосудистого повреждения2. В данном случае использование бесконтрастных методов эндоваскулярной реваскуляризации с проведением карбоксиангиографии для ангиографической оценки стеноза и позиционирования стента в сочетании с внутрисосудистым контролем и измерением истинного диаметра артерии и аппозиции стента после имплантации дает ряд весомых преимуществ и является, возможно, единственным способом малоинвазивной максимально эффективной помощи пациенту. Как мы видим, данное вмешательство замедлило прогрессирование ХБП, что может увеличить время до начала ЗПТ, и соответственно отсрочить возникновение рядя ассоциированных с ней осложнений.
Заключение
В представленном клиническом случае вынесен для обсуждения коморбидный пациент высокого хирургического риска с критическим атеросклеротическим поражением почечной артерии, ИБС, ХСН и ХБП 4 стадии. В связи с невозможностью проведения вмешательства под контролем стандартной ангиографии с РКВ, была выбрана стратегия бесконтрастной эндоваскулярной реваскуляризации с использованием карбоксиангиографии и ВСУЗИ, что привело к хорошему непосредственному результату со снижением скорости прогрессирования ХБП в динамике через 3 мес. Несмотря на неблагоприятный долгосрочный прогноз пациента ввиду тяжелой коморбидности, интервенционное вмешательство позволило замедлить прогрессирование ХБП.
Информированное согласие: информированное согласие пациента на публикацию своих данных получено 06.06.2024.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. 2024 ESC Guidelines for the management of peripheral arterial and aortic diseases.
2. Клинические рекомендации: Хроническая болезнь почек. Ассоциация нефрологов. 2021г.
Список литературы
1. Арутюнов А. Г., Батлук Т. И., Башкинов Р. А. и др. Мультифокальный атеросклероз: фокус на профилактике развития ишемических событий. Российский кардиологический журнал. 2021;26(12):4808. doi:10.15829/1560-4071-2021-4808.
2. Идрисов И. А., Хафизов Т. Н., Хафизов Р. Р. и др. Стеноз почечных артерий. Диагностика и тактика лечения пациентов (обзор литературы). Креативная хирургия и онкология. 2021;11(3):235-43. doi:10.24060/2076-3093-2021-11-3-235-243.
3. Aboyans V, Ricco JB, Bartelink MEL, et al. 2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery. Eur Heart J. 2018;39(9):763-816. doi:10.1093/eurheartj/ehx095.
4. Wheatley K, Ives N, Gray R, et al. Revascularization versus medical therapy for renal-artery stenosis. N Engl J Med. 2009; 361(20):1953-62. doi:10.1056/NEJMoa0905368.
5. Cooper CJ, Murphy TP, Cutlip DE, et al. Stenting and medical therapy for atherosclerotic renal-artery stenosis. N Engl J Med. 2014;370(1):13-22. doi:10.1056/NEJMoa1310753.
6. Tuttle KR, Dworkin LD, Henrich W, et al. Effects of Stenting for Atherosclerotic Renal Artery Stenosis on eGFR and Predictors of Clinical Events in the CORAL Trial. Clin J Am Soc Nephrol. 2016;11(7):1180-8. doi:10.2215/CJN.10491015.
7. Hicks CW, Clark TWI, Cooper CJ, et al. Atherosclerotic Renovascular Disease: A KDIGO (Kidney Disease: Improving Global Outcomes) Controversies Conference. Am J Kidney Dis. 2022;79(2):289-301. doi:10.1053/j.ajkd.2021.06.025.
8. Reinhard M, Schousboe K, Andersen UB, et al. Renal Artery Stenting in Consecutive High-Risk Patients With Atherosclerotic Renovascular Disease: A Prospective 2-Center Cohort Study. J Am Heart Assoc. 2022;11(7):e024421. doi:10.1161/JAHA.121.024421.
9. Homorodean C, Ober MC, Spinu M, et al. Outcomes after stenting of renal artery stenosis in patients with high-risk clinical features. Egypt Heart J. 2024;76(1):4. doi:10.1186/s43044-024-00435-z.
10. Казанцев А. В., Бурков Н. Н., Лидер Р. Ю. и др. Госпитальные результаты стентирования почечных артерий у пациентов с мультифокальным атеросклерозом. Хирургия. Журнал им. Н. И. Пирогова. 2020;(3):43-7. doi:10.17116/hirurgia202003143.
11. Li Y, Wang J. Contrast-induced acute kidney injury: a review of definition, pathogenesis, risk factors, prevention and treatment. BMC Nephrol. 2024;25(1):140. doi:10.1186/s12882-024-03570-6.
12. Adachi Y, Endo A, Nakashima R, et al. Renal Artery Stenting Using CO2 Gas Angiography in Combination with Iodinated Contrast Angiography. Intern Med. 2016;55(17):2419-22. doi:10.2169/internalmedicine.55.6846.
13. Семухина Е. Н., Семухин М. В., Зырянов И. П. и др. Поэтапное стентирование почечных артерий под контролем внутрисосудистого ультразвукового исследования у пациента с рефрактерной артериальной гипертонией. Сибирский медицинский журнал. 2013;28(2):69-74.
14. Lee SR, Ali S, Cardella J, et al. Carbon dioxide angiography during peripheral vascular interventions is associated with decreased cardiac and renal complications in patients with chronic kidney disease. J Vasc Surg. 2023;78(1):201-8. doi:10.1016/j.jvs.2023.03.029.
Об авторах
Д. К. ВасильевРоссия
к.м.н., врач по РЭВДиЛ, руководитель отдела рентгенэндоваскулярной и сердечно-сосудистой хирургии им. проф. В. П. Мазаева
Москва
Н. А. Араблинский
Россия
врач-кардиолог, врач по РЭВДиЛ, м.н.с. отдела рентгенэндоваскулярной и сердечно-сосудистой хирургии им. проф. В. П. Мазаева.
Москва
Ф. Б. Шукуров
Россия
врач по РЭВДиЛ, к.м.н., с.н.с., руководитель лаборатории интервенционной радиологии.
Москва
Д. А. Фещенко
Россия
врач по РЭВДиЛ, м.н.с. лаборатории интервенционной радиологии, зав. операционным блоком.
Москва
М. Т. Талиуридзе
Россия
врач по РЭВДиЛ, м.н.с. лаборатории интервенционной радиологии.
Москва
А. С. Шаноян
Россия
к.м.н., зав. отделением рентгенхирургических методов диагностики и лечения, врач по РЭВДиЛ, врач-кардиолог.
Москва
Н. П. Федотова
Россия
к.м.н., врач-кардиолог отделения рентгенхирургических методов диагностики и лечения.
Москва
- Вплоть до 30% пациентов с атеросклеротическим поражением в бассейне коронарных артерий имеют также атеросклеротическое поражение почечных артерий различной степени выраженности.
- Оптимальная стратегия ведения пациентов с атеросклеротическим поражением почечных артерий должна включать в себя назначение привычных в кардиологической практике комбинаций медикаментозных препаратов, а также у ряда пациентов — эндоваскулярную баллонную ангиопластику и стентирование пораженного сегмента почечной артерии.
- Использование йодсодержащих рентгеноконтрастных препаратов ограничено при наличии у пациента хронической болезни почек с выраженным снижением азот-выделительной функции. Использование эндоваскулярных технологий с применением внутрисосудистой визуализации и карбоксиангиографии может стать выходом из сложившейся ситуации.
- Представлен клинический случай успешной ангиопластики и стентирования критического стеноза правой почечной артерии под контролем карбоксиангиографии и внутрисосудистого ультразвукового исследования с хорошим отсроченным результатом.
Рецензия
Для цитирования:
Васильев Д.К., Араблинский Н.А., Шукуров Ф.Б., Фещенко Д.А., Талиуридзе М.Т., Шаноян А.С., Федотова Н.П. Возможности карбоксиангиографии при лечении критического поражения почечной артерии у пациента с хронической болезнью почек. Клинический случай. Кардиоваскулярная терапия и профилактика. 2024;23(12):4189. https://doi.org/10.15829/1728-8800-2024-4189. EDN: JPVQZG
For citation:
Vasiliev D.K., Arablinsky N.A., Shukurov F.B., Feshchenko D.A., Taliuridze M.T., Shanoyan A.S., Fedotova N.P. Potential of carbon dioxide angiography in the treatment of critical renal artery lesions in a patient with chronic kidney disease: a case report. Cardiovascular Therapy and Prevention. 2024;23(12):4189. (In Russ.) https://doi.org/10.15829/1728-8800-2024-4189. EDN: JPVQZG
JATS XML

























































