Перейти к:
Оценка метаболитов пуринового обмена после аортокоронарного шунтирования у пациентов с избыточной и нормальной массой тела
https://doi.org/10.15829/1728-8800-2025-4213
EDN: JLTSXI
Аннотация
Цель. Изучить динамику пуринового обмена у пациентов с избыточной массой тела (ИзбМТ), перенесших аортокоронарное шунтирование (АКШ), в ранний послеоперационный период и на этапах реабилитации в сравнении с таковой у пациентов с нормальной массой тела.
Материал и методы. Проведено проспективное исследование, в которое были включены 155 пациентов, из них 87 (56%) мужчин и 68 (44%) женщин, перенесших АКШ в связи с критическим стенозом коронарных артерий; у всех пациентов диагностировано однососудистое поражение коронарного русла. Возрастной диапазон составил 35-65 лет. Больные были разделены на 3 группы: 1 группу (n=85) составили лица с ИзбМТ, во 2 (n=70) вошли пациенты с нормальной массой тела, 3 группу (группу контроля) составили 30 здоровых лиц. Было оценено изменение уровня метаболитов пуринового обмена в динамике: на 1 сут. после восстановления кровотока в кардиохирургическом центре, а далее: на 1 (от 1 до 3 мес.), 2 (от 3 до 6 мес.) и 3 (от 6 мес. до 1 года) этапах реабилитации в кардиореабилитационном центре. Статистический анализ данных проводился с помощью программного обеспечения SPSS 27.0 и и MedCalc версии 22. Данные представлены в виде таблиц и графиков с использованием программного обеспечения GraphPad PrismTM (версия 7).
Результаты. У пациентов с ИзбМТ после АКШ уровень пуринов сначала снижается, в т.ч. на 1 и 2 этапах реабилитации, а затем — на 3 этапе реабилитации — резко повышается.
Заключение. У пациентов с ИзбМТ уровень метаболитов пуринового обмена резко повышается после АКШ на 3 этапе реабилитации по сравнению с таковым на 1 и 2 этапах, что предполагает возобновление активности патологического процесса (ишемии, воспаления).
Для цитирования:
Сейтекова А.Н., Молотов-Лучанский В.Б., Понамарева О.А., Мершенова Г.Ж., Екижанова Б.Т., Вистерничан О.А., Шаухат Д.М., Жумабекова И.К., Бейникова И.В., Айтишева Л.Б., Ауашева А.Б., Косыбаева М.Е., Мырзашова Н.Б., Дильдабекова А.С. Оценка метаболитов пуринового обмена после аортокоронарного шунтирования у пациентов с избыточной и нормальной массой тела. Кардиоваскулярная терапия и профилактика. 2025;24(10):4213. https://doi.org/10.15829/1728-8800-2025-4213. EDN: JLTSXI
For citation:
Seytekova A.N., Molotov-Luchansky V.B., Ponomareva O.A., Mershenova G.Zh., Ekizhanova B.T., Visternichyan O.A., Shaukhat D.M., Zhumabekova I.K., Beynikova I.V., Aitisheva L.B., Auasheva A.B., Kosybaeva M.E., Myrzashova N.B., Dildabekova A.S. Evaluation of purine metabolites after coronary artery bypass grafting in overweight and normal-weight patients. Cardiovascular Therapy and Prevention. 2025;24(10):4213. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4213. EDN: JLTSXI
Введение
Cердечно-сосудистые заболевания (ССЗ) остаются наиболее серьёзной проблемой здравоохранения во многих странах мира, включая Казахстан1 [1]. Роль фатальных осложнений ССЗ в мировом масштабе имеет большое значение, поскольку они являются ведущей причиной в структуре смертности населения2. По прогнозу Всемирной организации здравоохранения (ВОЗ), к 2030г у 23,6 млн человек трудоспособного возраста смерть может наступить от ССЗ3. Широкое применение интервенционных методов лечения позволило добиться прогресса в лечении ССЗ. Вместе с тем последующие этапы реабилитации обнажили серьезные проблемы, возникающие вследствие развивающихся постреперфузионных осложнений [2-6].
Немаловажную роль в развитии ССЗ играет метаболический синдром, одним из компонентов которого является избыточная масса тела (ИзбМТ) или абдоминальное ожирение, которое называют новой неинфекционной "эпидемией" XXIв4.
По последним оценкам ВОЗ5 [7], >1 млрд человек на планете имеет избыточный вес и отмечается тенденция к дальнейшему увеличение числа лиц с ИзбМТ, в особенности среди трудоспособного населения. ИзбМТ в настоящее время рассматривается как независимый фактор риска ССЗ6. Однако по сравнению с ожирением ИзбМТ недостаточно принимается во внимание при определении рисков развития постреперфузионных осложнений у пациентов, перенесших вмешательство на коронарных сосудах сердца, в послеоперационном периоде на различных стадиях реабилитационного процесса.
Анализируя данные, полученные в процессе проведенных исследований [8][9], можно сделать вывод о негативном влиянии ИзбМТ на функциональные возможности сердца. Отмечается, что более высокие значения индекса массы тела (ИМТ) коррелируют с развитием атеросклероза в шунтах. Ряд исследователей считает, что избыточный вес может стать причиной развития нежелательных явлений после реваскуляризации миокарда и самостоятельным предиктором повышенного риска смерти у пациентов, перенесших аортокоронарное шунтирование (АКШ) [10][11].
Восстановление кровотока купирует ишемическое повреждение, но парадоксальным образом может запустить независимое повреждение, вызываемое реперфузией. Впервые 65 лет назад Jennings RM (1960г) [12] предложил концепцию реперфузионных поражений, которую обосновал в эксперименте на изолированных сердцах собак. В этих экспериментах миокард собаки в течение 60 мин подвергался реперфузии, при которой наблюдалась повреждение, соответствовавшее некрозу, возникающему после 24-часовой окклюзии коронарной артерии.
На сегодняшний день актуальным является поиск новых биохимических маркеров ранней диагностики осложнений после реваскуляризации миокарда. В частности, интерес вызывает изучение роли пуринов в развитии патологических процессов в реваскуляризированном миокарде у пациентов с ИзбМТ.
Основными пуриновыми основаниями являются аденин и гуанин, а интермедиатами в процессах их метаболизма являются ксантин и гипоксантин Конечным продуктом катаболизма пуринов является окисленное пуриновое основание — мочевая кислота. Свое действие на клетки пурины осуществляют путем активации специфических рецепторов, которые широко представлены в клетках кровеносных сосудов, миокарда и других органов [13]. Типы пуриновых Р2Y-рецепторов различаются в зависимости от состояния миокарда: в здоровом сердце и в кардиомиоцитах при сердечной недостаточности они имеют разную структуру, что подтверждает их роль в регуляции функций миокарда [14]. В связи с этим представляется актуальным изучение пуринового обмена у пациентов с ИзбМТ после АКШ.
Цель исследования — изучить динамику пуринового обмена у пациентов с ИзбМТ, перенесших АКШ, в ранний послеоперационный период и на этапах реабилитации в сравнении с таковой у пациентов с нормальной массой тела (НорМТ).
Материал и методы
Проведено проспективное исследование в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской Декларации. Исследование было одобрено Комитетом по биоэтике Некоммерческого акционерного общества "Медицинский университет Караганды", протокол № 16 от 15.03.2021.
В работу были включены 155 пациентов, из них них 87 (56%) мужчин и 68 (44%) женщин в возрасте 35-65 лет с однососудистым поражением коронарного русла, которым проведено АКШ. Средний возраст составил 59±6 лет. Пациентам было проведено традиционное АКШ, которое выполнялось путем срединной стернотомии при искуственном кровообращении.
Критерии включения: пациенты с НорМТ и ИзбМТ при ИМТ от 25 до 29,9 кг/м² после АКШ. Критерии невключения: острый инфаркт миокарда, хроническая сердечная недостаточность ІІІ-IV функционального класса; острые нарушения мозгового кровообращения; сахарный диабет 1 и 2 типа в состоянии декомпенсации; ожирение І-ІІІ ст.
Больные были разделены на 3 группы: 1 группу составили 85 пациентов после АКШ с ИзбМТ (ИМТ =28,0±0,9 кг/м²), из них 48 мужчин и 37 женщин; во 2 группу вошли 70 пациентов после АКШ НорМТ (ИМТ =23,3±1,1 кг/м²), из них 39 мужчин и 31 женщина. У пациентов и 1, и 2 группы в предреваскуляризационном периоде и далее на этапах реабилитации клиники стенокардии не было. Группу контроля (3 группа) составили 30 добровольцев соответствующего возраста без острых и хронических заболеваний с ИМТ 20,4±0,7 кг/м², из них 19 мужчин и 11 женщин.
До начала исследования от всех пациентов и здоровых лиц было получено информированное согласие на участие в исследовании.
Исследование проведено в ранний послеоперационный период и в сроки, установленные приказами № 116 и № 65 Министерства здравоохранения Республики Казахстан для трех этапов кардиореабилитации
Изменение метаболитов пуринового обмена оценивалось в динамике: на 1 сут. после восстановления кровотка в областном кардиохирургическом центре, а также на 1 (от 1 до 3 мес.), 2 (от 3 до 6 мес.), 3 (от 6 мес. до 1 года) этапах реабилитации в кардиореабилитационном центре "Тулпар".
Лечение пациентов обеих групп было унифицированным, соответствующим стандартам, вне зависимости от массы тела. На стационарном уровне пациенты получали традиционное лечение (кардиопротективная, антиагрегантная, гипотензивная, антиангинальная, гиполипидемическая терапия). В реабилитационном центре подключались соответствующие программы (лечебная физкультура, дыхательная гимнастика, массаж, физиотерапевтические процедуры — по показаниям) в сочетании со стандартами кардиопротективной терапии.
Пурины и их промежуточные продукты, гуанин, гипоксантин, аденин, ксантин и мочевую кислоту определяли в плазме венозной крови и в эритроцитах методом прямой спектрофотометрии (модель "PD — 303UV", Япония, согласно методу Орешникова Е. В. и др. (2008) [15]. В стандартную стеклянную пробирку вносили 0,3 мл плазмы (отмытых эритроцитов) крови. Затем проводили термокоагуляцию на кипящей водяной бане в течение 5 мин. Обязательным условием являлось активное кипение во избежание дефрагментации коагулянта. После остывания при комнатной температуре в течение нескольких мин в пробирку наливали 3 мл бидистиллированной воды. Через 30 мин инкубации при 37 °С измеряли экстинкцию экстракта против чистого экстрагента (бидистиллированная вода) в кювете с длиной оптического хода 10 мм. При этом исходили из того, что экстинкции при длине волны 246, 250, 261, 276 и 293 нм, соответственно, отражают концентрации в плазме и эритроцитах крови гуанина, гипоксантина, аденина, ксантина и мочевой кислоты. Концентрацию пуринов и их катаболитов выражали в единицах экстинкции (ед.экст.), концентрацию мочевой кислоты — в мкмоль/л. Для расчета концентрации пуринов/катаболитов использовали формулу: C=E×1000, где: С — концентрация метаболитов пуринового обмена, выраженная в ед.экст.; Е — измеренное значение оптической плотности (экстинкции) исследуемого образца при соответствующей длине волны (обычно определяется спектрофотометрически); 1000 — коэффициент пересчёта оптической плотности (экстинкции) в условные единицы концентрации.
Статистический анализ данных проводился с помощью программного обеспечения SPSS 27.0 и и MedCalc версии 22. Данные представлены в виде таблиц и графиков с использованием программного обеспечения GraphPad PrismTM (версия 7). Оценка нормальности распределения осуществлена с помощью критерия Колмогорова-Смирнова.
Количественные показатели, учитывая распределение, отличное от нормального, описаны с использованием медианы (Ме) и интерквартильного размаха (Q25; Q75). Учитывая непараметрическое распределение данных, сравнительный анализ количественных данных между группами был проведен с использованием шкалы Манна-Уитни или Краскела-Уоллиса. Сравнительный анализ количественных данных в динамике был проведен с использованием критерия Фридмана. Точность предиктора определялась площадью под ROC-кривой (AUC) (of the receiver operating characteristic, ROC). AUC с 95% доверительным интервалом (ДИ) были рассчитаны для оценки диагностического значения ИМТ. С помощью ROC-анализа было определено оптимальное значение порога классификации или порога отсечения (cut-off value), который соответствовал точке на ROC-кривой с наибольшим показателем чувствительности при наименьшем значении ложноположительных результатов. Указанная точка на кривой определялась с помощью расчёта индекса Youden. Статистические тестовые различия считались значимыми при значении p<0,05.
Результаты
Характеристика пациентов исследуемой выборки по возрасту, полу и антропометрическим данным представлена в таблице 1. В исследовании приняло участие 87 (56%) мужчин, что в 1,2 раза больше, чем женщин — 68 (44%). Возрастной диапазон обследованных укладывался в интервал 52-64 лет. Среднее значение возраста составило 59±6 лет. ИзбМТ в 1 группе характеризовалась соответствующим индексом, который балансировал около нижнего порога ожирения или верхней границы ИзбМТ (ИМТ 28,0±0,9 кг/м²), 2 группа устойчиво сохраняла массу тела в пределах нормальных значений, ИМТ составил 23,3±1,1 кг/м². Площадь поверхности тела в 1 группе составила 2,4±0,18 м², во 2 группе — 1,7±0,11 м². Соответственно достоверно различались площади поверхности тела у обследуемых групп (таблица 1).
Таблица 1
Антропометрические данные пациентов 1 и 2 группы (М±SD)
|
Показатель |
Статистика (n=155) |
p* |
|
Возраст, годы, M±SD |
59±6 |
0,347 |
|
Пол, n (%) |
0,598 |
|
|
— Мужчины |
87 (56) |
|
|
— Женщины |
68 (44) |
|
|
ИМТ, кг/м², M±SD |
0,001 |
|
|
— 1 группа |
28,0±0,9) |
|
|
— 2 группа |
23,3±1,1) |
|
|
ППТ, м², M±SD |
0,001 |
|
|
— 1 группа |
2,4±0,18 |
|
|
— 2 группа |
1,7±0,11 |
Примечание: ИМТ — индекс массы тела, ППТ — площадь поверхности тела, M±SD — среднее± стандартное отклонение.
В таблице 2 представлены уровни метаболитов пуринового обмена обследованных лиц. Все показатели в 1 и во 2 группах были статистическии значимо (p<0,05) повышены по сравнению с контрольной группой. Следует отметить и статистически значимое (p<0,05) повышение данных показателей в 1 группе по сравнению со 2 (таблица 2).
Таблица 2
Сравнительный анализ уровней метаболитов пуринового обмена в плазме и эритроцитах крови в 1, 2 группе и в группе контроля
|
Показатель, ед.экст., Me [ Q25-Q75] |
Плазма крови |
p |
Эритроциты |
p |
||||
|
1 группа (n=85) |
2 группа (n=70) |
Контроль (n=30) |
1 группа (n=85) |
2 группа (n=70) |
Контроль (n=30) |
|||
|
Гуанин |
252 (215-287) |
182 (156-271) |
120,5 (106,7-139) |
0,001* |
460 (395-523) |
374 (296-496) |
237,5 (182-306) |
0,001* |
|
Аденин |
212 (144-254) |
143 (109-242) |
110,0 (99,5-125,5) |
0,001* |
524 (443-609) |
420 (297-547) |
232 (168-270) |
0,001* |
|
Гипоксантин |
206 (168-279) |
151 (114-256) |
84,0 (72,0-102,2) |
0,001* |
506 (439-564) |
405 (315-539) |
295 (262-370) |
0,001* |
|
Ксантин |
203 (170-280) |
179 (140-221) |
131,0 (85,5-150,5) |
0,001* |
235 (186-293) |
213 (153-261) |
135,5 (113-180) |
0,013* 0,001** |
|
Мочевая кислота, мкмоль/л |
292 (233-433) |
206 (164-349) |
135,5 (107,7-189) |
0,001* |
121 (100-137) |
100 (77-112) |
70,0 (68,7-76) |
0,001* |
Примечание: * — при сравнении между группами 1 и 2; ** — при сравнении между группой 1 и контролем, Me [ Q25-Q75] — медиана [интерквартильный размах].
На рисунке 1 представлена динамика изменений пуринового обмена в плазме крови на этапах реабилитации. Согласно полученным результатам, метаболиты пуринового обмена в плазме крови были статистически значимо повышены в 1 группе по сравнению со 2 группой.
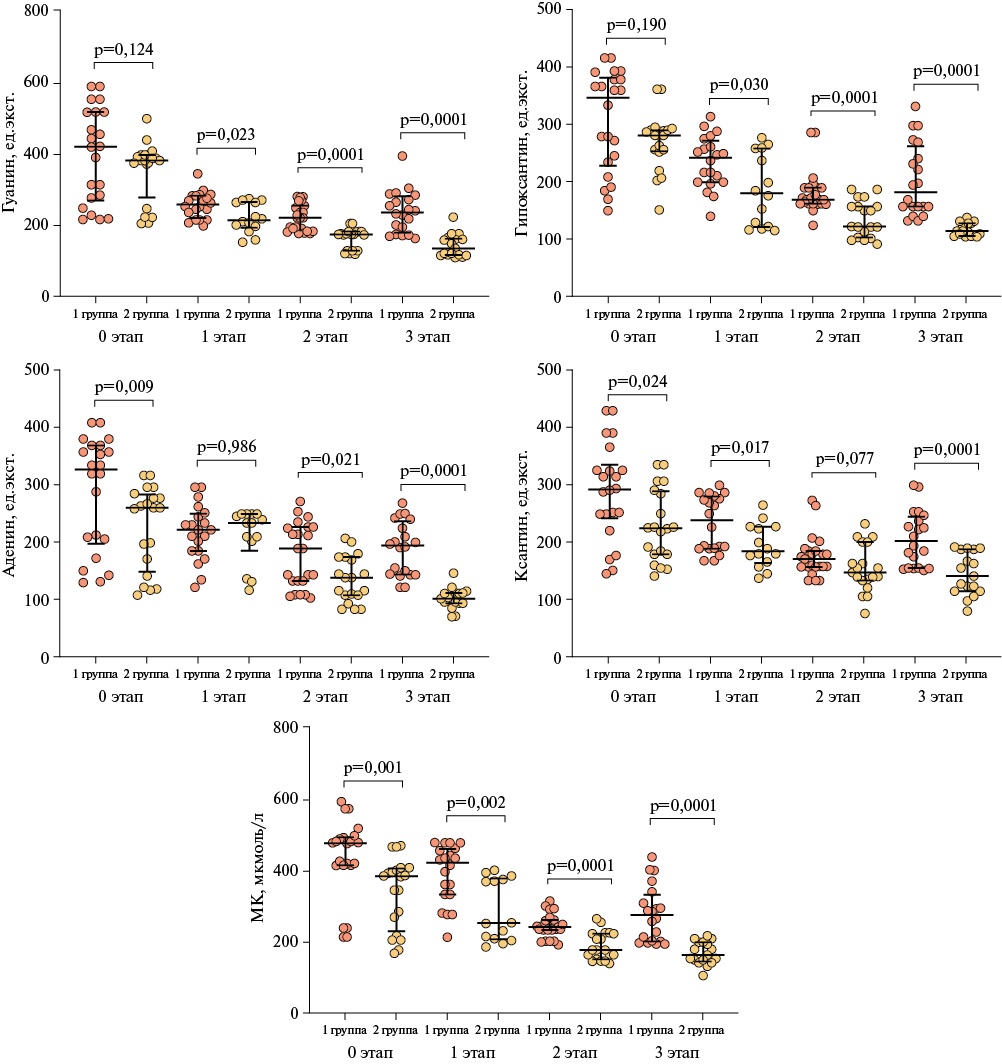
Рис. 1 Сравнительный анализ уровней метаболитов пуринового обмена в плазме крови в 1 и 2 группе в зависимости от этапов реабилитации (Me [ Q25; Q75]).
Примечание: МК — мочевая кислота, Me [ Q25-Q75] — медиана [интерквартильный размах].
Интермидиаты пуринового обмена в эритроцитах крови были статистически значимо выше в 1 группе по сравнению со 2 группой на 3 этапе реабилитации (рисунок 2). Обращает на себя внимание, что в 1 группе наиболее значимым оказалось повышение в плазме уровней гуанина и мочевой кислоты, а в эритроцитах — аденина и гипоксантина. Во 2 группе отмечается тенденция поэтапного снижения показателей интермидиатов пуринового обмена, тогда как в 1 группе уровень пуринов, поэтапно снижаясь, резко повышается на 3 этапе реабилитации.
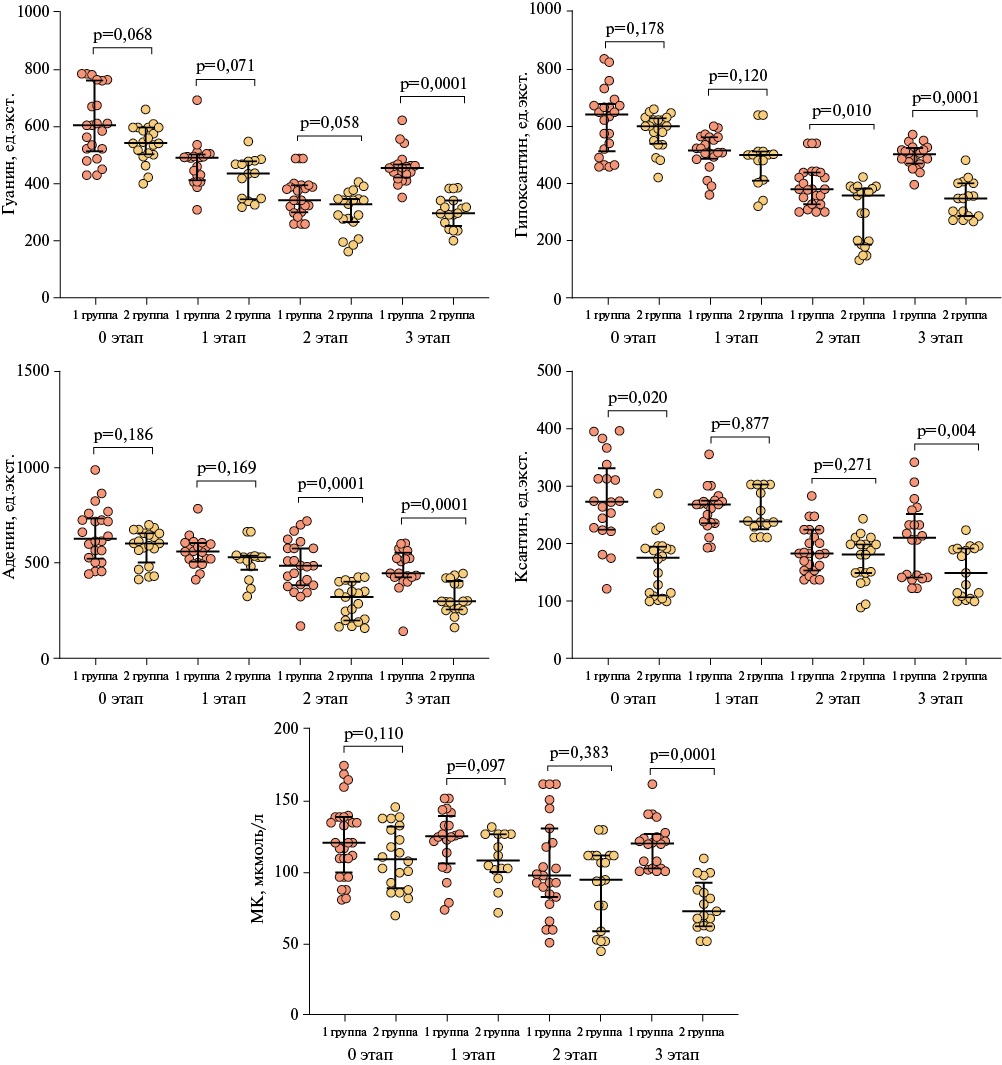
Рис. 2 Сравнительный анализ уровней метаболитов пуринового обмена в эритроцитах крови в 1 и 2 группе в зависимости от этапов реабилитации (Me [ Q25; Q75]).
Примечание: МК — мочевая кислота, Me [ Q25-Q75] — медиана [интерквартильный размах].
Для анализа взаимосвязи между ИМТ и показателями пуринового обмена, а также для оценки их вклада в развитие постреперфузионных нарушений после АКШ был проведён регрессионный анализ метаболитов пуринового обмена на различных этапах реабилитации (рисунок 3, таблица 3).
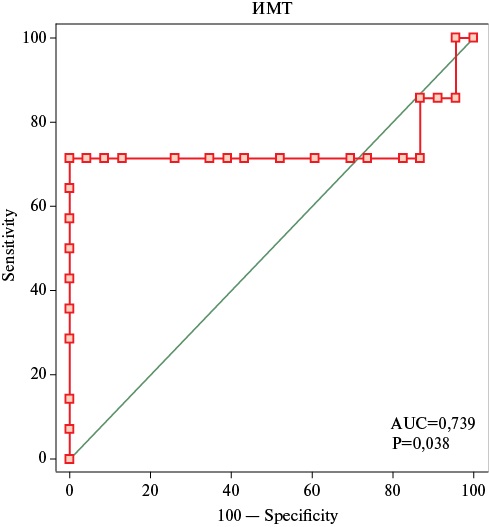
Рис. 3 ROC-кривая для прогнозирования развития изменений в параметрах пуринового обмена у исследуемых пациентов на 3 этапе реабилитации.
Примечание: AUC (площадь под ROC-кривой) и значения p для значимых показателей показаны на графике.
Таблица 3
Характеристики ROC-кривых для оценки диагностической точности ИМТ при выявлении выраженных изменений пуринового обмена у пациентов после АКШ
|
Cut-off |
Точка Youden |
AUC (95% ДИ) |
Чувствительность, % (95% ДИ) |
Специфичность, % (95% ДИ) |
р |
|
|
ИМТ, кг/м² |
>28,08 |
0,7143 |
0,739 (0,569-0,869) |
71,43 (41,9-91,6) |
100 (85,2-100,0) |
0,038 |
Примечание: ДИ — доверительные интервал, ИМТ — индекс массы тела, AUC — площадь под ROC-кривой.
Результаты анализа показали, что на 1 и 2 этапах реабилитации статистически значимых ассоциаций между ИМТ и концентрациями пуриновых метаболитов не выявлено (p=0,348 и p=0,380, соответственно). Однако на 3 этапе реабилитации установлена достоверная связь между увеличением ИМТ и ростом уровня метаболитов пуринового обмена, что указывает на участие ИзбМТ в активации метаболических процессов, ассоциированных с ишемией и воспалением миокарда. При увеличении ИМТ на одну единицу отношение шансов (odds ratio, OR) составило 1,36 (95% доверительный интервал, ДИ): 1,01-1,83; p=0,040), что свидетельствует о повышении вероятности выраженных изменений пуринового обмена у пациентов с ИзбМТ.
Для количественной оценки диагностической ценности ИМТ в выявлении выраженных изменений пуринового обмена у пациентов после АКШ использован ROC-анализ. Построенная ROC-кривая позволила определить площадь под кривой (AUC=0,739; 95% доверительный интервал ДИ: 0,569-0,869; p=0,038), что свидетельствует о достаточной диагностической точности ИМТ. Пороговое значение ИМТ составило 28,1 кг/м², при этом чувствительность составила 71,4%, а специфичность — 100%. Данный порог отражает границу, выше которой риск выраженных метаболических нарушений, ассоциированных с постреперфузионными осложнениями, существенно возрастает.
Эти данные свидетельствуют о том, что ИзбМТ является значимым метаболическим фактором, способствующим активации пуринового катаболизма на поздних этапах реабилитации после АКШ, что может отражать возобновление патологических процессов ишемическо-воспалительного характера.
Таким образом, у пациентов с ИзбМТ отмечается тенденция к нарастанию пуринового дисбаланса в поздний реабилитационный период, что может рассматриваться как ранний биохимический маркер риска развития постреперфузионных нарушений.
Обсуждение
Полученные данные позволяют предположить, что выявленная динамика показателей пуринового обмена у пациентов с ИзбМТ после АКШ отражает вовлечение пуриновых метаболитов в патологические процессы, инициированные окислительным стрессом. Повышение уровней пуринов и их катаболитов может свидетельствовать об активации цепи биохимических реакций, лежащих в основе ишемически-реперфузионного повреждения миокарда и связанных с ним осложнений. Известно, что окислительный стресс играет ключевую роль в развитии и прогрессировании целого ряда заболеваний — атеросклероза, хронической сердечной недосататочности, артериальной гипертензии, кардиопатии, почечной недостаточности, сахарного диабета и других патологических состояний7,8 [16-22].
В условиях избытка активных форм кислорода нарушается энергетический обмен кардиомиоцитов, что сопровождается усиленным катаболизмом пуринов и накоплением их конечных продуктов (гипоксантина, ксантина, мочевой кислоты).
В настоящем исследовании именно уровни пуриновых оснований и их катаболитов рассматривались как потенциальные биохимические маркеры постреперфузионных нарушений, а ИМТ использовался в качестве клинико-антропометрического модификатора, влияющего на выраженность метаболических изменений. Установленные различия между группами указывают на возможную роль пуринового обмена в патогенезе постреперфузионного повреждения миокарда у пациентов с ИзбМТ.
Не вызывает сомнений, что пуриновый обмен претерпевает изменения при различных патологических состояниях. Установлены его нарушения при ревматических заболеваниях [23], болезнях мочеполовой системы [24], органов дыхания [25]. Однако в настоящей работе пациенты с острыми патологическими процессами и обостренями хронических заболеваний в исследование не включались.
Повышение концентрации пуриновых метаболитов в плазме крови может быть обусловлено несколькими патогенетическими механизмами.
Первый механизм связан с ишемически-реперфузионным повреждением миокарда. В условиях ишемии вследствие дефицита кислорода и энергии в кардиомиоцитах происходит ускоренный распад адениновых нуклеотидов: аденозинтрифосфат (АТФ) → аденозиндифосфат (АДФ) → аденозинмонофосфат (АМФ) → гипоксантин, ксантин и мочевая кислота). После восстановления кровотока развивается феномен "ишемически-реперфузионного парадокса", при котором внезапное поступление кислорода вызывает чрезмерную генерацию активных форм кислорода. Эти радикальные соединения инициируют окислительный стресс, повреждающий мембраны и митохондрии кардиомиоцитов, что приводит к их апоптозу и некрозу. Разрушение клеток, в свою очередь, сопровождается выходом пуриновых оснований и их катаболитов в системный кровоток, что и проявляется ростом их концентрации в плазме [26][27].
Второй механизм повышения уровней пуринов связан с нарушением их обратного транспорта и утилизации клетками. В норме пуриновые основания частично реутилизируются через систему пуринового "спасательного" пути с участием ферментов гипоксантин-гуанин-фосфорибозилтрансферазы. При метаболическом стрессе, характерном для пациентов с ИзбМТ, активность этих ферментов снижается, а экспрессия пуриновых транспортеров и рецепторов (P1- и P2Y-рецепторов) на клеточных мембранах нарушается. Это приводит к накоплению внеклеточных пуринов, особенно гипоксантина и мочевой кислоты, и дальнейшему усилению окислительных процессов [28].
Таким образом, оба механизма — усиленный катаболизм пуринов в условиях ишемии-реперфузии и нарушение их утилизации — способствуют системному повышению уровня пуриновых метаболитов, отражая активацию окислительного стресса и клеточного повреждения у пациентов после АКШ, особенно при наличии ИзбМТ.
В условиях ишемии и реперфузии наблюдается активация катаболизма адениновых нуклеотидов, что сопровождается снижением общего пула АТФ, АДФ и АМФ в клетках миокарда. Этот процесс связан с действием фермента АМФ-дезаминазы, катализирующей превращение АМФ в инозинмонофосфат. Фермент активируется при снижении энергетического заряда клетки, т.е. при дефиците АТФ и избытке АДФ/АМФ, что отражает нарушение энергетического метаболизма кардиомиоцитов. В результате усиливается образование промежуточных продуктов пуринового обмена — инозина, гипоксантина, ксантина и конечного метаболита — мочевой кислоты, концентрация которых возрастает как внутри, так и вне клеток.
Ишемически-реперфузионный парадокс сопровождается разобщением окислительного фосфорилирования в митохондриях, нарушением функционирования электрон-транспортной цепи и снижением синтеза АТФ. Эти процессы приводят к повреждению мембран и гибели кардиомиоцитов, что сопровождается выходом пуриновых соединений в плазму крови [29-31].
Дополнительный вклад в повышение внеклеточной концентрации пуринов вносит апоптоз — контролируемая форма клеточной гибели, при которой из разрушающихся клеток высвобождаются низкомолекулярные нуклеотиды и их производные. Они выходят во внеклеточное пространство, где подвергаются последовательному катаболизму с образованием гипоксантина, ксантина и мочевой кислоты [32].
У пациентов с ИзбМТ эти механизмы выражены в большей степени. Согласно данным Furuhashi M, et al., 2020 [33], жировая ткань является значимым источником гипоксантина, и его концентрация положительно коррелирует с ИМТ. Авторы показали, что гипоксия в адипоцитах усиливает активность ксантиноксидазы и повышает продукцию гипоксантина, который далее окисляется до ксантина и мочевой кислоты. Этот каскад способствует развитию системного окислительного стресса и воспаления, что подтверждает метаболическую активность эпикардиальной и висцеральной жировой ткани как дополнительного источника пуриновых катаболитов.
Таким образом, результаты настоящего исследования, показавшие достоверное повышение уровней пуринов и их катаболитов после АКШ у пациентов с ИзбМТ по сравнению с пациентами с НорМТ, согласуются с выводами Furuhashi M, et al. о ключевой роли жировой ткани в регуляции пуринового обмена и генерации окислительного стресса.
Совокупность этих данных позволяет предположить, что увеличение содержания катаболитов пуринового обмена в плазме крови отражает степень ишемически-реперфузионного повреждения миокарда и выраженность метаболического дисбаланса, который усиливается у лиц с ИзбМТ. Вероятно, именно это определяет менее эффективное восстановление после АКШ и объясняет нарастание пуринового катаболизма к 3 этапу реабилитации.
Заключение
У пациентов с ИзбМТ после АКШ уровни метаболитов пуринового обмена в среднем выше в плазме крови на 13,5%, в эритроцитах крови на 12,2% по сравнению с данными показателями у пациентов с НорМТ, также перенесших АКШ.
Установлено, что у пациентов с ИзбМТ после АКШ наиболее значимо изменяется концентрация таких метаболитов пуринового обмена как гуанин и мочевая кислота, которые повышены в плазме в 1,4 раза; аденина и гипоксантина, которые повышены в эритроцитах в 1,3 раза, по сравнению с уровнем данных метаболитов у пациентов с НорМТ.
У пациентов с ИзбМТ уровень метаболитов пуринового обмена резко повышается после АКШ на 3 этапе реабилитации по сравнению с таковым на 1 и 2 этапах, что предполагает возобновление активности патологического процесса (ишемии, воспаления).
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. Ошакбаев К. П., Идрисов А. С., Абылайулы Ж. и др. Терапевтическая служба РК: показатели, тенденции, проблемы, научно-обоснованные подходы к совершенствованию, современные модели профилактической системы здравоохранения. Алматы. 2010;304.
2. Информация ВОЗ: Новейшая статистика сердечно-сосудистых заболеваний. Информационный бюллетень. https://www.who.int/ru/news-room/fact-sheets/detail/cardiovascular-diseases-(cvds) (11 июня 2021).
3. Информация ВОЗ: Сердечно-сосудистые заболевания. Информационный бюллетень. http://www.who.int/mediacentre/factsheets/fs317/ru/.
4. Информация ВОЗ: Ожирение и избыточная масса тела. Информационный бюллетень. https://www.who.int/ru/news-room/fact-sheets/detail/obesity-and-overweight.
5. Кремлев Д. Избыточный вес и сердечно-сосудистая сметрность. https://medach.pro/post/2271.
6. Информационный бюллетень ВОЗ. Ожирение и избыточный вес. http://www.who.int/mediacentre/factsheets/fs311/ru.
7. Ланкин В. З., Тихазе А. К. Окислительный и карбонильный стресс при атеросклерозе и диабете. Тезисы докладов Пленарного заседания. 2015:1618. elib.bsu.by›bitstream/123456789/119724/1/16.
8. Куликов В. Ю. Роль окислительного стресса в регуляции метаболической активности внеклеточного матрикса соединительной ткани. Медицина и образование в Сибири: электронный научный журнал. 2009;4. Режим доступа: http://ngmu.ru/cozo/mos/article/text_full.php?id=363.
Список литературы
1. Атарбаева В. Ш., Абдирова Т. М., Джусипов А. К. Повышение качества подготовки специалистов — приоритетное направление кафедры кардиологии и ревматологии. Вестник АГИУВ. 2011;4:3-4.
2. Комарова И. С., Желнов В. В., Андреева Н. В. и др. Постреперфузионный синдром у пациентов с ишемической болезнью сердца после коронарного стентирования. Клиническая медицина. 2018; 96(1):73-7. doi:10.18821/0023-2149-2018-96-1-73-77.
3. Хубулава Г. Г., Шишкевич А. Н., Михайлов С. С. и др. Синдром реперфузии миокарда: патогенез, клиника, диагностика. Вестник российской военно-медицинской академии. 2020;22(1):196-200. doi:10.17816/brmma25992.
4. Кoшелева Н. А., Мaгдеева Н. А., Фрoнтасьева В. В. и др. Реперфузионное повреждение миокарда после коронарного стентирования у больного с инфарктом миокарда с подъемом сегмента ST. Клиническое наблюдение. Архивъ внутренней медицины. 2016;6(6):65-7. doi:10.20514/2226-6704-2016-6-6-65-67.
5. Yang GZ, Xue FS, Liu YY, et al. Feasibility analysis of oxygen-glucose deprivation-nutrition resumption on H9c2 cells in vitro models of myocardial ischemia-reperfusion injury. Chin Med J (Engl). 2018;131(19):2277-86. doi:10.4103/0366-6999.241809.
6. Ягудин Т. А., Шабанова А. Т., Лиу Х. Новые аспекты в механизмах ишемического и реперфузионного повреждения миокарда. Креативная хирургия и онкология. 2018;8(3):216-24. doi:10.24060/2076-3093-2018-8-3-216-224.
7. Еганян Р. А. Избыточная масса тела и ожирение в первичном звене здравоохранения. Профилактическая медицина. 2010;4:12-21.
8. Лупанов В. П. Ожирение как фактор риска развития сердечно-сосудистых катастроф. Русский медицинский журнал. 2003;6:331.
9. Billington CJ, Goodwin NJ, Hill JO, et al. Overweight, obesity, and health risk. Arch Intern Med. 2000;160(7):898-904. doi:10.1001/archinte.160.7.898.
10. Кремлёв Д. И. Влияние положительной жировой дистрофии на развитие инфаркта миокарда. Парадокс ожирения. Вестник Российской военно-медицинской академии. 2018;3:204-11.
11. Сабирова Э. Ю., Чичерина Е. Н., Эпштейн А. М. Аортокоронарное шунтирование в лечении больных ишемической болезнью сердца. Вятский медицинский вестник. 2012;4:49-54.
12. Jennings RB, Sommers HM, Smyth GA, et al. Myocardial necrosis induced by temporary occlusion of a coronary artery in the dog. Arch Pathol. 1960;70:68-78.
13. Offermanns S. Activation of platelet function through G protein-coupled receptors. Circ Res. 2006; 99(12):1293-304. doi:10.1161/01.RES.0000251742.71301.16.
14. Грацианский Н. А. Антитромбоцитарная терапия при коронарной болезни сердца. Некоторые проблемы и достижения. Кардиология. 2010;3(54):19-22.
15. Орешников Е. В., Гунин А. Г., Мадьянов И. В. и др. Пурины крови и ликвора во время беременности. Проблемы репродукции. 2008;6:74-80.
16. Рагино Ю. И., Баум В. А., Полонская Я. В. и др. Атеросклероз и окислительные процессы. Новые способы оценки окислительной модификации белков. Бюллетень СО РАМН.2006;4(122):67-73.
17. Колесник М. Ю., Беленичев И. Ф., Дзяк Г. В. и др. Особенности функционирования митохондрий миокарда у крыс со спонтанной гипертензией (SHR) на фоне экспериментального сахарного диабета и атеросклероза. Запорожский медицинский журнал. 2012;2:26-30.
18. Ковалёва О. Н., Ащеулова Т. В., Герасимчук Н. Н. и др. Роль оксидативного стресса в становлении и прогрессировании гипертонической болезни. Научные ведомости Белгородского государственного университета. Серия: Медицина. Фармация. 2015;29;4(201):5-10.
19. Леонтьева И. В., Николаева Е. А. Кардиомиопатии при врожденных нарушениях метаболизма у детей. Российский вестник перинатологии и педиатрии. 2016;61(2):17-27. doi:10.21508/1027-4065-2016-61-2-17-27.
20. Ройтберг Г. Е. Метаболический синдром. Москва: МЕДпресс-информ, 2021:120. ISBN 978-5-00030-832-5.
21. Иванов В. В., Шахристова Е. В., Степовая Е. А. и др. Окислительный стресс: влияние на секрецию инсулина, рецепцию гормона адипоцитами и липолиз в жировой ткани. Бюллетень сибирской медицины. 2014;13(3):32-9. doi:10.20538/1682-0363-2014-3-32-39.
22. Провоторов В. М., Филатова Ю. И., Чернов А. В. Роль оксидативного стресса в патогенезе бронхиальной астмы. Прикладные информационные аспекты медицины. 2015;18(4):43-9.
23. Борисов В. В., Ставровская Е. В. Нарушения пуринового обмена: диагностика и терапия (клиническая лекция). Consilium Medicum. 2019;21(12):134-8. doi:10.26442/20751753.2019.12.190675.
24. Синюто О. В., Ноздрачева Е. В. Влияние нарушения пуринового обмена на функциональное состояние опорно-двигательного аппарата. Ученые записки Брянского государственного университета. 2021(1):48-52.
25. Shaukhat DM, Ibrayeva LK, Rybalkina DKh, et al. Assessment of purine catabolism and morbidity in miners depending on their work experience. Russian Open Medical J. 2024;13(1):1-8. doi:10.15275/rusomj.2024.0108.
26. Bical О, Gerhardt MF, Paumier D, et al. Comparison of different types of cardioplegia and reperfusion on myocardial metabolism and free radical activity. Circulation. 1991;84(5):375-9.
27. Кутепов Д. Е., Жигалова М. С., Пасечник И. Н. Патогенез синдрома ишемии-реперфузии. Казанский мед ж. 2018;99(4):640-4. doi:10.17816/KMJ2018-640.
28. Humphrey L, Fu R, Rogers K, et al. Homocysteine level and coronary heart disease incidence: a systematic review and meta-analysis. Mayo Clin Proc. 2008;83:1203-12. doi:10.4065/83.11.1203.
29. Гребенчиков О. А., Забелина Т. С., Филипповская Ж. С. и др. Окислительный стресс в кардиохирургии. Вестник анестезиологии и реаниматологии. 2016;13(4):53-60. doi:10.21292/2078-5658-2016-13-4-53-60.
30. Бульон В. В., Крылова И. Б., Селина Е. Н. Кардиопротекция при ишемическом повреждении миокарда. Обзоры по клинической фармакологии и лекарственной терапии. 2018;16(2):13-7. doi:10.17816/RCF16213-17.
31. Шемарова И. В., Нестеров В. П., Коротков С. М. и др. Участие Cа2+ в развитии ишемических нарушений сократительной функции миокарда. Журнал эволюционной биохимии и физиологии. 2017;53(5):328-37.
32. Jennings RB, Reimer KA, Hill ML, et al. Total ischemia in dog hearts, in vitro. 1. Comparison of high energy phosphate production, utilization, and depletion, and of adenine nucleotide catabolism in total ischemia in vitro vs. severe ischemia in vivo. Circ Res. 1981;l(49):892-900. doi:10.1161/01.res.49.4.892.
33. Furuhashi М, Koyama М, Higashiura Yu, et al. Differential regulation of hypoxanthine and xanthine by obesity in a general population. Diabetes Investig. 2020;11(4):878-87. doi:10.1111/jdi.13207.
Об авторах
А. Н. СейтековаКазахстан
Сейтекова Айжан Нурлановна — преподаватель-исследователь кафедры семейной медицины, докторант по специальности "Медицина".
ул. Гоголя, 40, Караганда, 100008
В. Б. Молотов-Лучанский
Казахстан
Молотов-Лучанский Вилен Борисович — д.м.н., профессор кафедры внутренних болезней.
ул. Гоголя, 40, Караганда, 100008
О. А. Понамарева
Казахстан
Понамарева Ольга Анатольевна — к.м.н., доцент, зав. кафедрой биомедицины.
ул. Гоголя, 40, Караганда, 100008
Г. Ж. Мершенова
Казахстан
Мершенова Гульжан Жумагалиевна — к.м.н., профессор кафедры семейной медицины.
ул. Гоголя, 40, Караганда, 100008
Б. Т. Екижанова
Казахстан
Екижанова Баян Толеухановна — директор кардио-реабилитационного центра "Тулпар".
ул. Касым Аманжолова, 79, Караганда, 100001
О. А. Вистерничан
Казахстан
Вистерничан Ольга Александровна — PhD, ассоцированный профессор кафедры внутренних болезней.
ул. Гоголя, 40, Караганда, 100008
Д. М. Шаухат
Казахстан
Шаухат Диана Мухамбетовна — ассистент кафедры внутренних болезней.
ул. Гоголя, 40, Караганда, 100008
И. К. Жумабекова
Казахстан
Жумабекова Индира Кайратовна — ассистент кафедры реабилитологии и спортивной медицины.
ул. Бейбитшилик, 49а, Астана, 010000
И. В. Бейникова
Казахстан
Бейникова Ирина Васильевна — ассистент профессора кафедры биомедицины.
ул. Гоголя, 40, Караганда, 100008
Л. Б. Айтишева
Казахстан
Айтишева Лайла Бахытжановна — ассистент профессора кафедры биомедицины.
ул. Гоголя, 40, Караганда, 100008
А. Б. Ауашева
Казахстан
Ауашева Айгерим Болатбаевна — ассистент профессора кафедры биомедицины.
ул. Гоголя, 40, Караганда, 100008
М. Е. Косыбаева
Казахстан
Косыбаева Меруерт Ержановна — ассистент-профессора кафедры семейной медицины.
ул. Гоголя, 40, Караганда, 100008
Н. Б. Мырзашова
Казахстан
Мырзашова Назым Боранбаевна — ассистент-профессора кафедры семейной медицины.
ул. Гоголя, 40, Караганда, 100008
А. С. Дильдабекова
Казахстан
Дильдабекова Айнур Смадияровна — PhD, ассоцированный профессор кафедры семейной медицины.
ул. Гоголя, 40, Караганда, 100008
Что известно о предмете исследования?
- Пациенты с избыточной массой тела (ИзбМТ) имеют более высокие риски негативных сердечно-сосудистых событий.
- Большинство пациентов с ИзбМТ подвержены риску развития атеросклероза коронарных артерий и составляют контингент больных, которым проводятся интервенционные вмешательства или операции аортокоронарного шунтирования.
- Пациенты с ИзбМТ после интервенционных методов лечения коронарных артерий, подлежат длительному восстановлению в реабилитационных центрах.
Что добавляют результаты исследования?
- У пациентов с ИзбМТ в период после аортокоронарного шунтирования уровень метаболитов пуринового обмена значительно повышается на 3 этапе реабилитации по сравнению с таковым на 1 и 2 этапах, что позволяет косвенно предполагать возобновление активности патологического процесса (ишемии, воспаления) и его прогрессирование.
Рецензия
Для цитирования:
Сейтекова А.Н., Молотов-Лучанский В.Б., Понамарева О.А., Мершенова Г.Ж., Екижанова Б.Т., Вистерничан О.А., Шаухат Д.М., Жумабекова И.К., Бейникова И.В., Айтишева Л.Б., Ауашева А.Б., Косыбаева М.Е., Мырзашова Н.Б., Дильдабекова А.С. Оценка метаболитов пуринового обмена после аортокоронарного шунтирования у пациентов с избыточной и нормальной массой тела. Кардиоваскулярная терапия и профилактика. 2025;24(10):4213. https://doi.org/10.15829/1728-8800-2025-4213. EDN: JLTSXI
For citation:
Seytekova A.N., Molotov-Luchansky V.B., Ponomareva O.A., Mershenova G.Zh., Ekizhanova B.T., Visternichyan O.A., Shaukhat D.M., Zhumabekova I.K., Beynikova I.V., Aitisheva L.B., Auasheva A.B., Kosybaeva M.E., Myrzashova N.B., Dildabekova A.S. Evaluation of purine metabolites after coronary artery bypass grafting in overweight and normal-weight patients. Cardiovascular Therapy and Prevention. 2025;24(10):4213. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4213. EDN: JLTSXI
JATS XML

























































